Scarabée
Les coléoptères sont des insectes qui forment l’ ordre des Coléoptères ( / k oʊ l iː ˈ ɒ p t ər ə / ), dans le super-ordre Endopterygota . Leur paire d’ailes avant est durcie en élytres, élytres, les distinguant de la plupart des autres insectes. Les Coléoptères, avec environ 400 000 espèces décrites, sont le plus grand de tous les ordres, constituant près de 40 % des insectes décrits et 25 % de toutes les formes de vie animales connues ; de nouvelles espèces sont fréquemment découvertes, les estimations suggérant qu’il existe entre 0,9 et 2,1 millions d’espèces au total. Présents dans presque tous les habitats à l’exception de la mer et des régions polaires , ils interagissent avec leurs écosystèmes de plusieurs manières : les coléoptères se nourrissent souvent de plantes et de champignons , décomposent les débris animaux et végétaux et mangent d’autres invertébrés . Certaines espèces sont de sérieux ravageurs agricoles, comme le doryphore de la pomme de terre , tandis que d’autres comme les Coccinellidae(coccinelles ou coccinelles) mangent des pucerons , des cochenilles , des thrips et d’autres insectes suceurs de plantes qui endommagent les cultures.
| Scarabée Plage temporelle : 299–0 Ma PréꞒ Ꞓ O S ré C P J J K Pg N Premier Permien – Présent |
|
|---|---|
 |
|
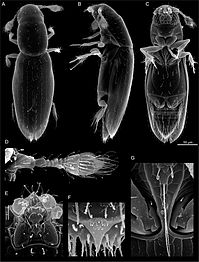
| Dans le sens des aiguilles d’une montre à partir du haut à gauche : femelle lucane dorée ( Lamprima aurata ), scarabée rhinocéros ( Megasoma sp.), charançon à long nez ( Rhinotia hemistictus ), coléoptère cowboy ( Chondropyga dorsalis ) et une espèce d’ Amblytelus | |
| Classement scientifique |
|
| Royaume: | Animalier |
| Phylum: | Arthropodes |
| Classe: | Insectes |
| (non classé): | Endoptérygote |
| Commande: | Coléoptères Linnaeus , 1758 |
| Sous-commandes | |
Voir les sous- groupes de l’ordre Coleoptera |
Les coléoptères ont généralement un exosquelette particulièrement dur , y compris les élytres , bien que certains comme les staphylins aient des élytres très courts tandis que les coléoptères vésicants ont des élytres plus mous. L’ anatomie générale d’un coléoptère est assez uniforme et typique des insectes, bien qu’il existe plusieurs exemples de nouveauté, comme des adaptations chez les coléoptères aquatiques qui emprisonnent des bulles d’air sous les élytres pour une utilisation en plongée. Les coléoptères sont des endoptérygotes , ce qui signifie qu’ils subissent une métamorphose complète , avec une série de changements évidents et relativement brusques dans la structure corporelle entre l’ éclosion et le devenir adulte après une période relativement immobile .stade nymphal . Certains, comme les lucanes , ont un dimorphisme sexuel marqué , les mâles possédant des mandibules énormément élargies qu’ils utilisent pour combattre d’autres mâles. De nombreux coléoptères sont aposématiques , avec des couleurs vives et des motifs avertissant de leur toxicité, tandis que d’autres sont des imitateurs batésiens inoffensifs de ces insectes. De nombreux coléoptères, y compris ceux qui vivent dans des endroits sablonneux, ont un camouflage efficace .
Les coléoptères occupent une place importante dans la culture humaine , des scarabées sacrés de l’Égypte ancienne à l’art des coléoptères et sont utilisés comme animaux de compagnie ou comme insectes de combat pour le divertissement et le jeu. De nombreux groupes de coléoptères sont de couleurs vives et attrayantes, ce qui en fait des objets de collection et des présentoirs décoratifs. Plus de 300 espèces sont utilisées comme nourriture , principalement sous forme de larves ; les espèces largement consommées comprennent les vers de farine et les larves de scarabée rhinocéros . Cependant, l’impact majeur des coléoptères sur la vie humaine est en tant que ravageurs agricoles, forestiers et horticoles . Les ravageurs sérieux comprennent lele charançon de la capsule du coton, le doryphore de la pomme de terre , le dendroctone du cocotier et le dendroctone du pin ponderosa . La plupart des coléoptères, cependant, ne causent pas de dommages économiques et beaucoup, comme les coccinelles et les bousiers , sont bénéfiques en aidant à contrôler les insectes nuisibles.
Étymologie

 Coléoptères au Staatliches Museum für Naturkunde Karlsruhe , Allemagne
Coléoptères au Staatliches Museum für Naturkunde Karlsruhe , Allemagne
Le nom de l’ordre taxonomique, Coleoptera, vient du grec koleopteros (κολεόπτερος), donné au groupe par Aristote pour leurs élytres , ailes antérieures durcies en forme de bouclier, de koleos , gaine, et pteron , aile. Le nom anglais coléoptère vient du vieil anglais bitela , petit mordeur, lié à bītan ( mordre), [2] [3] conduisant au moyen anglais betylle . [4] Un autre nom anglais ancien pour le coléoptère est ċeafor , hanneton, utilisé dans des noms tels que hanneton, du proto-germanique * kebrô (« scarabée » ; comparer l’allemand Käfer , le néerlandais kever ). [5]
Répartition et diversité
Les coléoptères sont de loin le plus grand ordre d’insectes : les quelque 400 000 espèces représentent environ 40 % de toutes les espèces d’insectes décrites jusqu’à présent et environ 25 % de tous les animaux. [1] [6] [7] [8] [9] [10] Une étude de 2015 a fourni quatre estimations indépendantes du nombre total d’espèces de coléoptères, donnant une estimation moyenne d’environ 1,5 million avec une “gamme étonnamment étroite” [11 ] couvrant les quatre estimations d’un minimum de 0,9 à un maximum de 2,1 millions d’espèces de coléoptères. Les quatre estimations utilisaient des relations de spécificité d’hôte (1,5 à 1,9 million), des rapports avec d’autres taxons (0,9 à 1,2 million), des rapports plante/coléoptère (1,2 à 1,3) et des extrapolations basées sur la taille corporelle par année de description (1,7 à 2,1 millions). [11] [12]
Les coléoptères se trouvent dans presque tous les habitats, y compris les habitats d’eau douce et côtiers, partout où se trouve le feuillage végétatif, des arbres et de leur écorce aux fleurs, feuilles et sous terre près des racines – même à l’intérieur des plantes dans les galles, dans tous les tissus végétaux, y compris morts ou en décomposition ceux. [13] Les canopées des forêts tropicales ont une faune importante et diversifiée de coléoptères, [14] y compris Carabidae, [15] Chrysomelidae, [16] et Scarabaeidae. [17]
Le coléoptère le plus lourd, en fait le stade d’insecte le plus lourd, est la larve du coléoptère goliath , Goliathus goliatus , qui peut atteindre une masse d’au moins 115 g (4,1 oz) et une longueur de 11,5 cm (4,5 po). Les coléoptères goliath mâles adultes sont les coléoptères les plus lourds à leur stade adulte, pesant 70 à 100 g (2,5 à 3,5 oz) et mesurant jusqu’à 11 cm (4,3 po). [18] Les scarabées éléphants adultes , Megasoma elephas et Megasoma actaeon atteignent souvent 50 g (1,8 oz) et 10 cm (3,9 po). [19]
Le coléoptère le plus long est le coléoptère Hercule Dynastes hercules , avec une longueur totale maximale d’au moins 16,7 cm (6,6 po), y compris la très longue corne pronotale . Le plus petit coléoptère enregistré et le plus petit insecte vivant en liberté (à partir de 2015 [update]) est le coléoptère plumes Scydosella musawasensis qui peut mesurer aussi peu que 325 μm de longueur. [20]
-
![]()
![]()
Le coléoptère Titan , Titanus giganteus , un longicorne tropical , est l’un des insectes les plus gros et les plus lourds au monde.
-
![]()
![]()
Scydosella musawasensis , le plus petit coléoptère connu : l’échelle (à droite) mesure 50 μm.
-
![]()
![]()
Coléoptère Hercule , Dynastes hercules ecuatorianus , le plus long de tous les coléoptères
-
![]()
![]()
Protaetia cuprea iridescent se nourrissant de chardon
Évolution
Paléozoïque supérieur et Trias

 Restauration des fossiles et de la vie de Moravocoleus permianus ( Tshekardocoleidae ) du Permien inférieur de la République tchèque, représentatif de la morphologie des premiers coléoptères
Restauration des fossiles et de la vie de Moravocoleus permianus ( Tshekardocoleidae ) du Permien inférieur de la République tchèque, représentatif de la morphologie des premiers coléoptères
Le plus ancien coléoptère connu est Coleopsis , du premier Permien ( Asselien ) d’Allemagne, il y a environ 295 millions d’années. [21] On pense que les premiers coléoptères du Permien, qui sont collectivement regroupés dans les ” Protocoleoptera “, étaient xylophages (mangeurs de bois) et foreurs de bois . Des fossiles de cette époque ont été trouvés en Sibérie et en Europe, par exemple dans les lits de fossiles d’ardoise rouge de Niedermoschel près de Mayence, en Allemagne. [22] D’autres fossiles ont été découverts à Obora, en République tchèque et à Tshekarda dans les montagnes de l’Oural, en Russie. [23] Cependant, il n’y a que quelques fossiles d’Amérique du Nord avant le Permien moyen, bien que l’ Asie et l’ Amérique du Nord aient été unies à l’ Euramérique . Les premières découvertes d’Amérique du Nord faites dans la Formation de Wellington d’Oklahoma ont été publiées en 2005 et 2008. [24] [25] Les premiers membres des lignées de coléoptères modernes sont apparus pendant le Permien supérieur . Lors de l’ événement d’extinction du Permien-Trias à la fin du Permien, la plupart des lignées «protocoléoptères» se sont éteintes. La diversité des coléoptères n’a pas retrouvé ses niveaux d’avant l’extinction avant le Trias moyen . [26]
jurassique

 Les genres de coléoptères étaient principalement des saprophages ( détritivores ) du Permien et du Trias . Au cours du Jurassique , les genres herbivores puis carnivores se sont multipliés. Au Cénozoïque , les genres aux trois niveaux trophiques sont devenus beaucoup plus nombreux.
Les genres de coléoptères étaient principalement des saprophages ( détritivores ) du Permien et du Trias . Au cours du Jurassique , les genres herbivores puis carnivores se sont multipliés. Au Cénozoïque , les genres aux trois niveaux trophiques sont devenus beaucoup plus nombreux.
Au cours du Jurassique ( 210 à 145 ma ), il y a eu une augmentation spectaculaire de la diversité des familles de coléoptères, [24] y compris le développement et la croissance des espèces carnivores et herbivores. Les Chrysomeloidea se sont diversifiées à peu près à la même époque, se nourrissant d’un large éventail de plantes hôtes allant des cycas et des conifères aux angiospermes . [27] Près du Jurassique supérieur, les Cupedidae ont diminué, mais la diversité des premières espèces herbivores a augmenté. Les coléoptères phytophages les plus récents se nourrissent de plantes à fleurs ou d’angiospermes, dont le succès a contribué au doublement des espèces phytophages au cours du Jurassique moyen.. Cependant, l’augmentation du nombre de familles de coléoptères au cours du Crétacé n’est pas corrélée à l’augmentation du nombre d’espèces d’angiospermes. [28] À peu près à la même époque, de nombreux charançons primitifs (par exemple Curculionoidea ) et des taupins (par exemple Elateroidea ) sont apparus. Les premiers coléoptères bijou (par exemple les Buprestidae ) sont présents, mais ils sont restés rares jusqu’au Crétacé. [29] [30] [31] Les premiers scarabées n’étaient pas coprophages mais se nourrissaient vraisemblablement de bois pourri à l’aide de champignons; ils sont un exemple précoce d’une relation mutualiste .
Il existe plus de 150 sites fossiles importants du Jurassique, la majorité en Europe de l’Est et en Asie du Nord. Les sites remarquables incluent Solnhofen en Haute- Bavière , en Allemagne, [32] Karatau dans le sud du Kazakhstan , [33] la formation de Yixian dans le Liaoning , en Chine du Nord, [34] ainsi que la formation de Jiulongshan et d’autres sites fossiles en Mongolie . En Amérique du Nord, il n’y a que quelques sites avec des archives fossiles d’insectes du Jurassique, à savoir les dépôts de calcaire coquillier dans le bassin de Hartford, le bassin de Deerfield et le bassin de Newark. [24] [35]
Crétacé
Le Crétacé a vu la fragmentation de la masse continentale du sud, avec l’ouverture de l’océan Atlantique sud et l’isolement de la Nouvelle-Zélande, tandis que l’Amérique du Sud, l’Antarctique et l’Australie se sont éloignées. [27] La diversité des Cupedidae et des Archostemata a considérablement diminué. Les carabes prédateurs (Carabidae) et les staphylins (Staphylinidae) ont commencé à se répartir selon différents modèles; les Carabidae se trouvaient principalement dans les régions chaudes, tandis que les Staphylinidae et les taupins (Elateridae) préféraient les climats tempérés. De même, les espèces prédatrices de Cleroidea et Cucujoideachassaient leurs proies sous l’écorce des arbres avec les coléoptères bijou (Buprestidae). La diversité des coléoptères bijou a augmenté rapidement, car ils étaient les principaux consommateurs de bois, [36] tandis que les capricornes ( Cerambycidae ) étaient plutôt rares : leur diversité n’a augmenté que vers la fin du Crétacé supérieur. [24] Les premiers coléoptères coprophages sont du Crétacé supérieur [37] et peuvent avoir vécu sur les excréments de dinosaures herbivores. [38]On trouve les premières espèces où les larves et les adultes sont adaptés à un mode de vie aquatique. Les coléoptères Whirligig (Gyrinidae) étaient modérément diversifiés, bien que d’autres coléoptères précoces (par exemple Dytiscidae) l’étaient moins, la plus répandue étant l’espèce de Coptoclavidae , qui se nourrissait de larves de mouches aquatiques. [24] Un examen de 2020 des interprétations paléoécologiques des coléoptères fossiles des ambres du Crétacé a suggéré que la saproxylicité était la stratégie d’alimentation la plus courante, les espèces fongivores en particulier semblant dominer. [39]
De nombreux sites fossiles dans le monde contiennent des coléoptères du Crétacé. La plupart se trouvent en Europe et en Asie et appartiennent à la zone climatique tempérée du Crétacé. [34] Les sites du Crétacé inférieur comprennent les lits fossiles de Crato dans le bassin d’Araripe dans le Ceará , au nord du Brésil, ainsi que la formation sus-jacente de Santana ; ce dernier était près de l’équateur à cette époque. En Espagne, des sites importants se trouvent à proximité du Montsec et de Las Hoyas . En Australie, les gisements fossilifères de Koonwarra du groupe Korumburra, South Gippsland , Victoria, sont remarquables. Les principaux sites du Crétacé supérieur comprennent Kzyl-Dzhar dans le sud du Kazakhstan et Arkagala en Russie. [24]
Cénozoïque


Les fossiles de coléoptères sont abondants au Cénozoïque ; au Quaternaire (jusqu’à 1,6 ma), les espèces fossiles sont identiques aux espèces vivantes, tandis qu’à partir du Miocène supérieur (5,7 ma), les fossiles sont encore si proches des formes modernes qu’ils sont très probablement les ancêtres des espèces vivantes. Les grandes oscillations du climat au cours du Quaternaire ont amené les coléoptères à modifier tellement leur répartition géographique que la localisation actuelle donne peu d’indices sur l’histoire biogéographique d’une espèce. Il est évident que l’isolement géographique des populations a souvent dû être rompu lorsque les insectes se sont déplacés sous l’influence du changement climatique, provoquant un mélange de pools génétiques, une évolution rapide et des extinctions, en particulier aux latitudes moyennes. [41]
Phylogénie
Le très grand nombre d’espèces de coléoptères pose des problèmes particuliers de classification . Certaines familles contiennent des dizaines de milliers d’espèces et doivent être divisées en sous-familles et tribus. Ce nombre immense a conduit le biologiste évolutionniste JBS Haldane à plaisanter, lorsque certains théologiens lui ont demandé ce qui pouvait être déduit de l’esprit du Créateur à partir des œuvres de Sa Création, “Un penchant démesuré pour les coléoptères”. [42] Polyphaga est le plus grand sous-ordre, contenant plus de 300 000 espèces décrites dans plus de 170 familles, dont les staphylins (Staphylinidae), les scarabées ( Scarabaeidae ), les coléoptères (Meloidae), les lucanes(Lucanidae) et les vrais charançons ( Curculionidae ). [9] [43] Ces groupes de coléoptères polyphages peuvent être identifiés par la présence de sclérites cervicaux (parties durcies de la tête utilisées comme points d’attache pour les muscles) absents dans les autres sous-ordres. [44] Adephaga contient environ 10 familles de coléoptères en grande partie prédateurs, y compris les coléoptères terrestres (Carabidae), les coléoptères aquatiques ( Dytiscidae ) et les coléoptères tourbillonnants (Gyrinidae). Chez ces insectes, les testicules sont tubulaires et le premier sternum abdominal (une plaque de l’ exosquelette ) est divisé par la coxae postérieure.(les articulations basales des pattes du coléoptère). [45] Archostemata contient quatre familles de coléoptères principalement mangeurs de bois, y compris les coléoptères réticulés (Cupedidae) et le coléoptère du poteau téléphonique . [46] Les Archostemata ont une plaque exposée appelée métatrochantine devant le segment basal ou coxa de la patte postérieure. [47] Myxophaga contient environ 65 espèces décrites dans quatre familles, la plupart très petites, en incluant Hydroscaphidae et le genre Sphaerius . [48] Les coléoptères myxophagan sont petits et se nourrissent principalement d’algues. Leurs pièces buccales sont caractérisées par l’absence de galées et la présence d’une dent mobile sur leur mandibule gauche.[49]
La cohérence de la morphologie des coléoptères , en particulier leur possession d ‘ élytres , a longtemps suggéré que les Coléoptères sont monophylétiques , bien qu’il y ait eu des doutes sur l’arrangement des sous -ordres , à savoir les Adephaga , Archostemata , Myxophaga et Polyphaga au sein de ce clade . [50] [27] [51] [52] [53] On pense que les parasites à ailes tordues, Strepsiptera , sont un groupe frère des coléoptères, s’étant séparés d’eux au début du Permien . [52] [54][55] [56]
L’analyse phylogénétique moléculaire confirme que les Coléoptères sont monophylétiques. Duane McKenna et al. (2015) ont utilisé huit gènes nucléaires pour 367 espèces de 172 des 183 familles de coléoptères. Ils ont divisé les Adephaga en 2 clades, Hydradephaga et Geadephaga, divisé les Cucujoidea en 3 clades et placé les Lymexyloidea dans les Tenebrionoidea. Les Polyphages semblent dater du Trias. La plupart des familles de coléoptères existantes semblent avoir surgi au Crétacé. [56] Le cladogramme est basé sur McKenna (2015). [56] Le nombre d’espèces dans chaque groupe (principalement des superfamilles) est indiqué entre parenthèses et en gras s’il est supérieur à 10 000. [57]Les noms communs anglais sont donnés dans la mesure du possible. Les dates d’origine des principaux groupes sont indiquées en italique il y a des millions d’années (mya). [57]
| Coléoptères |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 285 millions d’années |
Morphologie externe
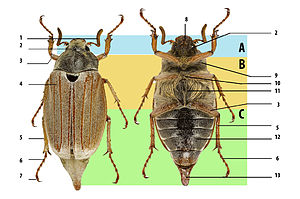
 Structure du corps du coléoptère, utilisant le hanneton . A : tête, B : thorax, C : abdomen. 1 : antenne, 2 : œil composé, 3 : fémur, 4 : élytre (couverture alaire), 5 : tibia, 6 : tarse, 7 : griffes, 8 : pièces buccales, 9 : prothorax, 10 : mésothorax, 11 : métathorax, 12 : sternites abdominaux, 13 : pygidium.
Structure du corps du coléoptère, utilisant le hanneton . A : tête, B : thorax, C : abdomen. 1 : antenne, 2 : œil composé, 3 : fémur, 4 : élytre (couverture alaire), 5 : tibia, 6 : tarse, 7 : griffes, 8 : pièces buccales, 9 : prothorax, 10 : mésothorax, 11 : métathorax, 12 : sternites abdominaux, 13 : pygidium.
Les coléoptères sont généralement caractérisés par un exosquelette particulièrement dur et des ailes antérieures dures ( élytres ) non utilisables pour le vol. Presque tous les coléoptères ont des mandibules qui se déplacent dans un plan horizontal. Les pièces buccales sont rarement suceuses, bien qu’elles soient parfois réduites; les maxillaires portent toujours des palpes. Les antennes ont généralement 11 segments ou moins, sauf dans certains groupes comme les Cerambycidae (coléoptères longicorne) et les Rhipiceridae (coléoptères parasites des cigales). Les coxae des pattes sont généralement situés en retrait dans une cavité coxale. Les structures génitales sont télescopées dans le dernier segment abdominal chez tous les coléoptères existants. Les larves de coléoptères peuvent souvent être confondues avec celles d’autres groupes d’endoptérygotes. [47] L’exosquelette du coléoptère est composé de nombreuses plaques, appeléessclérites , séparés par de fines sutures. Cette conception fournit des défenses blindées tout en conservant la flexibilité. L’ anatomie générale d’un coléoptère est assez uniforme, bien que des organes et des appendices spécifiques varient considérablement en apparence et en fonction entre les nombreuses familles de l’ordre. Comme tous les insectes, le corps des coléoptères est divisé en trois sections : la tête, le thorax et l’abdomen. [7] Parce qu’il y a tellement d’espèces, l’identification est assez difficile et repose sur des attributs tels que la forme des antennes, les formules tarsales [a]et les formes de ces petits segments sur les pattes, les pièces buccales et les plaques ventrales (sterna, plèvre, coxae). Chez de nombreuses espèces, une identification précise ne peut être faite que par l’examen des structures génitales mâles uniques. [58]
Tête

 Vue de face de la tête de Lamia textor
Vue de face de la tête de Lamia textor
La tête, dont les pièces buccales se projettent vers l’avant ou parfois vers le bas, est généralement fortement sclérifiée et parfois très volumineuse. [6] Les yeux sont composés et peuvent afficher une adaptabilité remarquable, comme dans le cas des coléoptères aquatiques tourbillonnants ( Gyrinidae ), où ils sont divisés pour permettre une vue à la fois au-dessus et au-dessous de la ligne de flottaison. Quelques longicornes ( Cerambycidae ) et charançons ainsi que certaines lucioles ( Rhagophthalmidae ) [59] ont des yeux divisés, tandis que beaucoup ont des yeux échancrés, et quelques-uns ont des ocelles , petits yeux simples généralement plus en arrière sur la tête (sur lasommet ); ceux-ci sont plus fréquents chez les larves que chez les adultes. [60] L’organisation anatomique des yeux composés peut être modifiée et dépend si une espèce est principalement crépusculaire, diurne ou nocturne active. [61] Ocelli sont trouvés dans le coléoptère adulte de tapis ( Dermestidae ), quelques coléoptères de rove ( Omaliinae ) et le Derodontidae . [60]

 Polyphylla fullo a des antennes distinctives en forme d’ éventail , l’une des nombreuses formes distinctes d’appendices chez les coléoptères.
Polyphylla fullo a des antennes distinctives en forme d’ éventail , l’une des nombreuses formes distinctes d’appendices chez les coléoptères.
Les antennes de coléoptère sont principalement des organes de perception sensorielle et peuvent détecter le mouvement, l’odeur et les substances chimiques, [62] mais peuvent également être utilisées pour ressentir physiquement l’environnement d’un coléoptère. Les familles de coléoptères peuvent utiliser les antennes de différentes manières. Par exemple, lorsqu’elles se déplacent rapidement, les cicindèles peuvent ne pas être en mesure de voir très bien et tiennent plutôt leurs antennes de manière rigide devant elles afin d’éviter les obstacles. [63] Certains Cerambycidae utilisent des antennes pour s’équilibrer et les coléoptères peuvent les utiliser pour saisir. Certaines espèces de coléoptères aquatiques peuvent utiliser des antennes pour recueillir l’air et le faire passer sous le corps lorsqu’elles sont submergées. De même, certaines familles utilisent des antennes lors de l’accouplement et quelques espèces les utilisent pour se défendre. Chez le cérambycidé Onychocerus albitarsis, les antennes ont des structures d’injection de venin utilisées dans la défense, ce qui est unique parmi les arthropodes . [64] Les antennes varient considérablement dans la forme, parfois entre les sexes, mais sont souvent similaires au sein d’une même famille. Les antennes peuvent être matraquées , filiformes , inclinées , en forme de collier de perles , en forme de peigne (d’un côté ou des deux, bipectinées) ou dentées. La variation physique des antennes est importante pour l’identification de nombreux groupes de coléoptères. Les Curculionidae ont des antennes coudées ou géniculées. Les antennes flabellées en forme de plumes sont une forme restreinte trouvée chez les Rhipiceridae et quelques autres familles. Les Silphidae ont des antennes capitées avec une tête sphérique à l’extrémité. Les Scarabaeidae ont généralement des antennes lamellaires avec les segments terminaux prolongés en longues structures plates empilées ensemble. Les Carabidae ont généralement des antennes filiformes. Les antennes se situent entre l’œil et les mandibules et chez les Tenebrionidae, les antennes s’élèvent devant une encoche qui brise le contour généralement circulaire de l’œil composé. Ils sont segmentés et se composent généralement de 11 parties, la première partie s’appelle le scape et la seconde partie est le pédicelle.[62] [65] [66]
Les coléoptères ont des pièces buccales comme celles des sauterelles . Les mandibules apparaissent comme de grandes pinces sur le devant de certains coléoptères. Les mandibules sont une paire de structures dures, souvent semblables à des dents, qui se déplacent horizontalement pour saisir, écraser ou couper de la nourriture ou des ennemis (voir défense , ci-dessous). Deux paires d’appendices en forme de doigt, les palpes maxillaire et labial, se trouvent autour de la bouche chez la plupart des coléoptères, servant à déplacer la nourriture dans la bouche. Chez de nombreuses espèces, les mandibules sont sexuellement dimorphes, celles des mâles étant énormément agrandies par rapport à celles des femelles de la même espèce. [6]
Thorax
Le thorax est segmenté en deux parties discernables, le pro- et le ptérothorax. Le ptérothorax est le méso et le métathorax fusionnés, qui sont généralement séparés chez d’autres espèces d’insectes, bien qu’articulés de manière flexible à partir du prothorax. Vu d’en bas, le thorax est la partie d’où proviennent les trois paires de pattes et les deux paires d’ailes. L’abdomen est tout ce qui est postérieur au thorax. [7] Vu d’en haut, la plupart des coléoptères semblent avoir trois sections claires, mais c’est trompeur : sur la surface supérieure du coléoptère, la section médiane est une plaque dure appelée pronotum , qui n’est que la partie avant du thorax ; la partie arrière du thorax est cachée par les ailes du coléoptère. Cette segmentation supplémentaire est généralement mieux vue sur l’abdomen. [67]

 Acilius sulcatus , un coléoptère plongeur avec des pattes postérieures adaptées comme membres nageurs
Acilius sulcatus , un coléoptère plongeur avec des pattes postérieures adaptées comme membres nageurs
Jambes
Les pattes multisegmentées se terminent par deux à cinq petits segments appelés tarses. Comme beaucoup d’autres ordres d’insectes, les coléoptères ont des griffes, généralement une paire, à l’extrémité du dernier segment tarsien de chaque patte. Alors que la plupart des coléoptères utilisent leurs pattes pour marcher, les pattes ont été adaptées à d’autres usages. Les coléoptères aquatiques, y compris les Dytiscidae (coléoptères plongeurs) , les Haliplidae et de nombreuses espèces d’ Hydrophiles , les pattes, souvent la dernière paire, sont modifiées pour nager, généralement avec des rangées de poils longs. Les coléoptères plongeurs mâles ont des ventouses sur leurs pattes antérieures qu’ils utilisent pour saisir les femelles. [68] D’autres coléoptères ont des fossoriauxpattes élargies et souvent épineuses pour creuser. Des espèces avec de telles adaptations se trouvent parmi les scarabées, les carabes et les coléoptères clowns ( Histeridae ). Les pattes postérieures de certains coléoptères, comme les altises (chez les Chrysomelidae) et les charançons des puces (chez les Curculionidae), ont des fémurs élargis qui les aident à sauter. [69]
Ailes

 Coléoptère à carreaux Trichodes alvearius décollant, montrant les élytres durs (ailes antérieures adaptées comme élytres) tenus fermement à l’écart des ailes de vol
Coléoptère à carreaux Trichodes alvearius décollant, montrant les élytres durs (ailes antérieures adaptées comme élytres) tenus fermement à l’écart des ailes de vol
Les ailes antérieures des coléoptères ne sont pas utilisées pour le vol , mais forment des élytres qui recouvrent la partie postérieure du corps et protègent les ailes postérieures. Les élytres sont généralement des structures dures en forme de coquille qui doivent être relevées pour permettre aux ailes postérieures de se déplacer pour le vol. [70] Cependant, chez les coléoptères soldats ( Cantharidae ), les élytres sont mous, ce qui a valu à cette famille le nom de leatherwings. [71] D’autres coléoptères à ailes molles comprennent le coléoptère à ailes nettes Calopteron discrepans , qui a des ailes cassantes qui se rompent facilement afin de libérer des produits chimiques pour la défense. [72]
Les ailes de vol des coléoptères sont croisées avec des veines et sont repliées après l’atterrissage, souvent le long de ces veines, et stockées sous les élytres. Un pli ( jugum ) de la membrane à la base de chaque aile est caractéristique. [70] Certains coléoptères ont perdu la capacité de voler. Il s’agit notamment de certains carabes (Carabidae) et de véritables charançons (Curculionidae), ainsi que d’espèces désertiques et troglodytiques d’autres familles. Beaucoup ont les deux élytres fusionnés, formant un bouclier solide sur l’abdomen. Dans quelques familles, la capacité de voler et les élytres ont été perdus, comme chez les vers luisants ( Phengodidae ), où les femelles ressemblent à des larves tout au long de leur vie. [73]La présence d’élytres et d’ailes n’indique pas toujours que le coléoptère volera. Par exemple, le tanaisie se promène entre les habitats bien qu’il soit physiquement capable de voler. [74]
Abdomen
L’ abdomen est la section derrière le métathorax, composée d’une série d’anneaux, chacun avec un trou pour la respiration et la respiration, appelé spiracle , composant trois sclérites segmentés différents : le tergum, la plèvre et le sternum. Le tergum de presque toutes les espèces est membraneux, ou généralement mou et caché par les ailes et les élytres lorsqu’il n’est pas en vol. La plèvre est généralement petite ou cachée chez certaines espèces, chaque pleuron ayant un seul spiracle. Le sternum est la partie la plus largement visible de l’abdomen, étant un segment plus ou moins sclérifié. L’abdomen lui-même n’a pas d’appendices, mais certains (par exemple, les Mordellidae ) ont des lobes sternaux articulés. [75]
Anatomie et physiologie
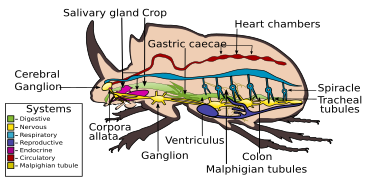
 Les systèmes corporels d’un coléoptère
Les systèmes corporels d’un coléoptère
Système digestif
Le système digestif des coléoptères est principalement adapté à un régime herbivore. La digestion a lieu principalement dans l’ intestin moyen antérieur , bien que dans les groupes prédateurs comme les Carabidae , la majeure partie de la digestion se produise dans la culture au moyen d’enzymes de l’intestin moyen. Chez les Elateridae , les larves sont des mangeoires liquides qui digèrent extraoralement leur nourriture en sécrétant des enzymes. [7] Le tube digestif se compose essentiellement d’un pharynx court et étroit , d’une expansion élargie, du jabot et d’un gésier peu développé . Vient ensuite l’intestin moyen, dont les dimensions varient d’une espèce à l’autre, avec une grande quantité de caecum, et l’intestin postérieur, avec des longueurs variables. Il y a généralement quatre à six tubules de Malpighi . [6]
Système nerveux
Le système nerveux des coléoptères contient tous les types trouvés chez les insectes, variant selon les différentes espèces, de trois ganglions thoraciques et sept ou huit ganglions abdominaux qui peuvent être distingués à celui dans lequel tous les ganglions thoraciques et abdominaux sont fusionnés pour former une structure composite. [7]
Système respiratoire

 Les spiracles de Dytiscus (à droite) sur la face supérieure de l’abdomen, normalement recouverts par les élytres, sont en contact avec une bulle d’air lorsque le coléoptère plonge.
Les spiracles de Dytiscus (à droite) sur la face supérieure de l’abdomen, normalement recouverts par les élytres, sont en contact avec une bulle d’air lorsque le coléoptère plonge.
Comme la plupart des insectes, les coléoptères inhalent de l’air, pour l’ oxygène qu’il contient, et exhalent du dioxyde de carbone , via un système trachéal . L’air entre dans le corps par les spiracles et circule dans l’hémocèle dans un système de trachées et de trachéoles, à travers les parois desquelles les gaz peuvent se diffuser. [7]
Les coléoptères plongeurs, comme les Dytiscidae , emportent avec eux une bulle d’air lorsqu’ils plongent. Une telle bulle peut être contenue sous les élytres ou contre le corps par des poils hydrophobes spécialisés. La bulle recouvre au moins certains des spiracles, permettant à l’air de pénétrer dans la trachée. [7] La fonction de la bulle n’est pas seulement de contenir une réserve d’air mais d’agir comme une ouïe physique . L’air qu’il emprisonne est en contact avec de l’eau oxygénée, de sorte que la consommation de l’animal épuise l’oxygène dans la bulle, plus d’oxygène peut diffuser pour la reconstituer. [76]Le dioxyde de carbone est plus soluble dans l’eau que l’oxygène ou l’azote, de sorte qu’il se diffuse plus rapidement qu’à l’intérieur. L’azote est le gaz le plus abondant dans la bulle et le moins soluble, il constitue donc un composant relativement statique de la bulle et agit comme un milieu stable dans lequel les gaz respiratoires peuvent s’accumuler et passer. Des visites occasionnelles à la surface suffisent au coléoptère pour rétablir la constitution de la bulle. [77]
Système circulatoire
Comme les autres insectes, les coléoptères ont un système circulatoire ouvert , basé sur l’ hémolymphe plutôt que sur le sang. Comme chez d’autres insectes, un cœur segmenté en forme de tube est attaché à la paroi dorsale de l’ hémocèle . Il a des entrées appariées ou ostia à intervalles sur sa longueur et fait circuler l’hémolymphe de la cavité principale de l’hémocèle et à travers la cavité antérieure de la tête. [78]
Organes spécialisés
Différentes glandes sont spécialisées dans différentes phéromones pour attirer les partenaires. Les phéromones des espèces de Rutelinae sont produites à partir de cellules épithéliales tapissant la surface interne des segments abdominaux apicaux; Les phéromones à base d’acides aminés de Melolonthinae sont produites à partir de glandes éversibles situées sur l’apex abdominal. D’autres espèces produisent différents types de phéromones. Les dermestides produisent des esters et les espèces d’ Elateridae produisent des aldéhydes et des acétates dérivés d’acides gras . [7]Pour attirer un partenaire, les lucioles (Lampyridae) utilisent des cellules adipeuses modifiées avec des surfaces transparentes soutenues par des cristaux d’acide urique réfléchissants pour produire de la lumière par bioluminescence . La production de lumière est très efficace, par oxydation de la luciférine catalysée par des enzymes ( luciférases ) en présence d’ adénosine triphosphate (ATP) et d’oxygène, produisant de l’oxyluciférine , du dioxyde de carbone et de la lumière. [7]
Les organes tympanaux ou organes auditifs constitués d’une membrane (tympan) tendue sur un cadre soutenu par un sac aérien et des neurones sensoriels associés, se retrouvent dans deux familles. [79] Plusieurs espèces du genre Cicindela (Carabidae) ont des organes auditifs sur les surfaces dorsales de leurs premiers segments abdominaux sous les ailes ; deux tribus des Dynastinae (au sein des Scarabaeidae ) ont des organes auditifs juste sous leurs boucliers pronotaux ou leurs membranes cervicales. Les deux familles sont sensibles aux fréquences ultrasonores, avec des preuves solides indiquant qu’elles fonctionnent pour détecter la présence de chauves-souris par leur écholocation ultrasonique. [7]
Reproduction et développement
Les coléoptères sont membres du super -ordre Endopterygota et, par conséquent, la plupart d’entre eux subissent une métamorphose complète . La forme typique de métamorphose chez les coléoptères passe par quatre étapes principales : l’ œuf , la larve , la nymphe et l’ imago ou adulte. Les larves sont communément appelées larves et la nymphe est parfois appelée la chrysalide. Chez certaines espèces, la pupe peut être enfermée dans un cocon construit par la larve vers la fin de son dernier stade . Certains coléoptères, comme les membres typiques des familles Meloidae et Rhipiphoridae , vont plus loin, subissanthypermétamorphose dans laquelle le premier stade prend la forme d’une triunguline . [80]
Accouplement

 Hanneton fleur ponctué ( Neorrhina punctata , Scarabaeidae) accouplement
Hanneton fleur ponctué ( Neorrhina punctata , Scarabaeidae) accouplement
Certains coléoptères ont un comportement d’accouplement complexe. La communication par phéromones est souvent importante pour localiser un partenaire. Différentes espèces utilisent différentes phéromones. Les scarabées tels que les Rutelinae utilisent des phéromones dérivées de la synthèse des acides gras , tandis que d’autres scarabées tels que les Melolonthinae utilisent des acides aminés et des terpénoïdes. Une autre façon dont les coléoptères trouvent des partenaires est observée chez les lucioles (Lampyridae) qui sont bioluminescentes , avec des organes abdominaux produisant de la lumière. Les mâles et les femelles s’engagent dans un dialogue complexe avant de s’accoupler; chaque espèce a une combinaison unique de schémas de vol, de durée, de composition et d’intensité de la lumière produite. [7]
Avant l’accouplement, les mâles et les femelles peuvent striduler ou faire vibrer les objets sur lesquels ils se trouvent. Chez les Meloidae, le mâle grimpe sur le dos de la femelle et caresse ses antennes sur sa tête, ses palpes et ses antennes. Chez Eupompha , le mâle dessine ses antennes le long de son vertex longitudinal. Ils peuvent ne pas s’accoupler du tout s’ils n’effectuent pas le rituel précopulatoire. [7] Ce comportement d’accouplement peut être différent parmi les populations dispersées de la même espèce. Par exemple, l’accouplement d’une population russe de tanaisie ( Chysolina graminis ) est précédé d’un rituel élaboré où le mâle tapote les yeux, le pronotum et les antennes de la femelle avec ses antennes, ce qui n’est pas évident dans la population de cette espèce auRoyaume-Uni . [81]
La compétition peut jouer un rôle dans les rituels d’accouplement d’espèces telles que les nécrophores ( Nicrophorus ), les insectes se battant pour déterminer lequel peut s’accoupler. De nombreux coléoptères mâles sont territoriaux et défendent farouchement leurs territoires contre les mâles intrus. Chez ces espèces, le mâle a souvent des cornes sur la tête ou le thorax, ce qui rend sa longueur corporelle supérieure à celle d’une femelle. La copulation est généralement rapide, mais dans certains cas dure plusieurs heures. Pendant la copulation, les spermatozoïdes sont transférés à la femelle pour féconder l’ovule. [6]
Cycle de vie

 Le cycle de vie du lucane cerf -volant comprend trois stades . Œuf
Le cycle de vie du lucane cerf -volant comprend trois stades . Œuf
Essentiellement, tous les coléoptères pondent des œufs, bien que certaines Aleocharinae myrmécophiles et certaines Chrysomelinae qui vivent dans les montagnes ou dans le subarctique soient ovovivipares , pondant des œufs qui éclosent presque immédiatement. Les œufs de coléoptères ont généralement des surfaces lisses et sont mous, bien que les Cupedidae aient des œufs durs. Les œufs varient considérablement d’une espèce à l’autre: les œufs ont tendance à être petits chez les espèces à nombreux stades (stades larvaires) et chez celles qui pondent un grand nombre d’œufs. Une femelle peut pondre de plusieurs dizaines à plusieurs milliers d’œufs au cours de sa vie, selon l’étendue des soins parentaux. Cela va de la simple ponte sous une feuille, aux soins parentaux apportés par les scarabées, qui abritent, nourrissent et protègent leurs petits. Les Attelabidae roulent les feuilles et pondent leurs œufs à l’intérieur du rouleau pour se protéger. [7] [82]
Larve
La larve est généralement le principal stade d’alimentation du cycle de vie du coléoptère . Les larves ont tendance à se nourrir avec voracité une fois sorties de leurs œufs. Certains se nourrissent de plantes à l’extérieur, comme celles de certains coléoptères, tandis que d’autres se nourrissent de leurs sources de nourriture. Des exemples de mangeoires internes sont la plupart des Buprestidae et des longicornes. Les larves de nombreuses familles de coléoptères sont prédatrices comme les adultes (carabes, coccinelles, staphylins). La période larvaire varie selon les espèces, mais peut durer plusieurs années. Les larves de coléoptères de la peau subissent un degré de développement inversé lorsqu’elles sont affamées, et repoussent plus tard au niveau de maturité précédemment atteint. Le cycle peut être répété plusieurs fois (voir Immortalité biologique). [83] La morphologie larvaire est très variée parmi les espèces, avec des têtes bien développées et sclérifiées, des segments thoraciques et abdominaux distincts (généralement le dixième, bien que parfois le huitième ou le neuvième). [6]

 Larve scarabée de scarabée Hercule
Larve scarabée de scarabée Hercule
Les larves de coléoptères peuvent être différenciées des autres larves d’insectes par leurs têtes durcies et souvent assombries, la présence de pièces buccales broyeuses et de stigmates le long des côtés de leur corps. Comme les coléoptères adultes, les larves sont d’apparence variée, en particulier entre les familles de coléoptères. Les coléoptères aux larves quelque peu aplaties et très mobiles comprennent les carabes et les staphylins; leurs larves sont décrites comme campodeiformes. Certaines larves de coléoptères ressemblent à des vers durcis avec des capsules de tête sombres et des pattes minuscules. Ce sont des larves élatériformes et se trouvent dans les familles des taupins ( Elateridae ) et des ténébrions (Tenebrionidae). Certaines larves élatériformes de taupins sont appelées taupins. Coléoptères dans le Scarabaeoideaont des larves courtes et épaisses décrites comme des scarabées, plus communément appelées larves. [84]
Toutes les larves de coléoptères passent par plusieurs stades , qui sont les stades de développement entre chaque mue . Chez de nombreuses espèces, les larves augmentent simplement de taille à chaque stade successif à mesure que davantage de nourriture est consommée. Dans certains cas, cependant, des changements plus spectaculaires se produisent. Parmi certaines familles ou genres de coléoptères, en particulier ceux qui présentent des modes de vie parasitaires, le premier stade (le planidium ) est très mobile pour rechercher un hôte, tandis que les stades suivants sont plus sédentaires et restent sur ou dans leur hôte. C’est ce qu’on appelle l’ hypermétamorphose ; il est présent chez les Meloidae , les Micromalthidae et les Ripiphoridae . [85] Le scarabée vésiculeuxEpicauta vittata (Meloidae), par exemple, a trois stades larvaires distincts. Son premier stade, la triunguline , possède des pattes plus longues pour partir à la recherche des œufs de sauterelles. Après s’être nourri pendant une semaine, il mue jusqu’au deuxième stade, appelé stade caraboïde, qui ressemble à la larve d’un carabe . Au bout d’une semaine, il mue et prend l’apparence d’une larve de scarabée – le stade scarabée. Son avant-dernier stade larvaire est la pseudo-nymphe ou la larve coarcée, qui hivernera et se nymphosera jusqu’au printemps suivant. [86]
La période larvaire peut varier considérablement. Un champignon se nourrissant de staphylinides Phanerota fasciata subit trois mues en 3,2 jours à température ambiante tandis qu’Anisotoma sp. (Leiodidae) termine son stade larvaire dans la fructification de la moisissure visqueuse en 2 jours et représente peut-être les coléoptères à la croissance la plus rapide. Les coléoptères dermestidés, Trogoderma inclusum , peuvent rester à l’état larvaire étendu dans des conditions défavorables, réduisant même leur taille entre les mues. Une larve aurait survécu pendant 3,5 ans dans un récipient fermé. [7]
Nymphe et adulte 
 Le coléoptère marqué d’ivoire, Eburia quadrigeminata , peut vivre jusqu’à 40 ans à l’intérieur des feuillus dont se nourrit la larve.
Le coléoptère marqué d’ivoire, Eburia quadrigeminata , peut vivre jusqu’à 40 ans à l’intérieur des feuillus dont se nourrit la larve.
Comme pour tous les endoptérygotes, les larves de coléoptères se nymphosent et de ces pupes émergent des coléoptères adultes pleinement formés et sexuellement matures, ou imagos . Les pupes n’ont jamais de mandibules (elles sont adectiques). Dans la plupart des pupes, les appendices ne sont pas attachés au corps et sont dits exarates ; chez quelques coléoptères (Staphylinidae, Ptiliidae, etc.), les appendices sont fusionnés avec le corps (appelés pupes obtect ). [6]
Les adultes ont des durées de vie extrêmement variables, de quelques semaines à plusieurs années, selon les espèces. [6] [47] Certains coléoptères xylophages peuvent avoir des cycles de vie extrêmement longs. On pense que lorsque des meubles ou du bois de maison sont infestés par des larves de coléoptères, le bois contenait déjà les larves lorsqu’il a été scié pour la première fois. Une bibliothèque en bouleau âgée de 40 ans a libéré des adultes Eburia quadrigeminata ( Cerambycidae ), tandis que Buprestis aurulenta et d’autres Buprestidae ont été documentés comme émergeant jusqu’à 51 ans après la fabrication d’articles en bois. [87]
Comportement
Locomotion

 Photinus pyralis , luciole, en vol
Photinus pyralis , luciole, en vol
Les élytres permettent aux coléoptères de voler et de se déplacer dans des espaces confinés, en repliant les ailes délicates sous les élytres pendant qu’ils ne volent pas et en repliant leurs ailes juste avant le décollage. Le déploiement et le pliage des ailes sont opérés par des muscles attachés à la base de l’aile ; tant que la tension sur les veines radiale et cubitale demeure, les ailes restent droites. Chez certaines espèces qui volent de jour (par exemple, Buprestidae , Scarabaeidae ), le vol n’inclut pas de grandes quantités de soulèvement des élytres, les ailes métathoraciques étant étendues sous les marges latérales des élytres. [7] L’altitude atteinte par les coléoptères en vol varie. Une étude portant sur l’altitude de vol des espèces de coccinelles Coccinella septempunctata etHarmonia axyridis utilisant un radar a montré que, alors que la majorité en vol au-dessus d’un seul endroit se trouvait à 150–195 m au-dessus du sol, certains atteignaient des altitudes supérieures à 1100 m. [88]
De nombreux staphylins ont des élytres considérablement réduits, et bien qu’ils soient capables de voler, ils se déplacent le plus souvent sur le sol : leurs corps mous et leurs muscles abdominaux forts les rendent flexibles, capables de se tortiller facilement dans de petites fissures. [89]
Les coléoptères aquatiques utilisent plusieurs techniques pour retenir l’air sous la surface de l’eau. Les coléoptères plongeurs (Dytiscidae) retiennent l’air entre l’abdomen et les élytres lorsqu’ils plongent. Les Hydrophilidae ont des poils sur leur surface inférieure qui retiennent une couche d’air contre leur corps. Les coléoptères aquatiques rampants adultes utilisent à la fois leurs élytres et leurs coxae postérieurs (le segment basal des pattes arrière) pour la rétention d’air, tandis que les coléoptères tourbillonnants transportent simplement une bulle d’air avec eux chaque fois qu’ils plongent. [90]
Communication
Les coléoptères ont une variété de façons de communiquer, y compris l’utilisation de phéromones . Le dendroctone du pin ponderosa émet une phéromone pour attirer d’autres coléoptères vers un arbre. La masse de coléoptères est capable de vaincre les défenses chimiques de l’arbre. Une fois les défenses de l’arbre épuisées, les coléoptères émettent une phéromone anti-agrégation. Cette espèce peut striduler pour communiquer, [91] mais d’autres peuvent utiliser le son pour se défendre lorsqu’elles sont attaquées. [92]
Soins parentaux

 Un bousier roulant de la bouse
Un bousier roulant de la bouse
Les soins parentaux se retrouvent dans quelques familles [93] de coléoptères, peut-être pour la protection contre les conditions défavorables et les prédateurs. [7] Le staphylin Bledius spectabilis vit dans les marais salants , de sorte que les œufs et les larves sont mis en danger par la marée montante . Le coléoptère maternel patrouille les œufs et les larves, creusant pour les empêcher d’être inondés et asphyxiés , et les protège du carabe prédateur Dicheirotrichus gustavi et de la guêpe parasitoïde Barycnemis blediator , qui tue environ 15 % des larves. [94]
Les coléoptères sont des parents attentifs et participent aux soins coopératifs et à l’alimentation de leur progéniture. Les deux parents s’efforcent d’enterrer les carcasses de petits animaux pour servir de ressource alimentaire à leurs petits et de construire une chambre à couvain autour d’elle. Les parents préparent la carcasse et la protègent des concurrents et de la décomposition précoce. Après l’éclosion de leurs œufs, les parents gardent les larves exemptes de champignons et de bactéries et aident les larves à se nourrir en régurgitant de la nourriture pour elles. [95]
Certains bousiers fournissent des soins parentaux, collectant les excréments d’herbivores et pondant des œufs dans cet approvisionnement alimentaire, un exemple d’ approvisionnement de masse . Certaines espèces ne partent pas après cette étape, mais restent pour sauvegarder leur progéniture. [96]
La plupart des espèces de coléoptères ne manifestent pas de comportements de soins parentaux après la ponte des œufs. [97]
La sous-socialité, où les femelles gardent leur progéniture, est bien documentée dans deux familles de Chrysomelidae, Cassidinae et Chrysomelinae. [98] [99] [100] [101] [102]
Eusocialité
L’eusocialité implique des soins coopératifs à la couvée (y compris les soins à la progéniture d’autres individus), des générations qui se chevauchent au sein d’une colonie d’adultes et une division du travail en groupes reproducteurs et non reproducteurs. [103] Peu d’organismes en dehors des hyménoptères présentent ce comportement; le seul coléoptère à le faire est le charançon Austroplatypus incompertus . [104] Cette espèce australienne vit dans des réseaux horizontaux de tunnels, dans le duramen des Eucalyptus . C’est l’une des plus de 300 espèces de coléoptères ambrosia xylophages qui distribuent les spores des champignons ambrosia. [105]Les champignons poussent dans les tunnels des coléoptères, fournissant de la nourriture aux coléoptères et à leurs larves; la progéniture femelle reste dans les tunnels et maintient la croissance fongique, ne se reproduisant probablement jamais. [105] [104] Les soins coopératifs du couvain se trouvent également chez les coléoptères bess ( Passalidae ) où les larves se nourrissent des excréments semi-digérés des adultes. [106]
Alimentation

 Hycleus sp. ( Meloidae ) se nourrissant des pétales d’ Ipomoea carnea
Hycleus sp. ( Meloidae ) se nourrissant des pétales d’ Ipomoea carnea
Les coléoptères sont capables d’exploiter une grande diversité de sources de nourriture disponibles dans leurs nombreux habitats. Certains sont omnivores , mangeant à la fois des plantes et des animaux. D’autres coléoptères sont hautement spécialisés dans leur régime alimentaire. De nombreuses espèces de coléoptères, de longicornes et de charançons sont très spécifiques à leur hôte et ne se nourrissent que d’une seule espèce de plante. Les carabes et les staphylins ( Staphylinidae ), entre autres, sont principalement carnivores et attrapent et consomment de nombreux autres arthropodes et petites proies, comme les vers de terre et les escargots. Alors que la plupart des coléoptères prédateurs sont des généralistes, quelques espèces ont des besoins ou des préférences plus spécifiques en matière de proies. [107] Chez certaines espèces, la capacité digestive repose sur unerelation symbiotique avec les champignons – certains coléoptères ont des levures qui vivent dans leurs tripes, y compris des levures inconnues auparavant. [108]
La matière organique en décomposition est un régime primaire pour de nombreuses espèces. Cela peut aller de la bouse , qui est consommée par des espèces coprophages (comme certains scarabées chez les Scarabaeidae ), à des animaux morts, qui sont mangés par des espèces nécrophages (comme les coléoptères charognards , Silphidae ). Certains coléoptères trouvés dans les excréments et les charognes sont en fait des prédateurs. Ceux-ci comprennent des membres des Histeridae et des Silphidae , se nourrissant des larves d’ insectes coprophages et nécrophages . [109]De nombreux coléoptères se nourrissent sous l’écorce, certains se nourrissent de bois tandis que d’autres se nourrissent de champignons poussant sur du bois ou des feuilles mortes. Certains coléoptères ont des mycangies spéciales , des structures pour le transport des spores fongiques. [110]
Écologie

 Un longicorne camouflé , Ecyrus dasycerus
Un longicorne camouflé , Ecyrus dasycerus
Adaptations anti-prédateurs
Les coléoptères, adultes et larves, sont la proie de nombreux prédateurs animaux, notamment des mammifères, des chauves -souris aux rongeurs , des oiseaux , des lézards , des amphibiens , des poissons , des libellules , des voleurs , des insectes réduvidés , des fourmis , d’autres coléoptères et des araignées . [111] [112] Les coléoptères utilisent une variété d’ adaptations anti-prédateurs pour se défendre. Ceux-ci incluent le camouflage et le mimétismecontre les prédateurs qui chassent à vue, par toxicité et par comportement défensif.
Camouflage
Le camouflage est courant et répandu parmi les familles de coléoptères, en particulier ceux qui se nourrissent de bois ou de végétation, comme les chrysomèles (Chrysomelidae, qui sont souvent verts) et les charançons . Chez certaines espèces, la sculpture ou diverses écailles ou poils colorés font que les coléoptères tels que le charançon de l’ avocat Heilipus apiatus ressemblent à de la bouse d’oiseau ou à d’autres objets non comestibles. [111] De nombreux coléoptères qui vivent dans des environnements sablonneux se fondent dans la coloration de ce substrat. [113]
Mimétisme et aposématisme 
 Clytus arietis ( Cerambycidae ), un imitateur batésien des guêpes
Clytus arietis ( Cerambycidae ), un imitateur batésien des guêpes
Certains longicornes (Cerambycidae) sont des imitateurs batésiens efficaces des guêpes . Les coléoptères peuvent combiner coloration et mimétisme comportemental, agissant comme les guêpes auxquelles ils ressemblent déjà beaucoup. De nombreux autres coléoptères, y compris les coccinelles , les coléoptères et les coléoptères lycidés , sécrètent des substances désagréables ou toxiques pour les rendre désagréables au goût ou toxiques, et sont souvent aposématiques , où une coloration vive ou contrastée avertit les prédateurs; de nombreux coléoptères et autres insectes imitent ces espèces chimiquement protégées. [114]

 Les coléoptères vésiculeux tels que Hycleus ont une coloration aposématique brillante , avertissant de leur toxicité.
Les coléoptères vésiculeux tels que Hycleus ont une coloration aposématique brillante , avertissant de leur toxicité. 
 Le coléoptère au nez sanglant, Timarcha tenebricosa , se défend en libérant une gouttelette de liquide rouge nocif (base de patte, à droite)
Le coléoptère au nez sanglant, Timarcha tenebricosa , se défend en libérant une gouttelette de liquide rouge nocif (base de patte, à droite)
La défense chimique est importante chez certaines espèces, généralement annoncée par des couleurs aposématiques vives. Certains Tenebrionidae utilisent leur posture pour libérer des produits chimiques nocifs afin d’avertir les prédateurs. Les défenses chimiques peuvent servir à des fins autres que la simple protection contre les vertébrés, comme la protection contre un large éventail de microbes. Certaines espèces séquestrent les produits chimiques des plantes dont elles se nourrissent, les incorporant à leurs propres défenses. [113]
D’autres espèces ont des glandes spéciales pour produire des produits chimiques dissuasifs. Les glandes défensives des carabes carabes produisent une variété d’ hydrocarbures , d’ aldéhydes , de phénols , de quinones , d’ esters et d’ acides libérés par une ouverture à l’extrémité de l’abdomen. Les carabes africains (par exemple, Anthia ) emploient les mêmes produits chimiques que les fourmis : l’acide formique . [114] Les coléoptères Bombardier ont des glandes pygidiennes bien développées qui se vident des côtés des membranes intersegments entre les septième et huitième segments abdominaux. Le presse-étoupe est constitué de deux chambres contenant, une pour les hydroquinoneset le peroxyde d’hydrogène , l’autre contenant les enzymes peroxyde d’hydrogène et catalase . Ces produits chimiques se mélangent et entraînent une éjection explosive, atteignant une température d’environ 100 ° C (212 ° F), avec la décomposition de l’hydroquinone en hydrogène, oxygène et quinone. L’oxygène propulse le spray chimique nocif comme un jet qui peut être dirigé avec précision sur les prédateurs. [7]
Autres défenses
Les grands coléoptères terrestres tels que les Carabidae , le scarabée rhinocéros et les longicornes se défendent en utilisant de fortes mandibules , ou des épines ou des cornes fortement sclérifiées (blindées) pour dissuader ou combattre les prédateurs. [113] De nombreuses espèces de charançons qui se nourrissent à l’air libre sur les feuilles des plantes réagissent à l’attaque en employant un réflexe de chute. Certains l’associent à la thanatose , dans laquelle ils referment leurs appendices et « font le mort ». [115] Les coléoptères de clic ( Elateridae ) peuvent soudainement se catapulter hors de danger en libérant l’énergie stockée par un mécanisme de clic, qui se compose d’une colonne vertébrale robuste sur le prosternum et d’une rainure correspondante dans le mésosternum.[111] Certaines espèces surprennent un attaquant en produisant des sons par un processus connu sous le nom de stridulation . [92]
Parasitisme
Quelques espèces de coléoptères sont ectoparasites sur les mammifères. Une de ces espèces, Platypsyllus castoris , parasite les castors ( Castor spp.). Ce coléoptère vit comme un parasite à la fois sous forme de larve et d’adulte, se nourrissant de tissu épidermique et éventuellement de sécrétions cutanées et d’exsudats de plaies. Ils sont étonnamment aplatis dorso-ventralement, sans doute comme une adaptation pour se glisser entre les poils des castors. Ils sont sans ailes et sans yeux, comme le sont de nombreux autres ectoparasites. [116] D’autres sont des kleptoparasites d’autres invertébrés, comme le petit coléoptère des ruches ( Aethina tumida ) qui infeste les nids d’abeilles , [117] tandis que de nombreuses espèces sont parasitesinquilines ou commensales dans les nids de fourmis . [118] Quelques groupes de coléoptères sont des parasitoïdes primaires d’autres insectes, se nourrissant et tuant finalement leurs hôtes. [119]
Pollinisation

 Un Israélien Copper Flower-Chafer ( Protaetia cuprea ignicollis ) sur une marguerite couronne ( Glebionis coronaria )
Un Israélien Copper Flower-Chafer ( Protaetia cuprea ignicollis ) sur une marguerite couronne ( Glebionis coronaria )
Les fleurs pollinisées par les coléoptères sont généralement grandes, de couleur verdâtre ou blanc cassé et très parfumées. Les odeurs peuvent être épicées, fruitées ou similaires à des matières organiques en décomposition. Les coléoptères ont probablement été les premiers insectes à polliniser les fleurs. [120] La plupart des fleurs pollinisées par les coléoptères sont aplaties ou en forme de plat, avec du pollen facilement accessible, bien qu’elles puissent inclure des pièges pour garder le coléoptère plus longtemps. Les ovaires des plantes sont généralement bien protégés des pièces buccales mordantes de leurs pollinisateurs. Les familles de coléoptères qui pollinisent habituellement les fleurs sont les Buprestidae , Cantharidae , Cerambycidae , Cleridae , Dermestidae , Lycidae ,Melyridae , Mordellidae , Nitidulidae et Scarabaeidae . [121] Les coléoptères peuvent être particulièrement importants dans certaines parties du monde telles que les régions semi-arides de l’Afrique australe et du sud de la Californie [122] et les prairies montagnardes du KwaZulu-Natal en Afrique du Sud. [123]
Mutualisme

 1 : Le scolyte ambrosia adulte s’enfouit dans le bois et pond des œufs, transportant des spores fongiques dans ses mycangies .
1 : Le scolyte ambrosia adulte s’enfouit dans le bois et pond des œufs, transportant des spores fongiques dans ses mycangies .
2 : La larve se nourrit de champignons, qui digère le bois, en éliminant les toxines, pour un bénéfice mutuel.
3 : Larve se nymphose.
Le mutualisme est bien connu chez quelques coléoptères, comme le scolyte à ambroisie , qui s’associe à des champignons pour digérer le bois des arbres morts. Les coléoptères creusent des tunnels dans les arbres morts dans lesquels ils cultivent des jardins fongiques, leur seule source de nutrition. Après avoir atterri sur un arbre approprié, un scolyte ambrosia creuse un tunnel dans lequel il libère les spores de son symbiote fongique . Le champignon pénètre dans le tissu du xylème de la plante, le digère et concentre les nutriments sur et près de la surface de la galerie des coléoptères, de sorte que les charançons et le champignon en profitent tous les deux. Les coléoptères ne peuvent pas manger le bois à cause des toxines et utilisent sa relation avec les champignons pour aider à surmonter les défenses de son arbre hôte afin de nourrir leurs larves. [124]Médiée chimiquement par un peroxyde polyinsaturé produit par des bactéries, [125] cette relation mutualiste entre le coléoptère et le champignon est co- évoluée . [124] [126]

 Coléoptère ténébrionide dans le désert du Thar
Coléoptère ténébrionide dans le désert du Thar
Tolérance aux environnements extrêmes

 Le coléoptère du désert du Namib , Stenocara gracilipes , est capable de survivre en recueillant l’eau du brouillard sur son dos.
Le coléoptère du désert du Namib , Stenocara gracilipes , est capable de survivre en recueillant l’eau du brouillard sur son dos.
Environ 90% des espèces de coléoptères entrent dans une période de diapause adulte , une phase calme avec un métabolisme réduit face aux conditions environnementales défavorables. La diapause adulte est la forme la plus courante de diapause chez les coléoptères. Pour supporter la période sans nourriture (qui dure souvent plusieurs mois), les adultes se préparent en accumulant des réserves de lipides, de glycogène, de protéines et d’autres substances nécessaires pour résister aux futurs changements dangereux des conditions environnementales. Cette diapause est induite par des signaux annonciateurs de l’arrivée de la saison défavorable ; habituellement le signal est photopériodique . La longueur du jour court (diminuant) sert de signal de l’approche de l’hiver et induit une diapause hivernale (hibernation). [127] Une étude de l’hibernation chez le coléoptère arctique Pterostichus brevicornisont montré que les niveaux de graisse corporelle des adultes étaient les plus élevés en automne avec le tube digestif rempli de nourriture, mais vide à la fin janvier. Cette perte de graisse corporelle était un processus graduel, se produisant en combinaison avec la déshydratation. [128]
Tous les insectes sont poïkilothermes [129] , de sorte que la capacité de quelques coléoptères à vivre dans des environnements extrêmes dépend de leur résistance à des températures anormalement élevées ou basses. Le scolyte Pityogenes chalcographus peut survivre à -39 ° C tout en hivernant sous l’écorce des arbres; [130] le coléoptère d’Alaska Cucujus clavipes puniceus est capable de résister à -58 °C ; ses larves peuvent survivre à -100 °C . [131]À ces basses températures, la formation de cristaux de glace dans les fluides internes est la plus grande menace pour la survie des coléoptères, mais cela est empêché par la production de protéines antigel qui empêchent les molécules d’eau de se regrouper. Les basses températures subies par Cucujus clavipes peuvent survivre grâce à leur déshydratation délibérée en conjonction avec les protéines antigel. Cela concentre plusieurs fois les antigels. [132] L’ hémolymphe du coléoptère Tenebrio molitor contient plusieurs protéines antigel . [133] Le coléoptère d’Alaska Upis ceramboides peut survivre à -60 °C : ses cryoprotecteurs sontle xylomannane , une molécule constituée d’un sucre lié à un acide gras , [134] et du sucre-alcool, le thréitol . [135]
À l’inverse, les coléoptères du désert sont adaptés pour tolérer des températures élevées. Par exemple, le coléoptère Tenebrionid Onymacris rugatipennis peut supporter 50 °C . [136] Les cicindèles dans les zones chaudes et sablonneuses sont souvent blanchâtres (par exemple, Habroscelimorpha dorsalis ), pour refléter plus de chaleur qu’une couleur plus foncée. Ces coléoptères présentent également des adaptations comportementales pour tolérer la chaleur : ils sont capables de se tenir debout sur leurs tarses pour tenir leur corps éloigné du sol chaud, chercher de l’ombre et se tourner pour faire face au soleil afin que seules les parties avant de leur tête soient directement exposé. [137]
Le coléoptère du désert du Namib , Stenocara gracilipes , est capable de recueillir l’eau du brouillard , car ses élytres ont une surface texturée combinant des bosses hydrophiles (qui aiment l’eau) et des creux cireux et hydrophobes . Le coléoptère fait face à la brise du petit matin, tendant son abdomen ; les gouttelettes se condensent sur les élytres et courent le long des crêtes vers leurs pièces buccales. Des adaptations similaires se retrouvent chez plusieurs autres coléoptères du désert du Namib comme Onymacris unguicularis . [138]
Certains coléoptères terrestres qui exploitent les habitats des rives et des plaines inondables ont des adaptations physiologiques pour survivre aux inondations. En cas d’inondation, les coléoptères adultes peuvent être suffisamment mobiles pour s’éloigner des inondations, mais les larves et les chrysalides ne le peuvent souvent pas. Les adultes de Cicindela togata sont incapables de survivre à l’immersion dans l’eau, mais les larves sont capables de survivre à une période prolongée, jusqu’à 6 jours, d’ anoxie lors d’inondations. La tolérance à l’anoxie chez les larves peut avoir été maintenue en passant à des voies métaboliques anaérobies ou en réduisant le taux métabolique. [139] Tolérance à l’anoxie chez le carabe adulte Pelophilia borealisa été testé dans des conditions de laboratoire et il a été constaté qu’ils pouvaient survivre pendant une période continue allant jusqu’à 127 jours dans une atmosphère de 99,9 % d’azote à 0 °C. [140]
Migration
De nombreuses espèces de coléoptères entreprennent des mouvements de masse annuels appelés migrations. Il s’agit notamment du coléoptère Meligethes aeneus [141] et de nombreuses espèces de coccinellides . [142] Ces mouvements de masse peuvent également être opportunistes, à la recherche de nourriture, plutôt que saisonniers. Une étude réalisée en 2008 sur une épidémie inhabituellement importante de dendroctones du pin ponderosa ( Dendroctonus ponderosae ) en Colombie-Britannique a révélé que les coléoptères étaient capables de voler de 30 à 110 km par jour à des densités allant jusqu’à 18 600 dendroctones par hectare. [143]
Relation aux humains
Dans les cultures anciennes
|
||
| Scarabée | ||
|---|---|---|
| Gardiner : L1 | ||
| Hiéroglyphes égyptiens |

 Un scarabée dans la Vallée des Rois
Un scarabée dans la Vallée des Rois
Plusieurs espèces de bousiers, en particulier le scarabée sacré, Scarabaeus sacer , étaient vénérées dans l’Égypte ancienne . [144] [145] L’image hiéroglyphique du coléoptère peut avoir eu une signification existentielle, fictive ou ontologique. [146] Des images du scarabée en os, en ivoire , en pierre, en faïence égyptienne et en métaux précieux sont connues depuis la sixième dynastie et jusqu’à la période de la domination romaine. Le scarabée était d’une importance primordiale dans le culte funéraire de l’Égypte ancienne. [147] Le scarabée était lié à Khepri , le dieu du soleil levant, de la ressemblance supposée du roulement de la boule de fumier par le scarabée au roulement du soleil par le dieu. [144] Certains des voisins de l’Égypte ancienne ont adopté le motif du scarabée pour des sceaux de différents types. Les plus connus d’entre eux sont les sceaux judéens LMLK , où huit des 21 dessins contenaient des scarabées, qui étaient utilisés exclusivement pour imprimer des empreintes sur des bocaux de stockage sous le règne d’ Ézéchias . [148] Les coléoptères sont mentionnés comme symbole du soleil, comme dans l’Égypte ancienne, dans la Moralia du 1er siècle de Plutarque . [149] Les papyrus magiques grecsdu 2ème siècle avant JC au 5ème siècle après JC décrivent les scarabées comme un ingrédient d’un sort. [150]
Pline l’Ancien parle des coléoptères dans son Histoire naturelle , [151] décrivant le lucane cerf -volant : “Certains insectes, pour la préservation de leurs ailes, sont recouverts d’un élytre ( le coléoptère, par exemple, dont l’aile est singulièrement fine et frêle. A ces insectes une piqûre a été refusée par la nature, mais dans une grande espèce, nous trouvons des cornes d’une longueur remarquable, à deux pointes aux extrémités, et formant des pinces, que l’animal ferme quand il a l’intention de mordre. .” [152] [153] Le coléoptère est enregistré dans un mythe grec par Nicandre et rappelé par Antoninus Liberalis dans lequel Cerambus [b]est transformé en coléoptère: “On le voit sur les troncs et il a des dents crochues, bougeant toujours ses mâchoires ensemble. Il est noir, long et a des ailes dures comme un grand bousier”. [154] L’histoire se termine par le commentaire que les coléoptères étaient utilisés comme jouets par les jeunes garçons et que la tête était enlevée et portée en pendentif. [153] [155]
Comme nuisibles

 Charançon de la capsule du coton
Charançon de la capsule du coton
Environ 75 % des espèces de coléoptères sont phytophages aux stades larvaire et adulte. Beaucoup se nourrissent de plantes économiquement importantes et de produits végétaux stockés, notamment des arbres, des céréales, du tabac et des fruits secs. [6] Certains, comme le charançon de la capsule , qui se nourrit de bourgeons de coton et de fleurs, peuvent causer des dommages extrêmement graves à l’agriculture. Le charançon de la capsule a traversé le Rio Grande près de Brownsville , au Texas , pour entrer aux États-Unis depuis le Mexique vers 1892, [156] et avait atteint le sud-est de l’Alabama .en 1915. Au milieu des années 1920, il était entré dans toutes les régions productrices de coton des États-Unis, parcourant de 40 à 160 miles (60 à 260 km) par an. Il demeure le ravageur du cotonnier le plus destructeur en Amérique du Nord. L’Université d’ État du Mississippi a estimé que, depuis que le charançon de la capsule est entré aux États-Unis, il a coûté aux producteurs de coton environ 13 milliards de dollars et, ces derniers temps, environ 300 millions de dollars par an. [156]
Le scolyte , la chrysomèle de l’ orme et le longicorne asiatique ( Anoplophora glabripennis ) [157] font partie des espèces qui s’attaquent aux ormes . Les scolytes ( Scolytidae ) sont porteurs de la maladie hollandaise de l’orme lorsqu’ils se déplacent des sites de reproduction infectés vers des arbres sains. La maladie a dévasté les ormes en Europe et en Amérique du Nord. [158]

 Les larves du doryphore de la pomme de terre , Leptinotarsa decemlineata , un grave ravageur des cultures
Les larves du doryphore de la pomme de terre , Leptinotarsa decemlineata , un grave ravageur des cultures
Certaines espèces de coléoptères ont développé une immunité aux insecticides. Par exemple, le doryphore de la pomme de terre , Leptinotarsa decemlineata , est un ravageur destructeur des plants de pomme de terre. Ses hôtes comprennent d’autres membres des Solanacées , comme la morelle , la tomate , l’ aubergine et le poivron , ainsi que la pomme de terre. Différentes populations ont développé entre elles une résistance à toutes les grandes classes d’insecticides. [159] Le doryphore de la pomme de terre a été évalué comme un outil de guerre entomologique pendant la Seconde Guerre mondiale , l’idée étant d’utiliser le coléoptère et ses larves pour endommager les récoltes des nations ennemies.[160] L’Allemagne a testé son programme de militarisation du doryphore de la pomme de terre au sud de Francfort , libérant 54 000 coléoptères. [161]
Le coléoptère de la veille de la mort , Xestobium rufovillosum ( Ptinidae ), est un ravageur sérieux des bâtiments en bois plus anciens en Europe. Il attaque les bois durs comme le chêne et le châtaignier , toujours là où une décomposition fongique a pris ou est en train de se produire. On pense que l’introduction réelle du ravageur dans les bâtiments a lieu au moment de la construction. [162]
Parmi les autres ravageurs, citons le coléoptère hispine du cocotier, Brontispa longissima , qui se nourrit de jeunes feuilles , de semis et de cocotiers matures , causant de graves dommages économiques aux Philippines . [163] Le dendroctone du pin ponderosa est un ravageur destructeur du pin tordu mature ou affaibli , affectant parfois de vastes régions du Canada. [164]
En tant que ressources bénéfiques

 Coccinella septempunctata , un coléoptère prédateur bénéfique pour l’agriculture
Coccinella septempunctata , un coléoptère prédateur bénéfique pour l’agriculture
Les coléoptères peuvent être bénéfiques pour l’économie humaine en contrôlant les populations de ravageurs. Les larves et les adultes de certaines espèces de coccinelles ( Coccinellidae ) se nourrissent de pucerons nuisibles. D’autres coccinelles se nourrissent de cochenilles , d’ aleurodes et de cochenilles . [165] Si les sources de nourriture normales sont rares, ils peuvent se nourrir de petites chenilles , de jeunes punaises ou de miellat et de nectar . [166] Les carabes (Carabidae) sont des prédateurs communs de nombreux insectes nuisibles, notamment les œufs de mouches, les chenilles et les taupins.[167] Les carabes peuvent aider à contrôler les mauvaises herbes en mangeant leurs graines dans le sol, réduisant ainsi le besoin d’ herbicides pour protéger les cultures. [168] L’efficacité de certaines espèces à réduire certaines populations végétales a entraîné l’introduction délibérée de coléoptères afin de contrôler les mauvaises herbes. Par exemple, le genre Zygogramma est originaire d’Amérique du Nord mais a été utilisé pour lutter contre Parthenium hysterophorus en Inde et Ambrosia artemisiifolia en Russie. [169] [170]
Les bousiers (Scarabidae) ont été utilisés avec succès pour réduire les populations de mouches pestilentielles, telles que Musca vetustissima et Haematobia exigua qui sont de sérieux ravageurs du bétail en Australie . [171] Les coléoptères rendent la bouse indisponible pour les ravageurs reproducteurs en la roulant et en l’enfouissant rapidement dans le sol, avec l’effet supplémentaire d’améliorer la fertilité du sol, l’état de la terre et le cycle des nutriments. [172] L’ Australian Dung Beetle Project (1965–1985), a introduit des espèces de bousiers en Australie depuis l’Afrique du Sud et l’Europe pour réduire les populations de Musca vetustissima , après des essais réussis de cette technique à Hawaï .[171] L’ American Institute of Biological Sciences rapporte que les bousiers font économiser à l’industrie bovine des États-Unis environ 380 millions de dollars américains par an en enfouissant les excréments de bétail hors sol. [173]
Les Dermestidae sont souvent utilisés en taxidermie et dans la préparation de spécimens scientifiques, pour nettoyer les tissus mous des os. [174] Les larves se nourrissent et enlèvent le cartilage avec d’autres tissus mous. [175] [176]
Comme nourriture et médicament

 Vers de farine dans un bol pour la consommation humaine
Vers de farine dans un bol pour la consommation humaine
Les coléoptères sont les insectes les plus consommés, avec environ 344 espèces utilisées comme nourriture, généralement au stade larvaire. [177] Le ver de farine (la larve du coléoptère noir ) et le coléoptère rhinocéros font partie des espèces couramment consommées. [178] Un large éventail d’espèces est également utilisé dans la médecine traditionnelle pour traiter les personnes souffrant de divers troubles et maladies, bien que cela se fasse sans études cliniques soutenant l’efficacité de ces traitements. [179]
Comme indicateurs de biodiversité
En raison de la spécificité de leur habitat, de nombreuses espèces de coléoptères ont été suggérées comme indicateurs appropriés, leur présence, leur nombre ou leur absence fournissant une mesure de la qualité de l’habitat. Les coléoptères prédateurs tels que les cicindèles ( Cicindelidae ) ont trouvé une utilisation scientifique comme taxon indicateur pour mesurer les modèles régionaux de biodiversité. Ils conviennent à cela car leur taxonomie est stable; leur histoire de vie est bien décrite; ils sont grands et simples à observer lors de la visite d’un site ; ils se produisent dans le monde entier dans de nombreux habitats, avec des espèces spécialisées dans des habitats particuliers ; et leur occurrence par espèce indique avec précision d’autres espèces, à la fois vertébrées et invertébrées. [180]Selon les habitats, de nombreux autres groupes tels que les staphylins dans les habitats modifiés par l’homme, les bousiers dans les savanes [181] et les coléoptères saproxyliques dans les forêts [182] ont été suggérés comme espèces indicatrices potentielles. [183]
Dans l’art et la parure

 Zopheridae dans les bijoux de la Texas A&M University Insect Collection
Zopheridae dans les bijoux de la Texas A&M University Insect Collection 
 Montre-pendentif en forme de scarabée, Suisse 1850–1900 or, diamant, émail
Montre-pendentif en forme de scarabée, Suisse 1850–1900 or, diamant, émail
De nombreux coléoptères ont des élytres durables qui ont été utilisés comme matériau dans l’art, le coléoptère étant le meilleur exemple. [184] Parfois, ils sont incorporés dans des objets rituels pour leur signification religieuse. Des coléoptères entiers, tels quels ou enfermés dans du plastique transparent, sont transformés en objets allant de souvenirs bon marché tels que des porte-clés à des bijoux d’art coûteux. Dans certaines parties du Mexique, les coléoptères du genre Zopherus sont transformés en broches vivantes en attachant des bijoux fantaisie et des chaînes dorées, ce qui est rendu possible par les élytres incroyablement durs et les habitudes sédentaires du genre. [185]
Dans le divertissement
Les scarabées combattants sont utilisés pour le divertissement et le jeu . Ce sport exploite le comportement territorial et la compétition d’accouplement de certaines espèces de grands coléoptères. Dans le district de Chiang Mai , au nord de la Thaïlande, des scarabées rhinocéros Xylotrupes mâles sont capturés dans la nature et entraînés au combat. Les femelles sont maintenues à l’intérieur d’une bûche pour stimuler les mâles combattants avec leurs phéromones. [186] Ces combats peuvent être compétitifs et impliquer des jeux d’argent et des biens. [187] En Corée du Sud , l’ espèce Dytiscidae Cybister tripunctatus est utilisée dans un jeu de type roulette. [188]
Les coléoptères sont parfois utilisés comme instruments : les Onabasulu de Papouasie-Nouvelle-Guinée utilisaient historiquement le charançon « hugu » Rhynchophorus ferrugineus comme instrument de musique en laissant la bouche humaine servir de chambre de résonance variable pour les vibrations des ailes du coléoptère adulte vivant. [187]
Comme animaux de compagnie
Certaines espèces de coléoptères sont gardées comme animaux de compagnie , par exemple les coléoptères plongeurs ( Dytiscidae ) peuvent être gardés dans un réservoir d’eau douce domestique. [189]

 “Coléoptères remarquables trouvés à Simunjon, Bornéo”. [c] Quelques-unes des 2 000 espèces de coléoptères recueillies par Alfred Russel Wallace à Bornéo
“Coléoptères remarquables trouvés à Simunjon, Bornéo”. [c] Quelques-unes des 2 000 espèces de coléoptères recueillies par Alfred Russel Wallace à Bornéo
Au Japon , l’élevage de scarabées rhinocéros cornus ( Dynastinae ) et de lucanes ( Lucanidae ) est particulièrement populaire chez les jeunes garçons. [190] La popularité au Japon est telle que des distributeurs automatiques de coléoptères vivants ont été développés en 1999, chacun pouvant contenir jusqu’à 100 coléoptères. [191] [192]
Comme des choses à collectionner
La collection de coléoptères est devenue extrêmement populaire à l’ époque victorienne . [193] Le naturaliste Alfred Russel Wallace a recueilli (selon son propre décompte) un total de 83 200 coléoptères au cours des huit années décrites dans son livre de 1869 L’archipel malais , dont 2 000 espèces nouvelles pour la science. [194]
Comme source d’inspiration pour les technologies
Plusieurs adaptations de coléoptères ont suscité un intérêt pour le biomimétique avec des applications commerciales possibles. Le puissant spray répulsif du scarabée bombardier a inspiré le développement d’une technologie de brumisation fine, censée avoir un faible impact carbone par rapport aux sprays aérosols. [195] Le comportement de récolte de l’humidité du coléoptère du désert du Namib ( Stenocara gracilipes ) a inspiré une bouteille d’eau à remplissage automatique qui utilise des matériaux hydrophiles et hydrophobes au profit des personnes vivant dans des régions sèches sans précipitations régulières. [196]
Des coléoptères vivants ont été utilisés comme cyborgs . Un projet financé par la Defense Advanced Research Projects Agency a implanté des électrodes dans des coléoptères Mecynorhina torquata , leur permettant d’être contrôlés à distance via un récepteur radio tenu sur le dos, comme preuve de concept pour les travaux de surveillance. [197] Une technologie similaire a été appliquée pour permettre à un opérateur humain de contrôler les allures de direction et de marche en vol libre de Mecynorhina torquata ainsi que les virages progressifs et la marche arrière de Zophobas morio . [198] [199] [200]
Une recherche publiée en 2020 visait à créer un sac à dos de caméra robotique pour les coléoptères. Des caméras miniatures pesant 248 mg ont été attachées à des coléoptères vivants des genres Tenebrionidae Asbolus et Eleodes . Les caméras ont filmé sur une plage de 60° pendant jusqu’à 6 heures. [201] [202]
En conservation
Étant donné que les coléoptères forment une si grande partie de la biodiversité mondiale, leur conservation est importante, et de même, la perte d’habitat et de biodiversité est essentiellement certaine d’avoir un impact sur les coléoptères. De nombreuses espèces de coléoptères ont des habitats très spécifiques et de longs cycles de vie qui les rendent vulnérables. Certaines espèces sont fortement menacées tandis que d’autres sont déjà éteintes. [203] Les espèces insulaires ont tendance à être plus sensibles, comme dans le cas d ‘ Helictopleurus undatus de Madagascar, qui aurait disparu à la fin du 20e siècle. [204] Les défenseurs de l’environnement ont tenté d’éveiller le goût des coléoptères avec des espèces phares comme le lucane, Lucanus cervus , [205] et les cicindèles ( Cicindelidae). Au Japon, la luciole Genji, Luciola cruciata , est extrêmement populaire, et en Afrique du Sud, le bousier d’éléphant Addo offre la promesse d’élargir l’écotourisme au-delà des cinq grandes espèces de mammifères touristiques . L’aversion populaire pour les coléoptères nuisibles peut également se transformer en intérêt public pour les insectes, tout comme les adaptations écologiques inhabituelles d’espèces comme le coléoptère féerique chasseur de crevettes, Cicinis bruchi . [206]
Remarques
- ^ Ceux-ci comptent les segments tarsiens de la jambe avant, moyenne et arrière, tels que 5-5-4.
- ↑ Le longicorne rongeur de bois du genre Cerambyx porte son nom.
- ^ La plaque était étiquetée “Neocerambyx æneas, Cladognathus tarandus, Diurus furcellatus, Ectatorhinus Wallacei, Megacriodes Saundersii, Cyriopalpus Wallacei”.
Références
- ^ un b Bouchard, P.; Bousquet, Y.; Davies, A.; Alonso-Zarazaga, M.; Lawrence, J.; Lyal, C.; Newton, A.; Reid, C.; Schmitt, M.; Ślipiński, A.; En ligneSmith, A. (2011). “Noms de groupes familiaux chez Coleoptera (Insecta)” . ZooKeys (88): 1–972. doi : 10.3897/zookeys.88.807 . PMC 3088472 . PMID 21594053 .
- ^ Harper, Douglas. “Coléoptères” . Dictionnaire d’étymologie en ligne .
- ^ Harper, Douglas. « Scarabée » . Dictionnaire d’étymologie en ligne .
- ^ “Scarabée” . Dictionnaire en ligne Merriam-Webster . Consulté le 20 février 2016 .
- ^ Harper, Douglas. “Chafer” . Dictionnaire d’étymologie en ligne .
- ^ un bcdefghi Gilliott , Cédric ( août 1995 ) . Entomologie (2 éd.). Springer Verlag. p. 96. ISBN 978-0-306-44967-3.
- ^ un bcdefghijklmnopq McHugh ( 2009 ) _ _ _ _ _ _ _ _ _ _ _ _
- ^ Rosenzweig, ML (1995). Diversité des espèces dans l’espace et le temps . Cambridge : Cambridge University Press. p. 2. ISBN 978-0-521-49952-1.
- ^ une chasse b , T.; Bergsten, J.; Levkanicova, Z.; Papadopoulou, A.; Jean, OS ; Sauvage, R. ; Hammond, PM ; Ahrens, D.; Balke, M.; Caterino, MS; Gómez-Zurita, J.; Ribera, je ; Barraclough, TG ; Bocakova, M.; Bocak, L; Vogler, AP (2007). “Une phylogénie complète des coléoptères révèle les origines évolutives d’un superradiation”. Sciences . 318 (5858): 1913-1916. Code bib : 2007Sci …318.1913H . doi : 10.1126/science.1146954 . PMID 18096805 . S2CID 19392955 .
- ^ Hammond, PM (1992). Inventaire des espèces . Biodiversité mondiale, état des ressources vivantes de la Terre: un rapport (1ère éd.). Londres : Chapman & Hall. p. 17–39 . ISBN 978-0-412-47240-4.
- ^ une cigogne b , Nigel E.; McBroom, James; Gély, Claire ; En ligneHamilton, Andrew J. (2015). “De nouvelles approches réduisent les estimations des espèces mondiales pour les coléoptères, les insectes et les arthropodes terrestres” . PNAS . 116 (24): 7519–7523. Bibcode : 2015PNAS..112.7519S . doi : 10.1073/pnas.1502408112 . PMC 4475949 . PMID 26034274 .
- ^ Gullan, PJ; Cranston, PS (2014). Les insectes: un aperçu de l’entomologie (5 éd.). John Wiley et fils. p. 6 . ISBN 978-1-4443-3036-6.
- ^ Gullan, PJ; Cranston, PS (2014). Les insectes: un aperçu de l’entomologie (5 éd.). John Wiley et fils. p. 517 . ISBN 978-1-4443-3036-6.
- ^ Kirmse S, Adis J, Morawetz W. 2003. Événements de floraison et diversité des coléoptères au Venezuela. Dans : Basset Y, Novotny V, Miller SE, Kitching RL, éditeurs. Arthropodes des forêts tropicales : Dynamique spatio-temporelle et utilisation des ressources dans la canopée. Cambridge : Cambridge University Press ; p. 256–265.
- ^ Arndt, Erik; Kirmse, Susan; En ligneErwin, Terry L. (2001). “Coléoptères arboricoles des forêts néotropicales: Agra Fabricius , descriptions larvaires avec des notes sur l’histoire naturelle et le comportement (Coleoptera, Carabidae, Lebiini, Agrina)”. Le Bulletin des coléoptères . 55 (3): 297–310. doi : 10.1649/0010-065x(2001)055[0297:abonfa]2.0.co;2 .
- ^ Kirmse, Susan; Chaboo, Caroline S. (2018). “La polyphagie et la florivorie prévalent dans une communauté de coléoptères (Coleoptera: Chrysomelidae) habitant la canopée d’une forêt tropicale de basse altitude dans le sud du Venezuela”. Revue d’histoire naturelle . 52 (41–42): 2677–2721. doi : 10.1080/00222933.2018.1548666 . S2CID 91732501 .
- ^ Kirmse, Susan; Ratcliffe, Brett C. (2019). “Composition et modèles d’utilisation de l’hôte d’une communauté de scarabées (Coleoptera: Scarabaeidae) habitant la canopée d’une forêt tropicale humide de basse altitude dans le sud du Venezuela” . Le Bulletin des coléoptères . 73 : 149. doi : 10.1649/0010-065X-73.1.149 . S2CID 108786139 .
- ^ “L’insecte le plus lourd” . Records du monde Guinness . Consulté le 1er février 2017 .
- ^ Williams, David M. (2001). “Chapitre 30 – Le plus gros insecte” . Livre des records d’insectes . Université de Floride . Archivé de l’original le 18 juillet 2011.
- ^ Polilov, Alexeï (2015). “Quelle est la taille du plus petit ? Nouveau record et nouvelle mesure de Scydosella musawasensis Hall, 1999 (Coleoptera, Ptiliidae), le plus petit insecte vivant en liberté connu” . ZooKeys (526): 61–64. faire : 10.3897/zookeys.526.6531 . PMC 4607844 . PMID 26487824 .
- ^ Kirejtshuk, Alexander G.; Poschmann, Markus; Prokop, Jakub ; Garrouste, Romain; Nel, André (4 juillet 2014). “Évolution de la nervation élytrale et adaptations structurelles chez les coléoptères paléozoïques les plus anciens (Insecta : Coleoptera : Tshekardocoleidae)” . Journal de paléontologie systématique . 12 (5): 575–600. doi : 10.1080/14772019.2013.821530 . ISSN 1477-2019 . S2CID 85163674 .
- ^ Hörnschemeyer, T.; Stapf, H. “Die Insektentaphozönose von Niedermoschel (Asselian, unt. Perm; Deutschland)”. Schriften der Alfred-Wegener-Stiftung (en allemand) (99/8): 98.
- ^ Kukalová, J. (1969). “Sur la position systématique des supposés coléoptères du Permien, Tshecardocoleidae, avec une description d’une nouvelle collection de Moravie”. Sborník Geologických Věd, Paléontologie . 11 : 139–161.
- ^ un bcdef Benisch , Christoph ( 2010 ). « Phylogénie des coléoptères » . La faune coléoptère de l’Allemagne . Kerbtier . Récupéré le 16 mars 2011 .
- ^ Beckemeyer, RJ; Engel, MS (2008). “Un deuxième spécimen de Permocoleus (Coleoptera) de la formation Wellington du Permien inférieur du comté de Noble, Oklahoma” (PDF) . Journal de la Société d’entomologie du Kansas . 81 (1): 4–7. doi : 10.2317/JKES-708.01.1 . S2CID 86835593 . Archivé de l’original (PDF) le 18 juillet 2011.
- ^ Zhao, Xianye; Yu, Yilun ; Clapham, Matthieu E; Yan, Evgeny ; Chen, juin ; Jarzembowski, Edmund A; Zhao, Xiangdong ; Wang, Bo (8 novembre 2021). Perry, George H; Fikacek, Martin (éd.). « Évolution précoce des coléoptères régulée par la déforestation de la fin du Permien » . eLife . 10 : e72692. doi : 10.7554/eLife.72692 . ISSN 2050-084X . PMC 8585485 . PMID 34747694 .
- ^ un bc McHugh (2009) , p. 186
- ^ Labandeira, CC; Sepkoski, JJ (1993). “La diversité des insectes dans les archives fossiles” (PDF) . Sciences . 261 (5119): 310–315. Bibcode : 1993Sci…261..310L . CiteSeerX 10.1.1.496.1576 . doi : 10.1126/science.11536548 . PMID 11536548 . Archivé de l’original (PDF) le 31 mars 2012.
- ^ Gratshev, Vadim G.; Zherikhin, Vladimir V. (15 octobre 2003). “La diversité des insectes dans les archives fossiles” (PDF) . Acta Zoologica Cracoviensia . 261 (5119): 129–138. Bibcode : 1993Sci…261..310L . CiteSeerX 10.1.1.496.1576 . doi : 10.1126/science.11536548 . PMID 11536548 . Archivé de l’original (PDF) le 29 décembre 2016 . Récupéré le 16 mars 2011 .
- ^ Chang, H.; Zhang, F.; Ren, D. (2008). “Un nouveau genre et deux nouvelles espèces d’élatérides fossiles de la formation Yixian du Liaoning occidental, Chine (Coleoptera: Elateridae)” (PDF) . Zootaxons . 1785 (1): 54–62. doi : 10.11646/zootaxa.1785.1.3 . Archivé de l’original (PDF) le 4 juillet 2011.
- ^ Alexeev, AV (1993). “Buprestidae du Jurassique et du Crétacé inférieur (Coleoptera) d’Eurasie” (PDF) . Journal paléontologique (1A): 9–34.
- ^ Ponomarenko, Alexandr G. (1985). “Insectes fossiles du Tithonien ‘Solnhofener Plattenkalke’ au Musée d’histoire naturelle de Vienne” (PDF) . Annalen des Naturhistorischen Museums à Vienne . 87 (1): 135–144.
- ^ Yan, EV (2009). “Un nouveau genre de coléoptères élatériformes (Coleoptera, Polyphaga) du Jurassique moyen-supérieur de Karatau” (PDF) . Journal paléontologique . 43 (1): 78–82. doi : 10.1134/S0031030109010080 . S2CID 84621777 . Archivé de l’original (PDF) le 18 juillet 2011.
- ^ un b Tan, J.-J.; Ren, D.; En ligneLiu, M. (2005). “Nouveaux ommatidés du Jurassique supérieur de l’ouest du Liaoning, Chine (Coleoptera: Archostemata)” (PDF) . Sciences des insectes . 12 (3): 207-216. doi : 10.1111/j.1005-295X.2005.00026.x . S2CID 83733980 . Archivé de l’original (PDF) le 18 juillet 2011.
- ^ Ponomarenko, AG (1997). “Nouveaux coléoptères de la famille des Cupedidae du Mésozoïque de Mongolie. Ommatini, Mesocupedini, Priacmini” (PDF) . Journal paléontologique . 31 (4): 389–399. Archivé de l’original (PDF) le 25 septembre 2006.
- ^ Alexeev, AV (2009). “Nouveaux Coléoptères Jewel (Coleoptera: Buprestidae) du Crétacé de Russie, du Kazakhstan et de Mongolie” (PDF) . Journal paléontologique . 43 (3): 277-281. doi : 10.1134/s0031030109030058 . S2CID 129618839 . Archivé de l’original (PDF) le 18 juillet 2011.
- ^ Chin, K.; Gill, BD (1996). “Dinosaures, bousiers et conifères; participants à un réseau trophique du Crétacé”. PALAIOS . 11 (3): 280–285. Bibcode : 1996Palai..11..280C . doi : 10.2307/3515235 . JSTOR 3515235 .
- ^ Arillo, Antonio & Ortuño, Vicente M. (2008). “Les dinosaures avaient-ils une relation avec les bousiers? (L’origine de la coprophagie)”. Revue d’histoire naturelle . 42 (19&20): 1405–1408. doi : 10.1080/00222930802105130 . S2CID 83643794 .
- ^ David Peris; Jes Rust (2020). “Coléoptères du Crétacé (Insecta : Coléoptères) dans l’ambre : la paléoécologie de ce groupe d’insectes des plus diversifiés” . Journal zoologique de la Linnean Society . 189 (4): 1085-1104. doi : 10.1093/zoolinnean/zlz118 .
- ^ McNamara, moi; Briggs, DEG; Orr, PJ; Non, H. ; Cao, H. (2011). “Les couleurs originales des coléoptères fossiles” . Actes de la Royal Society B: Sciences biologiques . 279 (1731): 1114–1121. doi : 10.1098/rspb.2011.1677 . PMC 3267148 . PMID 21957131 .
- ^ Cooper, GR (1979). “Coléoptères fossiles du Cénozoïque tardif: évolution, biogéographie et écologie”. Revue annuelle d’écologie et de systématique . 10 : 246–267. doi : 10.1146/annurev.es.10.110179.001335 . JSTOR 2096792 .
- ^ Hutchinson, GE (1959). “Hommage à Santa Rosalia ou pourquoi y a-t-il tant d’espèces d’animaux ?”. Le naturaliste américain . 93 (870): 145–159. doi : 10.1086/282070 . JSTOR 2458768 . S2CID 26401739 .
- ^ Maddison, DR (1995). “Polyphage” . Projet web Arbre de Vie . Consulté le 27 février 2016 .
- ^ Beutel, RG; Laurent, JF (2005). “4. Coléoptères (Morphologie)”. À Kristensen, NP ; Beutel, RG (éd.). Manuel de zoologie, Bande 4 : Arthropodes, 2 : Insectes, Coléoptères, Coléoptères. Tome 1 : Morphologie et Systématique (Archostemata, Adephaga, Myxophaga, Polyphaga partim) . p. 23. ISBN 978-3-11-017130-3.
- ^ Beutel, RG; En ligneRibera, I. (2005). “7. Adéphaga Schellenberg, 1806”. À Kristensen, NP ; Beutel, RG (éd.). Manuel de zoologie, Bande 4 : Arthropodes, 2 : Insectes, Coléoptères, Coléoptères. Tome 1 : Morphologie et Systématique (Archostemata, Adephaga, Myxophaga, Polyphaga partim) . p. 54. ISBN 978-3-11-017130-3.
- ^ “Sous-ordre Archostemata – Coléoptères réticulés et téléphoniques” . Guide des bogues. 2006 . Récupéré le 26 janvier 2017 .
- ^ un bc _ , John F.; Ślipinski, Adam (2013). Coléoptères australiens. Morphologie, classification et clés . CSIRO. p. 1–16. ISBN 978-0-643-09728-5.
- ^ Mesaros, Gabor (2013). “Sphaeriusidae (Coleoptera, Myxophaga): Une nouvelle famille de coléoptères pour la faune de Serbie” . Bulletin du Muséum d’histoire naturelle (6): 71–74. doi : 10.5937/bnhmb1306071m .
- ^ Beutel, Rolf G.; Leschen, Richard (2005). Manuel de zoologie. Volume 4. Partie 38. Arthropodes. Morphologie et Systématique (Archostemata, Adephaga, Myxophaga, Polyphaga partim) . Walter de Gruyter. p. 43.
- ^ Merlan, Michael F. (2002). “Phylogénie des ordres d’insectes holométaboles: preuves moléculaires”. Zoologica Scripta . 31 (1): 3–15. doi : 10.1046/j.0300-3256.2001.00093.x . S2CID 45544978 .
- ^ Beutel, R.; En ligneHaas, F. (2000). “Relations phylogénétiques des sous-ordres de Coleoptera (Insecta)”. Cladistique . 16 (1): 103–141. doi : 10.1111/j.1096-0031.2000.tb00350.x . PMID 34902922 . S2CID 56131113 .
- ^ un b Kukalová-Peck, J.; Laurent, JF (1993). “Evolution de l’aile postérieure chez les Coléoptères”. Entomologiste canadien . 125 (2): 181–258. doi : 10.4039/Ent125181-2 .
- ^ Maddison, DR; Moore, W.; Baker, MD; Ellis, TM; Ober, KA; Canon, JJ; Gutell, RR (2009). “Monophylie des coléoptères terrestres adephagan comme indiqué par trois gènes nucléaires (Coleoptera: Carabidae et Trachypachidae)” . Zoologica Scripta . 38 (1): 43–62. doi : 10.1111/j.1463-6409.2008.00359.x . PMC 2752903 . PMID 19789725 .
- ^ Maddison, David R. (11 septembre 2000). “Coléoptères. Coléoptère” . Projet Web Arbre de vie . tolweb.org . Consulté le 18 mars 2011 .
- ^ Niehuis, Olivier; Hartig, Gerrit; Grath, Sonja ; et coll. (2012). “Les preuves génomiques et morphologiques convergent pour résoudre l’énigme des strepsiptères” . Biologie actuelle . 22 (14): 1309-1313. doi : 10.1016/j.cub.2012.05.018 . PMID 22704986 .
- ^ un bc McKenna , Duane D.; Wild, Alexander L.; et coll. (2015). “L’arbre de vie du coléoptère révèle que les Coléoptères ont survécu à l’extinction massive de la fin du Permien pour se diversifier lors de la révolution terrestre du Crétacé” . Entomologie systématique . 40 (4): 835–880. doi : 10.1111/syen.12132 .
- ^ une chasse b , Toby; et coll. (2007). “Une phylogénie complète des coléoptères révèle les origines évolutives d’un superradiation”. Sciences . 318 (5858): 1913–19116. Code bib : 2007Sci …318.1913H . doi : 10.1126/science.1146954 . PMID 18096805 . S2CID 19392955 .
- ^ “Introduction à l’identification des coléoptères (coléoptères)” (PDF) . Université de Floride . Consulté le 15 mars 2017 .
- ^ Lau TFS; Meyer-Rochow VB (2006). “Dimorphisme sexuel dans l’œil composé de Rhagophthalmus ohbai (Coleoptera; Rhagophthalmidae): I. Morphologie et ultrastructure”. Journal d’entomologie Asie-Pacifique . 9 : 19–30. doi : 10.1016/S1226-8615(08)60271-X .
- ^ un b Hangay, G.; En ligneZborowski, P. (2010). Un guide des coléoptères d’Australie . CSIRO. p. 10 . ISBN 9780643094871.
- ^ Gokan N.; Meyer-Rochow VB (2000). “Les comparaisons morphologiques des yeux composés chez Scarabaeoidea (Coleoptera) liés aux maxima d’activité quotidienne des coléoptères et aux positions phylogénétiques”. Journal des sciences agricoles (Tokyo Nogyo Daigaku) . 45 (1): 15–61.
- ^ un b Benisch, Christoph (2007). “3. Antennes, morphologie du coléoptère” . Kerbtier.de (Faune coléoptère d’Allemagne) . Consulté le 14 mars 2017 .
- ^ Zurek, DB; Gilbert, C. (2014). “Les antennes statiques agissent comme des guides locomoteurs qui compensent le flou de mouvement visuel chez un prédateur diurne aux yeux perçants” . Actes de la Royal Society B: Sciences biologiques . 281 (1779) : 20133072. doi : 10.1098/rspb.2013.3072 . PMC 3924084 . PMID 24500171 .
- ^ Berkov, Amy; Rodríguez, Nelson ; Centeno, Pedro (2007). “Évolution convergente dans les antennes d’un coléoptère cérambycide, Onychocerus albitarsis , et la piqûre d’un scorpion”. Naturwissenschaften . 95 (3): 257–61. Bibcode : 2008NW…..95..257B . doi : 10.1007/s00114-007-0316-1 . PMID 18004534 . S2CID 30226487 .
- ^ “Types d’antennes” . Université de Sidney. Archivé de l’original le 22 février 2018 . Consulté le 26 janvier 2017 .
- ^ Arnett, Jr., RH; Thomas, MC (2001). Coléoptères d’Amérique, Volume I : Archostemata, Myxophaga, Adephaga, Polyphaga : Staphyliniformia . Presse CRC. p. 3–7. ISBN 978-1-4822-7432-5.{{cite book}}: CS1 maint: multiple names: authors list (link)
- ^ “Anatomie : tête, thorax, abdomen et organes génitaux (insectes)” . quoi-quand-comment.com. Archivé de l’original le 22 juin 2018 . Consulté le 26 janvier 2017 .
- ^ Vert, Kristina Karlsson; Kovalev, Alexandre; Svensson, Erik I.; Gorb, Stanislav N. (2013). “Capacité de serrage mâle, polymorphisme femelle et conflit sexuel: morphologie élytrale à petite échelle en tant qu’adaptation sexuellement antagoniste chez les coléoptères plongeurs femelles” . Journal de l’interface de la société royale . 10 (86) : 20130409. doi : 10.1098/rsif.2013.0409 . PMC 3730688 . PMID 23825114 .
- ^ Burkness, S.; En ligneHahn, J. (2007). “Les altises dans les jardins potagers” . Université du Minnesota (Extension) . Consulté le 26 janvier 2017 .
- ^ un charpentier b , George Herbert (1899). Les insectes, leur structure et leur vie .
- ^ Philips, Chris; Fread, Elizabeth; Kuhar, Tom, Leatherwing (Soldier) Beetles (PDF) , archivé de l’original (PDF) le 30 novembre 2016 , récupéré le 14 mars 2017
- ^ Donald W. Hall; Marc A. Branham (2016). “Calopteron discrepans (Newman) (Insecta : Coleoptera : Lycidae)” . Université de Floride . Consulté le 15 mars 2017 .
- ^ Laurent, JF; Hastings, AM ; Dallwitz, MJ; Paine, TA ; Zürcher, EJ (2005). ” Elateriformia (Coleoptera): descriptions, illustrations, identification, et recherche d’informations pour les familles et sous-familles” . Consulté le 26 janvier 2017 .
- ^ Beenen, R; Winkelman, JK (2001). “Aantekeningen sur Chrysomelidae aux Pays-Bas 5”. Entomologische Berichten (en néerlandais). 61 : 63–67.
- ^ Arnett, Ross H., Jr; En ligneThomas, Michael C. (2000). Coléoptères américains, Volume I : Archostemata, Myxophaga, Adephaga, Polyphaga : Staphyliniformia . Presse CRC. p. 8. ISBN 978-1-4822-7432-5.
- ^ Seymour, Roger S.; Matthews, Philip GD (2012). “Brillies physiques chez les insectes et araignées plongeurs : théorie et expérience” . Le Journal de biologie expérimentale . 216 (2): 164–70. doi : 10.1242/jeb.070276 . PMID 23255190 .
- ^ Schmidt-Nielsen, Knut (15 janvier 1997). “Respiration des insectes” . Physiologie animale: adaptation et environnement (5e éd.). Presse universitaire de Cambridge . p. 55. ISBN 978-0-521-57098-5.
- ^ Miller, TA (1985). “Chapitre 8: Structure et Physiologie du Système Circulatoire”. À Kerkut, Géorgie ; Gilbert, LI (éd.). Physiologie, biochimie et pharmacologie complètes des insectes. Tome 3 : Tégument, Respiration et Circulation . Presse de Pergame. p. 289–355. ISBN 978-0-08-030804-3.
- ^ Scoble, MJ (1992). Les lépidoptères : forme, fonction et diversité . Presse universitaire d’Oxford. ISBN 978-1-4020-6242-1.
- ^ Ozbek, H.; En ligneSzalokia, D. (1998). “Une contribution à la connaissance de la faune Meloidae (Coleoptera) de Turquie avec un nouveau record” . Journal turc de zoologie . 22 : 23–40.
- ^ Medvedev, LN; Pavlov, SI (1988). “Comportement d’accouplement des Chrysomelidae (Coleoptera)”. Revue entomologique . 67 : 100–108.
- ^ Crowson, RA (2013). La Biologie des Coléoptères . Sciences Elsevier . p. 358–370. ISBN 978-1-4832-1760-4.
- ^ Beck, SD; Bharadwaj, RK (1972). “Développement inversé et vieillissement cellulaire chez un insecte”. Sciences . 178 (4066): 1210–1211. Bibcode : 1972Sci…178.1210B . doi : 10.1126/science.178.4066.1210 . PMID 4637808 . S2CID 34101370 .
- ^ “Définition de ‘Scarabaeiform'” . Société des entomologistes amateurs . Récupéré le 27 janvier 2017 .
- ^ Krinsky, WL (2009). “8 Coléoptères ( Coléoptères )”. À Mullen, GR; Durden, LA (éd.). Entomologie médicale et vétérinaire (2e éd.). Elsvier . p. 101–115. ISBN 978-0-12-372500-4.
- ^ “Hypermetamorphosis of Striped Blister Beetle – Epicauta vittata ” . Guide des bogues. 2007 . Consulté le 27 janvier 2017 .
- ^ Zeng, Yong (1995). “Cycle de vie le plus long” . Université de Floride . Consulté le 17 mars 2017 .
- ^ Jeffries, Daniel L.; Chapman, Jason; Roy, Helen E. ; Humphries, Stuart; Harrington, Richard; Brown, Peter MJ; Handley, Lori-J. Lawson (2013). “Caractéristiques et moteurs du vol de la coccinelle à haute altitude: aperçus du radar entomologique à visée verticale” . PLOS ONE . 8 (2) : e82278. Bibcode : 2013PLoSO…882278J . doi : 10.1371/journal.pone.0082278 . PMC 3867359 . PMID 24367512 .
- ^ Capinera, John L. (2008). Encyclopédie d’entomologie (2 éd.). Springer Science et médias d’affaires. pages 3218-3219 . ISBN 978-1-4020-6242-1.
- ^ Arnett RH, Jr.; Thomas, MC (2001). “Haliplidés”. Coléoptères américains, tome 1 . Presse CRC. p. 138–143. ISBN 978-0-8493-1925-9.
- ^ “Coléoptère du pin de montagne – Amour du coléoptère” . Parcs Canada . Récupéré le 13 mars 2011 .
- ^ un b Meyer-Rochow, VB (1971). “Observations sur les coléoptères australiens stridulants (Hydrophilidae, Cerambycidae, Passalidae, Dynastinae) en utilisant des techniques microscopiques électroniques et électrophysiologiques à balayage”. Forma et Functio . 4 : 326–339.
- ^ Brandmayr P. 1992. Bref examen de l’évolution présociale chez Coleoptera. Ethol Ecol Evol. 4:7–16.
- ^ Wyatt, TD & Foster, WA (1989). “Soins parentaux chez le coléoptère subsocial intertidal, Bledius spectabilis , en relation avec le parasitisme par la guêpe ichneumonide, Barycnemis blediator “. Comportement . 110 (1–4) : 76–92. doi : 10.1163/156853989X00394 . JSTOR 4534785 .
- ^ Milne, Lorus J.; Milne, Margery J. (1944). “Notes sur le comportement des coléoptères funéraires (Nicrophorus spp.)”. Journal de la Société d’entomologie de New York . 52 (4): 311–327. JSTOR 25005075 .
- ^ Hanski, Ilkka; Yves, Cambefort (1991). Écologie du bousier . Presse universitaire de Princeton. pages 626–672. ISBN 978-0-691-08739-9.
- ^ “Coléoptère | Animaux et plantes du zoo de San Diego” . animaux.sandiegozoo.org . Consulté le 18 juillet 2017 .
- ^ Chaboo, CS; Frieiro-Costa, FA ; Gómez-Zurita, J.; En ligneWesterduijn, R. (2014). “Sous-socialité chez les coléoptères (Coleoptera: Chrysomelidae: Cassidinae, Chrysomelinae)”. Revue d’histoire naturelle . 48 : 1–44. doi : 10.1080/00222933.2014.909060 . S2CID 84683405 .
- ^ Chaboo, CS (2002). “Premier rapport sur les immatures, les organes génitaux et les soins maternels chez Eugenysa columbiana (Boheman) (Coleoptera: Chrysomelidae: Cassidinae: Eugenysini)”. Le Bulletin des coléoptères . 56 : 50–67. doi : 10.1649/0010-065x(2002)056[0050:froiga]2.0.co;2 .
- ^ Windsor, DM (1987). “Histoire naturelle d’un coléoptère de tortue subsocial, Acromis sparsa Boheman (Chrysomelidae, Cassidinae) au Panama” . Psyché . 94 (1–2) : 127–150. doi : 10.1155/1987/19861 .
- ^ Reid, CAME; Beatson, M; En ligneHasenpusch, J (2009). “La morphologie et la biologie de Pterodunga mirabile Daccordi, une chrysomeline sous-sociale inhabituelle (Coleoptera: Chrysomelidae)”. J. Nat. Hist . 43 (7–8) : 373–398. doi : 10.1080/00222930802586016 . S2CID 84744056 .
- ^ Windsor DM, Choe JC. 1994. Origines des soins parentaux chez les chrysomèles. Dans : Jolivet PH, Cox ML, Petitipierre E, éditeurs. Nouveaux aspects de la biologie des Chrysomelidae. Série Entomologica 50. Dordrecht : Kluwer Academic Publishers ; p. 111–117.
- ^ Crespi, BJ; Yanega, D. (1995). “La définition de l’eusocialité”. Écologie comportementale . 6 (1): 109–115. doi : 10.1093/beheco/6.1.109 .
- ^ un b Kent, DS & Simpson, JA (1992). “Eusocialité chez le coléoptère Austroplatypus incompertus (Coleoptera: Curculionidae)”. Naturwissenschaften . 79 (2): 86–87. Bib code : 1992NW …..79…86K . doi : 10.1007/BF01131810 . S2CID 35534268 .
- ^ un b “Science : Le coléoptère australien qui se comporte comme une abeille” . Nouveau scientifique . 9 mai 1992 . Consulté le 31 octobre 2010 .
- ^ Schuster, Jack C.; Schuster, Laura B. (1985). “Comportement social chez les coléoptères Passalid (Coleoptera: Passalidae): Soin coopératif du couvain” . Entomologiste de Floride . 68 (2): 266–272. doi : 10.2307/3494359 . JSTOR 3494359 .
- ^ Lobanov, AL (2002). “nourrir” . Biologie et écologie des coléoptères . Coléoptères (Coléoptères) et Coléoptérologue . Récupéré le 13 mars 2011 .
- ^ McCoy, Peter (2016). Mycologie radicale : un traité sur l’observation et le travail avec les champignons . Chthaeus Press. p. 187. ISBN 9780986399602.
- ^ Islam, M.; Hossain, A.; Mostafa, MG; Hossain, MM (2016). “Insectes d’importance médico-légale associés à la décomposition de la charogne de souris au Bangladesh” . Journal de l’Université Jahangirnagar des sciences biologiques . 5 (1) : 11–20. doi : 10.3329/jujbs.v5i1.29739 .
- ^ Grebennikov, Vasily V.; Leschen, Richard AB (2010). “Les cavités exosquelettiques externes chez les coléoptères et leurs possibles fonctions mycangiales”. Sciences entomologiques . 13 (1): 81–98. doi : 10.1111/j.1479-8298.2009.00351.x . S2CID 84593757 .
- ^ un bc Evans & Bellamy (2000) , pp. 27-28
- ^ Cott, HB (1940). Coloration adaptative chez les animaux . Methuen. p. 414 .
- ^ un bc Evans & Bellamy (2000) , p. 126
- ^ un b Evans & Bellamy (2000)
- ^ McHugh (2009) , p. 199
- ^ Peck, Stewart B. (2006). “Distribution et biologie du coléoptère ectoparasite du castor Platypsyllus castoris Ritsema en Amérique du Nord (Coleoptera : Leiodidae : Platypsyllinae)” . Insecta Mundi . 20 (1–2) : 85–94.
- ^ Neumann, P. & Elzen, PJ (2004). “La biologie du petit coléoptère des ruches ( Aethina tumida , Coléoptères : Nitidulidae) : Lacunes dans nos connaissances sur une espèce envahissante” . Apidologie . 35 (3): 229-247. doi : 10.1051/apido:2004010 .
- ^ Meyer, John R. (8 mars 2005). “Coléoptères” . Université d’État de Caroline du Nord . Archivé de l’original le 24 mai 2000 . Récupéré le 13 mars 2011 .
- ^ Weber, Donald C.; Saska, Pavel; En ligneChaboo, Caroline S. (2008). “Coléoptères Carabides (Coleoptera: Carabidae) comme Parasitoïdes”. Encyclopédie d’entomologie . Springer Pays-Bas. pages 719–721. doi : 10.1007/978-1-4020-6359-6_492 . ISBN 978-1-4020-6242-1.
- ^ Livingston, Stéphanie (novembre 2019). “Ce coléoptère à enveloppe d’ambre a peut-être été l’un des premiers insectes à polliniser les fleurs” . Sciences . doi : 10.1126/science.aba1758 . S2CID 213876270 . Consulté le 10 janvier 2021 .
- ^ Gullan, PJ; Cranston, PS (2014). Les insectes: un aperçu de l’entomologie (5 éd.). Wiley, John & Sons. p. 314.ISBN _ 978-1-4443-3036-6.
- ^ Jones, GD et Jones, SD (2001). “Les usages du pollen et son implication pour l’entomologie” . Entomologie néotropicale . 30 (3): 314–349. doi : 10.1590/S1519-566X2001000300001 .
- ^ Ollerton, J.; Johnson, SD ; Cranmer, L. & Kellie, S. (2003). “L’écologie de la pollinisation d’un assemblage d’asclépiades des prairies en Afrique du Sud” . Annales de Botanique . 92 (6): 807–834. doi : 10.1093/aob/mcg206 . PMC 4243623 . PMID 14612378 .
- ^ un b Malloch, D.; En ligneBlackwell, M. (1993). “Biologie de dispersion des champignons ophiostomatoïdes”. À Wingfield, MJ ; KA Seifert; JF Webber (dir.). Ceratocystis et Ophiostoma : taxonomie, écologie et pathologie . Saint-Paul : APS. p. 195–206. ISBN 978-0-89054-156-2.
- ^ Scott, JJ; Oh, CC ; Yuceer, MC; Klepzig, KD; Clardy, J.; Currie, CR (2008). “Protection bactérienne du mutualisme coléoptère-champignon” . Sciences . 322 (5898): 63. Bibcode : 2008Sci…322…63S . doi : 10.1126/science.1160423 . PMC 2761720 . PMID 18832638 .
- ^ Francke-Grossmann, H. (1967). “Ectosymbiose chez les insectes habitant le bois”. Dans M. Henry (éd.). Symbiose . Vol. 2. New York : presse académique . p. 141–205.
- ^ Hodek, Ivo (2012). “Article de revue : diapause adulte chez les coléoptères” . Psyché : Un Journal d’Entomologie . 2012 : 1–10. doi : 10.1155/2012/249081 .
- ^ Kaufmann, T. (1971). “Hibernation chez le coléoptère arctique, Pterostichus brevicornis , en Alaska”. Journal de la Société d’entomologie du Kansas . 44 (1): 81–92.
- ^ Gullan, PJ; Cranston, PS (1994). Les insectes : un aperçu de l’entomologie . Chapman et Hall. p. 103–104. ISBN 978-0-412-49360-7.
- ^ Lombadero, Maria J.; Ayres, Matthew P.; Ayres, Bruce D.; En ligneReeve, John D. (2000). “La tolérance au froid de quatre espèces de scolytes (Coleoptera: Scolytidae) en Amérique du Nord” (PDF) . Écologie de l’environnement . 29 (3): 421–432.
- ^ Sformo, T.; Walters, K.; Jeannet, K.; Wowk, B.; Fahy, directeur général ; Barnes, BM; Duman, JG (2010). “Surfusion profonde, vitrification et survie limitée à -100 ° C chez les larves du coléoptère d’Alaska Cucujus clavipes puniceus (Coleoptera: Cucujidae)” . Tourillon de biologie expérimentale . 213 (3): 502–509. doi : 10.1242/jeb.035758 . PMID 20086136 .
- ^ Brooks, Christopher (26 mars 2013). « La vie des extrêmophiles : Survivre dans des habitats hostiles » . BBC Nature . Consulté le 16 mars 2017 .
- ^ Graham, LA; Liou, YC; Walker, VK ; Davies, PL (août 1997). “Protéine antigel hyperactive des coléoptères”. Nature . 388 (6644): 727–728. Bibcode : 1997Natur.388..727G . doi : 10.1038/41908 . PMID 9285581 . S2CID 205029622 . Le coléoptère jaune du ver de farine contient une famille de petites protéines d’hystérésis thermique riches en Cys et riches en Thr qui abaissent le point de congélation de l’hémolymphe en dessous du point de fusion jusqu’à 5,58 °C (ΔT = hystérésis thermique). L’expression de la protéine d’hystérésis thermique a été évaluée tout au long du développement et après exposition à des conditions environnementales modifiées. Tenebrio molitor
- ^ Walters, KR Jr; Serianni, AS ; Sformo, T.; Barnes, BM; Duman, JG (2009). “Un antigel au xylomannane produisant une hystérésis thermique non protéique dans le coléoptère d’Alaska Upis ceramboides résistant au gel” . PNAS . 106 (48): 20210–20215. Bibcode : 2009PNAS..10620210W . doi : 10.1073/pnas.0909872106 . PMC 2787118 . PMID 19934038 .
- ^ Walters, Jr., KR; Pan, Q. ; Serianni, AS ; Duman, JG (2009). “La biosynthèse cryoprotectrice et l’accumulation sélective de thréitol chez le coléoptère d’Alaska résistant au gel, Upis ceramboides ” . Journal de chimie biologique . 284 (25): 16822–16831. doi : 10.1074/jbc.M109.013870 . PMC 2719318 . PMID 19403530 . {{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Edney, EB (1971). “La température corporelle des coléoptères ténébrionidés dans le désert du Namib en Afrique australe” (PDF) . Tourillon de biologie expérimentale . 55 : 253–272. doi : 10.1242/jeb.55.1.253 .
- ^ Knisley, CB; Schultz, TD ; Hasewinkel, TH (1990). “Activité saisonnière et comportement thermorégulateur de Cicindela patruela (Coleoptera: Cicindelidae)”. Annales de la Société d’entomologie d’Amérique . 83 (5): 911–915. doi : 10.1093/aesa/83.5.911 .
- ^ Parker, Andrew R.; Lawrence, Chris R. (1er novembre 2001). “Capture d’eau par un scarabée du désert”. Nature . 414 (6859): 33–34. Bibcode : 2001Natur.414…33P . doi : 10.1038/35102108 . PMID 11689930 . S2CID 34785113 .
- ^ Hoback, W. Wyatt; Stanley, David W.; Higley, Leon G.; Barnhart, M. Christopher (1998). « Survie à l’immersion et à l’anoxie des larves de cicindèles, Cicindela togata ». Le naturaliste américain des Midlands . 140 (1): 27–33. doi : 10.1674/0003-0031(1998)140[0027:SOIAAB]2.0.CO;2 .
- ^ Conradi-Larsen, Else-Margrete; Somme, Lauritz (1973). “Anaérobiose chez le coléoptère hivernant Pelophila borealis “. Nature . 245 (5425): 388–390. Bibcode : 1973Natur.245..388C . doi : 10.1038/245388a0 . S2CID 4288059 .
- ^ Allison, R. (17 mars 2015). “La moitié du Royaume-Uni voit le début de la migration des coléoptères polliniques” . Consulté le 16 mars 2017 .
- ^ Southwood, TRE (1962). “Migration des arthropodes terrestres en relation avec l’habitat”. Revues biologiques . 37 (2): 171–211. doi : 10.1111/j.1469-185X.1962.tb01609.x . S2CID 84711127 .
- ^ Dingle, H. (2014). Migration : la biologie de la vie en mouvement . Presse universitaire d’Oxford.
- ^ un b Zabludoff, Marc (2008). Coléoptères . Malaisie : Michelle Bison. p. 14–17. ISBN 978-0-7614-2532-8.
- ^ Cambefort, Yves (2011). “Les coléoptères comme symboles religieux” . Insectes.org. Archivé de l’original le 18 octobre 2016 . Consulté le 10 février 2017 .
- ^ Dollinger, André (janvier 2002). “Bestiaire égyptien antique : Insectes” . Archivé de l’original le 1er avril 2015 . Consulté le 19 juillet 2011 .
- ^ Morales-Correa, Ben (2006). “Symboles égyptiens” . Tout sur l’Egypte. Archivé de l’original le 20 août 2011 . Consulté le 19 juillet 2011 .
- ^ Ussishkin, David (2004). Les nouvelles fouilles archéologiques à Lakish (1973–1994) . Tel-Aviv : Institut d’archéologie de l’Université de Tel-Aviv . Archivé de l’original le 3 juillet 2018 . Consulté le 28 décembre 2015 .
- ↑ « Isis et Osiris » , Moralia , dans le volume V de la Loeb Classical Library , 1936. « La race des coléoptères n’a pas de femelle, mais tous les mâles éjectent leur sperme dans une pastille ronde de matière qu’ils enroulent en la poussant de le côté opposé, tout comme le soleil semble tourner les cieux dans la direction opposée à sa propre course, qui est d’ouest en est.
- ^ Betz, H. D., ed. (1992). The Greek Magical Papyri in Translation (Including the Demotic Spells) (2nd ed.). University of Chicago Press. pp. IV.52–85, VII.520, XII.101, XIII.1065–1070, XXXVI.170.
- ^ Pliny the Elder. “Natural History Book 11″. Perseus.tufts.edu. Retrieved January 25, 2017.
- ^ Pliny the Elder. “Natural History Book 11, Chapter 34″. Perseus.tufts.edu. Retrieved January 25, 2017.
- ^ un b Beavis, IC (1988). Insectes et autres invertébrés dans l’Antiquité classique . Université d’Exter . p. 153–154.
- ^ Antonin Libéralis . Métamorphoses. Trans. Celoria, F. 1992. Les Métamorphoses d’Antoninus Liberalis : Une traduction avec un commentaire . Londres et New York, Routledge.
- ^ Sprecher-Uebersax, E. (2008). “Le Stag Beetle Lucanus Cervus (Coleoptera, Lucanidae) dans l’Art et la Mythologie”. Revue d’Ecologie . 63 : 145–151.
- ^ a b Mississippi State University. “History of the Boll Weevil in the United States”. Economic impacts of the boll weevil. Archived from the original on May 12, 2008.
- ^ Allen, E. A.; Humble, L. M. (2002). “Nonindigenous species introductions: A threat to Canada’s forests and forest economy”. Canadian Journal of Plant Pathology. 24 (2): 103–110. doi:10.1080/07060660309506983. S2CID 85073955.
- ^ Webber, Joan F. (2000). “Le comportement des vecteurs d’insectes et l’évolution de la maladie hollandaise de l’orme”. Les ormes . p. 47. doi : 10.1007/978-1-4615-4507-1_3 . ISBN 978-1-4613-7032-1.
- ^ Alyokhin, A.; Baker, M.; Mota-Sanchez, D.; Dively, G.; Grafius, E. (2008). “Résistance du doryphore de la pomme de terre aux insecticides”. Journal américain de recherche sur la pomme de terre . 85 (6): 395–413. doi : 10.1007/s12230-008-9052-0 . S2CID 41206911 .
- ^ Lockwood, Jeffrey A. (October 21, 2007). “Bug bomb:Why our next terrorist attack could come on six legs”. Boston Globe. Retrieved February 13, 2017.
- ^ Heather, Neil W.; Hallman, Guy J. (2008). Pest Management and Phytosanitary Trade Barriers. CABI. pp. 17–18. doi:10.1079/9781845933432.0000. ISBN 978-1-84593-343-2.
- ^ Adcock, Edward (2005). “Pests – Death watch beetle”. Conservation and collective care. University of Oxford. Archived from the original on July 10, 2011. Retrieved July 17, 2011.
- ^ Takano, Shun-Ichiro; Takasu, Keiji; Fushimi, Tsutomu; Ichiki, Ryoko T.; Nakamura, Satoshi (2014). “Suitability of four palm species for the development of the invasive pest Brontispa longissima(Coleoptera: Chrysomelidae) in the field”. Entomological Science. 17 (2): 265–268. doi:10.1111/ens.12048. S2CID 85910791.
- ^ “The Mountain Pine Beetle in British Columbia”. Natural Resources Canada. August 19, 2008. Archived from the original on April 19, 2010. Retrieved June 24, 2010.
- ^ “Insecta: Coleoptera: Coccinellidae”. Institute of Food and Agricultural Services, University of Florida. 2014. Retrieved February 12, 2017.
- ^ “‘Deadly ladybird’ sighted in UK”. BBC News. October 5, 2004. Retrieved June 17, 2010.
- ^ Kromp, B. (1999). “Carabid beetles in sustainable agriculture: a review on pest control efficacy, cultivation aspects and enhancement”. Agriculture, Ecosystems and Environment. 74 (1–3): 187–228. doi:10.1016/S0167-8809(99)00037-7.
- ^ “Beetles play an important role in reducing weeds”. Rothamsted Research. Retrieved March 14, 2017.
- ^ “Zygogramma bicolorata (Mexican beetle)”. Invasive Species Compendium. 2012. Retrieved February 12, 2017.
- ^ Kovalev, O. V.; Reznik, S. Y.; Cherkashin, V. N. (1983). “Specific features of the methods of using Zygogramma Chevr. (Coleoptera, Chrysomelidae) in biological control of ragweeds (Ambrosia artemisiifolia L., A. psilostachya D.C.)”. Entomologicheskoe Obozrenije (in Russian). 62: 402–408.
- ^ a b Bornemissza, George (1970). “Insectary Studies on the Control of Dung Breeding Flies by the Activity of the Dung Beetle, Onthophagus Gazella F. (Coleoptera: Scarabaeinae)”. Australian Journal of Entomology. 9: 31–41. doi:10.1111/j.1440-6055.1970.tb00767.x.
- ^ Brown, Jacqueline; Scholtz, Clarke H.; Janeau, Jean-Louis; Grellier, Seraphine & Podwojewski, Pascal (2010). “Dung beetles (Coleoptera: Scarabaeidae) can improve soil hydrological properties”. Applied Soil Ecology. 46 (1): 9–16. doi:10.1016/j.apsoil.2010.05.010. hdl:2263/14419.
- ^ Losey, John E.; Vaughan, Mace (2006). “The economic value of ecological services provided by insects” (PDF). BioScience. 56 (4): 311–323. doi:10.1641/0006-3568(2006)56[311:TEVOES]2.0.CO;2. Archived from the original (PDF) on June 19, 2018. Retrieved July 17, 2011.
- ^ Tomberlin, Jeffery K.; Sanford, Michelle R. (2012). “Forensic entomology and wildlife”. In Huffman, Jane E.; Wallace, John R. (eds.). Wildlife Forensics: Methods and Applications. Developments in Forensic Science. Vol. 6 (2nd ed.). John Wiley & Sons. pp. 81–107. ISBN 978-1-119-95429-3.
- ^ Dermestid Beetles working on a female Black Bear skull. 2014. Archived from the original on November 16, 2021. Retrieved January 26, 2017.
- ^ Fernández-Jalvo, Yolanda; Monfort, Maria Dolores Marín (2008). “Experimental taphonomy in museums: Preparation protocols for skeletons and fossil vertebrates under the scanning electron microscopy”. Geobios. 41: 157–181. doi:10.1016/j.geobios.2006.06.006.
- ^ Ramos-Elorduy, Julieta; Menzel, Peter (1998). Creepy crawly cuisine: the gourmet guide to edible insects. Inner Traditions / Bear & Company. p. 5. ISBN 978-0-89281-747-4.
- ^ Holland, Jennifer S. (May 14, 2013). “U.N. Urges Eating Insects; 8 Popular Bugs to Try”. National Geographic. Retrieved January 26, 2017.
- ^ Meyer-Rochow, V. B. (January 2017). “Therapeutic arthropods and other, largely terrestrial, folk-medicinally important invertebrates: a comparative survey and review”. Journal of Ethnobiology and Ethnomedicine. 13 (9): 9. doi:10.1186/s13002-017-0136-0. PMC 5296966. PMID 28173820.
- ^ Pearson, David L.; Cassola, Fabio (1992). “World-Wide Species Richness Patterns of Tiger Beetles (Coleoptera: Cicindelidae): Indicator Taxon for Biodiversity and Conservation Studies”. Conservation Biology. 6 (3): 376–391. doi:10.1046/j.1523-1739.1992.06030376.x. JSTOR 2386038.
- ^ McGeoch, Melodie A.; Van Rensburg, Berndt J.; Botes, Antoinette (2002). “The verification and application of bioindicators: A case study of dung beetles in a savanna ecosystem”. Journal of Applied Ecology. 39 (4): 661–672. doi:10.1046/j.1365-2664.2002.00743.x.
- ^ Lachat, Thibault; Wermelinger, Beat; Gossner, Martin M.; Bussler, Heinz; Isacsson, Gunnar; Müller, Jörg (2012). “Saproxylic beetles as indicator species for dead-wood amount and temperature in European beech forests”. Ecological Indicators. 23: 323–331. doi:10.1016/j.ecolind.2012.04.013.
- ^ Bohac, Jaroslav (1999). “Staphylinid beetles as bioindicators” (PDF). Agriculture, Ecosystems & Environment. 74 (1–3): 357–372. CiteSeerX 10.1.1.496.4273. doi:10.1016/S0167-8809(99)00043-2.
- ^ Life cycle of the rounded jewel beetles, Sternocera spp. วงจรชีวิตของแมลงทับกลมใช้เวลานานถึง 2 ปี – Siam Insect Zoo-Museum. Malaeng.com (2008-10-20). Retrieved on 2013-04-04.
- ^ Ivie, Michael A. (2002). “105. Zopheridae”. In Ross H. Arnett; Michael Charles Thomas (eds.). American Beetles: Polyphaga: Scarabaeoidea through Curculionoidea. Volume 2 of American Beetles. CRC Press. pp. 457–462. ISBN 978-0-8493-0954-0.
- ^ Rennesson, Stephane; Cesard, Nicolas; Grimaud, Emmanuel (2008). “Duels en miniature: la délicate mise en scène des combats de scarabées au nord de la Thaïlande” (PDF). Insectes (in French). 3 (151).
- ^ a b Eraldo Medeiros Costa-Neto (2003). “Entertainment with insects: singing and fighting insects around the world. A brief review” (PDF). Etnobiología. 3: 21–29. Retrieved January 30, 2021.
- ^ Pemberton, R. W. (1990). “The Korean water beetle game”. Pan-Pacific Entomologist. 66 (2): 172–174.
- ^ Bateman, C.; Hulcr, J. (2016). “Predaceous Diving Beetles as Pets and the Self-Cleaning Aquarium” (PDF). University of Florida (IFAS Extension). Retrieved January 27, 2017.
- ^ Kawahara, A. Y. (2007). “Thirty-foot telescopic nets, bug-collecting video games, and beetle pets: Entomology in modern Japan” (PDF). American Entomologist. 53 (3): 160–172. doi:10.1093/ae/53.3.160. Archived from the original (PDF) on April 12, 2016. Retrieved January 27, 2017.
- ^ May, Mitchell (July 11, 1999). “Yen For Bugs”. Chicago Tribune. Retrieved January 27, 2017.
- ^ Watts, Jonathan (August 11, 1999). “Vending machine beetles”. The Guardian. Retrieved January 27, 2017.
- ^ Morse, Deborah Denenholz; Danahay, Martin A. (2007). Victorian Animal Dreams: Representations of Animals in Victorian Literature and Culture. Ashgate Publishing. p. 5. ISBN 978-0-7546-5511-4. the Victorian mania for beetle collecting
- ^ Wallace, Alfred Russel (1869). The Malay Archipelago: The land of the orang–utan, and the bird of paradise. A narrative of travel, with sketches of man and nature (1 ed.). Macmillan. pp. vii–xiv.
- ^ Swedish Biomimetics: The μMist Platform Technology (original URL = http://www.swedishbiomimetics.com/biomimetics_folder.pdf) (archive date = December 13, 2013)
- ^ “Namib Desert beetle inspires self-filling water bottle”. BBC News. November 23, 2012.
- ^ Singer, Emily (January 29, 2009). “The Army’s Remote-Controlled Beetle”. MIT Technology Review. Retrieved March 16, 2017.
- ^ Cao, Feng; Zhang, Chao; Hao Yu Choo; Sato, Hirotaka (2016). “Insect–computer hybrid legged robot with user-adjustable speed, step length and walking gait”. Journal of the Royal Society Interface. 13 (116): 20160060. doi:10.1098/rsif.2016.0060. PMC 4843679. PMID 27030043.
- ^ Sato, Hirotaka; Doan, Tat Thang Vo; Kolev, Svetoslav; Huynh, Ngoc Anh; Zhang, Chao; Massey, Travis L.; Kleef, Joshua van; Ikeda, Kazuo; Abbeel, Pieter (March 16, 2015). “Deciphering the Role of a Coleopteran Steering Muscle via Free Flight Stimulation”. Current Biology. 25 (6): 798–803. doi:10.1016/j.cub.2015.01.051. PMID 25784033.
- ^ Vo Doan, Tat Thang; Tan, Melvin Y.W.; Bui, Xuan Hien; Sato, Hirotaka (November 3, 2017). “An Ultralightweight and Living Legged Robot”. Soft Robotics. 5 (1): 17–23. doi:10.1089/soro.2017.0038. PMID 29412086.
- ^ Vikram Iyer1; Ali Najafi; Johannes James; Sawyer Fuller; Shyamnath Gollakota (July 2020). “Wireless steerable vision for live insects and insect-scale robots”. Science Robotics. 5 (44): eabb0839. doi:10.1126/scirobotics.abb0839. PMID 33022605. S2CID 220688078.
- ^ Rob Picheta (July 15, 2020). “Scientists strapped a tiny camera to a beetle to test just how small video technology can get”. CNN.
- ^ Kotze, D. Johan; O’Hara, Robert B. (2003). “Species decline—but why? Explanations of carabid beetle (Coleoptera, Carabidae) declines in Europe”. Oecologia. 135 (1): 138–148. Bibcode:2003Oecol.135..138K. doi:10.1007/s00442-002-1174-3. PMID 12647113. S2CID 11692514.
- ^ Hanski, Ilkka; Koivulehto, Helena; Cameron, Alison; Rahagalala, Pierre (2007). “Deforestation and apparent extinctions of endemic forest beetles in Madagascar”. Biology Letters. 3 (3): 344–347. doi:10.1098/rsbl.2007.0043. PMC 1995085. PMID 17341451.
- ^ Campanaro, A.; Zapponi, L.; Hardersen, S.; Méndez, M.; Al Fulaij, N.; Audisio, P.; Bardiani, M.; Carpaneto, G. M.; Corezzola, S.; Della Rocca, F.; Harvey, D.; Hawes, C.; Kadej, M.; Karg, J.; Rink, M.; Smolis, A.; Sprecher, E.; Thomaes, A.; Toni, I.; Vrezec, A.; Zauli, A.; Zilioli, M.; Chiari, S. (2016). “A European monitoring protocol for the stag beetle, a Saproxylic flagship species”. Insect Conservation and Diversity. 9 (6): 574–584. doi:10.1111/icad.12194. S2CID 88754595.
- ^ New, T. R. (2009). Beetles in Conservation. John Wiley & Sons. pp. ix, 1–26, passim. ISBN 978-1-4443-1863-0.
Bibliography
- Evans, Arthur V.; Bellamy, Charles (2000). An Inordinate Fondness for Beetles. University of California Press. ISBN 978-0-520-22323-3.
- McHugh, Joseph V.; Liebherr, James K. (2009). “Coleoptera”. In Vincent H. Resh; Ring T. Cardé (eds.). Encyclopedia of Insects (2nd ed.). Academic Press. pp. 183–201. ISBN 978-0-12-374144-8.
Further reading
- Beckmann, Poul (2001). Living Jewels: The Natural Design of Beetles. ISBN 978-3-7913-2528-6.
- Cooter, J.; M. V. L. Barclay, eds. (2006). A Coleopterist’s Handbook. Amateur Entomological Society. ISBN 978-0-900054-70-9.
- Beetle Larvae of the World. Entomological Society of America. December 1994. ISBN 978-0-643-05506-3.
- Grimaldi, David; Michael S. Engel (May 16, 2005). Evolution of the Insects. ISBN 978-0-521-82149-0.
- Harde, K. W. (1984). A Field Guide in Color to Beetles. pp. 7–24. ISBN 978-0-7064-1937-5.
- White, R. E. (1983). Beetles. Houghton Mifflin. ISBN 978-0-395-91089-4.
External links
| Wikispecies has information related to Coleoptera. |
| The Wikibook Dichotomous Key has a page on the topic of: Coleoptera |
- Coléoptères du projet Web Tree of Life
- (en allemand) Käfer der Welt
- Atlas des Coléoptères
- Coléoptères – Coléoptères