Cellule souche embryonnaire
Les cellules souches embryonnaires ( cellules ES ou ESC ) sont des cellules souches pluripotentes dérivées de la masse cellulaire interne d’ un blastocyste , un embryon préimplantatoire à un stade précoce . [1] [2] Les embryons humains atteignent le stade de blastocyste 4 à 5 jours après la fécondation , moment auquel ils sont constitués de 50 à 150 cellules. L’isolement de l’ embryoblaste , ou masse cellulaire interne (ICM), entraîne la destruction du blastocyste, un processus qui soulève des questions éthiques , y compris la question de savoir si les embryons au stade de préimplantation ont ou non les mêmes considérations morales que les embryons au stade de développement postimplantation. [3] [4]

 Pluripotentes : Les cellules souches embryonnaires sont capables de se développer en n’importe quel type de cellule, à l’exception de celles du placenta. Seules les cellules souches embryonnaires de la morula sont totipotentes : capables de se développer en n’importe quel type de cellule, y compris celles du placenta.
Pluripotentes : Les cellules souches embryonnaires sont capables de se développer en n’importe quel type de cellule, à l’exception de celles du placenta. Seules les cellules souches embryonnaires de la morula sont totipotentes : capables de se développer en n’importe quel type de cellule, y compris celles du placenta.
Les chercheurs se concentrent actuellement fortement sur le potentiel thérapeutique des cellules souches embryonnaires, l’utilisation clinique étant l’objectif de nombreux laboratoires. [5] Les utilisations potentielles incluent le traitement du diabète et des maladies cardiaques . [5] Les cellules sont étudiées pour être utilisées comme thérapies cliniques, modèles de troubles génétiques et réparation cellulaire/ADN. Cependant, des effets indésirables dans la recherche et les processus cliniques tels que des tumeurs et des réponses immunitaires indésirables ont également été signalés. [6]
Propriétés

 Cellule IPS
Cellule IPS 
 Le transcriptome des cellules souches embryonnaires
Le transcriptome des cellules souches embryonnaires
Les cellules souches embryonnaires (CSE), dérivées du stade blastocyste des premiers embryons de mammifères, se distinguent par leur capacité à se différencier en n’importe quel type de cellule embryonnaire et par leur capacité à s’auto-renouveler. Ce sont ces traits qui les rendent précieux dans les domaines scientifique et médical. Les CSE ont un caryotype normal , maintiennent une activité télomérase élevée et présentent un remarquable potentiel prolifératif à long terme. [7]
Pluripotent
Les cellules souches embryonnaires de la masse cellulaire interne sont pluripotentes , ce qui signifie qu’elles sont capables de se différencier pour générer un ectoderme primitif, qui se différencie finalement lors de la gastrulation en tous les dérivés des trois couches germinales primaires : ectoderme , endoderme et mésoderme . Ces couches germinales génèrent chacun des plus de 220 types de cellules du corps humain adulte. Lorsqu’ils reçoivent les signaux appropriés, les ESC forment initialement des cellules précurseurs qui se différencient ensuite en les types de cellules souhaités. La pluripotence distingue les cellules souches embryonnaires des cellules souches adultes , qui sontmultipotente et ne peut produire qu’un nombre limité de types cellulaires.
Auto-renouvellement et réparation de la structure
Dans des conditions définies, les cellules souches embryonnaires sont capables de s’auto-renouveler indéfiniment dans un état indifférencié. Les conditions d’auto-renouvellement doivent empêcher les cellules de s’agglutiner et maintenir un environnement qui prend en charge un état non spécialisé. [8] Cela se fait généralement en laboratoire avec des milieux contenant du sérum et un facteur inhibiteur de la leucémie ou des suppléments de milieu sans sérum avec deux médicaments inhibiteurs (“2i”), l’ inhibiteur de MEK PD03259010 et l’inhibiteur de GSK-3 CHIR99021. [9]
Croissance
Les CSE se divisent très fréquemment en raison d’une phase G1 raccourcie dans leur cycle cellulaire . La division cellulaire rapide permet aux cellules de croître rapidement en nombre, mais pas en taille, ce qui est important pour le développement précoce de l’embryon. Dans les ESC, les protéines cycline A et cycline E impliquées dans la transition G1/S sont toujours exprimées à des niveaux élevés. [10] Les kinases cycline-dépendantes telles que CDK2 qui favorisent la progression du cycle cellulaire sont hyperactives, en partie à cause de la régulation à la baisse de leurs inhibiteurs. [11] Protéines de rétinoblastome qui inhibent le facteur de transcription E2F jusqu’à ce que la cellule soit prête à entrerLa phase S est hyperphosphorylée et inactivée dans les CSE, conduisant à l’expression continue des gènes de prolifération. [10] Ces changements entraînent des cycles accélérés de division cellulaire. Bien que des niveaux d’expression élevés de protéines pro-prolifératives et une phase G1 raccourcie aient été liés au maintien de la pluripotence, [12] [13] les CSE cultivées dans des conditions 2i sans sérum expriment des protéines de rétinoblastome actives hypophosphorylées et ont une phase G1 allongée . [14] Malgré cette différence dans le cycle cellulaire par rapport aux ESC cultivées dans des milieux contenant du sérum, ces cellules ont des caractéristiques pluripotentes similaires. [15] Facteurs de pluripotence Oct4 et Nanogjouent un rôle dans la régulation transcriptionnelle du cycle cellulaire ESC. [16] [17]
Les usages
En raison de leur plasticité et de leur capacité potentiellement illimitée d’auto-renouvellement, les thérapies à base de cellules souches embryonnaires ont été proposées pour la médecine régénérative et le remplacement des tissus après une blessure ou une maladie. [ 18 ] _ _ _ _ _ _ _ _ _ _ _En plus de leur potentiel en médecine régénérative, les cellules souches embryonnaires fournissent une source alternative possible de tissus/organes qui sert de solution possible au dilemme de la pénurie de donneurs. Il existe cependant des controverses éthiques à ce sujet (voir la section Débat éthique ci-dessous). Outre ces utilisations, les ESC peuvent également être utilisées pour la recherche sur le développement humain précoce, certaines maladies génétiques et les tests de toxicologie in vitro . [7]
Utilisations
Selon un article paru en 2002 dans PNAS , “les cellules souches embryonnaires humaines ont le potentiel de se différencier en divers types de cellules et, par conséquent, peuvent être utiles comme source de cellules pour la transplantation ou l’ingénierie tissulaire”. [19]
Création de tissus
En génie tissulaire , l’utilisation de cellules souches a été découverte récemment et est connue pour son importance. Afin de réussir l’ingénierie d’un tissu, les cellules utilisées doivent être capables de remplir une fonction biologique spécifique telle que la sécrétion de cytokines, des molécules de signalisation, l’interaction avec les cellules voisines et la production d’une matrice extracellulaire dans la bonne organisation. Les cellules souches démontrent ces fonctions biologiques spécifiques tout en étant capables de s’auto-renouveler et de se différencier en un ou plusieurs types de cellules spécialisées. Les cellules souches embryonnaires sont l’une des sources actuelles envisagées pour l’utilisation de l’ingénierie tissulaire. [20]L’utilisation de cellules souches embryonnaires humaines a ouvert de nombreuses nouvelles possibilités pour l’ingénierie tissulaire, cependant, de nombreux obstacles doivent être franchis avant même que les cellules souches embryonnaires humaines puissent être utilisées. Il est théorisé que si les cellules souches embryonnaires peuvent être modifiées pour ne pas évoquer la réponse immunitaire lorsqu’elles sont implantées chez le patient, cela constituerait une étape révolutionnaire dans l’ingénierie tissulaire. [21]

 Corps embryoïdes 24 heures après formation.
Corps embryoïdes 24 heures après formation.
Cependant, les cellules souches embryonnaires ne se limitent pas à l’ingénierie cellulaire/tissulaire.
Thérapies de remplacement cellulaire
La recherche actuelle se concentre sur la différenciation des ESC en une variété de types de cellules pour une utilisation éventuelle en tant que thérapies de remplacement cellulaire (CRT). Certains des types de cellules qui ont été ou sont en cours de développement comprennent les Cardiomyocytes (CM), les Neurones , les Hépatocytes , les cellules de la moelle osseuse , les cellules des îlots et les cellules endothéliales . [22] Cependant, la dérivation de ces types de cellules à partir des ESC n’est pas sans obstacles, c’est pourquoi la recherche actuelle se concentre sur le dépassement de ces barrières. Par exemple, des études sont en cours pour différencier les ESC en CM spécifiques aux tissus et pour éradiquer leurs propriétés immatures qui les distinguent des CM adultes. [23]
Potentiel clinique
- Les chercheurs ont différencié les ESC en cellules productrices de dopamine dans l’espoir que ces Neurones pourraient être utilisés dans le traitement de la maladie de Parkinson. [24] [25]
- Les ESC ont été différenciées en cellules tueuses naturelles (NK) et en tissu osseux. [26]
- Des études impliquant des ESC sont en cours pour fournir un traitement alternatif pour le diabète. Par exemple, D’Amour et al. ont pu différencier les ESC en cellules productrices d’insuline [27] et les chercheurs de l’Université de Harvard ont pu produire de grandes quantités de cellules bêta pancréatiques à partir des ES. [28]
- Un article publié dans le European Heart Journal décrit un processus translationnel de génération de cellules progénitrices cardiaques dérivées de cellules souches embryonnaires humaines à utiliser dans des essais cliniques sur des patients souffrant d’insuffisance cardiaque sévère. [29]
Découverte de médicament
En plus de devenir une alternative importante aux greffes d’organes, les ESC sont également utilisées dans le domaine de la toxicologie et comme écrans cellulaires pour découvrir de nouvelles entités chimiques (NCE) qui peuvent être développées en tant que médicaments à petites molécules. Des études ont montré que les Cardiomyocytes dérivés des ESC sont des modèles in vitro validés pour tester les réponses aux médicaments et prédire les profils de toxicité. [22] Il a été démontré que les Cardiomyocytes dérivés de l’ES répondent aux stimuli pharmacologiques et peuvent donc être utilisés pour évaluer la cardiotoxicité comme les Torsades de Pointes . [30]
Les Hépatocytes dérivés d’ESC sont également des modèles utiles qui pourraient être utilisés dans les étapes précliniques de la découverte de médicaments. Cependant, le développement d’Hépatocytes à partir d’ESC s’est avéré difficile, ce qui entrave la capacité de tester le métabolisme des médicaments. Par conséquent, la recherche actuelle se concentre sur l’établissement d’Hépatocytes dérivés d’ESC entièrement fonctionnels avec une activité enzymatique stable de phases I et II. [31]
Modèles de troubles génétiques
Plusieurs nouvelles études ont commencé à aborder le concept de modélisation des troubles génétiques avec des cellules souches embryonnaires. Soit en manipulant génétiquement les cellules, soit plus récemment en dérivant des lignées cellulaires malades identifiées par diagnostic génétique prénatal (DPI), la modélisation des troubles génétiques est quelque chose qui a été accompli avec les cellules souches. Cette approche peut très bien s’avérer utile pour étudier des troubles tels que le Syndrome de l’X fragile , la fibrose kystique et d’autres maladies génétiques qui n’ont pas de système modèle fiable.
Yury Verlinsky , un Chercheur médical russo-américain spécialisé dans la génétique embryonnaire et cellulaire ( cytologie génétique ), a développé des méthodes de test de diagnostic prénatal pour déterminer les troubles génétiques et chromosomiques un mois et demi plus tôt que l’ amniocentèse standard. Les techniques sont maintenant utilisées par de nombreuses femmes enceintes et futurs parents, en particulier les couples qui ont des antécédents d’anomalies génétiques ou dont la femme a plus de 35 ans (lorsque le risque de troubles génétiques est plus élevé). De plus, en permettant aux parents de sélectionner un embryon sans troubles génétiques, ils ont le potentiel de sauver la vie de frères et sœurs qui avaient déjà des troubles et des maladies similaires en utilisant des cellules de la progéniture exempte de maladie. [32]
Réparation des dommages à l’ADN
Les cellules somatiques différenciées et les cellules ES utilisent différentes stratégies pour faire face aux dommages à l’ADN. Par exemple, les fibroblastes de prépuce humain, un type de cellule somatique, utilisent la jonction d’extrémité non homologue (NHEJ) , un processus de réparation de l’ADN sujet aux erreurs, comme voie principale de réparation des cassures double brin (DSB) à toutes les étapes du cycle cellulaire. [33] En raison de sa nature sujette aux erreurs, NHEJ a tendance à produire des mutations dans les descendants clonaux d’une cellule.
Les cellules ES utilisent une stratégie différente pour traiter les DSB. [34] Étant donné que les cellules ES donnent naissance à tous les types de cellules d’un organisme, y compris les cellules de la lignée germinale, les mutations survenant dans les cellules ES dues à une réparation défectueuse de l’ADN constituent un problème plus grave que dans les cellules somatiques différenciées. Par conséquent, des mécanismes robustes sont nécessaires dans les cellules ES pour réparer avec précision les dommages à l’ADN et, si la réparation échoue, pour éliminer les cellules présentant des dommages à l’ADN non réparés. Ainsi, les cellules ES de souris utilisent principalement la réparation par recombinaison homologue (HRR) haute fidélité pour réparer les DSB. [34] Ce type de réparation dépend de l’interaction des deux chromosomes frères [ vérification nécessaire ]formés pendant la phase S et présents ensemble pendant la phase G2 du cycle cellulaire. HRR peut réparer avec précision les DSB dans un chromosome sœur en utilisant les informations intactes de l’autre chromosome sœur. Les cellules dans la phase G1 du cycle cellulaire (c’est-à-dire après la métaphase/division cellulaire mais avant le cycle de réplication suivant) n’ont qu’une seule copie de chaque chromosome (c’est-à-dire que les chromosomes sœurs ne sont pas présents). Les cellules ES de souris n’ont pas de point de contrôle G1 et ne subissent pas d’arrêt du cycle cellulaire lors de l’acquisition de dommages à l’ADN. [35] Ils subissent plutôt une mort cellulaire programmée (apoptose) en réponse à des dommages à l’ADN. [36] L’apoptose peut être utilisée comme stratégie à sécurité intégrée pour éliminer les cellules présentant des dommages à l’ADN non réparés afin d’éviter la mutation et la progression vers le cancer. [37]Conformément à cette stratégie, les cellules souches ES de souris ont une fréquence de mutation environ 100 fois inférieure à celle des cellules somatiques de souris isogéniques. [38]
Essai clinique
Le 23 janvier 2009, des essais cliniques de phase I pour la transplantation d’ oligodendrocytes (un type de cellule du cerveau et de la moelle épinière) dérivés de cellules ES humaines chez des personnes atteintes de lésions médullaires ont reçu l’approbation de la Food and Drug Administration (FDA) des États-Unis, marquant il s’agit du premier essai humain sur des cellules ES humaines au monde. [39] L’étude menant à cette avancée scientifique a été menée par Hans Keirstead et ses collègues de l’ Université de Californie, Irvine et soutenue par Geron Corporation de Menlo Park, CA , fondée par Michael D. West, doctorat. Une expérience précédente avait montré une amélioration de la récupération locomotrice chez des rats blessés à la moelle épinière après une transplantation retardée de 7 jours de cellules ES humaines qui avaient été poussées dans une lignée oligodendrocytaire. [40]L’étude clinique de phase I a été conçue pour recruter environ huit à dix paraplégiques qui ont subi leurs blessures moins de deux semaines avant le début de l’essai, car les cellules doivent être injectées avant que le tissu cicatriciel puisse se former. Les chercheurs ont souligné que les injections n’étaient pas censées guérir complètement les patients et restaurer toute mobilité. Sur la base des résultats des essais sur les rongeurs, les chercheurs ont émis l’hypothèse que la restauration des gaines de myéline et une augmentation de la mobilité pourraient se produire. Ce premier essai était principalement conçu pour tester la sécurité de ces procédures et si tout se passait bien, on espérait qu’il conduirait à de futures études impliquant des personnes souffrant de handicaps plus graves. [41]L’essai a été suspendu en août 2009 en raison des inquiétudes de la FDA concernant un petit nombre de kystes microscopiques trouvés dans plusieurs modèles de rats traités, mais la suspension a été levée le 30 juillet 2010. [42]
En octobre 2010, des chercheurs ont recruté et administré des EST au premier patient du Shepherd Center d’ Atlanta . [43] Les fabricants de la thérapie par cellules souches, Geron Corporation , ont estimé qu’il faudrait plusieurs mois pour que les cellules souches se répliquent et pour que la thérapie GRNOPC1 soit évaluée pour le succès ou l’échec.
En novembre 2011, Geron a annoncé qu’il arrêtait l’essai et abandonnait la recherche sur les cellules souches pour des raisons financières, mais continuerait à surveiller les patients existants et tentait de trouver un partenaire qui pourrait poursuivre ses recherches. [44] En 2013 , BioTime , dirigé par le PDG, le Dr Michael D. West , a acquis tous les actifs de cellules souches de Geron, avec l’intention déclarée de redémarrer l’essai clinique basé sur les cellules souches embryonnaires de Geron pour la recherche sur les lésions de la moelle épinière . [45]
La société BioTime Asterias Biotherapeutics (NYSE MKT: AST) a reçu un prix de partenariat stratégique de 14,3 millions de dollars du California Institute for Regenerative Medicine (CIRM) pour relancer le premier essai clinique humain basé sur des cellules souches embryonnaires au monde, pour les lésions de la moelle épinière. Soutenu par des fonds publics californiens, le CIRM est le plus grand bailleur de fonds de la recherche et du développement liés aux cellules souches au monde. [46]
Le prix fournit un financement à Asterias pour relancer le développement clinique de l’AST-OPC1 chez les sujets atteints de lésions de la moelle épinière et pour étendre les tests cliniques de doses croissantes dans la population cible destinée aux futurs essais pivots. [46]
AST-OPC1 est une population de cellules dérivées de cellules souches embryonnaires humaines (CSEh) contenant des cellules progénitrices d’oligodendrocytes (OPC). Les OPC et leurs dérivés matures appelés oligodendrocytes fournissent un soutien fonctionnel essentiel aux cellules nerveuses de la moelle épinière et du cerveau. Asterias a récemment présenté les résultats d’un essai clinique de phase 1 portant sur une faible dose d’AST-OPC1 chez des patients présentant une lésion neurologique complète de la moelle épinière thoracique. Les résultats ont montré que l’AST-OPC1 a été délivré avec succès au site lésé de la moelle épinière. Les patients suivis 2 à 3 ans après l’administration d’AST-OPC1 n’ont montré aucun signe d’effets indésirables graves associés aux cellules lors d’évaluations de suivi détaillées comprenant des examens neurologiques fréquents et des IRM. La surveillance immunitaire des sujets pendant un an après la transplantation n’a montré aucune preuve de réponses immunitaires cellulaires ou basées sur des anticorps à AST-OPC1. Chez quatre des cinq sujets, des IRM en série effectuées tout au long de la période de suivi de 2 à 3 ans indiquent qu’une cavitation réduite de la moelle épinière peut s’être produite et que l’AST-OPC1 peut avoir eu des effets positifs sur la réduction de la détérioration des tissus de la moelle épinière. Il n’y a eu aucune dégénérescence ou amélioration neurologique inattendue chez les cinq sujets de l’essai, tel qu’évalué par l’examen des normes internationales pour la classification neurologique des lésions de la moelle épinière (ISNCSCI). Des IRM en série effectuées tout au long de la période de suivi de 2 à 3 ans indiquent qu’une cavitation réduite de la moelle épinière peut s’être produite et que l’AST-OPC1 peut avoir eu des effets positifs sur la réduction de la détérioration des tissus de la moelle épinière. Il n’y a eu aucune dégénérescence ou amélioration neurologique inattendue chez les cinq sujets de l’essai, tel qu’évalué par l’examen des normes internationales pour la classification neurologique des lésions de la moelle épinière (ISNCSCI). Des IRM en série effectuées tout au long de la période de suivi de 2 à 3 ans indiquent qu’une cavitation réduite de la moelle épinière peut s’être produite et que l’AST-OPC1 peut avoir eu des effets positifs sur la réduction de la détérioration des tissus de la moelle épinière. Il n’y a eu aucune dégénérescence ou amélioration neurologique inattendue chez les cinq sujets de l’essai, tel qu’évalué par l’examen des normes internationales pour la classification neurologique des lésions de la moelle épinière (ISNCSCI).[46]
La subvention de partenariat stratégique III du CIRM fournira un financement à Asterias pour soutenir le prochain essai clinique d’AST-OPC1 chez des sujets souffrant de lésions de la moelle épinière, et pour les efforts de développement de produits d’Asterias pour affiner et mettre à l’échelle les méthodes de fabrication afin de soutenir les essais à un stade ultérieur et éventuellement commercialisation. Le financement du CIRM sera conditionnel à l’approbation de l’essai par la FDA, à la conclusion d’un accord définitif entre Asterias et le CIRM, et aux progrès continus d’Asterias vers la réalisation de certaines étapes prédéfinies du projet. [46]
Préoccupation et controverse
Effets indésirables
La principale préoccupation concernant l’éventuelle transplantation d’ESC chez des patients en tant que thérapies est leur capacité à former des tumeurs, y compris des tératomes. [47] Les problèmes de sécurité ont incité la FDA à suspendre le premier essai clinique ESC, mais aucune tumeur n’a été observée.
La principale stratégie pour améliorer la sécurité des ESC pour une utilisation clinique potentielle consiste à différencier les ESC en types de cellules spécifiques (par exemple, Neurones, muscles, cellules hépatiques) qui ont réduit ou éliminé la capacité de provoquer des tumeurs. Après différenciation, les cellules sont soumises à un tri par cytométrie en flux pour une purification plus poussée. On prévoit que les ESC sont intrinsèquement plus sûres que les cellules IPS créées avec des vecteurs viraux à intégration génétique , car elles ne sont pas génétiquement modifiées avec des gènes tels que c-Myc qui sont liés au cancer. Néanmoins, les ESC expriment des niveaux très élevés de gènes induisant des iPS et ces gènes, y compris Myc, sont essentiels pour l’auto-renouvellement et la pluripotence des ESC, [48]et les stratégies potentielles pour améliorer la sécurité en éliminant l’expression de c-Myc sont peu susceptibles de préserver la « souche » des cellules. Cependant, N-myc et L-myc ont été identifiés pour induire des cellules iPS au lieu de c-myc avec une efficacité similaire. [49] Des protocoles plus récents pour induire la pluripotence contournent complètement ces problèmes en utilisant des vecteurs viraux à ARN non intégratifs tels que le virus sendai ou la transfection d’ ARNm .
Débat éthique
En raison de la nature de la recherche sur les cellules souches embryonnaires, il existe de nombreuses opinions controversées sur le sujet. Puisque la récolte de cellules souches embryonnaires nécessite la destruction de l’embryon à partir duquel ces cellules sont obtenues, le statut moral de l’embryon est remis en question. Certaines personnes prétendent que la masse de cellules de 5 jours est trop jeune pour devenir une personne ou que l’embryon, s’il est donné par une clinique de FIV (où les laboratoires acquièrent généralement des embryons), irait de toute façon aux déchets médicaux. Les opposants à la recherche ESC affirment qu’un embryon est une vie humaine, donc le détruire est un meurtre et l’embryon doit être protégé selon la même vision éthique qu’un être humain plus développé. [50]
Histoire
- 1964 : Lewis Kleinsmith et G. Barry Pierce Jr. isolent un seul type de cellule d’un tératocarcinome , une tumeur désormais connue à partir d’une cellule germinale . [51] Ces cellules ont été isolées du tératocarcinome répliqué et se sont développées en culture cellulaire en tant que cellule souche et sont maintenant connues sous le nom de cellules de carcinome embryonnaire (CE). [ citation nécessaire ] Bien que les similitudes dans la morphologie et le potentiel de différenciation ( pluripotence ) aient conduit à l’utilisation de cellules EC comme modèle in vitro pour le développement précoce de la souris, [52] les cellules EC hébergent des mutations génétiques et des caryotypes souvent anormauxcelle accumulée au cours du développement du tératocarcinome . Ces aberrations génétiques ont encore souligné la nécessité de pouvoir cultiver des cellules pluripotentes directement à partir de la masse cellulaire interne .

 Martin Evans a révélé une nouvelle technique de culture des embryons de souris dans l’utérus pour permettre la dérivation de cellules ES à partir de ces embryons.
Martin Evans a révélé une nouvelle technique de culture des embryons de souris dans l’utérus pour permettre la dérivation de cellules ES à partir de ces embryons.
- 1981: Les cellules souches embryonnaires (cellules ES) ont été dérivées pour la première fois indépendamment d’embryons de souris par deux groupes. Martin Evans et Matthew Kaufman du Département de génétique de l’Université de Cambridge ont publié pour la première fois en juillet, révélant une nouvelle technique de culture des embryons de souris dans l’utérus pour permettre une augmentation du nombre de cellules, permettant la dérivation de cellules ES à partir de ces embryons . [53] Gail R. Martin , du département d’anatomie de l’ université de Californie à San Francisco , a publié son article en décembre et a inventé le terme “cellule souche embryonnaire”. [54] Elle a montré que les embryons pouvaient être cultivés in vitroet que les cellules ES pourraient être dérivées de ces embryons.
- 1989 : Mario R. Cappechi, Martin J. Evans et Oliver Smithies publient leurs recherches qui détaillent leur isolement et les modifications génétiques des cellules souches embryonnaires, créant les premières « souris knock-out ». [55] En créant des souris knock-out, cette publication a fourni aux scientifiques une toute nouvelle façon d’étudier la maladie.
-
![]()
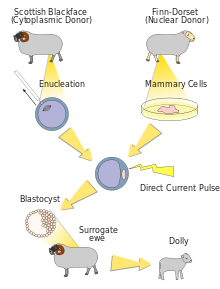
![]() Dolly la différenciation des cellules de mouton 1996 : Dolly est le premier mammifère cloné à partir d’une cellule adulte par le Roslin Institute de l’Université d’Edimbourg . [56] Cette expérience a institué la proposition que les cellules adultes spécialisées obtiennent le maquillage génétique pour effectuer une tâche spécifique; qui a établi une base pour de nouvelles recherches dans une variété de techniques de clonage. L’expérience de Dolly a été réalisée en obtenant les cellules mammaires de mammifère d’un mouton (Dolly) et en différenciant ces cellules jusqu’à ce que la division soit terminée. Un ovule a ensuite été obtenu d’un autre mouton hôte et le noyau a été retiré. Une cellule mammaire a été placée à côté de l’ovule et connectée par électricité, ce qui a permis à cette cellule de partager l’ADN. Cet ovule s’est différencié en embryonet l’embryon a été inséré dans un troisième mouton qui a donné naissance à la version clone de Dolly. [57]
Dolly la différenciation des cellules de mouton 1996 : Dolly est le premier mammifère cloné à partir d’une cellule adulte par le Roslin Institute de l’Université d’Edimbourg . [56] Cette expérience a institué la proposition que les cellules adultes spécialisées obtiennent le maquillage génétique pour effectuer une tâche spécifique; qui a établi une base pour de nouvelles recherches dans une variété de techniques de clonage. L’expérience de Dolly a été réalisée en obtenant les cellules mammaires de mammifère d’un mouton (Dolly) et en différenciant ces cellules jusqu’à ce que la division soit terminée. Un ovule a ensuite été obtenu d’un autre mouton hôte et le noyau a été retiré. Une cellule mammaire a été placée à côté de l’ovule et connectée par électricité, ce qui a permis à cette cellule de partager l’ADN. Cet ovule s’est différencié en embryonet l’embryon a été inséré dans un troisième mouton qui a donné naissance à la version clone de Dolly. [57] - 1998 : Une équipe de l’ Université du Wisconsin à Madison (James A. Thomson, Joseph Itskovitz-Eldor, Sander S. Shapiro, Michelle A. Waknitz, Jennifer J. Swiergiel, Vivienne S. Marshall et Jeffrey M. Jones) publie un article intitulé “Lignées de cellules souches embryonnaires dérivées de blastocystes humains”. Les chercheurs à l’origine de cette étude ont non seulement créé les premières cellules souches embryonnaires, mais ont reconnu leur pluripotence, ainsi que leur capacité d’auto-renouvellement. Le résumé de l’article note l’importance de la découverte en ce qui concerne les domaines de la biologie du développement et de la découverte de médicaments. [58]
- 2001 : Le président George W. Bush autorise un financement fédéral pour soutenir la recherche sur environ 60 lignées de cellules souches embryonnaires, déjà existantes à l’heure actuelle. Considérant que les lignées limitées sur lesquelles Bush autorisait la recherche avaient déjà été établies, cette loi soutenait la recherche sur les cellules souches embryonnaires sans soulever les questions éthiques qui pourraient survenir avec la création de nouvelles lignées dans le cadre du budget fédéral. [59]
- 2006 : Les scientifiques japonais Shinya Yamanaka et Kazutoshi Takashi publient un article décrivant l’induction de cellules souches pluripotentes à partir de cultures de fibroblastes de souris adultes . Les cellules souches pluripotentes induites (iPSC) sont une énorme découverte, car elles sont apparemment identiques aux cellules souches embryonnaires et pourraient être utilisées sans susciter la même controverse morale. [60]
- Janvier 2009 : La Food and Drug Administration (FDA) des États-Unis donne son approbation pour l’essai de phase I de Geron Corporation sur son traitement dérivé de cellules souches embryonnaires humaines pour les lésions de la moelle épinière . L’annonce a suscité l’enthousiasme de la communauté scientifique, mais aussi la méfiance des opposants aux cellules souches. Les cellules de traitement étaient cependant dérivées des lignées cellulaires approuvées dans le cadre de la politique ESC de George W. Bush . [61]
- Mars 2009 : Le décret exécutif 13505 est signé par le président Barack Obama , supprimant les restrictions mises en place sur le financement fédéral des cellules souches humaines par l’administration présidentielle précédente. Cela permettrait aux National Institutes of Health (NIH) de financer la recherche sur les CSEh. Le document indique également que le NIH doit fournir des directives de financement fédérales révisées dans les 120 jours suivant la signature de l’ordonnance. [62]
Techniques et conditions de dérivation et de culture
Dérivation de l’homme
La fécondation in vitro génère plusieurs embryons. Le surplus d’embryons n’est pas utilisé cliniquement ou est impropre à l’implantation chez le patient, et peut donc être donné par le donneur avec son consentement. Les cellules souches embryonnaires humaines peuvent être dérivées de ces embryons donnés ou, en outre, elles peuvent également être extraites d’embryons clonés créés à l’aide d’une cellule d’un patient et d’un ovule donné par le processus de transfert nucléaire de cellules somatiques . [63]La masse cellulaire interne (cellules d’intérêt), du stade blastocyste de l’embryon, est séparée du trophectoderme, les cellules qui se différencieraient en tissu extra-embryonnaire. L’immunochirurgie, le processus dans lequel les anticorps sont liés au trophectoderme et éliminés par une autre solution, et la dissection mécanique sont effectuées pour obtenir la séparation. Les cellules de la masse cellulaire interne résultantes sont plaquées sur des cellules qui fourniront un support. Les cellules de la masse cellulaire interne se fixent et se développent davantage pour former une lignée cellulaire embryonnaire humaine, qui sont indifférenciées. Ces cellules sont nourries quotidiennement et séparées par voie enzymatique ou mécanique tous les quatre à sept jours. Pour que la différenciation se produise, la lignée de cellules souches embryonnaires humaines est retirée des cellules de support pour former des corps embryoïdes, est co-cultivée avec un sérum contenant les signaux nécessaires,[64]
Dérivation d’autres animaux
Les cellules souches embryonnaires sont dérivées de la masse cellulaire interne de l’ embryon précoce , qui sont récoltées sur l’animal mère donneur. Martin Evans et Matthew Kaufman ont rapporté une technique qui retarde l’implantation de l’embryon, permettant à la masse cellulaire interne d’augmenter. Ce processus comprend l’ablation des ovaires de la mère donneuse et l’administration de progestérone , ce qui modifie l’environnement hormonal, ce qui permet aux embryons de rester libres dans l’utérus. Après 4 à 6 jours de cette culture intra-utérine, les embryons sont récoltés et cultivés en culture in vitro jusqu’à ce que la masse cellulaire interne forme des «structures en forme de cylindre d’œuf», qui sont dissociées en cellules individuelles et étalées surfibroblastes traités à la mitomycine-c (pour prévenir la mitose des fibroblastes ). Les lignées cellulaires clonales sont créées en développant une seule cellule. Evans et Kaufman ont montré que les cellules issues de ces cultures pouvaient former des tératomes et des corps embryoïdes et se différencier in vitro, ce qui indique que les cellules sont pluripotentes . [53]
Gail Martin a dérivé et cultivé ses cellules ES différemment. Elle a retiré les embryons de la mère donneuse environ 76 heures après la copulation et les a cultivés pendant une nuit dans un milieu contenant du sérum. Le lendemain, elle a retiré la masse cellulaire interne du blastocyste tardif par microchirurgie . La masse cellulaire interne extraite a été cultivée sur des fibroblastes traités à la mitomycine-c dans un milieu contenant du sérum et conditionné par des cellules ES. Après environ une semaine, des colonies de cellules se sont développées. Ces cellules se sont développées en culture et ont démontré des caractéristiques pluripotentes , comme en témoigne la capacité de former des tératomes, se différencient in vitro et forment des corps embryoïdes . Martin a qualifié ces cellules de cellules ES. [54]
On sait maintenant que les cellules nourricières fournissent le facteur inhibiteur de la leucémie (LIF) et que le sérum fournit les protéines morphogénétiques osseuses (BMP) qui sont nécessaires pour empêcher les cellules ES de se différencier. [65] [66] Ces facteurs sont extrêmement importants pour l’efficacité de la dérivation des cellules ES. En outre, il a été démontré que différentes souches de souris ont des efficacités différentes pour isoler les cellules ES. [67] Les utilisations actuelles des cellules ES de souris incluent la génération de souris transgéniques , y compris des souris knock-out. Pour le traitement humain, il existe un besoin de cellules pluripotentes spécifiques au patient. La génération de cellules ES humaines est plus difficile et se heurte à des problèmes éthiques. Ainsi, en plus de la recherche sur les cellules ES humaines, de nombreux groupes se concentrent sur la génération de cellules souches pluripotentes induites (cellules iPS). [68]
Méthodes potentielles pour la dérivation de nouvelles lignées cellulaires
Le 23 août 2006, l’édition en ligne de la revue scientifique Nature a publié une lettre du Dr Robert Lanza (directeur médical de Advanced Cell Technology à Worcester, MA) déclarant que son équipe avait trouvé un moyen d’extraire des cellules souches embryonnaires sans détruire le véritable embryon. [69] Cette réalisation technique permettrait potentiellement aux scientifiques de travailler avec de nouvelles lignées de cellules souches embryonnaires dérivées grâce à un financement public aux États-Unis, où le financement fédéral était à l’époque limité à la recherche utilisant des lignées de cellules souches embryonnaires dérivées avant août 2001. En mars , 2009, la limitation a été levée. [70]
Des cellules souches embryonnaires humaines ont également été dérivées par transfert nucléaire de cellules somatiques (SCNT) . [71] [72] Cette approche a aussi parfois été appelée “clonage thérapeutique” parce que le SCNT présente des similitudes avec d’autres types de clonage en ce que les noyaux sont transférés d’une cellule somatique dans un zygote énucléé. Cependant, dans ce cas, le SCNT a été utilisé pour produire des lignées de cellules souches embryonnaires dans un laboratoire, et non des organismes vivants via une grossesse. La partie “thérapeutique” du nom est incluse en raison de l’espoir que les cellules souches embryonnaires produites par SCNT pourraient avoir une utilité clinique.
Cellules souches pluripotentes induites
La technologie iPSC a été lancée par le laboratoire de Shinya Yamanaka à Kyoto , au Japon , qui a montré en 2006 que l’introduction de quatre gènes spécifiques codant pour des facteurs de transcription pouvait convertir des cellules adultes en cellules souches pluripotentes. [73] Il a reçu le prix Nobel 2012 avec Sir John Gurdon “pour la découverte que les cellules matures peuvent être reprogrammées pour devenir pluripotentes”. [74]
En 2007, il a été démontré que les cellules souches pluripotentes , très similaires aux cellules souches embryonnaires, peuvent être induites par la délivrance de quatre facteurs ( Oct3/4 , Sox2 , c-Myc et Klf4 ) à des cellules différenciées. [75] En utilisant les quatre gènes précédemment énumérés, les cellules différenciées sont “reprogrammées” en cellules souches pluripotentes, permettant la génération de cellules souches pluripotentes/embryonnaires sans l’embryon. La morphologie et les facteurs de croissance de ces cellules pluripotentes induites en laboratoire sont équivalentes aux cellules souches embryonnaires, ce qui conduit ces cellules à être connues sous le nom de « cellules souches pluripotentes induites » (cellules iPS). [76]Cette observation a été observée dans des cellules souches pluripotentes de souris, à l’origine, mais peut maintenant être réalisée dans des fibroblastes humains adultes en utilisant les quatre mêmes gènes. [77]
Étant donné que les préoccupations éthiques concernant les cellules souches embryonnaires concernent généralement leur dérivation à partir d’embryons terminés, on pense que la reprogrammation de ces «cellules souches pluripotentes induites» (cellules iPS) peut être moins controversée.
Cela peut permettre la génération de lignées cellulaires ES spécifiques au patient qui pourraient potentiellement être utilisées pour des thérapies de remplacement cellulaire. De plus, cela permettra la génération de lignées cellulaires ES à partir de patients atteints de diverses maladies génétiques et fournira des modèles inestimables pour étudier ces maladies.
Cependant, comme première indication que la technologie des cellules souches pluripotentes induites (iPS) peut rapidement conduire à de nouveaux traitements, elle a été utilisée par une équipe de recherche dirigée par Rudolf Jaenisch du Whitehead Institute for Biomedical Research à Cambridge , Massachusetts , pour guérir les souris de l’anémie falciforme , tel que rapporté par l’édition en ligne du journal Science le 6 décembre 2007. [78] [79]
Le 16 janvier 2008, une société californienne, Stemagen, a annoncé qu’elle avait créé les premiers embryons humains clonés matures à partir de cellules cutanées uniques prélevées sur des adultes. Ces embryons peuvent être récoltés pour les cellules souches embryonnaires correspondant aux patients. [80]
Contamination par des réactifs utilisés en culture cellulaire
L’édition en ligne de Nature Medicine a publié une étude le 24 janvier 2005, qui indiquait que les cellules souches embryonnaires humaines disponibles pour la recherche financée par le gouvernement fédéral sont contaminées par des molécules non humaines provenant du milieu de culture utilisé pour faire croître les cellules. [81] C’est une technique courante d’utiliser des cellules de souris et d’autres cellules animales pour maintenir la pluripotence des cellules souches en division active. Le problème a été découvert lorsque l’ acide sialique non humain dans le milieu de croissance s’est avéré compromettant les utilisations potentielles des cellules souches embryonnaires chez l’homme, selon des scientifiques de l’ Université de Californie à San Diego . [82]
Cependant, une étude publiée dans l’édition en ligne du Lancet Medical Journal le 8 mars 2005 a fourni des informations détaillées sur une nouvelle lignée de cellules souches dérivée d’embryons humains dans des conditions totalement exemptes de cellules et de sérum. Après plus de 6 mois de prolifération indifférenciée, ces cellules ont démontré le potentiel de former des dérivés des trois couches germinales embryonnaires à la fois in vitro et dans les tératomes . Ces propriétés ont également été maintenues avec succès (pour plus de 30 passages) avec les lignées de cellules souches établies. [83]
Cellules muses
Les cellules Muse (Multi-lineage differentiating stress enduring cell) sont des cellules souches pluripotentes non cancéreuses présentes chez l’adulte. [84] [85] Ils ont été découverts en 2010 par Mari Dezawa et son groupe de recherche. [84] Les cellules Muse résident dans le tissu conjonctif de presque tous les organes, y compris le cordon ombilical, la moelle osseuse et le sang périphérique. [86] [84] [87] [88] [89] Ils peuvent être collectés à partir de cellules mésenchymateuses disponibles dans le commerce telles que les fibroblastes humains , les cellules souches mésenchymateuses de la moelle osseuse et les cellules souches dérivées de la graisse. [90] [91] [92]Les cellules Muse sont capables de générer des cellules représentatives des trois couches germinales à partir d’une seule cellule à la fois spontanément et sous induction de cytokines . L’expression des gènes de pluripotence et la différenciation triploblastique sont auto-renouvelables au fil des générations. Les cellules Muse ne subissent pas de formation de tératome lorsqu’elles sont transplantées dans un environnement hôte in vivo, éliminant le risque de tumorigenèse par une prolifération cellulaire débridée. [84]
Voir également
- Corps embryoïde
- Comités de surveillance de la recherche sur les cellules souches embryonnaires
- Implant de tissu fœtal
- Cellules souches induites
- KOSR (Remplacement du sérum KnockOut)
- Controverse sur les cellules souches
Références
- ^ Thomson; Itskovitz-Eldor, J; Shapiro, SS; Waknitz, MA; Swiergiel, JJ; Marshall, VS ; Jones, JM (1998). “Lignées de cellules souches embryonnaires de blastocystes dérivées d’humains” . Sciences . 282 (5391): 1145–1147. Bibcode : 1998Sci…282.1145T . doi : 10.1126/science.282.5391.1145 . PMID 9804556 .
- ^ “Les bases des cellules souches du NIH. Que sont les cellules souches embryonnaires?” . Archivé de l’original le 2016-08-31 . Récupéré le 25/03/2014 .
- ^ Baldwing A (2009). « Moralité et recherche sur l’embryon humain. Introduction au point de discussion sur la moralité et la recherche sur l’embryon humain » . Rapports EMBO . 10 (4): 299–300. doi : 10.1038/embor.2009.37 . PMC 2672902 . PMID 19337297 .
- ^ Nakaya, Andrea C. (1er août 2011). Ethique biomédicale . San Diego, Californie : ReferencePoint Press. p. 96 . ISBN 978-1601521576.
- ^ un b “Introduction : que sont les cellules souches et pourquoi sont-elles importantes ?” . Instituts nationaux de la santé . Récupéré le 28 octobre 2018 .
- ^ Carla A Herberts; Marcel SG Kwa; Harm PH Hermsen (2011). “Facteurs de risque dans le développement de la thérapie par cellules souches” . Journal de médecine translationnelle . 9 (29): 29. doi : 10.1186/1479-5876-9-29 . PMC 3070641 . PMID 21418664 .
- ^ un b Thomson, JA; Itskovitz-Eldor, J; Shapiro, SS; Waknitz, MA; Swiergiel, JJ; Marshall, VS ; Jones, JM (1998). “Lignées de cellules souches embryonnaires dérivées de blastocystes humains” . Sciences . 282 (5391): 1145–7. Bibcode : 1998Sci…282.1145T . doi : 10.1126/science.282.5391.1145 . PMID 9804556 .
- ^ Ying; Nichols, J; Chambres, je ; Smith, A (2003). “L’induction BMP des protéines Id supprime la différenciation et soutient l’auto-renouvellement des cellules souches embryonnaires en collaboration avec STAT3” . Cellule . 115 (3): 281–292. doi : 10.1016/S0092-8674(03)00847-X . PMID 14636556 . S2CID 7201396 .
- ^ Martello, G.; En ligneSmith, A. (2014). “La nature des cellules souches embryonnaires”. Revue annuelle de biologie cellulaire et développementale . 30 : 647–75. doi : 10.1146/annurev-cellbio-100913-013116 . PMID 25288119 .
- ^ un b Boward, B.; Wu, T.; Dalton, S. (2016). “Examen concis : contrôle du destin cellulaire par le cycle cellulaire et les réseaux de pluripotence” . Cellules souches . 34 (6) : 1427–1436. doi : 10.1002/stem.2345 . PMC 5201256 . PMID 26889666 .
- ^ Blanc, J.; Stead, E.; Faast, R.; Conn, S.; Cartwright, P.; En ligneDalton, S. (2005). “Activation développementale de la voie Rb-E2F et établissement de l’activité kinase dépendante de la cycline régulée par le cycle cellulaire pendant la différenciation des cellules souches embryonnaires” . Biologie Moléculaire de la Cellule . 16 (4): 2018–27. doi : 10.1091/mbc.e04-12-1056 . PMC 1073679 . PMID 15703208 .
- ^ Ter Huurne, Menno; Stunnenberg, Hendrik G. (21 avril 2021). “Progression de la phase G1 dans les cellules souches pluripotentes” . Sciences de la vie cellulaire et moléculaire . 21 (10): 4507–4519. doi : 10.1007/s00018-021-03797-8 . ISSN 1875-9777 . PMC 8195903 . PMID 33884444 .
- ^ Singh, Amar M.; Dalton, Stephen (2009-08-07). “Le cycle cellulaire et Myc recoupent des mécanismes qui régulent la pluripotence et la reprogrammation” . Cellule Cellule Souches . 5 (2): 141–149. doi : 10.1016/j.stem.2009.07.003 . ISSN 1875-9777 . PMC 2909475 . PMID 19664987 .
- ^ Ter Huurne, Menno; Chappell, James; Dalton, Stephen; Stunnenberg, Hendrik G. (5 octobre 2017). “Contrôle distinct du cycle cellulaire dans deux états différents de la pluripotence de la souris” . Cellule Cellule Souches . 21 (4) : 449–455.e4. doi : 10.1016/j.stem.2017.09.004 . ISSN 1875-9777 . PMC 5658514 . PMID 28985526 .
- ^ Ying, Qi Long; Wray, Jason; Nichols, Jennifer ; Batlle-Morera, Laura; Doble, Bradley; Woodgett, James; Cohen, Philippe; Smith, Austin (2008-05-22). “L’état fondamental de l’auto-renouvellement des cellules souches embryonnaires” . Nature . 453 (7194): 519-523. Bibcode : 2008Natur.453..519Y . doi : 10.1038/nature06968 . ISSN 1476-4687 . PMC 5328678 . PMID 18497825 .
- ^ Lee, J.; Allez, Y. ; Kang, I. ; Han, YM; En ligneKim, J. (2010). “Oct-4 contrôle la progression du cycle cellulaire des cellules souches embryonnaires” . Le Journal biochimique . 426 (2): 171–181. doi : 10.1042/BJ20091439 . PMC 2825734 . PMID 19968627 .
- ^ Zhang, X.; Neganova, I.; Przyborski, S.; Yang, C.; Cooke, M.; Atkinson, SP; Anyfantis, G.; Fenyk, S.; Keith, WN; Hoare, SF; Hughes, O.; Strachan, T.; Stojkovic, M.; Hinds, PW ; Armstrong, L.; En ligneLako, M. (2009). “Un rôle pour NANOG dans la transition G1 à S dans les cellules souches embryonnaires humaines par liaison directe de CDK6 et CDC25A” . Le Journal de biologie cellulaire . 184 (1): 67–82. doi : 10.1083/jcb.200801009 . PMC 2615089 . PMID 19139263 .
- ^ Mahla, Ranjeet (19 juillet 2016). “Applications des cellules souches dans la médecine régénérative et la thérapeutique des maladies” . Journal international de biologie cellulaire . 2016 : 6940283. doi : 10.1155/2016/6940283 . PMC 4969512 . PMID 27516776 .
- ^ Levenberg, S. (2002). “Cellules endothéliales dérivées de cellules souches embryonnaires humaines” . Actes de l’Académie nationale des sciences . 99 (7): 4391–4396. Bibcode : 2002PNAS…99.4391L . doi : 10.1073/pnas.032074999 . PMC 123658 . PMID 11917100 .
- ^ cuves, A ; Tolley, N.-É.; Évêque, AE ; Polak, JM (2005-08-01). « Cellules souches embryonnaires et génie tissulaire : fournir des cellules souches à la clinique » . Journal de la Société royale de médecine . 98 (8): 346–350. doi : 10.1177/014107680509800804 . ISSN 0141-0768 . PMC 1181832 . PMID 16055897 .
- ^ Heath, Carole A. (2000-01-01). “Cellules pour l’ingénierie tissulaire” . Tendances en biotechnologie . 18 (1): 17–19. doi : 10.1016/S0167-7799(99)01396-7 . ISSN 0167-7799 . PMID 10631775 .
- ^ un b Davila, JC; Cézar, GG; Thiede, M; Strom, S; Miki, T ; Trosko, J (2004). “Utilisation et application des cellules souches en toxicologie” . Sciences toxicologiques . 79 (2): 214-223. doi : 10.1093/toxsci/kfh100 . PMID 15014205 .
- ^ Siu, CW; Moore, JC; Li, RA (2007). “Cardiomyocytes dérivés de cellules souches embryonnaires humaines pour les thérapies cardiaques”. Troubles cardiovasculaires et hématologiques Cibles médicamenteuses . 7 (2): 145–152. doi : 10.2174/187152907780830851 . PMID 17584049 .
- ^ Perrier, AL (2004). “Dérivation des Neurones dopaminergiques du mésencéphale à partir de cellules souches embryonnaires humaines” . Actes de l’Académie nationale des sciences . 101 (34): 12543–12548. Bibcode : 2004PNAS..10112543P . doi : 10.1073/pnas.0404700101 . PMC 515094 . PMID 15310843 .
- ^ Paroisse, CL; Arenas, E (2007). “Stratégies basées sur les cellules souches pour le traitement de la maladie de Parkinson”. Maladies Neuro-Dégénératives . 4 (4): 339–347. doi : 10.1159/000101892 . PMID 17627139 . S2CID 37229348 .
- ^ Waese, EY; Kandel, RA; Stanford, WL (2008). “Application des cellules souches dans la réparation osseuse”. Radiologie du squelette . 37 (7): 601–608. doi : 10.1007/s00256-007-0438-8 . PMID 18193216 . S2CID 12401889 .
- ^ d’Amour, KA; Bang, AG ; Eliazer, S; Kelly, OG ; Agulnick, AD ; Intelligent, NG ; Moorman, MA; Croon, E; Charpentier, MK ; En ligneBaetge, EE (2006). “Production de cellules endocrines exprimant l’hormone pancréatique à partir de cellules souches embryonnaires humaines”. Biotechnologie naturelle . 24 (11): 1392–1401. doi : 10.1038/nbt1259 . PMID 17053790 . S2CID 11040949 .
- ^ Colen, BD (9 octobre 2014) Le pas de géant contre le diabète The Harvard Gazette, récupéré le 24 novembre 2014
- ^ Menasché, Philippe; Vanneaux, Valérie; Fabreguettes, Jean-Roch; Bel, Alain; Tosca, Lucie; García, Sylvie (21 mars 2015). « Vers une utilisation clinique des progéniteurs cardiaques dérivés de cellules souches embryonnaires humaines : une expérience translationnelle » . Journal européen du cœur . 36 (12): 743–750. doi : 10.1093/eurheartj/ehu192 . PMID 24835485 .
- ^ Jensen, J; Hyllner, J; En ligneBjörquist, P (2009). “Technologies des cellules souches embryonnaires humaines et découverte de médicaments”. Tourillon de physiologie cellulaire . 219 (3): 513-519. doi : 10.1002/jcp.21732 . PMID 19277978 . S2CID 36354049 .
- ^ Söderdahl, T; Küppers-Munther, B; Heins, N; Edsbagge, J; Bjorquist, P; Cotgreave, moi ; En ligneJernström, B (2007). “Glutathion transférases dans des cellules de type hépatocyte dérivées de cellules souches embryonnaires humaines”. Toxicologie in Vitro . 21 (5): 929–937. doi : 10.1016/j.tiv.2007.01.021 . PMID 17346923 .
- ^ “Dr Yury Verlinsky, 1943–2009: Expert en technologie de la reproduction” Archivé le 08/08/2009 au Wayback Machine Chicago Tribune , 20 juillet 2009
- ^ Mao Z, Bozzella M, Seluanov A, Gorbunova V (septembre 2008). “Réparation de l’ADN par jonction d’extrémités non homologues et recombinaison homologue au cours du cycle cellulaire dans les cellules humaines” . Cycle cellulaire . 7 (18): 2902–2906. doi : 10.4161/cc.7.18.6679 . PMC 2754209 . PMID 18769152 .
- ^ un b Tichy ED, Pillai R, Deng L, et al. (novembre 2010). “Les cellules souches embryonnaires de souris, mais pas les cellules somatiques, utilisent principalement la recombinaison homologue pour réparer les cassures d’ADN double brin” . Développement de cellules souches . 19 (11): 1699–1711. doi : 10.1089/scd.2010.0058 . PMC 3128311 . PMID 20446816 .
- ^ Hong Y, Stambrook PJ (octobre 2004). “Restauration d’un arrêt G1 absent et protection contre l’apoptose dans les cellules souches embryonnaires après rayonnement ionisant” . Proc. Natl. Acad. Sci. États- Unis . 101 (40): 14443–14448. Bibcode : 2004PNAS..10114443H . doi : 10.1073/pnas.0401346101 . PMC 521944 . PMID 15452351 .
- ^ Aladjem MI, Spike BT, Rodewald LW, et al. (janvier 1998). “Les cellules ES n’activent pas les réponses au stress dépendantes de p53 et subissent une apoptose indépendante de p53 en réponse aux dommages à l’ADN” . Courant. Biol . 8 (3): 145–155. doi : 10.1016/S0960-9822(98)70061-2 . PMID 9443911 . S2CID 13938854 .
- ^ Bernstein C, Bernstein H, Payne CM, Garewal H (juin 2002). “Réparation de l’ADN / protéines à double rôle pro-apoptotiques dans cinq voies majeures de réparation de l’ADN: protection à sécurité intégrée contre la cancérogenèse”. Mutat. Rés . 511 (2): 145–178. doi : 10.1016/S1383-5742(02)00009-1 . PMID 12052432 .
- ^ Cervantes RB, Stringer JR, Shao C, Tischfield JA, Stambrook PJ (mars 2002). “Les cellules souches embryonnaires et les cellules somatiques diffèrent par la fréquence et le type de mutation” . Proc. Natl. Acad. Sci. États- Unis . 99 (6): 3586–3590. Bibcode : 2002PNAS…99.3586C . doi : 10.1073/pnas.062527199 . PMC 122567 . PMID 11891338 .
- ^ “La FDA approuve l’étude sur les cellules souches embryonnaires humaines – CNN.com” . 23 janvier 2009 . Récupéré le 1er mai 2010 .
- ^ Keirstead HS, Nistor G, Bernal G, et al. (2005). “Les greffes de cellules souches d’oligodendrocytes embryonnaires humaines dérivées remyélinisent et rétablissent la locomotion après une lésion de la moelle épinière” (PDF) . J. Neurosci . 25 (19): 4694–4705. doi : 10.1523/JNEUROSCI.0311-05.2005 . PMC 6724772 . PMID 15888645 .
- ^ Reinberg, Steven (2009-01-23) FDA OKs 1st Embryonic Stem Cell Trial . Le Washington Post
- ^ Commentaires de Geron sur la mise en attente de la FDA sur un essai de lésion de la moelle épinière . geron.com (27 août 2009)
- ^ Vergano, Dan (11 octobre 2010). “Cellules souches embryonnaires utilisées sur un patient pour la première fois” . Etats-Unis aujourd’hui . Récupéré le 12 octobre 2010 .
- ^ Brown, Eryn (15 novembre 2011). “Geron quitte la recherche sur les cellules souches” . LA fois . Récupéré le 15/11/2011 .
- ^ “Bonne nouvelle : la filiale de BioTime, Asterias, acquiert le programme de cellules souches embryonnaires de Geron” . iPScell.com . 1er octobre 2013.
- ^ un bcd California Institute of Regenerative Medicine Archivé le 24/10/2017 à la Wayback Machine . BioTime, Inc.
- ^ Knoepfler, Paul S. (2009). “Déconstruire la tumorigénicité des cellules souches : une feuille de route pour une médecine régénérative sûre” . Cellules souches . 27 (5): 1050–1056. doi : 10.1002/stem.37 . PMC 2733374 . PMID 19415771 .
- ^ Varlakhanova, Natalia V.; Cotterman, Rebecca F.; Devries, Wilhelmine N.; Morgan, Judy ; Donahue, Leah Rae; Murray, Stephen; Knowles, Barbara B.; En ligneKnoepfler, Paul S. (2010). “Myc maintient la pluripotence et l’auto-renouvellement des cellules souches embryonnaires” . Différenciation . 80 (1): 9–19. doi : 10.1016/j.diff.2010.05.001 . PMC 2916696 . PMID 20537458 .
- ^ Wernig, Marius; Meissner, Alexandre; Cassady, John P; Jaenisch, Rudolf (2008). “C-Myc est indispensable pour la reprogrammation directe des fibroblastes de souris” . Cellule Cellule Souches . 2 (1) : 10-12. doi : 10.1016/j.stem.2007.12.001 . PMID 18371415 .
- ^ Roi, Nancy; Perrin, Jacob (7 juillet 2014). “Problèmes éthiques dans la recherche et la thérapie sur les cellules souches” . Recherche et thérapie sur les cellules souches . 5 (4): 85. doi : 10.1186/scrt474 . PMC 4097842 . PMID 25157428 .
- ^ Kleinsmith LJ, Pierce GB Jr (1964). « Multipotentialité des cellules de carcinome embryonnaire unique » . Cancer Res . 24 : 1544–1551. PMID 14234000 .
- ^ Martin GR (1980). “Teratocarcinomes et embryogenèse mammifère”. Sciences . 209 (4458): 768–776. Bibcode : 1980Sci…209..768M . doi : 10.1126/science.6250214 . PMID 6250214 .
- ^ un b Evans M, Kaufman M (1981). “Etablissement en culture de cellules pluripotentes à partir d’embryons de souris”. Nature . 292 (5819): 154–156. Bibcode : 1981Natur.292..154E . doi : 10.1038/292154a0 . PMID 7242681 . S2CID 4256553 .
- ^ un b Martin G (1981). “Isolement d’une lignée cellulaire pluripotente à partir d’embryons de souris précoces cultivés dans un milieu conditionné par des cellules souches de tératocarcinome” . Proc Natl Acad Sci USA . 78 (12): 7634–7638. Bibcode : 1981PNAS…78.7634M . doi : 10.1073/pnas.78.12.7634 . PMC 349323 . PMID 6950406 .
- ^ “Le prix Nobel 2007 de physiologie ou médecine – Informations avancées” . Prix Nobel . Nobel Média.
- ^ “La vie de Dolly | Dolly le mouton” . Récupéré le 21/02/2022 .
- ^ Klotzko, Arlene Judith; Klotzko, chercheuse invitée Royal Free and University College Medical School Arlene Judith (2006). Un clone à vous ? . La presse de l’Universite de Cambridge. ISBN 978-0-521-85294-4.
- ^ Thompson, James A.; Itskovitz-Eldor, Joseph; Shapiro, Sander S.; Waknitz, Michelle A.; Swiergiel, Jennifer J.; Marshall, Vivienne S.; Jones, Jeffrey M. (6 novembre 1998). “Lignées de cellules souches embryonnaires dérivées de blastocyste humain” . Sciences . 282 (5391): 1145–1147. Bibcode : 1998Sci…282.1145T . doi : 10.1126/science.282.5391.1145 . PMID 9804556 .
- ^ “Le discours du président George W. Bush sur la recherche sur les cellules souches” . CNN Inside Politics. 9 août 2001.
- ^ Yamanaka, Shinya; Takahashi, Kazutoshi (25 août 2006). “Induction de cellules souches pluripotentes à partir de cultures de fibroblastes embryonnaires et adultes de souris par des facteurs définis”. Cellule . 126 (4): 663–676. doi : 10.1016/j.cell.2006.07.024 . hdl : 2433/159777 . PMID 16904174 . S2CID 1565219 .
- ^ Wadman, Meredith (27 janvier 2009). “Cellules souches prêtes pour les heures de grande écoute” . Nature . 457 (7229): 516. doi : 10.1038/457516a . PMID 19177087 .
- ^ “Ordonnance exécutive 13505 – Suppression des obstacles à la recherche scientifique responsable impliquant des cellules souches humaines” (PDF) . Registre fédéral : Documents présidentiels . 74 (46). 11 mars 2009.
- ^ Mountford, JC (2008). “Cellules souches embryonnaires humaines: origines, caractéristiques et potentiel de thérapie régénérative”. Transfus Med . 18 (1): 1–12. doi : 10.1111/j.1365-3148.2007.00807.x . PMID 18279188 . S2CID 20874633 .
- ^ Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM (1998). “Lignées de cellules souches embryonnaires dérivées de blastocystes humains” . Sciences . 282 (5391): 1145–1147. Bibcode : 1998Sci…282.1145T . doi : 10.1126/science.282.5391.1145 . PMID 9804556 .
- ^ Smith AG, Heath JK, Donaldson DD, Wong GG, Moreau J, Stahl M, Rogers D (1988). “Inhibition de la différenciation des cellules souches embryonnaires pluripotentielles par des polypeptides purifiés”. Nature . 336 (6200): 688–690. Bibcode : 1988Natur.336..688S . doi : 10.1038/336688a0 . PMID 3143917 . S2CID 4325137 .
- ^ Williams RL, Hilton DJ, Pease S, Willson TA, Stewart CL, Gearing DP, Wagner EF, Metcalf D, Nicola NA, Gough NM (1988). “Le facteur inhibiteur de la leucémie myéloïde maintient le potentiel de développement des cellules souches embryonnaires”. Nature . 336 (6200): 684–687. Bibcode : 1988Natur.336..684W . doi : 10.1038/336684a0 . PMID 3143916 . S2CID 4346252 .
- ^ Ledermann B, Bürki K (1991). “Établissement d’une lignée germinale compétente de cellules souches embryonnaires C57BL/6”. Exp Cell Res . 197 (2): 254–258. doi : 10.1016/0014-4827(91)90430-3 . PMID 1959560 .
- ^ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (2007). “Induction de cellules souches pluripotentes à partir de fibroblastes humains adultes par des facteurs définis”. Cellule . 131 (5): 861–872. doi : 10.1016/j.cell.2007.11.019 . hdl : 2433/49782 . PMID 18035408 . S2CID 8531539 .
- ^ Klimanskaya I, Chung Y, Becker S, Lu SJ, Lanza R (2006). “Lignées de cellules souches embryonnaires humaines dérivées de blastomères uniques”. Nature . 444 (7118): 481–485. Bibcode : 2006Natur.444..481K . doi : 10.1038/nature05142 . PMID 16929302 . S2CID 84792371 .
- ^ Des scientifiques américains soulagés alors qu’Obama lève l’interdiction de la recherche sur les cellules souches , The Guardian , 10 mars 2009
- ^ Tachibana, Masahito; Amato, Paula; Sparman, Michelle ; Gutierrez, Nuria Marti; Tippner-Hedges, Rebecca; Ma, Hong ; Kang, Eunju ; Fulati, Alimujiang ; Lee, Hyo-Sang ; Sritanaudomchai, Hataitip ; Masterson, Keith (2013-06-06). “Cellules souches embryonnaires humaines dérivées par transfert nucléaire de cellules somatiques” . Cellule . 153 (6): 1228-1238. doi : 10.1016/j.cell.2013.05.006 . ISSN 0092-8674 . PMC 3772789 . PMID 23683578 .
- ^ Chung, Jeune Gie; Euh, Jin Hee ; Lee, Jeung Eun; Shim, Sung Han; Sépilien, Vicken ; Hong, Seung Wook; Lee, Yumie ; Treff, Nathan R.; Choi, Young Ho ; Kimbrel, Erin A.; Dittman, Ralph E. (2014-06-05). “Transfert nucléaire de cellules somatiques humaines à l’aide de cellules adultes” . Cellule Cellule Souches . 14 (6): 777–780. doi : 10.1016/j.stem.2014.03.015 . ISSN 1934-5909 . PMID 24746675 .
- ^ Takahashi, K; Yamanaka, S (2006). “Induction de cellules souches pluripotentes à partir de cultures de fibroblastes embryonnaires et adultes de souris par des facteurs définis”. Cellule . 126 (4): 663–676. doi : 10.1016/j.cell.2006.07.024 . hdl : 2433/159777 . PMID 16904174 . S2CID 1565219 .
![open access]()
![open access]()
- ^ “Le prix Nobel de physiologie ou de médecine – Communiqué de presse 2012” . Nobel Media AB. 8 octobre 2012.
- ^ Wernig, Marius; Meissner, Alexandre; Contremaître, Ruth ; Brambrink, Tobias; Ku, Manching ; Hochedlinger, Konrad; Bernstein, Bradley E.; Jaenisch, Rudolf (2007-07-19). “Reprogrammation in vitro des fibroblastes dans un état de type cellule ES pluripotent”. Nature . 448 (7151): 318–324. Bibcode : 2007Natur.448..318W . doi : 10.1038/nature05944 . ISSN 1476-4687 . PMID 17554336 . S2CID 4377572 .
- ^ Takahashi, Kazutoshi; Yamanaka, Shinya (2006-08-25). “Induction de cellules souches pluripotentes à partir de cultures de fibroblastes embryonnaires et adultes de souris par des facteurs définis” . Cellule . 126 (4): 663–676. doi : 10.1016/j.cell.2006.07.024 . ISSN 0092-8674 . PMID 16904174 .
- ^ Takahashi, Kazutoshi; Tanabe, Koji ; Ohnuki, Mari ; Narita, Megumi; Ichisaka, Tomoko; Tomoda, Kiichiro ; Yamanaka, Shinya (2007-11-30). “Induction de cellules souches pluripotentes à partir de fibroblastes humains adultes par des facteurs définis” . Cellule . 131 (5): 861–872. doi : 10.1016/j.cell.2007.11.019 . ISSN 0092-8674 . PMID 18035408 . S2CID 8531539 .
- ^ Weiss, Rick (2007-12-07). “Les scientifiques guérissent les souris de la drépanocytose en utilisant la technique des cellules souches : la nouvelle approche provient de la peau, pas des embryons” . Le Washington Post . pages A02.
- ^ Hanna, J.; Wernig, M.; Markoulaki, S.; Sun, C.-W.; Meissner, A.; Cassady, JP; Beard, C.; Brambrink, T.; Wu, L.-C.; Townes, TM; En ligneJaenisch, R. (2007). “Traitement du modèle de souris d’anémie falciforme avec des cellules iPS générées à partir de peau autologue”. Sciences . 318 (5858): 1920–1923. Bibcode : 2007Sci…318.1920H . doi : 10.1126/science.1152092 . PMID 18063756 . S2CID 657569 .
- ^ Helen Briggs (2008-01-17). “Une équipe américaine fabrique des clones d’embryons d’hommes” . BBC . pages A01.
- ^ Ebert, Jessica (24 janvier 2005). “Les cellules souches humaines déclenchent une attaque immunitaire” . Nouvelles de la Nature . Londres : Groupe d’édition de la nature . doi : 10.1038/news050124-1 . Archivé de l’original le 2010-09-24 . Récupéré le 27/02/2009 .
- ^ Martin MJ, Muotri A, Gage F, Varki A (2005). “Les cellules souches embryonnaires humaines expriment un acide sialique non humain immunogène”. Nat. Méd . 11 (2): 228–232. doi : 10.1038/nm1181 . PMID 15685172 . S2CID 13739919 .
- ^ Klimanskaya I, Chung Y, Meisner L, Johnson J, West MD, Lanza R (2005). “Cellules souches embryonnaires humaines dérivées sans cellules nourricières”. Lancette . 365 (9471): 1636–1641. doi : 10.1016/S0140-6736(05)66473-2 . PMID 15885296 . S2CID 17139951 .
- ^ un bcd Kuroda , Y .; Kitada, M.; Wakao, S.; Nishikawa, K.; Tanimura, Y.; Makinoshima, H.; Goda, M.; Akashi, H.; Inutsuka, A.; Niwa, A.; Shigemoto, T.; Nabeshima, Y. ; Nakahata, T.; Nabeshima, Y.-i. ; Fujiyoshi, Y.; En ligneDezawa, M. (2010). “Cellules multipotentes uniques dans les populations de cellules mésenchymateuses humaines adultes” . Actes de l’Académie nationale des sciences . 107 (19): 8639–8643. Bibcode : 2010PNAS..107.8639K . doi : 10.1073/pnas.0911647107 . PMC 2889306 . PMID 20421459 .
- ^ “Cellules Muse | SpringerLink” .
- ^ Zikuan Leng 1 2, Dongming Sun 2, Zihao Huang 3, Iman Tadmori 2, Ning Chiang 2, Nikhit Kethidi 2, Ahmed Sabra 2, Yoshihiro Kushida 4, Yu-Show Fu 3, Mari Dezawa 4, Xijing He 1, Wise Young 2Analyse quantitative des cellules SSEA3+ du cordon ombilical humain après greffe de cellule de tri magnétique . juil. 2019;28(7):907–923.
- ^ Wakao, S.; Kitada, M.; Kuroda, Y.; Shigemoto, T.; Matsuse, D.; Akashi, H.; Tanimura, Y.; Tsuchiyama, K.; Kikuchi, T.; Goda, M.; Nakahata, T.; Fujiyoshi, Y.; En ligneDezawa, M. (2011). “Les cellules multi-différenciatrices résistantes au stress (Muse) sont une source principale de cellules souches pluripotentes induites dans les fibroblastes humains” . Actes de l’Académie nationale des sciences . 108 (24): 9875–9880. Bibcode : 2011PNAS..108.9875W . doi : 10.1073/pnas.1100816108 . PMC 3116385 . PMID 21628574 .
- ^ Dezawa, Mari (2016). “Les cellules Muse fournissent la pluripotence des cellules souches mésenchymateuses : contribution directe des cellules Muse à la régénération tissulaire” . Transplantation cellulaire . 25 (5): 849–861. doi : 10.3727/096368916X690881 . PMID 26884346 .
- ^ Hori, Emiko; Hayakawa, Yumiko; Hayashi, Tomohide; Hori, Satoshi; Okamoto, Soushi ; Shibata, Takashi; Kubo, Michiya; Horie, Yukio; Sasahara, Masakiyo; Kuroda, Satoshi (2016). “Mobilisation de cellules pluripotentes multilignées différenciatrices de stress dans l’AVC ischémique”. Journal des accidents vasculaires cérébraux et des maladies cérébrovasculaires . 25 (6): 1473-1481. doi : 10.1016/j.jstrokecerebrovasdis.2015.12.033 . PMID 27019988 .
- ^ Kuroda, Yasumasa; Wakao, Shohei ; Kitada, Masaaki; Murakami, Toru ; Nojima, Makoto; Dezawa, Mari (2013). “Isolement, culture et évaluation de cellules (Muse) endurantes au stress multilignées”. Protocoles naturels . 8 (7): 1391-1415. doi : 10.1038/nprot.2013.076 . PMID 23787896 . S2CID 28597290 . [ source médicale peu fiable ? ]
- ^ Ogura, Fumitaka; Wakao, Shohei ; Kuroda, Yasumasa; Tsuchiyama, Kenichiro; Bagheri, Mozhdeh; Heneidi, Saleh; Chazenbalk, Gregorio; Aiba, Setsuya ; Dezawa, Mari (2014). “Le tissu adipeux humain possède une population unique de cellules souches pluripotentes avec des activités non tumorigènes et à faible télomérase : implications potentielles en médecine régénérative”. Cellules souches et développement . 23 (7): 717–728. doi : 10.1089/scd.2013.0473 . PMID 24256547 .
- ^ Heneidi, Saleh; Simerman, Ariel A.; Keller, Erica; Singh, Prapti ; Li, Xinmin ; Dumesic, Daniel A.; Chazenbalk, Gregorio (2013). “Réveillé par le stress cellulaire : isolement et caractérisation d’une nouvelle population de cellules souches pluripotentes dérivées du tissu adipeux humain” . PLOS ONE . 8 (6) : e64752. Bibcode : 2013PLoSO…864752H . doi : 10.1371/journal.pone.0064752 . PMC 3673968 . PMID 23755141 .
Liens externes
| Wikimedia Commons a des médias liés aux cellules souches embryonnaires . |
- Comprendre les cellules souches : une vue de la science et des enjeux des académies nationales
- Instituts nationaux de la santé
- Atelier pratique de l’Université d’Oxford sur la technologie des cellules souches pluripotentes Archivé le 08/04/2016 à la Wayback Machine
- Fiche d’information sur les cellules souches embryonnaires
- Fiche d’information sur les questions éthiques dans la recherche sur les cellules souches embryonnaires
- Informations et alternatives à la recherche sur les cellules souches embryonnaires
- Un blog se concentrant spécifiquement sur les cellules ES et les cellules iPS, y compris la recherche, la biotechnologie et les problèmes axés sur le patient
Portails : ![]()
![]() La biologie
La biologie ![]()
![]() Médecine
Médecine