Numération globulaire complète
Une numération globulaire complète ( CBC ), également connue sous le nom de numération globulaire complète ( FBC ), est un ensemble de tests de laboratoire médical qui fournissent des informations sur les cellules du sang d’une personne . Le CBC indique le nombre de globules blancs , de globules rouges et de Plaquettes , la concentration d’ hémoglobine et l’ hématocrite (pourcentage en volume de globules rouges). Les indices de globules rouges , qui indiquent la taille moyenne et la teneur en hémoglobine des globules rouges, sont également rapportés, et unle différentiel de globules blancs , qui compte les différents types de globules blancs, peut être inclus.
| Numération globulaire complète | |
|---|---|
 Un échantillon CBC devant une impression affichant les résultats CBC et différentiels Un échantillon CBC devant une impression affichant les résultats CBC et différentiels |
|
| Synonymes | Numération globulaire complète, [1] numération globulaire complète (FBC), [2] numération globulaire complète, [3] examen sanguin complet (FBE), [2] hémogramme [4] |
| Engrener | D001772 |
| MedlinePlus | 003642 |
| LOINC | Codes pour CBC , par exemple, 57021-8 |
| HCPCS-L2 | G0306 |
Le CBC est souvent effectué dans le cadre d’une évaluation médicale et peut être utilisé pour surveiller la santé ou diagnostiquer des maladies. Les résultats sont interprétés en les comparant à des plages de référence , qui varient selon le sexe et l’âge. Des conditions telles que l’anémie et la thrombocytopénie sont définies par des résultats anormaux de numération globulaire complète. Les indices de globules rouges peuvent fournir des informations sur la cause de l’anémie d’une personne, comme une carence en fer et une carence en vitamine B12 , et les résultats du différentiel de globules blancs peuvent aider à diagnostiquer des infections virales , bactériennes et parasitaires et des troubles sanguins comme la leucémie .. Tous les résultats en dehors de la plage de référence ne nécessitent pas une intervention médicale.
Le CBC est effectué à l’aide d’un équipement de laboratoire de base ou d’un analyseur d’hématologie automatisé , qui compte les cellules et recueille des informations sur leur taille et leur structure. La concentration d’hémoglobine est mesurée et les indices de globules rouges sont calculés à partir des mesures de globules rouges et d’hémoglobine. Des tests manuels peuvent être utilisés pour confirmer indépendamment des résultats anormaux. Environ 10 à 25 % des échantillons nécessitent un examen manuel des frottis sanguins , [5] dans lequel le sang est coloré et examiné au microscope pour vérifier que les résultats de l’analyseur sont cohérents avec l’apparence des cellules et pour rechercher des anomalies. L’hématocrite peut être déterminé manuellement encentrifuger l’échantillon et mesurer la proportion de globules rouges, et dans les laboratoires sans accès à des instruments automatisés, les cellules sanguines sont comptées au microscope à l’aide d’un hémocytomètre .
En 1852, Karl Vierordt a publié la première procédure pour effectuer une numération globulaire, qui consistait à étaler un volume connu de sang sur une lame de microscope et à compter chaque cellule. L’invention de l’hémocytomètre en 1874 par Louis-Charles Malassez a simplifié l’analyse microscopique des cellules sanguines, et à la fin du XIXe siècle, Paul Ehrlich et Dmitri Leonidovich Romanowsky ont développé des techniques de coloration des globules blancs et rouges qui sont encore utilisées pour examiner les frottis sanguins. . Des méthodes automatisées de mesure de l’hémoglobine ont été développées dans les années 1920, et Maxwell Wintrobea introduit la méthode d’hématocrite Wintrobe en 1929, qui à son tour lui a permis de définir les indices de globules rouges. Le principe Coulter , qui a été breveté par Wallace H. Coulter en 1953, a fait date dans l’automatisation de la numération des cellules sanguines . Le principe Coulter utilise des mesures d’ impédance électrique pour compter les cellules sanguines et déterminer leur taille. c’est une technologie qui reste utilisée dans de nombreux analyseurs automatisés. D’autres recherches dans les années 1970 ont impliqué l’utilisation de mesures optiques pour compter et identifier les cellules, ce qui a permis l’automatisation du différentiel des globules blancs.
But

 Les cellules et les Plaquettes du sang humain. Les globules rouges , qui transportent l’oxygène, sont majoritaires et donnent la couleur du sang. Les globules blancs font partie du système immunitaire . Les Plaquettes sont nécessaires pour former des caillots , qui empêchent les saignements excessifs.
Les cellules et les Plaquettes du sang humain. Les globules rouges , qui transportent l’oxygène, sont majoritaires et donnent la couleur du sang. Les globules blancs font partie du système immunitaire . Les Plaquettes sont nécessaires pour former des caillots , qui empêchent les saignements excessifs.
Le sang est composé d’une partie liquide, appelée plasma , et d’une partie cellulaire qui contient des globules rouges , des globules blancs et des Plaquettes . [note 1] [7] La formule sanguine complète évalue les trois composants cellulaires du sang. Certaines conditions médicales, telles que l’ anémie ou la thrombocytopénie , sont définies par des augmentations ou des diminutions marquées du nombre de cellules sanguines. [8] Les changements dans de nombreux systèmes d’organes peuvent affecter le sang, de sorte que les résultats CBC sont utiles pour enquêter sur un large éventail de conditions. En raison de la quantité d’informations qu’elle fournit, la numération globulaire complète est l’une des plus couramment réalisées.tests de laboratoire médical . [9] [10] [11]
Le CBC est souvent utilisé pour dépister des maladies dans le cadre d’une évaluation médicale. [12] Il est également nécessaire lorsqu’un fournisseur de soins de santé soupçonne qu’une personne est atteinte d’une maladie qui affecte les cellules sanguines, comme une infection , un trouble de la coagulation ou certains cancers . Les personnes chez qui on a diagnostiqué des troubles pouvant entraîner des résultats anormaux de NFS ou qui reçoivent des traitements susceptibles d’affecter le nombre de cellules sanguines peuvent subir une NFS régulière pour surveiller leur état de santé, [4] [12] et le test est souvent effectué chaque jour sur les personnes hospitalisées. [13] Les résultats peuvent indiquer un besoin de transfusion de sang ou de Plaquettes. [14]
La formule sanguine complète a des applications spécifiques dans de nombreuses Spécialités médicales . Il est souvent effectué avant qu’une personne ne subisse une intervention chirurgicale pour détecter l’anémie, s’assurer que les taux de Plaquettes sont suffisants et dépister l’infection, [15] [16] ainsi qu’après l’intervention chirurgicale, afin que la Perte de sang puisse être surveillée. [12] [17] En médecine d’urgence , le CBC est utilisé pour étudier de nombreux symptômes, tels que la fièvre , les douleurs abdominales et l’ essoufflement , [18] [19] [20] et pour évaluer les saignements et les traumatismes . [21][22] Les numérations globulaires sont étroitement surveillées chez les personnes subissant une chimiothérapie ou une radiothérapie pour un cancer, car ces traitements suppriment la production de cellules sanguines dans la moelle osseuse et peuvent produire des taux très bas de globules blancs, de Plaquettes et d’ hémoglobine . [23] Les CBC réguliers sont nécessaires pour les personnes prenant certains médicaments psychiatriques , tels que la clozapine et la carbamazépine , qui, dans de rares cas, peuvent entraîner une baisse potentiellement mortelle du nombre de globules blancs ( agranulocytose ). [24] [25]Étant donné que l’anémie pendant la grossesse peut entraîner de moins bons résultats pour la mère et son bébé, la numération globulaire complète fait partie intégrante des soins prénataux ; [26] et chez les nouveau-nés , un CBC peut être nécessaire pour rechercher un ictère ou pour compter le nombre de cellules immatures dans le différentiel de globules blancs , ce qui peut être un indicateur de septicémie . [27] [28]
L’hémogramme complet est un outil essentiel de l’ hématologie , qui est l’étude de la cause, du pronostic, du traitement et de la prévention des maladies liées au sang. [29] Les résultats du CBC et de l’examen des frottis reflètent le fonctionnement du Système hématopoïétique — les organes et les tissus impliqués dans la production et le développement des cellules sanguines, en particulier la moelle osseuse . [9] [30] Par exemple, un faible nombre des trois types de cellules ( pancytopénie ) peut indiquer que la production de cellules sanguines est affectée par un trouble de la moelle, et un examen de la moelle osseuse peut en rechercher la cause. [31]Des cellules anormales sur le frottis sanguin peuvent indiquer une leucémie aiguë ou un lymphome , [30] tandis qu’un nombre anormalement élevé de neutrophiles ou de lymphocytes, associé à des symptômes indicatifs et à des résultats de frottis sanguin, peut faire suspecter un Trouble myéloprolifératif ou un Trouble lymphoprolifératif . L’examen des résultats du CBC et du frottis sanguin peut aider à distinguer les causes de l’anémie, telles que les carences nutritionnelles , les troubles de la moelle osseuse , les anémies hémolytiques acquises et les maladies héréditaires telles que la drépanocytose et la thalassémie . [32][33]
Les plages de référence pour la formule sanguine complète représentent la plage de résultats trouvés chez 95 % des personnes apparemment en bonne santé. [note 2] [35] Par définition, 5 % des résultats tomberont toujours en dehors de cette plage, de sorte que certains résultats anormaux peuvent refléter une variation naturelle plutôt que de signifier un problème médical. [36] Cela est particulièrement probable si ces résultats ne sont que légèrement en dehors de la plage de référence, s’ils sont cohérents avec les résultats précédents, ou s’il n’y a pas d’autres anomalies connexes montrées par le CBC. [37] Lorsque le test est effectué sur une population relativement en bonne santé, le nombre d’anomalies cliniquement insignifiantes peut dépasser le nombre de résultats qui représentent la maladie. [38]Pour cette raison, les organisations professionnelles aux États-Unis, au Royaume-Uni et au Canada recommandent de ne pas effectuer de test préopératoire de CBC pour les chirurgies à faible risque chez les personnes sans conditions médicales pertinentes. [15] [39] [40] Des prises de sang répétées pour des tests hématologiques chez des patients hospitalisés peuvent contribuer à l’anémie nosocomiale et entraîner des transfusions inutiles. [38]
Procédure
CBC réalisé par la méthode du bout du doigt , à l’aide d’un analyseur automatisé Abbott Cell-Dyn 1700
L’échantillon est prélevé en prélevant du sang dans un tube contenant un anticoagulant , généralement de l’EDTA , pour arrêter sa coagulation naturelle . [41] Le sang est généralement prélevé dans une veine , mais lorsque cela est difficile, il peut être prélevé dans les capillaires au moyen d’un doigt ou d’une piqûre au talon chez les bébés. [42] [43] Les tests sont généralement effectués sur un analyseur automatisé, mais des techniques manuelles telles qu’un examen de frottis sanguin ou un test d’hématocrite manuel peuvent être utilisées pour enquêter sur des résultats anormaux. [44]Les comptages cellulaires et les mesures d’hémoglobine sont effectués manuellement dans des laboratoires n’ayant pas accès à des instruments automatisés. [45]
automatique
A bord de l’analyseur, l’échantillon est agité pour répartir uniformément les cellules, puis dilué et partitionné en au moins deux canaux, dont l’un sert à compter les globules rouges et les Plaquettes, l’autre à compter les globules blancs et à déterminer la concentration en hémoglobine . Certains instruments mesurent l’hémoglobine dans un canal séparé, et des canaux supplémentaires peuvent être utilisés pour la numération différentielle des globules blancs, la numération des réticulocytes et les mesures spécialisées des Plaquettes. [46] [47] [48] Les cellules sont suspendues dans un flux de fluide et leurs propriétés sont mesurées lorsqu’elles passent devant des capteurs dans une technique connue sous le nom de cytométrie en flux . [note 3] [49] [52] Mise au point hydrodynamiquepeut être utilisé pour isoler des cellules individuelles afin d’obtenir des résultats plus précis : l’échantillon dilué est injecté dans un flux de fluide à basse pression, ce qui fait que les cellules de l’échantillon s’alignent en file indienne par flux laminaire . [53] [54]

 Analyseur d’hématologie automatisé Sysmex XT-4000i
Analyseur d’hématologie automatisé Sysmex XT-4000i 
 Le principe Coulter : la chute de courant transitoire est proportionnelle au volume des particules
Le principe Coulter : la chute de courant transitoire est proportionnelle au volume des particules
Pour mesurer la concentration d’hémoglobine, un réactif chimique est ajouté à l’échantillon pour détruire ( lyser ) les globules rouges dans un canal distinct de celui utilisé pour la numération des globules rouges. Sur les analyseurs qui effectuent la numération des globules blancs dans le même canal que la mesure de l’hémoglobine, cela permet de compter plus facilement les globules blancs. [55] Les analyseurs d’hématologie mesurent l’hémoglobine à l’aide de la spectrophotométrie et sont basés sur la relation linéaire entre l’ absorbance de la lumière et la quantité d’hémoglobine présente. Les produits chimiques sont utilisés pour convertir différentes formes d’hémoglobine, telles que l’ oxyhémoglobine et la carboxyhémoglobine, en une forme stable, généralement la cyanméthémoglobine , et pour créer un changement de couleur permanent. L’absorbance de la couleur résultante, lorsqu’elle est mesurée à une longueur d’onde spécifique – généralement 540 nanomètres – correspond à la concentration d’hémoglobine. [56] [57]
Les capteurs comptent et identifient les cellules de l’échantillon en utilisant deux grands principes : l’impédance électrique et la diffusion de la lumière . [58] Le comptage de cellules basé sur l’impédance fonctionne selon le principe de Coulter : les cellules sont suspendues dans un fluide transportant un courant électrique , et lorsqu’elles traversent une petite ouverture (une ouverture), elles provoquent des diminutions de courant en raison de leur faible conductivité électrique . L’ amplitude de l’ impulsion de tension générée lorsqu’une cellule traverse l’ouverture est en corrélation avec la quantité de fluide déplacée par la cellule, et donc le volume de la cellule, [59] [60]tandis que le nombre total d’impulsions est en corrélation avec le nombre de cellules dans l’échantillon. La distribution des volumes cellulaires est tracée sur un histogramme , et en fixant des seuils de volume basés sur les tailles typiques de chaque type de cellule, les différentes populations cellulaires peuvent être identifiées et comptées. [61]
Dans les techniques de diffusion de la lumière, la lumière d’un laser ou d’une lampe tungstène-halogène est dirigée vers le flux de cellules pour collecter des informations sur leur taille et leur structure. Les cellules diffusent la lumière à différents angles lorsqu’elles traversent le faisceau, qui est détecté à l’aide de photomètres . [62] La diffusion vers l’avant, qui fait référence à la quantité de lumière diffusée le long de l’axe du faisceau, est principalement causée par la diffraction de la lumière et est en corrélation avec la taille cellulaire, tandis que la diffusion latérale (lumière diffusée à un angle de 90 degrés) est causée par la réflexion et réfraction et fournit des informations sur la complexité cellulaire. [62] [63]
Les méthodes basées sur la radiofréquence peuvent être utilisées en combinaison avec l’impédance. Ces techniques fonctionnent sur le même principe de mesure de l’interruption du courant lorsque les cellules traversent une ouverture, mais comme le courant RF haute fréquence pénètre dans les cellules, l’amplitude de l’impulsion résultante est liée à des facteurs tels que la taille relative du noyau , la structure du noyau et la quantité de granules dans le cytoplasme . [64] [65] Les petits globules rouges et les débris cellulaires, qui sont de taille similaire aux Plaquettes, peuvent interférer avec la numération plaquettaire, et les grosses Plaquettes peuvent ne pas être comptées avec précision, de sorte que certains analyseurs utilisent des techniques supplémentaires pour mesurer les Plaquettes, telles que la fluorescence .coloration, diffusion de la lumière sous plusieurs angles et marquage d’anticorps monoclonaux . [48]
La plupart des analyseurs mesurent directement la taille moyenne des globules rouges, appelée volume globulaire moyen (MCV), et calculent l’hématocrite en multipliant le nombre de globules rouges par le MCV. Certains mesurent l’hématocrite en comparant le volume total de globules rouges au volume de sang prélevé et dérivent le MCV de l’hématocrite et du nombre de globules rouges. [66] La concentration d’hémoglobine, le nombre de globules rouges et l’hématocrite sont utilisés pour calculer la quantité moyenne d’hémoglobine dans chaque globule rouge, l’ hémoglobine corpusculaire moyenne (MCH); et sa concentration, la concentration corpusculaire moyenne d’hémoglobine (MCHC). [67] Autre calcul, lela largeur de distribution des globules rouges (RDW) est dérivée de l’ écart type du volume globulaire moyen et reflète la variation de la taille cellulaire. [68]

 Exemple de diagramme de dispersion différentiel des globules blancs : des grappes de couleurs différentes indiquent différentes populations de cellules
Exemple de diagramme de dispersion différentiel des globules blancs : des grappes de couleurs différentes indiquent différentes populations de cellules
Après avoir été traités avec des réactifs, les globules blancs forment trois pics distincts lorsque leurs volumes sont tracés sur un histogramme. Ces pics correspondent approximativement aux populations de granulocytes , de lymphocytes et d’autres cellules mononucléaires , ce qui permet d’effectuer un différentiel en trois parties basé uniquement sur le volume cellulaire. [69] [70] Des analyseurs plus avancés utilisent des techniques supplémentaires pour fournir un différentiel en cinq à sept parties, comme la diffusion de la lumière ou l’analyse par radiofréquence, [70] ou l’utilisation de colorants pour colorer des produits chimiques spécifiques à l’intérieur des cellules, par exemple, des acides nucléiques , qui se trouvent à des concentrations plus élevées dans les cellules immatures [71] ou la myéloperoxydase , uneenzyme présente dans les cellules de la lignée myéloïde . [72] [73] Les basophiles peuvent être comptés dans un canal séparé où un réactif détruit d’autres globules blancs et laisse les basophiles intacts. Les données recueillies à partir de ces mesures sont analysées et tracées sur un diagramme de dispersion , où elles forment des grappes en corrélation avec chaque type de globules blancs. [70] [72] Une autre approche pour automatiser le comptage différentiel est l’utilisation d’un logiciel de microscopie numérique, [74] qui utilise l’intelligence artificielle pour classer les globules blancs à partir de photomicrographiesdu frottis sanguin. Les images des cellules sont présentées à un opérateur humain, qui peut reclasser manuellement les cellules si nécessaire. [75]
La plupart des analyseurs prennent moins d’une minute pour exécuter tous les tests de la formule sanguine complète. [58] Parce que les analyseurs échantillonnent et comptent de nombreuses cellules individuelles, les résultats sont très précis. [76] Cependant, certaines cellules anormales peuvent ne pas être identifiées correctement, nécessitant un examen manuel des résultats de l’instrument et l’identification par d’autres moyens des cellules anormales que l’instrument n’a pas pu catégoriser. [5] [77]
Dépistage au point de service
Les tests au point de service font référence aux tests effectués en dehors du laboratoire, comme au chevet d’une personne ou dans une clinique. [78] [79] Cette méthode de test est plus rapide et utilise moins de sang que les méthodes conventionnelles, et ne nécessite pas de personnel spécialement formé, elle est donc utile dans les situations d’urgence et dans les zones où l’accès aux ressources est limité. Les appareils couramment utilisés pour les tests d’hématologie au point de service comprennent le HemoCue , un analyseur portable qui utilise la spectrophotométrie pour mesurer la concentration d’hémoglobine de l’échantillon, et le i-STAT , qui dérive une lecture d’hémoglobine en estimant la concentration de globules rouges à partir de la conductivité du sang. [79]L’hémoglobine et l’hématocrite peuvent être mesurés sur des appareils de point de service conçus pour le test des gaz du sang , mais ces mesures sont parfois mal corrélées avec celles obtenues par les méthodes standard. [78] Il existe des versions simplifiées d’analyseurs d’hématologie conçus pour être utilisés dans les cliniques qui peuvent fournir une numération globulaire complète et différentielle. [80]
Manuel
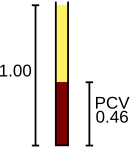
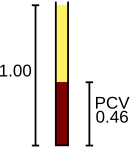 Détermination manuelle de l’hématocrite. Le sang a été centrifugé, le séparant en globules rouges et en plasma.
Détermination manuelle de l’hématocrite. Le sang a été centrifugé, le séparant en globules rouges et en plasma.
Les tests peuvent être effectués manuellement lorsque l’équipement automatisé n’est pas disponible ou lorsque les résultats de l’analyseur indiquent qu’une enquête plus approfondie est nécessaire. [45] Les résultats automatisés sont signalés pour l’examen manuel des frottis sanguins dans 10 à 25 % des cas, ce qui peut être dû à des populations de cellules anormales que l’analyseur ne peut pas compter correctement, [5] des signaux internes générés par l’analyseur qui suggèrent que les résultats pourraient être des résultats inexacts, [81] ou numériques en dehors des seuils fixés. [77] Pour enquêter sur ces questions, le sang est étalé sur une lame de microscope, coloré avec une tache de Romanowsky et examiné au microscope . [82]L’apparence des globules rouges et blancs et des Plaquettes est évaluée et des anomalies qualitatives sont signalées si elles sont présentes. [83] Les changements dans l’apparence des globules rouges peuvent avoir une signification diagnostique considérable – par exemple, la présence de cellules falciformes indique une drépanocytose , et un nombre élevé de globules rouges fragmentés ( schizocytes ) nécessite une enquête urgente car il peut suggèrent une anémie hémolytique microangiopathique . [84] Dans certaines conditions inflammatoires et dans les troubles paraprotéiques comme le myélome multiple , des niveaux élevés de protéines dans le sang peuvent faire apparaître des globules rouges empilés sur le frottis, ce qui est appelérouleaux . [85] Certaines maladies parasitaires , telles que le paludisme et la babésiose , peuvent être détectées en trouvant les organismes responsables sur le frottis sanguin, [86] et la numération plaquettaire peut être estimée à partir du frottis sanguin, ce qui est utile si la numération plaquettaire automatisée est inexacte. [77]
Pour effectuer un différentiel manuel des globules blancs, le microscopiste compte 100 cellules sur le frottis sanguin et les classe en fonction de leur apparence ; parfois 200 cellules sont comptées. [87] Cela donne le pourcentage de chaque type de globules blancs, et en multipliant ces pourcentages par le nombre total de globules blancs, le nombre absolu de chaque type de globules blancs peut être obtenu. [88] Le comptage manuel est sujet à une erreur d’échantillonnage car si peu de cellules sont comptées par rapport à l’analyse automatisée, [76] mais il peut identifier des cellules anormales que les analyseurs ne peuvent pas, [72] [77] telles que les cellules blastiques observées dans la leucémie aiguë. [89]Des caractéristiques cliniquement significatives telles que la granulation toxique et la vacuolisation peuvent également être déterminées à partir d’un examen microscopique des globules blancs. [90]
L’hématocrite peut être effectué manuellement en remplissant un tube capillaire de sang, en le centrifugant et en mesurant le pourcentage de sang constitué de globules rouges. [66] Ceci est utile dans certaines conditions qui peuvent entraîner des résultats d’hématocrite automatisés incorrects, comme la polycythémie (un nombre de globules rouges très élevé) [66] ou une leucocytose sévère (un nombre de globules blancs très élevé, qui interfère avec le rouge mesures des globules sanguins en faisant compter les globules blancs comme des globules rouges). [91]



 À gauche : un hémocytomètre Fuchs-Rosenthal modifié . À droite : Vue à travers le microscope de l’hémocytomètre. La grille intégrée aide à garder une trace des cellules qui ont été comptées.
À gauche : un hémocytomètre Fuchs-Rosenthal modifié . À droite : Vue à travers le microscope de l’hémocytomètre. La grille intégrée aide à garder une trace des cellules qui ont été comptées.
Les globules rouges et blancs et les Plaquettes peuvent être comptés à l’aide d’un hémocytomètre , une lame de microscope contenant une chambre qui contient un volume spécifié de sang dilué. La chambre de l’hémocytomètre est gravée avec une grille calibrée pour faciliter le comptage des cellules. Les cellules vues dans la grille sont comptées et divisées par le volume de sang examiné, qui est déterminé à partir du nombre de carrés comptés sur la grille, pour obtenir la concentration de cellules dans l’échantillon. [45] [92] Les comptages cellulaires manuels demandent beaucoup de travail et sont inexacts par rapport aux méthodes automatisées, de sorte qu’ils sont rarement utilisés, sauf dans les laboratoires qui n’ont pas accès à des analyseurs automatisés. [45] [92]Pour compter les globules blancs, l’échantillon est dilué à l’aide d’un liquide contenant un composé qui lyse les globules rouges, comme l’oxalate d’ammonium , l’acide acétique ou l’acide chlorhydrique . [93] Parfois, une tache est ajoutée au diluant qui met en évidence les noyaux des globules blancs, ce qui les rend plus faciles à identifier. La numération plaquettaire manuelle est effectuée de la même manière, bien que certaines méthodes laissent les globules rouges intacts. L’utilisation d’un microscope à contraste de phase , plutôt qu’un microscope optique , peut faciliter l’identification des Plaquettes. [94]La numération manuelle des globules rouges est rarement effectuée, car elle est imprécise et d’autres méthodes telles que l’hémoglobinométrie et l’hématocrite manuel sont disponibles pour évaluer les globules rouges; mais s’il est nécessaire de le faire, les globules rouges peuvent être comptés dans le sang dilué avec une solution saline. [95]
L’hémoglobine peut être mesurée manuellement à l’aide d’un spectrophotomètre ou d’un colorimètre . Pour mesurer l’hémoglobine manuellement, l’échantillon est dilué à l’aide de réactifs qui détruisent les globules rouges pour libérer l’hémoglobine. D’autres produits chimiques sont utilisés pour convertir différents types d’hémoglobine en une seule forme, ce qui permet de la mesurer facilement. La solution est ensuite placée dans une cuvette de mesure et l’absorbance est mesurée à une longueur d’onde spécifique, qui dépend du type de réactif utilisé. Un étalon de référence contenant une quantité connue d’hémoglobine est utilisé pour déterminer la relation entre l’absorbance et la concentration d’hémoglobine, permettant de mesurer le taux d’hémoglobine de l’échantillon. [96]
Dans les zones rurales et économiquement défavorisées, les tests disponibles sont limités par l’accès à l’équipement et au personnel. Dans les établissements de soins primaires de ces régions, les tests peuvent se limiter à l’examen de la morphologie des globules rouges et à la mesure manuelle de l’hémoglobine, tandis que des techniques plus complexes telles que la numération et les différentiels cellulaires manuels, et parfois la numération cellulaire automatisée, sont effectuées dans les laboratoires de district. Les hôpitaux régionaux et provinciaux et les centres universitaires ont généralement accès à des analyseurs automatisés. Lorsque les installations de laboratoire ne sont pas disponibles, une estimation de la concentration d’hémoglobine peut être obtenue en plaçant une goutte de sang sur un type standard de papier absorbant et en la comparant à une échelle de couleurs. [97]
Contrôle de qualité
Les analyseurs automatisés doivent être régulièrement calibrés . La plupart des fabricants fournissent du sang conservé avec des paramètres définis et les analyseurs sont ajustés si les résultats sont en dehors des seuils définis. [98] Pour s’assurer que les résultats continuent d’être exacts, les échantillons de contrôle de la qualité, qui sont généralement fournis par le fabricant de l’instrument, sont testés au moins une fois par jour. Les échantillons sont formulés pour fournir des résultats spécifiques, et les laboratoires comparent leurs résultats aux valeurs connues pour s’assurer que l’instrument fonctionne correctement. [99] [100] Pour les laboratoires n’ayant pas accès à du matériel de contrôle qualité commercial, un organisme de réglementation indien recommande de faire passer des échantillons de patients en double et de comparer les résultats. [101]Une mesure de moyenne mobile , dans laquelle les résultats moyens pour les échantillons de patients sont mesurés à des intervalles définis, peut être utilisée comme technique de contrôle qualité supplémentaire. En supposant que les caractéristiques de la population de patients restent à peu près les mêmes au fil du temps, la moyenne devrait rester constante ; de grands décalages dans la valeur moyenne peuvent indiquer des problèmes d’instrument. [99] [100] Les valeurs MCHC sont particulièrement utiles à cet égard. [102]
En plus d’analyser des échantillons de contrôle de qualité interne avec des résultats connus, les laboratoires peuvent recevoir des échantillons d’ évaluation de qualité externe d’organismes de réglementation. Alors que le but du contrôle qualité interne est de s’assurer que les résultats de l’analyseur sont reproductibles dans un laboratoire donné, l’évaluation qualité externe vérifie que les résultats des différents laboratoires sont cohérents entre eux et avec les valeurs cibles. [103] Les résultats attendus pour les échantillons d’évaluation externe de la qualité ne sont pas divulgués au laboratoire. [104] Les programmes d’évaluation externe de la qualité ont été largement adoptés en Amérique du Nord et en Europe occidentale, [99]et les laboratoires sont souvent tenus de participer à ces programmes pour conserver leur accréditation . [105] Des problèmes logistiques peuvent compliquer la mise en œuvre de programmes d’évaluation externe de la qualité pour les laboratoires situés dans des zones défavorisées. [106]
Essais inclus
Le CBC mesure les quantités de Plaquettes et de globules rouges et blancs, ainsi que les valeurs d’hémoglobine et d’hématocrite. Les indices de globules rouges – MCV, MCH et MCHC – qui décrivent la taille des globules rouges et leur teneur en hémoglobine, sont rapportés avec la largeur de distribution des globules rouges (RDW), qui mesure la quantité de variation dans la taille des globules rouges cellules. Un différentiel de globules blancs, qui énumère les différents types de globules blancs, peut être effectué, et une numération des globules rouges immatures (réticulocytes) est parfois incluse. [4] [107]
Globules rouges, hémoglobine et hématocrite
| Analyte | Résultat | Plage normale |
|---|---|---|
| nombre de globules rouges | 5,5 x 10 12 /L | 4,5–5,7 |
| Numération des globules blancs | 9,8 x 10 9 /L | 4,0–10,0 |
| Hémoglobine | 123g/L | 133–167 |
| Hématocrite | 0,42 | 0,35–0,53 |
| MCV | 76 FL | 77–98 |
| L’HME | 22,4 pages | 26–33 |
| MCHC | 293g/L | 330–370 |
| RDW | 14,5 % | 10.3–15.3 |
Un exemple de résultats CBC montrant une faible hémoglobine, un volume moyen de globules rouges (MCV), une hémoglobine moyenne des globules rouges (MCH) et une teneur moyenne en hémoglobine des globules rouges (MCHC). La personne était anémique. La cause pourrait être une carence en fer ou une hémoglobinopathie . [108]
Les globules rouges transportent l’ oxygène des poumons vers les tissus et, à leur retour , ramènent le dioxyde de carbone vers les poumons où il est expiré. Ces fonctions sont médiées par l’hémoglobine des cellules. [109] L’analyseur compte les globules rouges, rapporte le résultat en unités de 10 6 cellules par microlitre de sang (× 10 6 /μL) ou 10 12 cellules par litre (× 10 12 /L), et mesure leur taille moyenne, qui est appelé volume cellulaire moyen et exprimé en femtolitres ou micromètres cubes. [4]En multipliant le volume globulaire moyen par le nombre de globules rouges, l’hématocrite (HCT) ou l’hématocrite (PCV), une mesure du pourcentage de sang composé de globules rouges, peut être obtenue ; [66] et lorsque l’hématocrite est effectué directement, le volume cellulaire moyen peut être calculé à partir de l’hématocrite et du nombre de globules rouges. [110] [111] L’hémoglobine, mesurée après la lyse des globules rouges, est généralement rapportée en unités de grammes par litre (g/L) ou de grammes par décilitre (g/dL). [112]En supposant que les globules rouges sont normaux, il existe une relation constante entre l’hémoglobine et l’hématocrite : le pourcentage d’hématocrite est environ trois fois supérieur à la valeur d’hémoglobine en g/dL, plus ou moins trois. Cette relation, appelée la règle de trois , peut être utilisée pour confirmer que les résultats CBC sont corrects. [113]
Deux autres mesures sont calculées à partir du nombre de globules rouges, de la concentration en hémoglobine et de l’hématocrite : l’ hémoglobine corpusculaire moyenne et la concentration en hémoglobine corpusculaire moyenne . [114] [115] Ces paramètres décrivent la teneur en hémoglobine de chaque globule rouge. Le MCH et le MCHC peuvent prêter à confusion; Essentiellement, le MCH est une mesure de la quantité moyenne d’hémoglobine par globule rouge. Le MCHC donne la proportion moyenne de la cellule qui est l’hémoglobine. Le MCH ne tient pas compte de la taille des globules rouges alors que le MCHC le fait. [116] Collectivement, le MCV, le MCH et le MCHC sont appelés les indices de globules rouges . [114] [115]Des modifications de ces indices sont visibles sur le frottis sanguin : les globules rouges anormalement gros ou petits peuvent être identifiés par rapport à la taille des globules blancs, et les cellules à faible concentration en hémoglobine apparaissent pâles. [117] Un autre paramètre est calculé à partir des mesures initiales des globules rouges : la largeur de distribution des globules rouges ou RDW, qui reflète le degré de variation de la taille des cellules. [118]

 Frottis sanguin d’une personne atteinte d’anémie ferriprive , présentant une morphologie caractéristique des globules rouges. Les globules rouges sont anormalement petits ( microcytose ), ont de grandes zones de pâleur centrale ( hypochromie ) et varient considérablement en taille ( anisocytose ).
Frottis sanguin d’une personne atteinte d’anémie ferriprive , présentant une morphologie caractéristique des globules rouges. Les globules rouges sont anormalement petits ( microcytose ), ont de grandes zones de pâleur centrale ( hypochromie ) et varient considérablement en taille ( anisocytose ).
Une hémoglobine, un hématocrite ou un nombre de globules rouges anormalement bas indique une anémie. [119] L’anémie n’est pas un diagnostic en soi, mais elle indique une condition sous-jacente affectant les globules rouges de la personne. [88] Les causes générales de l’anémie comprennent la Perte de sang, la production de globules rouges défectueux ( érythropoïèse inefficace ), la diminution de la production de globules rouges (érythropoïèse insuffisante) et la destruction accrue des globules rouges ( anémie hémolytique ). [120] L’anémie réduit la capacité du sang à transporter l’oxygène, provoquant des symptômes comme la fatigue et l’essoufflement. [121]Si le taux d’hémoglobine tombe en dessous des seuils basés sur l’état clinique de la personne, une transfusion sanguine peut être nécessaire. [122]
Une augmentation du nombre de globules rouges, qui entraîne généralement une augmentation de l’hémoglobine et de l’hématocrite, [note 4] est appelée polycythémie . [126] La déshydratation ou l’utilisation de diurétiques peuvent provoquer une polyglobulie « relative » en diminuant la quantité de plasma par rapport aux globules rouges. Une véritable augmentation du nombre de globules rouges, appelée polycythémie absolue, peut se produire lorsque le corps produit plus de globules rouges pour compenser les faibles niveaux d’oxygène chroniques dans des conditions telles que les maladies pulmonaires ou cardiaques , ou lorsqu’une personne a des niveaux anormalement élevés d’ érythropoïétine . (EPO), une hormone qui stimule la production de globules rouges. Danspolycythémie vraie , la moelle osseuse produit des globules rouges et d’autres cellules sanguines à un rythme excessivement élevé. [127]
L’évaluation des indices de globules rouges est utile pour déterminer la cause de l’anémie. Si le VGM est bas, l’anémie est appelée microcytaire , tandis que l’anémie avec un VGM élevé est appelée anémie macrocytaire . L’anémie avec un MCHC bas est appelée anémie hypochrome . Si une anémie est présente mais que les indices érythrocytaires sont normaux, l’anémie est considérée comme normochrome et normocytaire . [117] Le terme hyperchromie , faisant référence à un MCHC élevé, n’est généralement pas utilisé. L’élévation du MCHC au-dessus de la valeur de référence supérieure est rare, survenant principalement dans des conditions telles que la sphérocytose , la drépanocytose et la maladie de l’hémoglobine C .[115] [128] Un MCHC élevé peut également être un faux résultat de conditions telles que l’agglutination des globules rouges (qui provoque une fausse diminution du nombre de globules rouges, élevant le MCHC) [129] [130] ou des quantités très élevées de lipides dans le sang (ce qui provoque une fausse augmentation du résultat d’hémoglobine). [128] [131]
L’anémie microcytaire est généralement associée à une carence en fer, à la thalassémie et à l’anémie des maladies chroniques , tandis que l’anémie macrocytaire est associée à l’alcoolisme , à une carence en folate et en B12 , à l’utilisation de certains médicaments et à certaines maladies de la moelle osseuse. Une Perte de sang aiguë, une anémie hémolytique, des troubles de la moelle osseuse et diverses maladies chroniques peuvent entraîner une anémie avec une image sanguine normocytaire. [115] [132] Le MCV sert un objectif supplémentaire dans le contrôle de la qualité en laboratoire. Il est relativement stable dans le temps par rapport aux autres paramètres CBC, de sorte qu’un changement important du MCV peut indiquer que l’échantillon a été prélevé sur le mauvais patient. [133]
Un RDW faible n’a aucune signification clinique, mais un RDW élevé représente une variation accrue de la taille des globules rouges, une condition connue sous le nom d’ anisocytose . [118] L’anisocytose est courante dans les anémies nutritionnelles telles que l’anémie ferriprive et l’anémie due à une carence en vitamine B12 ou en folate, tandis que les personnes atteintes de thalassémie peuvent avoir un RDW normal. [118] Sur la base des résultats du CBC, d’autres mesures peuvent être prises pour enquêter sur l’anémie, comme un test de ferritine pour confirmer la présence d’une carence en fer, ou une électrophorèse de l’hémoglobine pour diagnostiquer une hémoglobinopathie comme la thalassémie ou la drépanocytose. [134]
globules blancs
|
|
Le nombre de globules blancs et de Plaquettes est nettement augmenté et une anémie est présente. La numération différentielle montre une basophilie et la présence de neutrophiles en bande , de granulocytes immatures et de cellules blastiques . [135]
Les globules blancs défendent contre les infections et sont impliqués dans la réponse inflammatoire . [136] Un nombre élevé de globules blancs, appelé leucocytose, survient souvent dans les infections, l’inflammation et les états de stress physiologique . Elle peut également être causée par des maladies qui impliquent une production anormale de cellules sanguines, telles que les troubles myéloprolifératifs et lymphoprolifératifs . [137] Une diminution du nombre de globules blancs, appelée leucopénie , peut entraîner un risque accru de contracter des infections, [138] et se produit dans des traitements comme la chimiothérapie et la radiothérapie et de nombreuses conditions qui inhibent la production de cellules sanguines.[139] La septicémie est associée à la fois à une leucocytose et à une leucopénie. [140] Le nombre total de globules blancs est généralement exprimé en cellules par microlitre de sang (/μL) ou en 10 9 cellules par litre (× 10 9 /L). [4]
Dans le différentiel de globules blancs, les différents types de globules blancs sont identifiés et comptés. Les résultats sont rapportés en pourcentage et en nombre absolu par unité de volume. Cinq types de globules blancs ( neutrophiles , lymphocytes , monocytes , éosinophiles et basophiles ) sont généralement mesurés. [141] Certains instruments rapportent le nombre de granulocytes immatures, qui est une classification consistant en des précurseurs de neutrophiles ; spécifiquement, les promyélocytes , les myélocytes et les métamyélocytes . [note 5] [144]D’autres types de cellules sont signalés s’ils sont identifiés dans le différentiel manuel. [145]
Les résultats différentiels sont utiles pour diagnostiquer et surveiller de nombreuses conditions médicales. Par exemple, un nombre élevé de neutrophiles ( neutrophilie ) est associé à une Infection bactérienne, une inflammation et des troubles myéloprolifératifs, [146] [147] tandis qu’une diminution du nombre ( neutropénie ) peut survenir chez les personnes qui subissent une chimiothérapie ou prennent certains médicaments, ou qui ont des maladies affectant la moelle osseuse. [148] [149] La neutropénie peut également être causée par certains troubles congénitaux et peut survenir de manière transitoire après des infections virales ou bactériennes chez les enfants. [150]Les personnes atteintes de neutropénie sévère et de signes cliniques d’infection sont traitées avec des antibiotiques pour prévenir une maladie potentiellement mortelle. [151]


Un nombre accru de neutrophiles à bande – jeunes neutrophiles dépourvus de noyaux segmentés – ou de granulocytes immatures est appelé décalage vers la gauche et se produit dans la septicémie et certains troubles sanguins, mais est normal pendant la grossesse. [152] [153] Un nombre élevé de lymphocytes ( lymphocytose ) est associé à une Infection virale [6] et à des troubles lymphoprolifératifs comme la leucémie lymphoïde chronique ; [154] un nombre élevé de monocytes ( monocytose ) est associé à des états inflammatoires chroniques ; [155] et le nombre d’éosinophiles est souvent augmenté ( éosinophilie) dans les infections parasitaires et les états allergiques. [156] Un nombre accru de basophiles, appelés basophilie , peut survenir dans les troubles myéloprolifératifs comme la leucémie myéloïde chronique et la polycythémie vraie. [147] La présence de certains types de cellules anormales, telles que des cellules blastiques ou des lymphocytes présentant des caractéristiques néoplasiques , est évocatrice d’une hémopathie maligne . [89] [157]
Plaquettes
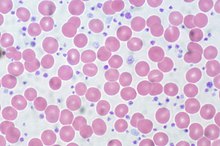
 Frottis sanguin de thrombocytémie essentielle . Les Plaquettes sont visibles sous forme de petites structures violettes.
Frottis sanguin de thrombocytémie essentielle . Les Plaquettes sont visibles sous forme de petites structures violettes.
Les Plaquettes jouent un rôle essentiel dans la coagulation. Lorsque la paroi d’un vaisseau sanguin est endommagée, les Plaquettes adhèrent à la surface exposée sur le site de la blessure et bouchent l’espace. L’activation simultanée de la cascade de coagulation entraîne la formation de fibrine , qui renforce le bouchon plaquettaire pour créer un caillot stable . [158] Une faible numération plaquettaire, connue sous le nom de thrombocytopénie, peut provoquer des saignements si elle est grave. [159]Elle peut survenir chez les personnes qui subissent des traitements qui suppriment la moelle osseuse, comme la chimiothérapie ou la radiothérapie, ou qui prennent certains médicaments, comme l’héparine, qui peuvent inciter le système immunitaire à détruire les Plaquettes. La thrombocytopénie est une caractéristique de nombreux troubles sanguins, comme la leucémie aiguë et l’anémie aplasique , ainsi que certaines maladies auto-immunes . [160] [161] Si le nombre de Plaquettes est extrêmement faible, une transfusion de Plaquettes peut être effectuée. [162] La thrombocytose , c’est-à-dire une numération plaquettaire élevée, peut survenir dans des états d’inflammation ou de traumatisme, [163] ainsi qu’en cas de carence en fer, [164]et la numération plaquettaire peut atteindre des niveaux exceptionnellement élevés chez les personnes atteintes de thrombocytémie essentielle , une maladie sanguine rare. [163] La numération plaquettaire peut être rapportée en unités de cellules par microlitre de sang (/μL), [165] 10 3 cellules par microlitre (× 10 3 /μL) ou 10 9 cellules par litre (× 10 9 /L ). [4]
Le volume plaquettaire moyen (MPV) mesure la taille moyenne des Plaquettes en femtolitres. Il peut aider à déterminer la cause de la thrombocytopénie ; un MPV élevé peut survenir lorsque de jeunes Plaquettes sont libérées dans la circulation sanguine pour compenser la destruction accrue des Plaquettes, tandis qu’une diminution de la production de Plaquettes due à un dysfonctionnement de la moelle osseuse peut entraîner un faible MPV. Le MPV est également utile pour différencier les maladies congénitales qui provoquent une thrombocytopénie. [118] [166] La fraction plaquettaire immature (IPF) ou la numération plaquettaire réticulée est rapportée par certains analyseurs et fournit des informations sur le taux de production de Plaquettes en mesurant le nombre de Plaquettes immatures dans le sang. [167]
Autres tests
Numération des réticulocytes 
 Globules rouges colorés au nouveau bleu de méthylène : les cellules contenant des structures bleu foncé sont des réticulocytes.
Globules rouges colorés au nouveau bleu de méthylène : les cellules contenant des structures bleu foncé sont des réticulocytes.
Les réticulocytes sont des globules rouges immatures qui, contrairement aux cellules matures, contiennent de l’ARN . Une numération des réticulocytes est parfois effectuée dans le cadre d’une numération globulaire complète, généralement pour rechercher la cause de l’anémie d’une personne ou évaluer sa réponse au traitement. L’anémie avec un nombre élevé de réticulocytes peut indiquer que la moelle osseuse produit des globules rouges à un taux plus élevé pour compenser la Perte de sang ou l’hémolyse, [74] tandis que l’anémie avec un faible nombre de réticulocytes peut suggérer que la personne a une condition qui réduit le capacité du corps à produire des globules rouges. [168]Lorsque les personnes atteintes d’anémie nutritionnelle reçoivent une supplémentation en nutriments, une augmentation du nombre de réticulocytes indique que leur corps réagit au traitement en produisant plus de globules rouges. [169] Les analyseurs d’hématologie effectuent le comptage des réticulocytes en colorant les globules rouges avec un colorant qui se lie à l’ARN et en mesurant le nombre de réticulocytes par diffusion de la lumière ou analyse de fluorescence. Le test peut être effectué manuellement en colorant le sang avec du nouveau bleu de méthylène et en comptant le pourcentage de globules rouges contenant de l’ARN au microscope. Le nombre de réticulocytes est exprimé en nombre absolu [168] ou en pourcentage de globules rouges. [170]
Certains instruments mesurent la quantité moyenne d’hémoglobine dans chaque réticulocyte ; un paramètre qui a été étudié comme indicateur de carence en fer chez les personnes qui ont des conditions qui interfèrent avec les tests standard. [171] La fraction de réticulocytes immatures (IRF) est une autre mesure produite par certains analyseurs qui quantifie la maturité des réticulocytes : les cellules moins matures contiennent plus d’ARN et produisent ainsi un signal fluorescent plus fort. Ces informations peuvent être utiles pour diagnostiquer les anémies et évaluer la production de globules rouges après un traitement contre l’anémie ou une greffe de moelle osseuse . [172]
Globules rouges nucléés
Au cours de leur formation dans la moelle osseuse, ainsi que dans le foie et la rate chez les fœtus, [173] les globules rouges contiennent un noyau cellulaire, qui est généralement absent des cellules matures qui circulent dans la circulation sanguine. [174] Lorsqu’elle est détectée, la présence de globules rouges nucléés, en particulier chez les enfants et les adultes, indique une demande accrue de globules rouges, qui peut être causée par des saignements, certains cancers et l’anémie. [118] La plupart des analyseurs peuvent détecter ces cellules dans le cadre du comptage cellulaire différentiel. Un nombre élevé de globules rouges nucléés peut entraîner un nombre de globules blancs faussement élevé, ce qui nécessitera un ajustement. [175]
Autres paramètres
Les analyseurs d’hématologie avancés génèrent de nouvelles mesures des cellules sanguines qui ont montré une importance diagnostique dans les études de recherche, mais n’ont pas encore trouvé d’utilisation clinique généralisée. [171] Par exemple, certains types d’analyseurs produisent des lectures de coordonnées indiquant la taille et la position de chaque groupe de globules blancs. Ces paramètres (appelés données de population cellulaire) [176] ont été étudiés en tant que marqueurs potentiels des troubles sanguins, des infections bactériennes et du paludisme. Les analyseurs qui utilisent la coloration à la myéloperoxydase pour produire des numérations différentielles peuvent mesurer l’expression de l’enzyme par les globules blancs, qui est altérée dans divers troubles. [75]Certains instruments peuvent rapporter le pourcentage de globules rouges hypochromes en plus de rapporter la valeur moyenne de la MCHC, ou fournir un nombre de globules rouges fragmentés ( schizocytes ), [171] qui se produisent dans certains types d’anémie hémolytique. [177] Étant donné que ces paramètres sont souvent spécifiques à des marques particulières d’analyseurs, il est difficile pour les laboratoires d’interpréter et de comparer les résultats. [171]
Plages de référence
| Test | Unités | Adulte | Pédiatrique
(4–7 ans) |
Nouveau-né
(0-1 jours) |
|---|---|---|---|---|
| GB | × 10 9 /L | 3,6–10,6 | 5,0–17,0 | 9.0–37.0 |
| RBC | × 10 12 /L |
|
16h00–17h20 | 4.10–6.10 |
| HGB | g/l |
|
102–152 | 165–215 |
| HCT | LL |
|
0,36–0,46 | 0,48–0,68 |
| MCV | FL | 80–100 | 78–94 | 95–125 |
| L’HME | page | 26–34 | 23–31 | 30–42 |
| MCHC | g/l | 320–360 | 320–360 | 300–340 |
| RDW | % | 11,5–14,5 | 11,5–14,5 | élevé [note 6] |
| PLT | × 10 9 /L | 150–450 | 150–450 | 150–450 |
| Neutrophiles | × 10 9 /L | 1,7–7,5 | 1,5–11,0 | 3,7–30,0 |
| Lymphocytes | × 10 9 /L | 1.0–3.2 | 1.5–11.1 | 1.6–14.1 |
| Monocytes | × 10 9 /L | 0,1–1,3 | 0,1–1,9 | 0,1–4,4 |
| Éosinophiles | × 10 9 /L | 0,0–0,3 | 0,0–0,7 | 0,0–1,5 |
| Basophiles | × 10 9 /L | 0,0–0,2 | 0,0–0,3 | 0,0–0,7 |
La formule sanguine complète est interprétée en comparant la sortie aux plages de référence, qui représentent les résultats trouvés chez 95 % des personnes apparemment en bonne santé. [35] Sur la base d’une distribution statistique normale , les fourchettes des échantillons testés varient selon le sexe et l’âge. En moyenne, les femmes adultes ont des valeurs d’hémoglobine, d’hématocrite et de numération des globules rouges inférieures à celles des hommes; la différence diminue, mais est toujours présente, après la ménopause . [179]
Le sang des nouveau-nés est très différent de celui des enfants plus âgés, qui est encore différent du sang des adultes. L’hémoglobine, l’hématocrite et le nombre de globules rouges des nouveau-nés sont extrêmement élevés pour compenser les faibles niveaux d’oxygène dans l’utérus, et ils ont une forte proportion d’ hémoglobine fœtale , qui est moins efficace pour fournir de l’oxygène aux tissus que les formes matures d’hémoglobine, à l’intérieur leurs globules rouges. [180] [181] Le MCV est également augmenté et le nombre de globules blancs est élevé avec une prépondérance de neutrophiles. [180] [182] Le nombre de globules rouges et les valeurs associées commencent à décliner peu de temps après la naissance, atteignant leur point le plus bas vers l’âge de deux mois et augmentant par la suite. [183][184] Les globules rouges des nourrissons plus âgés et des enfants sont plus petits, avec un MCH inférieur, que ceux des adultes. Dans le différentiel des globules blancs pédiatriques, les lymphocytes sont souvent plus nombreux que les neutrophiles, tandis que chez les adultes, les neutrophiles prédominent. [180]
D’autres différences entre les populations peuvent affecter les plages de référence : par exemple, les personnes vivant à des altitudes plus élevées ont des résultats d’hémoglobine, d’hématocrite et de globules rouges plus élevés, et les personnes d’origine africaine ont en moyenne un nombre de globules blancs inférieur. [185] Le type d’analyseur utilisé pour exécuter le CBC affecte également les plages de référence. Les plages de référence sont donc établies par des laboratoires individuels en fonction de leurs propres populations de patients et équipements. [186] [187]
Limites
Certaines conditions médicales ou problèmes avec l’échantillon de sang peuvent produire des résultats inexacts. Si l’échantillon est visiblement coagulé, ce qui peut être causé par une mauvaise technique de phlébotomie , il ne convient pas au test, car le nombre de Plaquettes sera faussement diminué et d’autres résultats peuvent être anormaux. [188] [189] Les échantillons conservés à température ambiante pendant plusieurs heures peuvent donner des lectures faussement élevées pour le MCV, [190] parce que les globules rouges gonflent lorsqu’ils absorbent l’eau du plasma; et les résultats différentiels des Plaquettes et des globules blancs peuvent être inexacts dans les échantillons âgés, car les cellules se dégradent avec le temps. [91]

 Agglutination des globules rouges : des amas de globules rouges sont visibles sur le frottis sanguin
Agglutination des globules rouges : des amas de globules rouges sont visibles sur le frottis sanguin
Les échantillons prélevés sur des individus présentant des taux très élevés de bilirubine ou de lipides dans leur plasma (appelés échantillon ictérique ou échantillon lipémique, respectivement) [191] peuvent présenter des lectures faussement élevées pour l’hémoglobine, car ces substances modifient la couleur et l’opacité du échantillon, ce qui interfère avec la mesure de l’hémoglobine. [192] Cet effet peut être atténué en remplaçant le plasma par une solution saline. [91]
Certaines personnes produisent un anticorps qui provoque la formation d’amas de leurs Plaquettes lorsque leur sang est prélevé dans des tubes contenant de l’EDTA, l’anticoagulant généralement utilisé pour prélever des échantillons de CBC. Les amas de Plaquettes peuvent être comptés comme des Plaquettes uniques par des analyseurs automatisés, ce qui entraîne une fausse numération plaquettaire. Ceci peut être évité en utilisant un anticoagulant alternatif tel que le citrate de sodium ou l’ héparine . [193]
L’agglutination des globules rouges est une autre condition médiée par les anticorps qui peut affecter les résultats de la formule sanguine complète . Ce phénomène provoque l’agglutination des globules rouges à cause des anticorps liés à la surface des cellules. [194] Les agrégats de globules rouges sont comptés comme des cellules individuelles par l’analyseur, ce qui entraîne une diminution marquée du nombre de globules rouges et de l’hématocrite, ainsi qu’une augmentation marquée du MCV et du MCHC. [53] Souvent, ces anticorps ne sont actifs qu’à température ambiante (auquel cas ils sont appelés agglutinines froides ), et l’agglutination peut être inversée en chauffant l’échantillon à 37 °C (99 °F). Échantillons de personnes atteintes d’anémie hémolytique auto-immune chaudepeut présenter une agglutination des globules rouges qui ne se résout pas au réchauffement. [130]
Bien que les cellules blastiques et lymphomateuses puissent être identifiées dans le différentiel manuel, l’examen microscopique ne peut pas déterminer de manière fiable la lignée hématopoïétique des cellules . Ces informations sont souvent nécessaires pour diagnostiquer les cancers du sang. Une fois les cellules anormales identifiées, des techniques supplémentaires telles que l’ immunophénotypage par cytométrie en flux peuvent être utilisées pour identifier des marqueurs qui fournissent des informations supplémentaires sur les cellules. [195] [196]
Histoire

 Un hémoglobinomètre précoce : les échantillons de sang étaient comparés à un nuancier de normes de référence pour déterminer le taux d’hémoglobine. [197]
Un hémoglobinomètre précoce : les échantillons de sang étaient comparés à un nuancier de normes de référence pour déterminer le taux d’hémoglobine. [197]
Avant l’introduction des compteurs de cellules automatisés, des tests de numération globulaire complets étaient effectués manuellement : les globules blancs et rouges et les Plaquettes étaient comptés à l’aide de microscopes. [198] La première personne à publier des observations microscopiques de cellules sanguines fut Antonie van Leeuwenhoek , [199] qui rapporta l’apparition de globules rouges dans une lettre de 1674 aux Actes de la Royal Society of London . [200] Jan Swammerdam avait décrit les globules rouges quelques années plus tôt, mais n’avait pas publié ses découvertes à l’époque. Au cours des 18e et 19e siècles, les améliorations de la technologie des microscopes, telles que les lentilles achromatiques , ont permis aux globules blancs et aux Plaquettesà compter dans les échantillons non colorés. [201]
Le physiologiste Karl Vierordt est crédité d’avoir effectué la première numération globulaire. [8] [202] [203] Sa technique, publiée en 1852, impliquait d’aspirer un volume de sang soigneusement mesuré dans un tube capillaire et de l’étaler sur une lame de microscope enduite de blanc d’œuf . Après que le sang ait séché, il a compté chaque cellule sur la lame ; ce processus pourrait prendre plus de trois heures. [204] L’hémocytomètre, introduit en 1874 par Louis-Charles Malassez , a simplifié le comptage microscopique des cellules sanguines. [205]L’hémocytomètre de Malassez consistait en une lame de microscope contenant un tube capillaire aplati. Le sang dilué a été introduit dans la chambre capillaire au moyen d’un tube en caoutchouc fixé à une extrémité, et un oculaire avec une grille graduée a été fixé au microscope, permettant au microscopiste de compter le nombre de cellules par volume de sang. En 1877, William Gowers a inventé un hémocytomètre avec une grille de comptage intégrée, éliminant ainsi le besoin de produire des oculaires spécialement calibrés pour chaque microscope. [206]

 Dmitri Leonidovich Romanowsky a inventé la coloration de Romanowsky.
Dmitri Leonidovich Romanowsky a inventé la coloration de Romanowsky.
Dans les années 1870, Paul Ehrlich a développé une technique de coloration utilisant une combinaison d’un colorant acide et basique qui pouvait distinguer différents types de globules blancs et permettre d’examiner la morphologie des globules rouges. [201] Dmitri Leonidovich Romanowsky a amélioré cette technique dans les années 1890, en utilisant un mélange d’ éosine et de bleu de méthylène vieilli pour produire une large gamme de teintes non présentes lorsque l’une ou l’autre des taches était utilisée seule. Cela est devenu la base de la coloration de Romanowsky, la technique encore utilisée pour colorer les frottis sanguins pour un examen manuel. [207]
Les premières techniques de mesure de l’hémoglobine ont été conçues à la fin du 19e siècle et impliquaient des comparaisons visuelles de la couleur du sang dilué par rapport à une norme connue. [203] Les tentatives d’automatisation de ce processus à l’aide de la spectrophotométrie et de la colorimétrie étaient limitées par le fait que l’hémoglobine est présente dans le sang sous de nombreuses formes différentes, ce qui signifie qu’elle ne pouvait pas être mesurée à une seule longueur d’onde . En 1920, une méthode pour convertir les différentes formes d’hémoglobine en une forme stable (cyanméthémoglobine ou cyanure d’hémiglobine) a été introduite, permettant de mesurer automatiquement les taux d’hémoglobine. La méthode à la cyanméthémoglobine reste la méthode de référence pour la mesure de l’hémoglobine et est toujours utilisée dans de nombreux analyseurs d’hématologie automatisés. [57][208] [209]
Maxwell Wintrobe est crédité de l’invention du test d’hématocrite. [66] [210] En 1929, il a entrepris un projet de PhD à l’ université de Tulane pour déterminer des gammes normales pour les paramètres de globule rouge et a inventé une méthode connue comme l’hématocrite Wintrobe. Les mesures d’hématocrite avaient déjà été décrites dans la littérature, mais la méthode de Wintrobe différait en ce qu’elle utilisait un grand tube qui pouvait être produit en série selon des spécifications précises, avec une échelle intégrée. La fraction de globules rouges dans le tube a été mesurée après centrifugation pour déterminer l’hématocrite. L’invention d’une méthode reproductible pour déterminer les valeurs d’hématocrite a permis à Wintrobe de définir les indices de globules rouges. [203]

 Modèle A Compteur Coulter
Modèle A Compteur Coulter
La recherche sur le comptage automatisé des cellules a commencé au début du 20e siècle. [209] Une méthode développée en 1928 utilisait la quantité de lumière transmise à travers un échantillon de sang dilué, telle que mesurée par photométrie, pour estimer le nombre de globules rouges, mais cela s’est avéré inexact pour les échantillons contenant des globules rouges anormaux. [8] D’autres tentatives infructueuses, dans les années 1930 et 1940, impliquaient des détecteurs photoélectriques attachés à des microscopes, qui comptaient les cellules au fur et à mesure qu’elles étaient scannées. [209] À la fin des années 1940, Wallace H. Coulter , motivé par le besoin de meilleures méthodes de comptage des globules rouges suite aux bombardements d’Hiroshima et de Nagasaki , [211]ont tenté d’améliorer les techniques de comptage des cellules photoélectriques. [note 7] Ses recherches ont été aidées par son frère, Joseph R. Coulter, dans un laboratoire du sous-sol de Chicago. [60] Leurs résultats utilisant des méthodes photoélectriques étaient décevants, et en 1948, après avoir lu un article reliant la conductivité du sang à sa concentration en globules rouges, Wallace a conçu le principe de Coulter – la théorie selon laquelle une cellule suspendue dans un milieu conducteur génère une goutte en courant proportionnel à sa taille lorsqu’il traverse une ouverture. [211]
En octobre, Wallace a construit un comptoir pour démontrer le principe. En raison de contraintes financières, l’ouverture a été faite en brûlant un trou à travers un morceau de cellophane d’un paquet de cigarettes. [60] [211] Wallace a déposé un brevet pour la technique en 1949 et en 1951 a demandé au Bureau de la Recherche Navale de financer le développement du compteur Coulter . [211] La demande de brevet de Wallace a été accordée en 1953, et après des améliorations de l’ouverture et l’introduction d’un manomètre à mercurepour fournir un contrôle précis sur la taille de l’échantillon, les frères ont fondé Coulter Electronics Inc. en 1958 pour commercialiser leurs instruments. Le compteur Coulter a été initialement conçu pour compter les globules rouges, mais avec des modifications ultérieures, il s’est avéré efficace pour compter les globules blancs. [60] Les compteurs Coulter ont été largement adoptés par les laboratoires médicaux. [209]
Le premier analyseur capable de produire plusieurs comptages cellulaires simultanément était le Technicon SMA 4A-7A, sorti en 1965. Il y est parvenu en divisant les échantillons de sang en deux canaux : un pour compter les globules rouges et blancs et un pour mesurer l’hémoglobine. Cependant, l’instrument n’était pas fiable et difficile à entretenir. En 1968, l’analyseur Coulter Model S est sorti et a été largement utilisé. Comme pour l’instrument Technicon, il utilisait deux chambres de réaction différentes, dont l’une était utilisée pour la numération des globules rouges et l’autre pour la numération des globules blancs et la détermination de l’hémoglobine. Le modèle S a également déterminé le volume cellulaire moyen à l’aide de mesures d’impédance, ce qui a permis de dériver les indices de globules rouges et l’hématocrite. La numération plaquettaire automatisée a été introduite en 1970 avec l’instrument Hemalog-8 de Technicon et a été adoptée par les analyseurs de la série S Plus de Coulter en 1980. [212]
Après l’automatisation du comptage cellulaire de base, le différentiel de globules blancs est resté un défi. Tout au long des années 1970, les chercheurs ont exploré deux méthodes pour automatiser le comptage différentiel : le traitement d’image numérique et la cytométrie en flux. Utilisant la technologie développée dans les années 1950 et 1960 pour automatiser la lecture des frottis Pap , plusieurs modèles d’analyseurs de traitement d’image ont été produits. [213] Ces instruments scanneraient un frottis sanguin coloré pour trouver des noyaux cellulaires, puis prendraient un instantané à plus haute résolution de la cellule pour l’analyser par densitométrie . [214]Ils étaient coûteux, lents et ne réduisaient pas la charge de travail du laboratoire car ils nécessitaient encore la préparation et la coloration de frottis sanguins, de sorte que les systèmes basés sur la cytométrie en flux sont devenus plus populaires [215] [216] et en 1990, pas d’image numérique. des analyseurs étaient disponibles dans le commerce aux États-Unis ou en Europe occidentale. [217] Ces techniques ont connu une résurgence dans les années 2000 avec l’introduction de plateformes d’analyse d’images plus avancées utilisant des réseaux de neurones artificiels . [218] [219] [220]
Les premiers appareils de cytométrie en flux projetaient des faisceaux de lumière sur les cellules dans des longueurs d’onde spécifiques et mesuraient l’absorbance, la fluorescence ou la diffusion de la lumière qui en résultaient, collectant des informations sur les caractéristiques des cellules et permettant de quantifier le contenu cellulaire tel que l’ADN . [221] Un de ces instruments – le spectrophotomètre cellulaire rapide, développé par Louis Kamentsky en 1965 pour automatiser la cytologie cervicale – pourrait générer des diagrammes de dispersion des cellules sanguines en utilisant des techniques de coloration cytochimique. Leonard Ornstein, qui avait aidé à développer le système de coloration sur le Rapid Cell Spectrophotometer, et ses collègues ont ensuite créé le premier analyseur différentiel de Leucocytes par cytométrie en flux commercial, le Hemalog D. [222] [223] Introduit en 1974, [224][225] cet analyseur a utilisé la diffusion de la lumière, l’absorbance et la coloration des cellules pour identifier les cinq types de globules blancs normaux en plus des « grandes cellules non identifiées », une classification qui consistait généralement en des lymphocytes atypiques ou des cellules blastiques. L’Hemalog D pouvait compter 10 000 cellules en un seul passage, une nette amélioration par rapport au différentiel manuel. [223] [226] En 1981, Technicon a combiné l’Hemalog D avec l’analyseur Hemalog-8 pour produire le Technicon H6000, le premier hémogramme complet combiné et analyseur différentiel. Cet analyseur était impopulaire auprès des laboratoires d’hématologie car son fonctionnement demandait beaucoup de main-d’œuvre, mais de la fin des années 1980 au début des années 1990, des systèmes similaires ont été largement produits par d’autres fabricants tels que Sysmex ,Abbott , Roche et Beckman Coulter . [227]
Notes d’explication
- ↑ Bien que communément appelées ainsi, les Plaquettes ne sont techniquement pas des cellules : ce sont des fragments de cellules, formés à partir du cytoplasme des mégacaryocytes de la moelle osseuse. [6]
- ^ Les données utilisées pour construire les plages de référence sont généralement dérivées de sujets “normaux”, mais il est possible que ces individus aient une maladie asymptomatique. [34]
- ^ Dans son sens le plus large, le terme cytométrie en flux fait référence à toute mesure des propriétés des cellules individuelles dans un flux de fluide, [49] [50] et à cet égard, tous les analyseurs d’hématologie (à l’exception de ceux utilisant le traitement d’image numérique) sont des cytomètres en flux . Cependant, le terme est couramment utilisé en référence aux méthodes de diffusion de la lumière et de fluorescence, en particulier celles impliquant l’identification de cellules à l’aide d’anticorps marqués qui se lient à des marqueurs de surface cellulaire ( immunophénotypage ). [49] [51]
- ^ Ce n’est pas toujours le cas. Dans certains types de thalassémie, par exemple, un nombre élevé de globules rouges se produit parallèlement à une hémoglobine faible ou normale, car les globules rouges sont très petits. [123] [124] L’ indice de Mentzer , qui compare le MCV au nombre de RBC, peut être utilisé pour faire la distinction entre l’anémie ferriprive et la thalassémie. [125]
- ↑ Les instruments automatisés regroupent ces trois types de cellules sous la classification des « granulocytes immatures », [142] mais ils sont comptés séparément dans le différentiel manuel. [143]
- ^ Le RDW est très élevé à la naissance et diminue progressivement jusqu’à l’âge de six mois environ. [178]
- ↑ Une histoire apocryphe soutient que Wallace a inventé le compteur Coulter pour étudier les particules dans les peintures utilisées sur les navires de la marine américaine ; d’autres récits affirment qu’il a été conçu à l’origine pendant la Seconde Guerre mondiale pour compter le plancton. Cependant, Wallace n’a jamais travaillé pour la marine et ses premiers écrits sur l’appareil indiquent qu’il a d’abord été utilisé pour analyser le sang. L’histoire de la peinture a finalement été retirée des documents produits par la Wallace H. Coulter Foundation. [211]
Références
Citations
- ^ Tefferi, A; Hanson, Californie ; Vers l’intérieur, DJ (2005). “Comment interpréter et poursuivre une numération globulaire complète anormale chez l’adulte” . Actes de la clinique Mayo . 80 (7): 923–936. doi : 10.4065/80.7.923 . ISSN 0025-6196 . PMC 7127472 . PMID 16212155 .
- ^ un b HealthDirect (août 2018). « Numération sanguine complète » . HealthDirect.gov.au . Archivé de l’original le 2 avril 2019 . Récupéré le 8 septembre 2020 .
- ^ “Tests sanguins : leucémie lymphoïde chronique (LLC)” . Recherche sur le cancer au Royaume-Uni . 18 septembre 2020. Archivé de l’original le 23 octobre 2020 . Récupéré le 23 octobre 2020 .
- ^ un bcdef Association américaine de chimie clinique ( 12 août 2020). “Numération sanguine complète (CBC)” . Tests de laboratoire en ligne . Archivé de l’original le 18 août 2020 . Récupéré le 8 septembre 2020 .
- ^ un bc Smock , KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Avantages et sources d’erreur avec l’hématologie automatisée”.
- ^ un b Turgeon, ML (2016). p. 309.
- ^ Harmening, DM (2009). p. 2–3.
- ^ un bc Vert , R; Wachsmann-Hogiu, S (2015). “Développement, histoire et avenir des compteurs de cellules automatisés”. Cliniques en médecine de laboratoire . 35 (1): 1–10. doi : 10.1016/j.cll.2014.11.003 . ISSN 0272-2712 . PMID 25676368 .
- ^ un b Keohane, E et autres . (2015). p. 244.
- ^ Leach, M (2014). “Interprétation de la numération globulaire complète dans les maladies systémiques – un guide pour le médecin” . Le Journal du Collège royal des médecins d’Édimbourg . 44 (1): 36–41. doi : 10.4997/JRCPE.2014.109 . ISSN 1478-2715 . PMID 24995446 .
- ^ Marshall, WJ et al . (2014). p. 497.
- ^ un bc Van Leeuwen , AM; Bladh, ML (2019). p. 377.
- ^ Lewandrowski, K et al. (2016). p. 96.
- ^ Association américaine des banques de sang (24 avril 2014). “Cinq choses que les médecins et les patients devraient remettre en question” . Choisir avec soin : une initiative de la Fondation ABIM . Association américaine des banques de sang. Archivé de l’original le 24 septembre 2014 . Récupéré le 12 juillet 2020 .
- ^ un b Lewandrowski, K et autres. (2016). p. 97.
- ^ Hartman, juge en chef; Kavoussi, LR (2017). p. 4–5.
- ^ Dewan, M (2016). “Réduire les tests de numération formule sanguine postopératoires inutiles dans l’unité de soins intensifs pédiatriques” . Le Journal Permanent . 21 : 16–051. doi : 10.7812/TPP/16-051 . ISSN 1552-5767 . PMC 5283785 . PMID 28241909 .
- ^ Murs, R et al. (2017). p. 130.
- ^ Murs, R et al . (2017). p. 219.
- ^ Murs, R et al. (2017). p. 199.
- ^ Murs, R et al. (2017). p. 1464.
- ^ Moore, EE et al . (2017). p. 162.
- ^ Lewis, SL et al. (2015). p. 280.
- ^ Wiciński, M; Węclewicz, MM (2018). “Agranulocytose / granulocytopénie induite par la clozapine”. Opinion actuelle en hématologie . 25 (1): 22–28. doi : 10.1097/MOH.0000000000000391 . ISSN 1065-6251 . PMID 28984748 . S2CID 20375973 .
- ^ Fatemi, SH; Clayton, PJ. (2016). p. 666.
- ^ Dooley, EK; Ringler, RL. (2012). p. 20–21.
- ^ Keohane, E et al . (2015). pages 834–835.
- ^ Schafermeyer, RW et al . (2018). p. 467–468.
- ^ Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Introduction”.
- ^ un b Kaushansky, K et autres . (2015). p. 11.
- ^ Kaushansky, K et al . (2015). p. 43.
- ^ Kaushansky, K et al . (2015). p. 42–44.
- ^ McPherson, RA; Pincus, M. (2017). p. 574.
- ^ Bain, BJ et al . (2017). p. 8.
- ^ un b Bain, BJ et autres . (2017). p. dix.
- ^ Bain, BJ (2015). p. 213.
- ^ Keohane, E et al . (2015). p. 245.
- ^ un b Lewandrowski, K et autres. (2016). p. 96–97.
- ^ “Tests préopératoires de routine pour la chirurgie élective (NG45)” . Institut national pour l’excellence de la santé et des soins . 5 avril 2016. Archivé de l’original le 28 juillet 2020 . Récupéré le 8 septembre 2020 .
- ^ Kirkham, KR et al . (2016). p. 805.
- ^ Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Collecte d’échantillons”.
- ^ Keohane, E et al . (2015). p. 28.
- ^ Bain, BJ et al. (2017). p. 1.
- ^ Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Numération cellulaire”, “Volume de concentré de globules rouges (hématocrite)”, “Différentiels leucocytaires”.
- ^ un bcd Bain , BJ et al . (2017). pages 551–555.
- ^ Bain, BJ (2015). p. 29.
- ^ Dasgupta, A; Sepulveda, JL (2013). p. 305.
- ^ un b D’Souza, C; Briggs, C; Machin, SJ (2015). « Plaquettes : les rares, les jeunes et les actifs ». Cliniques en médecine de laboratoire . 35 (1): 123-131. doi : 10.1016/j.cll.2014.11.002 . ISSN 0272-2712 . PMID 25676376 .
- ^ un bc Kottke -Marchant, K; Davis, B (2012). p. 8.
- ^ Shapiro, HM (2003). p. 1.
- ^ Bakke, AC (2001). “Les principes de la cytométrie en flux” . Médecine de laboratoire . 32 (4): 207-211. doi : 10.1309/2H43-5EC2-K22U-YC6T . ISSN 1943-7730 .
- ^ Kaushansky, K et al . (2015). p. 12.
- ^ un b Bain, BJ et autres . (2017). p. 32–33.
- ^ McPherson, RA; Pincus, M. (2017). p. 44.
- ^ Bain, BJ (2015). p. 29–30.
- ^ Whitehead, DR; Mei, Z; Mapango, C; Jefferds, MED (août 2019). “Méthodes et analyseurs pour la mesure de l’hémoglobine dans les laboratoires cliniques et sur le terrain” . Annales de l’Académie des sciences de New York . 1450 (1): 147-171. Bib code : 2019NYASA1450..147W . doi : 10.1111/nyas.14124 . PMC 6709845 . PMID 31162693 .
- ^ un b Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Concentration d’hémoglobine”.
- ^ un b Keohane, E et autres . (2015). p. 208.
- ^ Bain, BJ (2015). p. 30–31.
- ^ un bcd Graham , MD (2003). “Le principe Coulter: fondement d’une industrie” . Journal de l’Association pour l’automatisation des laboratoires . 8 (6): 72–81. doi : 10.1016/S1535-5535(03)00023-6 . ISSN 1535-5535 . S2CID 113694419 .
- ^ Keohane, E et al . (2015). p. 208–209.
- ^ un b Bain, BJ et autres . (2017). p. 32.
- ^ Keohane, E et al . (2015). p. 210–211.
- ^ Keohane, E et al . (2015). p. 210.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 27.
- ^ un bcde Smock , KJ . Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Volume de globules rouges concentrés (hématocrite)”.
- ^ Smock, KJ. Chapitre 1 dans Greer JP et al , éd. (2018), ch. “Volume corpusculaire moyen” ; “Hémoglobine corpusculaire moyenne”; “Concentration corpusculaire moyenne en hémoglobine” ; “Largeur de distribution des globules rouges“.
- ^ Keohane, E et al . (2015). p. 2.
- ^ Keohane, E et al . (2015). p. 209.
- ^ un bc Bain , BJ et autres . (2017). p. 37.
- ^ Arneth, BM; En ligneMenschikowki, M. (2015). p. 3.
- ^ un bc Smock , KJ. Chapitre 1 dans Greer JP et al , éd. (2018), ch. “Différentiels leucocytaires”.
- ^ Naeim, F et al . (2009). p. 210.
- ^ un b Turgeon, ML (2016). p. 318.
- ^ un b Bain, BJ et autres . (2017). p. 39.
- ^ un b Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Introduction”; “Cellule compte”.
- ^ un bcd Gulati , G ; chanson, J ; Dulau Florea, A; Gong, J (2013). “Objectif et critères de l’analyse des frottis sanguins, de l’examen des frottis sanguins et de l’examen des frottis sanguins” . Annales de médecine de laboratoire . 33 (1): 1–7. doi : 10.3343/alm.2013.33.1.1 . ISSN 2234-3806 . PMC 3535191 . PMID 23301216 .
- ^ un Mooney b , C; Byrne, M; Kapuya, P; Pentony, L; De la Salle, B; Cambridge, T ; Foley, D (2019). « Dépistage au point de service en hématologie générale » . Journal britannique d’hématologie . 187 (3): 296–306. doi : 10.1111/bjh.16208 . ISSN 0007-1048 . PMID 31578729 .
- ^ un b Sireci, AN (2015). “Tests d’hématologie dans les soins d’urgence et les milieux pauvres en ressources : un aperçu des tests au point de service et par satellite”. Cliniques en médecine de laboratoire . 35 (1): 197–207. doi : 10.1016/j.cll.2014.10.009 . ISSN 0272-2712 . PMID 25676380 .
- ^ Bain, BJ et al . (2017). p. 43.
- ^ Keohane, E et al . (2015). p. 225.
- ^ Bain, BJ. (2015). p. 9–11.
- ^ Palmer, L et al . (2015). p. 288–289.
- ^ Turgeon, ML (2016). p. 325–326.
- ^ Bain, BJ (2015). p. 98.
- ^ Bain, BJ (2015). p. 154.
- ^ Wang, SA; En ligneHasserjian, RP (2018). p. dix.
- ^ un b Turgeon, ML (2016). p. 329.
- ^ un b d’Onofrio, G; En ligneZini, G. (2014). p. 289.
- ^ Palmer, L et al. (2015). p. 296–297.
- ^ un bc Keohane , E et autres . (2015). p. 226.
- ^ un b Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Cellule compte”.
- ^ Keohane, E et al . (2017) p. 189.
- ^ Bain, BJ (2015). p. 22–23.
- ^ Keohane, E et al. (2017). p. 190–191.
- ^ Bain, BJ et al . (2017). p. 19–22.
- ^ Bain, BJ et al . (2017). pages 548–552.
- ^ Keohane, E et al . (2015). p. 46.
- ^ un bc Vis, JY ; Huisman, A (2016). “Vérification et contrôle qualité des analyseurs d’hématologie de routine” . Journal international d’hématologie de laboratoire . 38 : 100–109. doi : 10.1111/ijlh.12503 . ISSN 1751-5521 . PMID 27161194 .
- ^ un b Kottke-Marchant, K; Davis, B (2012). pages 697–698.
- ^ Pay, S; Frater, JL (2019). « Gestion de la qualité et accréditation en laboratoire d’hématologie : perspectives de l’Inde » . Journal international d’hématologie de laboratoire . 41 (S1): 177–183. doi : 10.1111/ijlh.13017 . ISSN 1751-5521 . PMID 31069974 .
- ^ Greer, JP (2008). p. 4.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 438.
- ^ Bain, BJ et al . (2017). pages 539–540.
- ^ Favaloro, EJ; Jennings, moi ; Olson, J; Van Cott, EM; Bonar, R; Gosselin, R; Meijer, P (2018). “Vers une harmonisation de l’évaluation externe de la qualité/des tests d’aptitude en hémostase” . Chimie clinique et médecine de laboratoire . 57 (1): 115-126. doi : 10.1515/cclm-2018-0077 . ISSN 1437-4331 . PMID 29668440 . S2CID 4978828 .
- ^ Bain, BJ et al . (2017). p. 551.
- ^ Keohane, E et al . (2015). p. 4–5.
- ^ Blann, A; Ahmed, N (2014). p. 106.
- ^ Turgeon, ML (2016). p. 293.
- ^ Bain, BJ et al . (2017). p. 33–34.
- ^ Turgeon, ML (2016). pages 319–320.
- ^ Brereton, M; McCafferty, R; Marsden, K; Kawai, Y; Etzell, J; Ermens, A (2016). “Recommandation pour la normalisation des unités de rapport d’hématologie utilisées dans la numération globulaire étendue” . Journal international d’hématologie de laboratoire . 38 (5): 472–482. doi : 10.1111/ijlh.12563 . ISSN 1751-5521 . PMID 27565952 .
- ^ Keohane, E et al . (2015). p. 195.
- ^ un b Bain, BJ (2015). p. 22.
- ^ un bcd Keohane , E et al . (2015). p. 196.
- ^ Schmaier, AH; Lazare, HM (2012). p. 25.
- ^ un b Bain, BJ (2015). p. 73–75.
- ^ un bcde May , JE ; Marques, MB; Reddy, VVB; Gangaraju, R (2019). “Trois numéros négligés dans le CBC: le compte RDW, MPV et NRBC” . Journal de médecine de la clinique de Cleveland . 86 (3): 167–172. doi : 10.3949/ccjm.86a.18072 . ISSN 0891-1150 . PMID 30849034 .
- ^ Keohane, E et al . (2015). p. 285.
- ^ Keohane, E et al . (2015). p. 286.
- ^ Kaushansky, K et al . (2015). p. 503.
- ^ Vieth, JT; Lane, DR (2014). p. 11-12.
- ^ Bain, BJ (2015). p. 297.
- ^ DiGregorio, RV et al . (2014). p. 491–493.
- ^ Isaacs, C et al . (2017). p. 331.
- ^ Bain, BJ (2015). p. 232.
- ^ McPherson, RA; Pincus, M. (2017). pages 600–601.
- ^ un b Smock, KJ. Chapitre 1 dans Greer, JP et al , éd. (2018), ch. “Concentration corpusculaire moyenne d’hémoglobine”.
- ^ Keohane, E et al . (2015). p. 197.
- ^ un b Kottke-Marchant, K; Davis, B (2012). p. 88.
- ^ Bain, BJ (2015). p. 193.
- ^ Bain, BJ et al . (2017). pages 501–502.
- ^ Ciesla, B (2018). p. 26.
- ^ Powell, DJ; Achebe, MO. (2016). pages 530, 537–539.
- ^ Harmening, DM (2009). p. 380.
- ^ Pagana, TJ et al. (2014). p. 992.
- ^ Murs, R et al. (2017). pp. 1480–1481.
- ^ Territo, M (janvier 2020). “Vue d’ensemble des troubles des globules blancs” . Manuels Merck version grand public . Archivé de l’original le 23 juin 2020 . Récupéré le 8 septembre 2020 .
- ^ Pagana, TJ et al. (2014). p. 991.
- ^ McCulloh, RJ; Opale, SM. Chapitre 42 dans Oropello, JM et al , éd. (2016), ch. “Numération et différentiel des globules blancs“.
- ^ Association américaine de chimie clinique (29 juillet 2020). “Différentiel WBC” . Tests de laboratoire en ligne . Archivé de l’original le 19 août 2020 . Récupéré le 8 septembre 2020 .
- ^ Wang, SA; En ligneHasserjian, RP (2018). p. 8.
- ^ Palmer, L et al . (2015). p. 294–295.
- ^ Chabot-Richards, DS; George, TI (2015). p. dix.
- ^ Palmer, L et al. (2015). p. 294.
- ^ Turgeon, ML (2016). p. 306.
- ^ un b Kaushansky, K et autres . (2015). p. 44.
- ^ Hoffman, EJ et al. (2013). p. 644.
- ^ Porwit, A et al . (2011). p. 247–252.
- ^ Murs, R et al. (2017). p. 1483.
- ^ Murs, R et al. (2017). pp. 1497–1498.
- ^ Bain, BJ (2015). p. 99.
- ^ Bain, BJ et al. (2017). p. 85.
- ^ Bain, BJ et al . (2017). p. 498.
- ^ Bain, BJ (2015). p. 243.
- ^ Porwit, A et al . (2011). p. 256.
- ^ Palmer, L et al . (2015). p. 298.
- ^ Turgeon, ML (2016). p. 358–360.
- ^ Kaushansky, K et al. (2015). p. 1993.
- ^ Turgeon, ML (2016). p. 315.
- ^ Murs, R et al. (2017). pp. 1486–1488.
- ^ Kaufman, RM; Djulbegovic, B; Gernsheimer, T; Kleinman, S; Tinmouth, A. T. ; Capocelli, KE; et coll. (2015). “Transfusion de Plaquettes : un guide de pratique clinique de l’AABB” . Annales de médecine interne . 162 (3): 205–213. doi : 10.7326/M14-1589 . ISSN 0003-4819 . PMID 25383671 .
- ^ un b Keohane, E et autres . (2015). p. 4.
- ^ Murs, R et al. (2017). p. 1489.
- ^ Gersten, T (25 août 2020). “Numération plaquettaire: Encyclopédie médicale MedlinePlus” . MedlinePlus . Bibliothèque nationale de médecine des États-Unis. Archivé de l’original le 9 septembre 2020 . Récupéré le 9 septembre 2020 .
- ^ Wang, SA; En ligneHasserjian, RP (2018). p. 7.
- ^ Kaushansky, K et al . (2015). p. 18–19.
- ^ un b Kaushansky, K et autres . (2015). p. 14.
- ^ Turgeon, ML (2016). pages 318–319.
- ^ Turgeon, ML (2016). p. 319.
- ^ un bcd Kaushansky , K et al . (2015). p. 16.
- ^ Bain, BJ et al . (2017). p. 42–43.
- ^ Harmening, DM (2009). p. 8–10.
- ^ Constantino, B; Cogionis, B (2000). “Grocytes nucléés – importance dans le film sanguin périphérique” . Médecine de laboratoire . 31 (4): 223-229. doi : 10.1309/D70F-HCC1-XX1T-4ETE .
- ^ Zandecki, M et al. (2007). p. 24–25.
- ^ Virk, H; Varma, N; Naseem, S; Bihana, je ; Soukhachev, D (2019). “Utilité des données de population cellulaire (paramètres VCS) comme outil de dépistage rapide de la leucémie myéloïde aiguë (LMA) dans les laboratoires aux ressources limitées” . Journal d’analyse de laboratoire clinique . 33 (2) : e22679. doi : 10.1002/jcla.22679 . ISSN 0887-8013 . PMC 6818587 . PMID 30267430 .
- ^ Bain, BJ (2015). p. 90.
- ^ un b Keohane, E et autres . (2015). Avant-matière.
- ^ Bain, BJ (2015). p. 211–213.
- ^ un bc Bain , BJ (2015). p. 143.
- ^ Lanzkowsky, P et al . (2016). p. 197.
- ^ Kaushansky, K et al . (2015). p. 99.
- ^ Kaushansky, K et al . (2015). p. 103.
- ^ Bain, BJ (2015). p. 220.
- ^ Bain, BJ (2015). p. 214.
- ^ Bain, BJ et al . (2017). p. 8–10.
- ^ Palmer, L et al . (2015). p. 296.
- ^ Bain, BJ (2015). p. 195.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 67.
- ^ Bain, BJ (2015). p. 194.
- ^ Turgeon, ML (2016). p. 91.
- ^ Kottke-Marchant, K; Davis, B (2012) p. 80, 86–87.
- ^ Bain, BJ (2015). p. 196–197.
- ^ Rodak, BF; Carr, JH. (2013). p. 109.
- ^ Wang, SA; En ligneHasserjian, RP (2018). p. 9.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 19–20.
- ^ Musée des sciences, Londres. “Hémoglobinomètre, Royaume-Uni, 1850–1950” . Collection Bienvenue . Archivé de l’original le 29 mars 2020 . Récupéré le 29 mars 2020 .
- ^ Keohane, E et al . (2015). p. 1–4.
- ^ Kottke-Marchant, K; Davis, B. (2012). p. 1.
- ^ Wintrobe, MM. (1985). p. dix.
- ^ un b Kottke-Marchant, K; Davis, B. (2012). p. 3–4.
- ^ Verso, ML (mai 1962). “L’évolution des techniques de numération sanguine” . Lire lors d’une réunion de la section de l’histoire de la médecine, premier congrès médical australien . 8 (2): 149–158. doi : 10.1017/s0025727300029392 . PMC 1033366 . PMID 14139094 .
- ^ un bc signifie, RT (2011) . “Tout a commencé à la Nouvelle-Orléans : Wintrobe, l’hématocrite et la définition de la normale”. Le Journal américain des sciences médicales . 341 (1): 64–65. doi : 10.1097/MAJ.0b013e3181e2eb09 . ISSN 0002-9629 . PMID 21191263 .
- ^ Davis, JD (1995). p. 167.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 4.
- ^ Davis, JD (1995). p. 168–171.
- ^ Bezrukov, AV (2017). “La coloration Romanowsky, l’effet Romanowsky et réflexions sur la question de la priorité scientifique”. Biotechnique & Histochimie . 92 (1): 29–35. doi : 10.1080/10520295.2016.1250285 . ISSN 1052-0295 . PMID 28098484 . S2CID 37401579 .
- ^ Keohane, E et al . (2015). p. 134.
- ^ un bcd Kottke – Marchant , K; Davis, B (2012). p. 5.
- ^ Robinson, JP (2013). “Wallace H. Coulter : des décennies d’invention et de découverte” . Cytométrie Partie A . 83A (5) : 424–438. doi : 10.1002/cyto.a.22296 . ISSN 1552-4922 . PMID 23596093 .
- ^ un bcde Graham , MD (2013) . « Le principe Coulter : Origines imaginaires » . Cytométrie Partie A . 83 (12): 1057–1061. doi : 10.1002/cyto.a.22398 . ISSN 1552-4922 . PMC 4237176 . PMID 24151220 .
- ^ Kottke-Marchant, K; Davis, B (2012). p. 6.
- ^ Groner, W (1995). p. 12–14.
- ^ Lewis, SM (1981). “Comptage différentiel automatisé des Leucocytes: état actuel et tendances futures”. Blut . 43 (1): 1–6. doi : 10.1007/BF00319925 . ISSN 0006-5242 . PMID 7260399 . S2CID 31055044 .
- ^ Da Costa, L (2015). p. 5.
- ^ Groner, W (1995). p. 12–15.
- ^ Bentley, SA (1990). “Comptes de globules blancs différentiels automatisés: une évaluation critique”. Hématologie clinique de Baillière . 3 (4): 851–869. doi : 10.1016/S0950-3536(05)80138-6 . ISSN 0950-3536 . PMID 2271793 .
- ^ Kratz, A; Lee, S; Zini, G; Riedl, JA; Hur, M; Machin, S (2019). « Analyseurs numériques de morphologie en hématologie : bilan et recommandations de l’ICSH » . Journal international d’hématologie de laboratoire . 41 (4): 437–447. doi : 10.1111/ijlh.13042 . ISSN 1751-5521 . PMID 31046197 .
- ^ Da Costa, L (2015). p. 5–6.
- ^ McCann, SR (2016). p. 193.
- ^ Melamed, M (2001). p. 5–6.
- ^ Shapiro, HM (2003). p. 84–85.
- ^ un b Melamed, M. (2001). p. 8.
- ^ Picot, J et al . (2012). p. 110.
- ^ Mansberg, HP; Saunders, AM ; Groner, W (1974). “Le système différentiel de globules blancs Hemalog D” . Journal d’histochimie et de cytochimie . 22 (7): 711–724. doi : 10.1177/22.7.711 . ISSN 0022-1554 . PMID 4137312 .
- ^ Pierre, RV (2002). p. 281.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 8–9.
Bibliographie générale
- Arneth, BM; En ligneMenschikowki, M (2015). « Technologie et nouveaux paramètres de cytométrie en flux à fluorescence dans les analyseurs hématologiques » . Journal d’analyse de laboratoire clinique . 29 (3): 175–183. doi : 10.1002/jcla.21747 . ISSN 0887-8013 . PMC 6807107 . PMID 24797912 .
- Bain, BJ (2015). Cellules sanguines : un guide pratique (5 éd.). John Wiley et fils. ISBN 978-1-118-81733-9.
- Bain, BJ; Bates, moi ; Laffan, MA (2017). Dacie et Lewis Practical Hematology (12e éd.). Sciences de la santé Elsevier. ISBN 978-0-7020-6925-3.
- Blann, A; Ahmed, N (2014). Science du sang (1 éd.). Institut des sciences biomédicales. p. 106. ISBN 978-1-118-35146-8.
- Chabot-Richards, DS; George, TI (2015). “Nombre de globules blancs“. Cliniques en médecine de laboratoire . 35 (1): 11–24. doi : 10.1016/j.cll.2014.10.007 . ISSN 0272-2712 . PMID 25676369 .
- Ciesla, B (2018). Hématologie en pratique (3 éd.). Compagnie FA Davis. ISBN 978-0-8036-6825-6.
- Da Costa, L (2015). “Analyse d’image numérique des cellules sanguines”. Cliniques en médecine de laboratoire . 35 (1): 105–122. doi : 10.1016/j.cll.2014.10.005 . ISSN 0272-2712 . PMID 25676375 .
- Dasgupta, A; Sepulveda, JL (2013). Des résultats précis en laboratoire clinique : un guide pour la détection et la correction des erreurs . Elsevier. ISBN 978-0-12-415858-0.
- Davis, JD (1995). “L’évolution de l’hémocytomètre de l’ère progressive” . Caduceus: Un journal des sciences humaines pour la médecine et les sciences de la santé . 11 (3): 164-183. PMID 8680947 .
- DiGregorio, RV; Green-Hernandez, C; Holzemer, SP (2014). Soins primaires : une perspective interprofessionnelle (2 éd.). Société d’édition Springer. ISBN 978-0-8261-7148-1.
- Dooley, EK; Ringler, RL (2012). “Soins prénataux : toucher l’avenir”. Soins primaires : Cliniques en pratique de bureau . 39 (1): 17–37. doi : 10.1016/j.pop.2011.11.002 . ISSN 0095-4543 . PMID 22309579 .
- Fatemi, SH; Clayton, PJ (2016). La base médicale de la psychiatrie (4 éd.). Springer. ISBN 978-1-4939-2528-5.
- Greer, JP (2008). L’hématologie clinique de Wintrobe (12e éd.). Lippincott Williams & Wilkins. ISBN 978-0-7817-6507-7.
- Greer, JP; Arber, DA; Glader, BE ; Liste, AF ; Moyens, RM ; Rodgers, GM (2018). L’hématologie clinique de Wintrobe (14e éd.). Santé Wolters Kluwer. ISBN 978-1-4963-6713-6.
- Groner, W (1995). Guide pratique des analyseurs d’hématologie modernes . Wiley. ISBN 978-0-471-95712-6.
- En ligneHarmening, D (2009). Hématologie clinique et principes fondamentaux de l’hémostase (5 éd.). Compagnie FA Davis. ISBN 978-0-8036-1732-2.
- Hartman, CJ; Kavoussi, LR (2017). Manuel de technique chirurgicale: Un véritable guide du chirurgien pour naviguer dans la salle d’opération . Sciences de la santé Elsevier. ISBN 978-0-323-51222-0.
- Hoffman, R; Benz, Jr., EJ; Silberstein, LE; Heslop, H; Anastasi, J; Weitz, J (2013). Hématologie : principes de base et pratique (6 éd.). Sciences de la santé Elsevier. ISBN 978-1-4377-2928-3.
- Isaacs, C; Agarwala, S; Cheson, B (2017). Revue d’hématologie-oncologie de Hoffman et Abeloff (1 éd.). Sciences de la santé Elsevier. ISBN 978-0-323-44318-0.
- Kaushansky, K; Lichtman, MA; Prchal, J; Lévi, MM ; Appuyez sur, OW ; Burns, LJ; Caligiuri, M (2015). Williams Hematology (9 éd.). McGraw Hill Education. ISBN 978-0-07-183301-1.
- Keohane, E; Smith, L; En ligneWalenga, J (2015). Hématologie de Rodak : principes cliniques et applications (5 éd.). Sciences de la santé Elsevier. ISBN 978-0-323-23906-6.
- Kirkham, KR; Wijeysundera, DN ; Pendrith, C; Ng, R; Tu, JV ; Boozary, AS ; et coll. (2016). “Enquêtes de laboratoire préopératoires”. Anesthésiologie . 124 (4): 804–814. doi : 10.1097/ALN.0000000000001013 . ISSN 0003-3022 . PMID 26825151 . S2CID 35916964 .
- Kottke-Marchant, K; Davis, B (2012). Laboratoire d’hématologie pratique (1 éd.). John Wiley et fils. ISBN 978-1-4443-9857-1.
- Lanzkowsky, P; Lipton, JM; Poisson, JD (2016). Manuel d’hématologie et d’oncologie pédiatrique de Lanzkowsky . Sciences Elsevier. ISBN 978-0-12-801674-9.
- Lewandrowski, K; Rudolf, J. (2016). “Gestion de l’utilisation dans le laboratoire d’hématologie de routine”. Dans Lewandrowski J, Sluss PM (éd.). Gestion de l’utilisation dans le laboratoire clinique et autres services auxiliaires . Springer. doi : 10.1007/978-3-319-34199-6_10 . ISBN 978-3-319-34199-6.
- Lewis, SL; Dirksen, SR; Heitkempet, MM; Bucher, L; Caméra, je (2015). Soins infirmiers médico-chirurgicaux: évaluation et gestion des problèmes cliniques, volume unique (8 éd.). Sciences de la santé Elsevier. ISBN 978-0-323-29033-3.
- Marshall, WJ; Lapsley, M; Jour, A ; Ayling, R (2014). Livre électronique de biochimie clinique : Aspects métaboliques et cliniques (3 éd.). Sciences de la santé Elsevier. ISBN 978-0-7020-5478-5.
- McCann, SR (2016). Une histoire de l’hématologie : d’Hérodote au VIH . OUP Oxford. ISBN 978-0-19-102713-0.
- McPherson, RA; Pincus, M. (2017). Diagnostic clinique et gestion de Henry par des méthodes de laboratoire (23 éd.). Sciences de la santé Elsevier. ISBN 978-0-323-41315-2.
- En ligneMelamed, M (2001). “Chapitre 1 une brève histoire de la cytométrie en flux et du tri”. Méthodes en biologie cellulaire . Vol. 63 partie A. Elsevier. p. 3–17. doi : 10.1016/S0091-679X(01)63005-X . ISBN 978-0-12-544166-7. PMID 11060834 .
- Moore, EE ; Feliciano, DV; Mattox, KL (2017). Traumatisme (8 éd.). McGraw Hill Education. ISBN 978-1-260-12860-4.
- Naeim, F; Rao, PN ; Grody, WW (2009). Hématopathologie : morphologie, immunophénotype, cytogénétique et approches moléculaires (1 éd.). Presse académique. ISBN 978-0-08-091948-5.
- d’Onofrio, G; Zini, G (2014). Morphologie des troubles sanguins (2 éd.). Wiley. ISBN 978-1-118-44258-6.
- Oropello, JM; Kvetan, V; Pastores, SM (2016). Soins intensifs de Lange . McGraw Hill Education. ISBN 978-0-07-181726-4.
- Pagane, KD ; Pagane, TJ ; Pagana, TN (2014). Référence des tests de diagnostic et de laboratoire de Mosby . Sciences de la santé Elsevier. ISBN 978-0-323-22592-2.
- Palmer, L; Briggs, C; McFadden, S; Zini, G; Burthem, J; Rozenberg, G; Proytcheva, M; Machin, SJ (2015). “Recommandations de l’ICSH pour la normalisation de la nomenclature et du classement des caractéristiques morphologiques des cellules sanguines périphériques” . Journal international d’hématologie de laboratoire . 37 (3): 287–303. doi : 10.1111/ijlh.12327 . ISSN 1751-5521 . PMID 25728865 .
- Picot, J; Guérin, CL; Le Van Kim, C; Boulanger, C (2012). « Cytométrie en flux : rétrospective, fondamentaux et instrumentation récente » . Cytotechnologie . 64 (2): 109-130. doi : 10.1007/s10616-011-9415-0 . ISSN 0920-9069 . PMC 3279584 . PMID 22271369 .
- Porwit, A; McCullough, J; Erber, WN (2011). Pathologie du sang et de la moelle osseuse (2e éd.). Sciences de la santé Elsevier. ISBN 978-0-7020-4535-6.
- Pierre, RV (2002). “Examen de film de sang périphérique: la disparition du différentiel de Leucocytes eyecount”. Cliniques en médecine de laboratoire . 22 (1): 279-297. doi : 10.1016/S0272-2712(03)00075-1 . ISSN 0272-2712 . PMID 11933579 .
- Powell, DJ ; Achebe, Missouri (2016). “L’anémie pour le médecin de soins primaires”. Soins primaires : Cliniques en pratique de bureau . 43 (4): 527–542. doi : 10.1016/j.pop.2016.07.006 . ISSN 0095-4543 . PMID 27866575 .
- Rodak, BF; Carr, JH (2013). Atlas d’hématologie clinique (4e éd.). Sciences de la santé Elsevier. ISBN 978-1-4557-0830-7.
- Schafermeyer, RW; Tenenbein, M; Macias, CJ (2018). Médecine d’urgence pédiatrique de Strange et Schafermeyer (5 éd.). McGraw Hill Education. ISBN 978-1-259-86076-8.
- Shapiro, HM (2003). Cytométrie en flux pratique (4 éd.). John Wiley et fils. ISBN 978-0-471-43403-0.
- Schmaier, AH; Lazare, HM (2012). Guide concis d’hématologie (1 éd.). Wiley-Blackwell. ISBN 978-1-4051-9666-6.
- Turgeon, ML (2016). Science de laboratoire clinique de Linné & Ringsrud: concepts, procédures et applications cliniques (7 éd.). Elsevier Mosby. ISBN 978-0-323-22545-8.
- Van Leeuwen, AM ; Bladh, ML (2019). Manuel complet de Davis sur les tests de laboratoire et de diagnostic avec implications en soins infirmiers (8 éd.). Compagnie FA Davis. ISBN 978-0-8036-9448-4.
- Vieth, JT; Lane, DR (2014). “Anémie”. Cliniques de médecine d’urgence d’Amérique du Nord . 32 (3): 613–628. doi : 10.1016/j.emc.2014.04.007 . ISSN 0733-8627 . PMID 25060253 .
- Murs, R ; Hockberger, R; Gausche-Hill, M (2017). Médecine d’urgence de Rosen – Concepts et pratique clinique (9 éd.). Sciences de la santé Elsevier.ISBN 978-0-323-39016-3.
- Wang, SA ; En ligneHasserjian, RP (2018). Diagnostic des troubles du sang et de la moelle osseuse . Springer. ISBN 978-3-319-20279-2.
- Wintrobe, MM (1985). L’hématologie, l’éclosion d’une science : une histoire d’inspiration et d’efforts . Léa & Febiger. ISBN 978-0-8121-0961-0.
- Zandecki, M; Geneviève, F; Gérard, J; Godon, A (février 2007). “Comptages et résultats erronés sur les analyseurs d’hématologie : un examen. Partie II : globules blancs, globules rouges, hémoglobine, indices de globules rouges et réticulocytes” . Journal international d’hématologie de laboratoire . 29 (1): 21–41. doi : 10.1111/j.1365-2257.2006.00871.x . PMID 17224005 .
