Graphique enthalpie-entropie
Un graphique enthalpie-entropie , également connu sous le nom de graphique H – S ou diagramme de Mollier , trace la chaleur totale par rapport à l’entropie, [1] décrivant l’ enthalpie d’un système thermodynamique . [2] Un graphique typique couvre une plage de pression de 0,01 à 1 000 bar et des températures allant jusqu’à 800 degrés Celsius . [3] Il montre l’enthalpie H {displaystyle H} 





 Le diagramme enthalpie-entropie de Mollier pour l’eau et la vapeur. La “fraction de siccité”, x , donne la fraction massique d’eau gazeuse dans la zone humide, le reste étant des gouttelettes de liquide.
Le diagramme enthalpie-entropie de Mollier pour l’eau et la vapeur. La “fraction de siccité”, x , donne la fraction massique d’eau gazeuse dans la zone humide, le reste étant des gouttelettes de liquide.
Histoire
Le diagramme a été créé en 1904, lorsque Richard Mollier a tracé la chaleur totale [4] H contre l’entropie S . [5] [1]
Lors de la conférence de thermodynamique de 1923 tenue à Los Angeles, il fut décidé de nommer, en son honneur, “diagramme de Mollier” tout diagramme thermodynamique utilisant l’enthalpie comme l’un de ses axes. [6]
Des détails

 Diagramme de Mollier (graphique), unités I – P
Diagramme de Mollier (graphique), unités I – P 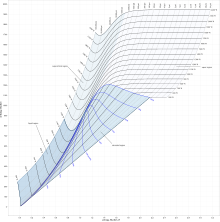
 Diagramme de Mollier (graphique), unités américaines
Diagramme de Mollier (graphique), unités américaines
Sur le diagramme, des lignes de pression constante, de température et de volume constants sont tracées, donc dans une région à deux phases, les lignes de pression et de température constantes coïncident. [7] Ainsi, les coordonnées sur le diagramme représentent l’ entropie et la chaleur . [8]
Le travail effectué dans un processus sur les cycles de vapeur est représenté par la longueur de h , il peut donc être mesuré directement, alors que dans un diagramme T – s , il doit être calculé en utilisant la relation thermodynamique entre les propriétés thermodynamiques. [1]
Dans un processus isobare , la pression reste constante, donc l’interaction thermique est le changement d’enthalpie. [2]
Dans un processus Isenthalpique , l’enthalpie est constante. [2] Une ligne horizontale dans le diagramme représente un processus Isenthalpique .
Une ligne verticale dans la carte h–s représente un processus isentropique . Le processus 3–4 dans un cycle de Rankine est isentropique lorsque la turbine à vapeur est dite idéale. Ainsi, le processus d’expansion dans une turbine peut être facilement calculé à l’aide du graphique h – s lorsque le processus est considéré comme idéal (ce qui est normalement le cas lors du calcul des enthalpies, des entropies, etc. Plus tard, les écarts par rapport aux valeurs idéales et ils peuvent être calculé en tenant compte du rendement isentropique de la turbine à vapeur utilisée.)
Des lignes de fraction de siccité constante ( x ), parfois appelées la qualité , sont tracées dans la région humide et des lignes de température constante sont tracées dans la région surchauffée. [3] X donne la fraction (en masse) de substance gazeuse dans la région humide, le reste étant des gouttelettes liquides colloïdales . Au-dessus de la ligne épaisse, la température est supérieure au point d’ébullition et la substance sèche (surchauffée) est uniquement du gaz.
En général, ces graphiques ne montrent pas les valeurs des volumes spécifiques , ni les enthalpies de l’eau saturée à des pressions qui sont de l’ordre de celles rencontrées dans les condenseurs d’une centrale thermique . [3] Par conséquent, le graphique n’est utile que pour les changements d’enthalpie dans le processus d’expansion du cycle de vapeur. [3]
Applications et utilisation
Il peut être utilisé dans des applications pratiques telles que le maltage , pour représenter le système grain-air-humidité. [9]
Les données de propriétés sous-jacentes du diagramme de Mollier sont identiques à celles d’un diagramme psychrométrique . Lors de la première inspection, il peut sembler peu de ressemblance entre les graphiques, mais si l’utilisateur fait pivoter un graphique de quatre-vingt-dix degrés et le regarde dans un miroir, la ressemblance est apparente. Les coordonnées du diagramme de Mollier sont l’enthalpie h et le taux d’humidité x . La coordonnée d’enthalpie est asymétrique et les lignes d’enthalpie constante sont parallèles et régulièrement espacées.
Voir également
- Diagrammes thermodynamiques
- Ligne de contour
- Diagramme de phase
Références
| Wikimedia Commons a des médias liés aux diagrammes enthalpie-entropie . |
- ^ un bc RK Rajput (2009), Engineering Thermodynamics , Infinity Science Series / Engineering series (3 éd.), Jones & Bartlett Learning, p. 77, ISBN 978-1-934015-14-8, récupéré le 25/06/2010
- ^ un bcY . VC Rao (2004), Une Introduction à la Thermodynamique , Universities Press, p. 70, ISBN 978-81-7371-461-0, récupéré le 25/06/2010
- ^ un bcd TD Eastop , A. McConkey (15 mars 1993), Thermodynamique appliquée pour les technologues en génie (5 éd.), Longman, ISBN 978-0-582-09193-1
- ^ “chaleur totale” est utilisée de manière équivalente avec “enthalpie”, un terme inventé seulement après 1904, et plus largement utilisé à partir de c. les années 1920.
- ^ Mollier, R. (20 février 1904). “Neue Diagramme zur technischen Wärmelehre” [Nouveaux diagrammes pour la thermodynamique technique]. Zeitschrift des Vereines Deutscher Ingenieure (en allemand). 48 (8): 271–275.
- ^ Voir :
- Mollier, R. (8 septembre 1923). “Ein neues Diagramm für Dampfluftgemische” [Un nouveau diagramme pour les mélanges vapeur d’eau-air]. Zeitschrift des Vereines Deutscher Ingenieure (en allemand). 67 : 869–872.
- Traduction anglaise : Mollier, Richard (décembre 1923). “Un nouveau diagramme pour les mélanges vapeur d’eau-air”. Génie Mécanique . 45 : 703–705.
- ^ YVC Rao (2001), Thermodynamique , Universities Press, p. 113, ISBN 978-81-7371-388-0, récupéré le 25/06/2010
- ^ Robert CH Heck (2008), La machine à vapeur et la turbine – Un manuel pour les collèges d’ingénieurs , Lire des livres, ISBN 978-1-4437-3134-8, récupéré le 25/06/2010
- ^ Dennis Edward Briggs (1998), Malts et Malterie , Springer, p. 499, ISBN 978-0-412-29800-4, récupéré le 25/06/2010
