Fluorocarbone
Les fluorocarbures , parfois appelés perfluorocarbures ou PFC , sont des composés organofluorés de formule C x F y , c’est-à-dire qu’ils ne contiennent que du carbone et du fluor . [1] La terminologie n’est pas strictement suivie et de nombreux composés organiques contenant du fluor sont appelés fluorocarbures. [2] Les composés avec le préfixe perfluoro- sont des hydrocarbures, y compris ceux avec des hétéroatomes, dans lesquels toutes les liaisons CH ont été remplacées par des liaisons CF. [3]Les fluorocarbures comprennent les perfluoroalcanes, les fluoroalcènes, les fluoroalcynes et les composés perfluoroaromatiques. Les fluorocarbures et leurs dérivés ( composés perfluorés ) sont utilisés comme fluoropolymères , Réfrigérants , solvants et anesthésiques .

Perfluoroalcanes
Propriétés chimiques
Les perfluoroalcanes sont très stables en raison de la force de la liaison carbone-fluor , l’une des plus fortes de la chimie organique. [4] Sa force est le résultat de l’électronégativité du fluor conférant un caractère ionique partiel par des charges partielles sur les atomes de carbone et de fluor, qui raccourcissent et renforcent la liaison grâce à des interactions covalentes favorables . De plus, plusieurs liaisons carbone-fluor augmentent la résistance et la stabilité d’autres liaisons carbone-fluor à proximité sur le même carbone géminal , car le carbone a une charge partielle positive plus élevée. [2] De plus, de multiples liaisons carbone-fluor renforcent également les liaisons carbone-carbone “squelettiques” de laeffet inductif . [2] Par conséquent, les fluorocarbures saturés sont plus stables chimiquement et thermiquement que leurs homologues hydrocarbonés correspondants, et en fait tout autre composé organique. Ils sont susceptibles d’être attaqués par des réducteurs très puissants, par exemple la réduction de Birch et des complexes organométalliques très spécialisés. [5]
Les fluorocarbures sont incolores et ont une densité élevée, jusqu’à plus de deux fois celle de l’eau. Ils ne sont pas miscibles avec la plupart des solvants organiques (par exemple, l’éthanol, l’acétone, l’acétate d’éthyle et le chloroforme), mais sont miscibles avec certains hydrocarbures (par exemple, l’hexane dans certains cas). Ils ont une très faible solubilité dans l’eau, et l’eau a une très faible solubilité dans eux (de l’ordre de 10 ppm). Ils ont de faibles indices de réfraction .
C δ + − F δ − {displaystyle {ce {{overset {delta+}{C}}-{overset {delta-}{F}}}}} 
Les charges partielles dans la liaison polarisée carbone-fluor
Comme l’ électronégativité élevée du fluor réduit la polarisabilité de l’atome, [2] les fluorocarbures ne sont que faiblement sensibles aux dipôles fugaces qui forment la base de la force de dispersion de Londres . En conséquence, les fluorocarbures ont de faibles forces d’attraction intermoléculaires et sont lipophobes en plus d’être hydrophobes et non polaires . Reflétant les faibles forces intermoléculaires, ces composés présentent de faibles viscosités par rapport à des liquides de points d’ébullition similaires , de faibles tensions superficielles et de faibles chaleurs de vaporisation . Le basles forces d’attraction des liquides fluorocarbonés les rendent compressibles (faible module de compressibilité ) et capables de dissoudre relativement bien les gaz. Les fluorocarbures plus petits sont extrêmement volatils . [2] Il existe cinq gaz perfluoroalcanes : le Tétrafluorométhane (bp −128 °C), l’hexafluoroéthane (bp −78,2 °C), l’ octafluoropropane (bp −36,5 °C), le perfluoro-n-butane (bp −2,2 °C) et le perfluoro -iso-butane (Eb -1 °C). Presque tous les autres fluoroalcanes sont des liquides ; l’exception la plus notable est le perfluorocyclohexane , qui se sublime à 51 °C. [6] Les fluorocarbures ont également une faibledes énergies de surface et des rigidités diélectriques élevées . [2]
- Perfluoroalcanes
-
![]()
![]()
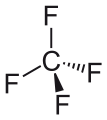
Tétrafluorure de carbone , le perfluoroalcane le plus simple
-
![]()
![]()
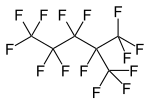
Perfluorooctane , un perfluoroalcane linéaire
-
![]()
![]()
Perfluoro-2-méthylpentane , un perfluoroalcane ramifié
-
![]()
![]()
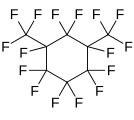
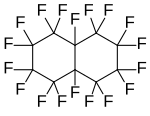
Perfluoro-1,3-diméthylcyclohexane , un perfluoroalcane cyclique
-
![]()
![]()
Perfluorodécaline , un perfluoroalcane polycyclique
Inflammabilité
Dans les années 1960, on s’intéressait beaucoup aux fluorocarbures en tant qu’anesthésiques. La recherche n’a produit aucun anesthésique, mais la recherche comprenait des tests sur la question de l’inflammabilité et a montré que les fluorocarbures testés n’étaient inflammables dans l’air en aucune proportion, bien que la plupart des tests aient été effectués dans de l’ oxygène pur ou du protoxyde d’azote pur (gaz de importance en anesthésiologie). [7] [8]
| Composé | Conditions d’essai | Résultat |
|---|---|---|
| Hexafluoroéthane | Limite inférieure d’inflammabilité dans l’oxygène | Rien |
| Perfluoropentane | Point d’éclair dans l’air | Rien |
| Point d’éclair dans l’oxygène | −6 °C | |
| Point d’éclair protoxyde d’azote | −32 °C | |
| Perfluorométhylcyclohexane | Limite inférieure d’inflammabilité dans l’air | Rien |
| Limite inférieure d’inflammabilité dans l’oxygène | 8,3 % | |
| Limite inférieure d’inflammabilité dans l’oxygène (50 °C) | 7,4 % | |
| Limite inférieure d’inflammabilité dans le protoxyde d’azote | 7,7 % | |
| Perfluoro-1,3-diméthylcyclohexane | Limite inférieure d’inflammabilité dans l’oxygène (50 °C) | 5,2 % |
| Perfluorométhyldécaline | Essai d’ allumage spontané dans l’oxygène à 127 bar |
Pas d’allumage à 500 °C |
| Allumage spontané en onde de choc adiabatique en oxygène, 0,98 à 186 bar |
Pas d’allumage | |
| Allumage spontané en onde de choc adiabatique en oxygène, 0,98 à 196 bar |
Allumage |
En 1993, 3M a envisagé les fluorocarbures comme extincteurs pour remplacer les CFC. [9] Cet effet d’extinction a été attribué à leur grande capacité calorifique , qui éloigne la chaleur du feu. Il a été suggéré qu’une atmosphère contenant un pourcentage significatif de perfluorocarbures sur une station spatiale ou similaire empêcherait complètement les incendies. [10] [11] Lorsque la combustion se produit, des fumées toxiques en résultent, notamment du fluorure de carbonyle , du monoxyde de carbone et du fluorure d’hydrogène .
Propriétés de dissolution des gaz
Les perfluorocarbures dissolvent des volumes relativement élevés de gaz. La solubilité élevée des gaz est attribuée aux faibles interactions intermoléculaires dans ces fluides fluorocarbonés. [12]
Le tableau montre les valeurs de la fraction molaire, x 1 , d’azote dissous, calculées à partir du coefficient de partage sang-gaz , à 298,15 K (25 °C), 0,101325 MPa. [13]
| Liquide | 10 4 x 1 | Concentration (mM) |
|---|---|---|
| Eau | 0,118 | 0,65 |
| Éthanol | 3,57 | 6.12 |
| Tétrahydrofurane | 5.21 | 6.42 |
| Acétone | 5.42 | 7.32 |
| Cyclohexane | 7.73 | 7.16 |
| Perfluoro-1,3-diméthylcyclohexane | 31,9 | 14.6 |
| Perfluorométhylcyclohexane | 33.1 | 16.9 |
Fabrication
Le développement de l’industrie des fluorocarbures a coïncidé avec la Seconde Guerre mondiale . [14] Auparavant, les fluorocarbures étaient préparés par réaction du fluor avec l’hydrocarbure, c’est-à-dire par fluoration directe. Étant donné que les liaisons CC sont facilement clivées par le fluor, la fluoration directe donne principalement des perfluorocarbures plus petits, tels que le Tétrafluorométhane, l’hexafluoroéthane et l’octafluoropropane. [15]
Processus Fowler
Une percée majeure qui a permis la fabrication à grande échelle de fluorocarbures a été le procédé Fowler . Dans ce processus, le Trifluorure de cobalt est utilisé comme source de fluor. A titre d’illustration, la synthèse du perfluorohexane :
C 6 H 14 + 28 CoF 3 → C 6 F 14 + 14 HF + 28 CoF 2
Le difluorure de cobalt résultant est ensuite régénéré, parfois dans un réacteur séparé :
2 CoF 2 + F 2 → 2 CoF 3
Industriellement, les deux étapes sont combinées, par exemple dans la fabrication de la gamme de fluorocarbures Flutec par F2 Chemicals Ltd, à l’aide d’un réacteur vertical à lit agité, avec hydrocarbure introduit en bas, et fluor introduit à mi-hauteur du réacteur. La vapeur de fluorocarbone est récupérée par le haut.
Fluoration électrochimique
La fluoration électrochimique (ECF) (également connue sous le nom de procédé de Simons) implique l’ électrolyse d’un substrat dissous dans du fluorure d’hydrogène . Comme le fluor est lui-même fabriqué par l’électrolyse du fluorure d’hydrogène, l’ECF est une voie plutôt plus directe vers les fluorocarbures. Le processus se déroule à basse tension (5 – 6 V) afin que le fluor libre ne soit pas libéré. Le choix du substrat est restreint car idéalement il doit être soluble dans le fluorure d’hydrogène. Les éthers et les amines tertiaires sont généralement employés. Pour fabriquer du perfluorohexane, on utilise de la trihexylamine, par exemple :
N(C 6 H 13 ) 3 + 45 HF → 3 C 6 F 14 + NF 3 + 42 H 2
L’amine perfluorée sera également produite :
N(C 6 H 13 ) 3 + 39 HF → N(C 6 F 13 ) 3 + 39H 2
Préoccupations environnementales et sanitaires
Les fluoroalcanes sont généralement inertes et non toxiques. [16] [17] [18]
Les fluoroalcanes n’appauvrissent pas la couche d’ ozone , car ils ne contiennent pas d’atomes de chlore ou de brome, et ils sont parfois utilisés en remplacement des produits chimiques appauvrissant la couche d’ozone. [19] Le terme fluorocarbure est utilisé de manière assez vague pour inclure tout produit chimique contenant du fluor et du carbone, y compris les chlorofluorocarbures , qui appauvrissent la couche d’ozone. Les fluoroalcanes sont parfois confondus avec les tensioactifs fluorés , qui se bioaccumulent de manière significative. [ citation nécessaire ]
Les perfluoroalcanes ne se bioaccumulent pas; [ citation nécessaire ] ceux utilisés dans les procédures médicales sont rapidement excrétés du corps, principalement par expiration avec le taux d’excrétion en fonction de la pression de vapeur ; la demi-vie de l’ octafluoropropane est inférieure à 2 minutes, [20] contre environ une semaine pour la perfluorodécaline. [21]

 Concentration atmosphérique de PFC-14 et PFC-116 par rapport à des gaz halogénés synthétiques similaires entre les années 1978 et 2015 (graphique de droite). Notez l’échelle logarithmique.
Concentration atmosphérique de PFC-14 et PFC-116 par rapport à des gaz halogénés synthétiques similaires entre les années 1978 et 2015 (graphique de droite). Notez l’échelle logarithmique.
Les perfluoroalcanes à bas point d’ébullition sont de puissants Gaz à effet de serre , en partie en raison de leur très longue durée de vie dans l’atmosphère, et leur utilisation est couverte par le protocole de Kyoto . [ citation nécessaire ] [22] Le potentiel de réchauffement global (comparé à celui du dioxyde de carbone) de nombreux gaz peut être trouvé dans le 5e rapport d’évaluation du GIEC, [23] avec un extrait ci-dessous pour quelques perfluoroalcanes.
| Nom | Formule chimique | Durée de vie (a) | GWP (100 ans) |
|---|---|---|---|
| PFC-14 | FC 4 | 50000 | 6630 |
| PFC-116 | C 2 F 6 | 10000 | 11100 |
| PFC-c216 | cC 3 F 6 | 3000 | 9200 |
| PFC-218 | C 3 F 6 | 2600 | 8900 |
| PFC-318 | cC 4 F 8 | 3200 | 9540 |
L’industrie de la fusion de l’aluminium a été une source majeure de perfluorocarbures atmosphériques ( Tétrafluorométhane et hexafluoroéthane en particulier), produits comme sous-produit du processus d’électrolyse. [24] Cependant, l’industrie s’est activement impliquée dans la réduction des émissions ces dernières années. [25]
Applications
Comme ils sont inertes, les perfluoroalcanes n’ont pratiquement aucune utilisation chimique, mais leurs propriétés physiques ont conduit à leur utilisation dans de nombreuses applications diverses. Ceux-ci inclus:
- Traceur perfluorocarbone
- Diélectrique liquide
- Dépôt chimique en phase vapeur
- Cycle organique de Rankine
- Catalyse biphasique fluorée [26]
- Produits de beauté
- Fart de ski
Ainsi que plusieurs usages médicaux :
- Échographie de contraste
- Oxygénothérapie
- Substitut de sang
- Respiration liquide
- Chirurgie oculaire [27]
- Détatouage [28]
Fluoroalcènes et fluoroalcynes
Les fluorocarbures insaturés sont beaucoup plus réactifs que les fluoroalcanes. Bien que le difluoroacétylène soit instable (comme c’est le cas pour les alcynes apparentés, voir dichloroacétylène ), [2] l’hexafluoro-2-butyne et les alcynes fluorés apparentés sont bien connus.
- Fluorocarbures insaturés
-
![]()
![]()
Perfluoroisobutène , un gaz fluoroalcène réactif et hautement toxique
-
![]()
![]()
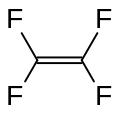
Tétrafluoroéthylène , un important monomère perfluoré.
-
![]()
![]()
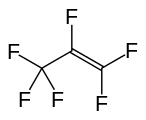
Hexafluoropropylène , un autre perfluoroalcène important.
-
![]()
![]()
Hexafluoro-2-butyne , un perfluoroalcyne.
Polymérisation
Les fluoroalcènes polymérisent de manière plus exothermique que les alcènes normaux. [2] Les fluorocarbures insaturés ont une force motrice vers l’hybridation sp 3 en raison des atomes de fluor électronégatifs recherchant une plus grande part d’électrons de liaison avec un caractère s réduit dans les orbitales. [2] Le membre le plus célèbre de cette classe est le tétrafluoroéthylène , qui est utilisé pour fabriquer le polytétrafluoroéthylène (PTFE), mieux connu sous le nom commercial Teflon .
Préoccupations environnementales et sanitaires
Les fluoroalcènes et les alcynes fluorés sont réactifs et beaucoup sont toxiques, par exemple le perfluoroisobutène . [29] [30] Les fluoroalcènes n’appauvrissent pas la couche d’ ozone , car ils ne contiennent pas d’atomes de chlore ou de brome. Ils sont trop réactifs pour être des Gaz à effet de serre. [ citation nécessaire ] Pour produire du polytétrafluoroéthylène , divers tensioactifs fluorés sont utilisés, dans le processus connu sous le nom de polymérisation en émulsion , et le tensioactif inclus dans le polymère peut se bioaccumuler.
Composés perfluoroaromatiques
Les composés perfluoroaromatiques ne contiennent que du carbone et du fluor, comme les autres fluorocarbures, mais contiennent également un cycle aromatique. Les trois exemples les plus importants sont l’hexafluorobenzène , l’ octafluorotoluène et l’octafluoronaphtalène.
- Composés perfluoroaromatiques
-
![]()
![]()
Hexafluorobenzène
Les composés perfluoroaromatiques peuvent être fabriqués via le procédé Fowler, comme les fluoroalcanes, mais les conditions doivent être ajustées pour éviter une fluoration complète. Ils peuvent également être fabriqués en chauffant le composé perchloroaromatique correspondant avec du fluorure de potassium à haute température (typiquement 500 ° C), au cours de laquelle les atomes de chlore sont remplacés par des atomes de fluor. Une troisième voie est la défluoration du fluoroalcane ; par exemple, l’octafluorotoluène peut être fabriqué à partir de perfluorométhylcyclohexane en chauffant à 500 ° C avec un catalyseur au nickel ou au fer. [31]
Les composés perfluoroaromatiques sont relativement volatils pour leur poids moléculaire, avec des points de fusion et d’ébullition similaires au composé aromatique correspondant, comme le montre le tableau ci-dessous. Ils ont une densité élevée et sont ininflammables. Pour la plupart, ce sont des liquides incolores. Contrairement aux perfluoralcanes, ils ont tendance à être miscibles avec les solvants courants. [ citation nécessaire ]
| Composé | Point de fusion (°C) | Point d’ébullition (°C) |
|---|---|---|
| Hexafluorobenzène | 5.3 | 80,5 |
| Benzène | 5.5 | 80.1 |
| Octafluorotoluène | <−70 | 102–103 |
| Toluène | −95 | 110.6 |
| Perfluoro(éthylbenzène) | 114–115 | |
| Éthylbenzène | −93,9 | 136.2 |
| Octafluoronaphtalène | 86–87 | 209 [32] |
| Naphtaline | 80.2 | 217,9 |
Voir également
- Catégorie :Fluorocarbures
- Industrie chimique fluorée
- Hydrofluorocarbure
- Fluorographène
- Perfluorocycloalcène (PFCA)
Références
- ^ IUPAC , Compendium de terminologie chimique , 2e éd. (le “Livre d’or”) (1997). Version corrigée en ligne : (2006–) ” fluorocarbures “. doi : 10.1351/goldbook.F02459
- ^ un bcdefghi Lemal DM ( janvier 2004 ) . _ “Perspective sur la chimie des fluorocarbures”. J. Org. Chim . 69 (1): 1–11. doi : 10.1021/jo0302556 . PMID 14703372 .
- ^ Murphy WJ (mars 1947). “Nomenclature du fluor … Une déclaration des rédacteurs”. Ing. ind. Chim . 39 (3): 241–242. doi : 10.1021/ie50447a004 .
- ^ O’Hagan D (février 2008). “Comprendre l’organofluorichimie. Une introduction à la liaison C – F”. Chim. Soc. Rév . 37 (2): 308–319. doi : 10.1039/b711844a . PMID 18197347 .
- ^ Kiplinger JL, Richmond TG, Osterberg CE (1994). “Activation des liaisons carbone-fluor par des complexes métalliques”. Chim. Rév . 94 (2): 373–431. doi : 10.1021/cr00026a005 .
- ^ “Copie archivée” (PDF) . Archivé de l’original (PDF) le 2008-12-05 . Récupéré le 29/11/2008 . {{cite web}}: Maint CS1 : copie archivée comme titre ( lien )
- ^ Larsen ER (1969). “Composés fluorés en anesthésiologie: inflammabilité VI”. Fluor Chem. Rév . 3 : 22–27.
- ^ Flutec (rapport technique). ISC Chemicals Limited. 1982.
- ^ John A. Pignato, Jr.; Paul E. Rivers; Myron T.Pike. “Développement des perfluorocarbures en tant qu’agents d’extinction propres” (PDF) . Institut national des normes et de la technologie. Archivé de l’original (PDF) le 2014-05-21 . Récupéré le 03/01/2019 .
- ^ McHale ET (1974). “Soutien vital sans risques de combustion”. Technologie du feu . 10 (1): 15–24. doi : 10.1007/bf02590509 . S2CID 111161665 .
- ^ Huggett C (1973). “Atmosphères Habitables Qui Ne Supportent Pas La Combustion”. Combustion et Flamme . 20 : 140–142. doi : 10.1016/s0010-2180(73)81268-4 .
- ^ “Dissoudre les gaz dans les liquides FLUTEC” (PDF) . F2 Chemicals Ltd. 2005-05-10.
- ^ Battino R, Rettich TR, Tominaga T (1984). “La solubilité de l’azote et de l’air dans les liquides”. J.Phys. Chim. Réf. Données . 13 (2): 308–319. Bibcode : 1984JPCRD..13..563B . doi : 10.1063/1.555713 .
- ^ McBee ET (mars 1947). “Chimie du fluor”. Ing. ind. Chim . 39 (3): 236–237. doi : 10.1021/ie50447a002 .
- ^ Siegemund G, Schwertfeger W, Feiring A, Smart B, Behr F, Vogel H, McKusick B “Composés fluorés, organiques” dans “Ullmann’s Encyclopedia of Industrial Chemistry” 2005, Wiley-VCH, Weinheim. doi : 10.1002/14356007.a11_349
- ^ “Copie archivée” . Archivé de l’original le 2015-09-24 . Récupéré le 19/05/2014 . {{cite web}}: Maint CS1 : copie archivée comme titre ( lien )
- ^ “Résumés robustes HPV et plan de test” (PDF) . Archives Internet. Archivé de l’original (PDF) le 2012-12-02 . Récupéré le 03/01/2019 .
- ^ Yamanouchi K; Yokoyama K (1975). “Actes du Xe Congrès international de la nutrition : Symposium sur le sang artificiel perfluorochimique, Kyoto”: 91. {{cite journal}}:Cite journal requires |journal= (help)
- ^ “Copie archivée” . Archivé de l’original le 2014-05-19 . Récupéré le 19/05/2014 . {{cite web}}: CS1 maint: archived copy as title (link)
- ^ Platts DG; Fraser JF (2011). “Soins critiques et réanimation”. 13 (1): 44–55. {{cite journal}}: Cite journal requires |journal= (help)
- ^ GeyerRP (1975). “Proc. Xth Intern. Congress for Nutr .: Symp on Perfluorochemical Artif. Blood, Kyoto”: 3–19. {{cite journal}}: Cite journal requires |journal= (help)
- ^ Changement, Convention-cadre des Nations Unies sur le climat. “Protocole de Kyoto” . unfccc.int . Récupéré le 27/09/2017 .
- ^ Myhre, G., D. Shindell, F.-M. Bréon, W. Collins, J. Fuglestvedt, J. Huang, D. Koch, J.-F. Lamarque, D. Lee, B. Mendoza, T. Nakajima, A. Robock, G. Stephens, T. Takemura et H. Zhang (2013) “Forçage radiatif anthropique et naturel” (voir tableau 8.A.1). Dans : Changement climatique 2013 : La base des sciences physiques. Contribution du Groupe de travail I au Cinquième rapport d’évaluation du Groupe d’experts intergouvernemental sur l’évolution du climat . Stocker, TF, D. Qin, G.-K. Plattner, M. Tignor, SK Allen, J. Boschung, A. Nauels, Y. Xia, V. Bex et PM Midgley (eds.). Cambridge University Press, Cambridge, Royaume-Uni et New York, NY, États-Unis.
- ^ “L’effet d’anode” . aluminium-production.com . Archivé de l’original le 2019-02-22 . Récupéré le 20/05/2014 .
- ^ “Copie archivée” (PDF) . Archivé de l’original (PDF) le 16/02/2013 . Récupéré le 20/05/2014 . {{cite web}}: CS1 maint: archived copy as title (link)www.climatevision.gov
- ^ “Copie archivée” (PDF) . Archivé de l’original (PDF) le 2014-02-07 . Récupéré le 19/05/2014 . {{cite web}}: CS1 maint: archived copy as title (link)
- ^ Imamura Y; Minami M; Ueki M; Sato B ; Ikeda T (2003). “Utilisation de liquide perfluorocarboné pendant la vitrectomie pour la rétinopathie diabétique proliférative sévère” . Br J Ophthalmol . 87 (5): 563–566. doi : 10.1136/bjo.87.5.563 . PMC 1771679 . PMID 12714393 .
- ^ “Copie archivée” (PDF) . Archivé de l’original (PDF) le 2014-05-19 . Récupéré le 19/05/2014 . {{cite web}}: CS1 maint: archived copy as title (link)
- ^ “L’annexe 2 de la Convention sur les armes chimiques” . OIAC . Récupéré le 25/01/2022 .
- ^ Timperley, Christopher M. (2000). “Composés fluorés hautement toxiques”. La Chimie du Fluor au Millenium . p. 499–538. doi : 10.1016/B978-008043405-6/50040-2 . ISBN 9780080434056.
- ^ Banques, RE (1970). Fluorocarbures et leurs dérivés, deuxième édition . Londres: MacDonald & Co. (Publishers) Ltd. pp. 203–207. ISBN 978-0-356-02798-2.
- ^ “Octafluoronaphtalène” . ChemSpider.
Liens externes
| Wikimedia Commons a des médias liés aux perfluorocarbures . |
- Fluorocarbures et hexafluorure de soufre, proposés par le Comité technique européen des fluorocarbures
- CFCs and Ozone Depletion Freeview vidéo fournie par le Vega Science Trust.
- Introduction aux fluoropolymères
- Chimie des organofluorés par Graham Sandford [ lien mort permanent ]