Caresser
Un accident vasculaire cérébral est une condition médicale dans laquelle une mauvaise circulation sanguine vers le cerveau provoque la mort cellulaire . [5] Il existe deux principaux types d’AVC : ischémique , dû à un manque de circulation sanguine, et hémorragique , dû à un saignement . [5] Les deux provoquent l’arrêt du fonctionnement correct de certaines parties du cerveau. [5] Les signes et symptômes d’un accident vasculaire cérébral peuvent inclure une incapacité à bouger ou à sentir d’un côté du corps, des problèmes de compréhension ou d’élocution , des étourdissements ou une perte de vision d’un côté .. [2] [3] Les signes et les symptômes apparaissent souvent peu de temps après l’AVC. [3] Si les symptômes durent moins d’une ou deux heures, l’AVC est un accident ischémique transitoire (AIT), également appelé mini-AVC. [3] Un accident vasculaire cérébral hémorragique peut également être associé à un mal de tête sévère . [3] Les symptômes d’un AVC peuvent être permanents. [5] Les complications à long terme peuvent inclure une pneumonie et une perte de contrôle de la vessie . [3]
| Caresser | |
|---|---|
| Autres noms | Accident vasculaire cérébral (AVC), atteinte vasculaire cérébrale (IVC), attaque cérébrale |
 |
|
| Tomodensitométrie du cerveau montrant un AVC ischémique antérieur du côté droit dû au blocage d’une artère. Les changements sur un CT peuvent ne pas être visibles dès le début. [1] | |
| Spécialité | Neurologie , médecine de l’AVC |
| Les symptômes | Incapacité à bouger ou à sentir d’un côté du corps, problèmes de compréhension ou d’élocution , étourdissements , perte de vision d’un côté [2] [3] |
| Complications | État végétatif persistant [4] |
| causes | Ischémique (blocage) et hémorragique (saignement) [5] |
| Facteurs de risque | Hypertension artérielle , tabagisme , obésité , taux de cholestérol sanguin élevé , diabète sucré , antécédents d’ AIT , insuffisance rénale terminale , fibrillation auriculaire [2] [6] [7] |
| Méthode diagnostique | Basé sur les symptômes avec l’imagerie médicale généralement utilisée pour exclure un saignement [8] [9] |
| Diagnostic différentiel | Faible taux de sucre dans le sang [8] |
| Traitement | Basé sur le type [2] |
| Pronostic | Espérance de vie moyenne 1 an [2] |
| La fréquence | 42,4 millions (2015) [10] |
| Décès | 6,3 millions (2015) [11] |
Le principal facteur de risque d’AVC est l’hypertension artérielle . [6] D’autres facteurs de risque comprennent l’hypercholestérolémie , le tabagisme , l’obésité , le diabète sucré , un AIT antérieur, une insuffisance rénale terminale et la fibrillation auriculaire . [2] [6] [7] Un accident vasculaire cérébral ischémique est généralement causé par le blocage d’un vaisseau sanguin, bien qu’il existe également des causes moins fréquentes. [12] [13] [14] Un accident vasculaire cérébral hémorragique est causé par un saignement direct dans le cerveau ou dans l’ espaceentre les membranes du cerveau . [12] [15] Le saignement peut se produire en raison d’un anévrisme cérébral rompu . [12] Le diagnostic est généralement basé sur un examen physique et étayé par une imagerie médicale telle qu’une tomodensitométrie ou une IRM . [8] Une tomodensitométrie peut exclure un saignement, mais n’exclut pas nécessairement une ischémie, qui, au début, n’apparaît généralement pas sur une tomodensitométrie. [9] D’autres tests tels qu’un électrocardiogramme (ECG) et des tests sanguins sont effectués pour déterminer les facteurs de risque et exclure d’autres causes possibles. [8] Un faible taux de sucre dans le sang peut provoquer des symptômes similaires. [8]
La prévention comprend la diminution des facteurs de risque, la chirurgie pour ouvrir les artères du cerveau chez les personnes présentant un rétrécissement carotidien problématique et la warfarine chez les personnes atteintes de fibrillation auriculaire . [2] L’aspirine ou les statines peuvent être recommandées par les médecins à titre préventif. [2] Un accident vasculaire cérébral ou un AIT nécessite souvent des soins d’urgence. [5] Un AVC ischémique, s’il est détecté dans les trois à quatre heures et demie, peut être traité avec un médicament capable de décomposer le caillot . [2] Certains AVC hémorragiques bénéficient de la chirurgie . [2]Le traitement visant à tenter de récupérer une fonction perdue est appelé réadaptation post-AVC et se déroule idéalement dans une unité d’AVC ; cependant, ceux-ci ne sont pas disponibles dans une grande partie du monde. [2]
En 2013, environ 6,9 millions de personnes ont subi un AVC ischémique et 3,4 millions de personnes ont subi un AVC hémorragique. [16] En 2015, environ 42,4 millions de personnes avaient déjà subi un AVC et étaient encore en vie. [10] Entre 1990 et 2010, le nombre d’AVC survenus chaque année a diminué d’environ 10 % dans le monde développé et augmenté de 10 % dans le monde en développement. [17] En 2015, les accidents vasculaires cérébraux étaient la deuxième cause de décès après la maladie coronarienne , représentant 6,3 millions de décès (11 % du total). [11] Environ 3,0 millions de décès ont résulté d’un AVC ischémique tandis que 3,3 millions de décès ont résulté d’un AVC hémorragique.[11] Environ la moitié des personnes qui ont subi un AVC vivent moins d’un an. [2] Dans l’ensemble, les deux tiers des AVC sont survenus chez les personnes de plus de 65 ans. [17]
Classification
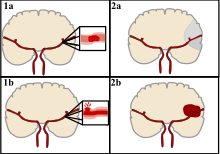
 Il existe deux grandes catégories d’AVC. Ischémique (en haut), généralement causée par un caillot sanguin dans une artère (1a) entraînant la mort cérébrale de la zone touchée (2a). Hémorragique (en bas), causée par une fuite de sang dans ou autour du cerveau à partir d’un vaisseau sanguin rompu (1b) permettant au sang de s’accumuler dans la zone affectée (2b) augmentant ainsi la pression sur le cerveau.
Il existe deux grandes catégories d’AVC. Ischémique (en haut), généralement causée par un caillot sanguin dans une artère (1a) entraînant la mort cérébrale de la zone touchée (2a). Hémorragique (en bas), causée par une fuite de sang dans ou autour du cerveau à partir d’un vaisseau sanguin rompu (1b) permettant au sang de s’accumuler dans la zone affectée (2b) augmentant ainsi la pression sur le cerveau. 

Les AVC peuvent être classés en deux grandes catégories : ischémiques et hémorragiques . [18] Les AVC ischémiques sont causés par une interruption de l’apport sanguin au cerveau, tandis que les AVC hémorragiques résultent de la rupture d’un vaisseau sanguin ou d’une structure vasculaire anormale . Environ 87 % des AVC sont ischémiques, le reste étant hémorragique. Les saignements peuvent se développer à l’intérieur des zones d’ischémie, une condition connue sous le nom de “transformation hémorragique”. On ne sait pas combien d’AVC hémorragiques commencent réellement par des AVC ischémiques. [2]
Définition
Dans les années 1970, l’ Organisation mondiale de la santé a défini l’AVC comme un “déficit neurologique de cause cérébrovasculaire qui persiste au-delà de 24 heures ou est interrompu par la mort dans les 24 heures”, [19] bien que le mot “AVC” soit vieux de plusieurs siècles. Cette définition était censée refléter la réversibilité des lésions tissulaires et a été conçue à cet effet, le délai de 24 heures étant choisi arbitrairement. La limite de 24 heures sépare l’AVC de l’accident ischémique transitoire , qui est un syndrome connexe de symptômes d’AVC qui disparaissent complètement en 24 heures. [2]Avec la disponibilité de traitements qui peuvent réduire la gravité de l’AVC lorsqu’ils sont administrés tôt, beaucoup préfèrent désormais une terminologie alternative, telle que crise cérébrale et syndrome cérébrovasculaire ischémique aigu (sur le modèle de la crise cardiaque et du syndrome coronarien aigu , respectivement), pour refléter l’urgence des symptômes de l’AVC et la nécessité d’agir rapidement. [20]
ischémique
Lors d’un AVC ischémique, l’apport sanguin à une partie du cerveau est diminué, ce qui entraîne un dysfonctionnement du tissu cérébral dans cette zone. Il y a quatre raisons pour lesquelles cela peut arriver :
- Thrombose (obstruction d’un vaisseau sanguin par un caillot sanguin se formant localement)
- Embolie (obstruction due à une embolie venue d’ailleurs dans le corps), [2]
- Hypoperfusion systémique (diminution générale de l’apport sanguin, p. ex. en état de choc ) [21]
- Thrombose du sinus veineux cérébral . [22]
Un accident vasculaire cérébral sans explication évidente est qualifié de cryptogénique (d’origine inconnue); cela représente 30 à 40% de tous les AVC ischémiques. [2] [23]
Il existe différents systèmes de classification pour l’AVC ischémique aigu. La classification de l’Oxford Community Stroke Project (OCSP, également connue sous le nom de classification de Bamford ou d’Oxford) repose principalement sur les premiers symptômes ; en fonction de l’étendue des symptômes, l’épisode d’AVC est classé comme infarctus total de la circulation antérieure (TACI), infarctus partiel de la circulation antérieure (PACI), Infarctus lacunaire (LACI) ou infarctus de la circulation postérieure (POCI). Ces quatre entités prédisent l’étendue de l’AVC, la zone du cerveau qui est touchée, la cause sous-jacente et le pronostic. [24] [25] Le TOAST (Procès d’ Org 10172dans le traitement de l’AVC aigu) la classification est basée sur les symptômes cliniques ainsi que sur les résultats d’investigations complémentaires ; sur cette base, un accident vasculaire cérébral est classé comme étant dû à (1) une thrombose ou une embolie due à l’ athérosclérose d’une grosse artère, (2) une embolie d’origine cardiaque , (3) l’obstruction complète d’un petit vaisseau sanguin, (4) autre cause déterminée, (5) cause indéterminée (deux causes possibles, aucune cause identifiée ou enquête incomplète). [26] Les utilisateurs de stimulants comme la cocaïne et la méthamphétamine courent un risque élevé d’AVC ischémique. [27]
Hémorragique
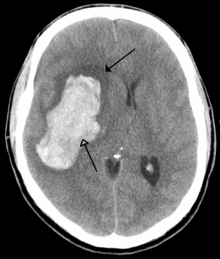
 Scanner d’un saignement intraparenchymateux (flèche du bas) avec œdème environnant (flèche du haut)
Scanner d’un saignement intraparenchymateux (flèche du bas) avec œdème environnant (flèche du haut)
Il existe deux principaux types d’AVC hémorragiques : [28] [29]
- Hémorragie intracérébrale , qui saigne essentiellement dans le cerveau lui-même (lorsqu’une artère du cerveau éclate, inondant de sang les tissus environnants), due à une hémorragie intraparenchymateuse (saignement dans le tissu cérébral) ou à une hémorragie intraventriculaire (saignement dans le système ventriculaire du cerveau). ).
- Hémorragie sous-arachnoïdienne , qui est essentiellement un saignement qui se produit à l’extérieur du tissu cérébral mais toujours dans le crâne, et précisément entre l’ arachnoïde et la pie-mère (la délicate couche la plus interne des trois couches des méninges qui entourent le cerveau).
Les deux principaux types d’AVC hémorragiques ci-dessus sont également deux formes différentes d’ hémorragie intracrânienne , qui est l’accumulation de sang n’importe où dans la voûte crânienne ; mais les autres formes d’hémorragie intracrânienne, telles que l’hématome épidural (saignement entre le crâne et la dure-mère , qui est la couche épaisse la plus externe des méninges qui entourent le cerveau) et l’hématome sous-dural (saignement dans l’ espace sous-dural ), ne sont pas pris en compte “coups hémorragiques”. [30]
Des accidents vasculaires cérébraux hémorragiques peuvent survenir à la suite d’altérations des vaisseaux sanguins du cerveau, telles qu’une angiopathie amyloïde cérébrale , une malformation artério -veineuse cérébrale et un anévrisme intracrânien , pouvant provoquer une hémorragie intraparenchymateuse ou sous-arachnoïdienne. [31]
En plus des troubles neurologiques, les AVC hémorragiques provoquent généralement des symptômes spécifiques (par exemple, l’hémorragie sous-arachnoïdienne provoque classiquement un mal de tête sévère connu sous le nom de mal de tête en coup de tonnerre ) ou révèlent des signes d’un traumatisme crânien antérieur .
Signes et symptômes
Les symptômes d’AVC commencent généralement soudainement, en quelques secondes à quelques minutes, et dans la plupart des cas, ne progressent pas davantage. Les symptômes dépendent de la zone du cerveau touchée. Plus la zone du cerveau touchée est étendue, plus les fonctions susceptibles d’être perdues sont nombreuses. Certaines formes d’AVC peuvent provoquer des symptômes supplémentaires. Par exemple, dans le cas d’une hémorragie intracrânienne, la zone touchée peut comprimer d’autres structures. La plupart des formes d’AVC ne sont pas associées à une céphalée , à l’exception de l’hémorragie sous-arachnoïdienne et de la thrombose veineuse cérébrale et parfois de l’hémorragie intracérébrale. [32]
Reconnaissance précoce
Divers systèmes ont été proposés pour augmenter la reconnaissance des accidents vasculaires cérébraux. Différents résultats sont capables de prédire la présence ou l’absence d’AVC à des degrés divers. Une faiblesse soudaine du visage, une dérive des bras (c’est-à-dire si une personne, lorsqu’on lui demande de lever les deux bras, laisse involontairement un bras dériver vers le bas) et un discours anormal sont les résultats les plus susceptibles de conduire à l’identification correcte d’un cas d’AVC, augmentant la probabilité de 5,5 lorsqu’au moins l’un d’entre eux est présent. De même, lorsque ces trois éléments sont absents, la probabilité d’AVC est diminuée (– rapport de vraisemblance de 0,39). [33] Bien que ces résultats ne soient pas parfaits pour diagnostiquer un accident vasculaire cérébral, le fait qu’ils puissent être évalués relativement rapidement et facilement les rend très utiles dans le cadre aigu.
Une annonce d’intérêt public des Centers for Disease Control and Prevention sur le traitement médical d’urgence après ou pendant un AVC à partir de 2021.
Un moyen mnémotechnique pour se souvenir des signes avant-coureurs d’un accident vasculaire cérébral est FAST (affaissement du visage, faiblesse des bras, difficulté d’élocution et délai pour appeler les services d’urgence), [34] tel que préconisé par le Ministère de la Santé (Royaume-Uni) et la Stroke Association , l’ association américaine Stroke Association , la National Stroke Association (États-Unis), le Los Angeles Prehospital Stroke Screen (LAPSS) [35] et le Cincinnati Prehospital Stroke Scale (CPSS). [36] L’utilisation de ces échelles est recommandée par les directives professionnelles. [37] FAST est moins fiable dans la reconnaissance des accidents vasculaires cérébraux postérieurs. [38]
Pour les personnes référées aux URGENCES , la reconnaissance précoce de l’AVC est jugée importante car cela peut accélérer les tests de diagnostic et les traitements. Un système de notation appelé ROSIER (reconnaissance des AVC aux URGENCES) est préconisé à cet effet ; il est basé sur les caractéristiques des antécédents médicaux et de l’examen physique. [37] [39]
Sous-types
Si la zone du cerveau affectée comprend l’une des trois principales voies du système nerveux central – le tractus spinothalamique , le tractus corticospinal et la voie de la colonne dorsale et du lemnisque médial , les symptômes peuvent inclure :
- Hémiplégie et faiblesse musculaire du visage
- engourdissement
- diminution de la sensation sensorielle ou vibratoire
- Flaccidité initiale (diminution du tonus musculaire), remplacée par la spasticité (augmentation du tonus musculaire), réflexes excessifs et synergies obligatoires. [40]
Dans la plupart des cas, les symptômes n’affectent qu’un seul côté du corps (unilatéral). Selon la partie du cerveau affectée, le défaut dans le cerveau se situe généralement du côté opposé du corps. Cependant, étant donné que ces voies voyagent également dans la moelle épinière et que toute lésion là-bas peut également produire ces symptômes, la présence de l’un de ces symptômes n’indique pas nécessairement un accident vasculaire cérébral. En plus des voies ci-dessus du SNC, le tronc cérébral donne naissance à la plupart des douze nerfs crâniens . Un accident vasculaire cérébral affectant le tronc cérébral et le cerveau peut donc produire des symptômes liés à des déficits de ces nerfs crâniens : [ la citation nécessaire ]
- altération de l’odorat, du goût, de l’ouïe ou de la vision (totale ou partielle)
- chute de la paupière ( ptose ) et faiblesse des muscles oculaires
- diminution des réflexes : haut-le-cœur, déglutition, réactivité de la pupille à la lumière
- diminution des sensations et faiblesse musculaire du visage
- problèmes d’équilibre et nystagmus
- altération de la respiration et du rythme cardiaque
- faiblesse du muscle sternocléidomastoïdien avec incapacité à tourner la tête d’un côté
- faiblesse de la langue (incapacité à tirer la langue ou à la déplacer d’un côté à l’autre)
Si le cortex cérébral est impliqué, les voies du SNC peuvent à nouveau être affectées, mais peuvent également produire les symptômes suivants :
- aphasie (difficulté d’expression verbale, de compréhension auditive, de lecture et d’écriture ; aire de Broca ou de Wernicke généralement impliquée)
- dysarthrie ( trouble moteur de la parole résultant d’une lésion neurologique)
- apraxie (mouvements volontaires modifiés)
- défaut du champ visuel
- déficits de mémoire (atteinte du lobe temporal )
- héminégligence (atteinte du lobe pariétal )
- pensée désorganisée, confusion, gestes hypersexuels (avec atteinte du lobe frontal)
- manque de compréhension de son handicap, généralement lié à un accident vasculaire cérébral
Si le cervelet est impliqué, l’ataxie peut être présente et cela comprend :
- démarche de marche altérée
- coordination des mouvements altérée
- vertige et/ou déséquilibre
Symptômes associés
La perte de conscience , les maux de tête et les vomissements surviennent généralement plus souvent dans les accidents vasculaires cérébraux hémorragiques que dans les thromboses en raison de l’augmentation de la pression intracrânienne due à la fuite de sang comprimant le cerveau.
Si les symptômes sont maximaux au début, la cause est plus susceptible d’être une hémorragie sous-arachnoïdienne ou un accident vasculaire cérébral embolique.
causes
AVC thrombotique

 Illustration d’un accident vasculaire cérébral embolique, montrant un blocage logé dans un vaisseau sanguin.
Illustration d’un accident vasculaire cérébral embolique, montrant un blocage logé dans un vaisseau sanguin.
Dans les accidents vasculaires cérébraux thrombotiques, un thrombus [41] (caillot sanguin) se forme généralement autour des plaques d’ athérosclérose . Le blocage de l’artère étant progressif, l’apparition d’un AVC thrombotique symptomatique est plus lente que celle d’un AVC hémorragique. Un thrombus lui-même (même s’il ne bloque pas complètement le vaisseau sanguin) peut entraîner un accident vasculaire cérébral embolique (voir ci-dessous) si le thrombus se détache et se déplace dans la circulation sanguine, auquel cas on parle d’ embolie . Deux types de thrombose peuvent provoquer un AVC :
- La maladie des gros vaisseaux touche les artères carotides communes et internes , l’ artère vertébrale et le cercle de Willis . [42] Les maladies pouvant former des thrombus dans les gros vaisseaux comprennent (en incidence décroissante) : l’athérosclérose, la vasoconstriction (resserrement de l’artère), la dissection de l’artère aortique , carotidienne ou vertébrale , diverses maladies inflammatoires de la paroi des vaisseaux sanguins ( artérite de Takayasu , géant artérite cellulaire , vascularite ), vasculopathie non inflammatoire, maladie de Moyamoyaet dysplasie fibromusculaire .
- La maladie des petits vaisseaux implique les petites artères à l’intérieur du cerveau : les branches du cercle de Willis , l’artère cérébrale moyenne, la tige et les artères issues de l’artère vertébrale distale et de l’ artère basilaire . [43] Les maladies qui peuvent former des thrombi dans les petits vaisseaux comprennent (en incidence décroissante) : la lipohyalinose (accumulation de matière hyaline grasse dans le vaisseau sanguin en raison de l’hypertension artérielle et du vieillissement) et la dégénérescence fibrinoïde (un accident vasculaire cérébral impliquant ces vaisseaux sanguins est connu sous le nom d’ AVC lacunaire ) et de microathérome (petites plaques d’athérosclérose). [44]
L’anémie falciforme , qui peut provoquer l’agglutination des cellules sanguines et bloquer les vaisseaux sanguins, peut également entraîner un accident vasculaire cérébral. Un accident vasculaire cérébral est la deuxième cause de décès chez les personnes de moins de 20 ans atteintes d’anémie falciforme. [45] La pollution de l’air peut également augmenter le risque d’AVC. [46]
AVC embolique
Un accident vasculaire cérébral embolique fait référence à une embolie artérielle (un blocage d’une artère) par une embolie , une particule voyageant ou des débris dans la circulation sanguine artérielle provenant d’ailleurs. Un embole est le plus souvent un thrombus, mais il peut également s’agir d’un certain nombre d’autres substances, notamment de la graisse (par exemple, de la moelle osseuse dans un os cassé ), de l’air, des cellules cancéreuses ou des amas de bactéries (généralement d’une endocardite infectieuse ). [47]
Parce qu’une embolie survient d’ailleurs, la thérapie locale ne résout le problème que temporairement. Ainsi, la source de l’embolie doit être identifiée. Parce que le blocage embolique est d’apparition soudaine, les symptômes sont généralement maximaux au début. De plus, les symptômes peuvent être transitoires car l’embolie est partiellement résorbée et se déplace vers un endroit différent ou se dissipe complètement.
Les emboles proviennent le plus souvent du cœur (en particulier dans la fibrillation auriculaire ) mais peuvent provenir d’ailleurs dans l’arbre artériel. Dans l’ embolie paradoxale , une thrombose veineuse profonde s’embolie par un défaut septal auriculaire ou ventriculaire du cœur dans le cerveau. [47]
Les causes d’AVC liées au cœur peuvent être distinguées entre à haut et à faible risque : [48]
- Risque élevé : fibrillation auriculaire et fibrillation auriculaire paroxystique , maladie rhumatismale de la valvule mitrale ou aortique , valvules cardiaques artificielles , thrombus cardiaque connu de l’oreillette ou du ventricule, maladie des sinus , flutter auriculaire soutenu , infarctus du myocarde récent, infarctus du myocarde chronique avec fraction d’éjection < 28 %, insuffisance cardiaque congestive symptomatique avec fraction d’éjection < 30 %, cardiomyopathie dilatée , endocardite de Libman-Sacks, endocardite marantique , endocardite infectieuse, fibroélastome papillaire , myxome auriculaire gauche et chirurgie de pontage aortocoronarien (CABG).
- Faible risque/potentiel : calcification de l’anneau (anneau) de la valve mitrale, foramen ovale perméable (PFO), anévrisme septal auriculaire, anévrisme septal auriculaire avec foramen ovale perméable, anévrisme ventriculaire gauche sans thrombus, « fumée » auriculaire gauche isolée à l’ échocardiographie (pas de sténose mitrale ni de fibrillation auriculaire), athérome complexe de l’ aorte ascendante ou de l’arc proximal.
Parmi ceux qui ont un blocage complet de l’une des artères carotides, le risque d’accident vasculaire cérébral de ce côté est d’environ un pour cent par an. [49]
Une forme particulière d’AVC embolique est l’ AVC embolique de source indéterminée (ESUS). Ce sous-ensemble d’AVC cryptogénique est défini comme un infarctus cérébral non lacunaire sans sténose artérielle proximale ni sources cardio-emboliques. Environ un AVC ischémique sur six pourrait être classé comme ESUS. [50]
Hypoperfusion cérébrale
L’hypoperfusion cérébrale est la réduction du flux sanguin vers toutes les parties du cerveau. La réduction pourrait être à une partie particulière du cerveau en fonction de la cause. Elle est le plus souvent due à une insuffisance cardiaque due à un arrêt cardiaque ou à des arythmies, ou à un débit cardiaque réduit à la suite d’ un infarctus du myocarde , d’une embolie pulmonaire , d’ un épanchement péricardique ou d’un saignement. [ citation nécessaire ] Hypoxémie(faible teneur en oxygène dans le sang) peut précipiter l’hypoperfusion. Parce que la réduction du flux sanguin est globale, toutes les parties du cerveau peuvent être affectées, en particulier les zones vulnérables du « bassin versant », les régions frontalières alimentées par les principales artères cérébrales. Un accident vasculaire cérébral dans les bassins versants fait référence à la condition dans laquelle l’approvisionnement en sang de ces zones est compromis. Le flux sanguin vers ces zones ne s’arrête pas nécessairement, mais il peut plutôt diminuer au point où des lésions cérébrales peuvent survenir.
Thrombose veineuse
La thrombose du sinus veineux cérébral entraîne un accident vasculaire cérébral en raison de l’augmentation locale de la pression veineuse, qui dépasse la pression générée par les artères. Les infarctus sont plus susceptibles de subir une transformation hémorragique (fuite de sang dans la zone endommagée) que les autres types d’AVC ischémiques. [22]
Hémorragie intracérébrale
Elle survient généralement dans les petites artères ou artérioles et est souvent due à l’hypertension, [51] à des malformations vasculaires intracrâniennes (y compris des angiomes caverneux ou des malformations artério -veineuses ), à une angiopathie amyloïde cérébrale ou à des infarctus dans lesquels une hémorragie secondaire s’est produite. [2] D’autres causes potentielles sont les traumatismes, les troubles de la coagulation , l’angiopathie amyloïde , la consommation de drogues illicites (par exemple, les amphétamines ou la cocaïne ). L’hématome grossit jusqu’à ce que la pression des tissus environnants limite sa croissance, ou jusqu’à ce qu’il se décomprime en se vidant dans le système ventriculaire , CSFou la surface piale. Un tiers des saignements intracérébraux se situent dans les ventricules cérébraux. L’ICH a un taux de mortalité de 44 % après 30 jours, supérieur à celui de l’AVC ischémique ou de l’hémorragie sous- arachnoïdienne (qui, techniquement, peut également être classé comme un type d’AVC [2] ).
Autre
D’autres causes peuvent inclure un spasme d’une artère. Cela peut se produire en raison de la cocaïne . [52]
Course silencieuse
Un AVC silencieux est un AVC qui ne présente aucun symptôme extérieur, et les gens ne sont généralement pas conscients qu’ils ont eu un AVC. Bien qu’il ne provoque pas de symptômes identifiables, un AVC silencieux endommage toujours le cerveau et expose la personne à un risque accru d’ accident ischémique transitoire et d’accident vasculaire cérébral majeur à l’avenir. À l’inverse, ceux qui ont eu un AVC majeur sont également à risque d’avoir des AVC silencieux. [53] Dans une vaste étude en 1998, on estime que plus de 11 millions de personnes ont subi un accident vasculaire cérébral aux États-Unis. Environ 770 000 de ces AVC étaient symptomatiques et 11 millions étaient les premiers infarctus ou hémorragies IRM silencieux . Les AVC silencieux provoquent généralement des lésionsqui sont détectés par l’utilisation de la neuroimagerie comme l’ IRM . On estime que les AVC silencieux se produisent à cinq fois le taux d’AVC symptomatiques. [54] [55] Le risque d’accident vasculaire cérébral silencieux augmente avec l’âge, mais peut également affecter les jeunes adultes et les enfants, en particulier ceux souffrant d’ anémie aiguë . [54] [56]
Physiopathologie
ischémique
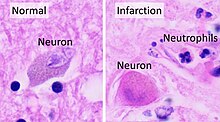
 Histopathologie à fort grossissement d’un neurone normal, et un AVC ischémique à environ 24 heures sur coloration H&E : Les neurones deviennent hyperéosinophiles et il y a un infiltrat de neutrophiles . Il y a un léger œdème et une perte d’architecture normale dans le neuropile environnant .
Histopathologie à fort grossissement d’un neurone normal, et un AVC ischémique à environ 24 heures sur coloration H&E : Les neurones deviennent hyperéosinophiles et il y a un infiltrat de neutrophiles . Il y a un léger œdème et une perte d’architecture normale dans le neuropile environnant .
L’AVC ischémique survient en raison d’une perte d’approvisionnement en sang dans une partie du cerveau, déclenchant la cascade ischémique . [57] Le tissu cérébral cesse de fonctionner s’il est privé d’oxygène pendant plus de 60 à 90 secondes [ citation nécessaire ] , et après environ trois heures, il subira des lésions irréversibles pouvant entraîner la mort du tissu, c’est-à-dire un infarctus . (C’est pourquoi les fibrinolytiques tels que l’alteplase ne sont administrés que jusqu’à trois heures après le début de l’AVC.) L’athérosclérose peut perturber l’apport sanguin en rétrécissant la lumière des vaisseaux sanguins, entraînant une réduction du flux sanguin, en provoquant la formation de caillots sanguins. à l’intérieur du vaisseau, ou en libérant des gerbes de petitesemboles par la désintégration des plaques d’athérosclérose. [58] L’infarctus embolique survient lorsque des embolies se forment ailleurs dans le système circulatoire, généralement dans le cœur à la suite d’une fibrillation auriculaire, ou dans les artères carotides, se rompent, pénètrent dans la circulation cérébrale, puis se logent et bloquent les vaisseaux sanguins cérébraux. Étant donné que les vaisseaux sanguins du cerveau sont maintenant bloqués, le cerveau perd de son énergie et recourt donc à l’utilisation du métabolisme anaérobie dans la région du tissu cérébral affectée par l’ischémie. Le métabolisme anaérobie produit moins d’ adénosine triphosphate (ATP) mais libère un sous-produit appelé acide lactique. L’acide lactique est un irritant qui pourrait potentiellement détruire les cellules car c’est un acide et perturbe l’équilibre acido-basique normal dans le cerveau. La zone d’ischémie est appelée ” pénombre ischémique “. [59]
Au fur et à mesure que l’oxygène ou le glucose s’épuisent dans le tissu cérébral ischémique, la production de composés phosphate à haute énergie tels que l’adénosine triphosphate (ATP) échoue, entraînant l’échec des processus dépendant de l’énergie (tels que le pompage ionique) nécessaires à la survie des cellules tissulaires. Cela déclenche une série d’événements interdépendants qui entraînent des lésions cellulaires et la mort. Une cause majeure de lésion neuronale est la libération du glutamate, un neurotransmetteur excitateur. La concentration de glutamate à l’extérieur des cellules du système nerveux est normalement maintenue faible par des transporteurs dits d’absorption, qui sont alimentés par les gradients de concentration des ions (principalement Na +) à travers la membrane cellulaire. Cependant, un accident vasculaire cérébral coupe l’apport d’oxygène et de glucose qui alimente les pompes ioniques maintenant ces gradients. En conséquence, les gradients ioniques transmembranaires diminuent et les transporteurs de glutamate inversent leur direction, libérant du glutamate dans l’espace extracellulaire. Le glutamate agit sur les récepteurs des cellules nerveuses (en particulier les récepteurs NMDA), produisant un afflux de calcium qui active les enzymes qui digèrent les protéines, les lipides et le matériel nucléaire des cellules. L’afflux de calcium peut également conduire à l’échec des mitochondries , ce qui peut conduire davantage à l’épuisement de l’énergie et peut déclencher la mort cellulaire due à la mort cellulaire programmée . [60]
L’ischémie induit également la production de radicaux libres d’oxygène et d’autres espèces réactives de l’oxygène . Ceux-ci réagissent avec et endommagent un certain nombre d’éléments cellulaires et extracellulaires. Les dommages à la paroi des vaisseaux sanguins ou à l’endothélium sont particulièrement importants. En fait, de nombreux neuroprotecteurs antioxydants tels que l’acide urique et le NXY-059 agissent au niveau de l’endothélium et non dans le cerveau en soi . Les radicaux libres initient également directement des éléments de la cascade de mort cellulaire programmée au moyen de la signalisation redox . [61]
Ces processus sont les mêmes pour tout type de tissu ischémique et sont appelés collectivement la cascade ischémique . Cependant, le tissu cérébral est particulièrement vulnérable à l’ischémie car il a peu de réserve respiratoire et dépend complètement du métabolisme aérobie , contrairement à la plupart des autres organes.
En plus des effets néfastes sur les cellules cérébrales, l’ischémie et l’infarctus peuvent entraîner une perte de l’intégrité structurelle du tissu cérébral et des vaisseaux sanguins, en partie par la libération de métalloprotéases matricielles, qui sont des enzymes dépendantes du zinc et du calcium qui décomposent le collagène, l’acide hyaluronique , et d’autres éléments du tissu conjonctif . D’autres protéases contribuent également à ce processus. La perte de l’intégrité structurelle vasculaire entraîne une rupture de la barrière hémato-encéphalique protectrice qui contribue à l’œdème cérébral , ce qui peut entraîner une progression secondaire de la lésion cérébrale. [ citation nécessaire ]
Hémorragique
Les AVC hémorragiques sont classés en fonction de leur pathologie sous-jacente. Certaines causes d’AVC hémorragique sont l’hémorragie hypertensive , la rupture d’ anévrisme , la rupture de la fistule AV , la transformation d’un infarctus ischémique antérieur et les saignements induits par des médicaments . [62] Ils entraînent des lésions tissulaires en provoquant une compression des tissus à partir d’un hématome ou d’hématomes en expansion. De plus, la pression peut entraîner une perte d’approvisionnement en sang des tissus affectés, entraînant un infarctus , et le sang libéré par une hémorragie cérébrale semble avoir des effets toxiques directs sur les tissus cérébraux et le système vasculaire . [45] [63] Inflammationscontribue à la lésion cérébrale secondaire après une hémorragie. [63]
Diagnostic

 Une tomodensitométrie montrant les premiers signes d’un AVC de l’artère cérébrale moyenne avec perte de définition des gyri et limite gris blanc
Une tomodensitométrie montrant les premiers signes d’un AVC de l’artère cérébrale moyenne avec perte de définition des gyri et limite gris blanc 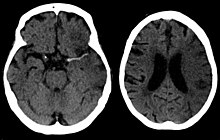
 Dens media signe chez un patient présentant un infarctus de l’artère cérébrale moyenne illustré à gauche. Image correcte après 7 heures.
Dens media signe chez un patient présentant un infarctus de l’artère cérébrale moyenne illustré à gauche. Image correcte après 7 heures.
L’AVC est diagnostiqué par plusieurs techniques : un examen neurologique (comme le NIHSS ), des tomodensitogrammes (le plus souvent sans amélioration du contraste) ou des IRM , une échographie Doppler et une artériographie . Le diagnostic d’AVC lui-même est clinique, avec l’aide des techniques d’imagerie. Les techniques d’imagerie aident également à déterminer les sous-types et la cause de l’AVC. Il n’y a pas encore de test sanguin couramment utilisé pour le diagnostic de l’AVC lui-même, bien que des tests sanguins puissent être utiles pour découvrir la cause probable de l’AVC. [64] Chez les personnes décédées, une autopsie d’AVC peut aider à établir le délai entre le début de l’AVC et le décès.
Examen physique
Un examen physique , y compris la prise d’antécédents médicaux des symptômes et d’un état neurologique, permet d’évaluer l’emplacement et la gravité d’un accident vasculaire cérébral. Il peut donner un score standard sur, par exemple, l’ échelle des accidents vasculaires cérébraux du NIH .
Imagerie
Pour diagnostiquer un AVC ischémique (blocage) en situation d’urgence : [65]
- CT scans ( sans amélioration du contraste)
sensibilité = 16 % (moins de 10 % dans les 3 premières heures suivant l’apparition des symptômes) spécificité = 96%
- IRM
sensibilité= 83% spécificité= 98%
Pour diagnostiquer un AVC hémorragique en situation d’urgence :
- CT scans ( sans amélioration du contraste)
sensibilité= 89% spécificité= 100%
- IRM
sensibilité= 81% spécificité= 100%
Pour détecter les hémorragies chroniques, l’IRM est plus sensible. [66]
Pour l’évaluation d’un AVC stable, les scanners de médecine nucléaire SPECT et PET/CT peuvent être utiles. La SPECT documente le flux sanguin cérébral et la TEP avec isotope FDG l’activité métabolique des neurones.
Les tomodensitogrammes peuvent ne pas détecter un AVC ischémique, surtout s’il est petit, d’apparition récente, [9] ou dans les régions du tronc cérébral ou du cervelet ( infarctus de la circulation postérieure ). L’IRM est plus efficace pour détecter l’infarctus de la circulation postérieure avec l’imagerie pondérée en diffusion . [67] Une tomodensitométrie sert davantage à exclure certaines imitations d’AVC et à détecter des saignements. [9]
Cause sous-jacente
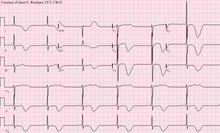
 ECG à 12 dérivations d’un patient victime d’un AVC, montrant de grandes ondes T profondément inversées . Divers changements à l’ECG peuvent survenir chez les personnes victimes d’accidents vasculaires cérébraux et d’autres troubles cérébraux.
ECG à 12 dérivations d’un patient victime d’un AVC, montrant de grandes ondes T profondément inversées . Divers changements à l’ECG peuvent survenir chez les personnes victimes d’accidents vasculaires cérébraux et d’autres troubles cérébraux.
Lorsqu’un accident vasculaire cérébral a été diagnostiqué, diverses autres études peuvent être effectuées pour déterminer la cause sous-jacente. Avec les options de traitement et de diagnostic actuellement disponibles, il est particulièrement important de déterminer s’il existe une source périphérique d’emboles. La sélection des tests peut varier puisque la cause de l’AVC varie selon l’âge, la comorbidité et la présentation clinique. Voici les techniques couramment utilisées :
- une étude échographique/doppler des artères carotides (pour détecter une sténose carotidienne ) ou une dissection des artères précérébrales ;
- un électrocardiogramme (ECG) et un échocardiogramme (pour identifier les arythmies et les caillots résultants dans le cœur qui peuvent se propager aux vaisseaux cérébraux par la circulation sanguine);
- une étude de moniteur Holter pour identifier les rythmes cardiaques anormaux intermittents ;
- une angiographie du système vasculaire cérébral (si l’on pense qu’un saignement provient d’un anévrisme ou d’ une malformation artério -veineuse );
- des tests sanguins pour déterminer si le cholestérol sanguin est élevé , s’il existe une tendance anormale aux saignements et si certains processus plus rares tels que l’homocystinurie peuvent être impliqués.
Pour les accidents vasculaires cérébraux hémorragiques, une tomodensitométrie ou une IRM avec contraste intravasculaire peut être en mesure d’identifier des anomalies dans les artères cérébrales (telles que des anévrismes) ou d’autres sources de saignement, et une IRM structurelle si cela ne montre aucune cause. Si cela n’identifie pas non plus une cause sous-jacente du saignement, une angiographie cérébrale invasive peut être réalisée, mais cela nécessite un accès à la circulation sanguine avec un cathéter intravasculaire et peut entraîner d’autres accidents vasculaires cérébraux ainsi que des complications au site d’insertion et cette investigation est donc réservée à situations particulières. [68] S’il y a des symptômes suggérant que l’hémorragie pourrait avoir eu lieu à la suite d’ une thrombose veineuse, CT ou phlébographie IRM peuvent être utilisés pour examiner les veines cérébrales. [68]
Erreur de diagnostic
Parmi les personnes ayant subi un AVC ischémique, un diagnostic erroné survient de 2 à 26 % du temps. [69] Un « caméléon de l’AVC » (SC) est un accident vasculaire cérébral qui est diagnostiqué comme autre chose. [69] [70]
Les personnes qui ne subissent pas d’AVC peuvent également être diagnostiquées à tort comme un AVC. L’administration de thrombolytiques (casse-caillots) dans de tels cas provoque des saignements intracérébraux 1 à 2% du temps, ce qui est inférieur à celui des personnes ayant subi un AVC. Ce traitement inutile augmente les coûts des soins de santé. Même dans ce cas, les lignes directrices de l’AHA/ASA indiquent qu’il est préférable de commencer le tPA intraveineux chez d’éventuels mimiques plutôt que de retarder le traitement pour des tests supplémentaires. [69]
Les femmes, les Afro-Américains, les Hispano-Américains, les Asiatiques et les Insulaires du Pacifique sont plus souvent mal diagnostiqués pour une condition autre qu’un AVC alors qu’ils ont en fait un AVC. De plus, les adultes de moins de 44 ans sont sept fois plus susceptibles de manquer un AVC que les adultes de plus de 75 ans. C’est particulièrement le cas pour les personnes plus jeunes atteintes d’infarctus de la circulation postérieure. [69] Certains centres médicaux ont utilisé l’IRM hyperaiguë dans des études expérimentales pour des personnes initialement considérées comme ayant une faible probabilité d’accident vasculaire cérébral. Et chez certaines de ces personnes, des accidents vasculaires cérébraux ont été découverts, qui ont ensuite été traités avec des médicaments thrombolytiques. [69]
La prévention
Compte tenu de la charge de morbidité des accidents vasculaires cérébraux, la prévention est une importante préoccupation de santé publique . [71] La prévention primaire est moins efficace que la prévention secondaire (à en juger par le nombre de personnes à traiter pour prévenir un accident vasculaire cérébral par an). [71] Des lignes directrices récentes détaillent les preuves de la prévention primaire de l’AVC. [72] Chez ceux qui sont par ailleurs en bonne santé, l’aspirine ne semble pas bénéfique et n’est donc pas recommandée. [73] Chez les personnes ayant subi un infarctus du myocarde ou celles présentant un risque cardiovasculaire élevé, elle offre une certaine protection contre un premier AVC. [74] [75]Chez ceux qui ont déjà eu un AVC, un traitement avec des médicaments tels que l’aspirine , le clopidogrel et le dipyridamole peut être bénéfique. [74] Le groupe de travail américain sur les services préventifs (USPSTF) recommande de ne pas dépister la sténose de l’artère carotide chez les personnes sans symptômes. [76]
Facteurs de risque
Les facteurs de risque modifiables les plus importants d’accident vasculaire cérébral sont l’hypertension artérielle et la fibrillation auriculaire, bien que l’ampleur de l’effet soit faible ; 833 personnes doivent être traitées pendant 1 an pour prévenir un AVC. [77] [78] D’autres facteurs de risque modifiables comprennent les taux élevés de cholestérol sanguin, le diabète sucré , l’insuffisance rénale terminale , [7] le tabagisme [79] [80] (actif et passif), la consommation excessive d’ alcool , [81] la consommation de drogue . consommation, [82] manque d’ activité physique , obésité , consommation de viande rouge transformée, [83] et alimentation malsaine.[84] Fumer une seule cigarette par jour augmente le risque de plus de 30 %. [85] La consommation d’alcool pourrait prédisposer aux accidents vasculaires cérébraux ischémiques, ainsi qu’aux hémorragies intracérébrales et sous-arachnoïdiennes via de multiples mécanismes (par exemple, via l’hypertension, la fibrillation auriculaire, la thrombocytose de rebond et l’agrégation plaquettaire et les troubles de la coagulation ). [86] Les drogues, le plus souvent les amphétamines et la cocaïne, peuvent provoquer un accident vasculaire cérébral en endommageant les vaisseaux sanguins du cerveau et en provoquant une hypertension aiguë. [62] [87] La migraine avec aura double le risque d’AVC ischémique d’une personne. [88] [89] Non traité,la maladie cœliaque, indépendamment de la présence de symptômes, peut être une cause sous-jacente d’accident vasculaire cérébral, tant chez les enfants que chez les adultes. [90]
Des niveaux élevés d’activité physique réduisent le risque d’AVC d’environ 26 %. [91] Il y a un manque d’études de haute qualité portant sur les efforts promotionnels pour améliorer les facteurs liés au mode de vie. [92] Néanmoins, étant donné le grand nombre de preuves circonstancielles, la meilleure prise en charge médicale de l’AVC comprend des conseils sur l’alimentation, l’exercice, le tabagisme et la consommation d’alcool. [93] La médication est la méthode la plus courante de prévention des accidents vasculaires cérébraux; l’endartériectomie carotidienne peut être une méthode chirurgicale utile pour prévenir les accidents vasculaires cérébraux.
Pression artérielle
L’hypertension artérielle représente 35 à 50 % du risque d’AVC. [94] Une réduction de la pression artérielle de 10 mmHg systolique ou diastolique de 5 mmHg réduit le risque d’AVC d’environ 40 %. [95] L’abaissement de la pression artérielle a été démontré de manière concluante pour prévenir les AVC ischémiques et hémorragiques. [96] [97] Il est également important en prévention secondaire. [98] Même les personnes âgées de plus de 80 ans et celles souffrant d’hypertension systolique isolée bénéficient d’un traitement antihypertenseur. [99] [100] [101]Les preuves disponibles ne montrent pas de grandes différences dans la prévention des accidents vasculaires cérébraux entre les médicaments antihypertenseurs – par conséquent, d’autres facteurs tels que la protection contre d’autres formes de maladies cardiovasculaires et le coût doivent être pris en compte. [102] [103] Il n’a pas été démontré que l’utilisation systématique de bêta-bloquants à la suite d’un accident vasculaire cérébral ou d’un AIT entraîne des avantages. [104]
Lipides sanguins
Des taux élevés de cholestérol ont été associés de manière incohérente aux accidents vasculaires cérébraux (ischémiques). [97] [105] Il a été démontré que les statines réduisent le risque d’AVC d’environ 15 %. [106] Étant donné que les méta-analyses antérieures d’autres médicaments hypolipidémiants n’ont pas montré de risque réduit, [107] les statines pourraient exercer leur effet par des mécanismes autres que leurs effets hypolipémiants. [106]
Diabète sucré
Le diabète sucré augmente le risque d’AVC de 2 à 3 fois. Bien qu’il ait été démontré qu’un contrôle intensif de la glycémie réduisait les complications des petits vaisseaux sanguins telles que les lésions rénales et les lésions de la rétine de l’œil , il n’a pas été démontré qu’il réduisait les complications des gros vaisseaux sanguins telles que les accidents vasculaires cérébraux. [108] [109]
Médicaments anticoagulants
Les anticoagulants oraux tels que la warfarine sont le pilier de la prévention des AVC depuis plus de 50 ans. Cependant, plusieurs études ont montré que l’aspirine et les autres antiplaquettaires sont très efficaces en prévention secondaire après un AVC ou un accident ischémique transitoire. [74] De faibles doses d’aspirine (par exemple 75 à 150 mg) sont aussi efficaces que des doses élevées mais ont moins d’effets secondaires ; la dose efficace la plus faible reste inconnue. [110] Les thiénopyridines ( clopidogrel , ticlopidine ) pourraient être légèrement plus efficaces que l’aspirine et avoir un risque réduit de saignement gastro-intestinal , mais sont plus chers. [111]L’aspirine et le clopidogrel peuvent être utiles dans les premières semaines après un accident vasculaire cérébral mineur ou un AIT à haut risque. [112] Le clopidogrel a moins d’effets secondaires que la ticlopidine. [111] Le dipyridamole peut être ajouté à la thérapie à l’aspirine pour fournir un petit avantage supplémentaire, même si les maux de tête sont un effet secondaire courant. [113] L’aspirine à faible dose est également efficace pour la prévention des accidents vasculaires cérébraux après un infarctus du myocarde. [75]
Les personnes atteintes de fibrillation auriculaire ont un risque d’accident vasculaire cérébral de 5 % par an, et ce risque est plus élevé chez les personnes atteintes de fibrillation auriculaire valvulaire. [114] Selon le risque d’AVC, l’anticoagulation avec des médicaments tels que la warfarine ou l’aspirine est utile pour la prévention. [115] Sauf chez les personnes atteintes de fibrillation auriculaire, les anticoagulants oraux ne sont pas conseillés pour la prévention des accidents vasculaires cérébraux – tout avantage est compensé par le risque de saignement. [116]
En prévention primaire, cependant, les antiagrégants plaquettaires ne réduisaient pas le risque d’AVC ischémique mais augmentaient le risque d’hémorragie majeure. [117] [118] D’autres études sont nécessaires pour étudier un éventuel effet protecteur de l’aspirine contre l’AVC ischémique chez les femmes. [119] [120]
Opération
L’endartériectomie carotidienne ou l’ angioplastie carotidienne peut être utilisée pour éliminer le rétrécissement athéroscléreux de l’ artère carotide . Il existe des preuves à l’appui de cette procédure dans des cas sélectionnés. [93] L’endartériectomie pour une sténose importante s’est avérée utile pour prévenir d’autres AVC chez ceux qui en ont déjà subi un. [121] Le stenting de l’artère carotide ne s’est pas avéré aussi utile. [122] [123] Les personnes sont sélectionnées pour la chirurgie en fonction de l’âge, du sexe, du degré de sténose, du temps écoulé depuis les symptômes et des préférences de la personne. [93]La chirurgie est plus efficace lorsqu’elle n’est pas retardée trop longtemps – le risque d’AVC récurrent chez une personne qui a une sténose de 50 % ou plus peut atteindre 20 % après 5 ans, mais l’endartériectomie réduit ce risque à environ 5 %. Le nombre d’interventions nécessaires pour guérir une personne était de 5 pour une intervention chirurgicale précoce (dans les deux semaines suivant l’AVC initial), mais de 125 si elle était retardée de plus de 12 semaines. [124] [125]
Le dépistage du rétrécissement de l’artère carotide ne s’est pas révélé être un test utile dans la population générale. [126] Les études d’intervention chirurgicale pour la sténose de l’artère carotide sans symptômes n’ont montré qu’une faible diminution du risque d’AVC. [127] [128] Pour être bénéfique, le taux de complications de la chirurgie doit être maintenu en dessous de 4 %. Même dans ce cas, pour 100 interventions chirurgicales, 5 personnes bénéficieront d’éviter un AVC, 3 développeront un AVC malgré la chirurgie, 3 développeront un AVC ou mourront des suites de la chirurgie elle-même, et 89 resteront sans AVC mais l’auraient également fait sans intervention. [93]
Régime
La nutrition, en particulier le régime de style méditerranéen , a le potentiel de réduire de plus de moitié le risque d’avoir un accident vasculaire cérébral. [129] Il ne semble pas que l’abaissement des niveaux d’ homocystéine avec de l’acide folique affecte le risque d’accident vasculaire cérébral. [130] [131]
Une annonce d’intérêt public des Centers for Disease Control and Prevention concernant une femme victime d’un accident vasculaire cérébral après une grossesse.
Femmes
Un certain nombre de recommandations spécifiques ont été faites pour les femmes, notamment la prise d’aspirine après la 11e semaine de grossesse en cas d’antécédents d’hypertension artérielle chronique et la prise de médicaments contre l’hypertension pendant la grossesse si la pression artérielle est supérieure à 150 mmHg systolique ou supérieure à 100 mmHg diastolique. Chez celles qui ont déjà eu une prééclampsie , d’autres facteurs de risque doivent être traités de manière plus agressive. [132]
AVC ou AIT antérieur
Il est recommandé de maintenir la pression artérielle en dessous de 140/90 mmHg. [133] L’anticoagulation peut prévenir les AVC ischémiques récurrents. Chez les personnes atteintes de fibrillation auriculaire non valvulaire, l’anticoagulation peut réduire les AVC de 60 %, tandis que les agents antiplaquettaires peuvent réduire les AVC de 20 %. [134] Cependant, une méta-analyse récente suggère que les dommages causés par l’anticoagulation ont commencé tôt après un accident vasculaire cérébral embolique. [135] Le traitement de prévention des AVC pour la fibrillation auriculaire est déterminé selon le score CHA2DS2–VASc . L’anticoagulant le plus largement utilisé pour prévenir les accidents vasculaires cérébraux thromboemboliques chez les personnes atteintes de fibrillation auriculaire non valvulaire est la warfarine , un agent oral, tandis qu’un certain nombre d’agents plus récents, dont le dabigatransont des alternatives qui ne nécessitent pas de surveillance du temps de prothrombine . [133]
Les anticoagulants, lorsqu’ils sont utilisés après un AVC, ne doivent pas être arrêtés pour les procédures dentaires. [136]
Si les études montrent une sténose de l’artère carotide et que la personne présente un certain degré de fonction résiduelle du côté affecté, l’endartériectomie carotidienne (ablation chirurgicale de la sténose) peut réduire le risque de récidive si elle est effectuée rapidement après un AVC.
La gestion
AVC ischémique
L’aspirine réduit le risque global de récidive de 13 % avec un bénéfice plus important dès le début. [137] Le traitement définitif dans les premières heures vise à éliminer le blocage en brisant le caillot ( thrombolyse ) ou en le retirant mécaniquement ( thrombectomie ). La prémisse philosophique sous-jacente à l’importance d’une intervention rapide en cas d’AVC a été résumée par Time is Brain! au début des années 1990. [138] Des années plus tard, cette même idée, selon laquelle la restauration rapide du flux sanguin cérébral entraîne la mort de moins de cellules cérébrales, a été prouvée et quantifiée. [139]
Un contrôle strict de la glycémie au cours des premières heures n’améliore pas les résultats et peut être nocif. [140] L’hypertension artérielle n’est pas non plus généralement abaissée car cela ne s’est pas avéré utile. [141] [142] La cérébrolysine , un mélange de facteurs neurotrophiques dérivés du porc utilisé pour traiter l’AVC ischémique aigu dans de nombreux pays asiatiques et européens, n’améliore pas les résultats et peut augmenter le risque d’événements indésirables graves. [143]
Thrombolyse
La thrombolyse , comme avec l’activateur tissulaire du plasminogène recombinant (rtPA), dans l’AVC ischémique aigu, lorsqu’elle est administrée dans les trois heures suivant l’apparition des symptômes, entraîne un bénéfice global de 10 % par rapport à la vie sans incapacité. [144] [145] Cependant, cela n’améliore pas les chances de survie. [144] L’avantage est d’autant plus grand qu’il est utilisé tôt. [144] Entre trois heures et quatre heures et demie, les effets sont moins nets. [146] [147] [148] L’AHA/ASA le recommande pour certaines personnes dans ce laps de temps. [149]Une étude de 2014 a révélé une augmentation de 5 % du nombre de personnes vivant sans incapacité entre trois et six mois ; cependant, il y avait un risque accru de décès de 2 % à court terme. [145] Après quatre heures et demie, la thrombolyse aggrave les résultats. [146] Ces avantages ou absence d’avantages se produisaient quel que soit l’âge de la personne traitée. [150] Il n’existe aucun moyen fiable de déterminer qui aura un saignement intracrânien après le traitement par rapport à qui n’en aura pas. [151] Chez ceux qui ont découvert des tissus savables sur l’imagerie médicale entre 4,5 heures et 9 heures ou qui se réveillent avec un accident vasculaire cérébral, l’altéplase entraîne certains avantages. [152]
Son utilisation est approuvée par l’ American Heart Association , l’ American College of Emergency Physicians et l’ American Academy of Neurology comme traitement recommandé pour l’AVC aigu dans les trois heures suivant l’apparition des symptômes, à condition qu’il n’y ait pas d’autres contre-indications (telles que des valeurs de laboratoire anormales , hypertension artérielle ou chirurgie récente). Cette position pour le tPA est basée sur les résultats de deux études menées par un groupe de chercheurs [153] qui ont montré que le tPA améliore les chances d’un bon résultat neurologique. Lorsqu’elle est administrée dans les trois premières heures, la thrombolyse améliore les résultats fonctionnels sans affecter la mortalité. [154]6,4 % des personnes ayant subi un AVC important ont développé une hémorragie cérébrale importante en tant que complication de l’administration de tPA, ce qui explique en partie l’augmentation de la mortalité à court terme. [155] L’ Académie américaine de médecine d’urgence avait précédemment déclaré que les preuves objectives concernant l’applicabilité du tPA pour l’AVC ischémique aigu étaient insuffisantes. [156] En 2013, l’American College of Emergency Medicine a réfuté cette position, [157] reconnaissant l’ensemble des preuves de l’utilisation du tPA dans les AVC ischémiques ; [158] mais le débat continue. [159] [160] Fibrinolyse intra-artérielle, où un cathéter est passé dans une artère dans le cerveau et le médicament est injecté au site de la thrombose, s’est avéré améliorer les résultats chez les personnes victimes d’un AVC ischémique aigu. [161]
Traitement endovasculaire
L’élimination mécanique du caillot sanguin à l’origine de l’AVC ischémique, appelée thrombectomie mécanique , est un traitement potentiel de l’occlusion d’une grosse artère, telle que l’ artère cérébrale moyenne . En 2015, une revue a démontré l’innocuité et l’efficacité de cette procédure si elle est effectuée dans les 12 heures suivant l’apparition des symptômes. [162] [163] Cela n’a pas changé le risque de décès, mais a réduit l’invalidité par rapport à l’utilisation de la thrombolyse intraveineuse qui est généralement utilisée chez les personnes évaluées pour une thrombectomie mécanique. [164] [165] Certains cas peuvent bénéficier d’une thrombectomie jusqu’à 24 heures après le début des symptômes. [166]
Craniectomie
Les accidents vasculaires cérébraux affectant de grandes parties du cerveau peuvent provoquer un gonflement important du cerveau avec des lésions cérébrales secondaires dans les tissus environnants. Ce phénomène est principalement rencontré dans les accidents vasculaires cérébraux affectant le tissu cérébral dépendant de l’artère cérébrale moyenne pour l’approvisionnement en sang et est également appelé “infarctus cérébral malin” car il est porteur d’un pronostic sombre. Le soulagement de la pression peut être tenté avec des médicaments, mais certains nécessitent une hémicraniectomie , l’ablation chirurgicale temporaire du crâne d’un côté de la tête. Cela diminue le risque de décès, bien que certaines personnes – qui seraient autrement décédées – survivent avec un handicap. [167]
AVC hémorragique
Les personnes atteintes d’hémorragie intracérébrale ont besoin de soins de soutien, y compris le contrôle de la pression artérielle si nécessaire. Les personnes sont surveillées pour détecter les changements du niveau de conscience, et leur glycémie et leur oxygénation sont maintenues à des niveaux optimaux. Les anticoagulants et les antithrombotiques peuvent aggraver les saignements et sont généralement interrompus (et inversés si possible). [ citation nécessaire ] Une proportion peut bénéficier d’ une intervention neurochirurgicale pour retirer le sang et traiter la cause sous-jacente, mais cela dépend de l’emplacement et de la taille de l’hémorragie ainsi que des facteurs liés au patient, et des recherches en cours sont menées sur la question. quant aux personnes atteintes d’hémorragie intracérébrale qui pourraient en bénéficier. [168]
Dans l’hémorragie sous-arachnoïdienne , un traitement précoce des anévrismes cérébraux sous-jacents peut réduire le risque d’autres hémorragies. Selon le site de l’anévrisme, cela peut être une intervention chirurgicale qui consiste à ouvrir le crâne ou par voie endovasculaire (à travers les vaisseaux sanguins). [169]
Unité de course
Idéalement, les personnes qui ont subi un AVC sont admises dans une «unité d’AVC», un service ou une zone dédiée dans un hôpital composé d’infirmières et de thérapeutes expérimentés dans le traitement des AVC. Il a été démontré que les personnes admises dans une unité d’AVC ont plus de chances de survivre que celles admises ailleurs à l’hôpital, même si elles sont prises en charge par des médecins sans expérience de l’AVC. [2] [170] Les soins infirmiers sont fondamentaux pour maintenir les soins de la peau , l’alimentation, l’hydratation, le positionnement et la surveillance des signes vitaux tels que la température, le pouls et la tension artérielle. [171]
Réhabilitation
La réadaptation après un AVC est le processus par lequel les personnes victimes d’un AVC invalidant suivent un traitement pour les aider à retrouver une vie normale autant que possible en retrouvant et en réapprenant les compétences de la vie quotidienne. Il vise également à aider la survivante à comprendre et à s’adapter aux difficultés, à prévenir les complications secondaires et à éduquer les membres de la famille à jouer un rôle de soutien. La réadaptation après un AVC devrait commencer presque immédiatement avec une approche multidisciplinaire. L’équipe de réadaptation peut comprendre des médecins formés en médecine de réadaptation, des neurologues , des pharmaciens cliniciens , du personnel infirmier, des physiothérapeutes , des ergothérapeutes , des orthophonistes et des orthésistes .. Certaines équipes peuvent également inclure des psychologues et des travailleurs sociaux , car au moins un tiers des personnes touchées manifestent une dépression post-AVC . Des instruments validés tels que l’ échelle de Barthel peuvent être utilisés pour évaluer la probabilité qu’une personne ayant subi un AVC puisse s’en sortir à domicile avec ou sans soutien après sa sortie de l’hôpital. [172]
La réadaptation après un AVC doit être commencée le plus rapidement possible et peut durer de quelques jours à plus d’un an. La plupart des retours de fonction sont observés au cours des premiers mois, puis l’amélioration diminue avec la «fenêtre» considérée officiellement par les unités de réadaptation de l’État américain et d’autres comme étant fermée après six mois, avec peu de chances d’amélioration supplémentaire. [ citation médicale nécessaire ] Cependant, certaines personnes ont signalé qu’elles continuaient à s’améliorer pendant des années, retrouvant et renforçant des capacités telles que l’écriture, la marche, la course et la parole. [ citation médicale nécessaire ]Les exercices de réadaptation quotidiens devraient continuer à faire partie de la routine quotidienne des personnes qui ont subi un AVC. La récupération complète est inhabituelle mais pas impossible et la plupart des gens s’amélioreront dans une certaine mesure : une alimentation et un exercice appropriés sont connus pour aider le cerveau à récupérer.
Négligence spatiale
L’ensemble des preuves actuelles est incertain sur l’efficacité de la réadaptation cognitive pour réduire les effets invalidants de la négligence et l’augmentation de l’indépendance reste à prouver. [173] Cependant, il existe des preuves limitées que la réadaptation cognitive peut avoir un effet bénéfique immédiat sur les tests de négligence. [173] Dans l’ensemble, aucune approche de réhabilitation ne peut être étayée par des preuves de négligence spatiale.
Conduite automobile
L’ensemble actuel de preuves n’est pas certain que l’utilisation de la réadaptation puisse améliorer les compétences de conduite sur route après un AVC. [174] Il y a peu de preuves que la formation sur un simulateur de conduite améliorera les performances de reconnaissance des panneaux routiers après la formation. [174] Les résultats sont basés sur des preuves de faible qualité car des recherches supplémentaires sont nécessaires impliquant un grand nombre de participants.
Yoga
Sur la base de preuves de faible qualité, il n’est actuellement pas certain que le yoga ait un avantage significatif pour la réadaptation après un AVC sur les mesures de la qualité de vie, de l’équilibre, de la force, de l’endurance, de la douleur et des scores d’invalidité. [175] Le yoga peut réduire l’anxiété et pourrait faire partie de la réadaptation centrée sur le patient. [175] Des recherches supplémentaires sont nécessaires pour évaluer les avantages et la sécurité du yoga dans la réadaptation après un AVC.
Observation d’action pour les membres supérieurs
Les dernières preuves scientifiques indiquent que l’observation de l’action est bénéfique pour améliorer la fonction motrice des membres supérieurs et la dépendance dans les activités de la vie quotidienne chez les patients victimes d’un AVC. [176] Ainsi, la thérapie d’observation de l’action est généralement associée à une meilleure fonction du bras et de la main, sans événements indésirables significatifs. [176] Les conclusions sont fondées sur des preuves de qualité faible à modérée.
Rééducation cognitive des déficits de l’attention
L’ensemble des preuves scientifiques actuelles est incertain sur l’efficacité de la réadaptation cognitive pour les déficits d’attention chez les patients après un AVC. [177] Bien qu’il puisse y avoir un effet immédiat après le traitement sur l’attention, les résultats sont basés sur une qualité faible à modérée et un petit nombre d’études. [177] Des recherches supplémentaires sont nécessaires pour évaluer si l’effet peut être maintenu dans les tâches quotidiennes nécessitant de l’attention.
Imagerie motrice pour la rééducation de la marche
Les dernières preuves confirment les avantages à court terme de l’imagerie motrice (IM) sur la vitesse de marche chez les personnes ayant subi un AVC, par rapport à d’autres thérapies. [178] MI n’améliore pas la fonction motrice après un AVC et ne semble pas causer d’événements indésirables importants. [178] Les résultats sont basés sur des preuves de faible qualité, car des recherches supplémentaires sont nécessaires pour estimer l’effet de l’EM sur l’endurance à la marche et la dépendance à l’assistance personnelle.
Physiothérapie et ergothérapie
La physiothérapie et l’ergothérapie ont des domaines d’expertise qui se chevauchent; cependant, la physiothérapie se concentre sur l’amplitude des mouvements et la force des articulations en effectuant des exercices et en réapprenant des tâches fonctionnelles telles que la mobilité au lit, le transfert, la marche et d’autres fonctions motrices globales. Les physiothérapeutes peuvent également travailler avec des personnes qui ont subi un AVC pour améliorer la prise de conscience et l’utilisation du côté hémiplégique . La rééducation consiste à travailler sur la capacité à produire des mouvements forts ou la capacité à effectuer des tâches en utilisant des schémas normaux. L’accent est souvent mis sur les tâches fonctionnelles et les objectifs des personnes. Un exemple que les physiothérapeutes utilisent pour promouvoir l’apprentissage moteur implique la thérapie par le mouvement induit par la contrainte. Grâce à une pratique continue, la personne réapprend à utiliser et à adapter le membre hémiplégique lors d’activités fonctionnelles pour créer des changements permanents et durables. [179] La physiothérapie est efficace pour la récupération de la fonction et de la mobilité après un AVC. [180] L’ergothérapie est impliquée dans la formation pour aider à réapprendre les activités quotidiennes appelées les activités de la vie quotidienne (AVQ) telles que manger, boire, s’habiller, se laver, cuisiner, lire et écrire ., et faire sa toilette. Les approches pour aider les personnes souffrant d’incontinence urinaire comprennent la thérapie physique, la thérapie cognitive et des interventions spécialisées avec des professionnels de la santé expérimentés, cependant, l’efficacité de ces approches pour améliorer l’incontinence urinaire après un AVC n’est pas claire. [181]
Le traitement de la spasticité liée à un accident vasculaire cérébral implique souvent des mobilisations précoces, généralement effectuées par un physiothérapeute, associées à un allongement des muscles spastiques et à des étirements soutenus dans différentes positions. [40] L’amélioration initiale de l’amplitude des mouvements est souvent obtenue grâce à des schémas de rotation rythmiques associés au membre affecté. [40] Une fois l’amplitude complète atteinte par le thérapeute, le membre doit être positionné dans les positions allongées pour éviter d’autres contractures, lésions cutanées et désuétude du membre avec l’utilisation d’attelles ou d’autres outils pour stabiliser l’articulation. [40] Il a été prouvé que le froid sous forme d’enveloppements de glace ou de packs de glace réduit brièvement la spasticité en atténuant temporairement les taux de déclenchement neuronal.[40] La stimulation électrique des muscles antagonistes ou des vibrations a également été utilisée avec un certain succès. [40] La kinésithérapie est parfois suggérée pour les personnes qui souffrent de dysfonction sexuelle à la suite d’un AVC. [182]
Interventions pour les problèmes visuels liés à l’âge chez les patients ayant subi un AVC
La prévalence des problèmes de vision augmentant avec l’âge chez les patients victimes d’AVC, l’effet global des interventions pour les problèmes visuels liés à l’âge est actuellement incertain. Il n’est pas sûr non plus que les personnes victimes d’un AVC réagissent différemment de la population générale lorsqu’elles traitent des problèmes oculaires. [183] Des recherches supplémentaires dans ce domaine sont nécessaires car l’ensemble des preuves actuelles est de très faible qualité.
Thérapie de la parole et du langage
L’orthophonie est appropriée pour les personnes souffrant de troubles de la production de la parole : dysarthrie [184] et apraxie de la parole , [185] aphasie , [186] troubles de la communication cognitive et problèmes de déglutition . Comparativement à l’absence de traitement, l’orthophonie pour l’aphasie après un AVC améliore la communication fonctionnelle, la lecture, l’écriture et le langage expressif. Une intensité élevée et des doses élevées peuvent être bénéfiques sur une période plus longue, mais ces doses d’intensité plus élevée peuvent ne pas être acceptables pour tout le monde. [180]
Les personnes qui ont subi un accident vasculaire cérébral peuvent avoir des problèmes particuliers, comme la dysphagie , qui peut faire passer le matériel avalé dans les poumons et provoquer une pneumonie par aspiration . L’état peut s’améliorer avec le temps, mais dans l’intervalle, une sonde nasogastrique peut être insérée, permettant d’administrer des aliments liquides directement dans l’estomac. Si la déglutition est toujours considérée comme dangereuse, un tube de gastrostomie endoscopique percutanée (PEG) est passé et cela peut rester indéfiniment. La thérapie par déglutition a des résultats mitigés en 2018. [187]
Dispositifs
Souvent, les technologies d’assistance telles que les fauteuils roulants , les déambulateurs et les cannes peuvent être bénéfiques. De nombreux problèmes de mobilité peuvent être améliorés par l’utilisation d’ orthèses cheville-pied . [188]
Forme physique
Un accident vasculaire cérébral peut également réduire la condition physique générale des personnes. [189] Une condition physique réduite peut réduire la capacité de réadaptation ainsi que l’état de santé général. [190] Les exercices physiques dans le cadre d’un programme de réadaptation à la suite d’un AVC semblent sécuritaires. [189] L’entraînement cardiorespiratoire qui implique la marche en réadaptation peut améliorer la vitesse, la tolérance et l’indépendance pendant la marche, et peut améliorer l’équilibre. [189] Les données à long terme sur les effets de l’exercice et de l’entraînement sur le décès, la dépendance et l’invalidité après un AVC sont insuffisantes. [189]Les futurs domaines de recherche pourraient se concentrer sur la prescription optimale d’exercices et les bienfaits à long terme de l’exercice sur la santé. L’effet de l’entraînement physique sur la cognition peut également être étudié plus avant.
La capacité de marcher de manière autonome dans leur communauté, à l’intérieur ou à l’extérieur, est importante après un AVC. Bien qu’aucun effet négatif n’ait été signalé, il n’est pas clair si les résultats peuvent s’améliorer avec ces programmes de marche par rapport au traitement habituel. [191]
Autres méthodes de thérapie
Certaines méthodes thérapeutiques actuelles et futures incluent l’utilisation de la réalité virtuelle et des jeux vidéo pour la rééducation. Ces formes de réadaptation offrent un potentiel pour motiver les gens à effectuer des tâches thérapeutiques spécifiques que de nombreuses autres formes n’offrent pas. [192] Bien que la réalité virtuelle et les jeux vidéo interactifs ne soient pas plus efficaces que la thérapie conventionnelle pour améliorer la fonction des membres supérieurs, lorsqu’ils sont utilisés en conjonction avec les soins habituels, ces approches peuvent améliorer la fonction des membres supérieurs et la fonction AVQ. [193] Les données sur l’effet de la réalité virtuelle et des jeux vidéo interactifs sur la vitesse de marche, l’équilibre, la participation et la qualité de vie sont insuffisantes. [193]De nombreuses cliniques et hôpitaux adoptent l’utilisation de ces appareils prêts à l’emploi pour l’exercice, l’interaction sociale et la rééducation, car ils sont abordables, accessibles et peuvent être utilisés à la clinique et à domicile. [192]
La thérapie miroir est associée à une amélioration de la fonction motrice du membre supérieur chez les personnes ayant subi un AVC. [194]
D’autres méthodes de rééducation non invasives utilisées pour augmenter la thérapie physique de la fonction motrice chez les personnes qui se remettent d’un AVC comprennent la stimulation magnétique transcrânienne et la stimulation transcrânienne à courant continu . [195] et thérapies robotiques . [196] La thérapie par les mouvements induits par la contrainte (TCIM), la pratique mentale, la thérapie par le miroir, les interventions pour déficience sensorielle, la réalité virtuelle et une dose relativement élevée de pratique de tâches répétitives peuvent être efficaces pour améliorer la fonction des membres supérieurs. Cependant, d’autres recherches primaires, en particulier sur la CIMT, la pratique mentale, la thérapie du miroir et la réalité virtuelle sont nécessaires. [197]
Orthèses

 Marcher avec une orthèse après un AVC
Marcher avec une orthèse après un AVC
Des études cliniques confirment l’importance des orthèses dans la rééducation post-AVC. [198] [199] [200] L’orthèse soutient les applications thérapeutiques et aide également à mobiliser le patient à un stade précoce. À l’aide d’une orthèse, la station debout et la marche physiologiques peuvent être réappris et les conséquences tardives sur la santé causées par une mauvaise démarche peuvent être évitées. Un traitement avec une orthèse peut donc être utilisé pour soutenir la thérapie.
Autogestion
Un accident vasculaire cérébral peut affecter la capacité à vivre de manière indépendante et avec qualité. Les programmes d’autogestion sont une formation spéciale qui éduque les survivants d’un AVC sur l’AVC et ses conséquences, les aide à acquérir des compétences pour faire face à leurs défis et les aide à établir et à atteindre leurs propres objectifs pendant leur processus de rétablissement. Ces programmes sont adaptés au public cible et dirigés par une personne formée et experte en AVC et ses conséquences (le plus souvent des professionnels, mais aussi des survivants d’AVC et des pairs). Une revue de 2016 a rapporté que ces programmes améliorent la qualité de vie après un AVC, sans effets négatifs. Les personnes ayant subi un AVC se sentaient plus autonomes, heureuses et satisfaites de la vie après avoir participé à cette formation. [201]
Pronostic
L’invalidité touche suffisamment 75 % des survivants d’un AVC pour réduire leur capacité de travail. [202] L’AVC peut affecter les personnes physiquement, mentalement, émotionnellement ou une combinaison des trois. Les résultats d’un accident vasculaire cérébral varient considérablement en fonction de la taille et de l’emplacement de la lésion. [203]
Effets physiques
Certains des handicaps physiques qui peuvent résulter d’un AVC comprennent la faiblesse musculaire, l’engourdissement, les escarres , la pneumonie , l’ incontinence , l’apraxie (incapacité à effectuer des mouvements appris), les difficultés à effectuer les activités quotidiennes , la perte d’appétit, la perte de la parole, la perte de vision et la douleur . Si l’AVC est suffisamment grave ou à un certain endroit, comme certaines parties du tronc cérébral, il peut en résulter un coma ou la mort. Jusqu’à 10 % des personnes après un AVC développent des convulsions , le plus souvent dans la semaine suivant l’événement ; la gravité de l’AVC augmente la probabilité d’une crise.[204] [205] On estime que 15 % des personnes souffrent d’incontinence urinaire pendant plus d’un an à la suite d’un accident vasculaire cérébral. [181] 50% des personnes ont une diminution de la fonction sexuelle (dysfonctionnement sexuel ) suite à un accident vasculaire cérébral. [182]
Effets émotionnels et mentaux
Les dysfonctionnements émotionnels et mentaux correspondent à des zones du cerveau qui ont été endommagées. Les problèmes émotionnels consécutifs à un AVC peuvent être dus à des dommages directs aux centres émotionnels du cerveau ou à la frustration et à la difficulté à s’adapter à de nouvelles limitations. Les difficultés émotionnelles post-AVC comprennent l’anxiété , les attaques de panique , l’affect plat (incapacité à exprimer ses émotions), la manie , l’apathie et la psychose . D’autres difficultés peuvent inclure une diminution de la capacité à communiquer des émotions par l’expression faciale, le langage corporel et la voix. [206]
La perturbation de l’identité de soi, des relations avec les autres et du bien-être émotionnel peut entraîner des conséquences sociales après un AVC en raison du manque de capacité à communiquer. De nombreuses personnes qui éprouvent des troubles de la communication après un AVC ont plus de difficulté à faire face aux problèmes sociaux qu’aux déficiences physiques. Des aspects plus larges des soins doivent tenir compte de l’impact émotionnel des troubles de la parole sur ceux qui éprouvent des difficultés à parler après un AVC. [184] Ceux qui subissent un accident vasculaire cérébral sont à risque de paralysie , ce qui pourrait entraîner une image corporelle perturbée qui peut également entraîner d’autres problèmes sociaux. [207]
30 à 50 % des survivants d’un AVC souffrent de dépression post-AVC, qui se caractérise par une léthargie, une irritabilité, des troubles du sommeil , une baisse de l’estime de soi et un repli sur soi. [208] La dépression peut réduire la motivation et aggraver les résultats, mais peut être traitée avec un soutien social et familial, une psychothérapie et, dans les cas graves, des antidépresseurs . Les séances de psychothérapie peuvent avoir un léger effet sur l’amélioration de l’humeur et la prévention de la dépression après un AVC [209] , mais la psychothérapie ne semble pas efficace pour traiter la dépression après un AVC. [210] Les médicaments antidépresseurs peuvent être utiles pour traiter la dépression après un AVC. [210]
La labilité émotionnelle , une autre conséquence de l’AVC, amène la personne à basculer rapidement entre les hauts et les bas émotionnels et à exprimer ses émotions de manière inappropriée, par exemple avec un excès de rires ou de pleurs avec peu ou pas de provocation. Alors que ces expressions d’émotion correspondent généralement aux émotions réelles de la personne, une forme plus grave de labilité émotionnelle fait rire et pleurer la personne affectée de manière pathologique, sans égard au contexte ou à l’émotion. [202] Certaines personnes montrent le contraire de ce qu’elles ressentent, par exemple en pleurant quand elles sont heureuses. [211] La labilité émotionnelle survient chez environ 20 % des personnes ayant subi un AVC. Ceux qui ont subi un AVC dans l’hémisphère droit sont plus susceptibles d’avoir des problèmes d’empathie qui peuvent rendre la communication plus difficile. [212]
Les déficits cognitifs résultant d’un accident vasculaire cérébral comprennent les troubles de la perception, l’ aphasie , [213] la démence , [214] [215] et les problèmes d’attention [216] et de mémoire. [217] Une victime d’AVC peut ignorer ses propres handicaps, une condition appelée anosognosie . Dans une condition appelée négligence hémispatiale , la personne affectée est incapable de s’occuper de quoi que ce soit du côté de l’espace opposé à l’hémisphère endommagé. Les résultats cognitifs et psychologiques après un AVC peuvent être affectés par l’âge auquel l’AVC s’est produit, le fonctionnement intellectuel de base avant l’AVC, les antécédents psychiatriques et l’existence éventuelle d’une pathologie cérébrale préexistante.[218]
Épidémiologie
 Décès par accident vasculaire cérébral par million de personnes en 2012 58–316 317–417 418–466 467–518 519–575 576–640 641–771 772–974 975-1 683 1 684–3 477
Décès par accident vasculaire cérébral par million de personnes en 2012 58–316 317–417 418–466 467–518 519–575 576–640 641–771 772–974 975-1 683 1 684–3 477 
 Année de vie ajustée sur l’incapacité pour les maladies vasculaires cérébrales pour 100 000 habitants en 2004. [219]
Année de vie ajustée sur l’incapacité pour les maladies vasculaires cérébrales pour 100 000 habitants en 2004. [219]
| pas de données <250 250–425 425–600 600–775 775–950 950–1125 | 1125–1300 1300–1475 1475–1650 1650–1825 1825–2000 >2000 |
L’AVC était la deuxième cause de décès la plus fréquente dans le monde en 2011, représentant 6,2 millions de décès (~11 % du total). [220] Environ 17 millions de personnes ont eu un accident vasculaire cérébral en 2010 et 33 millions de personnes ont déjà eu un accident vasculaire cérébral et étaient encore en vie. [17] Entre 1990 et 2010, le nombre d’AVC a diminué d’environ 10 % dans le monde développé et augmenté de 10 % dans le monde en développement. [17] Dans l’ensemble, les deux tiers des AVC sont survenus chez les personnes de plus de 65 ans. [17] Les Sud-Asiatiques courent un risque particulièrement élevé d’AVC, représentant 40 % des décès par AVC dans le monde. [221] L’incidence de l’AVC ischémique est dix fois plus fréquente que l’AVC hémorragique. [222]
Il est classé après les maladies cardiaques et avant le cancer. [2] Aux États-Unis, les accidents vasculaires cérébraux sont une des principales causes d’invalidité et sont récemment passés de la troisième à la quatrième cause de décès. [223] Des disparités géographiques dans l’incidence des accidents vasculaires cérébraux ont été observées, y compris l’existence d’une « ceinture d’AVC » dans le sud-est des États-Unis , mais les causes de ces disparités n’ont pas été expliquées.
Le risque d’AVC augmente de façon exponentielle à partir de 30 ans, et la cause varie selon l’âge. [224] L’âge avancé est l’un des facteurs de risque d’AVC les plus importants. 95 % des AVC surviennent chez des personnes âgées de 45 ans et plus, et les deux tiers des AVC surviennent chez des personnes de plus de 65 ans. [45] [208]
Le risque de mourir d’un AVC augmente également avec l’âge. Cependant, un AVC peut survenir à tout âge, y compris pendant l’enfance. [ citation nécessaire ]
Les membres de la famille peuvent avoir une tendance génétique aux accidents vasculaires cérébraux ou partager un mode de vie qui contribue aux accidents vasculaires cérébraux. Des niveaux plus élevés de facteur Von Willebrand sont plus fréquents chez les personnes qui ont subi un AVC ischémique pour la première fois. [225] Les résultats de cette étude ont révélé que le seul facteur génétique significatif était le groupe sanguin de la personne . Le fait d’avoir eu un AVC dans le passé augmente considérablement le risque d’avoir de futurs AVC.
Les hommes sont 25 % plus susceptibles d’être victimes d’un AVC que les femmes [45] , mais 60 % des décès dus à un AVC surviennent chez des femmes. [211] Comme les femmes vivent plus longtemps, elles sont en moyenne plus âgées lorsqu’elles subissent un AVC et donc plus souvent tuées. [45] Certains facteurs de risque d’AVC ne s’appliquent qu’aux femmes. Les principaux d’entre eux sont la grossesse, l’accouchement, la ménopause et leur traitement ( THS ).
Histoire

 Hippocrate a décrit pour la première fois la paralysie soudaine qui est souvent associée à un accident vasculaire cérébral.
Hippocrate a décrit pour la première fois la paralysie soudaine qui est souvent associée à un accident vasculaire cérébral.
Des épisodes d’accident vasculaire cérébral et d’accident vasculaire cérébral familial ont été signalés à partir du 2e millénaire avant notre ère dans l’ancienne Mésopotamie et la Perse. [226] Hippocrate (460 à 370 av. J.-C.) fut le premier à décrire le phénomène de paralysie soudaine souvent associé à l’ischémie . L’apoplexie , du mot grec signifiant « frappé de violence », est apparue pour la première fois dans les écrits hippocratiques pour décrire ce phénomène. [227] [228] Le mot accident vasculaire cérébral a été utilisé comme synonyme de crise d’apoplexie dès 1599, [229] et est une traduction assez littérale du terme grec. Le terme AVC apoplectiqueest un terme archaïque, non spécifique, pour un accident vasculaire cérébral accompagné d’hémorragie ou d’AVC hémorragique. [230] Martin Luther a été décrit comme ayant un accident vasculaire cérébral apoplectique qui l’a privé de sa parole peu de temps avant sa mort en 1546. [231]
En 1658, dans son Apoplexie , Johann Jacob Wepfer (1620-1695) a identifié la cause de l’ AVC hémorragique lorsqu’il a suggéré que les personnes décédées d’apoplexie avaient des saignements dans le cerveau. [45] [227] Wepfer a également identifié les principales artères alimentant le cerveau, les artères vertébrales et carotides , et identifié la cause d’un type d’ accident vasculaire cérébral ischémique connu sous le nom d’ infarctus cérébral lorsqu’il a suggéré que l’ apoplexie pourrait être causée par un blocage de celles-ci. navires. [45] Rudolf Virchowont d’abord décrit le mécanisme de la thromboembolie comme un facteur majeur. [232]
Le terme accident vasculaire cérébral a été introduit en 1927, reflétant une “prise de conscience et une acceptation croissantes des théories vasculaires et (…) une reconnaissance des conséquences d’une perturbation soudaine de l’apport vasculaire du cerveau”. [233] Son utilisation est aujourd’hui déconseillée par un certain nombre de manuels de neurologie, estimant que la connotation fortuite portée par le mot accident met insuffisamment en évidence la modifiabilité des facteurs de risque sous-jacents. [234] [235] [236] L’insulte cérébrovasculaire peut être utilisée de façon interchangeable. [237]
Le terme attaque cérébrale a été introduit pour souligner la nature aiguë de l’AVC selon l’ American Stroke Association , [237] qui utilise le terme depuis 1990, [238] et est utilisé familièrement pour désigner à la fois l’AVC ischémique et hémorragique. . [239]
Rechercher
À partir de 2017, l’ angioplastie et les stents faisaient l’objet de recherches cliniques préliminaires pour déterminer les avantages thérapeutiques possibles de ces procédures par rapport au traitement par statines , antithrombotiques ou antihypertenseurs . [240]
Voir également
- Maladie cérébrovasculaire
- Syndrome de Déjerine-Roussy
- Mesure d’indépendance fonctionnelle
- Lipoprotéine(a)
- Mécanisme de dépolarisation anoxique dans le cerveau
- Thrombolyse systémique assistée par ultrasons
- Le syndrome de Weber
- Journée mondiale de l’AVC
Références
- ^ Gaillard F. “AVC ischémique” . radiopedia.org . Récupéré le 3 juin 2018 .
- ^ un bcdefghijklmnopqrst Donnan GA , Fisher M , Macleod M , Davis SM ( mai 2008 ) . _ _ _ “Caresser”. Lancette . 371 (9624): 1612–23. doi : 10.1016/S0140-6736(08)60694-7 . PMID 18468545 . S2CID 208787942 . (abonnement requis)
- ^ un bcdef ” Quels sont les signes et les symptômes d’un accident vasculaire cérébral? ” . www.nhlbi.nih.gov . 26 mars 2014. Archivé de l’original le 27 février 2015 . Récupéré le 27 février 2015 .
- ^ Martin G (2009). Soins infirmiers palliatifs : soins de qualité jusqu’à la fin de vie, troisième édition . Société d’édition Springer. p. 290. ISBN 978-0-8261-5792-8. Archivé de l’original le 2017-08-03.
- ^ un bcdef ” Qu’est – ce qu’un accident vasculaire cérébral?” . www.nhlbi.nih.gov/ . 26 mars 2014. Archivé de l’original le 18 février 2015 . Récupéré le 26 février 2015 .
- ^ un bc “Qui est en danger pour un coup? ” . www.nhlbi.nih.gov . 26 mars 2014. Archivé de l’original le 27 février 2015 . Récupéré le 27 février 2015 .
- ^ un bc Hu A, Niu J, Winkelmayer WC (novembre 2018). “Anticoagulation orale chez les patients atteints d’insuffisance rénale terminale sous dialyse et fibrillation auriculaire” . Séminaires en Néphrologie . 38 (6): 618–628. doi : 10.1016/j.semnéphrol.2018.08.006 . PMC 6233322 . PMID 30413255 .
- ^ un bcde ” Comment un accident vasculaire cérébral est-il diagnostiqué?” . www.nhlbi.nih.gov . 26 mars 2014. Archivé de l’original le 27 février 2015 . Récupéré le 27 février 2015 .
- ^ un bcd Yew KS , Cheng E (juillet 2009). “Diagnostic d’AVC aigu” . Médecin de famille américain . 80 (1): 33–40. PMC 2722757 . PMID 19621844 .
- ^ a b GBD 2015 Collaborateurs sur l’incidence et la prévalence des maladies et des blessures (octobre 2016). “Incidence, prévalence et années vécues avec un handicap au niveau mondial, régional et national pour 310 maladies et blessures, 1990-2015 : une analyse systématique pour l’étude Global Burden of Disease Study 2015” . Lancette . 388 (10053): 1545-1602. doi : 10.1016/S0140-6736(16)31678-6 . PMC 5055577 . PMID 27733282 . {{cite journal}}: |author=a un nom générique ( aide )
- ^ a bc GBD 2015 Mortalité et causes de décès Collaborateurs (octobre 2016). “Espérance de vie mondiale, régionale et nationale, mortalité toutes causes confondues et mortalité par cause pour 249 causes de décès, 1980-2015 : une analyse systématique pour l’étude Global Burden of Disease Study 2015” . Lancette . 388 (10053): 1459-1544. doi : 10.1016/S0140-6736(16)31012-1 . PMC 5388903 . PMID 27733281 . {{cite journal}}: |author=a un nom générique ( aide )
- ^ un bc “les Types d’AVC” . www.nhlbi.nih.gov . 26 mars 2014. Archivé de l’original le 19 mars 2015 . Récupéré le 27 février 2015 .
- ^ Roos KL (2012). Neurologie d’urgence . Springer Science et médias d’affaires. p. 360.ISBN _ 978-0-387-88584-1. Archivé de l’original le 2017-01-08.
- ^ Wityk RJ, Llinas RH (2007). AVC . Presse ACP. p. 296. ISBN 978-1-930513-70-9. Archivé de l’original le 2017-01-08.
- ^ Feigin VL, Rinkel GJ, Lawes CM, Algra A, Bennett DA, van Gijn J, Anderson CS (décembre 2005). “Facteurs de risque d’hémorragie sous-arachnoïdienne : une revue systématique mise à jour des études épidémiologiques” . AVC . 36 (12): 2773–80. doi : 10.1161/01.STR.0000190838.02954.e8 . PMID 16282541 .
- ^ Collaborateurs de l’étude Global Burden of Disease Study 2013 (août 2015). “Incidence, prévalence et années vécues avec un handicap au niveau mondial, régional et national pour 301 maladies et blessures aiguës et chroniques dans 188 pays, 1990-2013 : une analyse systématique pour l’étude Global Burden of Disease Study 2013” . Lancette . 386 (9995): 743–800. doi : 10.1016/s0140-6736(15)60692-4 . PMC 4561509 . PMID 26063472 . {{cite journal}}: |author=a un nom générique ( aide )
- ^ un bcde Feigin VL , Forouzanfar MH, Krishnamurthi R, Mensah GA, Connor M, Bennett DA, et al. (Janvier 2014). “Fardeau mondial et régional des accidents vasculaires cérébraux pendant la période 1990-2010 : résultats de l’étude Global Burden of Disease Study 2010” . Lancette . 383 (9913): 245–54. doi : 10.1016/S0140-6736(13)61953-4 . PMC 4181600 . PMID 24449944 .
- ^ “Bases du cerveau : Prévenir les AVC” . Institut national des troubles neurologiques et des accidents vasculaires cérébraux. Archivé de l’original le 2009-10-08 . Récupéré le 24/10/2009 .
- ^ Organisation mondiale de la santé (1978). Troubles cérébrovasculaires (publications décalées) . Genève : Organisation mondiale de la santé . ISBN 978-92-4-170043-6. OCLC 4757533 .
- ^ Kidwell CS, Warach S (décembre 2003). “Syndrome cérébrovasculaire ischémique aigu : critères diagnostiques” . AVC . 34 (12): 2995–8. doi : 10.1161/01.STR.0000098902.69855.A9 . PMID 14605325 .
- ^ Shuaib A, Hachinski VC (septembre 1991). “Mécanismes et prise en charge des AVC chez les personnes âgées” . JAMC . 145 (5) : 433–443. PMC 1335826 . PMID 1878825 .
- ^ un b Stam J (avril 2005). “Thrombose des veines et des sinus cérébraux” . Le New England Journal of Medicine . 352 (17): 1791–8. doi : 10.1056/NEJMra042354 . PMID 15858188 .
- ^ Guercini F, Acciarresi M, Agnelli G, Paciaroni M (avril 2008). « AVC cryptogénique : il est temps de déterminer l’étiologie » . Journal de la thrombose et de l’hémostase . 6 (4): 549–54. doi : 10.1111/j.1538-7836.2008.02903.x . PMID 18208534 . S2CID 20211745 .
- ^ Bamford J, Sandercock P, Dennis M, Burn J, Warlow C (juin 1991). “Classification et histoire naturelle des sous-types cliniquement identifiables d’infarctus cérébral”. Lancette . 337 (8756): 1521–6. doi : 10.1016/0140-6736(91)93206-O . PMID 1675378 . S2CID 21784682 . Des publications ultérieures font la distinction entre «syndrome» et «infarctus», sur la base de preuves issues de l’imagerie. “Syndrome” peut être remplacé par “hémorragie” si l’imagerie montre un saignement. Voir Internet Stroke Center. “Échelle d’AVC d’Oxford” . Archivé de l’original le 2008-10-25 . Récupéré le 14/11/2008 .
- ^ Bamford JM (2000). “Le rôle de l’examen clinique dans la sous-classification des AVC”. Maladies cérébrovasculaires . 10 (4) : 2–4. doi : 10.1159/000047582 . PMID 11070389 . S2CID 29493084 .
- ^ Adams HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, Marsh EE (janvier 1993). “Classification du sous-type d’AVC ischémique aigu. Définitions à utiliser dans un essai clinique multicentrique. TOAST. Essai d’Org 10172 dans le traitement des AVC aigus” . AVC . 24 (1): 35–41. doi : 10.1161/01.STR.24.1.35 . PMID 7678184 .
- ^ Osterweil N (2006-12-26). “AVC ischémiques induits par la méthamphétamine” . Medpage aujourd’hui. Archivé de l’original le 13 décembre 2013 . Récupéré le 24 août 2013 .
- ^ Anonyme (2014-07-29). « AVC hémorragique » . Association nationale des AVC. Archivé de l’original le 27 juin 2016 . Récupéré le 30 juin 2016 .
- ^ Anonyme (6 décembre 2013). “Types d’AVC” . www.cdc.gov . Centres de contrôle et de prévention des maladies. Archivé de l’original le 27 juin 2016 . Récupéré le 30 juin 2016 .
- ^ Al-Shahi Salman R, Labovitz DL, Stapf C (juillet 2009). “Hémorragie intracérébrale spontanée”. BMJ . 339 (juil24 1): b2586. doi : 10.1136/bmj.b2586 . PMID 19633038 . S2CID 206891608 .
- ^ “Articles” . Cèdres-Sinaï . Récupéré le 26/04/2022 .
- ^ “Articles” . Cèdres-Sinaï . Récupéré le 26/04/2022 .
- ^ Goldstein LB, Simel DL (mai 2005). “Ce patient a-t-il un accident vasculaire cérébral?” . JAMA . 293 (19): 2391–402. doi : 10.1001/jama.293.19.2391 . PMID 15900010 . S2CID 20408776 .
- ^ Harbison J, Massey A, Barnett L, Hodge D, Ford GA (juin 1999). “Protocole d’ambulance rapide pour l’AVC aigu”. Lancette . 353 (9168): 1935. doi : 10.1016/S0140-6736(99)00966-6 . PMID 10371574 . S2CID 36692451 .
- ^ Kidwell CS, Saver JL, Schubert GB, Eckstein M, Starkman S (1998). “Conception et analyse rétrospective du Los Angeles Prehospital Stroke Screen (LAPSS)”. Soins préhospitaliers d’urgence . 2 (4): 267–73. doi : 10.1080/10903129808958878 . PMID 9799012 .
- ^ Kothari RU, Pancioli A, Liu T, Brott T, Broderick J (avril 1999). “Échelle d’AVC préhospitalier de Cincinnati : reproductibilité et validité”. Annales de médecine d’urgence . 33 (4) : 373–8. doi : 10.1016/S0196-0644(99)70299-4 . PMID 10092713 .
- ^ un Institut national b pour la Santé et l’Excellence Clinique . Directive clinique 68 : Accident vasculaire cérébral . Londres, 2008.
- ^ Merwick Á, Werring D (mai 2014). “AVC ischémique de la circulation postérieure” . BMJ . 348 (19 mai 33) : g3175. doi : 10.1136/bmj.g3175 . PMID 24842277 .
- ^ Ni AM, Davis J, Sen B, Shipsey D, Louw SJ, Dyker AG, et al. (novembre 2005). “L’échelle de reconnaissance des AVC aux URGENCES (ROSIER) : développement et validation d’un instrument de reconnaissance des AVC”. Le Lancet. Neurologie . 4 (11): 727–734. doi : 10.1016/S1474-4422(05)70201-5 . PMID 16239179 . S2CID 2744751 .
- ^ un bcdef O’Sullivan SB ( 2007 ). “Caresser”. Dans O’Sullivan SB, Schmitz TJ (eds.). Réadaptation physique . Vol. 5. Philadelphie : FA Davis Company. p. 719.
- ^ “Thrombus” . MedlinePlus . Bibliothèque nationale de médecine des États-Unis. Archivé de l’original le 01/07/2016.
- ^ “Cercle de Willis” . Le Centre Internet de l’AVC. Archivé de l’original le 2016-02-05.
- ^ “Anaurysme cérébral – Introduction” . Choix du NHS . 2017-10-19. Archivé de l’original le 2016-02-08.
- ^ Fisher CM (décembre 1968). “Les lésions artérielles sous-jacentes aux lacunes”. Acta Neuropathologique . 12 (1): 1–15. doi : 10.1007/BF00685305 . PMID 5708546 . S2CID 6942826 .
- ^ un bcdefg Institut national des troubles neurologiques et des accidents vasculaires cérébraux (NINDS) ( 1999). « Accident vasculaire cérébral : l’espoir par la recherche » . Instituts nationaux de la santé. Archivé de l’original le 2015-10-04.
- ^ Shah AS, Lee KK, McAllister DA, Hunter A, Nair H, Whiteley W, et al. (mars 2015). “Exposition à court terme à la pollution de l’air et aux accidents vasculaires cérébraux : examen systématique et méta-analyse” . BMJ . 350 (23 mars 11) : h1295. doi : 10.1136/bmj.h1295 . PMC 4373601 . PMID 25810496 .
- ^ un b Kumar V (2009). Robbins et Cotran Pathologic Basis of Disease, édition professionnelle (8e éd.). Philadelphie : Elsevier. ISBN 978-1-4377-0792-2.
- ^ Ay H, Furie KL, Singhal A, Smith WS, Sorensen AG, Koroshetz WJ (novembre 2005). “Un système de classification causale fondé sur des preuves pour l’AVC ischémique aigu”. Annales de Neurologie . 58 (5): 688-97. doi : 10.1002/ana.20617 . PMID 16240340 . S2CID 28798146 .
- ^ Hackam DG (mai 2016). “Pronostic de l’occlusion asymptomatique de l’artère carotide : examen systématique et méta-analyse” . AVC . 47 (5) : 1253–7. doi : 10.1161/strokeaha.116.012760 . PMID 27073237 . S2CID 3669224 .
- ^ Hart RG, Catanese L, Perera KS, Ntaios G, Connolly SJ (avril 2017). « Accident vasculaire cérébral embolique de source indéterminée : une revue systématique et une mise à jour clinique » . AVC . 48 (4): 867–872. doi : 10.1161/STROKEAHA.116.016414 . PMID 28265016 . S2CID 3679562 .
- ^ Strandgaard S (octobre 1996). “Hypertension et accident vasculaire cérébral”. Supplément Journal of Hypertension . 14 (3) : S23-7. doi : 10.1097/00004872-199610003-00005 . PMID 9120662 . S2CID 11817729 .
- ^ Harrigan MR, Deveikis JP (2012). Manuel des maladies cérébrovasculaires et de la technique neurointerventionnelle . Springer Science et médias d’affaires. p. 692.ISBN _ 978-1-61779-945-7. Archivé de l’original le 2017-01-09.
- ^ Miwa K, Hoshi T, Hougaku H, Tanaka M, Furukado S, Abe Y, et al. (2010). “L’infarctus cérébral silencieux est associé à un accident vasculaire cérébral incident et à un AIT indépendant de l’épaisseur intima-média carotidienne” . Médecine Interne . 49 (9): 817–22. doi : 10.2169/internalmedicine.49.3211 . PMID 20453400 .
- ^ un b Herderscheê D, Hijdra A, Algra A, Koudstaal PJ, Kappelle LJ, van Gijn J (septembre 1992). “AVC silencieux chez les patients ayant subi un accident ischémique transitoire ou un accident vasculaire cérébral ischémique mineur. Le groupe d’étude néerlandais sur les essais TIA” . AVC . 23 (9) : 1220–4. doi : 10.1161/01.STR.23.9.1220 . PMID 1519274 .
- ^ Leary MC, Économiseur JL (2003). « Incidence annuelle du premier AVC silencieux aux États-Unis : une estimation préliminaire ». Maladies cérébrovasculaires . 16 (3) : 280–5. doi : 10.1159/000071128 . PMID 12865617 . S2CID 33095581 .
- ^ Vermeer SE, Koudstaal PJ, Oudkerk M, Hofman A, Breteler MM (janvier 2002). “Facteurs de prévalence et de risque d’infarctus cérébraux silencieux dans l’étude d’analyse de Rotterdam basée sur la population” . AVC . 33 (1): 21–5. doi : 10.1161/hs0102.101629 . PMID 11779883 .
- ^ Deb P, Sharma S, Hassan KM (juin 2010). « Mécanismes physiopathologiques de l’AVC ischémique aigu : un aperçu mettant l’accent sur la signification thérapeutique au-delà de la thrombolyse ». Physiopathologie . 17 (3): 197–218. doi : 10.1016/j.pathophys.2009.12.001 . PMID 20074922 .
- ^ Snell RS (2006). Neuroanatomie clinique, 6. éd . Lippincott Williams & Wilkins, Philadelphie. p. 478–85. ISBN 978-963-226-293-2.
- ^ Manuel de Brunner et Suddarth sur les soins infirmiers médico-chirurgicaux, 11e édition
- ^ Kristián T, Siesjö BK (1996). “Dommages liés au calcium dans l’ischémie”. Sciences de la vie . 59 (5–6) : 357–67. doi : 10.1016/0024-3205(96)00314-1 . PMID 8761323 .
- ^ Chan PH (janvier 2001). « Radicaux réactifs de l’oxygène dans la signalisation et les dommages dans le cerveau ischémique » . Journal du flux sanguin cérébral et du métabolisme . 21 (1): 2–14. doi : 10.1097/00004647-200101000-00002 . PMID 11149664 .
- ^ un b Smith WS, anglais JD, Johnston SC (2012). “Chapitre 370: Maladies cérébrovasculaires”. Dans Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson JL, Loscalzo J (eds.). Les principes de médecine interne de Harrison (18e éd.). New York : McGraw Hill. pages 3270–3299. ISBN 978-0-07-174889-6.
- ^ un b Wang J (décembre 2010). “Recherche préclinique et clinique sur l’inflammation après hémorragie intracérébrale” . Progrès en Neurobiologie . 92 (4): 463–77. doi : 10.1016/j.pneurobio.2010.08.001 . PMC 2991407 . PMID 20713126 .
- ^ Hill MD (novembre 2005). « Biomarqueurs diagnostiques de l’AVC : le point de vue d’un neurologue spécialisé dans l’AVC » . Chimie clinique . 51 (11): 2001–2. doi : 10.1373/clinchem.2005.056382 . PMID 16244286 .
- ^ Chalela JA, Kidwell CS, Nentwich LM, Luby M, Butman JA, Demchuk AM, et al. (janvier 2007). “Imagerie par résonance magnétique et tomodensitométrie dans l’évaluation d’urgence des patients suspectés d’AVC aigu : une comparaison prospective” . Lancette . 369 (9558) : 293–8. doi : 10.1016/S0140-6736(07)60151-2 . PMC 1859855 . PMID 17258669 .
- ^ Kidwell CS, Chalela JA, Saver JL, Starkman S, Hill MD, Demchuk AM, et al. (octobre 2004). “Comparaison de l’IRM et du scanner pour la détection d’une hémorragie intracérébrale aiguë” . JAMA . 292 (15): 1823–1830. doi : 10.1001/jama.292.15.1823 . PMID 15494579 .
- ^ Nouh A, Remke J, Ruland S (2014). “AVC ischémique de la circulation postérieure : un examen de l’anatomie, des présentations cliniques, du diagnostic et de la gestion actuelle” . Frontières en Neurologie . 5 : 30. doi : 10.3389/fneur.2014.00030 . PMC 3985033 . PMID 24778625 .
- ^ un b Wilson D, Adams ME, Robertson F, Murphy M, Werring DJ (mai 2015). “Enquête sur l’hémorragie intracérébrale”. BMJ . 350 (mai20 10): h2484. doi : 10.1136/bmj.h2484 . PMID 25994363 . S2CID 26908106 .
- ^ un bcde Bakradze E , Liberman AL (février 2018). “Erreur de diagnostic dans les raisons de l’AVC et les solutions proposées”. Rapports actuels sur l’athérosclérose . 20 (2): 11. doi : 10.1007/s11883-018-0712-3 . PMID 29441421 . S2CID 3335617 .
- ^ Dupre CM, Libman R, Dupre SI, Katz JM, Rybinnik I, Kwiatkowski T (février 2014) [Disponible en ligne le 15 août 2013]. “Caméléons de course”. Journal des accidents vasculaires cérébraux et des maladies cérébrovasculaires . 23 (2): 374–8. doi : 10.1016/j.jstrokecerebrovasdis.2013.07.015 . PMID 23954604 .
- ^ un b Straus SE, Majumdar SR, McAlister FA (septembre 2002). « Nouvelles preuves pour la prévention des accidents vasculaires cérébraux : examen scientifique » . JAMA . 288 (11): 1388–1395. doi : 10.1001/jama.288.11.1388 . PMID 12234233 .
- ^ Goldstein LB, Adams R, Alberts MJ, Appel LJ, Brass LM, Bushnell CD, et al. (juin 2006). “Prévention primaire de l’AVC ischémique : une ligne directrice de l’American Heart Association/American Stroke Association Stroke Council : coparrainée par le groupe de travail interdisciplinaire sur les maladies vasculaires périphériques athéroscléreuses ; le Conseil des soins infirmiers cardiovasculaires ; le Conseil de cardiologie clinique ; le Conseil de la nutrition, de l’activité physique et du métabolisme ; et le groupe de travail interdisciplinaire de recherche sur la qualité des soins et les résultats : l’American Academy of Neurology affirme la valeur de cette ligne directrice” . AVC . 37 (6): 1583–633. doi : 10.1161/01.STR.0000223048.70103.F1 . PMID 16675728 .
- ^ Centre d’évaluation et de recherche sur les médicaments. “Informations pour les consommateurs (drogues) – Utilisation de l’aspirine pour la prévention primaire des crises cardiaques et des accidents vasculaires cérébraux” . www.fda.gov . Archivé de l’original le 17/11/2015 . Récupéré le 16/11/2015 .
- ^ un bc NPS Prescription Pratique Révision 44: Antiplaquettaires et anticoagulants dans la prévention des accidents vasculaires cérébraux (2009) . Disponible sur nps.org.au Archivé le 07/04/2012 sur la Wayback Machine
- ^ une Collaboration b d’Antithrombotic Trialists (le janvier de 2002). “Méta-analyse collaborative d’essais randomisés de thérapie antiplaquettaire pour la prévention de la mort, de l’infarctus du myocarde et de l’AVC chez les patients à haut risque” . BMJ . 324 (7329): 71–86. doi : 10.1136/bmj.324.7329.71 . PMC 64503 . PMID 11786451 .
- ^ Jonas DE, Feltner C, Amick HR, Sheridan S, Zheng ZJ, Watford DJ, et al. (septembre 2014). “Dépistage de la sténose asymptomatique de l’artère carotide : une revue systématique et une méta-analyse pour le groupe de travail américain sur les services préventifs”. Annales de médecine interne . 161 (5) : 336–346. doi : 10.7326/M14-0530 . PMID 25004169 . S2CID 8741746 .
- ^ Groupe de travail du Conseil de la recherche médicale (juillet 1985). “Essai MRC de traitement de l’hypertension légère: principaux résultats. Groupe de travail du Conseil de la recherche médicale” . Journal médical britannique . 291 (6488): 97–104. doi : 10.1136/bmj.291.6488.97 . PMC 1416260 . PMID 2861880 .
- ^ Thomson R (août 2009). “Mise en œuvre basée sur des preuves d’interventions complexes”. BMJ . 339 : b3124. doi : 10.1136/bmj.b3124 . PMID 19675081 . S2CID 692596 .
- ^ Hankey GJ (août 1999). “Tabagisme et risque d’accident vasculaire cérébral”. Journal du risque cardiovasculaire . 6 (4): 207-211. doi : 10.1177/204748739900600403 . PMID 10501270 . S2CID 43819614 .
- ^ Wannamethee SG, Shaper AG, Whincup PH, Walker M (juillet 1995). “L’arrêt du tabac et le risque d’accident vasculaire cérébral chez les hommes d’âge moyen”. JAMA . 274 (2): 155–60. doi : 10.1001/jama.274.2.155 . PMID 7596004 .
- ^ Reynolds K, Lewis B, Nolen JD, Kinney GL, Sathya B, He J, Lewis BL (février 2003). “Consommation d’alcool et risque d’AVC : une méta-analyse” . JAMA . 289 (5): 579–88. doi : 10.1001/jama.289.5.579 . PMID 12578491 . S2CID 28076015 .
- ^ Sloan MA, Kittner SJ, Rigamonti D, Price TR (septembre 1991). “Occurrence d’accident vasculaire cérébral associé à l’utilisation / l’abus de drogues”. Neurologie . 41 (9) : 1358–1364. doi : 10.1212/WNL.41.9.1358 . PMID 1891081 . S2CID 26670239 .
- ^ Larsson SC, Virtamo J, Wolk A (août 2011). “Consommation de viande rouge et risque d’AVC chez les hommes suédois” . Le tourillon américain de la nutrition clinique . 94 (2): 417–21. doi : 10.3945/ajcn.111.015115 . PMID 21653800 .
- ^ “Facteurs de risque d’AVC” . Association américaine du cœur . 2007 . Récupéré le 22 janvier 2007 .
- ^ Hackshaw A, Morris JK, Boniface S, Tang JL, Milenković D (janvier 2018). “Faible consommation de cigarettes et risque de maladie coronarienne et d’accident vasculaire cérébral : méta-analyse de 141 études de cohorte dans 55 rapports d’étude” . BMJ . 360 : j5855. doi : 10.1136/bmj.j5855 . PMC 5781309 . PMID 29367388 .
- ^ Gorelick PB (1987). « Alcool et AVC » . AVC . 18 (1): 268–71. doi : 10.1161/01.STR.18.1.268 . PMID 3810763 .
- ^ Westover AN, McBride S, Haley RW (avril 2007). “AVC chez les jeunes adultes qui abusent d’amphétamines ou de cocaïne : une étude basée sur la population de patients hospitalisés” . Archives de psychiatrie générale . 64 (4): 495–502. doi : 10.1001/archpsyc.64.4.495 . PMID 17404126 .
- ^ Schürks M, Rist PM, Bigal ME, Buring JE, Lipton RB, Kurth T (octobre 2009). “Migraine et maladies cardiovasculaires : revue systématique et méta-analyse” . BMJ . 339 (oct27 1): b3914. doi : 10.1136/bmj.b3914 . PMC 2768778 . PMID 19861375 .
- ^ Kurth T, Chabriat H, Bousser MG (janvier 2012). « Migraine et accident vasculaire cérébral : une association complexe avec des implications cliniques ». Le Lancet. Neurologie . 11 (1): 92–100. doi : 10.1016/S1474-4422(11)70266-6 . PMID 22172624 . S2CID 31939284 .
- ^ Ciaccio EJ, Lewis SK, Biviano AB, Iyer V, Garan H, Green PH (août 2017). “Atteinte cardiovasculaire dans la maladie coeliaque” . Journal mondial de cardiologie (révision). 9 (8): 652–666. doi : 10.4330/wjc.v9.i8.652 . PMC 5583538 . PMID 28932354 .
- ^ Kyu HH, Bachman VF, Alexander LT, Mumford JE, Afshin A, Estep K, et al. (août 2016). “Activité physique et risque de cancer du sein, de cancer du côlon, de diabète, de cardiopathie ischémique et d’accidents vasculaires cérébraux ischémiques : examen systématique et méta-analyse dose-réponse pour l’étude Global Burden of Disease Study 2013” . BMJ . 354 : 13857. doi : 10.1136/bmj.i3857 . PMC 4979358 . PMID 27510511 .
- ^ Ezekowitz JA, Straus SE, Majumdar SR, McAlister FA (décembre 2003). « AVC : stratégies de prévention primaire ». Médecin de famille américain . 68 (12): 2379–86. PMID 14705756 .
- ^ un bcd Ederle J , Brown MM (octobre 2006). “Les preuves de la médecine par rapport à la chirurgie pour la sténose carotidienne”. Journal européen de radiologie . 60 (1): 3–7. doi : 10.1016/j.ejrad.2006.05.021 . PMID 16920313 .
- ^ Whisnant JP (février 1996). “Efficacité versus efficacité du traitement de l’hypertension pour la prévention des accidents vasculaires cérébraux”. Neurologie . 46 (2): 301–7. doi : 10.1212/WNL.46.2.301 . PMID 8614485 . S2CID 28985425 .
- ^ Loi MR, Morris JK, Wald NJ (mai 2009). “Utilisation de médicaments antihypertenseurs dans la prévention des maladies cardiovasculaires : méta-analyse de 147 essais randomisés dans le contexte des attentes d’études épidémiologiques prospectives” . BMJ . 338 : b1665. doi : 10.1136/bmj.b1665 . PMC 2684577 . PMID 19454737 .
- ^ Psaty BM, Lumley T, Furberg CD, Schellenbaum G, Pahor M, Alderman MH, Weiss NS (mai 2003). “Les résultats de santé associés à diverses thérapies antihypertensives utilisées comme agents de première intention : une méta-analyse en réseau” . JAMA . 289 (19): 2534–44. doi : 10.1001/jama.289.19.2534 . PMID 12759325 . S2CID 123289 .
- ^ un b “Le cholestérol, la tension artérielle diastolique et l’accident vasculaire cérébral : 13 000 accidents vasculaires cérébraux chez 450 000 personnes dans 45 cohortes prospectives. Collaboration d’études prospectives”. Lancette . 346 (8991–8992): 1647–53. 1995. doi : 10.1016/S0140-6736(95)92836-7 . PMID 8551820 . S2CID 12043767 .
- ^ Gueyffier F, Boissel JP, Boutitie F, Pocock S, Coope J, Cutler J, et al. (décembre 1997). “Effet du traitement antihypertenseur chez les patients ayant déjà souffert d’un accident vasculaire cérébral. Rassembler les preuves. Les collaborateurs du projet INDANA (ANAlyse de données individuelles des essais d’intervention antihypertenseurs)”. AVC . 28 (12): 2557–62. doi : 10.1161/01.STR.28.12.2557 . PMID 9412649 .
- ^ Gueyffier F, Bulpitt C, Boissel JP, Schron E, Ekbom T, Fagard R, et al. (mars 1999). “Médicaments antihypertenseurs chez les personnes très âgées: une méta-analyse de sous-groupe d’essais contrôlés randomisés. Groupe INDANA” . Lancette . 353 (9155): 793–6. doi : 10.1016/S0140-6736(98)08127-6 . PMID 10459960 . S2CID 43858004 .
- ^ Staessen JA, Gasowski J, Wang JG, Thijs L, Den Hond E, Boissel JP, et al. (mars 2000). “Risques d’hypertension systolique isolée non traitée et traitée chez les personnes âgées: méta-analyse des essais de résultats”. Lancette . 355 (9207): 865–72. doi : 10.1016/S0140-6736(99)07330-4 . PMID 10752701 . S2CID 31403774 .
- ^ Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. (mai 2008). “Traitement de l’hypertension chez les patients de 80 ans ou plus” (PDF) . Le New England Journal of Medicine . 358 (18): 1887-1898. doi : 10.1056/NEJMoa0801369 . PMID 18378519 .
- ^ Neal B, MacMahon S, Chapman N (décembre 2000). “Effets des inhibiteurs de l’ECA, des antagonistes du calcium et d’autres médicaments anti-hypertenseurs : résultats d’aperçus d’essais randomisés conçus de manière prospective. Collaboration des essais de traitement anti-hypertenseur”. Lancette . 356 (9246): 1955–64. doi : 10.1016/S0140-6736(00)03307-9 . PMID 11130523 . S2CID 46148907 .
- ^ Les Officiers et Coordonnateurs Allhat pour le Groupe de Recherche Collaboratif Allhat (décembre 2002). “Résultats majeurs chez les patients hypertendus à haut risque randomisés pour recevoir un inhibiteur de l’enzyme de conversion de l’angiotensine ou un inhibiteur calcique contre un diurétique : le traitement antihypertenseur et hypolipidémiant pour prévenir l’essai de crise cardiaque (ALLHAT)” . JAMA . 288 (23): 2981–97. doi : 10.1001/jama.288.23.2981 . PMID 12479763 .
- ^ De Lima LG, Saconato H, Atallah AN, da Silva EM (octobre 2014). “Bêta-bloquants pour prévenir la récidive d’AVC”. La base de données Cochrane des revues systématiques . 10 (10) : CD007890. doi : 10.1002/14651858.CD007890.pub3 . PMID 25317988 .
- ^ Iso H, Jacobs DR, Wentworth D, Neaton JD, Cohen JD (avril 1989). “Taux de cholestérol sérique et mortalité à six ans par accident vasculaire cérébral chez 350 977 hommes examinés pour l’essai d’intervention sur les facteurs de risque multiples”. Le New England Journal of Medicine . 320 (14): 904–10. doi : 10.1056/NEJM198904063201405 . PMID 2619783 .
- ^ un b O’Regan C, Wu P, Arora P, Perri D, Mills EJ (janvier 2008). “Thérapie par les statines dans la prévention des accidents vasculaires cérébraux : une méta-analyse impliquant 121 000 patients”. Le Journal américain de médecine . 121 (1): 24–33. doi : 10.1016/j.amjmed.2007.06.033 . PMID 18187070 .
- ^ Hébert PR, Gaziano JM, Hennekens CH (janvier 1995). “Un aperçu des essais de réduction du cholestérol et du risque d’accident vasculaire cérébral”. Archives de médecine interne . 155 (1) : 50–5. doi : 10.1001/archite.155.1.50 . PMID 7802520 .
- ^ “Contrôle intensif de la glycémie avec des sulfonylurées ou de l’insuline par rapport au traitement conventionnel et au risque de complications chez les patients atteints de diabète de type 2 (UKPDS 33). Groupe d’étude prospective sur le diabète au Royaume-Uni (UKPDS)” . Lancette . 352 (9131): 837–53. Septembre 1998. doi : 10.1016/S0140-6736(98)07019-6 . PMID 9742976 . S2CID 7019505 .
- ^ Dormandy JA, Charbonnel B, Eckland DJ, Erdmann E, Massi-Benedetti M, Moules IK, et al. (octobre 2005). “Prévention secondaire des événements macrovasculaires chez les patients atteints de diabète de type 2 dans l’étude PROactive (PROspective pioglitAzone Clinical Trial In macroVascular Events): un essai contrôlé randomisé” . Lancette . 366 (9493): 1279–89. doi : 10.1016/S0140-6736(05)67528-9 . manche : 2268/6536 . PMID 16214598 . S2CID 11825315 .
- ^ Johnson ES, Lanes SF, Wentworth CE, Satterfield MH, Abebe BL, Dicker LW (juin 1999). “Une analyse de métarégression de l’effet dose-réponse de l’aspirine sur les accidents vasculaires cérébraux” . Archives de médecine interne . 159 (11): 1248–1253. doi : 10.1001/archite.159.11.1248 . PMID 10371234 .
- ^ un b Sudlow CL, Mason G, Maurice JB, Wedderburn CJ, Hankey GJ (octobre 2009). “Dérivés de thiénopyridine par rapport à l’aspirine pour prévenir les accidents vasculaires cérébraux et d’autres événements vasculaires graves chez les patients à haut risque vasculaire” . La base de données Cochrane des revues systématiques (4) : CD001246. doi : 10.1002/14651858.CD001246.pub2 . PMC 7055203 . PMID 19821273 . S2CID 205162946 .
- ^ Hao Q, Tampi M, O’Donnell M, Foroutan F, Siemieniuk RA, Guyatt G (décembre 2018). “Clopidogrel plus aspirine versus aspirine seule pour l’AVC ischémique mineur aigu ou l’accident ischémique transitoire à haut risque : revue systématique et méta-analyse” . BMJ . 363 : k5108. doi : 10.1136/bmj.k5108 . PMC 6298178 . PMID 30563866 .
- ^ Halkes PH, van Gijn J, Kappelle LJ, Koudstaal PJ, Algra A (mai 2006). “Aspirine plus dipyridamole versus aspirine seule après ischémie cérébrale d’origine artérielle (ESPRIT): essai contrôlé randomisé”. Lancette . 367 (9523): 1665–73. doi : 10.1016/S0140-6736(06)68734-5 . PMID 16714187 . S2CID 10691264 .
- ^ Wolf PA, Abbott RD, Kannel WB (septembre 1987). “Fibrillation auriculaire : un contributeur majeur à l’AVC chez les personnes âgées. L’étude de Framingham”. Archives de médecine interne . 147 (9) : 1561–4. doi : 10.1001/archite.147.9.1561 . PMID 3632164 .
- ^ Fuster V, Rydén LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, et al. (Août 2006). “Directives ACC/AHA/ESC 2006 pour la prise en charge des patients atteints de fibrillation auriculaire : un rapport de l’American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation) : développé en collaboration avec l’European Heart Rhythm Association et la Heart Rhythm Society” . Circulation . 114 (7) : e257-354. doi : 10.1161/CIRCULATIONAHA.106.177292 . PMID 16908781 .
- ^ Halkes PH, van Gijn J, Kappelle LJ, Koudstaal PJ, Algra A (février 2007). “Anticoagulants oraux d’intensité moyenne versus aspirine après ischémie cérébrale d’origine artérielle (ESPRIT): un essai contrôlé randomisé”. Le Lancet. Neurologie . 6 (2): 115–24. doi : 10.1016/S1474-4422(06)70685-8 . PMID 17239798 .
- ^ Hart RG, Halperin JL , McBride R, Benavente O, Man-Son-Hing M, Kronmal RA (mars 2000). “Aspirine pour la prévention primaire des accidents vasculaires cérébraux et autres événements vasculaires majeurs : méta-analyse et hypothèses” . Archives de Neurologie . 57 (3): 326–332. doi : 10.1001/archneur.57.3.326 . PMID 10714657 .
- ^ Bartolucci AA, Howard G (septembre 2006). “Méta-analyse des données des six essais de prévention primaire des événements cardiovasculaires utilisant l’aspirine”. Le Journal américain de cardiologie . 98 (6): 746–50. doi : 10.1016/j.amjcard.2006.04.012 . PMID 16950176 .
- ^ Berger JS, Roncaglioni MC, Avanzini F, Pangrazzi I, Tognoni G, Brown DL (janvier 2006). “Aspirine pour la prévention primaire des événements cardiovasculaires chez les femmes et les hommes : une méta-analyse spécifique au sexe d’essais contrôlés randomisés” . JAMA . 295 (3): 306–313. doi : 10.1001/jama.295.3.306 . PMID 16418466 . S2CID 11952921 .
- ^ Yerman T, Gan WQ, Sin DD (octobre 2007). “L’influence du sexe sur les effets de l’aspirine dans la prévention de l’infarctus du myocarde” . Médecine BMC . 5 : 29. doi : 10.1186/1741-7015-5-29 . PMC 2131749 . PMID 17949479 .
- ^ Rothwell PM, Eliasziw M, Gutnikov SA, Fox AJ, Taylor DW, Mayberg MR, et al. (janvier 2003). “Analyse des données regroupées des essais contrôlés randomisés d’endartériectomie pour la sténose carotidienne symptomatique”. Lancette . 361 (9352): 107–16. doi : 10.1016/S0140-6736(03)12228-3 . PMID 12531577 . S2CID 2484664 .
- ^ Ringleb PA, Chatellier G, Hacke W, Favre JP, Bartoli JM, Eckstein HH, Mas JL (février 2008). “Sécurité du traitement endovasculaire de la sténose de l’artère carotide par rapport au traitement chirurgical : une méta-analyse” . Journal de chirurgie vasculaire . 47 (2): 350–5. doi : 10.1016/j.jvs.2007.10.035 . PMID 18241759 .
- ^ Müller MD, Lyrer P, Brown MM, Bonati LH (février 2020). « Stenting de l’artère carotide versus endartériectomie pour le traitement de la sténose de l’artère carotide » . La base de données Cochrane des revues systématiques . 2 : CD000515. doi : 10.1002/14651858.CD000515.pub5 . PMC 7041119 . PMID 32096559 .
- ^ Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ (mars 2004). “Endartériectomie pour la sténose carotidienne symptomatique en relation avec les sous-groupes cliniques et le moment de la chirurgie”. Lancette . 363 (9413): 915–24. doi : 10.1016/S0140-6736(04)15785-1 . PMID 15043958 . S2CID 3916408 .
- ^ Fairhead JF, Mehta Z, Rothwell PM (août 2005). “Étude basée sur la population des retards dans l’imagerie et la chirurgie carotidiennes et le risque d’AVC récurrent”. Neurologie . 65 (3): 371–5. doi : 10.1212/01.wnl.0000170368.82460.b4 . PMID 16087900 . S2CID 24829283 .
- ^ Groupe de travail américain sur les services préventifs (décembre 2007). “Dépistage de la sténose de l’artère carotide : déclaration de recommandation du groupe de travail sur les services préventifs des États-Unis” . Annales de médecine interne . 147 (12): 854–9. doi : 10.7326/0003-4819-147-12-200712180-00005 . PMID 18087056 .
- ^ Halliday A, Mansfield A, Marro J, Peto C, Peto R, Potter J, Thomas D (mai 2004). “Prévention des accidents vasculaires cérébraux invalidants et mortels par une endartériectomie carotidienne réussie chez des patients sans symptômes neurologiques récents: essai contrôlé randomisé”. Lancette . 363 (9420): 1491–502. doi : 10.1016/S0140-6736(04)16146-1 . PMID 15135594 . S2CID 22814764 .
- ^ Chambers BR, Donnan GA (octobre 2005). “Endartériectomie carotidienne pour sténose carotidienne asymptomatique” . La base de données Cochrane des revues systématiques . 2008 (4) : CD001923. doi : 10.1002/14651858.CD001923.pub2 . PMC 6669257 . PMID 16235289 .
- ^ Spence JD (septembre 2006). “Nutrition et prévention des AVC” . AVC . 37 (9) : 2430–5. doi : 10.1161/01.STR.0000236633.40160.ee . PMID 16873712 .
- ^ Zhou YH, Tang JY, Wu MJ, Lu J, Wei X, Qin YY, et al. (2011). “Effet de la supplémentation en acide folique sur les résultats cardiovasculaires : une revue systématique et une méta-analyse” . PLOS ONE . 6 (9) : e25142. Bibcode : 2011PLoSO…625142Z . doi : 10.1371/journal.pone.0025142 . PMC 3182189 . PMID 21980387 .
- ^ Clarke R, Halsey J, Lewington S, Lonn E, Armitage J, Manson JE, et al. (October 2010). “Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals”. Archives of Internal Medicine. 170 (18): 1622–31. doi:10.1001/archinternmed.2010.348. PMID 20937919.
- ^ Bushnell C, McCullough LD , Awad IA, Chireau MV, Fedder WN, Furie KL, et al. (mai 2014). “Lignes directrices pour la prévention des accidents vasculaires cérébraux chez les femmes : une déclaration pour les professionnels de la santé de l’American Heart Association/American Stroke Association” . AVC . 45 (5): 1545–88. doi : 10.1161/01.str.0000442009.06663.48 . PMID 24503673 .
- ^ un b Kernan WN, Ovbiagele B, Black HR, Bravata DM, Chimowitz MI, Ezekowitz MD, et al. (juillet 2014). “Lignes directrices pour la prévention des accidents vasculaires cérébraux chez les patients ayant subi un AVC et un accident ischémique transitoire : une ligne directrice pour les professionnels de la santé de l’American Heart Association/American Stroke Association” . AVC . 45 (7): 2160–236. doi : 10.1161/STR.0000000000000024 . PMID 24788967 .
- ^ Hart RG, Pearce LA, Aguilar MI (June 2007). “Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation”. Annals of Internal Medicine. 146 (12): 857–67. doi:10.7326/0003-4819-146-12-200706190-00007. PMID 17577005. S2CID 25505238.
- ^ Paciaroni M, Agnelli G, Micheli S, Caso V (February 2007). “Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke: a meta-analysis of randomized controlled trials”. Stroke. 38 (2): 423–30. doi:10.1161/01.STR.0000254600.92975.1f. PMID 17204681.ACP JC synopsis Archived 2012-11-14 at the Wayback Machine
- ^ Armstrong MJ, Gronseth G, Anderson DC, Biller J, Cucchiara B, Dafer R, et al. (May 2013). “Summary of evidence-based guideline: periprocedural management of antithrombotic medications in patients with Ischemic cerebrovascular disease: report of the Guideline Development Subcommittee of the American Academy of Neurology”. Neurology. 80 (22): 2065–9. doi:10.1212/WNL.0b013e318294b32d. PMC 3716407. PMID 23713086.
- ^ Rothwell PM, Algra A, Chen Z, Diener HC, Norrving B, Mehta Z (July 2016). “Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke: time-course analysis of randomised trials”. Lancet. 388 (10042): 365–375. doi:10.1016/S0140-6736(16)30468-8. PMC 5321490. PMID 27209146.
- ^ Gomez CR (1993). “Editorial: Time is brain!”. Journal of Stroke and Cerebrovascular Diseases. 3 (1): 1–2. doi:10.1016/S1052-3057(10)80125-9. PMID 26487071.
- ^ Saver JL (January 2006). “Time is brain–quantified”. Stroke. 37 (1): 263–6. doi:10.1161/01.STR.0000196957.55928.ab. PMID 16339467.
- ^ Bellolio MF, Gilmore RM, Ganti L (January 2014). “Insulin for glycaemic control in acute ischaemic stroke”. The Cochrane Database of Systematic Reviews. 1 (1): CD005346. doi:10.1002/14651858.CD005346.pub4. PMID 24453023.
- ^ Bath PM, Krishnan K (October 2014). “Interventions for deliberately altering blood pressure in acute stroke” (PDF). The Cochrane Database of Systematic Reviews. 2014 (10): CD000039. doi:10.1002/14651858.CD000039.pub3. PMC 7052738. PMID 25353321. Archived from the original (PDF) on 2019-04-12. Retrieved 2018-05-16.
- ^ Lee M, Ovbiagele B, Hong KS, Wu YL, Lee JE, Rao NM, et al. (July 2015). “Effect of Blood Pressure Lowering in Early Ischemic Stroke: Meta-Analysis”. Stroke. 46 (7): 1883–9. doi:10.1161/STROKEAHA.115.009552. PMID 26022636.
- ^ Ziganshina LE, Abakumova T, Hoyle CH (July 2020). “Cerebrolysin for acute ischaemic stroke”. The Cochrane Database of Systematic Reviews. 7 (9): CD007026. doi:10.1002/14651858.CD007026.pub6. PMC 7387239. PMID 32662068.
- ^ a b c Wardlaw JM, Murray V, Berge E, del Zoppo GJ (July 2014). “Thrombolysis for acute ischaemic stroke”. The Cochrane Database of Systematic Reviews. 7 (7): CD000213. doi:10.1002/14651858.CD000213.pub3. PMC 4153726. PMID 25072528.
- ^ a b Emberson J, Lees KR, Lyden P, Blackwell L, Albers G, Bluhmki E, et al. (November 2014). “Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials”. Lancet. 384 (9958): 1929–35. doi:10.1016/S0140-6736(14)60584-5. PMC 4441266. PMID 25106063.
- ^ a b “Thrombolytics for acute stroke”. Dynamed. Sep 15, 2014. Archived from the original on 7 January 2016. Retrieved 4 October 2014. at 3–4.5 hours after stroke onset t-PA increases risk of symptomatic intracranial hemorrhage but effect on functional outcomes is inconsistent
- ^ Alper BS, Malone-Moses M, McLellan JS, Prasad K, Manheimer E (March 2015). “Thrombolysis in acute ischaemic stroke: time for a rethink?”. BMJ. 350 (h1075): h1075. doi:10.1136/bmj.h1075. PMID 25786912. S2CID 38909467.
- ^ “Canadian Association of Emergency Physicians Position Statement on Acute Ischemic Stroke” (PDF). caep.ca. March 2015. Archived from the original (PDF) on 2015-09-18. Retrieved 7 April 2015.
- ^ “10 points to remember”. American College of Cardiology. 2018. Retrieved March 27, 2020.
- ^ Wardlaw JM, Murray V, Berge E, del Zoppo G, Sandercock P, Lindley RL, Cohen G (June 2012). “Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis”. Lancet. 379 (9834): 2364–72. doi:10.1016/S0140-6736(12)60738-7. PMC 3386494. PMID 22632907.
- ^ Whiteley WN, Slot KB, Fernandes P, Sandercock P, Wardlaw J (November 2012). “Risk factors for intracranial hemorrhage in acute Ischemic stroke patients treated with recombinant tissue plasminogen activator: a systematic review and meta-analysis of 55 studies”. Stroke. 43 (11): 2904–9. doi:10.1161/STROKEAHA.112.665331. PMID 22996959.
- ^ Campbell BC, Ma H, Ringleb PA, Parsons MW, Churilov L, Bendszus M, et al. (July 2019). “Extending thrombolysis to 4·5-9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data”. Lancet. 394 (10193): 139–147. doi:10.1016/S0140-6736(19)31053-0. hdl:10138/312914. PMID 31128925. S2CID 205990717.
- ^ The National Institute Of Neurological Disorders And Stroke Rt-Pa Stroke Study Group (December 1995). “Tissue plasminogen activator for acute Ischemic stroke”. The New England Journal of Medicine. 333 (24): 1581–7. doi:10.1056/NEJM199512143332401. PMID 7477192.
- ^ Wardlaw JM, Murray V, Berge E, del Zoppo GJ (July 2014). “Thrombolysis for acute ischaemic stroke”. The Cochrane Database of Systematic Reviews. 7 (7): CD000213. doi:10.1002/14651858.CD000213.pub3. PMC 4153726. PMID 25072528.
- ^ Dubinsky R, Lai SM (June 2006). “Mortality of stroke patients treated with thrombolysis: analysis of nationwide inpatient sample”. Neurology. 66 (11): 1742–4. doi:10.1212/01.wnl.0000218306.35681.38. PMID 16769953. S2CID 13610719.
- ^ “Position Statement on the Use of Intravenous Thrombolytic Therapy in the Treatment of Stroke”. American Academy of Emergency Medicine. Archived from the original on 2006-10-04. Retrieved 2008-01-25.
- ^ Chapman SN, Mehndiratta P, Johansen MC, McMurry TL, Johnston KC, Southerland AM (2014-02-24). “Current perspectives on the use of intravenous recombinant tissue plasminogen activator (tPA) for treatment of acute Ischemic stroke”. Vascular Health and Risk Management. 10: 75–87. doi:10.2147/VHRM.S39213. PMC 3938499. PMID 24591838.
- ^ American College of Emergency Physicians (February 2013). “Clinical Policy: Use of intravenous tPA for the management of acute Ischemic stroke in the emergency department”. Annals of Emergency Medicine. 61 (2): 225–43. doi:10.1016/j.annemergmed.2012.11.005. PMID 23331647.
- ^ Kolata G (2018-03-26). “For Many Strokes, There’s an Effective Treatment. Why Aren’t Some Doctors Offering It?”. The New York Times. ISSN 0362-4331. Retrieved 2020-03-28.
- ^ “The Case Against Thrombolytic Therapy in Stroke”. Medscape. Retrieved 2020-03-28.
- ^ Lee M, Hong KS, Saver JL (May 2010). “Efficacy of intra-arterial fibrinolysis for acute Ischemic stroke: meta-analysis of randomized controlled trials”. Stroke. 41 (5): 932–7. doi:10.1161/STROKEAHA.109.574335. PMID 20360549.
- ^ Sardar P, Chatterjee S, Giri J, Kundu A, Tandar A, Sen P, et al. (September 2015). “Endovascular therapy for acute ischaemic stroke: a systematic review and meta-analysis of randomized trials”. European Heart Journal. 36 (35): 2373–80. doi:10.1093/eurheartj/ehv270. PMID 26071599.
- ^ Saver JL, Goyal M, van der Lugt A, Menon BK, Majoie CB, Dippel DW, et al. (September 2016). “Time to Treatment With Endovascular Thrombectomy and Outcomes From Ischemic Stroke: A Meta-analysis”. JAMA. 316 (12): 1279–88. doi:10.1001/jama.2016.13647. PMID 27673305.
- ^ Goyal M, Menon BK, van Zwam WH, Dippel DW, Mitchell PJ, Demchuk AM, et al. (April 2016). “Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials”. Lancet. 387 (10029): 1723–31. doi:10.1016/s0140-6736(16)00163-x. PMID 26898852. S2CID 34799180.
- ^ Mistry EA, Mistry AM, Nakawah MO, Chitale RV, James RF, Volpi JJ, Fusco MR (September 2017). “Mechanical Thrombectomy Outcomes With and Without Intravenous Thrombolysis in Stroke Patients: A Meta-Analysis”. Stroke. 48 (9): 2450–2456. doi:10.1161/STROKEAHA.117.017320. PMID 28747462. S2CID 3751956.
- ^ Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, et al. (March 2018). “2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association”. Stroke. 49 (3): e46–e110. doi:10.1161/STR.0000000000000158. PMID 29367334. S2CID 4972922.
- ^ Simard JM, Sahuquillo J, Sheth KN, Kahle KT, Walcott BP (April 2011). “Managing malignant cerebral infarction”. Current Treatment Options in Neurology. 13 (2): 217–29. doi:10.1007/s11940-010-0110-9. PMC 3243953. PMID 21190097.
- ^ Vespa PM, Martin N, Zuccarello M, Awad I, Hanley DF (June 2013). “Surgical trials in intracerebral hemorrhage”. Stroke. 44 (6 Suppl 1): S79-82. doi:10.1161/STROKEAHA.113.001494. PMC 6778724. PMID 23709739.
- ^ Steiner T, Juvela S, Unterberg A, Jung C, Forsting M, Rinkel G (2013). “European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage” (PDF). Cerebrovascular Diseases. 35 (2): 93–112. doi:10.1159/000346087. PMID 23406828. S2CID 3526670.
- ^ Langhorne P, Ramachandra S (April 2020). “Organised inpatient (stroke unit) care for stroke: network meta-analysis”. The Cochrane Database of Systematic Reviews. 4: CD000197. doi:10.1002/14651858.CD000197.pub4. PMC 7197653. PMID 32324916.
- ^ Clarke DJ (May 2014). “Nursing practice in Stroke rehabilitation: systematic review and meta-ethnography”. Journal of Clinical Nursing. 23 (9–10): 1201–26. doi:10.1111/jocn.12334. PMID 24102924.
- ^ Duffy L, Gajree S, Langhorne P, Stott DJ, Quinn TJ (February 2013). “Reliability (inter-rater agreement) of the Barthel Index for assessment of stroke survivors: systematic review and meta-analysis”. Stroke. 44 (2): 462–8. doi:10.1161/STROKEAHA.112.678615. PMID 23299497. S2CID 9499113.
- ^ a b Longley, Verity; Hazelton, Christine; Heal, Calvin; Pollock, Alex; Woodward-Nutt, Kate; Mitchell, Claire; Pobric, Gorana; Vail, Andy; Bowen, Audrey (2021-07-01). “Non-pharmacological interventions for spatial neglect or inattention following stroke and other non-progressive brain injury”. The Cochrane Database of Systematic Reviews. 2021 (7): CD003586. doi:10.1002/14651858.CD003586.pub4. ISSN 1469-493X. PMC 8247630. PMID 34196963.
- ^ a b George S, Crotty M, Gelinas I, Devos H (February 2014). “Rehabilitation for improving automobile driving after stroke”. The Cochrane Database of Systematic Reviews. 2014 (2): CD008357. doi:10.1002/14651858.CD008357.pub2. PMC 6464773. PMID 24567028.
- ^ a b Lawrence M, Celestino Junior FT, Matozinho HH, Govan L, Booth J, Beecher J (December 2017). “Yoga for Stroke rehabilitation“. The Cochrane Database of Systematic Reviews. 2017 (12): CD011483. doi:10.1002/14651858.CD011483.pub2. PMC 6486003. PMID 29220541.
- ^ a b Borges LR, Fernandes AB, Melo LP, Guerra RO, Campos TF (October 2018). “Action observation for upper limb rehabilitation after stroke”. The Cochrane Database of Systematic Reviews. 2018 (10): CD011887. doi:10.1002/14651858.CD011887.pub2. PMC 6517007. PMID 30380586.
- ^ a b Loetscher T, Potter KJ, Wong D, das Nair R (November 2019). “Cognitive rehabilitation for attention deficits following stroke”. The Cochrane Database of Systematic Reviews. 2019 (11). doi:10.1002/14651858.CD002842.pub3. PMC 6953353. PMID 31706263.
- ^ a b Silva S, Borges LR, Santiago L, Lucena L, Lindquist AR, Ribeiro T, et al. (Cochrane Stroke Group) (September 2020). “Motor imagery for gait rehabilitation after stroke”. The Cochrane Database of Systematic Reviews. 2020 (9): CD013019. doi:10.1002/14651858.CD013019.pub2. PMC 8094749. PMID 32970328.
- ^ O’Sullivan 2007, pp. 471, 484, 737, 740
- ^ a b Pollock A, Baer G, Campbell P, Choo PL, Forster A, Morris J, et al. (Cochrane Stroke Group) (April 2014). “Physical rehabilitation approaches for the recovery of function and mobility following stroke”. The Cochrane Database of Systematic Reviews (4): CD001920. doi:10.1002/14651858.CD001920.pub3. PMC 6465059. PMID 24756870.
- ^ a b Thomas LH, Coupe J, Cross LD, Tan AL, Watkins CL (February 2019). “Interventions for treating urinary incontinence after stroke in adults”. The Cochrane Database of Systematic Reviews. 2019 (2): CD004462. doi:10.1002/14651858.CD004462.pub4. PMC 6355973. PMID 30706461.
- ^ a b Stratton H, Sansom J, Brown-Major A, Anderson P, Ng L (May 2020). “Interventions for sexual dysfunction following stroke”. The Cochrane Database of Systematic Reviews. 2020 (5): CD011189. doi:10.1002/14651858.CD011189.pub2. PMC 7197697. PMID 32356377.
- ^ Pollock A, Hazelton C, Henderson CA, Angilley J, Dhillon B, Langhorne P, et al. (March 2012). “Interventions for age-related visual problems in patients with stroke”. The Cochrane Database of Systematic Reviews (3): CD008390. doi:10.1002/14651858.cd008390.pub2. PMID 22419333.
- ^ a b Mackenzie C (April 2011). “Dysarthria in stroke: a narrative review of its description and the outcome of intervention”. International Journal of Speech-Language Pathology. 13 (2): 125–36. doi:10.3109/17549507.2011.524940. PMID 21480809. S2CID 39377646.
- ^ West C, Hesketh A, Vail A, Bowen A (October 2005). “Interventions for apraxia of speech following stroke”. The Cochrane Database of Systematic Reviews (4): CD004298. doi:10.1002/14651858.CD004298.pub2. PMID 16235357.
- ^ Brady MC, Kelly H, Godwin J, Enderby P, Campbell P (June 2016). “Speech and language therapy for aphasia following stroke”. The Cochrane Database of Systematic Reviews. 2016 (6): CD000425. doi:10.1002/14651858.CD000425.pub4. hdl:1893/26112. PMC 8078645. PMID 27245310.
- ^ Bath PM, Lee HS, Everton LF (October 2018). “Swallowing therapy for dysphagia in acute and subacute stroke”. The Cochrane Database of Systematic Reviews. 2018 (10): CD000323. doi:10.1002/14651858.CD000323.pub3. PMC 6516809. PMID 30376602.
- ^ “NHS Scotland – SHOW” (PDF). Archived (PDF) from the original on 2013-05-16. Retrieved 2012-11-09.
- ^ a b c d Saunders DH, Sanderson M, Hayes S, Johnson L, Kramer S, Carter DD, et al. (March 2020). “Physical fitness training for stroke patients”. The Cochrane Database of Systematic Reviews. 2020 (3): CD003316. doi:10.1002/14651858.CD003316.pub7. PMC 7083515. PMID 32196635.
- ^ Institute for Quality and Efficiency in Health Care (IQWiG). “After a stroke: Does fitness training improve overall health and mobility?”. Informed Health Online. Institute for Quality and Efficiency in Health Care (IQWiG). Retrieved 20 June 2013.
- ^ Barclay RE, Stevenson TJ, Poluha W, Ripat J, Nett C, Srikesavan CS (March 2015). “Interventions for improving community ambulation in individuals with stroke”. The Cochrane Database of Systematic Reviews. 2015 (3): CD010200. doi:10.1002/14651858.CD010200.pub2. PMC 6465042. PMID 25767912.
- ^ a b Lange B, Flynn S, Rizzo A (2009). “Initial usability assessment of off-the-shelf video game consoles for clinical game-based motor rehabilitation”. Physical Therapy Reviews. 14 (5): 355–62. doi:10.1179/108331909X12488667117258. S2CID 14767181.
- ^ a b Laver KE, Lange B, George S, Deutsch JE, Saposnik G, Crotty M, et al. (Cochrane Stroke Group) (November 2017). “Virtual reality for Stroke rehabilitation“. The Cochrane Database of Systematic Reviews. 11: CD008349. doi:10.1002/14651858.CD008349.pub4. PMC 6485957. PMID 29156493.
- ^ Thieme H, Mehrholz J, Pohl M, Behrens J, Dohle C (January 2013). “Mirror therapy for improving motor function after stroke”. Stroke. 44 (1): e1-2. doi:10.1161/strokeaha.112.673087. PMID 23390640.
- ^ Fregni F, Pascual-Leone A (July 2007). “Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS”. Nature Clinical Practice. Neurology. 3 (7): 383–93. doi:10.1038/ncpneuro0530. PMID 17611487. S2CID 11365968.
- ^ Balasubramanian S, Klein J, Burdet E (December 2010). “Robot-assisted rehabilitation of hand function”. Current Opinion in Neurology. 23 (6): 661–70. doi:10.1097/WCO.0b013e32833e99a4. PMID 20852421.
- ^ Pollock A, Farmer SE, Brady MC, Langhorne P, Mead GE, Mehrholz J, van Wijck F, et al. (Cochrane Stroke Group) (November 2014). “Interventions for improving upper limb function after stroke”. The Cochrane Database of Systematic Reviews (11): CD010820. doi:10.1002/14651858.CD010820.pub2. PMC 6469541. PMID 25387001.
- ^ Falso M (2017). “How does a Personalized Rehabilitative Model influence the Functional Response of Different Ankle Foot Orthoses in a Cohort of Patients Affected by Neurological Gait Pattern?”. Journal of Novel Physiotherapy and Rehabilitation. 1 (2): 072–092. doi:10.29328/journal.jnpr.1001010. ISSN 2573-6264.
- ^ Bowers R (2004). “Report of a Consensus Conference on the Orthotic Management of Stroke Patients, Non-Articulated Ankle-Foot Ortheses” (PDF). International Society for Prosthetics and Orthotics: 87–94.
- ^ Condie E, Bowers RJ (2008). Hsu JD, Michael JW, Fisk JR (eds.). Lower limb orthoses for persons who have had a stroke. AAOS Atlas of Orthoses and Assistive Devices. Philadelphia: Elsevier Health Sciences. pp. 433–440. ISBN 978-0-323-03931-4.
- ^ Fryer CE, Luker JA, McDonnell MN, Hillier SL (August 2016). “Self management programmes for quality of life in people with stroke”. The Cochrane Database of Systematic Reviews. 2016 (8): CD010442. doi:10.1002/14651858.CD010442.pub2. PMC 6450423. PMID 27545611.
- ^ a b Coffey CE, Cummings JL, Starkstein S, Robinson R (2000). Stroke – the American Psychiatric Press Textbook of Geriatric Neuropsychiatry (Second ed.). Washington DC: American Psychiatric Press. pp. 601–17. ISBN 9780880488419.
- ^ Stanford Hospital & Clinics. “Cardiovascular Diseases: Effects of Stroke”. Archived from the original on 2009-02-10.
- ^ Reith J, Jørgensen HS, Nakayama H, Raaschou HO, Olsen TS (August 1997). “Seizures in acute stroke: predictors and prognostic significance. The Copenhagen Stroke Study”. Stroke. 28 (8): 1585–9. doi:10.1161/01.STR.28.8.1585. PMID 9259753. Archived from the original on 2013-01-12.
- ^ Burn J, Dennis M, Bamford J, Sandercock P, Wade D, Warlow C (December 1997). “Epileptic seizures after a first stroke: the Oxfordshire Community Stroke Project”. BMJ. 315 (7122): 1582–7. doi:10.1136/bmj.315.7122.1582. PMC 2127973. PMID 9437276.
- ^ Heilman KM (2014). “Disorders of emotional communication after stroke”. In Schweizer TA, Macdonald RL (eds.). The behavioral consequences of stroke. New York [u.a.]: Springer. pp. 119–33. doi:10.1007/978-1-4614-7672-6_7. ISBN 978-1-4614-7671-9.
- ^ Ackley B, Ladwig GB, Kelley H (2010). Nursing diagnosis handbook: an evidence-based guide to planning care (9th ed.). Maryland Heights, MO.: Mosby.
- ^ a b Senelick RC, Rossi PW, Dougherty K (1994). Living with Stroke: A Guide for Families. Contemporary Books, Chicago. ISBN 978-0-8092-2607-8. OCLC 40856888.
- ^ Allida S, Cox KL, Hsieh CF, House A, Hackett ML (May 2020). “Pharmacological, psychological and non-invasive brain stimulation interventions for preventing depression after stroke”. The Cochrane Database of Systematic Reviews. 2020 (5): CD003689. doi:10.1002/14651858.CD003689.pub4. PMC 7211517. PMID 32390167.
- ^ a b Allida S, Cox KL, Hsieh CF, Lang H, House A, Hackett ML (January 2020). “Pharmacological, psychological, and non-invasive brain stimulation interventions for treating depression after stroke”. The Cochrane Database of Systematic Reviews. 1: CD003437. doi:10.1002/14651858.CD003437.pub4. PMC 6999797. PMID 31989584.
- ^ a b Villarosa L, Singleton L, Johnson KA (1993). The Black health library guide to stroke. New York: Henry Holt and Co. ISBN 978-0-8050-2289-6. OCLC 26929500.
- ^ Leigh R, Oishi K, Hsu J, Lindquist M, Gottesman RF, Jarso S, et al. (August 2013). “Acute lesions that impair affective empathy”. Brain. 136 (Pt 8): 2539–49. doi:10.1093/brain/awt177. PMC 3722353. PMID 23824490.
- ^ Hamilton RH, Chrysikou EG, Coslett B (July 2011). “Mechanisms of aphasia recovery after stroke and the role of noninvasive brain stimulation”. Brain and Language. 118 (1–2): 40–50. doi:10.1016/j.bandl.2011.02.005. PMC 3109088. PMID 21459427.
- ^ Leys D, Hénon H, Mackowiak-Cordoliani MA, Pasquier F (November 2005). “Poststroke dementia”. The Lancet. Neurology. 4 (11): 752–9. doi:10.1016/S1474-4422(05)70221-0. PMID 16239182. S2CID 1129308.
- ^ Kuźma E, Lourida I, Moore SF, Levine DA, Ukoumunne OC, Llewellyn DJ (November 2018). “Stroke and dementia risk: A systematic review and meta-analysis”. Alzheimer’s & Dementia. 14 (11): 1416–1426. doi:10.1016/j.jalz.2018.06.3061. PMC 6231970. PMID 30177276.
- ^ Coulthard E, Singh-Curry V, Husain M (December 2006). “Treatment of attention deficits in neurological disorders”. Current Opinion in Neurology. 19 (6): 613–8. doi:10.1097/01.wco.0000247605.57567.9a. PMID 17102702. S2CID 24315173.
- ^ Lim C, Alexander MP (December 2009). “Stroke and episodic memory disorders”. Neuropsychologia. 47 (14): 3045–58. doi:10.1016/j.neuropsychologia.2009.08.002. PMID 19666037. S2CID 9056952.
- ^ Murray ED, Buttner N, Price BH (2012). “Depression and Psychosis in Neurological Practice”. In Bradley WG, Daroff RB, Fenichel GM, Jankovic J (eds.). Bradley’s neurology in clinical practice. Vol. 1 (6th ed.). Philadelphia: Elsevier/Saunders. pp. 100–01. ISBN 978-1-4377-0434-1.
- ^ “WHO Disease and injury country estimates”. World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved November 11, 2009.
- ^ “The top 10 causes of death”. WHO. Archived from the original on 2013-12-02.
- ^ “Why South Asians Facts”. Indian Heart Association. Archived from the original on May 18, 2015. Retrieved May 8, 2015.
- ^ Andersen, Klaus Kaae; Olsen, Tom Skyhøj; Dehlendorff, Christian; Kammersgaard, Lars Peter (June 2009). “Hemorrhagic and Ischemic Strokes Compared: Stroke Severity, Mortality, and Risk Factors”. Stroke. 40 (6): 2068–2072. doi:10.1161/STROKEAHA.108.540112. ISSN 0039-2499.
- ^ Towfighi A, Saver JL (August 2011). “Stroke declines from third to fourth leading cause of death in the United States: historical perspective and challenges ahead”. Stroke. 42 (8): 2351–5. doi:10.1161/STROKEAHA.111.621904. PMID 21778445.
- ^ Ellekjaer H, Holmen J, Indredavik B, Terent A (November 1997). “Epidemiology of stroke in Innherred, Norway, 1994 to 1996. Incidence and 30-day case-fatality rate”. Stroke. 28 (11): 2180–4. doi:10.1161/01.STR.28.11.2180. PMID 9368561. Archived from the original on February 28, 2008.
- ^ Bongers TN, de Maat MP, van Goor ML, Bhagwanbali V, van Vliet HH, Gómez García EB, et al. (November 2006). “High von Willebrand factor levels increase the risk of first Ischemic stroke: influence of ADAMTS13, inflammation, and genetic variability”. Stroke. 37 (11): 2672–7. doi:10.1161/01.STR.0000244767.39962.f7. PMID 16990571.
- ^ Ashrafian H (April 2010). “Familial stroke 2700 years ago”. Stroke. 41 (4): e187, author reply e188. doi:10.1161/STROKEAHA.109.573170. PMID 20185778.
- ^ a b Thompson JE (August 1996). “The evolution of surgery for the treatment and prevention of stroke. The Willis Lecture”. Stroke. 27 (8): 1427–34. doi:10.1161/01.STR.27.8.1427. PMID 8711815.
- ^ Kopito J (September 2001). “A Stroke in Time”. MERGINET.com. 6 (9). Archived from the original on 2012-12-08.
- ^ Barnhart RK, ed. (1995). The Barnhart Concise Dictionary of Etymology (1st ed.). New York: HarperCollins Publishers. ISBN 978-0-06-270084-1.
- ^ “Apoplectic Stroke”. TheFreeDictionary.com. Retrieved 13 December 2020.
- ^ Brecht M (1999). Martin Luther: The Preservation of the Church, 1532-1546. Vol. 3. Translated by Schaaf JL. Minneapolis: Fortress Press. pp. 369–79. ISBN 978-0-8006-2815-4.
- ^ Schiller F (April 1970). “Concepts of stroke before and after Virchow”. Medical History. 14 (2): 115–31. doi:10.1017/S0025727300015325. PMC 1034034. PMID 4914683.
- ^ Finger S, Boller F, Tyler KL (2010). Handbook of Clinical Neurology. North-Holland Publishing Company. p. 401. ISBN 978-0-444-52009-8. Archived from the original on 12 October 2013. Retrieved 1 October 2013.
- ^ Scadding JW (2011). Clinical Neurology. CRC Press. p. 488. ISBN 978-0-340-99070-4. Archived from the original on 12 October 2013. Retrieved 1 October 2013.
- ^ Sirven JI, Malamut BL (2008). Clinical Neurology of the Older Adult. Lippincott Williams & Wilkins. p. 243. ISBN 978-0-7817-6947-1. Archived from the original on 12 October 2013. Retrieved 1 October 2013.
- ^ Kaufman DM, Milstein MJ (5 December 2012). Kaufman’s Clinical Neurology for Psychiatrists. Elsevier Health Sciences. p. 892. ISBN 978-1-4557-4004-8. Archived from the original on 12 October 2013. Retrieved 1 October 2013.
- ^ a b Mosby’s Medical Dictionary, 8th edition. Elsevier. 2009.
- ^ “What is a Stroke/Brain Attack?” (PDF). National Stroke Association. Archived (PDF) from the original on 19 October 2013. Retrieved 27 February 2014.
- ^ Segen’s Medical Dictionary. Farlex, Inc. 2010.
- ^ Morris DR, Ayabe K, Inoue T, Sakai N, Bulbulia R, Halliday A, Goto S (April 2017). “Evidence-Based Carotid Interventions for Stroke Prevention: State-of-the-art Review”. Journal of Atherosclerosis and Thrombosis. 24 (4): 373–387. doi:10.5551/jat.38745. PMC 5392474. PMID 28260723.
Further reading
- Mohr JP, Choi D, Grotta J, Wolf P (2004). Stroke: Pathophysiology, Diagnosis, and Management. New York: Churchill Livingstone. ISBN 978-0-443-06600-9. OCLC 50477349.
- Warlow CP, van Gijn J, Dennis MS, Wardlaw JM, Bamford JM, Hankey GJ, Sandercock PA, Rinkel G, Langhorne P, Sudlow C, Rothwell P (2008). Accident vasculaire cérébral: Gestion pratique (3e éd.). Wiley-Blackwell. ISBN 978-1-4051-2766-0.
Liens externes
| Wikimedia Commons a des médias liés à l’ AVC . |
- AVC chez Curlie
- Score DRAGON pour la post-thrombolyse
- Score THRIVE pour l’issue de l’AVC
- Institut national des troubles neurologiques et des accidents vasculaires cérébraux
