Canal de potentiel récepteur transitoire
Les canaux potentiels des récepteurs transitoires ( canaux TRP ) sont un groupe de canaux ioniques situés principalement sur la membrane plasmique de nombreux types de cellules animales. La plupart d’entre eux sont regroupés en deux grands groupes : le groupe 1 comprend TRPC (« C » pour canonique), TRPV (« V » pour vanilloïde), TRPVL (« VL » pour vanilloïde-like), TRPM (« M » pour mélastatine) , TRPS (“S” pour soromélastine), TRPN (“N” pour aucun potentiel de mécanorécepteur C) et TRPA (“A” pour ankyrine). Le groupe 2 est composé de TRPP (“P”[1] [2] D’autres canaux TRP moins bien classés existent, y compris les canaux de levure et un certain nombre de canaux du groupe 1 et du groupe 2 présents chez les non-animaux. [2] [3] [4] Beaucoup de ces canaux transmettent une variété de sensations telles que la douleur, la température, différents types de goûts, la pression et la vision. Dans le corps, on pense que certains canaux TRP se comportent comme des thermomètres microscopiques et sont utilisés chez les animaux pour détecter le chaud ou le froid. [5] Certains canaux TRP sont activés par des molécules présentes dans les épices comme l’ail ( allicine ), le piment ( capsaïcine ), le wasabi ( isothiocyanate d’allyle ) ; d’autres sont activés par le menthol , le camphre, menthe poivrée et agents rafraîchissants ; d’autres encore sont activés par des molécules présentes dans le cannabis (c’est-à-dire le THC , le CBD et le CBN ) ou la stévia . Certains agissent comme des capteurs de pression osmotique, de volume, d’étirement et de vibration. La plupart des canaux sont activés ou inhibés par les lipides de signalisation et contribuent à une famille de canaux ioniques dépendants des lipides . [6] [7]
| Canal ionique à potentiel de récepteur transitoire (TRP) | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| Symbole | TRP | ||||||
| Pfam | PF06011 | ||||||
| InterPro | IPR013555 | ||||||
| Superfamille OPM | 8 | ||||||
| Protéine OPM | 3j5p | ||||||
| Membranome | 605 | ||||||
|
Ces canaux ioniques ont une perméabilité relativement non sélective aux cations , dont le sodium , le calcium et le magnésium .
Les canaux TRP ont été initialement découverts dans la souche mutante dite « à potentiel de récepteur transitoire » ( trp -mutant) de la mouche des fruits Drosophila , d’où leur nom (voir Histoire des canaux TRP de Drosophila ci-dessous). Plus tard, les canaux TRP ont été trouvés chez les Vertébrés où ils sont exprimés de manière omniprésente dans de nombreux types de cellules et tissus. La plupart des canaux TRP sont composés de 6 hélices traversant la membrane avec des terminaisons N et C intracellulaires . Les canaux TRP des mammifères sont activés et régulés par une grande variété de stimuli et sont exprimés dans tout le corps.
Familles
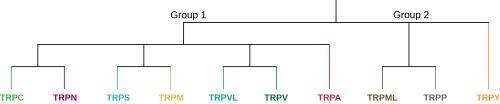
 Groupes et familles de canaux TRP.
Groupes et familles de canaux TRP.
Dans la superfamille TRP animale, il existe actuellement 9 familles proposées divisées en deux groupes, chaque famille contenant un certain nombre de sous-familles. [2]Le groupe un comprend TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS et TRPN, tandis que le groupe deux contient TRPP et TRPML. Il existe une famille supplémentaire appelée TRPY qui n’est pas toujours incluse dans l’un ou l’autre de ces groupes. Toutes ces sous-familles sont similaires en ce qu’elles sont des canaux cationiques non sélectifs à détection moléculaire qui ont six segments transmembranaires, cependant, chaque sous-famille est très unique et partage peu d’homologie structurelle les unes avec les autres. Cette unicité donne lieu aux diverses fonctions de perception sensorielle et de régulation que les canaux TRP ont dans tout le corps. Le groupe un et le groupe deux varient en ce que TRPP et TRPML du groupe deux ont une boucle extracellulaire beaucoup plus longue entre les segments transmembranaires S1 et S2. Une autre caractéristique différenciatrice est que toutes les sous-familles du groupe un contiennent soit un C-terminal,[8] Vous trouverez ci-dessous les membres des sous-familles et une brève description de chacune :
APTR
| Famille | Sous-famille | Taxons connus [9] [10] [11] |
|---|---|---|
| APTR | TRPA1 | Vertébrés , Arthropodes et Mollusques |
| De type TRPA | Choanoflagellés , Cnidaires , Nématodes , Arthropodes (uniquement crustacés et myriapodes), Mollusques et Échinodermes | |
| TRPA5 | Arthropodes (uniquement crustacés et insectes) | |
| sans douleur | ||
| pyrexie | ||
| sorcier | ||
| HsTRPA | Spécifique aux insectes hyménoptères |
TRPA, A pour “ankyrine”, est nommé pour la grande quantité de répétitions d’ankyrine trouvées près de l’extrémité N-terminale. [12] Le TRPA se trouve principalement dans les fibres nerveuses nociceptives afférentes et est associé à l’amplification de la signalisation de la douleur ainsi qu’à l’hypersensibilité à la douleur froide. Il a été démontré que ces canaux sont à la fois des récepteurs mécaniques de la douleur et des chimiocapteurs activés par diverses espèces chimiques, notamment les isothiocyanates (produits chimiques piquants contenus dans des substances telles que l’huile de moutarde et le wasabi), les cannabinoïdes, les analgésiques généraux et locaux et le cinnamaldéhyde. [13]
Alors que TRPA1 est exprimé chez une grande variété d’animaux, une variété d’autres canaux TRPA existent en dehors des Vertébrés. TRPA5, indolore, pyrexie et waterwitch sont des branches phylogénétiques distinctes au sein du clade TRPA et ne sont exprimées que chez les crustacés et les insectes, tandis que HsTRPA est apparu comme une duplication de waterwitch spécifique aux hyménoptères. [14] Comme TRPA1 et d’autres canaux TRP, ceux-ci fonctionnent comme des canaux ioniques dans un certain nombre de systèmes sensoriels. Les canaux de type TRPA ou TRPA1 existent également dans une variété d’espèces en tant que clade phylogénétiquement distinct, mais ils sont moins bien compris. [dix]
TRPC
| Famille | Sous-famille | Taxons connus [11] [15] [16] |
|---|---|---|
| TRPC | TRPC1 | Vertébrés |
| TRPC2 | ||
| TRPC3 | ||
| TRPC4 | ||
| TRPC5 | ||
| TRPC6 | ||
| TRPC7 | ||
| TRP | Arthropodes | |
| TRPgamma | ||
| TRPL | ||
| Inconnue | Choanoflagellés, Cnidaires, xénacoélomorphes , lophotrochozoaires et Nématodes |
TRPC, C pour “canonique”, est nommé pour être le plus étroitement lié à Drosophila TRP, l’homonyme des canaux TRP. La phylogénie des canaux TRPC n’a pas été résolue en détail, mais ils sont présents dans tous les taxons animaux. Il n’y a en fait que six canaux TRPC exprimés chez l’homme car TRPC2 s’avère être exprimé uniquement chez la souris et est considéré comme un pseudo-gène chez l’homme; cela est en partie dû au rôle de TRPC2 dans la détection des phéromones, dont les souris ont une capacité accrue par rapport aux humains. Des mutations dans les canaux TRPC ont été associées à des maladies respiratoires ainsi qu’à une glomérulosclérose segmentaire focale dans les reins. [13] Tous les canaux TRPC sont activés soit par la phospholipase C (PLC) soit par le diacyglycérol(DAG).
TRPM
| Famille | Sous-famille | Taxons connus |
|---|---|---|
| TRPM | Alpha/α (y compris TRPM1, 3, 6 et 7) | Choanoflagellés et animaux (sauf Tardigrades ) |
| Bêta/β (y compris TRPM2, 4, 5 et 8) |
La TRPM, M pour « mélastatine », a été retrouvée lors d’une analyse génétique comparative entre les naevus bénins et les naevus malins (mélanome). [12] Des mutations dans les canaux TRPM ont été associées à une hypomagnésémie avec hypocalcémie secondaire. Les canaux TRPM sont également devenus connus pour leurs mécanismes de détection du froid, comme c’est le cas avec TRPM8. [13] Des études comparatives ont montré que les domaines fonctionnels et les acides aminés critiques des canaux TRPM sont hautement conservés à travers les espèces. [17] [10] [18]
La phylogénétique a montré que les canaux TRPM sont divisés en deux clades principaux, αTRPM et βTRPM. [10] [16] Les αTRPM comprennent les Vertébrés TRPM1, TRPM3 et les “chanzymes” TRPM6 et TRPM7, ainsi que le seul canal TRPM des insectes, entre autres. Les βTRPM comprennent, mais sans s’y limiter, les Vertébrés TRPM2, TRPM4, TRPM5 et TRPM8 (le capteur de froid et de menthol). Deux clades majeurs supplémentaires ont été décrits : TRPMc, qui n’est présent que chez une variété d’Arthropodes, [16] et un clade basal, [11] [10] qui a depuis été proposé comme une famille de canaux TRP distincte et séparée (TRPS ). [16]
TRPML
| Famille | Sous-famille | Taxons connus [11] [19] |
|---|---|---|
| TRPML | Inconnue | Cnidaires, Vertébrés basaux, Tuniciers , Céphalochordés , Hémichordés , Échinodermes, Arthropodes et Nématodes |
| TRPML1 | Spécifique aux Vertébrés à mâchoires | |
| TRPML2 | ||
| TRPML3 |
TRPML, ML pour “mucolipine”, tire son nom du trouble neurodéveloppemental mucolipidose IV . La mucolipidose IV a été découverte pour la première fois en 1974 par ER Berman qui a remarqué des anomalies dans les yeux d’un nourrisson. [20] Ces anomalies sont rapidement devenues associées à des mutations du gène MCOLN1 qui code pour le canal ionique TRPML1. TRPML n’est toujours pas hautement caractérisé. Les trois exemplaires Vertébrés connus sont limités aux Vertébrés à mâchoires, à quelques exceptions près (par exemple Xenopus tropicalis ). [19]
TRPN
| Famille | Sous-famille | Taxons connus [21] [11] |
|---|---|---|
| TRPN | TRPN/nompC | Placozoaires, Cnidaires, Nématodes, Arthropodes, Mollusques, Annélides et Vertébrés (à l’exclusion des amniotes) |
TRPN a été décrit à l’origine chez Drosophila melanogaster et Caenorhabditis elegans comme nompC, un canal ionique à déclenchement mécanique. [22] [21] Un seul TRPN, N pour “aucun potentiel de mécanorécepteur C” ou “nompC”, est connu pour être largement exprimé chez les animaux (bien que certains Cnidaires en aient plus), et n’est notamment qu’un pseudogène chez les Vertébrés amniotes . [21] [11] Bien que TRPA soit nommé pour les répétitions d’ankyrine, on pense que les canaux TRPN ont le plus de tous les canaux TRP, généralement autour de 28, qui sont hautement conservés à travers les taxons [21] Depuis sa découverte, DrosophilanompC a été impliqué dans la mécanosensation (y compris la stimulation mécanique de la cuticule et la détection du son) et la nociception froide . [23]
TRPP
| Famille | Sous-famille [11] [24] [25] [2] | Taxons connus [26] [25] |
|---|---|---|
| TRPP | PKD1-like | Animaux (hors Arthropodes) |
| PKD2-like | Animaux | |
| Brividos | Insectes |
TRPP , P pour “polycistine”, est nommé pour la polykystose rénale , qui est associée à ces canaux. [12] Ces canaux sont également appelés canaux ioniques PKD (polycistic kindey disease).
Les gènes de type PKD2 (par exemple, TRPP2 , TRPP3 et TRPP5 ) codent pour les canaux TRP canoniques. Les gènes de type PKD1 codent pour des protéines beaucoup plus grandes avec 11 segments transmembranaires, qui n’ont pas toutes les caractéristiques des autres canaux TRP. Cependant, 6 des segments transmembranaires des protéines de type PKD1 ont une homologie de séquence substantielle avec les canaux TRP, ce qui indique qu’ils peuvent simplement s’être grandement diversifiés à partir d’autres protéines étroitement apparentées. [26]
Les insectes ont une troisième sous-famille de TRPP, appelés brividos, qui participent à la détection du froid. [25] [2]
TRPS
TRPS, S pour Soromelastatin, a été nommé car il forme un groupe frère de TRPM. Le TRPS est largement présent chez les animaux, mais notamment absent chez les Vertébrés et les insectes (entre autres). [16] Le TRPS n’a pas encore été bien décrit fonctionnellement, bien que l’on sache que le TRPS de C. elegans , connu sous le nom de CED-11, est un canal calcique qui participe à l’apoptose . [27]
TRPV
| Famille | Sous-famille | Taxons connus [11] [28] |
|---|---|---|
| TRPV | Nanchung | Placozoaires , Cnidaires, Nématodes, Annélides, Mollusques et Arthropodes (éventuellement à l’exclusion des arachnides ) |
| Inactif | ||
| TRPV1 | Spécifique aux Vertébrés | |
| TRPV2 | ||
| TRPV3 | ||
| TRPV4 | ||
| TRPV5 | ||
| TRPV6 |
Le TRPV, V pour “vanilloïde”, a été découvert à l’origine chez Caenorhabditis elegans et porte le nom des produits chimiques vanilloïdes qui activent certains de ces canaux. [24] [29] Ces canaux ont été rendus célèbres pour leur association avec des molécules telles que la capsaïcine (un agoniste TRPV1). [13] En plus des 6 paralogues de Vertébrés connus, 2 clades majeurs sont connus en dehors des deterostomes : nanchung et Iav. Les études mécanistes de ces derniers clades ont été largement limitées à la drosophile , mais les analyses phylogénétiques ont placé un certain nombre d’autres gènes de Placozoa, Annelida, Cnidaria, Mollusca et d’autres Arthropodes en leur sein. [11] [30] [31]Des canaux TRPV ont également été décrits chez les protistes. [11]
TRPVL
Il a été proposé que TRPVL soit un clade sœur de TRPV et se limite aux Cnidaires Nematostella vectensis et Hydra magnipapillata , et à l’annélide Capitella teleta . [11] On sait peu de choses sur ces chaînes.
TRPY
TRPY, Y pour “levure”, est hautement localisé dans la vacuole de levure, qui est l’équivalent fonctionnel d’un lysosome dans une cellule de mammifère, et agit comme un mécanocapteur pour la pression osmotique vacuolaire. Les techniques de patch-clamp et la stimulation hyperosmotique ont montré que le TRPY joue un rôle dans la libération de calcium intracellulaire. [32] L’analyse phylogénétique a montré que TRPY1 ne fait pas partie des autres groupes métazoaires TRP un et deux, et il est suggéré qu’il a évolué après la divergence des métazoaires et des champignons. [8] D’autres ont indiqué que TRPY sont plus étroitement liés à TRPP. [33]
Structure
Les canaux TRP sont composés de 6 hélices traversant la membrane (S1-S6) avec des terminaisons N et C intracellulaires . Les canaux TRP des mammifères sont activés et régulés par une grande variété de stimuli, y compris de nombreux mécanismes post-transcriptionnels tels que la phosphorylation , le couplage des récepteurs de la protéine G , la synchronisation des ligands et l’ ubiquitination . Les récepteurs se trouvent dans presque tous les types de cellules et sont largement localisés dans les membranes cellulaires et organites, modulant l’entrée des ions.
La plupart des canaux TRP forment des homo- ou hétérotétramères lorsqu’ils sont complètement fonctionnels. Le filtre de sélectivité ionique, pore, est formé par la combinaison complexe de boucles p dans la protéine tétramérique, qui sont situées dans le domaine extracellulaire entre les segments transmembranaires S5 et S6. Comme avec la plupart des canaux cationiques, les canaux TRP ont des résidus chargés négativement dans le pore pour attirer les ions chargés positivement. [34]
Caractéristiques du groupe 1
Chaque canal de ce groupe est structurellement unique, ce qui ajoute à la diversité des fonctions que possèdent les canaux TRP, cependant, il existe des points communs qui distinguent ce groupe des autres. À partir de l’extrémité N-terminale intracellulaire, il existe différentes longueurs de répétitions d’ankryine (sauf dans TRPM) qui facilitent l’ancrage membranaire et d’autres interactions protéiques. Peu de temps après S6 à l’extrémité C-terminale, il existe un domaine TRP hautement conservé (sauf dans TRPA) qui est impliqué dans la modulation de déclenchement et la multimérisation des canaux. D’autres modifications C-terminales telles que les domaines alpha-kinase dans TRPM7 et M8 ont également été observées dans ce groupe. [8] [13] [12]
Caractéristiques du groupe 2
Le trait le plus distinctif du groupe deux est la longue portée extracellulaire entre les segments transmembranaires S1 et S2. Les membres du groupe deux manquent également de répétitions d’ankryine et d’un domaine TRP. Il a cependant été démontré qu’ils ont des séquences de rétention du réticulum endoplasmique (RE) vers l’extrémité C-terminale illustrant les interactions possibles avec le RE. [8] [13] [12]
Une fonction
Les canaux TRP modulent les forces motrices d’entrée des ions et la machinerie de transport du Ca 2+ et du Mg 2+ dans la membrane plasmique, où se trouvent la plupart d’entre eux. Les TRP ont des interactions importantes avec d’autres protéines et forment souvent des complexes de signalisation dont les voies exactes sont inconnues. [35] Les canaux TRP ont été initialement découverts dans la souche mutante trp de la mouche des fruits Drosophila [36] qui présentait une élévation transitoire du potentiel en réponse à des stimuli lumineux et étaient ainsi nommés canaux potentiels de récepteurs transitoires . [37] Les canaux TRPML fonctionnent comme des canaux de libération de calcium intracellulaire et jouent ainsi un rôle important dans la régulation des organelles. [35]Il est important de noter que bon nombre de ces canaux transmettent une variété de sensations telles que les sensations de douleur, de température, de différents types de goûts, de pression et de vision. Dans le corps, on pense que certains canaux TRP se comportent comme des thermomètres microscopiques et sont utilisés chez les animaux pour détecter le chaud ou le froid. Les TRP agissent comme des capteurs de pression osmotique , de volume , d’ étirement et de vibration . On a vu que les TRP avaient des rôles multidimensionnels complexes dans la signalisation sensorielle. De nombreux TRP fonctionnent comme des canaux de libération de calcium intracellulaire.
Sensation de douleur et de température
Les canaux ioniques TRP convertissent l’énergie en potentiels d’action dans les nocicepteurs somatosensoriels. [38] Les canaux thermo-TRP ont un domaine C-terminal qui est responsable de la thermosensation et ont une région interchangeable spécifique qui leur permet de détecter des stimuli de température liés aux processus de régulation du ligand. [39] Bien que la plupart des canaux TRP soient modulés par les changements de température, certains ont un rôle crucial dans la sensation de température. Il existe au moins 6 canaux Thermo-TRP différents et chacun joue un rôle différent. Par exemple, TRPM8 concerne les mécanismes de détection du froid, TRPV1 et TRPM3 contribuent aux sensations de chaleur et d’inflammation, et TRPA1facilite de nombreuses voies de signalisation telles que la transduction sensorielle, la nociception , l’inflammation et le stress oxydatif . [38]
Goûter
TRPM5 est impliqué dans la signalisation gustative des goûts sucré , amer et umami en modulant la voie du signal dans les cellules réceptrices du goût de type II. [40] TRPM5 est activé par les glycosides sucrés présents dans la plante stévia .
Plusieurs autres canaux TRP jouent un rôle important dans la chimiosensation par le biais de terminaisons nerveuses sensorielles dans la bouche qui sont indépendantes des papilles gustatives. TRPA1 répond à l’huile de moutarde ( isothiocyanate d’allyle ), au wasabi et à la cannelle, TRPA1 et TRPV1 répondent à l’ail ( allicine ), TRPV1 répond au piment ( capsaïcine ), TRPM8 est activé par le menthol , le camphre , la menthe poivrée et les agents de refroidissement ; TRPV2 est activé par des molécules ( THC , CBD et CBN ) présentes dans la marijuana.
Canaux de type TRP dans la vision des insectes

 Figure 1. Canaux TRPL activés par la lumière dans les photorécepteurs Periplaneta americana . A, un courant typique à travers les canaux TRPL a été évoqué par une impulsion de lumière vive de 4 s (barre horizontale). B, une réponse de tension de la membrane photoréceptrice à l’activation induite par la lumière des canaux TRPL, les données de la même cellule sont présentées
Figure 1. Canaux TRPL activés par la lumière dans les photorécepteurs Periplaneta americana . A, un courant typique à travers les canaux TRPL a été évoqué par une impulsion de lumière vive de 4 s (barre horizontale). B, une réponse de tension de la membrane photoréceptrice à l’activation induite par la lumière des canaux TRPL, les données de la même cellule sont présentées
Les mouches des fruits mutantes trp , qui n’ont pas de copie fonctionnelle du gène trp, sont caractérisées par une réponse transitoire à la lumière, contrairement aux mouches de type sauvage qui démontrent une activité cellulaire photoréceptrice soutenue en réponse à la lumière. [36] Une isoforme éloignée du canal TRP, le canal de type TRP (TRPL), a ensuite été identifiée dans les photorécepteurs de la drosophile , où elle est exprimée à des niveaux environ 10 à 20 fois inférieurs à ceux de la protéine TRP. Une mouche mutante, trpl , a ensuite été isolée. Outre les différences structurelles, les canaux TRP et TRPL diffèrent par leur perméabilité cationique et leurs propriétés pharmacologiques.
Les canaux TRP/TRPL sont seuls responsables de la dépolarisation de la membrane plasmique des photorécepteurs d’insectes en réponse à la lumière. Lorsque ces canaux s’ouvrent, ils permettent au sodium et au calcium de pénétrer dans la cellule par le gradient de concentration, ce qui dépolarise la membrane. Les variations d’intensité lumineuse affectent le nombre total de canaux TRP/TRPL ouverts et, par conséquent, le degré de dépolarisation membranaire. Ces réponses de tension graduées se propagent aux synapses des photorécepteurs avec les neurones rétiniens de second ordre et plus loin vers le cerveau.
Il est important de noter que le mécanisme de photoréception des insectes est radicalement différent de celui des mammifères. L’excitation de la rhodopsine dans les photorécepteurs de mammifères conduit à l’hyperpolarisation de la membrane réceptrice mais pas à la dépolarisation comme dans l’œil de l’insecte. Chez la drosophile et, il est présumé, d’autres insectes, une cascade de signalisation médiée par la phospholipase C (PLC) relie la photoexcitation de la rhodopsine à l’ouverture des canaux TRP/TRPL. Bien que de nombreux activateurs de ces canaux comme le phosphatidylinositol-4,5-bisphosphate (PIP 2) et les acides gras polyinsaturés (AGPI) étaient connus depuis des années, un facteur clé dans le couplage chimique entre les canaux PLC et TRP/TRPL est resté un mystère jusqu’à récemment. Il a été constaté que la dégradation d’un produit lipidique de la cascade PLC, le diacylglycérol (DAG), par l’enzyme diacylglycérol lipase , génère des AGPI qui peuvent activer les canaux TRP, initiant ainsi la dépolarisation membranaire en réponse à la lumière. [41] Ce mécanisme d’activation du canal TRP peut être bien préservé parmi d’autres types de cellules où ces canaux remplissent diverses fonctions.
Signification clinique
Des mutations dans les TRP ont été liées à des troubles neurodégénératifs , à une dysplasie squelettique , à des troubles rénaux [35] et peuvent jouer un rôle important dans le cancer. Les TRP peuvent constituer des cibles thérapeutiques importantes. Il y a une signification clinique significative au rôle de TRPV1, TRPV2, TRPV3 et TRPM8 en tant que thermorécepteurs, et au rôle de TRPV4 et TRPA1 en tant que mécanorécepteurs ; la réduction de la douleur chronique peut être possible en ciblant les canaux ioniques impliqués dans la sensation thermique, chimique et mécanique pour réduire leur sensibilité aux stimuli. [42] Par exemple, l’utilisation d’agonistes de TRPV1 inhiberait potentiellement la nociception à TRPV1, en particulier dans le tissu pancréatique où TRPV1 est fortement exprimé. [43]La capsaïcine agoniste TRPV1, présente dans les piments, a été indiquée pour soulager la douleur neuropathique. [35] Les agonistes de TRPV1 inhibent la nociception à TRPV1
Rôle dans le cancer
L’expression altérée des protéines TRP conduit souvent à la tumorigenèse , comme indiqué pour TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 et TRPM8. [43] TRPV1 et TRPV2 ont été impliqués dans le cancer du sein. L’expression de TRPV1 dans les agrégats trouvés au niveau du réticulum endoplasmique ou de l’appareil de Golgi et/ou entourant ces structures chez les patientes atteintes d’un cancer du sein confère une survie plus faible. [44] TRPV2 est un biomarqueur potentiel et une cible thérapeutique dans le cancer du sein triple négatif. [ citation nécessaire ] La famille de canaux ioniques TRPM est particulièrement associée au cancer de la prostate où TRPM2 (et son long ARN non codant TRPM2-AS), TRPM4 et TRPM8 sont surexprimés dans le cancer de la prostate associés à des résultats plus agressifs. [45] Il a été démontré que TRPM3 favorise la croissance et l’ autophagie dans le carcinome à cellules claires du rein, [46] TRPM4 est surexprimé dans le lymphome diffus à grandes cellules B associé à une survie plus faible, [47] tandis que TRPM5 a des propriétés oncogènes dans le mélanome . [48]
Rôle dans les réponses inflammatoires
En plus des voies médiées par TLR4 , certains membres de la famille des canaux ioniques potentiels des récepteurs transitoires reconnaissent le LPS . L’activation médiée par le LPS de TRPA1 a été montrée chez la souris [49] et les mouches Drosophila melanogaster . [50] À des concentrations plus élevées, le LPS active également d’autres membres de la famille des canaux TRP sensoriels, tels que TRPV1, TRPM3 et, dans une certaine mesure, TRPM8. [51] Le LPS est reconnu par TRPV4 sur les cellules épithéliales. L’activation de TRPV4 par le LPS était nécessaire et suffisante pour induire la production d’oxyde nitrique avec un effet bactéricide. [52]
Histoire des canaux TRP de la drosophile
Le mutant TRP original chez la drosophile a été décrit pour la première fois par Cosens et Manning en 1969 comme “une souche mutante de D. melanogaster qui, bien qu’elle se comporte phototactiquement positive dans un labyrinthe en T sous une faible lumière ambiante, est malvoyante et se comporte comme si elle était aveugle” . Il a également montré une réponse électrorétinographique anormale des photorécepteurs à la lumière qui était transitoire plutôt que soutenue comme dans le “type sauvage”. [36] Il a été étudié par la suite par Baruch Minke, un post-doc dans le groupe de William Pak, et nommé TRP selon son comportement à l’ERG. [53]L’identité de la protéine mutée était inconnue jusqu’à ce qu’elle soit clonée par Craig Montell, un chercheur post-doctoral dans le groupe de recherche de Gerald Rubin, en 1989, qui a noté sa relation structurelle prédite avec les canaux connus à l’époque [37] et Roger Hardie et Baruch Minke qui a fourni la preuve en 1992 qu’il s’agit d’un canal ionique qui s’ouvre en réponse à une stimulation lumineuse. [54] Le canal TRPL a été cloné et caractérisé en 1992 par le groupe de recherche de Leonard Kelly. [55]
Voir également
- Système endocannabinoïde
- Base de données de protéines interagissant avec les canaux potentiels des récepteurs transitoires (2010)
Références
- ^ Islam MS, éd. (janvier 2011). Canaux potentiels des récepteurs transitoires . Les progrès de la médecine expérimentale et de la biologie. Vol. 704. Berlin : Springer. p. 700. ISBN 978-94-007-0264-6.
- ^ un bcde Himmel NJ , Cox DN (août 2020). “Canaux potentiels des récepteurs transitoires : perspectives actuelles sur l’évolution, la structure, la fonction et la nomenclature” . Procédure. Sciences Biologiques . 287 (1933) : 20201309. doi : 10.1098/rspb.2020.1309 . PMC 7482286 . PMID 32842926 .
- ^ Arias-Darraz L, Cabezas D, Colenso CK, Alegría-Arcos M, Bravo-Moraga F, Varas-Concha I, et al. (janvier 2015). “Un canal ionique potentiel de récepteur transitoire chez Chlamydomonas partage des caractéristiques clés avec les canaux TRP associés à la transduction sensorielle chez les mammifères” . La cellule végétale . 27 (1): 177-188. doi : 10.1105/tpc.114.131862 . PMC 4330573 . PMID 25595824 .
- ^ Lindström JB, Pierce NT, Latz MI (octobre 2017). “Rôle des canaux TRP dans la mécanotransduction des dinoflagellés”. Le Bulletin Biologique . 233 (2): 151–167. doi : 10.1086/695421 . PMID 29373067 . S2CID 3388001 .
- ^ Vriens J, Nilius B, Voets T (septembre 2014). “Thermosensation périphérique chez les mammifères”. Revues naturelles. Neurosciences . 15 (9): 573–89. doi : 10.1038/nrn3784 . PMID 25053448 . S2CID 27149948 .
- ^ Robinson CV, Rohacs T, Hansen SB (septembre 2019). “Outils pour comprendre la régulation lipidique à l’échelle nanométrique des canaux ioniques” . Tendances en sciences biochimiques . 44 (9): 795–806. doi : 10.1016/j.tibs.2019.04.001 . PMC 6729126 . PMID 31060927 .
- ^ Hansen SB (mai 2015). “Agonisme lipidique : le paradigme PIP2 des canaux ioniques ligand-dépendants” . Biochimica et Biophysica Acta (BBA) – Biologie Moléculaire et Cellulaire des Lipides . 1851 (5) : 620–8. doi : 10.1016/j.bbalip.2015.01.011 . PMC 4540326 . PMID 25633344 .
- ^ un bcde Kadowaki T (octobre 2015) . “Dynamique évolutive des canaux TRP métazoaires”. Archives Pflügers . 467 (10): 2043–53. doi : 10.1007/s00424-015-1705-5 . PMID 25823501 . S2CID 9190224 .
- ^ Kang K, Pulver SR, Panzano VC, Chang EC, Griffith LC, Theobald DL, Garrity PA (mars 2010). “L’analyse de Drosophila TRPA1 révèle une origine ancienne pour la nociception chimique humaine” . Nature . 464 (7288): 597–600. Bibcode : 2010Natur.464..597K . doi : 10.1038/nature08848 . PMC 2845738 . PMID 20237474 .
- ^ un bcd e Himmel NJ , Letcher JM, Sakurai A, Gray TR, Benson MN, Cox DN (novembre 2019). ” La sensibilité au menthol de la drosophile et les origines précambriennes de la chimiosensation dépendante du potentiel des récepteurs transitoires” . Transactions philosophiques de la Royal Society de Londres. Série B, Sciences biologiques . 374 (1785) : 20190369. doi : 10.1098/rstb.2019.0369 . PMC 6790378 . PMID 31544603 .
- ^ un bcdefghijk Peng G , Shi X , Kadowaki T ( mars 2015 ). “L’évolution des canaux TRP déduite de leur classification dans diverses espèces animales”. Phylogénétique moléculaire et évolution . 84 : 145–57. doi : 10.1016/j.ympev.2014.06.016 . PMID 24981559 .
- ^ un bcde Moran MM, McAlexander MA, Bíró T, Szallasi A (août 2011). “Canaux potentiels de récepteurs transitoires comme cibles thérapeutiques”. Revues naturelles. Découverte de médicaments . 10 (8): 601–20. doi : 10.1038/nrd3456 . PMID 21804597 . S2CID 8809131 .
- ^ un bcdef Szallasi A ( 2015-04-09 ). Les canaux TRP comme cibles thérapeutiques : de la science fondamentale à l’utilisation clinique . Szallasi, Arpad, 1958-, McAlexander, M. Allen. Amsterdam, Pays-Bas]. ISBN 9780124200791. OCLC 912315205 .
- ^ Kohno K, Sokabe T, Tominaga M, Kadowaki T (septembre 2010). “Le capteur thermique/chimique des abeilles, AmHsTRPA, révèle la néofonctionnalisation et la perte des gènes des canaux potentiels des récepteurs transitoires” . Le Journal des neurosciences . 30 (37): 12219–29. doi : 10.1523/JNEUROSCI.2001-10.2010 . PMC 6633439 . PMID 20844118 .
- ^ AS français, Meisner S, Liu H, Weckström M, Torkkeli PH (2015). “L’analyse du transcriptome et l’interférence ARN de la phototransduction des cafards indiquent trois opsines et suggèrent un rôle majeur pour les canaux TRPL” . Frontières en physiologie . 6 : 207. doi : 10.3389/fphys.2015.00207 . PMC 4513288 . PMID 26257659 .
- ^ un bcd e Himmel NJ , Gray TR, Cox DN (juillet 2020). “La phylogénétique identifie deux clades de TRPM eumétazoaires et une huitième famille de TRP, TRP Soromelastatin (TRPS)” . Biologie moléculaire et évolution . 37 (7): 2034-2044. doi : 10.1093/molbev/msaa065 . PMC 7306681 . PMID 32159767 .
- ^ Mederos et Schnitzler M, Wäring J, Gudermann T, Chubanov V (mai 2008). “Déterminants évolutifs de la sélectivité calcique divergente des canaux TRPM”. Revue FASEB . 22 (5) : 1540–1551. doi : 10.1096/fj.07-9694com . PMID 18073331 . S2CID 25474094 .
- ^ Iordanov I, Tóth B, Szollosi A, Csanády L (avril 2019). “L’activité enzymatique et la stabilité du filtre de sélectivité des anciens canaux TRPM2 ont été simultanément perdues chez les premiers Vertébrés” . eLife . 8 . doi : 10.7554/eLife.44556 . PMC 6461439 . PMID 30938679 .
- ^ un b García-Añoveros J, Wiwatpanit T (2014). “Évolution de TRPML2 et de mucolipine”. Manuel de pharmacologie expérimentale . 222 : 647–58. doi : 10.1007/978-3-642-54215-2_25 . ISBN 978-3-642-54214-5. PMID 24756724 .
- ^ Berman ER, Livni N, Shapira E, Merin S, Levij IS (avril 1974). « Opacification cornéenne congénitale avec des corps de stockage systémiques anormaux : une nouvelle variante de la mucolipidose ». Le Journal de pédiatrie . 84 (4): 519–26. doi : 10.1016/s0022-3476(74)80671-2 . PMID 4365943 .
- ^ un bcd Schüler A, Schmitz G, Reft A, Özbek S, Thurm U, Bornberg-Bauer E (juin 2015). “L’ascension et la chute de TRP-N, une ancienne famille de canaux ioniques mécanogénés, à Metazoa” . Biologie et évolution du génome . 7 (6): 1713–27. doi : 10.1093/gbe/evv091 . PMC 4494053 . PMID 26100409 .
- ^ Walker RG, Willingham AT, Zuker CS (mars 2000). “Un canal de transduction mécanosensorielle de Drosophila”. Sciences . 287 (5461): 2229–34. Bibcode : 2000Sci…287.2229W . doi : 10.1126/science.287.5461.2229 . PMID 10744543 .
- ^ Himmel N, Patel A, Cox D (mars 2017). “Nociception des invertébrés”. L’Encyclopédie de recherche d’Oxford sur les neurosciences . doi : 10.1093/acrefore/9780190264086.013.166 . ISBN 9780190264086.
- ^ un b Montell C (juillet 2001). “Physiologie, phylogénie et fonctions de la superfamille TRP des canaux cationiques”. STKE de la science . 2001 (90) : re1. doi : 10.1126/stke.2001.90.re1 . PMID 11752662 . S2CID 37074808 .
- ^ un bc Gallio M, Ofstad TA, Macpherson LJ, Wang JW, Zuker CS (février 2011). « Le codage de la température dans le cerveau de la drosophile » . Cellule . 144 (4): 614–624. doi : 10.1016/j.cell.2011.01.028 . PMC 3336488 . PMID 21335241 .
- ^ un b Bezares-Calderón LA, Berger J, Jasek S, Verasztó C, Mendes S, Gühmann M, et al. (décembre 2018). “Circuit neuronal d’une réponse de sursaut hydrodynamique médiée par la polycystine pour éviter les prédateurs” . eLife . 7 . doi : 10.7554/eLife.36262 . PMC 6294549 . PMID 30547885 .
- ^ Driscoll K, Stanfield GM, Droste R, Horvitz HR (août 2017). “Le canal TRP présomptif CED-11 favorise la diminution du volume cellulaire et facilite la dégradation des cellules apoptotiques chez Caenorhabditis elegans ” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 114 (33): 8806–8811. doi : 10.1073/pnas.1705084114 . PMC 5565440 . PMID 28760991 .
- ^ Cattaneo AM, Bengtsson JM, Montagné N, Jacquin-Joly E, Rota-Stabelli O, Salvagnin U, et al. (2016). “TRPA5, un canal TRP d’insectes de la sous-famille Ankyrin, est exprimé dans les antennes de Cydia pomonella (Lepidoptera : Tortricidae) dans plusieurs variantes d’épissage” . Journal de la science des insectes . 16 (1): 83. doi : 10.1093/jisesa/iew072 . PMC 5026476 . PMID 27638948 .
- ^ Colbert HA, Smith TL, Bargmann CI (novembre 1997). “OSM-9, une nouvelle protéine présentant une similitude structurelle avec les canaux, est nécessaire pour l’olfaction, la mécanosensation et l’adaptation olfactive chez Caenorhabditis elegans” . Le Journal des neurosciences . 17 (21): 8259–69. doi : 10.1523/JNEUROSCI.17-21-08259.1997 . PMC 6573730 . PMID 9334401 .
- ^ Gong Z, Fils W, Chung YD, Kim J, Shin DW, McClung CA, et al. (octobre 2004). “Deux sous-unités de canaux TRPV interdépendantes, inactives et Nanchung, médiatisent l’audition chez la drosophile” . Le Journal des neurosciences . 24 (41): 9059–66. doi : 10.1523/JNEUROSCI.1645-04.2004 . PMC 6730075 . PMID 15483124 .
- ^ Kim J, Chung YD, Park DY, Choi S, Shin DW, Soh H, et al. (juillet 2003). “Un canal ionique de la famille TRPV requis pour entendre chez la drosophile”. Nature . 424 (6944): 81–4. Bibcode : 2003Natur.424…81K . doi : 10.1038/nature01733 . PMID 12819662 . S2CID 4426696 .
- ^ Dong XP, Wang X, Xu H (avril 2010). “Canaux TRP des membranes intracellulaires” . Journal de neurochimie . 113 (2): 313–328. doi : 10.1111/j.1471-4159.2010.06626.x . PMC 2905631 . PMID 20132470 .
- ^ Palovcak E, Delemotte L, Klein ML, Carnevale V (juillet 2015). “L’analyse comparative des séquences suggère un mécanisme de déclenchement conservé pour les canaux TRP” . Le Journal de physiologie générale . 146 (1): 37-50. doi : 10.1085/jgp.201411329 . PMC 4485022 . PMID 26078053 .
- ^ Hille B (2001). Canaux ioniques des membranes excitables (3e éd.). Sunderland, Massachusetts : Sinauer. ISBN 978-0878933211. OCLC 46858498 .
- ^ un bcd Winston KR , Lutz W (mars 1988). “Accélérateur linéaire comme outil neurochirurgical pour la radiochirurgie stéréotaxique”. Neurochirurgie . 22 (3): 454–64. doi : 10.1097/00006123-198803000-00002 . PMID 3129667 .
- ^ un bcCosens DJ , Manning A (octobre 1969). “Électrorétinogramme anormal d’un mutant de drosophile”. Nature . 224 (5216) : 285–7. Bibcode : 1969Natur.224..285C . doi : 10.1038/224285a0 . PMID 5344615 . S2CID 4200329 .
- ^ un b Montell C, Rubin GM (avril 1989). “Caractérisation moléculaire du locus trp de Drosophila: une protéine membranaire intégrale putative requise pour la phototransduction”. Neurone . 2 (4): 1313–23. doi : 10.1016/0896-6273(89)90069-x . PMID 2516726 . S2CID 8908180 .
- ^ un b Eccles R (1989). “Physiologie nasale et maladie en référence à l’asthme”. Agents et Actions. Suppléments . 28 : 249–61. PMID 2683630 .
- ^ Brauchi S, Orta G, Salazar M, Rosenmann E, Latorre R (mai 2006). “Un récepteur froid à détection de chaleur : le domaine C-terminal détermine la thermosensation dans les canaux potentiels des récepteurs transitoires” . Le Journal des neurosciences . 26 (18): 4835–40. doi : 10.1523/JNEUROSCI.5080-05.2006 . PMC 6674176 . PMID 16672657 .
- ^ Philippaert K, Pironet A, Mesuere M, Sones W, Vermeiren L, Kerselaers S, et al. (mars 2017). “Les glycosides de stéviol améliorent la fonction des cellules bêta pancréatiques et la sensation gustative en potentialisant l’activité du canal TRPM5” . Communication Nature . 8 : 14733. Bibcode : 2017NatCo…814733P . doi : 10.1038/ncomms14733 . PMC 5380970 . PMID 28361903 .
- ^ Leung HT, Tseng-Crank J, Kim E, Mahapatra C, Shino S, Zhou Y, et al. (juin 2008). “L’activité de la lipase DAG est nécessaire à la régulation du canal TRP dans les photorécepteurs de la drosophile” . Neurone . 58 (6): 884–96. doi : 10.1016/j.neuron.2008.05.001 . PMC 2459341 . PMID 18579079 .
- ^ Levine JD, Alessandri-Haber N (août 2007). « Canaux TRP : cibles pour le soulagement de la douleur ». Biochimica et Biophysica Acta (BBA) – Base moléculaire de la maladie . 1772 (8) : 989-1003. doi : 10.1016/j.bbadis.2007.01.008 . PMID 17321113 .
- ^ un b Prevarskaya N, Zhang L, Barritt G (août 2007). “Canaux TRP dans le cancer”. Biochimica et Biophysica Acta (BBA) – Base moléculaire de la maladie . 1772 (8) : 937–46. doi : 10.1016/j.bbadis.2007.05.006 . PMID 17616360 .
- ^ Lozano C, Córdova C, Marchant I, Zúñiga R, Ochova P, Ramírez-Barrantes R, et al. (15 octobre 2018). “Le TRPV1 agrégé intracellulaire est associé à une survie plus faible chez les patientes atteintes d’un cancer du sein” . Cancer du sein : cibles et thérapie . 10 : 161–168. doi : 10.2147/BCTT.S170208 . PMC 6197232 . PMID 30410392 .
- ^ Wong KK, Banham AH, Yaacob NS, Nur Husna SM (février 2019). “Les rôles oncogènes des canaux ioniques TRPM dans le cancer” . Tourillon de physiologie cellulaire . 234 (9): 14556–14573. doi : 10.1002/jcp.28168 . PMID 30710353 . S2CID 73432591 .
- ^ Hall DP, Cost NG, Hegde S, Kellner E, Mikhaylova O, Stratton Y, et al. (novembre 2014). “TRPM3 et miR-204 établissent un circuit de régulation qui contrôle l’autophagie oncogène dans le carcinome à cellules claires du rein” . Cellule cancéreuse . 26 (5): 738–53. doi : 10.1016/j.ccell.2014.09.015 . PMC 4269832 . PMID 25517751 .
- ^ Loo SK, Ch’ng ES, Md Salleh MS, Banham AH, Pedersen LM, Møller MB, et al. (juillet 2017). “L’expression de TRPM4 est associée au sous-type de cellule B activé et à une faible survie dans le lymphome diffus à grandes cellules B” . Histopathologie . 71 (1): 98-111. doi : 10.1111/his.13204 . PMID 28248435 . S2CID 4767956 .
- ^ Palmer RK, Atwal K, Bakaj I, Carlucci-Derbyshire S, Buber MT, Cerne R, et al. (Décembre 2010). “L’oxyde de triphénylphosphine est un inhibiteur puissant et sélectif du canal ionique potentiel de récepteur transitoire de la mélastatine-5”. Technologies de dosage et de développement de médicaments . 8 (6): 703–13. doi : 10.1089/adt.2010.0334 . PMID 21158685 .
- ^ Meseguer V, Alpizar YA, Luis E, Tajada S, Denlinger B, Fajardo O, et al. (20 janvier 2014). “Les canaux TRPA1 interviennent dans l’inflammation et la douleur neurogènes aiguës produites par les endotoxines bactériennes” . Communication Nature . 5 : 3125. Bibcode : 2014NatCo…5.3125M . doi : 10.1038/ncomms4125 . PMC 3905718 . PMID 24445575 .
- ^ Soldano A, Alpizar YA, Boonen B, Franco L, López-Requena A, Liu G, et al. (juin 2016). “Évitement à médiation gustative des lipopolysaccharides bactériens via l’activation de TRPA1 chez la drosophile” . eLife . 5 . doi : 10.7554/eLife.13133 . PMC 4907694 . PMID 27296646 .
- ^ Boonen B, Alpizar YA, Sanchez A, López-Requena A, Voets T, Talavera K (juillet 2018). “Effets différentiels du lipopolysaccharide sur les canaux TRP sensoriels de la souris” . Calcium cellulaire . 73 : 72–81. doi : 10.1016/j.ceca.2018.04.004 . PMID 29689522 .
- ^ Alpizar YA, Boonen B, Sanchez A, Jung C, López-Requena A, Naert R, et al. (octobre 2017). “L’activation de TRPV4 déclenche des réponses protectrices aux lipopolysaccharides bactériens dans les cellules épithéliales des voies respiratoires” . Communication Nature . 8 (1): 1059. Bibcode : 2017NatCo…8.1059A . doi : 10.1038/s41467-017-01201-3 . PMC 5651912 . PMID 29057902 .
- ^ Minke B, Wu C, Pak WL (novembre 1975). “Induction du bruit de tension du photorécepteur dans l’obscurité chez le mutant Drosophila”. Nature . 258 (5530) : 84–7. Bibcode : 1975Natur.258…84M . doi : 10.1038/258084a0 . PMID 810728 . S2CID 4206531 .
- ^ Hardie RC, Minke B (avril 1992). “Le gène trp est essentiel pour un canal Ca2 + activé par la lumière dans les photorécepteurs de Drosophila”. Neurone . 8 (4) : 643–651. doi : 10.1016/0896-6273(92)90086-S . PMID 1314617 . S2CID 34820827 .
- ^ Phillips AM, Bull A, Kelly LE (avril 1992). “Identification d’un gène de drosophile codant pour une protéine de liaison à la calmoduline avec une homologie avec le gène de phototransduction trp”. Neurone . 8 (4): 631–642. doi : 10.1016/0896-6273(92)90085-R . PMID 1314616 . S2CID 21130927 .
Liens externes
- Transient+Receptor+Potential+Channels à la US National Library of Medicine Medical Subject Headings (MeSH)
- “Canaux potentiels des récepteurs transitoires” . Base de données IUPHAR des récepteurs et des canaux ioniques . Union internationale de pharmacologie fondamentale et clinique.
- Clapham DE, DeCaen P, Carvacho I, Chaudhuri D, Doerner JF, Julius D, et al. “Canaux potentiels des récepteurs transitoires” . Guide de pharmacologie IUPHAR/BPS.
- “Base de données TRIP” . une base de données organisée manuellement des interactions protéine-protéine pour les canaux TRP de mammifères .
