Néoplasme
Un néoplasme ( / ˈ n iː oʊ p l æ z əm , ˈ n i ə -/ [1] ) est un type de croissance anormale et excessive de tissu . Le processus qui se produit pour former ou produire un néoplasme est appelé néoplasie . La croissance d’un néoplasme n’est pas coordonnée avec celle du tissu environnant normal et persiste à se développer anormalement, même si le déclencheur d’origine est supprimé. [2] [3] [4] Cette croissance anormale forme généralement une masse, alors qu’on peut l’appeler une tumeur . [5]
| Néoplasme | |
|---|---|
| Autres noms | Tumeur, tumeur, carcinocytes |
 |
|
| Spécimen de colectomie contenant une tumeur maligne, à savoir un exemple invasif de cancer colorectal (la tumeur en forme de cratère, rougeâtre et de forme irrégulière) | |
| Spécialité | Oncologie |
| Les symptômes | Morceau |
| Complications | Cancer |
| causes | Radiation , facteur environnemental , certaines infections |
La CIM-10 classe les néoplasmes en quatre groupes principaux : les néoplasmes bénins , les néoplasmes in situ , les Néoplasmes malins et les néoplasmes de comportement incertain ou inconnu. [6] Les Néoplasmes malins sont également connus sous le nom de cancers et sont au centre de l’ oncologie .
Avant la croissance anormale des tissus, comme la néoplasie, les cellules subissent souvent un schéma de croissance anormal, comme la métaplasie ou la dysplasie . [7] Cependant, la métaplasie ou la dysplasie ne progresse pas toujours vers la néoplasie et peut également survenir dans d’autres conditions. [2] Le mot vient du grec ancien νέος- neo ‘nouveau’ et πλάσμα plasma ‘formation, création’.
Les types
Une tumeur peut être bénigne , potentiellement maligne ou maligne ( cancer ). [8]
- Les tumeurs bénignes comprennent les Fibromes utérins , les Ostéophytes et les naevus mélanocytaires (grains de beauté). Elles sont circonscrites et localisées et ne se transforment pas en cancer. [7]
- Les néoplasmes potentiellement malins comprennent le carcinome in situ . Ils sont localisés, n’envahissent pas et ne détruisent pas mais avec le temps, peuvent se transformer en cancer.
- Les Néoplasmes malins sont communément appelés cancers. Ils envahissent et détruisent les tissus environnants, peuvent former des métastases et, s’ils ne sont pas traités ou ne répondent pas au traitement, s’avéreront généralement mortels.
- Le néoplasme secondaire fait référence à toute classe de tumeur cancéreuse qui est soit une ramification métastatique d’une tumeur primaire, soit une tumeur apparemment non apparentée dont la fréquence augmente à la suite de certains traitements anticancéreux tels que la chimiothérapie ou la Radiothérapie .
- Rarement, il peut y avoir un néoplasme métastatique sans site connu du cancer primitif et celui-ci est classé comme un cancer d’origine primaire inconnue .
Clonalité
Les tumeurs néoplasiques sont souvent hétérogènes et contiennent plus d’un type de cellule, mais leur initiation et leur croissance continue dépendent généralement d’une seule population de cellules néoplasiques. Ces cellules sont présumées être clonales – c’est-à-dire qu’elles sont dérivées de la même cellule, [9] et portent toutes la même anomalie génétique ou épigénétique – évidente de clonalité. Pour les néoplasmes lymphoïdes , p . _ _ _ _ _lésions). La démonstration de la clonalité est maintenant considérée comme nécessaire pour identifier une prolifération de cellules lymphoïdes comme néoplasique. [dix]
Il est tentant de définir les néoplasmes comme des proliférations cellulaires clonales mais la démonstration de la clonalité n’est pas toujours possible. Par conséquent, la clonalité n’est pas requise dans la définition de la néoplasie. [ citation nécessaire ]
Tumeur vs tumeur
Le mot tumeur ou tumeur vient du mot latin pour gonflement , qui est l’un des signes cardinaux de l’inflammation. Le mot désignait à l’origine toute forme de gonflement , néoplasique ou non. En anglais moderne, la tumeur est utilisée comme synonyme de néoplasme (une lésion kystique solide ou remplie de liquide qui peut ou non être formée par une croissance anormale de cellules néoplasiques) dont la taille semble agrandie. [11] [12] Certains néoplasmes ne forment pas de tumeur – ceux-ci incluent la leucémie et la plupart des formes de carcinome in situ . La tumeur n’est pas non plus synonyme de cancer .Alors que le cancer est par définition malin, une tumeur peut être bénigne , précancéreuse ou maligne .
Les termes masse et nodule sont souvent utilisés comme synonymes de tumeur . D’une manière générale, cependant, le terme tumeur est utilisé de manière générique, sans référence à la taille physique de la lésion. [2] Plus précisément, le terme masse est souvent utilisé lorsque la lésion a un diamètre maximal d’au moins 20 millimètres (mm) dans sa plus grande direction, tandis que le terme nodule est généralement utilisé lorsque la taille de la lésion est inférieure à 20 mm dans sa plus grande dimension (25,4 mm = 1 pouce). [2]
causes
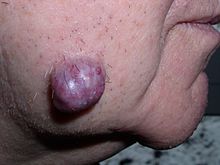
 Tumeur néoplasique de la peau de la joue, ici une tumeur bénigne des Glandes sudoripares appelée hidradénome , qui n’est pas solide mais remplie de liquide
Tumeur néoplasique de la peau de la joue, ici une tumeur bénigne des Glandes sudoripares appelée hidradénome , qui n’est pas solide mais remplie de liquide 
 Schéma illustrant les néoplasmes bénins, à savoir les fibromes de l’ utérus
Schéma illustrant les néoplasmes bénins, à savoir les fibromes de l’ utérus
Les tumeurs chez l’homme surviennent à la suite d’altérations génétiques et épigénétiques accumulées dans des cellules individuelles, qui provoquent la division et l’expansion incontrôlables de la cellule. [13] Un néoplasme peut être causé par une prolifération anormale de tissus, qui peut être causée par des mutations génétiques . Cependant, tous les types de néoplasmes ne provoquent pas une prolifération tumorale de tissu (comme la leucémie ou le carcinome in situ ) et des similitudes entre les croissances néoplasmiques et les processus de régénération, par exemple la dédifférenciation et la prolifération cellulaire rapide, ont été soulignées. [14]
La croissance tumorale a été étudiée à l’aide des mathématiques et de la mécanique du continuum . Les tumeurs vasculaires telles que les hémangiomes et les lymphangiomes (formés de vaisseaux sanguins ou lymphatiques) sont ainsi considérées comme des amalgames d’un squelette solide formé de cellules collantes et d’un liquide organique remplissant les espaces dans lesquels les cellules peuvent se développer. [15] Dans ce type de modèle, les contraintes mécaniques et les contraintes peuvent être traitées et leur influence sur la croissance de la tumeur et des tissus et vaisseaux environnants peut être élucidée. Les découvertes récentes d’expériences qui utilisent ce modèle montrent que la croissance active de la tumeur est limitée aux bords extérieurs de la tumeur et que la raideur du tissu normal sous-jacent inhibe également la croissance tumorale. [16]
Cependant, des conditions bénignes qui ne sont pas associées à une prolifération anormale de tissus (comme les kystes sébacés ) peuvent également se présenter comme des tumeurs, mais n’ont aucun potentiel malin. Les kystes mammaires (comme ceux qui surviennent fréquemment pendant la grossesse et à d’autres moments) sont un autre exemple, tout comme d’autres gonflements glandulaires encapsulés (thyroïde, glande surrénale, pancréas).
Les hématomes encapsulés, les tissus nécrotiques encapsulés (provenant d’une piqûre d’insecte, d’un corps étranger ou d’un autre mécanisme nocif), les chéloïdes (excroissances discrètes de tissu cicatriciel) et les granulomes peuvent également se présenter sous forme de tumeurs.
Des élargissements localisés discrets de structures normales (uretères, vaisseaux sanguins, voies biliaires intrahépatiques ou extrahépatiques, inclusions pulmonaires ou duplications gastro -intestinales ) dus à des obstructions ou des rétrécissements de l’écoulement, ou à des connexions anormales, peuvent également se présenter sous la forme d’une tumeur. Les exemples sont les fistules ou anévrismes artério-veineux (avec ou sans thrombose), les fistules ou anévrismes biliaires, la cholangite sclérosante, la cysticercose ou les kystes hydatiques, les duplications intestinales et les inclusions pulmonaires comme on le voit avec la mucoviscidose. La biopsie peut être dangereuseun certain nombre de types de tumeurs dans lesquelles la fuite de leur contenu serait potentiellement catastrophique. Lorsque de tels types de tumeurs sont rencontrés, des modalités de diagnostic telles que l’échographie, la tomodensitométrie, l’IRM, les angiographies et les analyses de médecine nucléaire sont utilisées avant (ou pendant) la biopsie ou l’exploration/excision chirurgicale dans le but d’éviter de telles complications graves. [ citation nécessaire ]
Néoplasmes malins
Dommages à l’ADN

 Le rôle central des dommages à l’ADN et des défauts épigénétiques dans les gènes de réparation de l’ADN dans les Néoplasmes malins
Le rôle central des dommages à l’ADN et des défauts épigénétiques dans les gènes de réparation de l’ADN dans les Néoplasmes malins
Les dommages à l’ADN sont considérés comme la principale cause sous-jacente des Néoplasmes malins appelés cancers. [17] Son rôle central dans la progression vers le cancer est illustré dans la figure de cette section, dans l’encadré en haut. (Les caractéristiques centrales des dommages à l’ADN, des altérations épigénétiques et de la réparation déficiente de l’ADN dans la progression vers le cancer sont indiquées en rouge.) Les dommages à l’ADN sont très courants. Les dommages naturels à l’ADN (principalement dus au métabolisme cellulaire et aux propriétés de l’ADN dans l’eau à la température du corps) se produisent à un rythme de plus de 60 000 nouveaux dommages, en moyenne, par cellule humaine, par jour [ citation nécessaire ] [voir également l’article ADN dommages (naturels) ]. Des dommages supplémentaires à l’ADN peuvent résulter de l’exposition àagents exogènes . La fumée de tabac provoque une augmentation des dommages exogènes à l’ ADN, et ces dommages à l’ADN sont la cause probable du cancer du poumon dû au tabagisme. [18] La lumière UV du rayonnement solaire cause des dommages à l’ADN qui sont importants dans le mélanome. [19] L’infection à Helicobacter pylori produit des niveaux élevés d’ espèces réactives de l’oxygène qui endommagent l’ADN et contribuent au cancer gastrique. [20] Les acides biliaires , à des niveaux élevés dans le côlon des humains ayant une alimentation riche en graisses, causent également des dommages à l’ADN et contribuent au cancer du côlon. [21]Katsurano et al. ont indiqué que les macrophages et les neutrophiles dans un épithélium colique enflammé sont la source d’espèces réactives de l’oxygène causant les dommages à l’ADN qui initient la tumorigenèse colique. [22] [ source non fiable ? ] Certaines sources de dommages à l’ADN sont indiquées dans les cases en haut de la figure dans cette section.
Les personnes présentant une mutation de la lignée germinale provoquant une déficience de l’un des 34 gènes de réparation de l’ADN (voir l’article Trouble déficitaire de la réparation de l’ADN ) courent un risque accru de cancer . Certaines mutations de la lignée germinale dans les gènes de réparation de l’ADN entraînent jusqu’à 100 % de risque de cancer à vie (par exemple, les mutations p53 ). [23] Ces mutations de la lignée germinale sont indiquées dans un encadré à gauche de la figure avec une flèche indiquant leur contribution au déficit de réparation de l’ADN.
Environ 70 % des Néoplasmes malins n’ont pas de composante héréditaire et sont appelés « cancers sporadiques ». [24] Seule une minorité de cancers sporadiques présentent un déficit de réparation de l’ADN dû à une mutation dans un gène de réparation de l’ADN. Cependant, la majorité des cancers sporadiques présentent un déficit de réparation de l’ADN en raison d’ altérations épigénétiques qui réduisent ou font taire l’expression des gènes de réparation de l’ADN. Par exemple, sur 113 cancers colorectaux séquentiels, seuls quatre présentaient une mutation faux -sens du gène de réparation de l’ADN MGMT , tandis que la majorité présentait une expression réduite de MGMT en raison de la méthylation de la région promotrice de MGMT (une altération épigénétique). [25]Cinq rapports présentent des preuves qu’entre 40 % et 90 % des cancers colorectaux ont réduit l’expression de MGMT en raison de la méthylation de la région promotrice de MGMT. [26] [27] [28] [29] [30]
De même, sur 119 cas de cancers colorectaux déficients en réparation des mésappariements dépourvus d’expression du gène de réparation de l’ADN PMS2, PMS2 était déficient dans 6 cas en raison de mutations du gène PMS2, tandis que dans 103 cas, l’expression de PMS2 était déficiente car son partenaire d’appariement MLH1 était réprimé en raison de à la méthylation du promoteur (la protéine PMS2 est instable en l’absence de MLH1). [31] Dans les 10 autres cas, la perte d’expression de PMS2 était probablement due à une surexpression épigénétique du microARN, miR-155, qui régule à la baisse MLH1. [32]
Dans d’autres exemples, des défauts épigénétiques ont été trouvés à des fréquences comprises entre 13 % et 100 % pour les gènes de réparation de l’ADN BRCA1 , WRN , FANCB , FANCF , MGMT, MLH1 , MSH2 , MSH4 , ERCC1 , XPF , NEIL1 et ATM . Ces défauts épigénétiques sont apparus dans divers cancers (par exemple du sein, de l’ovaire, colorectal et de la tête et du cou). Deux ou trois déficits d’expression de ERCC1, XPF ou PMS2 surviennent simultanément dans la majorité des 49 cancers du côlon évalués par Facista et al. [33]Les altérations épigénétiques provoquant une expression réduite des gènes de réparation de l’ADN sont indiquées dans une boîte centrale au troisième niveau à partir du haut de la figure dans cette section, et le déficit de réparation de l’ADN qui en résulte est indiqué au quatrième niveau.
Lorsque l’expression des gènes de réparation de l’ADN est réduite, les dommages à l’ADN s’accumulent dans les cellules à un niveau supérieur à la normale, et ces dommages excessifs entraînent une augmentation des fréquences de mutation ou d’épimutation. Les taux de mutation augmentent fortement dans les cellules défectueuses en réparation des mésappariements d’ADN [34] [35] ou en réparation par recombinaison homologue (HRR). [36]
Lors de la réparation des cassures double brin de l’ADN ou de la réparation d’autres dommages à l’ADN, des sites de réparation incomplètement dégagés peuvent provoquer un silençage génique épigénétique . [37] [38] Les déficiences de réparation de l’ADN (niveau 4 sur la figure) provoquent une augmentation des dommages à l’ADN (niveau 5 sur la figure) qui entraînent une augmentation des mutations somatiques et des altérations épigénétiques (niveau 6 sur la figure).
Les défauts de champ, des tissus d’apparence normale avec de multiples altérations (et discutés dans la section ci-dessous), sont des précurseurs courants du développement du clone de tissu désordonné et proliférant de manière inappropriée dans un néoplasme malin. De tels défauts de champ (deuxième niveau à partir du bas de la figure) peuvent avoir de multiples mutations et altérations épigénétiques.
Une fois qu’un cancer est formé, il présente généralement une instabilité du génome . Cette instabilité est probablement due à une réparation réduite de l’ADN ou à des dommages excessifs à l’ADN. En raison de cette instabilité, le cancer continue d’évoluer et de produire des sous-clones. Par exemple, un cancer du rein, échantillonné dans 9 zones, avait 40 mutations ubiquitaires, démontrant une hétérogénéité tumorale (c’est-à-dire présente dans toutes les zones du cancer), 59 mutations partagées par certaines (mais pas toutes les zones), et 29 mutations “privées” uniquement présent dans l’une des zones du cancer. [39]
Défauts de champ

 Segment de côlon fraîchement réséqué ouvert longitudinalement montrant un cancer et quatre polypes, plus un diagramme schématique indiquant un défaut de champ probable (une région de tissu qui précède et prédispose au développement du cancer) dans ce segment de côlon. Le diagramme indique les sous-clones et les sous-sous-clones précurseurs des tumeurs.
Segment de côlon fraîchement réséqué ouvert longitudinalement montrant un cancer et quatre polypes, plus un diagramme schématique indiquant un défaut de champ probable (une région de tissu qui précède et prédispose au développement du cancer) dans ce segment de côlon. Le diagramme indique les sous-clones et les sous-sous-clones précurseurs des tumeurs.
Divers autres termes ont été utilisés pour décrire ce phénomène , notamment « effet de champ », « cancérisation de champ » et « carcinogenèse de champ ». Le terme « cancérisation de champ » a été utilisé pour la première fois en 1953 pour décrire une zone ou un « champ » d’épithélium qui a été préconditionné par (à l’époque) des processus largement inconnus afin de le prédisposer au développement du cancer. [40] Depuis lors, les termes “cancerisation de champ” et “défaut de champ” ont été utilisés pour décrire les tissus pré-malignes dans lesquels de nouveaux cancers sont susceptibles d’apparaître. [ citation nécessaire ]
Les anomalies du champ sont importantes dans la progression vers le cancer. [41] [42] Cependant, dans la plupart des recherches sur le cancer, comme l’a souligné Rubin [43] “La grande majorité des études dans la recherche sur le cancer a été réalisée sur des tumeurs bien définies in vivo, ou sur des foyers néoplasiques discrets in vitro. Pourtant, il est prouvé que plus de 80% des mutations somatiques trouvées dans les tumeurs colorectales humaines de phénotype mutateur se produisent avant le début de l’expansion clonale terminale. [44] De même, Vogelstein et al. [45]soulignent que plus de la moitié des mutations somatiques identifiées dans les tumeurs sont survenues dans une phase pré-néoplasique (dans un défaut du champ), lors de la croissance de cellules apparemment normales. De même, des altérations épigénétiques présentes dans les tumeurs peuvent s’être produites dans des défauts de champ pré-néoplasiques. [ citation nécessaire ]
Une vision élargie de l’effet de champ a été appelée « effet de champ étiologique », qui englobe non seulement les changements moléculaires et pathologiques dans les cellules pré-néoplasiques, mais également les influences des facteurs environnementaux exogènes et des changements moléculaires dans le microenvironnement local sur l’évolution néoplasique de l’initiation de la tumeur au patient . la mort. [46]
Dans le côlon, un défaut de terrain survient probablement par sélection naturelle d’une cellule mutante ou épigénétiquement modifiée parmi les cellules souches à la base de l’une des cryptes intestinalessur la face interne du côlon. Une cellule souche mutante ou épigénétiquement modifiée peut remplacer les autres cellules souches voisines par sélection naturelle. Ainsi, un patch de tissu anormal peut apparaître. La figure de cette section comprend une photo d’un segment du côlon fraîchement réséqué et ouvert dans le sens de la longueur montrant un cancer du côlon et quatre polypes. Sous la photo, il y a un diagramme schématique de la façon dont une grande parcelle de cellules mutantes ou épigénétiquement modifiées peut s’être formée, illustrée par la grande zone en jaune dans le diagramme. Dans ce premier grand patch du diagramme (un grand clone de cellules), une seconde mutation ou altération épigénétique de ce type peut se produire de sorte qu’une cellule souche donnée acquiert un avantage par rapport aux autres cellules souches du patch, et cette cellule souche altérée peut se développer formant par clonage un patch secondaire, ou sous-clone, dans le patch d’origine. Ceci est indiqué dans le diagramme par quatre petites taches de couleurs différentes dans la grande zone d’origine jaune. Dans ces nouveaux patchs (sous-clones), le processus peut être répété plusieurs fois, indiqué par les patchs encore plus petits dans les quatre patchs secondaires (avec des couleurs encore différentes dans le diagramme) qui se développent par clonage, jusqu’à ce que des cellules souches apparaissent qui génèrent soit de petits polypes ou bien une tumeur maligne (cancer).[ citation nécessaire ]
Sur la photo, un défaut de champ apparent dans ce segment d’un côlon a généré quatre polypes (étiquetés avec la taille des polypes, 6 mm, 5 mm et deux de 3 mm, et un cancer d’environ 3 cm de diamètre dans sa dimension la plus longue). Ces néoplasmes sont également indiqués, dans le schéma sous la photo, par 4 petits cercles beiges (polypes) et une plus grande zone rouge (cancer). Le cancer sur la photo s’est produit dans la région cæcale du côlon, où le côlon rejoint l’intestin grêle (étiqueté) et où se trouve l’appendice (étiqueté). La graisse sur la photo est externe à la paroi externe du côlon. Dans le segment du côlon illustré ici, le côlon a été coupé dans le sens de la longueur pour exposer la surface interne du côlon et pour afficher le cancer et les polypes se produisant dans la paroi épithéliale interne du côlon. [ citation nécessaire ]
Si le processus général par lequel les cancers du côlon sporadiques apparaissent est la formation d’un clone pré-néoplasique qui se propage par sélection naturelle, suivie de la formation de sous-clones internes dans le clone initial et de sous-sous-clones à l’intérieur de ceux-ci, alors les cancers du côlon doivent généralement être associés et précédés de champs d’anomalies croissantes reflétant la succession d’événements prémalignes. La région d’anomalie la plus étendue (la zone irrégulière jaune la plus à l’extérieur du diagramme) refléterait l’événement le plus précoce dans la formation d’un néoplasme malin. [ citation nécessaire ]
Dans l’évaluation expérimentale des déficiences spécifiques de la réparation de l’ADN dans les cancers, de nombreuses déficiences spécifiques de la réparation de l’ADN se sont également avérées se produire dans les défauts de champ entourant ces cancers. Le tableau ci-dessous donne des exemples pour lesquels le déficit de réparation de l’ADN dans un cancer s’est avéré être causé par une altération épigénétique, et les fréquences quelque peu inférieures avec lesquelles le même déficit de réparation de l’ADN causé épigénétiquement a été trouvé dans le défaut du champ environnant.
| Cancer | Gène | Fréquence dans le cancer | Fréquence dans le défaut de champ | Réf. |
|---|---|---|---|---|
| colorectal | MGMT | 46% | 34% | [26] |
| colorectal | MGMT | 47% | 11% | [28] |
| colorectal | MGMT | 70% | 60% | [47] |
| colorectal | MSH2 | 13% | 5% | [28] |
| colorectal | ERCC1 | 100% | 40% | [33] |
| colorectal | PMS2 | 88% | 50% | [33] |
| colorectal | XPF | 55% | 40% | [33] |
| Tête et Cou | MGMT | 54% | 38% | [48] |
| Tête et Cou | MLH1 | 33% | 25% | [49] |
| Tête et Cou | MLH1 | 31% | 20% | [50] |
| Estomac | MGMT | 88% | 78% | [51] |
| Estomac | MLH1 | 73% | 20% | [52] |
| Œsophage | MLH1 | 77%-100% | 23%-79% | [53] |
Certains des petits polypes dans le défaut de champ montrés sur la photo du segment de côlon ouvert peuvent être des néoplasmes relativement bénins. Parmi les polypes de moins de 10 mm, découverts lors d’une coloscopie et suivis de coloscopies répétées pendant 3 ans, 25 % étaient de taille inchangée, 35 % régressaient ou diminuaient de taille tandis que 40 % augmentaient de taille. [54]
Instabilité du génome
Les cancers sont connus pour présenter une instabilité du génome ou un phénotype mutateur. [55] L’ADN codant pour les protéines dans le noyau représente environ 1,5 % de l’ADN génomique total. [56] Au sein de cet ADN codant pour les protéines (appelé l’ exome ), un cancer moyen du sein ou du côlon peut avoir environ 60 à 70 mutations altérant les protéines, dont environ 3 ou 4 peuvent être des mutations “pilotes”, et les autres peuvent être des mutations « passagères » [45] Cependant, le nombre moyen de mutations de séquences d’ADN dans l’ensemble du génome (y compris les régions non codantes pour les protéines ) dans un échantillon de tissu de cancer du sein est d’environ 20 000. [57] Dans un échantillon moyen de tissu de mélanome (où les mélanomes ont unfréquence de mutation de l’ exome [45] ) le nombre total de mutations de la séquence d’ADN est d’environ 80 000. [58] Cela se compare à la très faible fréquence de mutation d’environ 70 nouvelles mutations dans l’ensemble du génome entre les générations (parent à enfant) chez l’homme. [59] [60]
Les fréquences élevées de mutations dans les séquences nucléotidiques totales au sein des cancers suggèrent que souvent une altération précoce des défauts de champ donnant lieu à un cancer (par exemple, la zone jaune dans le diagramme de cette section) est une déficience de la réparation de l’ADN. Les grands défauts de champ entourant les cancers du côlon (s’étendant jusqu’à environ 10 cm de chaque côté d’un cancer) ont été montrés par Facista et al. [33] présentent fréquemment des défauts épigénétiques dans 2 ou 3 protéines de réparation de l’ADN ( ERCC1 , XPF ou PMS2 ) dans toute la zone du défaut de champ. Les déficiences dans la réparation de l’ADN entraînent une augmentation des taux de mutation. [34] [35] [36] Une déficience dans la réparation de l’ADN, elle-même, peut permettre aux dommages à l’ADN de s’accumuler et à la synthèse de translesion sujette aux erreurspassés certains de ces dommages peuvent donner lieu à des mutations. De plus, une réparation défectueuse de ces dommages accumulés à l’ADN peut donner lieu à des épimutations. Ces nouvelles mutations ou épimutations peuvent fournir un avantage prolifératif, générant un défaut de champ. Bien que les mutations/épimutations dans les gènes de réparation de l’ADN ne confèrent pas en elles-mêmes un avantage sélectif, elles peuvent être transportées en tant que passagers dans les cellules lorsque les cellules acquièrent des mutations/épimutations supplémentaires qui fournissent un avantage prolifératif.
Étymologie
Le terme néoplasme est synonyme de tumeur . La néoplasie désigne le processus de formation de néoplasmes/tumeurs, et le processus est appelé processus néoplasique . Le mot néoplastique lui-même vient du grec néo « nouveau » et plastique « formé, moulé ». [ citation nécessaire ]
Le terme tumeur dérive du nom latin tumor ‘un gonflement’, finalement du verbe tumēre ‘gonfler’. Dans le Commonwealth britannique, l’orthographe tumor est couramment utilisée, alors qu’aux États-Unis, le mot est généralement orthographié tumor . [ citation nécessaire ]
Dans son sens médical, la tumeur a traditionnellement signifié un gonflement anormal de la chair. L’encyclopédiste médical romain Celsus ( vers 30 avant JC-38 après JC) a décrit les quatre signes cardinaux de l’ inflammation aiguë comme tumeur , douleur , calor et Rubor (gonflement, douleur, augmentation de la chaleur et rougeur). (Son traité, De Medicina , fut le premier livre médical imprimé en 1478 suite à l’invention de l’imprimerie à caractères mobiles.)
En anglais contemporain, le mot tumeur est souvent utilisé comme synonyme d’une croissance kystique (remplie de liquide) ou d’un néoplasme solide (cancéreux ou non cancéreux), [61] avec d’autres formes de gonflement souvent appelées « gonflements » . [62]
Des termes apparentés apparaissent couramment dans la littérature médicale, où les noms tuméfaction et tumescence (dérivé de l’adjectif tumescent ), [63] sont des termes médicaux courants pour un gonflement non néoplasique. Ce type de gonflement est le plus souvent causé par une inflammation causée par un traumatisme, une infection et d’autres facteurs.
Cependant, les tumeurs peuvent être causées par des conditions autres qu’une prolifération de cellules néoplasiques. Les kystes (tels que les kystes sébacés) sont également appelés tumeurs, même s’ils ne contiennent pas de cellules néoplasiques. C’est la norme dans la terminologie de la facturation médicale (en particulier lors de la facturation d’une croissance dont la pathologie n’a pas encore été déterminée).
Voir également
-
![icon]()
![icon]() Portail de biologie
Portail de biologie -
![icon]()
![icon]() Portail de la médecine
Portail de la médecine
- Évolution somatique dans le cancer
- Liste des troubles du développement biologique
- Épidémiologie du cancer
- Pléomorphisme
Références
- ^ “Tumeur” . Lexique . Presse universitaire d’Oxford.
- ^ un bcd Birbrair A , Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (juillet 2014). “Les péricytes de type 2 participent à l’angiogenèse normale et tumorale” . Un m. J. Physiol., Cell Physiol . 307 (1) : C25–38. doi : 10.1152/ajpcell.00084.2014 . PMC 4080181 . PMID 24788248 .
- ^ Cooper GM (1992). Éléments du cancer humain . Boston : éditeurs Jones et Bartlett. p. 16. ISBN 978-0-86720-191-8.
- ^ Taylor, Elizabeth J. (2000). Dictionnaire médical illustré de Dorland (29e éd.). Philadelphie : Saunders. p. 1184 . ISBN 978-0721662541.
- ^ Dictionnaire médical de Stedman (28e éd.). Philadelphie : Lippincott Williams & Wilkins. 2006. p. Néoplasme. ISBN 978-0781733908.
- ^ “II Tumeurs” . Classification statistique internationale des maladies et des problèmes de santé connexes 10e révision (CIM-10) Version pour 2010 . Organisation mondiale de la santé . Récupéré le 19 juin 2014 .
- ^ un b Abrams, Gérald. “Néoplasie I” . Récupéré le 23 janvier 2012 .
- ^ “Cancer – Activité 1 – Glossaire, page 4 sur 5” . Archivé de l’original le 2008-05-09 . Récupéré le 08/01/2008 .
- ^ “Définition médicale du clone” .
- ^ Lee ES, Locker J, Nalesnik M, Reyes J, Jaffe R, Alashari M, Nour B, Tzakis A, Dickman PS (janvier 1995). “L’association du virus d’Epstein-Barr avec des tumeurs des muscles lisses survenant après une transplantation d’organe”. N. Engl. J.Med . 332 (1): 19-25. doi : 10.1056/NEJM199501053320104 . PMID 7990861 .
- ^ “Cancer du pancréas : Glossaire des termes” . Récupéré le 08/01/2008 .
- ^ “Tumeur”. Dictionnaire médical illustré de Dorland (31e éd.). Saunders . 2007. ISBN 978-1-84972-348-0.
- ^ Tammela, Tuomas; Sauge, Julien (2020). “Enquêter sur l’hétérogénéité des tumeurs dans des modèles de souris” . Revue annuelle de la biologie du cancer . 4 (1): 99-119. doi : 10.1146/annurev-cancerbio-030419-033413 . PMC 8218894 . PMID 34164589 .
- ^ Asashima M, Oinuma T, Meyer-Rochow VB (1987). “Tumeurs dans les amphibiens”. Sciences Zoologiques . 4 : 411–425.
- ^ Ambrosi D, Mollica F (2002). “Sur la mécanique d’une tumeur en croissance”. Revue internationale des sciences de l’ingénieur . 40 (12): 1297–316. doi : 10.1016/S0020-7225(02)00014-9 .
- ^ Volokh KY (septembre 2006). “Stress dans les tissus mous en croissance”. Acta Biomater . 2 (5): 493–504. doi : 10.1016/j.actbio.2006.04.002 . PMID 16793355 .
- ^ Kastan MB (2008). “Réponses aux dommages à l’ADN: mécanismes et rôles dans les maladies humaines: conférence du prix commémoratif GHA Clowes 2007” . Mol. Cancer Res . 6 (4): 517–24. doi : 10.1158/1541-7786.MCR-08-0020 . PMID 18403632 .
- ^ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (novembre 2011). “Une nouvelle application de l’approche de la marge d’exposition: ségrégation des toxiques de la fumée de tabac”. Chimie alimentaire. Toxicol . 49 (11): 2921–33. doi : 10.1016/j.fct.2011.07.019 . PMID 21802474 .
- ^ Kanavy HE, Gerstenblith MR (décembre 2011). « Rayonnement ultraviolet et mélanome ». Semin Cutan Med Surg . 30 (4) : 222–8. doi : 10.1016/j.sder.2011.08.003 . PMID 22123420 .
- ^ Handa O, Naito Y, Yoshikawa T (2011). “Biologie redox et carcinogenèse gastrique : le rôle d’Helicobacter pylori” . Rédox Rep . 16 (1): 1–7. doi : 10.1179/174329211X12968219310756 . PMC 6837368 . PMID 21605492 .
- ^ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (août 2011). « Cancérogénicité du désoxycholate, un acide biliaire secondaire » . Cambre. Toxicol . 85 (8): 863–71. doi : 10.1007/s00204-011-0648-7 . PMC 3149672 . PMID 21267546 .
- ^ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (janvier 2012). “Formation à un stade précoce d’un défaut de champ épigénétique dans un modèle de colite de souris et rôles non essentiels des lymphocytes T et B dans l’induction de la méthylation de l’ADN” . Oncogène . 31 (3): 342–351. doi : 10.1038/onc.2011.241 . PMID 21685942 .
- ^ Malkin D (avril 2011). “Syndrome de Li-fraumeni” . Gènes Cancer . 2 (4): 475-484. doi : 10.1177/1947601911413466 . PMC 3135649 . PMID 21779515 .
- ^ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (juillet 2000). “Facteurs environnementaux et héréditaires dans la causalité du cancer – analyses de cohortes de jumeaux de Suède, du Danemark et de Finlande”. N. Engl. J.Med . 343 (2): 78–85. doi : 10.1056/NEJM200007133430201 . PMID 10891514 .
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (juin 2005). “O(6)-méthylguanine méthyltransférase dans les cancers colorectaux : détection de mutations, perte d’expression et faible association avec les transitions G:C>A:T” . Intestin . 54 (6): 797–802. doi : 10.1136/gut.2004.059535 . PMC 1774551 . PMID 15888787 .
- ^ a b Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (septembre 2005). “Méthylation du promoteur MGMT et défaut de champ dans le cancer colorectal sporadique” . J. Natl. Institut du cancer . 97 (18): 1330–8. doi : 10.1093/jnci/dji275 . PMID 16174854 .
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (juillet 2010). “Statut de méthylation du promoteur de hMLH1, MGMT et CDKN2A/p16 dans les adénomes colorectaux” . Monde J. Gastroenterol . 16 (28): 3553–60. doi : 10.3748/wjg.v16.i28.3553 . PMC 2909555 . PMID 20653064 .
- ^ un bc Lee KH, Lee JS, Nam JH, Choi C , Lee MC, Park CS, Juhng SW, Lee JH (octobre 2011). “Statut de méthylation du promoteur des gènes hMLH1, hMSH2 et MGMT dans le cancer colorectal associé à la séquence adénome-carcinome”. Chirurgie de l’arche de Langenbecks . 396 (7): 1017-1026. doi : 10.1007/s00423-011-0812-9 . PMID 21706233 . S2CID 8069716 .
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (avril 2013). “L’hyperméthylation de l’îlot CpG promoteur de l’enzyme de réparation de l’ADN MGMT prédit la réponse clinique à la dacarbazine dans une étude de phase II sur le cancer colorectal métastatique” . Clin. Cancer Res . 19 (8): 2265–72. doi : 10.1158/1078-0432.CCR-12-3518 . PMID 23422094 .
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, et al. (mai 2013). “Différents modèles de méthylation de l’ADN des deux régions promotrices distinctes de la O6-méthylguanine-ADN méthyltransférase (O6-MGMT) dans le cancer colorectal”. Mol. Biol. Rép . 40 (5): 3851–7. doi : 10.1007/s11033-012-2465-3 . PMID 23271133 . S2CID 18733871 .
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, et al. (mai 2005). “L’analyse immunohistochimique révèle une fréquence élevée de défauts PMS2 dans le cancer colorectal”. Gastroentérologie . 128 (5) : 1160–1171. doi : 10.1053/j.gastro.2005.01.056 . PMID 15887099 .
- ^ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (Avril 2010). “Modulation de la réparation des mésappariements et de la stabilité génomique par miR-155” . Proc. Natl. Acad. Sci. États- Unis . 107 (15): 6982–7. Bibcode : 2010PNAS..107.6982V . doi : 10.1073/pnas.1002472107 . PMC 2872463 . PMID 20351277 .
- ^ un bcde Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (2012). “Expression déficiente des enzymes de réparation de l’ADN dans la progression précoce vers le cancer du côlon sporadique” . Intégrité du génome . 3 (1): 3. doi : 10.1186/2041-9414-3-3 . PMC 3351028 . PMID 22494821 .
- ^ un b Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (avril 1997). “Niveaux élevés de mutation dans plusieurs tissus de souris déficientes en gène de réparation des mésappariements d’ADN Pms2” . Proc. Natl. Acad. Sci. États- Unis . 94 (7) : 3122–7. Bibcode : 1997PNAS…94.3122N . doi : 10.1073/pnas.94.7.3122 . PMC 20332 . PMID 9096356 .
- ^ un b Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (décembre 2006). “Modèles différents d’instabilité génétique chez les souris déficientes en gènes de réparation des mésappariements Pms2, Mlh1, Msh2, Msh3 et Msh6” . Carcinogenèse . 27 (12): 2402–8. doi : 10.1093/carcin/bgl079 . PMC 2612936 . PMID 16728433 .
- ^ un b Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (mars 2002). “La perturbation de Brca2 augmente le taux de mutation spontanée in vivo : synergie avec les rayonnements ionisants” . Représentant EMBO 3 (3): 255–60. doi : 10.1093/embo-reports/kvf037 . PMC 1084010 . PMID 11850397 .
- ^ O’Hagan HM, Mohammad HP, Baylin SB (2008). Lee JT (éd.). “Les cassures double brin peuvent initier le silençage génique et l’apparition de la méthylation de l’ADN dépendante de SIRT1 dans un îlot CpG promoteur exogène” . PLOS Genet . 4 (8) : e1000155. doi : 10.1371/journal.pgen.1000155 . PMC 2491723 . PMID 18704159 .
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (juillet 2007). “Dommages à l’ADN, réparation dirigée par l’homologie et méthylation de l’ADN” . PLOS Genet . 3 (7) : e110. doi : 10.1371/journal.pgen.0030110 . PMC 1913100 . PMID 17616978 .
- ^ Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, et al. (mars 2012). “Hétérogénéité intratumorale et évolution ramifiée révélées par le séquençage multirégional” . N. Engl. J.Med . 366 (10): 883–92. doi : 10.1056/NEJMoa1113205 . PMC 4878653 . PMID 22397650 .
- ^ Abattage DP, Southwick HW, Smejkal W (septembre 1953). “Cancerisation de terrain dans l’épithélium squameux stratifié oral; implications cliniques d’origine multicentrique”. Cancer . 6 (5): 963–8. doi : 10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q . PMID 13094644 .
- ^ Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H (février 2008). “Défauts de terrain dans la progression vers les cancers du tractus gastro-intestinal” . Cancer Lett . 260 (1–2) : 1–10. doi : 10.1016/j.canlet.2007.11.027 . PMC 2744582 . PMID 18164807 .
- ^ Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). “Pms2 déficient, ERCC1, Ku86, CcOI dans les défauts de champ au cours de la progression vers le cancer du côlon” . J Vis Exp (41) : 1931. doi : 10.3791/1931 . PMC 3149991 . PMID 20689513 .
- ^ Rubin H (mars 2011). “Champs et cancérisation des champs: les origines prénéoplasiques du cancer: les champs hyperplasiques asymptomatiques sont des précurseurs de la néoplasie, et leur progression vers les tumeurs peut être suivie par la densité de saturation en culture”. Bioessais . 33 (3): 224–231. doi : 10.1002/bies.201000067 . PMID 21254148 . S2CID 44981539 .
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (février 2000). “Reconstruction génétique des antécédents individuels de tumeurs colorectales” . Proc. Natl. Acad. Sci. États- Unis . 97 (3): 1236–1241. Bibcode : 2000PNAS…97.1236T . doi : 10.1073/pnas.97.3.1236 . PMC 15581 . PMID 10655514 .
- ^ un bc Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (mars 2013). « Paysages du génome du cancer » . Sciences . 339 (6127): 1546–58. Bibcode : 2013Sci…339.1546V . doi : 10.1126/science.1235122 . PMC 3749880 . PMID 23539594 .
- ^ Lochhead P, Chan AT, Nishihara R, Fuchs CS, Beck AH, Giovannucci E, Ogino S (2014). “Effet de champ étiologique : réévaluation du concept d’effet de champ dans la prédisposition et la progression du cancer” . Mod Pathol . 28 (1): 14-29. doi : 10.1038/modpathol.2014.81 . PMC 4265316 . PMID 24925058 .
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, et al. (novembre 2010). “Tolérance à la méthylation due à un défaut de champ O6-méthylguanine ADN méthyltransférase (MGMT) dans la muqueuse colique: une étape initiale dans le développement de cancers colorectaux déficients en réparation des mésappariements”. Intestin . 59 (11): 1516–26. doi : 10.1136/gut.2009.194787 . PMID 20947886 . S2CID 206950452 .
- ^ Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (février 2011). “Hyperméthylation fréquente de DAPK, RARbeta, MGMT, RASSF1A et FHIT dans les carcinomes épidermoïdes du larynx et la muqueuse normale adjacente”. Oncol oral . 47 (2): 104–7. doi : 10.1016/j.oraloncology.2010.11.006 . PMID 21147548 .
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (octobre 2009). “Instabilité microsatellite accrue et inactivation épigénétique du gène hMLH1 dans le carcinome épidermoïde de la tête et du cou”. Chirurgie de la tête et du cou d’Otolaryngol . 141 (4): 484–90. doi : 10.1016/j.otohns.2009.07.007 . PMID 19786217 . S2CID 8357370 .
- ^ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). “Carcinome épidermoïde de la tête et du cou: immunohistochimie de réparation des mésappariements et hyperméthylation du promoteur du gène hMLH1”. Suis J Otolaryngol . 32 (6): 528–36. doi : 10.1016/j.amjoto.2010.11.005 . PMID 21353335 .
- ^ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (novembre 2009). “Hyperméthylation de promoteur de gènes multiples dans l’adénocarcinome gastrique précoce et les lésions précancéreuses”. Hum. Pathol . 40 (11): 1534–42. doi : 10.1016/j.humpath.2009.01.029 . PMID 19695681 .
- ^ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). “Statut de méthylation du promoteur du gène de réparation de l’ADN (hMLH1) chez les patients atteints de carcinome gastrique de la vallée du Cachemire” . Pac asiatique. J. Cancer Préc . 13 (8): 4177–81. doi : 10.7314/APJCP.2012.13.8.4177 . PMID 23098428 .
- ^ Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). « Rôle des altérations épigénétiques dans la pathogenèse de l’œsophage de Barrett et de l’adénocarcinome de l’œsophage » . Int J Clin Exp Pathol . 5 (5) : 382–396. PMC 3396065 . PMID 22808291 .
- ^ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (septembre 1996). “Croissance des polypes colorectaux : redétection et évaluation des polypes non réséqués pendant une période de trois ans” . Intestin . 39 (3): 449–56. doi : 10.1136/gut.39.3.449 . PMC 1383355 . PMID 8949653 .
- ^ Schmitt MW, Prindle MJ, Loeb LA (septembre 2012). “Implications de l’hétérogénéité génétique dans le cancer” . Ann. NY Acad. Sci . 1267 (1) : 110–6. Bib code : 2012NYASA1267..110S . doi : 10.1111/j.1749-6632.2012.06590.x . PMC 3674777 . PMID 22954224 .
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W, et al. (février 2001). “Séquençage initial et analyse du génome humain” (PDF) . Nature . 409 (6822): 860–921. doi : 10.1038/35057062 . PMID 11237011 .
- ^ Yost SE, Smith EN, Schwab RB, Bao L, Jung H, Wang X, Voest E, Pierce JP, Messer K, Parker BA, Harismendy O, Frazer KA (août 2012). “Identification de mutations somatiques de haute confiance dans la séquence du génome entier d’échantillons de cancer du sein fixés au formol” . Nucleic Acids Res . 40 (14) : e107. doi : 10.1093/nar/gks299 . PMC 3413110 . PMID 22492626 .
- ^ Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, et al. (mai 2012). “Le séquençage du génome du mélanome révèle des mutations fréquentes de PREX2” . Nature . 485 (7399): 502–6. Bibcode : 2012Natur.485..502B . doi : 10.1038/nature11071 . PMC 3367798 . PMID 22622578 .
- ^ Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT, et al. (Avril 2010). “Analyse du patrimoine génétique dans un quatuor familial par séquençage du génome entier” . Sciences . 328 (5978): 636–9. Bibcode : 2010Sci…328..636R . doi : 10.1126/science.1186802 . PMC 3037280 . PMID 20220176 .
- ^ Campbell CD, Chong JX, Malig M, Ko A, Dumont BL, Han L, et al. (novembre 2012). “Estimation du taux de mutation humaine à l’aide de l’autozygotie dans une population fondatrice” . Nat. Genet . 44 (11): 1277–1281. doi : 10.1038/ng.2418 . PMC 3483378 . PMID 23001126 .
- ^ Tumeur dans l’encyclopédie médicale
- ^ “Gonflement” . Encyclopédie médicale MedlinePlus . 14 octobre 2012.
- ^ “tumescence” . Dictionnaire anglais Oxford (éd. En ligne). Presse universitaire d’Oxford . (Abonnement ou adhésion à une institution participante requise.)
