Octane
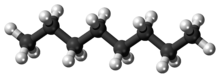
L’octane est un hydrocarbure et un alcane de formule chimique C 8 H 18 et de formule structurale condensée CH 3 (CH 2 ) 6 CH 3 . L’octane possède de nombreux isomères structuraux qui diffèrent par la quantité et l’emplacement des ramifications dans la chaîne carbonée . L’un de ces isomères, le 2,2,4-triméthylpentane (communément appelé iso-octane) est utilisé comme l’une des valeurs standard dans l’ échelle d’indice d’octane .
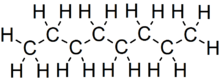 |
|
 |
|
 |
|
| Des noms | |
|---|---|
| Nom IUPAC préféré Indice d’octane [1] | |
| Identifiants | |
| Numero CAS |
|
| Modèle 3D ( JSmol ) |
|
| 3DMet |
|
| Référence Beilstein | 1696875 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| Carte d’information de l’ECHA | 100.003.539 |
| Numéro CE |
|
| Référence Gmelin | 82412 |
| KEGG |
|
| Engrener | octane |
| CID PubChem |
|
| Numéro RTECS |
|
| UNII |
|
| Numéro ONU | 1262 |
| Tableau de bord CompTox ( EPA ) |
|
InChI
|
|
SOURIRES
|
|
| Propriétés | |
| Formule chimique | C 8 H 18 |
| Masse molaire | 114,232 g · mol -1 |
| Apparence | liquide incolore |
| Odeur | Semblable à l’essence [2] |
| Densité | 0,703 g·cm −3 |
| Point de fusion | -57,1 à -56,6 °C ; -70,9 à -69,8 °F ; 216,0 à 216,6 K |
| Point d’ébullition | 125,1 à 126,1 °C; 257,1 à 258,9 °F ; 398,2 à 399,2 Ko |
| solubilité dans l’eau | 0,007 mg dm −3 (à 20 °C) |
| journal P | 4.783 |
| La pression de vapeur | 1,47 kPa (à 20,0 °C) |
| Constante de la loi de Henry ( k H ) | 29 nmol Pa −1 kg −1 |
| Acide conjugué | octonium |
| Susceptibilité magnétique (χ) | -96,63·10 −6 cm 3 /mol |
| Indice de réfraction ( n D ) | 1.398 |
| Viscosité |
|
| Thermochimie | |
| Capacité calorifique ( C ) | 255,68 JK- 1 mol – 1 |
| Entropie molaire standard ( S o 298 ) | 361.20 JK −1 mol −1 |
| Enthalpie standard de formation (Δ f H ⦵ 298 ) |
−252,1–−248,5 kJ mol −1 |
| Enthalpie de combustion standard (Δ c H ⦵ 298 ) |
−5,53–−5,33 MJ mol −1 |
| Dangers | |
| Étiquetage SGH : | |
| Pictogrammes |     |
| Mention d’avertissement | Danger |
| Mentions de danger | H225 , H304 , H315 , H336 , H410 |
| Conseils de prudence | P210 , P261 , P273 , P301+P310 , P331 |
| NFPA 704 (diamant de feu) |  1 3 0 1 3 0 |
| point de rupture | 13,0 ° C (55,4 ° F; 286,1 K) |
| Température d’auto-inflammation | 220,0 ° C (428,0 ° F; 493,1 K) |
| Limites explosives | 0,96–6,5 % |
| Dose ou concentration létale (DL, CL) : | |
| LD Lo ( plus bas publié ) | 428 mg/kg (souris, intraveineuse) [4] |
| NIOSH (limites d’exposition pour la santé aux États-Unis) : | |
| PEL (Autorisé) | TWA 500 ppm (2350 mg/m 3 ) [2] |
| REL (recommandé) | TWA 75 ppm (350 mg/m 3 ) C 385 ppm (1800 mg/m 3 ) [15 minutes] [2] |
| DIVS (Danger immédiat) | 1000 ppm [2] |
| Composés apparentés | |
| Alcanes apparentés |
|
| Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
L’octane est un composant de l’ essence (essence). Comme tous les hydrocarbures de faible poids moléculaire, l’octane est volatil et très inflammable.
Utilisation du terme dans l’essence
« Octane » est couramment utilisé comme une forme courte de « indice d’octane », en particulier dans l’expression « indice d’octane élevé ». “L’indice d’octane” est un indice de la capacité d’un carburant à résister au cognement du moteur (pré-allumage) dans des moteurs ayant différents taux de compression, ce qui est une caractéristique des isomères à chaîne ramifiée de l’octane, en particulier l’iso-octane. L’indice d’octane de l’essence n’est pas directement lié à la puissance d’un moteur. L’utilisation d’essence d’un indice d’octane supérieur à celui pour lequel un moteur est conçu ne peut pas augmenter la puissance de sortie.
L’indice d’octane a été déterminé à l’origine en mélangeant des carburants uniquement à partir d’heptane normal et d’iso octane (2,2,4-triméthylpentane, un indice d’octane hautement ramifié) et en attribuant des indices antidétonants de zéro pour l’heptane normal et de 100 pour l’iso octane pur. L’indice antidétonant de ce mélange serait le même que le pourcentage d’iso octane dans le mélange. Différents isomères d’octane peuvent contribuer à un indice d’octane inférieur ou supérieur. Par exemple, le n -octane (la chaîne droite de 8 atomes de carbone sans ramification) a un indice d’ octane de recherche de -20 (négatif) , tandis que l’iso octane pur a un indice RON de 100. Certains carburants ont un indice d’octane supérieur à 100, notamment ceux contenant du méthanol ou de l’éthanol.
Utilisation métaphorique
L’octane est devenu bien connu dans la culture populaire américaine au milieu et à la fin des années 1960, lorsque les compagnies pétrolières se vantaient de niveaux “d’octane élevés” dans leurs publicités pour l’essence.
L’adjectif composé “high octane”, signifiant puissant ou dynamique, est enregistré au sens figuré à partir de 1944. [5] Au milieu des années 1990, l’expression était couramment utilisée comme intensificateur et elle a trouvé sa place dans l’anglais moderne. vernaculaire.
Isomères
L’octane a 18 isomères structuraux (24 y compris les stéréoisomères ) :
- Indice d’ octane ( n -octane)
- 2-méthylheptane
- 3-Méthylheptane (2 Énantiomères )
- 4-méthylheptane
- 3-éthylhexane
- 2,2-diméthylhexane
- 2,3-Diméthylhexane (2 Énantiomères)
- 2,4-Diméthylhexane (2 Énantiomères)
- 2,5-diméthylhexane
- 3,3-diméthylhexane
- 3,4-Diméthylhexane (2 Énantiomères + 1 composé méso )
- 3-éthyl-2-méthylpentane
- 3-éthyl-3-méthylpentane
- 2,2,3-Triméthylpentane (2 Énantiomères)
- 2,2,4-Triméthylpentane (isooctane)
- 2,3,3-Triméthylpentane
- 2,3,4-Triméthylpentane
- 2,2,3,3-tétraméthylbutane
Références
- ^ “octane – Résumé composé” . Composé PubChem . États-Unis : Centre national d’information sur la biotechnologie. 16 septembre 2004. Pièces d’identité et documents connexes . Récupéré le 6 janvier 2012 .
- ^ un bcd Guide de poche NIOSH sur les risques chimiques. “#0470” . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Dymond, JH; Oye, HA (1994). “Viscosité des n-alcanes liquides sélectionnés”. Journal des données de référence physiques et chimiques . 23 (1): 41–53. Bibcode : 1994JPCRD..23…41D . doi : 10.1063/1.555943 . ISSN 0047-2689 .
- ^ “Octane” . Concentrations immédiatement dangereuses pour la vie ou la santé (IDLH) . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Dictionnaire anglais d’Oxford .
Liens externes
- Carte internationale de sécurité chimique 0933
- Guide de poche NIOSH sur les risques chimiques. “#0470” . Institut national pour la sécurité et la santé au travail (NIOSH).
- Bases de données phytochimiques et ethnobotaniques du Dr Duke, Octane, [1]
