Nocicepteur
Un nocicepteur (“récepteur de la douleur”) est un neurone sensoriel qui répond à des stimuli dommageables ou potentiellement dommageables en envoyant des signaux de “menace possible” [1] [2] [3] [4] à la moelle épinière et au cerveau. Le cerveau crée la sensation de douleur pour attirer l’attention sur la partie du corps, de sorte que la menace peut, espérons-le, être atténuée ; ce processus est appelé nociception .
| Nocicepteur | |
|---|---|
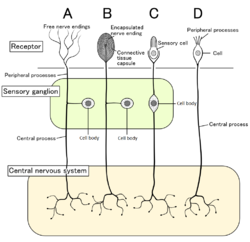 Quatre types de neurones sensoriels et leurs cellules réceptrices. Nocicepteurs représentés comme des terminaisons nerveuses libres de type A Quatre types de neurones sensoriels et leurs cellules réceptrices. Nocicepteurs représentés comme des terminaisons nerveuses libres de type A |
|
| Identifiants | |
| Engrener | D009619 |
| Terminologie anatomique [ modifier sur Wikidata ] |
Histoire
Les nocicepteurs ont été découverts par Charles Scott Sherrington en 1906. Au cours des siècles précédents, les scientifiques croyaient que les animaux étaient comme des dispositifs mécaniques qui transformaient l’énergie des stimuli sensoriels en réponses motrices. Sherrington a utilisé de nombreuses expériences différentes pour démontrer que différents types de stimulation du champ récepteur d’ une fibre nerveuse afférente conduisaient à des réponses différentes. Certains stimuli intenses déclenchent un retrait réflexe , certaines réponses autonomes et de la douleur . Les récepteurs spécifiques de ces stimuli intenses étaient appelés nocicepteurs. [5]
Emplacement
Chez les mammifères, les nocicepteurs se trouvent dans n’importe quelle zone du corps qui peut détecter des stimuli nocifs. Les nocicepteurs externes se trouvent dans des tissus tels que la peau ( nocicepteurs cutanés ), les cornées et les muqueuses . Les nocicepteurs internes se trouvent dans une variété d’organes, tels que les muscles , les articulations , la vessie , les organes viscéraux et le tube digestif. Les corps cellulaires de ces neurones sont situés soit dans les Ganglions de la racine dorsale, soit dans les ganglions du trijumeau . [6]Les ganglions trigéminés sont des nerfs spécialisés pour le visage, tandis que les Ganglions de la racine dorsale sont associés au reste du corps. Les axones s’étendent dans le système nerveux périphérique et se terminent en branches pour former des champs récepteurs.
Développement
Les nocicepteurs se développent à partir des cellules souches de la crête neurale . La crête neurale est responsable d’une grande partie du développement précoce chez les vertébrés. Il est spécifiquement responsable du développement du système nerveux périphérique (SNP). Les cellules souches de la crête neurale se séparent du tube neural lors de sa fermeture et des nocicepteurs se développent à partir de la partie dorsale de ce tissu de la crête neurale. Ils se forment tardivement au cours de la neurogenèse. Les cellules qui se forment plus tôt dans cette région peuvent devenir des récepteurs non sensibles à la douleur, soit des Propriocepteurs , soit des Mécanorécepteurs à seuil bas . Tous les neurones dérivés de la crête neurale, y compris les nocicepteurs embryonnaires, expriment le TrkA, qui est un récepteur au facteur de croissance nerveuse(NGF). Cependant, les facteurs de transcription qui déterminent le type de nocicepteur restent flous. [7]
Après la neurogenèse sensorielle, une différenciation se produit et deux types de nocicepteurs se forment. Ils sont classés comme nocicepteurs peptidergiques ou non peptidergiques, chacun exprimant un répertoire distinct de canaux ioniques et de récepteurs. Leurs spécialisations permettent aux récepteurs d’innerver différentes cibles centrales et périphériques. Cette différenciation se produit à la fois dans les périodes périnatales et postnatales. Les nocicepteurs non peptidergiques désactivent la kinase A ou TrkA du récepteur de la tropomyosine et commencent à exprimer Ret, qui est un composant de signalisation transmembranaire qui permet l’expression du facteur neurotrophique dérivé de la lignée cellulaire gliale.(GDNF). Cette transition est assistée par Runx1 qui est vital dans le développement des nocicepteurs non peptidergiques. Au contraire, les nocicepteurs peptidergiques continuent à utiliser TrkA, et ils expriment un type de facteur de croissance complètement différent. Il existe actuellement de nombreuses recherches sur les différences entre les nocicepteurs. [7]
Types et fonctions
Le terminal périphérique du nocicepteur mature est l’endroit où les stimuli nocifs sont détectés et transduits en énergie électrique. [8] Lorsque l’énergie électrique atteint une valeur seuil, un potentiel d’action est induit et dirigé vers le système nerveux central(CNS). Cela conduit à la suite d’événements qui permet la prise de conscience consciente de la douleur. La spécificité sensorielle des nocicepteurs est établie par le seuil élevé uniquement à des caractéristiques particulières de stimuli. Ce n’est que lorsque le seuil haut a été atteint par des environnements chimiques, thermiques ou mécaniques que les nocicepteurs sont déclenchés. La majorité des nocicepteurs sont classés selon les modalités environnementales auxquelles ils répondent. Certains nocicepteurs répondent à plus d’une de ces modalités et sont par conséquent désignés polymodaux. D’autres nocicepteurs ne répondent à aucune de ces modalités (bien qu’ils puissent répondre à une stimulation dans des conditions d’inflammation) et sont appelés endormis ou silencieux.
Les nocicepteurs ont deux types d’axones différents. Les premiers sont les axones de la fibre Aδ . Ils sont myélinisés et peuvent permettre à un potentiel d’action de se déplacer à une vitesse d’environ 20 mètres/seconde vers le SNC. L’autre type est celui des axones des fibres C à conduction plus lente. Ceux-ci ne conduisent qu’à des vitesses d’environ 2 mètres/seconde. [9]Cela est dû à la lumière ou à la non-myélinisation de l’axone. En conséquence, la douleur se présente en deux phases. La première phase est médiée par les fibres Aδ à conduction rapide et la seconde par les fibres C (polymodales). La douleur associée aux fibres Aδ peut être associée à une douleur initiale extrêmement vive. La deuxième phase est une sensation de douleur plus prolongée et légèrement moins intense à la suite des dommages aigus. S’il y a une entrée massive ou prolongée dans une Fibre C, il y a une accumulation progressive dans la corne dorsale de la moelle épinière; ce phénomène est similaire au tétanos dans les muscles mais est appelé liquidation . En cas de liquidation, il y a une probabilité de sensibilité accrue à la douleur. [dix]
Thermique
Les nocicepteurs thermiques sont activés par la chaleur ou le froid nocif à différentes températures. Il existe des transducteurs nocicepteurs spécifiques qui sont responsables de comment et si la terminaison nerveuse spécifique répond au stimulus thermique. Le premier à être découvert était TRPV1 , et il a un seuil qui coïncide avec la température de la chaleur douloureuse de 43 °C. Les autres températures dans la plage chaude-chaude sont médiées par plus d’un canal TRP . Chacun de ces canaux exprime un domaine C-terminal particulier qui correspond à la sensibilité chaud-chaud. Les interactions entre tous ces canaux et la manière dont le niveau de température est déterminé comme étant supérieur au seuil de douleur sont inconnues à l’heure actuelle. Les stimuli froids sont détectés par TRPM8canaux. Son domaine C-terminal diffère des TRP sensibles à la chaleur. Bien que ce canal corresponde à des stimuli froids, on ignore encore s’il contribue également à la détection du froid intense. Une découverte intéressante liée aux stimuli froids est que la sensibilité tactile et la fonction motrice se détériorent alors que la perception de la douleur persiste.
Mécanique
Les nocicepteurs mécaniques répondent à une pression excessive ou à une déformation mécanique. Ils répondent également aux incisions qui brisent la surface de la peau. La réaction au stimulus est traitée comme une douleur par le cortex, tout comme les réponses chimiques et thermiques. Ces nocicepteurs mécaniques ont fréquemment des caractéristiques polymodales. Il est donc possible que certains des transducteurs pour les stimuli thermiques soient les mêmes pour les stimuli mécaniques. Il en va de même pour les stimuli chimiques, puisque TRPA1 semble détecter à la fois les changements mécaniques et chimiques. Certains stimuli mécaniques peuvent provoquer la libération de produits chimiques intermédiaires, tels que l’ATP , qui peut être détecté par les récepteurs purinergiques P2 , ou le facteur de croissance nerveuse , qui peut être détecté par le récepteur kinase A de la tropomyosine (TrkA). [11]
Chimique
Les nocicepteurs chimiques ont des canaux TRP qui répondent à une grande variété d’épices. Celui qui voit le plus de réponse et qui est très largement testé est la capsaïcine . D’autres stimulants chimiques sont des irritants environnementaux comme l’acroléine , une arme chimique de la Première Guerre mondiale et un composant de la fumée de cigarette. Outre ces stimulants externes, les nocicepteurs chimiques ont la capacité de détecter des ligands endogènes et certaines amines d’acides gras qui résultent de modifications des tissus internes. Comme dans les nocicepteurs thermiques, TRPV1 peut détecter des produits chimiques comme la capsaïcine et les toxines et acides des araignées. [7] [11] Les canaux ioniques à détection d’acide (ASIC) détectent également l’acidité. [11]
Sommeil/silencieux
Bien que chaque nocicepteur puisse avoir une variété de niveaux de seuil possibles, certains ne répondent pas du tout aux stimuli chimiques, thermiques ou mécaniques à moins qu’une blessure ne se soit réellement produite. Ceux-ci sont généralement appelés nocicepteurs silencieux ou endormis, car leur réponse ne survient qu’au début de l’inflammation des tissus environnants. [6]
Polymodal
De nombreux neurones n’exécutent qu’une seule fonction; par conséquent, les neurones qui remplissent ces fonctions en combinaison reçoivent la classification “polymodale”. [12]
Sentier
Ascendant
Les fibres nociceptives afférentes (celles qui envoient des informations vers , plutôt que depuis le cerveau) remontent vers la moelle épinière où elles forment des synapses dans sa corne dorsale . Cette fibre nociceptive (située en périphérie) est un neurone de premier ordre. Les cellules de la corne dorsale sont divisées en couches physiologiquement distinctes appelées lamelles. Différents types de fibres forment des synapses dans différentes couches et utilisent soit le Glutamate , soit la substance P comme neurotransmetteur. Les fibres Aδ forment des synapses dans les lames I et V, les fibres C se connectent aux neurones de la lame II, les fibres Aβ se connectent aux lames I, III et V. [6]Après avoir atteint la lame spécifique de la moelle épinière, le projet nociceptif de premier ordre se projette sur des neurones de second ordre qui traversent la ligne médiane au niveau de la commissure blanche antérieure. Les neurones du second ordre envoient alors leurs informations par deux voies vers le thalamus : le système médial-lemniscal de la colonne dorsale et le Système antérolatéral . Le premier est davantage réservé aux sensations régulières non douloureuses, tandis que le second est réservé aux sensations douloureuses. En atteignant le thalamus, les informations sont traitées dans le noyau postérieur ventral et envoyées au cortex cérébral dans le cerveau via des fibres du membre postérieur de la capsule interne.
Descendant
Comme il existe une voie ascendante vers le cerveau qui initie la réalisation consciente de la douleur, il existe également une voie descendante qui module la sensation de douleur. Le cerveau peut demander la libération d’ hormones ou de produits chimiques spécifiques qui peuvent avoir des effets analgésiques qui peuvent réduire ou inhiber la sensation de douleur. La zone du cerveau qui stimule la libération de ces hormones est l’ hypothalamus . [13] Cet effet d’inhibition descendante peut être démontré en stimulant électriquement la zone grise périaqueducale du mésencéphale ou du noyau périventriculaire . Ils se projettent tous deux à leur tour vers d’autres zones impliquées dans la régulation de la douleur, telles que le noyau raphé magnusqui reçoit également des afférences similaires du noyau reticularis paragigantocellularis (NPG). À son tour, le noyau raphe magnus se projette dans la région de la substantia gelatinosa de la corne dorsale et médie la sensation d’entrées spinothalamiques. Cela se fait d’abord par le noyau raphe magnus envoyant des neurones sérotoninergiques aux neurones de la moelle dorsale, qui à leur tour sécrètent de l’ enképhaline aux interneurones qui portent la perception de la douleur. [14] L’enképhaline fonctionne en se liant aux Récepteurs opioïdes pour provoquer l’inhibition du neurone post-synaptique, inhibant ainsi la douleur. [11] Le Gris périaqueducal contient égalementrécepteurs opioïdes ce qui explique l’un des mécanismes par lesquels les opioïdes tels que la morphine et la Diacétylmorphine présentent un effet analgésique.
Sensibilité
La sensibilité des neurones nocicepteurs est modulée par une grande variété de médiateurs dans l’espace extracellulaire. [15] La sensibilisation périphérique représente une forme de plasticité fonctionnelle du nocicepteur. Le nocicepteur peut passer d’un simple détecteur de stimuli nocifs à un détecteur de stimuli non nocifs. Le résultat est que des stimuli de faible intensité provenant d’une activité régulière déclenchent une sensation douloureuse. C’est ce qu’on appelle communément l’ hyperalgésie . L’inflammation est une cause fréquente qui entraîne la sensibilisation des nocicepteurs. Normalement, l’hyperalgésie cesse lorsque l’inflammation diminue, cependant, parfois des défauts génétiques et/ou des blessures répétées peuvent entraîner une allodynie: un stimulus complètement non nocif comme un toucher léger provoque une douleur extrême. L’allodynie peut également être causée lorsqu’un nocicepteur est endommagé dans les nerfs périphériques. Cela peut entraîner une déafférentation, ce qui signifie le développement de différents processus centraux à partir du Nerf afférent survivant. Dans cette situation, les axones survivants de la racine dorsale des nocicepteurs peuvent entrer en contact avec la moelle épinière, modifiant ainsi l’entrée normale. [dix]
Autres animaux
La nociception a été documentée chez les animaux non mammifères, y compris les poissons [16] et un large éventail d’ invertébrés , y compris les sangsues , [17] les vers nématodes , [18] les limaces de mer , [19] et les larves de mouches des fruits . [20] Bien que ces neurones puissent avoir des voies et des relations avec le système nerveux central différentes de celles des nocicepteurs de mammifères, les neurones nociceptifs chez les non-mammifères se déclenchent souvent en réponse à des stimuli similaires à ceux des mammifères, tels qu’une température élevée (40 degrés C ou plus), une basse pH , capsaïcine et lésions tissulaires.
Terminologie
En raison d’une incompréhension historique de la douleur, les nocicepteurs sont également appelés à tort récepteurs de la douleur . Bien que toute douleur soit réelle, des facteurs psychologiques peuvent fortement influencer l’intensité subjective. [21]
Voir également
- La capsaïcine et son mécanisme d’action dans les nocicepteurs.
- Pipérine de poivre noir
- Canal ionique TRPC
Références
- ^ http://www.bodyinmind.org/what-is-pain/ [ URL nue ]
- ^ “NOI – Institut Neuro Orthopédique” . www.noigroup.com . Archivé de l’original le 2018-10-17 . Récupéré le 13/10/2017 .
- ^ “Nociception et douleur: quelle est la différence et pourquoi est-ce important? – Massage St. Louis, St. Louis, MO” . www.massage-stlouis.com .
- ^ Animaux, Comité du Conseil national de recherches (États-Unis) sur la reconnaissance et le soulagement de la douleur en laboratoire (8 décembre 2017). Mécanismes de la douleur . National Academies Press (États-Unis) – via www.ncbi.nlm.nih.gov.
- ^ Sherrington C. L’action intégrative du système nerveux. Oxford : presse universitaire d’Oxford ; 1906.
- ^ un bc Jessell , Thomas M.; Kandel, Eric R.; Schwartz, James H. (1991). Principes de la science neurale . Norwalk, Connecticut : Appleton & Lange. p. 472–79 . ISBN 978-0-8385-8034-9.
- ^ un bcWoolf CJ , Ma Q (août 2007). “Nocicepteurs – détecteurs de stimuli nocifs” . Neurone . 55 (3): 353–364. doi : 10.1016/j.neuron.2007.07.016 . PMID 17678850 . S2CID 13576368 .
- ^ Fein, A Nociceptors: les cellules qui ressentent la douleur http://cell.uchc.edu/pdf/fein/nociceptors_fein_2012.pdf
- ^ Williams, SJ; Purves, Dale (2001). Neurosciences . Sunderland, Masse : Sinauer Associates. ISBN 978-0-87893-742-4.
- ^ a b Fields HL, Rowbotham M, Baron R (octobre 1998). “Névralgie post-herpétique: nocicepteurs irritables et déafférentation”. Neurobiol. Dis . 5 (4): 209-227. doi : 10.1006/nbdi.1998.0204 . PMID 9848092 . S2CID 13217293 .
- ^ un bcd Yuan , Jason ; Brooks, Heddwen L.; Barman, Susan M.; Barrett, Kim E. (2019). Examen de la physiologie médicale de Ganong . ISBN 978-1-26-012240-4.
- ^ Fein, Alan. Nocicepteurs : les cellules qui ressentent la douleur .
- ^ “Voie de la douleur” . Récupéré le 02/06/2008 . [ lien mort ]
- ^ Hall, Michael E.; Hall, John E. (2021). Guyton et Hall manuel de physiologie médicale (14e éd.). Philadelphie, Pennsylvanie : Saunders/Elsevier. ISBN 978-0-323-59712-8.
- ^ Hucho T, Levine JD (août 2007). « Voies de signalisation dans la sensibilisation : vers une biologie des cellules nociceptrices » . Neurone . 55 (3): 365–76. doi : 10.1016/j.neuron.2007.07.008 . PMID 17678851 . S2CID 815135 .
- ^ Sneddon LU; Braithwaite VA ; Doux MJ (2003). “Les poissons ont-ils des nocicepteurs ? Preuve de l’évolution d’un système sensoriel de vertébrés” . Actes de la Royal Society of London B: Biological Sciences . 270 (1520): 1115–1121. doi : 10.1098/rspb.2003.2349 . PMC 1691351 . PMID 12816648 .
- ^ Pasteur J.; Soria B.; En ligneBelmonte C. (1996). “Propriétés des neurones nociceptifs du ganglion segmentaire de la sangsue” . Journal de neurophysiologie . 75 (6): 2268–2279. doi : 10.1152/jn.1996.75.6.2268 . PMID 8793740 .
- ^ Wittenburg N.; En ligneBaumeister R. (1999). “Évitement thermique chez Caenorhabditis elegans : une approche de l’étude de la nociception” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 96 (18): 10477–10482. Bibcode : 1999PNAS…9610477W . doi : 10.1073/pnas.96.18.10477 . PMC 17914 . PMID 10468634 .
- ^ Illich PA; Walters ET (1997). “Les neurones mécanosensoriels innervant le siphon d’ aplysie codent des stimuli nocifs et affichent une sensibilisation nociceptive” . Le Journal des neurosciences . 17 (1): 459–469. doi : 10.1523/JNEUROSCI.17-01-00459.1997 . PMC 6793714 . PMID 8987770 .
- ^ Tracey J.; Daniel W.; Wilson RI; Laurent G. ; En ligneBenzer S. (2003). « indolore , un gène de Drosophile indispensable à la nociception » . Cellule . 113 (2): 261-273. doi : 10.1016/S0092-8674(03)00272-1 . PMID 12705873 . S2CID 1424315 .
- ^ “La douleur est étrange : une sensation volatile et trompeuse” .
