Isomérisation
En chimie, l’ isomérisation ou l’ isomérisation est le processus par lequel une molécule , un ion ou un fragment moléculaire est transformé en un isomère avec une structure chimique différente . [1] L’énolisation est un exemple d’isomérisation, tout comme la Tautomérisation . [2] Lorsque l’isomérisation se produit de manière intramoléculaire , on peut l’appeler une réaction de réarrangement . [ citation nécessaire ]
Lorsque l’ énergie d’activation de la réaction d’isomérisation est suffisamment faible, les deux isomères existent dans un équilibre dépendant de la température l’un avec l’autre. De nombreuses valeurs de la différence d’énergie libre standard, Δ g ∘ {displaystyle Delta G^{circ }} 
Exemples et applications
Alcanes
L’isomérisation du squelette se produit dans le processus de craquage , utilisé dans l’ industrie pétrochimique . En plus de réduire la longueur moyenne de la chaîne, les hydrocarbures à chaîne droite sont convertis en isomères ramifiés dans le procédé, comme illustré par la réaction suivante. [ citation nécessaire ]
C H 3 C H 2 C H 2 C H 3 {displaystyle CH_{3}CH_{2}CH_{2}CH_{3}} 
( N-butane ) → C H 3 C H ( C H 3 ) C H 3 {displaystyle CH_{3}CH(CH_{3})CH_{3}}

( I-butane )
Les carburants contenant des hydrocarbures ramifiés sont privilégiés pour les moteurs à combustion interne en raison de leur indice d’ octane plus élevé . [4]
Alcènes
Les alcènes terminaux s’isomérisent en alcènes internes en présence de catalyseurs métalliques. Ce procédé est utilisé dans le procédé Shell pour les oléfines supérieures pour convertir les alpha-oléfines en oléfines internes, qui sont soumises à la métathèse des oléfines . Dans certains types de réactions de polymérisation d’alcènes, la marche en chaîne est un processus d’isomérisation qui introduit des ramifications dans les polymères en croissance. [ citation nécessaire ]
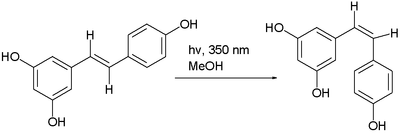
L’ isomère trans du resvératrol peut être converti en isomère cis dans une réaction photochimique. [5]

Un réarrangement thermique de l’ azulène en naphtalène a été observé. [ citation nécessaire ]
Autres exemples
L’isomérie aldose-cétose , alias transformation de Lobry de Bruyn-van Ekenstein, fournit un exemple dans la Chimie des saccharides . [ citation nécessaire ]


Un exemple d’ isomérisation organométallique est la production de décaphénylferrocène, [(η 5 -C 5 Ph 5 ) 2 Fe] à partir de son Isomère de liaison . [6] [7]


Voir également
- Isomérisation des époxydes favorisée par une base
- Epimérisation
- Racémisation
- Tautomérisation
- Isomérie de liaison
Références
- ^ IUPAC , Compendium de terminologie chimique , 2e éd. (le “Livre d’or”) (1997). Version corrigée en ligne : (2006–) ” isomérisation “. doi : 10.1351/goldbook.I03295
- ^ Antonov L (2016). Tautomérisme: concepts et applications en science et technologie (1ère éd.). Weinheim, Allemagne : Wiley-VCH. ISBN 978-3-527-33995-2.
- ^ Comment calculer les énergies d’isomérisation des molécules organiques avec des méthodes chimiques quantiques Stefan Grimme , Marc Steinmetz et Martin Korth J. Org. Chim. ; 2007 ; 72(6) pages 2118 – 2126 ; (Article) doi : 10.1021/jo062446p
- ^ Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke (2002). “Hydrocarbures”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a13_227 . {{cite encyclopedia}}: Maint CS1 : utilise le paramètre auteurs ( lien )
- ^ Photoisomérisation du resvératrol: une expérience d’enquête guidée intégrative Elyse Bernard, Philip Britz-McKibbin, Nicholas Gernigon Vol. 84 n° 7 juillet 2007 Journal of Chemical Education 1159.
- ^ Brown, KN; Champ, LD ; Lay, Pennsylvanie ; Lindall, CM; Maîtrise, AF (1990). “(η 5 -Pentaphénylcyclopentadiényl){1-(η 6 -phényl)-2,3,4,5-tétraphénylcyclopentadiényl}fer(II), [Fe(η 5 -C 5 Ph 5 ){(η 6 -C 6 H 5 )C 5 Ph 4 }], un Isomère de liaison du décaphénylferrocène”. J. Chem. Soc., Chem. Commun. (5): 408–410. doi : 10.1039/C39900000408 .
- ^ Champ, LD; Hamley, TW ; Humphrey, Pennsylvanie ; Lindall, CM; Gainsford, GJ; Maîtrise, AF ; Stpierre, TG; Webb, J. (1995). “Décaphénylferrocène”. Aust. J. Chem . 48 (4): 851–860. doi : 10.1071/CH9950851 .
