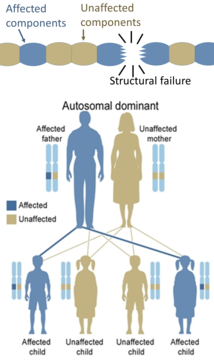
Dominance (génétique)
En génétique , la dominance est le phénomène d’une variante ( allèle ) d’un gène sur un chromosome masquant ou annulant l’ effet d’une variante différente du même gène sur l’autre copie du chromosome . [1] [2] La première variante est appelée dominante et la seconde récessive . Cet état d’avoir deux variantes différentes du même gène sur chaque chromosome est à l’origine causé par une mutation dans l’un des Gènes, soit nouvelle ( de novo ), soit héréditaire . Les termesautosomique dominant ou autosomique récessif sont utilisés pour décrire les variants génétiques sur les chromosomes non sexuels ( Autosomes ) et leurs traits associés, tandis que ceux sur les Chromosomes sexuels (allosomes) sont appelés dominants liés à l’X , récessifs liés à l’X ou liés à l’Y ; ceux-ci ont un modèle d’héritage et de présentation qui dépend du sexe du parent et de l’enfant (voir Lien sexuel ). Puisqu’il n’y a qu’une seule copie du chromosome Y, les traits liés à Y ne peuvent pas être dominants ou récessifs. De plus, il existe d’autres formes de dominance telles que la dominance incomplète, dans laquelle une variante de gène a un effet partiel par rapport à sa présence sur les deux chromosomes, et la co-dominance , dans laquelle différentes variantes sur chaque chromosome présentent toutes deux leurs traits associés.
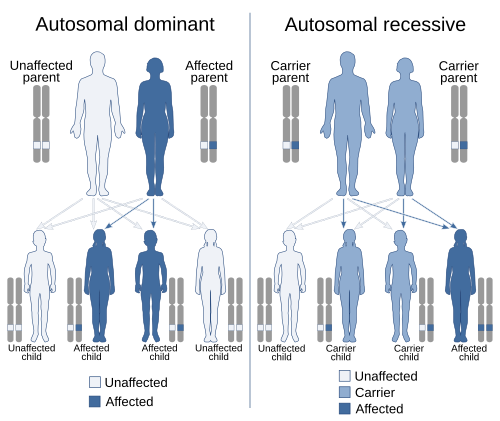 Hérédité autosomique dominante et autosomique récessive, les deux modèles d’ hérédité mendélienne les plus courants. Un autosome est tout chromosome autre qu’un chromosome sexuel .
Hérédité autosomique dominante et autosomique récessive, les deux modèles d’ hérédité mendélienne les plus courants. Un autosome est tout chromosome autre qu’un chromosome sexuel .
La dominance est un concept clé de l’hérédité mendélienne et de la génétique classique . Les lettres et les Carrés de Punnett sont utilisés pour démontrer les principes de dominance dans l’enseignement, et l’utilisation de lettres majuscules pour les allèles dominants et de lettres minuscules pour les allèles récessifs est une convention largement suivie. Un exemple classique de dominance est l’hérédité de la forme des graines chez les pois . Les pois peuvent être ronds, associés à l’allèle R , ou ridés, associés à l’allèle r . Dans ce cas, trois combinaisons d’allèles (Génotypes) sont possibles : RR , Rr et rr . Le RR (les individus homozygotes ) ont des pois ronds, et les individus rr (homozygotes) ont des pois ridés. Chez les individus Rr ( hétérozygotes ), l’ allèle R masque la présence de l’ allèle r , donc ces individus ont aussi des pois ronds. Ainsi, l’allèle R est dominant sur l’allèle r et l’allèle r est récessif à l’allèle R .
La dominance n’est pas inhérente à un allèle ou à ses traits ( phénotype ). C’est un effet strictement relatif entre deux allèles d’un gène donné de fonction quelconque ; un allèle peut être dominant sur un deuxième allèle du même gène, récessif sur un troisième et co-dominant sur un quatrième. De plus, un allèle peut être dominant pour un trait mais pas pour les autres.
La dominance diffère de l’ épistasie , le phénomène d’un allèle d’un gène masquant l’effet des allèles d’un gène différent . [3]
Arrière-plan

 Hérédité du nanisme chez le maïs. Démonstration de la hauteur des plantes des deux variations parentales et de leur hybride Hétérozygote F1 (au centre)
Hérédité du nanisme chez le maïs. Démonstration de la hauteur des plantes des deux variations parentales et de leur hybride Hétérozygote F1 (au centre)
Le concept de dominance a été introduit par Gregor Johann Mendel . Bien que Mendel, “le père de la génétique”, ait utilisé le terme pour la première fois dans les années 1860, il n’était pas largement connu avant le début du XXe siècle. Mendel a observé que, pour une variété de traits de pois de jardin liés à l’apparence des graines, des gousses et des plantes, il y avait deux phénotypes distincts, tels que les graines rondes par rapport aux graines ridées, les graines jaunes par rapport aux vertes, les fleurs rouges par rapport aux fleurs blanches ou plantes hautes contre plantes courtes. Lorsqu’elles sont cultivées séparément, les plantes produisent toujours les mêmes phénotypes, génération après génération. Cependant, lorsque des lignées de phénotypes différents ont été croisées (croisées), un et un seul des phénotypes parentaux est apparu dans la progéniture (vert, ou rond, ou rouge, ou grand). Cependant, lorsque ces hybridesplantes ont été croisées, les plantes descendantes ont montré les deux phénotypes originaux, dans un rapport caractéristique de 3: 1, le phénotype le plus courant étant celui des plantes hybrides parentales. Mendel a estimé que chaque parent du premier croisement était homozygote pour différents allèles (un parent AA et l’autre parent aa), que chacun contribuait à un allèle à la progéniture, avec pour résultat que tous ces hybrides étaient hétérozygotes (Aa), et que l’un des deux allèles du croisement hybride dominait l’expression de l’autre : A masqué a. Le croisement final entre deux hétérozygotes (Aa X Aa) produirait une progéniture AA, Aa et aa dans un rapport génotypique de 1: 2: 1, les deux premières classes montrant le phénotype (A) et la dernière montrant le phénotype (a). , produisant ainsi le rapport phénotypique 3:1.
Mendel n’a pas utilisé les termes gène, allèle, phénotype, génotype, homozygote et Hétérozygote, qui ont tous été introduits plus tard. Il a introduit la notation des lettres majuscules et minuscules pour les allèles dominants et récessifs, respectivement, toujours en usage aujourd’hui.
En 1928, le généticien des populations britannique Ronald Fisher a proposé que la dominance agisse sur la base de la sélection naturelle grâce à la contribution de Gènes modificateurs . En 1929, le généticien américain Sewall Wright a répondu en déclarant que la dominance est simplement une conséquence physiologique des voies métaboliques et de la nécessité relative du gène impliqué. L’explication de Wright est devenue un fait établi en génétique et le débat a été largement clos. Cependant, certains traits peuvent voir leur dominance influencée par des mécanismes évolutifs. [4] [5] [6]
Chromosomes, Gènes et allèles
La plupart des animaux et certaines plantes ont des chromosomes appariés et sont décrits comme diploïdes. Ils ont deux versions de chaque chromosome, l’une apportée par l’ Ovule de la mère et l’autre par le sperme du père , appelés gamètes , décrits comme haploïdes et créés par la méiose . Ces gamètes fusionnent ensuite lors de la fécondation lors de la reproduction sexuée , en un nouveau zygote unicellulaire , qui se divise plusieurs fois, résultant en un nouvel organisme avec le même nombre de paires de chromosomes dans chaque cellule (non gamète) que ses parents.
Chaque chromosome d’une paire correspondante (homologue) est structurellement similaire à l’autre et possède une séquence d’ADN très similaire ( loci , locus singulier). L’ADN de chaque chromosome fonctionne comme une série de Gènes discrets qui influencent divers traits. Ainsi, chaque gène a également un homologue correspondant, qui peut exister dans différentes versions appelées allèles . Les allèles au même locus sur les deux chromosomes homologues peuvent être identiques ou différents.
Le groupe sanguin d’un être humain est déterminé par un gène qui crée un groupe sanguin A, B, AB ou O et est situé dans le bras long du chromosome neuf. Il y a trois allèles différents qui pourraient être présents à ce locus, mais seulement deux peuvent être présents chez un individu, un hérité de sa mère et un de son père. [7]
Si deux allèles d’un gène donné sont identiques, l’organisme est appelé homozygote et est dit homozygote par rapport à ce gène ; si au contraire les deux allèles sont différents, l’organisme est Hétérozygote et est Hétérozygote. La composition génétique d’un organisme, soit à un seul locus, soit sur tous ses Gènes collectivement, est appelée son génotype . Le génotype d’un organisme, directement et indirectement, affecte ses traits moléculaires, physiques et autres, qui sont appelés individuellement ou collectivement son phénotype . Aux locus de Gènes hétérozygotes, les deux allèles interagissent pour produire le phénotype. [ citation nécessaire ]
Types de domination
Domination complète
En dominance complète, l’effet d’un allèle dans un génotype Hétérozygote masque complètement l’effet de l’autre. L’allèle qui masque est considéré comme dominant par rapport à l’autre allèle, et l’allèle masqué est considéré comme récessif . [8] La dominance complète dans le phénotype d’un Hétérozygote est indiscernable du phénotype d’un homozygote dominant.
Un exemple classique de dominance complète est l’hérédité de la forme de la graine (forme de pois) chez les pois. Les pois peuvent être ronds (associés à l’allèle R ) ou ridés (associés à l’allèle r ). Dans ce cas, trois combinaisons d’allèles ( Génotypes ) sont possibles : RR, rr, Rr. RR et rr sont homozygotes et Rr est Hétérozygote. Les individus RR ont des pois ronds et les individus rr ont des pois ridés. Chez les individus Rr , l’allèle R masque la présence de l’ allèle r , de sorte que ces individus ont également des pois ronds. Ainsi, l’allèle Rest complètement dominant pour l’allèle r et l’allèle r est récessif pour l’allèle R .
Dominance incomplète
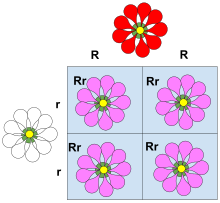
 Ce carré de Punnett illustre une dominance incomplète. Dans cet exemple, le trait pétale rouge associé à l’ allèle R se recombine avec le trait pétale blanc de l’allèle r. La plante exprime de manière incomplète le trait dominant (R) amenant les plantes avec le génotype Rr à exprimer des fleurs avec moins de pigment rouge, ce qui donne des fleurs roses. Les couleurs ne se mélangent pas, le trait dominant s’exprime juste moins fortement.
Ce carré de Punnett illustre une dominance incomplète. Dans cet exemple, le trait pétale rouge associé à l’ allèle R se recombine avec le trait pétale blanc de l’allèle r. La plante exprime de manière incomplète le trait dominant (R) amenant les plantes avec le génotype Rr à exprimer des fleurs avec moins de pigment rouge, ce qui donne des fleurs roses. Les couleurs ne se mélangent pas, le trait dominant s’exprime juste moins fortement.
La dominance incomplète (également appelée dominance partielle , semi-dominance ou héritage intermédiaire ) se produit lorsque le phénotype du génotype Hétérozygote est distinct et souvent intermédiaire aux phénotypes des Génotypes homozygotes. Le résultat phénotypique apparaît souvent comme une forme mixte de caractères à l’état Hétérozygote. Par exemple, la couleur de la fleur de muflier est homozygote pour le rouge ou le blanc. Lorsque la fleur homozygote rouge est associée à la fleur homozygote blanche, le résultat donne une fleur de muflier rose. Le muflier rose est le résultat d’une dominance incomplète. Un type similaire de dominance incomplète se trouve dans l’ usine de quatre heuresdans lequel la couleur rose est produite lorsque des parents de race pure de fleurs blanches et rouges sont croisés. En génétique quantitative , où les phénotypes sont mesurés et traités numériquement, si le phénotype d’un Hétérozygote se situe exactement entre (numériquement) celui des deux homozygotes, on dit que le phénotype ne présente aucune dominance , c’est-à-dire que la dominance n’existe que lorsque la mesure du phénotype de l’Hétérozygote est plus proche à un homozygote qu’à l’autre.
Lorsque les plantes de la génération F 1 sont autopollinisées, le rapport phénotypique et génotypique de la génération F 2 sera de 1:2:1 (Rouge:Rose:Blanc). [9]
Voir hypothèse de dominance partielle .
Co-dominance

 Co-dominance dans un cultivar de Camellia
Co-dominance dans un cultivar de Camellia 
 Les groupes sanguins A et B chez l’homme montrent une co-dominance, mais le type O est récessif à A et B.
Les groupes sanguins A et B chez l’homme montrent une co-dominance, mais le type O est récessif à A et B. 
 Ce carré de Punnett montre la co-dominance. Dans cet exemple, un taureau blanc (WW) s’accouple avec une vache rouge (RR), et leur progéniture présente une co-dominance exprimant à la fois les poils blancs et rouges.
Ce carré de Punnett montre la co-dominance. Dans cet exemple, un taureau blanc (WW) s’accouple avec une vache rouge (RR), et leur progéniture présente une co-dominance exprimant à la fois les poils blancs et rouges.
La co-dominance se produit lorsque les contributions des deux allèles sont visibles dans le phénotype et qu’aucun allèle ne masque l’autre.
Par exemple, dans le système de groupe sanguin ABO , les modifications chimiques d’une glycoprotéine (l’antigène H) à la surface des cellules sanguines sont contrôlées par trois allèles, dont deux sont co-dominants ( I A , I B ) et dominant sur le i récessif au locus ABO . Les allèles I A et I B produisent des modifications différentes. L’enzyme codée par IA ajoute une N-acétylgalactosamine à un antigène H lié à la membrane. L’ enzyme I B ajoute un galactose. Le jel’allèle ne produit aucune modification. Ainsi, les allèles I A et I B sont chacun dominants pour i ( les individus I A I A et I A i ont tous deux du sang de type A, et les individus I B I B et I B i ont tous deux du sang de type B), mais I A I Les individus B ont les deux modifications sur leurs cellules sanguines et ont donc du sang de type AB, de sorte que les allèles I A et I B sont dits co-dominants.
Un autre exemple se produit au locus du composant Bêta-globine de l’hémoglobine , où les trois phénotypes moléculaires de Hb A /Hb A , Hb A /Hb S et Hb S /Hb S se distinguent tous par Électrophorèse des protéines . (La condition médicale produite par le génotype Hétérozygote est appelée Trait drépanocytaire et est une condition plus bénigne qui se distingue de L’anémie falciforme , ainsi les allèles montrent une dominance incomplèteconcernant l’anémie, voir ci-dessus). Pour la plupart des locus de Gènes au niveau moléculaire, les deux allèles sont exprimés de manière co-dominante, car ils sont tous deux transcrits en ARN .
La co-dominance, où les produits alléliques coexistent dans le phénotype, est différente de la dominance incomplète, où l’interaction quantitative des produits alléliques produit un phénotype intermédiaire. Par exemple, en co-dominance, une fleur homozygote rouge et une fleur homozygote blanche produiront une progéniture qui a des taches rouges et blanches. Lorsque les plantes de la génération F1 sont autopollinisées, le rapport phénotypique et génotypique de la génération F2 sera de 1:2:1 (Rouge:Tacheté:Blanc). Ces ratios sont les mêmes que ceux de la dominance incomplète. Encore une fois, cette terminologie classique est inappropriée – en réalité, de tels cas ne devraient pas du tout être considérés comme faisant preuve de dominance.
Aborder les idées fausses courantes
| Apprendre encore plus Cette section ne cite aucune source . ( janvier 2020 )Veuillez aider à améliorer cette section en ajoutant des citations à des sources fiables . Le matériel non sourcé peut être contesté et supprimé . (Découvrez comment et quand supprimer ce modèle de message) |
La dominance concerne la relation entre deux versions d’un gène. Un trait dominant correspond généralement aux modèles d’héritage que l’on peut voir dans les Carrés de Punnett. Si un individu a deux versions d’un gène, alors le gène qui est fréquemment observé dans les générations suivantes est considéré comme “dominant”. [dix]
En génétique, il y a quelques idées fausses qui sont assez courantes. On pense qu’un trait dominant est « plus fort » et « surpasse » un trait récessif. Les traits dominants sont également supposés plus susceptibles d’être hérités et plus répandus dans une population. L’idée que les traits dominants sont masculins ou masculins est également une hypothèse courante dans le monde de la génétique. Tout biologiste expérimenté sait que ces idées ne sont pas factuelles, mais pour un débutant, ces idées se démarquent. Mais, si ces idées ne sont pas factuelles, pourquoi émergent-elles ? Les différentes idées de dominance en matière de génétique découlent des définitions communément connues du mot dominance dans un cadre non génétique. On pense que la dominance contrôle, est forte et puissante, ce qui donne à la dominance génétique cette stigmatisation erronée. [11]
La dominance ne détermine pas si un allèle est délétère, neutre ou avantageux. Cependant, la sélection doit opérer sur les Gènes indirectement par le biais des phénotypes et la dominance affecte l’exposition des allèles dans les phénotypes, d’où le taux de changement des fréquences alléliques sous sélection. Les allèles récessifs délétères peuvent persister dans une population à de faibles fréquences, la plupart des copies étant portées par des hétérozygotes, sans frais pour ces individus. Ces rares récessifs sont à la base de nombreuses maladies génétiques héréditaires .
Nomenclature
En génétique, les symboles ont commencé comme des espaces réservés algébriques. Lorsqu’un allèle est dominant par rapport à un autre, la convention la plus ancienne est de symboliser l’allèle dominant par une majuscule. L’allèle récessif se voit attribuer la même lettre en minuscule. Dans l’exemple du pois, une fois la relation de dominance entre les deux allèles connue, il est possible de désigner l’allèle dominant qui produit une forme ronde par un symbole majuscule R , et l’allèle récessif qui produit une forme ridée par un symbole R inférieur. symbole de cas r . Les Génotypes homozygotes dominants, hétérozygotes et homozygotes récessifs sont alors respectivement notés RR , Rr et rr . Il serait également possible de désigner les deux allèles par Wet w , et les trois Génotypes WW , Ww et ww , dont les deux premiers ont produit des pois ronds et le troisième des pois ridés. Le choix du « R » ou du « W » comme symbole de l’allèle dominant ne préjuge pas si l’allèle provoquant le phénotype « rond » ou « ridé » lorsqu’il est homozygote est le dominant.
Un gène peut avoir plusieurs allèles. Chaque allèle est symbolisé par le symbole du locus suivi d’un exposant unique. Chez de nombreuses espèces, l’allèle le plus commun dans la population sauvage est désigné l’allèle de type sauvage. Il est symbolisé par un caractère + en exposant. D’autres allèles sont dominants ou récessifs par rapport à l’allèle de type sauvage. Pour les allèles récessifs, le symbole du locus est en lettres minuscules. Pour les allèles avec n’importe quel degré de dominance par rapport à l’allèle de type sauvage, la première lettre du symbole du locus est en majuscule. Par exemple, voici quelques-uns des allèles au locus a de la souris de laboratoire, Mus musculus : A y , dominante jaune ; a + , type sauvage; et un bt , noir et feu. Leun allèle bt est récessif à l’allèle de type sauvage, et l’ allèle A y est codominant à l’allèle de type sauvage. L’ allèle A y est également codominant avec l’ allèle a bt , mais montre que cette relation dépasse les limites des règles de la nomenclature génétique de la souris.
Les règles de la nomenclature génétique ont évolué à mesure que la génétique est devenue plus complexe. Des comités ont standardisé les règles pour certaines espèces, mais pas pour toutes. Les règles d’une espèce peuvent différer quelque peu des règles d’une autre espèce. [12] [13]
Relation avec d’autres concepts génétiques
Allèles multiples
Bien que tout individu d’un organisme diploïde ait au plus deux allèles différents à un locus (à l’exception des aneuploïdies ), la plupart des Gènes existent dans un grand nombre de versions alléliques dans l’ensemble de la population. Si les allèles ont des effets différents sur le phénotype, parfois leurs relations de dominance peuvent être décrites comme une série.
Par exemple, la couleur du pelage chez les chats domestiques est affectée par une série d’allèles du gène TYR (qui code l’enzyme tyrosinase ). Les allèles C , c b , c s et c a (plein couleur, birman , siamois et albinos , respectivement) produisent différents niveaux de pigment et donc différents niveaux de dilution de couleur. L’ allèle C (polychrome) est complètement dominant sur les trois derniers et l’ allèle c a (albinos) est complètement récessif sur les trois premiers. [14] [15] [16]
Dominance autosomique versus liée au sexe
| Apprendre encore plus Cette section ne cite aucune source . ( janvier 2020 )Veuillez aider à améliorer cette section en ajoutant des citations à des sources fiables . Le matériel non sourcé peut être contesté et supprimé . (Découvrez comment et quand supprimer ce modèle de message) |
Chez l’homme et d’autres espèces de mammifères , le sexe est déterminé par deux Chromosomes sexuels appelés chromosome X et chromosome Y. Les femmes humaines sont XX ; les mâles sont XY . Les paires de chromosomes restantes se trouvent chez les deux sexes et sont appelées Autosomes ; les traits génétiques dus aux locus de ces chromosomes sont décrits comme autosomiques et peuvent être dominants ou récessifs. Les traits génétiques des chromosomes X et Y sont dits liés au sexe, car ils sont liés aux Chromosomes sexuels, et non parce qu’ils sont caractéristiques d’un sexe ou de l’autre. En pratique, le terme fait presque toujours référence à X-les traits liés et un grand nombre de ces traits (tels que la déficience de la vision des couleurs rouge-vert) ne sont pas affectés par le sexe. Les femelles ont deux copies de chaque locus génique trouvé sur le chromosome X, tout comme pour les Autosomes, et les mêmes relations de dominance s’appliquent. Les mâles, cependant, n’ont qu’une seule copie de chaque locus du gène du chromosome X et sont décrits comme hémizygotes pour ces Gènes. Le chromosome Y est beaucoup plus petit que le X et contient un ensemble beaucoup plus petit de Gènes, y compris, mais sans s’y limiter, ceux qui influencent la « masculinité », comme le gène SRY pour le facteur déterminant des testicules.. Les règles de dominance des locus de Gènes liés au sexe sont déterminées par leur comportement chez la femelle : comme le mâle n’a qu’un seul allèle (sauf dans le cas de certains types d’ aneuploïdie du chromosome Y ), cet allèle est toujours exprimé qu’il soit dominant ou non. récessif. Les oiseaux ont des Chromosomes sexuels opposés : les oiseaux mâles ont des chromosomes ZZ et les oiseaux femelles ZW. Cependant, l’héritage des traits rappelle le système XY autrement; les diamants mandarins mâles peuvent porter le gène de la coloration blanche dans leur chromosome Z sur deux, mais les femelles développent toujours une coloration blanche. Les sauterelles ont le système XO. Les femelles ont XX, mais les mâles seulement X. Il n’y a pas de chromosome Y du tout.
épistasie
L’épistasie [” épi + stase = s’asseoir sur le dessus”] est une interaction entre des allèles à deux loci de Gènes différents qui affectent un seul trait, qui peut parfois ressembler à une interaction de dominance entre deux allèles différents au même locus. L’épistasie modifie le rapport caractéristique 9:3:3:1 attendu pour deux Gènes non épistatiques. Pour deux locus, 14 classes d’interactions épistatiques sont reconnues. Comme exemple d’ épistasie récessive , un locus génique peut déterminer si un pigment de fleur est jaune ( AA ou Aa ) ou vert ( aa), tandis qu’un autre locus détermine si le pigment est produit ( BB ou Bb ) ou non ( bb ). Dans une plante bb , les fleurs seront blanches, quel que soit le génotype de l’autre locus comme AA , Aa ou aa . La combinaison bb n’est pas dominante pour l’ allèle A : le gène B montre plutôt une épistasie récessive au gène A , car le locus B lorsqu’il est homozygote pour l’allèle récessif ( bb ) supprime l’expression phénotypique de l’ allèle A.lieu. Dans un croisement entre deux plantes AaBb , cela produit un rapport caractéristique de 9:3:4 , dans ce cas des fleurs jaunes : vertes : blanches.
Dans l’épistasie dominante , un locus de gène peut déterminer le pigment jaune ou vert comme dans l’exemple précédent : AA et Aa sont jaunes et aa sont verts. Un second locus détermine si un précurseur de pigment est produit ( dd ) ou non ( DD ou Dd ). Ici, chez une plante DD ou Dd , les fleurs seront incolores quel que soit le génotype au locus A , du fait de l’effet épistatique de l’ allèle D dominant. Ainsi, dans un croisement entre deux plantes AaDd , les 3/4 des plantes seront incolores, et les phénotypes jaune et vert ne s’expriment qu’enjj plantes. Cela produit un rapport caractéristique de 12:3:1 de plantes blanches : jaunes : vertes.
Une épistasie supplémentaire se produit lorsque deux locus affectent le même phénotype. Par exemple, si la couleur du pigment est produite par CC ou Cc mais pas cc , et par DD ou Dd mais pas dd , alors le pigment n’est produit dans aucune combinaison génotypique avec cc ou dd . Autrement dit, les deux locus doivent avoir au moins un allèle dominant pour produire le phénotype. Cela produit un rapport caractéristique de 9: 7 entre les plantes pigmentées et non pigmentées. L’épistasie complémentaire en revanche produit une plante non pigmentée si et seulement si le génotype est cc et dd, et le rapport caractéristique est de 15:1 entre les plantes pigmentées et non pigmentées. [17]
La génétique classique considérait les interactions épistatiques entre deux Gènes à la fois. Il est maintenant évident d’après la génétique moléculaire que tous les locus de Gènes sont impliqués dans des interactions complexes avec de nombreux autres Gènes (par exemple, les voies métaboliques peuvent impliquer des dizaines de Gènes), et que cela crée des interactions épistatiques beaucoup plus complexes que les modèles classiques à deux locus. .
Principe de Hardy-Weinberg (estimation de la fréquence porteuse)
| Apprendre encore plus Cette section ne cite aucune source . ( janvier 2020 )Veuillez aider à améliorer cette section en ajoutant des citations à des sources fiables . Le matériel non sourcé peut être contesté et supprimé . (Découvrez comment et quand supprimer ce modèle de message) |
La fréquence de l’état Hétérozygote (qui est l’état porteur d’un trait récessif) peut être estimée à l’aide de la formule de Hardy-Weinberg : p 2 + 2 p q + q 2 = 1 {displaystyle p^{2}+2pq+q^{2}=1} 
Cette formule s’applique à un gène avec exactement deux allèles et relie les fréquences de ces allèles dans une grande population aux fréquences de leurs trois Génotypes dans cette population.
Par exemple, si p est la fréquence de l’allèle A et q est la fréquence de l’allèle a , alors les termes p 2 , 2 pq et q 2 sont les fréquences des Génotypes AA , Aa et aa respectivement. Puisque le gène n’a que deux allèles, tous les allèles doivent être A ou a et p + q = 1 . Maintenant, si A est complètement dominant sur a alors la fréquence du génotype porteur Aane peut pas être observé directement (puisqu’il a les mêmes traits que le génotype homozygote AA ), mais il peut être estimé à partir de la fréquence du trait récessif dans la population, puisque celle-ci est la même que celle du génotype homozygote aa . c’est-à-dire que les fréquences alléliques individuelles peuvent être estimées : q = √ f (aa) , p = 1 − q , et à partir de celles-ci la fréquence du génotype porteur peut être dérivée : f (Aa) = 2 pq .
Cette formule repose sur un certain nombre d’ hypothèses et une estimation précise de la fréquence du trait récessif. En général, toute situation réelle s’écartera de ces hypothèses dans une certaine mesure, introduisant des inexactitudes correspondantes dans l’estimation. Si le trait récessif est rare, il sera difficile d’estimer sa fréquence avec précision, car un très grand échantillon sera nécessaire.
Dominant versus avantageux
| Apprendre encore plus Cette section ne cite aucune source . ( janvier 2020 ) Please help improve this section by adding citations to reliable sources. Unsourced material may be challenged and removed. (Learn how and when to remove this template message) |
La propriété de « dominant » est parfois confondue avec la notion d’avantageux et la propriété de « récessif » est parfois confondue avec la notion de délétère, mais les phénomènes sont distincts. La dominance décrit le phénotype des hétérozygotes par rapport aux phénotypes des homozygotes et sans égard à la mesure dans laquelle différents phénotypes peuvent être bénéfiques ou délétères. Étant donné que de nombreux allèles de maladies génétiques sont récessifs et que le mot dominance a une connotation positive, on suppose souvent que le phénotype dominant est supérieur en termes de fitness. Ceci n’est cependant pas assuré ; comme indiqué ci-dessous, alors que la plupart des allèles de maladies génétiques sont délétères et récessifs, toutes les maladies génétiques ne sont pas récessives.
Néanmoins, cette confusion a été omniprésente tout au long de l’histoire de la génétique et persiste à ce jour. Aborder cette confusion était l’une des principales motivations de la publication du principe de Hardy-Weinberg .
Mécanismes moléculaires
La base moléculaire de la dominance était inconnue de Mendel. Il est maintenant entendu qu’un locus génique comprend une longue série (des centaines à des milliers) de bases ou de nucléotides d’ acide désoxyribonucléique (ADN) à un point particulier sur un chromosome. Le dogme central de la biologie moléculaire stipule que ” l’ADN fait que l’ ARN fait la protéine “, c’est-à-dire que l’ADN est transcrit pour faire une copie d’ARN et que l’ARN est traduit pour faire une protéine. Dans ce processus, différents allèles à un locus peuvent ou non être transcrits, et s’ils sont transcrits, ils peuvent être traduits en versions légèrement différentes de la même protéine (appelées isoformes). Les protéines fonctionnent souvent comme des enzymes qui catalysent des réactions chimiques dans la cellule, qui produisent directement ou indirectement des phénotypes. Des mutations au sein du génome peuvent altérer l’activité catalytique et donc affecter la dominance. [18] Dans n’importe quel organisme diploïde, les séquences d’ADN des deux allèles présents à n’importe quel locus génique peuvent être identiques (homozygotes) ou différentes (hétérozygotes). Même si le locus du gène est Hétérozygote au niveau de la séquence d’ADN, les protéines fabriquées par chaque allèle peuvent être identiques. En l’absence de toute différence entre les produits protéiques, aucun allèle ne peut être considéré comme dominant (voir co-dominance , ci-dessus). Même si les deux produits protéiques sont légèrement différents ( allozymes), il est probable qu’ils produisent le même phénotype en ce qui concerne l’action enzymatique, et encore une fois aucun allèle ne peut être considéré comme dominant.
Zygosité
Historiquement, la loi de Mendel sur l’assortiment indépendant supposait que les allèles se triaient indépendamment, un allèle étant “dominant”. La zygosité , degré de similitude des allèles d’un organisme, peut affecter la dominance. Au sein d’un organisme diploïde, ceux-ci seraient définis par les interactions haplotypes des allèles. L’haploïdie génique peut se traduire par un seul allèle fonctionnel produisant suffisamment de protéines pour produire un phénotype identique à celui de l’homozygote [19] . Trois types généraux d’interactions d’haplotypes sont possibles :
- Haplosuffisance. Chez un diploïde, un allèle fonctionnel d’un gène haplosuffisant serait considéré comme dominant, tandis qu’un allèle non fonctionnel serait considéré comme récessif. [20]Par exemple, supposons que la quantité standard d’enzyme produite dans l’homozygote fonctionnel soit de 100 %, les deux allèles fonctionnels contribuant à 50 % chacun. L’allèle fonctionnel unique chez l’Hétérozygote produit 50% de la quantité standard d’enzyme, ce qui est suffisant pour produire le phénotype standard. Si l’Hétérozygote et l’homozygote à allèle fonctionnel ont des phénotypes identiques, l’allèle fonctionnel est dominant par rapport à l’allèle non fonctionnel. Cela se produit au locus du gène albinos : l’Hétérozygote produit suffisamment d’enzyme pour convertir le précurseur du pigment en mélanine, et l’individu a une pigmentation standard. Par exemple, chez les humains et d’autres organismes, la peau non pigmentée de l’ albinosle phénotype se produit lorsqu’un individu est homozygote pour un allèle qui code une version non fonctionnelle d’une enzyme nécessaire pour produire le pigment cutané mélanine . [21]
- Haploinsuffisance incomplète. Moins fréquemment, la présence d’un seul allèle fonctionnel donne un phénotype non normal, mais moins sévère, que celui de l’homozygote non fonctionnel. Cela se produit lorsque l’allèle fonctionnel n’est pas haplo-suffisant, ainsi les termes haplo-insuffisance et dominance incomplète sont généralement appliqués à ces cas. L’interaction intermédiaire se produit lorsque le génotype Hétérozygote produit un phénotype intermédiaire entre les deux homozygotes. Selon lequel des deux homozygotes l’Hétérozygote ressemble le plus, on dit qu’un allèle montre une dominance incomplète sur l’autre. Par exemple, chez l’homme, le locus du gène Hb est responsable de la protéine de la chaîne bêta ( HBB ) qui est l’une des deux protéines de la globineprotéines qui composent le pigment sanguin hémoglobine . De nombreuses personnes sont homozygotes pour un allèle appelé Hb A ; certaines personnes portent un allèle alternatif appelé Hb S , soit en tant qu’homozygotes, soit en tant qu’hétérozygotes. Les molécules d’hémoglobine des homozygotes Hb S / Hb S subissent un changement de forme qui déforme la morphologie des globules rouges et provoque une forme d’ anémie grave et potentiellement mortelle appelée anémie falciforme . Les personnes hétérozygotes Hb A / Hb S pour cet allèle présentent une forme d’anémie beaucoup moins sévère appeléetrait drépanocytaire . Étant donné que le phénotype de la maladie des hétérozygotes Hb A / Hb S est plus similaire mais pas identique à l’ homozygote Hb A / Hb A , l’allèle Hb A est dit incomplètement dominant par rapport à l’ allèle Hb S. [22]
- Haploinsuffisance complète.Un seul allèle fonctionnel chez l’Hétérozygote peut produire un produit génique insuffisant pour toute fonction du gène, ce qui fait que les allèles généralement non fonctionnels deviennent dominants. Le phénotype ressemblera alors à celui d’un homozygote avec un allèle non fonctionnel au lieu du type sauvage. L’allèle non fonctionnel serait dit être dominant par rapport à l’allèle fonctionnel du phénotype de type sauvage. Cette situation peut se produire lorsque l’allèle non fonctionnel produit une protéine défectueuse qui interfère avec le bon fonctionnement de la protéine produite par l’allèle standard. La présence de la protéine défectueuse “domine” la protéine standard, et le phénotype de la maladie de l’Hétérozygote ressemble plus étroitement à celui de l’homozygote pour deux allèles défectueux. Le terme “dominant” est souvent incorrectement appliqué aux allèles défectueux dont le phénotype homozygote n’a pas été examiné, mais qui provoquent un phénotype distinct lorsqu’ils sont hétérozygotes avec l’allèle normal. Ce phénomène se produit dans plusieursles maladies à répétition trinucléotidique , un exemple étant la maladie de Huntington . Dans la maladie de Huntington, l’haploinsuffisance complète provoque l’effet dominant de la protéine mutante. Normalement, une personne a environ 20 répétitions de nucléotides CAG dans son gène HTT, mais les personnes atteintes de la maladie de Huntington ont plus de 40 répétitions CAG. [23] Un autre exemple est le syndrome de Marfan, un trouble héréditaire du tissu conjonctif, causé par une mutation du gène de la fibrilline-1 (FBN1). Une copie normale du gène FBN1 est héritée d’un parent tandis qu’une copie dominante anormale du gène FBN1 est héritée d’un autre parent. [24]
Mutations dominantes négatives
De nombreuses protéines sont normalement actives sous la forme d’un multimère, un agrégat de plusieurs copies de la même protéine, également appelée protéine homomultimérique ou protéine homooligomérique . En fait, la majorité des 83 000 enzymes différentes provenant de 9 800 organismes différents dans la base de données d’enzymes BRENDA [25] représentent des homooligomères. [26] Lorsque la version de type sauvage de la protéine est présente avec une version mutante, un multimère mixte peut être formé. Une mutation qui conduit à une protéine mutante qui perturbe l’activité de la protéine de type sauvage dans le multimère est une mutation dominante-négative.
Une mutation dominante négative peut survenir dans une cellule somatique humaine et fournir un avantage prolifératif à la cellule mutante, conduisant à son expansion clonale. Par exemple, une mutation dominante négative dans un gène nécessaire au processus normal de mort cellulaire programmée ( apoptose ) en réponse à des dommages à l’ADN peut rendre la cellule résistante à l’apoptose. Cela permettra la prolifération du clone même en cas de dommages excessifs à l’ADN. De telles mutations dominantes négatives se produisent dans le gène suppresseur de tumeur p53 . [27] [28] La protéine de type sauvage P53 est normalement présente sous la forme d’un multimère à quatre protéines (oligotétramère). Dominant-négatif p53des mutations se produisent dans un certain nombre de types différents de cancer et de lésions précancéreuses (par exemple, les tumeurs cérébrales, le cancer du sein, les lésions précancéreuses orales et le cancer de la bouche). [27]
Des mutations dominantes négatives se produisent également dans d’autres Gènes suppresseurs de tumeurs. Par exemple, deux mutations de la lignée germinale dominante négative ont été identifiées dans le gène muté de l’ataxie télangiectasie (ATM) qui augmente la susceptibilité au cancer du sein. [29] Des mutations négatives dominantes du facteur de transcription C/EBPα peuvent provoquer une leucémie myéloïde aiguë. [30] Les mutations négatives dominantes héritées peuvent également augmenter le risque de maladies autres que le cancer. Les mutations dominantes négatives du récepteur gamma activé par les proliférateurs de peroxysomes (PPARγ) sont associées à une résistance sévère à l’insuline, au diabète sucré et à l’hypertension. [31]
Des mutations dominantes négatives ont également été décrites dans des organismes autres que l’homme. En fait, la première étude rapportant une protéine mutante inhibant la fonction normale d’une protéine de type sauvage dans un multimère mixte concernait la protéine GP37 de la fibre de queue du bactériophage T4. [32] Les mutations qui produisent une protéine tronquée plutôt qu’une protéine mutante de pleine longueur semblent avoir l’effet négatif dominant le plus fort dans les études de P53, ATM, C/EBPα et du bactériophage T4 GP37.
-
![]()
![]()
Les défauts héréditaires des enzymes sont généralement hérités de manière autosomique car il y a plus de chromosomes non X que de chromosomes X, et de manière récessive car les enzymes des Gènes non affectés sont généralement suffisantes pour prévenir les symptômes chez les porteurs. Les exceptions incluent les cas d’ haploinsuffisance , où le gène non affecté ne peut pas compenser celui qui est affecté.
-
![]()
![]()
D’autre part, les défauts héréditaires des protéines structurelles (comme l’ ostéogenèse imparfaite , le syndrome de Marfan et les syndromes d’ Ehlers -Danlos ) sont généralement autosomiques dominants, car il suffit que certains composants soient défectueux pour rendre toute la structure dysfonctionnelle. Il s’agit d’un processus dominant négatif, dans lequel un produit génique muté affecte négativement le produit génique non muté dans la même cellule.
Maladies génétiques dominantes et récessives chez l’homme
Chez l’homme, de nombreux traits génétiques ou maladies sont classés simplement comme “dominants” ou “récessifs”. Notamment avec les maladies dites récessives, qui sont bien un facteur de Gènes récessifs, mais qui peuvent simplifier à l’extrême les bases moléculaires sous-jacentes et conduire à une méconnaissance de la nature de la dominance.
Par exemple, la maladie génétique récessive phénylcétonurie (PCU) [33] résulte d’un grand nombre (> 60) d’allèles au locus du gène de l’enzyme phénylalanine hydroxylase ( PAH ). [34] Beaucoup de ces allèles produisent peu ou pas de HAP , ce qui a pour conséquence que le substrat phénylalanine (Phe) et ses sous-produits métaboliques s’accumulent dans le système nerveux central et peuvent provoquer une déficience intellectuelle grave s’ils ne sont pas traités.
Pour illustrer ces nuances, les Génotypes et les conséquences phénotypiques des interactions entre trois allèles hypothétiques de HAP sont présentés dans le tableau suivant : [35]
| Génotype | Activité des HAP | [ Phe ] concentré | PCU ? |
|---|---|---|---|
| AA | 100% | 60 μM | Non |
| UN B | 30% | 120 μM | Non |
| CC | 5% | 200 ~ 300 μM | Hyperphénylalaninémie |
| BB | 0,3 % | 600 ~ 2400 μM | Oui |
Chez les personnes non atteintes homozygotes pour un allèle fonctionnel standard ( AA ), l’activité du PAH est standard (100 %) et la concentration de phénylalanine dans le sang [ Phe ] est d’environ 60 μM (= μmol/L ). Chez les personnes non traitées homozygotes pour l’un des allèles PCU ( BB ), l’activité PAH est proche de zéro, [Phe] dix à quarante fois la norme, et l’individu manifeste la PCU.
Chez l’ Hétérozygote AB , l’activité PAH n’est que de 30 % (et non 50 %) de la norme, la [ Phe ] sanguine est multipliée par deux et la personne ne manifeste pas de PCU. Ainsi, l’ allèle A est dominant par rapport à l’ allèle B par rapport à la PCU, mais l’ allèle B est incomplètement dominant par rapport à l’ allèle A par rapport à son effet moléculaire, détermination du niveau d’activité PAH (0,3 % < 30 % << 100 %) . Enfin, l’ allèle A est incomplètement dominant sur le Ballèle par rapport à [Phe], comme 60 μM < 120 μM << 600 μM. Notez une fois de plus qu’il n’est pas pertinent pour la question de dominance que l’allèle récessif produise un phénotype [Phe] plus extrême.
Pour un troisième allèle C , un homozygote CC produit une très petite quantité d’enzyme PAH , ce qui entraîne un taux quelque peu élevé de [ Phe ] dans le sang, une affection appelée hyperphénylalaninémie , qui n’entraîne pas de déficience intellectuelle.
C’est-à-dire que les relations de dominance de deux allèles quelconques peuvent varier selon l’aspect du phénotype considéré. Il est généralement plus utile de parler des conséquences phénotypiques des interactions alléliques impliquées dans n’importe quel génotype, plutôt que d’essayer de les forcer dans des catégories dominantes et récessives.
Voir également
- Dominance ambidirectionnelle
- Liste des traits mendéliens chez l’homme
- ADN mitochondrial
- Place Punnett
Références
- ^ “dominance” . Dictionnaires Oxford en ligne . Presse universitaire d’Oxford . Récupéré le 14 mai 2014 .
- ^ “exprimer” . Dictionnaires Oxford en ligne . Presse universitaire d’Oxford . Récupéré le 14 mai 2014 .
- ^ Griffiths AJF; Gelbart WM; Miller JH; et coll. (1999). “L’interaction génique conduit à des rapports dihybrides modifiés” . Analyse génétique moderne . New York : WH Freeman & Company. ISBN 978-0-7167-3118-4.
- ^ Mayo, O. et Bürger, R. 1997. L’évolution de la dominance : Une théorie dont le temps est révolu ? “Revues biologiques”, volume 72, numéro 1, pp. 97–110
- ^ Bourguet, D. 1999. L’évolution de l’ hérédité de dominance , Volume 83, Numéro 1, pp. 1–4
- ^ Bagheri, HC 2006. Limites non résolues de la théorie de l’évolution et la question de l’évolution des systèmes d’héritage: 75 ans de débat sur l’évolution de la dominance “Journal of Experimental Zoology Part B: Molecular and Developmental Evolution”, Volume 306B, Numéro 4, pp 329–359
- ^ Ridley, Matt (1999). “Maladie” . Génome : l’autobiographie d’une espèce en 23 chapitres . Harper Collins. p. 136–146. ISBN 978-0-06-089408-5.
- ^ Roi, RC; et coll. (2006). Un dictionnaire de génétique (7e éd.). Presse universitaire d’Oxford. p. 129. ISBN 978-0-19-530761-0. La dominance [fait référence] aux allèles qui manifestent pleinement leur phénotype lorsqu’ils sont présents à l’ état Hétérozygote ….
- ^ Pennington, Sandra (1999). 11e heure : Introduction à la génétique . Wiley. p. 43. ISBN 978-0-632-04438-2.
- ^ Dominante . Génome.gov. (sd). Extrait le 29 mars 2022 de https://www.genome.gov/genetics-glossary/Dominant
- ^ Allchin, D. (2005). Le dilemme de la domination. Biologie & Philosophie, 20 (2-3), 427-451. doi : http://dx.doi.org/10.1007/s10539-005-2561-z
- ^ [1] , “Lignes directrices en ligne pour la nomenclature des Gènes, des marqueurs génétiques, des allèles et des mutations chez la souris et le rat”
- ^ [2] , En ligne ‘Une norme pour la nomenclature génétique du maïs’
- ^ “Couleur de manteau de chat” . Laboratoire de génétique vétérinaire, Université de Californie. Archivé de l’original le 19/05/2012 . Récupéré le 02/11/2011 .
- ^ Imes, DL; Geary, LA ; Grahn, RA; Lyons, LA (avril 2006). “L’albinisme chez le chat domestique ( Felis catus ) est associé à une mutation de la tyrosinase ( TYR )” . Génétique animale . 37 (2): 175–8. doi : 10.1111/j.1365-2052.2005.01409.x . PMC 1464423 . PMID 16573534 .
- ^ Schmidt-Küntzel, A.; Eizirik, E.; O’Brien, SJ; Menotti-Raymond, M. (avril 2005). “La tyrosinase et les allèles de la protéine 1 apparentée à la tyrosinase spécifient les phénotypes de couleur de pelage du chat domestique des loci albinos et bruns” . Journal de l’Hérédité . 96 (4): 289–301. doi : 10.1093/jhered/esi066 . PMID 15858157 .
- ^ Carr, Steven M. “Extensions à l’analyse mendélienne” . Université Memorial de Terre-Neuve.
- ^ Kasser, Henrik; Brûlures, James A (1981-03-01). “LA BASE MOLÉCULAIRE DE LA DOMINANCE” . Génétique . 97 (3–4): 639–666. doi : 10.1093/genetics/97.3-4.639 . ISSN 1943-2631 .
- ^ Encyclopédie du cancer . M. Schwab (2e éd.). Berlin : Springer. 2009. ISBN 978-3-540-47648-1. OCLC 656366443 .{{cite book}}: CS1 maint: others (link)
- ^ “https://www.cancer.gov/publications/dictionaries/genetics-dictionary/def/haploinsufficiency” . www.cancer.gov . 2012-07-20 . Récupéré le 28/04/2022 . {{cite web}}: Lien externe dans |title=( aide )
- ^ Federico, Justin R.; Krishnamurthy, Karthik (19 avril 2022). StatPearls . Édition StatPearls. PMID 30085560 – via PubMed.
- ^ Steinberg, MH, & Sebastiani, P. (2012). Modificateurs génétiques de la drépanocytose. Journal américain d’hématologie , 87 (8), 795–803. https://doi.org/10.1002/ajh.23232
- ^ Shin, JW, Kim, K.-H., Chao, MJ, Atwal, RS, Gillis, T., MacDonald, ME, Gusella, JF et Lee, J.-M. (2016, 15 septembre). Inactivation permanente de la mutation de la maladie de Huntington par CRISPR/Cas9 allèle spécifique personnalisé . OUP Académique. Extrait le 4 mars 2022 de https://academic.oup.com/hmg/article/25/20/4566/2525895
- ^ Nancy Garrick, directrice adjointe (2017-04-11). “Syndrome de Marfan” . Institut national de l’arthrite et des maladies musculo-squelettiques et cutanées . Récupéré le 18/03/2022 .
- ^ Schomburg I; Chang A ; Ebeling C; et coll. (janvier 2004). « BRENDA, la base de données enzymatiques : mises à jour et nouveautés majeures » . Nucleic Acids Res . 32 (numéro de la base de données) : D431–3. doi : 10.1093/nar/gkh081 . PMC 308815 . PMID 14681450 .
- ^ Hashimoto K; Nishi H; Bryant S; Panchenko AR (juin 2011). « Pris en auto-interaction : mécanismes évolutifs et fonctionnels de l’homoligomérisation des protéines » . Phys Biol . 8 (3) : 035007. Bibcode : 2011PhBio…8c5007H . doi : 10.1088/1478-3975/8/3/035007 . PMC 3148176 . PMID 21572178 .
- ^ un b Marutani M; Tonoki H; Tada M; et coll. (octobre 1999). “Mutations dominantes négatives du suppresseur de tumeur p53 relatives à l’apparition précoce du glioblastome multiforme” . Cancer Res . 59 (19): 4765–9. PMID 10519380 .
- ^ Goh AM; Cofill CR ; Lane DP (janvier 2011). “Le rôle du mutant p53 dans le cancer humain” . J. Pathol . 223 (2) : 116–126. doi : 10.1002/chemin.2784 . PMID 21125670 . S2CID 23998813 .
- ^ Chenevix-Tranchée G; Spurdle AB; Gatei M; et coll. (février 2002). « Mutations ATM négatives dominantes dans les familles de cancer du sein » . J. Natl. Institut du cancer . 94 (3): 205–215. doi : 10.1093/jnci/94.3.205 . PMID 11830610 .
- ^ Pabst T; Müller BU ; Zhang P; et coll. (mars 2001). “Mutations dominantes négatives de CEBPA, codant pour la protéine de liaison CCAAT/enhancer-alpha (C/EBPalpha), dans la leucémie myéloïde aiguë”. Nat. Genet . 27 (3): 263-270. doi : 10.1038/85820 . PMID 11242107 . S2CID 33788907 .
- ^ Barroso I; Gurnell M; Crowley VE ; et coll. (1999). « Mutations négatives dominantes dans le PPARgamma humain associées à une résistance à l’insuline sévère, au diabète sucré et à l’hypertension ». Nature . 402 (6764): 880–3. Bibcode : 1999Natur.402..880B . doi : 10.1038/47254 . PMID 10622252 . S2CID 4423555 .
- ^ Bernstein H; Fisher KM (mars 1968). “Dominance dans le bactériophage T4D” . Génétique . 58 (3): 307–318. doi : 10.1093/genetics/58.3.307 . PMC 1211863 . PMID 5662621 .
- ^ Héritage mendélien en ligne chez l’homme (OMIM): hyperphénylalaninémie, non PCU légère – 261600
- ^ Héritage mendélien en ligne chez l’homme (OMIM): Phénylalanine Hydroxylase; HAP – 612349
- ^ Carr, Steven M. “Un gène, une enzyme” . Université Memorial de Terre-Neuve.
- “Notes en ligne pour Biologie 2250 – Principes de génétique” . Université Memorial de Terre-Neuve.
- Hérédité mendélienne en ligne chez l’homme (OMIM) : hémoglobine—locus bêta ; HBB – 141900 — Anémie falciforme
- Héritage mendélien en ligne chez l’homme (OMIM) : ABO Glycosyltransférase – 110300 — Groupes sanguins ABO
Liens externes
- “L’héritage mendélien en ligne chez l’homme” (OMIM)
- “Dominance autosomique de la maladie de Huntington” . Projet de sensibilisation à la maladie de Huntington pour l’éducation à Stanford