Champignon
Un champignon ( pluriel : champignons [2] ou champignons [3] ) est tout membre du groupe d’ organismes eucaryotes qui comprend des micro-organismes tels que les levures et les moisissures , ainsi que les champignons plus familiers . Ces organismes sont classés comme un royaume , [4] séparément des autres royaumes eucaryotes, qui, selon une classification traditionnelle, incluent Plantae , Animalia , Protozoa et Chromista .
| Champignons Plage temporelle : Début du Dévonien – Présent (mais voir le texte ) 410–0 Ma PréꞒ Ꞓ O S ré C P J J K Pg N |
|
|---|---|
 |
|
Dans le sens des aiguilles d’une montre à partir du haut à gauche :
|
|
| Classement scientifique |
|
| (non classé): | Opisthokonta |
| (non classé): | Holomycota |
| (non classé): | Zoosporie |
| Royaume: | Champignons ( L. ) RTMoore [1] |
| Sous-royaumes / Phyla | |
|
Une caractéristique qui place les champignons dans un règne différent des plantes, des bactéries et de certains protistes est la chitine dans leurs parois cellulaires . Les champignons, comme les animaux, sont des hétérotrophes ; ils acquièrent leur nourriture en absorbant des molécules dissoutes, généralement en sécrétant des enzymes digestives dans leur environnement. Les champignons ne font pas de photosynthèse . La croissance est leur moyen de mobilité , à l’exception des spores (dont quelques-unes sont flagellées ), qui peuvent voyager dans l’air ou dans l’eau. Les champignons sont les principaux décomposeurs des systèmes écologiques. Ces différences et d’autres placent les champignons dans un seul groupe d’organismes apparentés, nommé leEumycota ( vrais champignons ou Eumycètes ), qui partagent un ancêtre commun (c’est-à-dire qu’ils forment un groupe monophylétique ), une interprétation également fortement soutenue par la phylogénétique moléculaire . Ce groupe fongique est distinct des myxomycètes (moisissures visqueuses) et des oomycètes (moisissures aquatiques) structurellement similaires. La discipline de la biologie consacrée à l’étude des champignons est connue sous le nom de mycologie (du grec μύκης mykes , champignon). Autrefois, la mycologie était considérée comme une branche de la botanique, bien qu’il soit maintenant connu que les champignons sont génétiquement plus étroitement liés aux animaux qu’aux plantes.
Abondants dans le monde, la plupart des champignons sont discrets en raison de la petite taille de leurs structures et de leurs modes de vie cryptiques dans le sol ou sur la matière morte. Les champignons comprennent des symbiotes de plantes, d’animaux ou d’autres champignons ainsi que des Parasites . Ils peuvent devenir visibles lors de la fructification , sous forme de champignons ou de moisissures. Les champignons jouent un rôle essentiel dans la décomposition de la matière organique et jouent un rôle fondamental dans le cycle et l’échange des nutriments dans l’environnement. Ils ont longtemps été utilisés comme source directe d’alimentation humaine, sous forme de champignons et de truffes ; comme agent levant pour le pain; et dans la fermentationde divers produits alimentaires, tels que le vin , la bière et la sauce soja . Depuis les années 1940, les champignons sont utilisés pour la production d’ antibiotiques , et, plus récemment, diverses enzymes produites par les champignons sont utilisées industriellement et dans les détergents . Les champignons sont également utilisés comme pesticides biologiques pour lutter contre les mauvaises herbes, les maladies des plantes et les insectes nuisibles. De nombreuses espèces produisent des composés bioactifs appelés mycotoxines , tels que des alcaloïdes et des polycétides , qui sont toxiques pour les animaux, y compris les humains. Les structures fructifères de quelques espècescontiennent des composés psychotropes et sont consommés à des fins récréatives ou lors de cérémonies spirituelles traditionnelles . Les champignons peuvent décomposer les matériaux manufacturés et les bâtiments et devenir des agents pathogènes importants pour les humains et les autres animaux. Les pertes de récoltes dues aux maladies fongiques (par exemple, la pyriculariose ) ou à la détérioration des aliments peuvent avoir un impact important sur l’ approvisionnement alimentaire humain et les économies locales.
Le royaume des champignons englobe une énorme diversité de taxons avec des écologies variées, des stratégies de cycle de vie et des morphologies allant des chytrides aquatiques unicellulaires aux grands champignons. Cependant, on sait peu de choses sur la véritable biodiversité de Kingdom Fungi, qui a été estimée entre 2,2 et 3,8 millions d’espèces. [5] Parmi ceux-ci, seulement environ 148 000 ont été décrits, [6] avec plus de 8 000 espèces connues pour être nuisibles aux plantes et au moins 300 qui peuvent être pathogènes pour les humains. [7] Depuis les travaux taxonomiques pionniers des XVIIIe et XIXe siècles de Carl Linnaeus ,Christiaan Hendrik Persoon et Elias Magnus Fries , les champignons ont été classés en fonction de leur morphologie (par exemple, des caractéristiques telles que la couleur des spores ou des caractéristiques microscopiques) ou leur physiologie . Les progrès de la génétique moléculaire ont ouvert la voie à l’intégration de l’analyse de l’ADN dans la taxonomie, ce qui a parfois remis en question les regroupements historiques basés sur la morphologie et d’autres traits. Les études phylogénétiques publiées dans la première décennie du 21e siècle ont contribué à remodeler la classification au sein du royaume des champignons, qui est divisé en un sous- royaume , sept phylums et dix sous-phylums.
Étymologie
Le mot anglais fungus est directement adopté du latin fungus (champignon), utilisé dans les écrits d’ Horace et de Pline . [8] Celui-ci est à son tour dérivé du mot grec sphongos (σφόγγος « éponge »), qui fait référence aux structures macroscopiques et à la morphologie des champignons et des moisissures ; [9] la racine est également utilisée dans d’autres langues, telles que l’allemand Schwamm (« éponge ») et Schimmel (« moule »). [dix]
Le mot mycologie est dérivé du grec mykes (μύκης « champignon ») et logos (λόγος « discours »). [11] Il désigne l’étude scientifique des champignons. La forme adjectivale latine de « mycologie » ( mycologicæ ) apparaît dès 1796 dans un livre sur le sujet de Christiaan Hendrik Persoon . [12] Le mot est apparu en anglais dès 1824 dans un livre de Robert Kaye Greville . [13] En 1836, la publication du naturaliste anglais Miles Joseph Berkeley , The English Flora of Sir James Edward Smith, Vol. 5. désigne également la mycologie comme l’étude des champignons. [9][14]
Un groupe de tous les champignons présents dans une région particulière est connu sous le nom de mycobiote (nom pluriel, pas de singulier). [15] Le terme mycota est souvent utilisé à cette fin, mais de nombreux auteurs l’utilisent comme synonyme de Fungi. Le mot champignon a été proposé comme un terme moins ambigu similaire à celui de la faune et de la flore . [16] La Commission de la sauvegarde des espèces (SSC) de l’ Union internationale pour la conservation de la nature (UICN) a demandé en août 2021 que l’expression faune et flore soit remplacée par faune, flore et champignons . [17]
Les caractéristiques

 Cellules d’hyphes fongiques
Cellules d’hyphes fongiques
- Paroi hyphale
- Septum
- Mitochondrie
- Vacuole
- Cristal d’ergostérol
- Ribosome
- Noyau
- Réticulum endoplasmique
- Corps lipidique
- Membrane plasma
- Spitzenkörper
- Appareil de Golgi

 Cycle cellulaire fongique montrant les dicaryons typiques des champignons supérieurs
Cycle cellulaire fongique montrant les dicaryons typiques des champignons supérieurs
Avant l’introduction de méthodes moléculaires pour l’analyse phylogénétique, les taxonomistes considéraient les champignons comme des membres du règne végétal en raison de similitudes dans leur mode de vie : les champignons et les plantes sont principalement immobiles et présentent des similitudes dans la morphologie générale et l’habitat de croissance. Comme les plantes, les champignons poussent souvent dans le sol et, dans le cas des champignons , forment des fructifications bien visibles , qui ressemblent parfois à des plantes telles que les mousses . Les champignons sont désormais considérés comme un royaume à part, distinct à la fois des plantes et des animaux, dont ils semblent avoir divergé il y a environ un milliard d’années (autour du début du Néoprotérozoïque) .Ère). [18] [19] Certaines caractéristiques morphologiques, biochimiques et génétiques sont partagées avec d’autres organismes, tandis que d’autres sont uniques aux champignons, les séparant clairement des autres règnes :
Fonctionnalités partagées :
- Avec d’autres eucaryotes : Les cellules fongiques contiennent des noyaux liés à la membrane avec des chromosomes qui contiennent de l’ADN avec des régions non codantes appelées introns et des régions codantes appelées exons . Les champignons ont des organites cytoplasmiques liés à la membrane tels que les mitochondries , les membranes contenant des stérols et les ribosomes de type 80S . [20] Ils ont une gamme caractéristique de glucides solubles et de composés de stockage, y compris les alcools de sucre (par exemple, le mannitol ),disaccharides , (par exemple, tréhalose ) et polysaccharides (par exemple, glycogène , qui se trouve également chez les animaux [21] ).
- Avec les animaux : Les champignons manquent de chloroplastes et sont des organismes hétérotrophes et ont donc besoin de composés organiques préformés comme sources d’énergie. [22]
- Avec les plantes : Les champignons ont une paroi cellulaire [23] et des vacuoles . [24] Ils se reproduisent à la fois par des moyens sexués et asexués, et comme les groupes de plantes basales (tels que les fougères et les mousses ) produisent des spores . Semblables aux mousses et aux algues, les champignons ont généralement des noyaux haploïdes . [25]
- Avec les euglénoïdes et les bactéries : les champignons supérieurs, les euglénoïdes et certaines bactéries produisent l’ acide aminé L -lysine lors d’étapes de biosynthèse spécifiques , appelées voie de l’ α-aminoadipate . [26] [27]
- Les cellules de la plupart des champignons se développent sous forme de structures tubulaires, allongées et filiformes (filamenteuses) appelées hyphes , qui peuvent contenir plusieurs noyaux et s’étendre en se développant à leurs extrémités. Chaque pointe contient un ensemble de vésicules agrégées – des structures cellulaires constituées de protéines , de lipides et d’autres molécules organiques – appelées Spitzenkörper . [28] Les champignons et les oomycètes se développent sous forme de cellules hyphales filamenteuses. [29] En revanche, des organismes d’apparence similaire, tels que les algues vertes filamenteuses , se développent par division cellulaire répétée au sein d’une chaîne de cellules. [21] Il existe aussi des champignons unicellulaires ( levures) qui ne forment pas d’hyphes, et certains champignons ont à la fois des formes d’hyphes et de levures. [30]
- En commun avec certaines espèces végétales et animales, plus de 70 espèces fongiques présentent une bioluminescence . [31]
Caractéristiques uniques:
- Certaines espèces poussent sous forme de levures unicellulaires qui se reproduisent par bourgeonnement ou fission . Les champignons dimorphes peuvent basculer entre une phase de levure et une phase hyphale en réponse aux conditions environnementales. [30]
- La paroi cellulaire fongique est constituée de glucanes et de chitine ; alors que les glucanes se trouvent également dans les plantes et la chitine dans l’ exosquelette des arthropodes , [32] les champignons sont les seuls organismes qui combinent ces deux molécules structurelles dans leur paroi cellulaire. Contrairement à celles des plantes et des oomycètes, les parois cellulaires des champignons ne contiennent pas de cellulose. [33] [34]

 Omphalotus nidiformis , un champignon bioluminescent
Omphalotus nidiformis , un champignon bioluminescent
La plupart des champignons n’ont pas de système efficace pour le transport à longue distance de l’eau et des nutriments, comme le xylème et le phloème de nombreuses plantes. Pour surmonter cette limitation, certains champignons, tels que Armillaria , forment des rhizomorphes , [35] qui ressemblent et remplissent des fonctions similaires aux racines des plantes. En tant qu’eucaryotes, les champignons possèdent une voie de biosynthèse pour produire des terpènes qui utilise l’acide mévalonique et le pyrophosphate comme blocs de construction chimiques . [36]Les plantes et certains autres organismes ont une voie supplémentaire de biosynthèse des terpènes dans leurs chloroplastes, une structure que les champignons et les animaux n’ont pas. [37] Les champignons produisent plusieurs métabolites secondaires dont la structure est similaire ou identique à ceux fabriqués par les plantes. [36] De nombreuses enzymes végétales et fongiques qui fabriquent ces composés diffèrent les unes des autres par leur séquence et d’autres caractéristiques, ce qui indique des origines distinctes et une évolution convergente de ces enzymes dans les champignons et les plantes. [36] [38]
Diversité


Les champignons ont une distribution mondiale et poussent dans un large éventail d’habitats, y compris des environnements extrêmes tels que les déserts ou les zones à fortes concentrations de sel [39] ou de rayonnement ionisant , [40] ainsi que dans les sédiments marins profonds. [41] Certains peuvent survivre aux intenses rayons UV et cosmiques rencontrés lors des voyages spatiaux. [42] La plupart poussent dans des environnements terrestres, bien que plusieurs espèces vivent partiellement ou uniquement dans des habitats aquatiques, comme les champignons chytrides Batrachochytrium dendrobatidis et B. salamandrivorans , parasitesresponsables du déclin mondial des populations d’ amphibiens . Ces organismes passent une partie de leur cycle de vie en tant que zoospore mobile , leur permettant de se propulser dans l’eau et d’entrer dans leur hôte amphibien. [43] D’autres exemples de champignons aquatiques incluent ceux qui vivent dans les zones hydrothermales de l’océan. [44]
En 2020, environ 148 000 espèces de champignons ont été décrites par les taxonomistes , [6] mais la biodiversité mondiale du royaume des champignons n’est pas entièrement comprise. [45] Une estimation de 2017 suggère qu’il pourrait y avoir entre 2,2 et 3,8 millions d’espèces. [5] Le nombre de nouvelles espèces de champignons découvertes chaque année est passé de 1 000 à 1 500 par an il y a environ 10 ans, à environ 2 000 avec un pic de plus de 2 500 espèces en 2016. En 2019, 1 882 nouvelles espèces de champignons ont été décrites. , et il a été estimé que plus de 90% des champignons restent inconnus. [6] En mycologie, les espèces ont historiquement été distinguées par une variété de méthodes et de concepts. Classification basée sur la morphologiecaractéristiques, telles que la taille et la forme des spores ou des structures de fructification, a traditionnellement dominé la taxonomie fongique. [46] Les espèces peuvent également être distinguées par leurs caractéristiques biochimiques et physiologiques , telles que leur capacité à métaboliser certains produits biochimiques ou leur réaction aux tests chimiques . Le concept d’espèce biologique discrimine les espèces en fonction de leur capacité à s’accoupler . L’application d’ outils moléculaires , tels que le séquençage de l’ADN et l’analyse phylogénétique, pour étudier la diversité a considérablement amélioré la résolution et la robustesse des estimations de la diversité génétiqueau sein de divers groupes taxonomiques. [47]
Mycologie

 En 1729, Pier Antonio Micheli a publié pour la première fois des descriptions de champignons.
En 1729, Pier Antonio Micheli a publié pour la première fois des descriptions de champignons.
La mycologie est la branche de la biologie concernée par l’étude systématique des champignons, y compris leurs propriétés génétiques et biochimiques, leur taxonomie et leur utilisation par l’homme comme source de médicaments, de nourriture et de substances psychotropes consommées à des fins religieuses, ainsi que leurs dangers. , comme un empoisonnement ou une infection. Le domaine de la phytopathologie , l’étude des maladies des plantes, est étroitement lié car de nombreux agents pathogènes des plantes sont des champignons. [48]
L’utilisation des champignons par l’homme remonte à la préhistoire ; Ötzi the Iceman , une momie bien conservée d’un homme néolithique de 5 300 ans retrouvé congelé dans les Alpes autrichiennes, transportait deux espèces de champignons polypores qui auraient pu être utilisés comme amadou ( Fomes fomentarius ) ou à des fins médicinales ( Piptoporus betulinus ). [49] Les peuples anciens ont utilisé les champignons comme sources de nourriture – souvent sans le savoir – pendant des millénaires, dans la préparation de pain au levain et de jus fermentés. Certains des documents écrits les plus anciens contiennent des références à la destruction de cultures qui ont probablement été causées par des champignons pathogènes. [50]
Histoire
La mycologie est une science relativement nouvelle qui est devenue systématique après le développement du microscope au 17ème siècle. Bien que les spores fongiques aient été observées pour la première fois par Giambattista della Porta en 1588, le travail fondateur dans le développement de la mycologie est considéré comme la publication de l’ouvrage Nova plantarum genres de Pier Antonio Micheli en 1729 . [51] Micheli a non seulement observé des spores, mais a également montré que, dans des conditions appropriées, elles pouvaient être amenées à se développer dans la même espèce de champignons dont elles provenaient. [52] Étendre l’utilisation du système binomial de nomenclature introduit par Carl Linnaeus dans sonSpecies plantarum (1753), le hollandais Christiaan Hendrik Persoon (1761–1836) a établi la première classification des champignons avec une telle habileté qu’il est considéré comme un fondateur de la mycologie moderne. Plus tard, Elias Magnus Fries (1794–1878) a approfondi la classification des champignons, en utilisant la couleur des spores et les caractéristiques microscopiques, méthodes encore utilisées par les taxonomistes aujourd’hui. Parmi les autres premiers contributeurs notables à la mycologie aux XVIIe-XIXe et début du XXe siècles, citons Miles Joseph Berkeley , August Carl Joseph Corda , Anton de Bary , les frères Louis René et Charles Tulasne , Arthur HR Buller ,Curtis G. Lloyd , et Pier Andrea Saccardo . Aux 20e et 21e siècles, les progrès de la biochimie , de la génétique , de la biologie moléculaire , de la biotechnologie , du séquençage de l’ADN et de l’analyse phylogénétique ont fourni de nouvelles informations sur les relations fongiques et la biodiversité , et ont remis en question les groupements traditionnels basés sur la morphologie dans la taxonomie fongique . [53]
Morphologie
Structures microscopiques
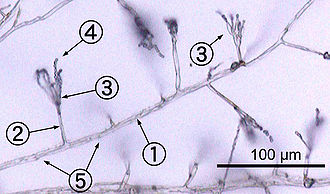
 Un isolat environnemental de Penicillium
Un isolat environnemental de Penicillium
- hyphe
- Conidiophore
- phialide
- conidies
- cloisons
La plupart des champignons poussent sous forme d’ hyphes , qui sont des structures cylindriques filiformes de 2 à 10 μm de diamètre et pouvant atteindre plusieurs centimètres de longueur. Les hyphes poussent à leurs extrémités (apex); les nouveaux hyphes sont généralement formés par l’émergence de nouvelles pointes le long des hyphes existantes par un processus appelé ramification , ou occasionnellement des pointes d’hyphes en croissance, donnant naissance à deux hyphes à croissance parallèle. [54] Les hyphes fusionnent aussi parfois lorsqu’ils entrent en contact, un processus appelé fusion hyphale (ou anastomose ). Ces processus de croissance conduisent au développement d’un mycélium , un réseau interconnecté d’hyphes. [30] Les hyphes peuvent être septés ou cénocytaires . Les hyphes septés sont divisés en compartiments séparés par des parois transversales (parois cellulaires internes, appelées septa, formées à angle droit par rapport à la paroi cellulaire donnant à l’hyphe sa forme), chaque compartiment contenant un ou plusieurs noyaux; les hyphes coenocytaires ne sont pas compartimentés. [55] Les septa ont des pores qui permettent au cytoplasme , aux organites et parfois aux noyaux de passer à travers ; un exemple est le septum dolipore chez les champignons du phylum Basidiomycota . [56] Les hyphes coenocytaires sont essentiellement des supercellules multinucléées . [57]
De nombreuses espèces ont développé des structures d’hyphes spécialisées pour l’absorption des nutriments par les hôtes vivants; les exemples incluent les haustoria chez les espèces phytoparasites de la plupart des phylums fongiques [58] et les arbuscules de plusieurs champignons mycorhiziens , qui pénètrent dans les cellules hôtes pour consommer des nutriments. [59]
Bien que les champignons soient des opisthokonts – un groupe d’organismes apparentés sur le plan de l’évolution généralement caractérisés par un seul flagelle postérieur – tous les phylums, à l’exception des chytrides , ont perdu leur flagelle postérieur. [60] Les champignons sont inhabituels parmi les eucaryotes en ce qu’ils ont une paroi cellulaire qui, en plus des glucanes (par exemple, β-1,3-glucane ) et d’autres composants typiques, contient également la chitine biopolymère . [34]
Structures macroscopiques

 Armillaria solidipes
Armillaria solidipes
Les mycéliums fongiques peuvent devenir visibles à l’œil nu, par exemple, sur diverses surfaces et substrats , tels que les murs humides et les aliments avariés, où ils sont communément appelés moisissures . Les mycéliums cultivés sur des milieux solides de gélose dans des boîtes de Pétri de laboratoire sont généralement appelés colonies . Ces colonies peuvent présenter des formes et des couleurs de croissance (dues aux spores ou à la pigmentation ) qui peuvent être utilisées comme caractéristiques diagnostiques dans l’identification d’espèces ou de groupes. [61] Certaines colonies fongiques individuelles peuvent atteindre des dimensions et des âges extraordinaires comme dans le cas d’une colonie clonale d’ Armillaria solidipes, qui s’étend sur une superficie de plus de 900 ha (3,5 miles carrés), avec un âge estimé à près de 9 000 ans. [62]
L’ apothécie – une structure spécialisée importante dans la reproduction sexuée chez les ascomycètes – est un corps fruitier en forme de coupe qui est souvent macroscopique et contient l’ hyménium , une couche de tissu contenant les cellules porteuses de spores. [63] Les fructifications des basidiomycètes ( basidiocarpes ) et de certains ascomycètes peuvent parfois devenir très gros, et beaucoup sont bien connus sous le nom de champignons .
Croissance et physiologie

 Croissance de moisissure couvrant une pêche en décomposition . Les images ont été prises à environ 12 heures d’intervalle sur une période de six jours.
Croissance de moisissure couvrant une pêche en décomposition . Les images ont été prises à environ 12 heures d’intervalle sur une période de six jours.
La croissance des champignons sous forme d’hyphes sur ou dans des substrats solides ou sous forme de cellules individuelles dans les milieux aquatiques est adaptée à l’extraction efficace des nutriments, car ces formes de croissance ont des rapports surface / volume élevés . [64] Les hyphes sont spécifiquement adaptés pour la croissance sur des surfaces solides et pour envahir les substrats et les tissus. [65] Ils peuvent exercer de grandes forces mécaniques pénétrantes; par exemple, de nombreux agents pathogènes végétaux , dont Magnaporthe grisea , forment une structure appelée appressorium qui a évolué pour perforer les tissus végétaux. [66] La pression générée par l’appressorium, dirigée contre l’ épiderme de la plante, peut dépasser 8 mégapascals (1 200 psi). [66] Le champignon filamenteux Paecilomyces lilacinus utilise une structure similaire pour pénétrer les œufs de nématodes . [67]
La pression mécanique exercée par l’appressorium est générée à partir de processus physiologiques qui augmentent la turgescence intracellulaire en produisant des osmolytes tels que le glycérol . [68] De telles adaptations sont complétées par des enzymes hydrolytiques sécrétées dans l’environnement pour digérer de grosses molécules organiques – telles que des polysaccharides , des protéines et des lipides – en molécules plus petites qui peuvent ensuite être absorbées en tant que nutriments. [69] [70] [71] La grande majorité des champignons filamenteux se développent de manière polaire (s’étendant dans une direction) par allongement à l’extrémité (apex) de l’hyphe. [72]D’autres formes de croissance fongique comprennent l’extension intercalaire (expansion longitudinale des compartiments hyphes situés sous l’apex) comme dans le cas de certains champignons endophytes [73] ou la croissance par expansion volumique lors du développement des pieds de champignons et d’autres grands organes. [74] La croissance des champignons en tant que structures multicellulaires constituées de cellules somatiques et reproductrices – une caractéristique développée indépendamment chez les animaux et les plantes [75] – a plusieurs fonctions, notamment le développement de fructifications pour la dissémination des spores sexuelles (voir ci-dessus) et des biofilms pour colonisation du substrat et communication intercellulaire .[76]
Les champignons sont traditionnellement considérés comme des hétérotrophes , des organismes qui dépendent uniquement du carbone fixé par d’autres organismes pour leur métabolisme . Les champignons ont développé un degré élevé de polyvalence métabolique qui leur permet d’utiliser une gamme variée de substrats organiques pour leur croissance, y compris des composés simples tels que le nitrate , l’ammoniac , l’ acétate ou l’ éthanol . [77] [78] Chez certaines espèces, le pigment mélanine peut jouer un rôle dans l’extraction de l’énergie du rayonnement ionisant , comme le rayonnement gamma . Cette forme de “radiotrophe”la croissance n’a été décrite que pour quelques espèces, les effets sur les taux de croissance sont faibles et les processus biophysiques et biochimiques sous-jacents ne sont pas bien connus. [40] Ce processus pourrait avoir des similitudes avec la fixation du CO 2 via la lumière visible , mais utilise à la place le rayonnement ionisant comme source d’énergie. [79]
la reproduction

 Polyporus squameux
Polyporus squameux
La reproduction fongique est complexe, reflétant les différences de modes de vie et de constitution génétique au sein de ce royaume diversifié d’organismes. [80] On estime qu’un tiers de tous les champignons se reproduisent en utilisant plus d’une méthode de propagation; par exemple, la reproduction peut se produire en deux étapes bien différenciées dans le cycle de vie d’une espèce, le téléomorphe (reproduction sexuée) et l’ anamorphe (reproduction asexuée). [81] Les conditions environnementales déclenchent des états de développement génétiquement déterminés qui conduisent à la création de structures spécialisées pour la reproduction sexuée ou asexuée. Ces structures facilitent la reproduction en dispersant efficacement les spores ou les propagules contenant des spores .
Reproduction asexuée
La reproduction asexuée se produit par l’intermédiaire de spores végétatives ( conidies ) ou par fragmentation mycélienne . La fragmentation mycélienne se produit lorsqu’un mycélium fongique se sépare en morceaux et que chaque composant se développe en un mycélium séparé. La fragmentation mycélienne et les spores végétatives maintiennent des populations clonales adaptées à une niche spécifique , et permettent une dispersion plus rapide que la reproduction sexuée. [82] Les “Fungi imperfecti” (champignons dépourvus du stade parfait ou sexuel) ou Deuteromycota comprennent toutes les espèces dépourvues d’un cycle sexuel observable. [83]Deuteromycota (également connu sous le nom de deutéromycètes, champignons conidiens ou champignons mitosporiques) n’est pas un clade taxonomique accepté et est maintenant considéré comme simplement des champignons qui n’ont pas de stade sexuel connu. [84]
Reproduction sexuée
La reproduction sexuée avec méiose a été directement observée dans tous les phylums fongiques à l’exception de Glomeromycota [85] (l’analyse génétique suggère également une méiose chez Glomeromycota). Elle diffère par de nombreux aspects de la reproduction sexuée chez les animaux ou les plantes. Des différences existent également entre les groupes fongiques et peuvent être utilisées pour discriminer les espèces par des différences morphologiques dans les structures sexuelles et les stratégies de reproduction. [86] [87] Des expériences d’accouplement entre des isolats fongiques peuvent identifier des espèces sur la base de concepts d’espèces biologiques. [87] Les principaux groupements fongiques ont été initialement délimités en fonction de la morphologie de leurs structures sexuelles et de leurs spores; par exemple, les structures contenant des spores, asciet les basides , peuvent être utilisées dans l’identification des ascomycètes et des basidiomycètes, respectivement. Les champignons emploient deux systèmes d’accouplement : les espèces hétérothalliques ne permettent l’accouplement qu’entre des individus de type d’accouplement opposé , tandis que les espèces homothalliques peuvent s’accoupler et se reproduire sexuellement avec n’importe quel autre individu ou avec elles-mêmes. [88]
La plupart des champignons ont à la fois un stade haploïde et un stade diploïde dans leur cycle de vie. Dans les champignons à reproduction sexuée, des individus compatibles peuvent se combiner en fusionnant leurs hyphes ensemble en un réseau interconnecté; ce processus, l’ anastomose , est nécessaire pour l’initiation du cycle sexuel. De nombreux ascomycètes et basidiomycètes passent par un stade dicaryote , dans lequel les noyaux hérités des deux parents ne se combinent pas immédiatement après la fusion cellulaire, mais restent séparés dans les cellules hyphes (voir hétérocaryose ). [89]
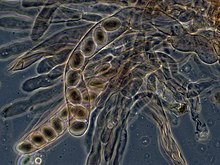
 Les asques à 8 spores de Morchella elata , vus au microscope à contraste de phase
Les asques à 8 spores de Morchella elata , vus au microscope à contraste de phase
Chez les ascomycètes, les hyphes dicaryotes de l’ hyménium (la couche de tissu porteur de spores) forment un crochet caractéristique (crozier) au niveau du septum des hyphes. Au cours de la division cellulaire , la formation du crochet assure une bonne distribution des noyaux nouvellement divisés dans les compartiments hyphes apical et basal. Un ascus ( asci au pluriel ) se forme alors, dans lequel se produit la caryogamie (fusion nucléaire). Les asques sont incrustés dans un ascocarpe , ou organe de fructification. La caryogamie des asques est suivie immédiatement par la méiose et la production d’ ascospores . Après dispersion, les ascospores peuvent germer et former un nouveau mycélium haploïde. [90]
La reproduction sexuée chez les basidiomycètes est similaire à celle des ascomycètes. Les hyphes haploïdes compatibles fusionnent pour produire un mycélium dicaryote. Cependant, la phase dicaryote est plus étendue chez les basidiomycètes, souvent également présents dans le mycélium à croissance végétative. Une structure anatomique spécialisée, appelée connexion de serrage , est formée à chaque septum hyphal. Comme pour le crochet structurellement similaire chez les ascomycètes, la connexion de serrage dans les basidiomycètes est nécessaire pour le transfert contrôlé des noyaux pendant la division cellulaire, afin de maintenir le stade dicaryote avec deux noyaux génétiquement différents dans chaque compartiment hyphe. [91] Un basidiocarpe est formé dans lequel des structures en forme de club connues sous le nom de basides génèrent des haploïdesbasidiospores après caryogamie et méiose. [92] Les basidiocarpes les plus connus sont les champignons, mais ils peuvent également prendre d’autres formes (voir section Morphologie ).
Chez les champignons anciennement classés comme Zygomycota , les hyphes haploïdes de deux individus fusionnent, formant un gamétange , une structure cellulaire spécialisée qui devient une cellule fertile productrice de gamètes . Le gamétange se développe en une zygospore , une spore à paroi épaisse formée par l’union des gamètes. Lorsque la zygospore germe, elle subit une méiose , générant de nouveaux hyphes haploïdes, qui peuvent alors former des sporangiospores asexuées . Ces sporangiospores permettent au champignon de se disperser rapidement et de germer en de nouveaux mycéliums fongiques haploïdes génétiquement identiques. [93]
Dispersion des spores
Les spores de la plupart des espèces de champignons étudiées sont transportées par le vent. [94] [95] Ces espèces produisent souvent des spores sèches ou hydrophobes qui n’absorbent pas l’eau et sont facilement dispersées par les gouttes de pluie, par exemple. [94] [96] [97] Dans d’autres espèces, les spores ou sporangiospores asexuées et sexuelles sont souvent activement dispersées par éjection forcée de leurs structures reproductrices. Cette éjection assure la sortie des spores des structures reproductrices ainsi que leur déplacement dans l’air sur de longues distances.


Des mécanismes mécaniques et physiologiques spécialisés, ainsi que des structures de surface des spores (telles que les hydrophobines ), permettent une éjection efficace des spores. [98] Par exemple, la structure des cellules porteuses de spores chez certaines espèces d’ascomycètes est telle que l’accumulation de substances affectant le volume cellulaire et l’équilibre hydrique permet la décharge explosive de spores dans l’air. [99] La décharge forcée de spores uniques appelées balistospores implique la formation d’une petite goutte d’eau (la goutte de Buller), qui au contact de la spore conduit à sa libération de projectile avec une accélération initiale de plus de 10 000 g ; [100] le résultat net est que la spore est éjectée de 0,01 à 0,02 cm, une distance suffisante pour qu’elle tombe à travers les branchies ou les pores dans l’air en dessous. [101] D’autres champignons, comme les vesse -de-loup , reposent sur des mécanismes alternatifs de libération des spores, tels que des forces mécaniques externes. Les champignons hydnoïdes (champignons dentaires) produisent des spores sur des projections pendantes, en forme de dent ou en forme d’épine. [102] Les champignons du nid d’oiseau utilisent la force des gouttes d’eau qui tombent pour libérer les spores des fructifications en forme de coupe. [103] Une autre stratégie est vue dans les stinkhorns, un groupe de champignons aux couleurs vives et à l’odeur putride qui attirent les insectes pour disperser leurs spores. [104]
Homothalisme
Dans la reproduction sexuée homothallique , deux noyaux haploïdes issus du même individu fusionnent pour former un zygote qui peut ensuite subir une méiose . Les champignons homothalliques comprennent des espèces avec un stade asexué de type Aspergillus (anamorphes) présents dans de nombreux genres différents, [105] plusieurs espèces du genre ascomycète Cochliobolus , [106] et l’ascomycète Pneumocystis jiroveccii . [107] Le premier mode de reproduction sexuée chez les eucaryotes était probablement l’homothallisme, c’est-à -dire la reproduction unisexuée autofertile .[108]
Autres processus sexuels
Outre la reproduction sexuée régulière avec méiose, certains champignons, tels que ceux des genres Penicillium et Aspergillus , peuvent échanger du matériel génétique via des processus parasexuels , initiés par anastomose entre les hyphes et la plasmogamie des cellules fongiques. [109] La fréquence et l’importance relative des événements parasexuels ne sont pas claires et peuvent être inférieures à celles d’autres processus sexuels. Il est connu pour jouer un rôle dans l’hybridation intraspécifique [110] et est probablement nécessaire pour l’hybridation entre espèces, qui a été associée à des événements majeurs dans l’évolution fongique. [111]
Évolution
Contrairement aux plantes et aux animaux , les premiers enregistrements fossiles des champignons sont maigres. Les facteurs qui contribuent probablement à la sous-représentation des espèces fongiques parmi les fossiles comprennent la nature des fructifications fongiques , qui sont des tissus mous, charnus et facilement dégradables et les dimensions microscopiques de la plupart des structures fongiques, qui ne sont donc pas facilement évidentes. Les fossiles fongiques sont difficiles à distinguer de ceux des autres microbes et sont plus facilement identifiés lorsqu’ils ressemblent à des champignons existants . [112] Souvent récupérés à partir d’une plante ou d’un animal hôte perminéralisé , ces échantillons sont généralement étudiés en réalisant des préparations en lames minces qui peuvent être examinées avecmicroscopie optique ou microscopie électronique à transmission . [113] Les chercheurs étudient les fossiles de compression en dissolvant la matrice environnante avec de l’acide, puis en utilisant la microscopie optique ou électronique à balayage pour examiner les détails de surface. [114]

 Prototaxites milwaukeensis (Penhallow, 1908) – un champignon du Dévonien moyen du Wisconsin
Prototaxites milwaukeensis (Penhallow, 1908) – un champignon du Dévonien moyen du Wisconsin
Les premiers fossiles possédant des caractéristiques typiques des champignons datent de l’ ère paléoprotérozoïque , il y a environ 2 400 millions d’années ( Ma ); ces organismes benthiques multicellulaires avaient des structures filamenteuses capables d’ anastomose . [115] D’autres études (2009) estiment l’arrivée d’organismes fongiques à environ 760-1060 Ma sur la base de comparaisons du taux d’évolution dans des groupes étroitement liés. [116] Pendant une grande partie de l’ ère paléozoïque (542–251 Ma), les champignons semblent avoir été aquatiques et se sont composés d’organismes similaires aux chytrides existants en ce qu’ils ont des spores portant des flagelles.[117] L’adaptation évolutive d’un mode de vie aquatique à un mode de vie terrestre a nécessité une diversification des stratégies écologiques pour obtenir des nutriments, y compris le parasitisme , le saprobisme et le développement de relations mutualistes telles que la mycorhize et la lichénisation. [118] Des études suggèrent que l’état écologique ancestral de l’ Ascomycota était le saprobisme et que des événements de lichénisation indépendants se sont produits plusieurs fois. [119]
En mai 2019, des scientifiques ont signalé la découverte d’un champignon fossilisé , nommé Ourasphaira giraldae , dans l’ Arctique canadien , qui aurait pu pousser sur terre il y a un milliard d’années, bien avant que les plantes ne vivent sur terre. [120] [121] [122] Des microfossiles ressemblant à des champignons pyritisés conservés dans la formation basale d’Ediacaran Doushantuo (~ 635 Ma) ont été signalés dans le sud de la Chine. [123] Auparavant, on avait présumé que les champignons avaient colonisé la terre pendant le Cambrien (542–488,3 Ma), également bien avant les plantes terrestres. [124] Hyphes et spores fossilisés récupérés de la L’Ordovicien du Wisconsin (460 Ma) ressemble aux Glomerales modernes et existait à une époque où la flore terrestre se composait probablement uniquement de plantes ressemblant à des bryophytes non vasculaires. [125] Les prototaxites , qui étaient probablement un champignon ou un lichen, auraient été l’organisme le plus grand du Silurien tardif et du Dévonien précoce . Les fossiles fongiques ne deviennent communs et incontestables qu’au début du Dévonien (416–359,2 Ma), lorsqu’ils sont abondants dans le chert de Rhynie , principalement sous forme de Zygomycota et Chytridiomycota . [124] [126] [127]À peu près à la même époque, environ 400 Ma, les Ascomycota et Basidiomycota ont divergé, [128] et toutes les classes modernes de champignons étaient présentes au Carbonifère supérieur ( Pennsylvanien , 318,1–299 Ma). [129]
Les lichens formaient une composante des premiers écosystèmes terrestres et l’âge estimé du plus ancien fossile de lichen terrestre est de 415 Ma; [130] cette date correspond à peu près à l’âge du plus ancien fossile de sporocarpe connu, une espèce de Paleopyrenomycites trouvée dans le Rhynie Chert. [131] Le fossile le plus ancien avec des caractéristiques microscopiques ressemblant aux basidiomycètes modernes est Palaeoancistrus , trouvé perminéralisé avec une fougère du Pennsylvanien. [132] Rares dans les archives fossiles sont les Homobasidiomycètes (un taxon à peu près équivalent aux espèces productrices de champignons des Agaricomycètes ). Deuxdes spécimens conservés dans l’ ambre fournissent la preuve que les premiers champignons connus formant des champignons (l’espèce éteinte Archaeomarasmius leggetti ) sont apparus à la fin du Crétacé , 90 Ma. [133] [134]
Quelque temps après l’ événement d’extinction du Permien-Trias (251,4 Ma), un épi fongique (considéré à l’origine comme une abondance extraordinaire de spores fongiques dans les sédiments ) s’est formé, suggérant que les champignons étaient la forme de vie dominante à cette époque, représentant près de 100% de les archives fossiles disponibles pour cette période. [135] Cependant, la proportion relative de spores fongiques par rapport aux spores formées par les espèces d’ algues est difficile à évaluer, [136] l’épi n’est pas apparu dans le monde entier, [137] [138] et dans de nombreux endroits, il n’est pas tombé sur le Permien. –Limite triasique. [139]
Il y a soixante-cinq millions d’années, immédiatement après l’ événement d’ extinction Crétacé-Paléogène qui a tué la plupart des dinosaures, il y a eu une augmentation spectaculaire des preuves de champignons; apparemment, la mort de la plupart des espèces végétales et animales a entraîné une énorme prolifération fongique comme “un énorme tas de compost”. [140]
Taxonomie
Bien qu’ils soient couramment inclus dans les programmes et les manuels de botanique, les champignons sont plus étroitement liés aux animaux qu’aux plantes et sont placés avec les animaux dans le groupe monophylétique des opisthokonts . [141] Les analyses utilisant la phylogénétique moléculaire soutiennent une origine monophylétique des champignons. [47] [142] La taxonomie des champignons est dans un état de flux constant, en particulier en raison de la recherche basée sur des comparaisons d’ADN. Ces analyses phylogénétiques actuelles bouleversent souvent les classifications fondées sur des méthodes plus anciennes et parfois moins discriminantes basées sur des caractères morphologiques et des concepts d’espèces biologiques obtenus à partir d’expériences expérimentales.accouplements . [143]
Il n’y a pas de système unique généralement accepté aux niveaux taxonomiques supérieurs et il y a des changements de noms fréquents à tous les niveaux, des espèces vers le haut. Des efforts parmi les chercheurs sont actuellement en cours pour établir et encourager l’utilisation d’une nomenclature unifiée et plus cohérente . [47] [144] Jusqu’aux modifications relativement récentes (2012) du Code international de nomenclature pour les algues, les champignons et les plantes , les espèces fongiques pouvaient également avoir plusieurs noms scientifiques en fonction de leur cycle de vie et de leur mode de reproduction (sexué ou asexué). [145] Des sites Web tels que Index Fungorum et MycoBank sont des sites nomenclaturaux officiellement reconnus .référentiels et répertorier les noms actuels des espèces fongiques (avec renvois aux synonymes plus anciens ). [146]
La classification 2007 de Kingdom Fungi est le résultat d’un effort de recherche collaboratif à grande échelle impliquant des dizaines de mycologues et d’autres scientifiques travaillant sur la taxonomie fongique. [47] Il reconnaît sept embranchements , dont deux – les Ascomycota et les Basidiomycota – sont contenus dans une branche représentant le sous- royaume Dikarya , le groupe le plus riche en espèces et le plus familier, y compris tous les champignons, la plupart des moisissures d’altération des aliments, la plupart des champignons phytopathogènes , et les levures de bière, de vin et de pain. Le cladogramme qui l’ accompagne décrit les principaux taxons fongiques et leur relation avec les organismes opisthokont et unikont, sur la base des travaux de Philippe Silar, [147]“The Mycota : A Comprehensive Treatise on Fungi as Experimental Systems for Basic and Applied Research” [148] et Tedersoo et al. 2018. [149] Les longueurs des branches ne sont pas proportionnelles aux distances évolutives .
| Zoosporie |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Basidiomycota |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ascomycètes |
|
Groupes taxonomiques

 Principaux groupes de champignons
Principaux groupes de champignons
Les principaux embranchements (parfois appelés divisions) des champignons ont été classés principalement sur la base des caractéristiques de leurs structures reproductives sexuées . En 2019 [update], neuf lignées majeures ont été identifiées : Opisthosporidia, Chytridiomycota, Neocallimastigomycota, Blastocladiomycota, Zoopagomycota, Mucoromycota, Glomeromycota, Ascomycota et Basidiomycota. [150]
L’analyse phylogénétique a démontré que les Microsporidies , Parasites unicellulaires des animaux et des protistes, sont des champignons endobiotiques assez récents et hautement dérivés (vivant dans les tissus d’une autre espèce). [117] Auparavant considérés comme des protozoaires “primitifs”, on pense maintenant qu’ils sont soit une branche basale des champignons, soit un groupe sœur – le parent évolutif le plus proche l’un de l’autre. [151]
Les Chytridiomycota sont communément appelés chytrides. Ces champignons sont distribués dans le monde entier. Les chytrides et leurs proches parents Neocallimastigomycota et Blastocladiomycota (ci-dessous) sont les seuls champignons à motilité active, produisant des zoospores capables de se déplacer activement à travers les phases aqueuses avec un seul flagelle , ce qui a conduit les premiers taxonomistes à les classer comme protistes . Les phylogénies moléculaires , déduites des séquences d’ ARNr dans les ribosomes , suggèrent que les Chytrides sont un groupe basal divergent des autres phylums fongiques, composé de quatre principauxclades avec preuves évocatrices de paraphylie ou éventuellement de polyphylie . [152]
Les Blastocladiomycota étaient auparavant considérés comme un clade taxonomique au sein des Chytridiomycota. Les données moléculaires et les caractéristiques ultrastructurales placent cependant les Blastocladiomycota comme un clade frère des Zygomycota, Glomeromycota et Dikarya (Ascomycota et Basidiomycota). Les blastocladiomycètes sont des saprotrophes , se nourrissant de matière organique en décomposition, et ce sont des Parasites de tous les groupes eucaryotes. Contrairement à leurs proches parents, les chytrides, dont la plupart présentent une méiose zygotique , les blastocladiomycètes subissent une méiose sporique . [117]
Les Neocallimastigomycota étaient auparavant placés dans le phylum Chytridomycota. Les membres de ce petit phylum sont des organismes anaérobies , vivant dans le système digestif des grands mammifères herbivores et dans d’autres environnements terrestres et aquatiques enrichis en cellulose (par exemple, les décharges d’ordures ménagères). [153] Ils manquent de mitochondries mais contiennent des hydrogénosomes d’origine mitochondriale. Comme chez les chrystrides apparentées, les néocallimastigomycètes forment des zoospores uniflagellées ou polyflagellées postérieurement. [47]

 Mycorhizes arbusculaires vues au microscope. Cellules corticales de racine de lin contenant des paires d’arbuscules.
Mycorhizes arbusculaires vues au microscope. Cellules corticales de racine de lin contenant des paires d’arbuscules. 
 Schéma d’une apothécie (la structure de reproduction typique en forme de coupe des ascomycètes) montrant des tissus stériles ainsi que des asques en développement et matures.
Schéma d’une apothécie (la structure de reproduction typique en forme de coupe des ascomycètes) montrant des tissus stériles ainsi que des asques en développement et matures.
Les membres des Glomeromycota forment des mycorhizes arbusculaires , une forme de symbiose mutualiste dans laquelle les hyphes fongiques envahissent les cellules des racines des plantes et les deux espèces bénéficient de l’apport accru de nutriments qui en résulte. Toutes les espèces connues de Glomeromycota se reproduisent de manière asexuée. [85] L’association symbiotique entre les Glomeromycota et les plantes est ancienne, avec des preuves datant d’il y a 400 millions d’années. [154] Autrefois faisant partie des Zygomycota (communément appelés moules «à sucre» et «à épingles»), les Glomeromycota ont été élevés au statut de phylum en 2001 et remplacent maintenant l’ancien phylum Zygomycota. [155]Les champignons qui ont été placés dans le Zygomycota sont maintenant réaffectés au Glomeromycota, ou au sous-phyla incertae sedis Mucoromycotina , Kickxellomycotina , Zoopagomycotina et Entomophthoromycotina . [47] Certains exemples bien connus de champignons anciennement dans le Zygomycota incluent la moisissure noire du pain ( Rhizopus stolonifer ) et les espèces de Pilobolus , capables d’éjecter des spores à plusieurs mètres dans l’air. [156] Les genres médicalement pertinents incluent Mucor , Rhizomucor et Rhizopus . [157]
Les Ascomycota , communément appelés champignons à sac ou ascomycètes, constituent le plus grand groupe taxonomique au sein des Eumycota. [46] Ces champignons forment des spores méiotiques appelées ascospores , qui sont enfermées dans une structure spéciale en forme de sac appelée asque . Ce phylum comprend les morilles , quelques champignons et truffes , des levures unicellulaires (par exemple, des genres Saccharomyces , Kluyveromyces , Pichia et Candida ).), et de nombreux champignons filamenteux vivant comme saprotrophes, Parasites et symbiotes mutualistes (par exemple les lichens). Les genres proéminents et importants d’ascomycètes filamenteux comprennent Aspergillus , Penicillium , Fusarium et Claviceps . De nombreuses espèces d’ascomycètes n’ont été observées qu’en cours de reproduction asexuée (appelées espèces anamorphiques ), mais l’analyse des données moléculaires a souvent permis d’identifier leurs téléomorphes les plus proches chez les Ascomycota. [158] Parce que les produits de la méiose sont retenus dans l’asque en forme de sac, les ascomycètes ont été utilisés pour élucider les principes de la génétique et de l’hérédité (par exemple, Neurospora crassa ).[159]
Les membres du Basidiomycota , communément appelés champignons du club ou basidiomycètes, produisent des méiospores appelées basidiospores sur des tiges en forme de club appelées basides . La plupart des champignons communs appartiennent à ce groupe, ainsi que les champignons de la rouille et du charbon , qui sont des agents pathogènes majeurs des céréales. D’autres basidiomycètes importants incluent l’ agent pathogène du maïs Ustilago maydis , [160] les espèces commensales humaines du genre Malassezia , [161] et l’ agent pathogène humain opportuniste , Cryptococcus neoformans . [162]
Organismes ressemblant à des champignons
En raison de similitudes dans la morphologie et le mode de vie, les moisissures visqueuses ( mycétozoaires , plasmodiophoridés , acrasides , Fonticula et labyrinthulides , maintenant chez Amoebozoa , Rhizaria , Excavata , Opisthokonta et Stramenopiles , respectivement), les moisissures aquatiques ( oomycètes ) et les hyphochytrides (les deux Stramenopiles ) étaient autrefois classés dans le royaume Fungi, dans des groupes comme Mastigomycotina , Gymnomycota et Phycomycetes. Les moisissures visqueuses ont également été étudiées en tant que protozoaires , ce qui a conduit à une taxonomie ambiregnale et dupliquée. [163]
Contrairement aux vrais champignons, les parois cellulaires des oomycètes contiennent de la cellulose et manquent de chitine . Les hyphochytrides contiennent à la fois de la chitine et de la cellulose. Les moisissures visqueuses n’ont pas de paroi cellulaire pendant la phase d’assimilation (sauf les labyrinthulides, qui ont une paroi d’écailles) et absorbent les nutriments par ingestion ( phagocytose , sauf les labyrinthulides) plutôt que par absorption ( osmotrophie , comme les champignons, les labyrinthulides, les oomycètes et les hyphochytrides). Ni les moisissures aquatiques ni les moisissures visqueuses ne sont étroitement liées aux vrais champignons et, par conséquent, les taxonomistes ne les regroupent plus dans le royaume des champignons. Néanmoins, les études sur les oomycètes et les myxomycètes sont encore souvent incluses dans la mycologiemanuels scolaires et littérature de recherche primaire. [164]
Les Eccrinales et les Amoebidiales sont des protistes opisthokont , autrefois considérés comme des champignons zygomycètes. D’autres groupes maintenant dans Opisthokonta (par exemple, Corallochytrium , Ichthyosporea ) ont également été à un moment donné classés comme champignons. Le genre Blastocystis , maintenant dans Stramenopiles , était à l’origine classé comme une levure. Ellobiopsis , maintenant dans Alveolata , était considéré comme un chytride. Les bactéries ont également été incluses dans les champignons dans certaines classifications, comme le groupe Schizomycètes.
Le clade Rozellida , y compris le “ex-chytride” Rozella , est un groupe génétiquement disparate connu principalement à partir de séquences d’ADN environnementales qui est un groupe frère des champignons. [150] Les membres du groupe qui ont été isolés n’ont pas la paroi cellulaire chitineuse caractéristique des champignons. Alternativement, Rozella peut être classée comme un groupe fongique basal. [142]
Les nucléaires pourraient être le prochain groupe frère du clade des eumycètes et, en tant que tels, pourraient être inclus dans un royaume fongique élargi. [141] De nombreux Actinomycetales ( Actinomycetota ), un groupe avec de nombreuses bactéries filamenteuses, ont également longtemps été considérés comme des champignons. [165] [166]
Écologie

 Un moule à épingles décomposant une pêche
Un moule à épingles décomposant une pêche
Bien que souvent discrets, les champignons sont présents dans tous les environnements de la Terre et jouent un rôle très important dans la plupart des écosystèmes . Avec les bactéries, les champignons sont les principaux décomposeurs dans la plupart des écosystèmes terrestres (et certains aquatiques) et jouent donc un rôle essentiel dans les cycles biogéochimiques [167] et dans de nombreux réseaux trophiques . En tant que décomposeurs, ils jouent un rôle essentiel dans le cycle des nutriments , notamment en tant que saprotrophes et symbiotes , dégradant la matière organique en molécules inorganiques, qui peuvent ensuite réintégrer les voies métaboliques anaboliques des plantes ou d’autres organismes. [168] [169]
Symbiose
De nombreux champignons ont des relations symbiotiques importantes avec des organismes de la plupart sinon de tous les règnes . [170] [171] [172] Ces interactions peuvent être de nature mutualiste ou antagoniste ou, dans le cas des champignons commensaux , ne présenter aucun avantage ou préjudice apparent pour l’hôte. [173] [174] [175]
Avec des plantes
La symbiose mycorhizienne entre les plantes et les champignons est l’une des associations plantes-champignons les plus connues et revêt une importance significative pour la croissance et la persistance des plantes dans de nombreux écosystèmes; plus de 90% de toutes les espèces végétales s’engagent dans des relations mycorhiziennes avec des champignons et dépendent de cette relation pour leur survie. [176]
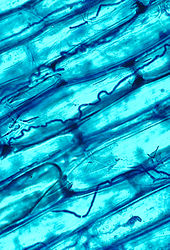
 Les filaments sombres sont des hyphes du champignon endophyte Epichloë coenophiala dans les espaces intercellulaires du tissu de la gaine foliaire de la fétuque élevée
Les filaments sombres sont des hyphes du champignon endophyte Epichloë coenophiala dans les espaces intercellulaires du tissu de la gaine foliaire de la fétuque élevée
La symbiose mycorhizienne est ancienne, datant d’au moins 400 millions d’années. [154] Il augmente souvent l’absorption par la plante de composés inorganiques, tels que le nitrate et le phosphate provenant de sols ayant de faibles concentrations de ces éléments nutritifs essentiels pour les plantes. [168] [177] Les partenaires fongiques peuvent également assurer la médiation du transfert de plante à plante d’hydrates de carbone et d’autres nutriments. [178] De telles communautés mycorhiziennes sont appelées « réseaux mycorhiziens communs ». [179] [180] Un cas particulier de mycorhize est la myco-hétérotrophie , par laquelle la plante parasite le champignon, obtenant tous ses nutriments de son symbiote fongique. [181]Certaines espèces fongiques habitent les tissus à l’intérieur des racines, des tiges et des feuilles, auquel cas elles sont appelées endophytes. [182] Semblable à la mycorhize, la colonisation endophyte par des champignons peut bénéficier aux deux symbiotes ; par exemple, les endophytes des graminées confèrent à leur hôte une résistance accrue aux herbivores et à d’autres stress environnementaux et reçoivent en retour de la nourriture et un abri de la plante. [183]
Aux algues et cyanobactéries 
 Le lichen Lobaria pulmonaria , une symbiose d’ espèces fongiques, algales et cyanobactériennes
Le lichen Lobaria pulmonaria , une symbiose d’ espèces fongiques, algales et cyanobactériennes
Les lichens sont une relation symbiotique entre les champignons et les algues photosynthétiques ou les cyanobactéries . Le partenaire photosynthétique dans la relation est appelé dans la terminologie des lichens un “photobionte”. La partie fongique de la relation est composée principalement de diverses espèces d ‘ ascomycètes et de quelques basidiomycètes . [184] Les lichens sont présents dans tous les écosystèmes de tous les continents, jouent un rôle clé dans la formation des sols et l’initiation de la succession biologique , [185] et sont prédominants dans certains environnements extrêmes, y compris les environnements polaires , alpins et semi -arides.régions désertiques. [186] Ils sont capables de pousser sur des surfaces inhospitalières, y compris le sol nu, les rochers, l’écorce des arbres , le bois, les coquillages, les balanes et les feuilles. [187] Comme dans les mycorhizes , le photobionte fournit des sucres et d’autres glucides via la photosynthèse au champignon, tandis que le champignon fournit des minéraux et de l’eau au photobionte. Les fonctions des deux organismes symbiotiques sont si étroitement liées qu’elles fonctionnent presque comme un seul organisme ; dans la plupart des cas, l’organisme résultant diffère considérablement des composants individuels. [188] La lichénisation est un mode de nutrition courant pour les champignons; environ 27% des champignons connus – plus de 19 400 espèces – sont lichénisés. [189]Les caractéristiques communes à la plupart des lichens comprennent l’obtention de carbone organique par photosynthèse, une croissance lente, une petite taille, une longue durée de vie, des structures de reproduction végétatives durables (saisonnières) , une nutrition minérale obtenue en grande partie de sources aéroportées et une plus grande tolérance à la dessiccation que la plupart des autres organismes photosynthétiques dans le même habitat. [190]
Avec des insectes
De nombreux insectes s’engagent également dans des relations mutualistes avec des champignons. Plusieurs groupes de fourmis cultivent des champignons dans l’ordre des Chaetothyriales à plusieurs fins : comme source de nourriture, comme élément structurel de leurs nids et dans le cadre d’une symbiose fourmi/plante dans les domaties (chambres minuscules dans les plantes qui abritent des arthropodes). [191] Les coléoptères ambrosia cultivent diverses espèces de champignons dans l’écorce des arbres qu’ils infestent. [192] De même, les femelles de plusieurs espèces de guêpes des bois (genre Sirex ) injectent leurs œufs avec des spores du champignon lignivore Amylostereum areolatum dans l’ aubier depins ; la croissance du champignon offre des conditions nutritionnelles idéales pour le développement des larves de guêpes. [193] Au moins une espèce d’ abeille sans dard a une relation avec un champignon du genre Monascus , où les larves consomment et dépendent du champignon transféré des anciens aux nouveaux nids. [194] Les termites de la savane africaine sont également connus pour cultiver des champignons, [170] et des levures des genres Candida et Lachancea habitent l’ intestin d’un large éventail d’insectes, y compris les neuroptères , les coléoptères et les cafards .; on ne sait pas si ces champignons profitent à leurs hôtes. [195] Les champignons qui poussent dans le bois mort sont indispensables aux insectes xylophages (par exemple les coléoptères xylophages ). [196] [197] [198] Ils fournissent les nutriments nécessaires aux xylophages au bois mort nutritionnellement rare. [199] [197] [198] Grâce à cet enrichissement nutritionnel, les larves de l’insecte xylophage peuvent grandir et se développer jusqu’à l’âge adulte. [196] Les larves de nombreuses familles de mouches fongicoles , en particulier celles de la superfamille Sciaroidea telles que les Mycetophilidaeet certains Keroplatidae se nourrissent de fructifications fongiques et de mycorhizes stériles . [200]
En tant qu’agents pathogènes et Parasites 
 Le phytopathogène Puccinia magellanicum ( rouille calafate ) provoque le défaut connu sous le nom de balai de sorcière , vu ici sur un arbuste d’épine- vinette au Chili.
Le phytopathogène Puccinia magellanicum ( rouille calafate ) provoque le défaut connu sous le nom de balai de sorcière , vu ici sur un arbuste d’épine- vinette au Chili. 
 Coloration de Gram de Candida albicans à partir d’un écouvillon vaginal d’une femme atteinte de candidose , montrant des hyphes et des chlamydospores, qui mesurent 2 à 4 μm de diamètre.
Coloration de Gram de Candida albicans à partir d’un écouvillon vaginal d’une femme atteinte de candidose , montrant des hyphes et des chlamydospores, qui mesurent 2 à 4 μm de diamètre.
De nombreux champignons sont des Parasites des plantes, des animaux (y compris les humains) et d’autres champignons. Les agents pathogènes graves de nombreuses plantes cultivées causant des dommages et des pertes importants à l’agriculture et à la foresterie comprennent le champignon Magnaporthe oryzae , [201] des agents pathogènes des arbres tels que Ophiostoma ulmi et Ophiostoma novo-ulmi causant la maladie hollandaise de l’orme [202] et Cryphonectria parasitica responsable du châtaignier . mildiou , [203] et phytopathogènes des genres Fusarium , Ustilago , Alternaria , etCochliobole . [174] Certains champignons carnivores , comme Paecilomyces lilacinus , sont des prédateurs de nématodes , qu’ils capturent à l’aide d’un éventail de structures spécialisées telles que des anneaux de constriction ou des filets adhésifs. [204] De nombreux champignons pathogènes des plantes, tels que Magnaporthe oryzae , peuvent passer du statut biotrophe (parasite des plantes vivantes) au statut nécrotrophe (se nourrissant des tissus morts des plantes qu’ils ont tuées). [205] Ce même principe est appliqué aux Parasites se nourrissant de champignons, y compris Asterotremella albida, qui se nourrit des fructifications d’autres champignons à la fois pendant leur vie et après leur mort. [206]
Certains champignons peuvent provoquer des maladies graves chez l’homme, dont plusieurs peuvent être mortelles si elles ne sont pas traitées. Ceux-ci comprennent l’ aspergillose , la candidose , la coccidioïdomycose , la cryptococcose , l’histoplasmose , les mycétomes et la paracoccidioïdomycose . En outre, les personnes immunodéficientes sont particulièrement sensibles aux maladies par des genres tels que Aspergillus , Candida , Cryptoccocus , [175] [207] [208] Histoplasma , [209] et Pneumocystis . [210]D’autres champignons peuvent attaquer les yeux, les ongles, les cheveux, et surtout la peau, les champignons dits dermatophytes et kératinophiles, et provoquer des infections locales comme la teigne et le pied d’athlète . [211] Les spores fongiques sont également une cause d’ allergies et les champignons de différents groupes taxonomiques peuvent provoquer des réactions allergiques. [212]
En tant que cibles des mycoparasites
Les organismes qui parasitent les champignons sont appelés organismes mycoparasites . Environ 300 espèces de champignons et d’organismes apparentés, appartenant à 13 classes et 113 genres, sont utilisées comme agents de lutte biologique contre les maladies fongiques des plantes. [213] Les champignons peuvent également agir comme mycoparasites ou antagonistes d’autres champignons, tels que Hypomyces chrysospermus , qui pousse sur les cèpes . Les champignons peuvent également devenir la cible d’infections par des mycovirus . [214] [215]
Mycotoxines
![(6aR,9R)-N-((2R,5S,10aS,10bS)-5-benzyl-10b-hydroxy-2-methyl-3,6-dioxooctahydro-2H-oxazolo[3,2-a] pyrrolo[2,1-c]pyrazin-2-yl)-7-methyl-4,6,6a,7,8,9-hexahydroindolo[4,3-fg] quinoline-9-carboxamide](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/Ergotamine3.png/220px-Ergotamine3.png)
![(6aR,9R)-N-((2R,5S,10aS,10bS)-5-benzyl-10b-hydroxy-2-methyl-3,6-dioxooctahydro-2H-oxazolo[3,2-a] pyrrolo[2,1-c]pyrazin-2-yl)-7-methyl-4,6,6a,7,8,9-hexahydroindolo[4,3-fg] quinoline-9-carboxamide](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/Ergotamine3.png/220px-Ergotamine3.png) L’ergotamine , une mycotoxine majeure produite par l’espèce Claviceps , qui, si elle est ingérée, peut provoquer une gangrène , des convulsions et des hallucinations
L’ergotamine , une mycotoxine majeure produite par l’espèce Claviceps , qui, si elle est ingérée, peut provoquer une gangrène , des convulsions et des hallucinations
De nombreux champignons produisent des composés biologiquement actifs , dont plusieurs sont toxiques pour les animaux ou les plantes et sont donc appelés mycotoxines . Les mycotoxines produites par les moisissures causant la détérioration des aliments et les champignons vénéneux (voir ci-dessus) sont particulièrement importantes pour les humains. Les amatoxines mortelles présentes dans certains champignons Amanita et les alcaloïdes de l’ ergot sont particulièrement tristement célèbres .[216] D’autres mycotoxines notables comprennent les aflatoxines , qui sont des toxines hépatiques insidieuseset des métabolites hautement cancérigènes produits par certaines espèces d’ Aspergillus qui poussent souvent dans ou sur les céréales et les noix consommées par les humains, les ochratoxines , la patuline et les trichothécènes (par exemple, la mycotoxine T-2 ) et les fumonisines , qui ont un impact significatif sur l’alimentation humaine ou le bétail . [217]
Les mycotoxines sont des métabolites secondaires (ou produits naturels ), et la recherche a établi l’existence de voies biochimiques uniquement dans le but de produire des mycotoxines et d’autres produits naturels dans les champignons. [36] Les mycotoxines peuvent apporter des avantages pour la forme physique en termes d’adaptation physiologique, de compétition avec d’autres microbes et champignons et de protection contre la consommation ( fongivore ). [218] [219] De nombreux métabolites secondaires fongiques (ou dérivés) sont utilisés médicalement, comme décrit sous Utilisation humaine ci-dessous.
Mécanismes pathogènes
Ustilago maydis est un champignon végétal pathogène qui cause la maladie du charbon chez le maïs et le téosinte . Les plantes ont développé des systèmes de défense efficaces contre les microbes pathogènes tels que U. maydis . Une réaction de défense rapide après une attaque par un agent pathogène est la poussée oxydative où la plante produit des espèces réactives de l’oxygène sur le site de la tentative d’invasion. U. maydis peut répondre à la poussée oxydative par une réponse au stress oxydatif, régulée par le gène YAP1 . La réponse protège U. maydis de la défense de l’hôte et est nécessaire à la virulence de l’agent pathogène. [220] Par ailleurs, U. maydispossède un système bien établi de réparation de l’ADN par recombinaison qui agit pendant la mitose et la méiose. [221] Le système peut aider l’agent pathogène à survivre aux dommages à l’ADN résultant de la réponse défensive oxydative de la plante hôte à l’infection. [222]
Cryptococcus neoformans est une levure encapsulée qui peut vivre aussi bien chez les plantes que chez les animaux. C. neoformans infecte généralement les poumons, où il est phagocyté par les macrophages alvéolaires . [223] Certains C. neoformans peuvent survivre à l’intérieur des macrophages, ce qui semble être à la base de la latence , de la maladie disséminée et de la résistance aux agents antifongiques. Un mécanisme par lequel C. neoformans survit à l’environnement hostile des macrophages consiste à réguler à la hausse l’expression de gènes impliqués dans la réponse au stress oxydatif. [223] Un autre mécanisme implique la méiose. La majorité des C. neoformans s’accouplent de “type a”. Les filaments de “type a” d’accouplement ont généralement des noyaux haploïdes, mais ils peuvent devenir diploïdes (peut-être par endoduplication ou par fusion nucléaire stimulée) pour former des blastospores . Les noyaux diploïdes des blastospores peuvent subir une méiose, y compris une recombinaison, pour former des basidiospores haploïdes qui peuvent être dispersées. [224] Ce processus est appelé fructification monocaryote. Ce processus nécessite un gène appelé DMC1 , qui est un homologue conservé des gènes recA chez les bactéries et RAD51 chez les eucaryotes, qui assure la médiation de l’appariement des chromosomes homologues pendant la méiose et la réparation des cassures double brin de l’ADN. Ainsi, C. neoformans peut subir une méiose, une fructification monocaryote, qui favorise la réparation par recombinaison dans l’environnement oxydant et endommageant l’ADN du macrophage hôte, et la capacité de réparation peut contribuer à sa virulence. [222] [224]
Utilisation humaine

 Cellules de Saccharomyces cerevisiae montrées par microscopie DIC
Cellules de Saccharomyces cerevisiae montrées par microscopie DIC
L’utilisation humaine des champignons pour la préparation ou la conservation des aliments et à d’autres fins est importante et a une longue histoire. La culture et la cueillette des champignons sont de grandes industries dans de nombreux pays. L’étude des usages historiques et de l’impact sociologique des champignons est connue sous le nom d’ ethnomycologie . En raison de la capacité de ce groupe à produire une vaste gamme de produits naturels ayant des activités antimicrobiennes ou d’autres activités biologiques, de nombreuses espèces sont utilisées depuis longtemps ou sont en cours de développement pour la production industrielle d’antibiotiques , de vitamines et de médicaments anticancéreux et hypocholestérolémiants . Des méthodes ont été développées pourl’ingénierie génétique des champignons, [225] permettant l’ingénierie métabolique des espèces fongiques. Par exemple, la modification génétique d’espèces de levures [226] – faciles à cultiver à des vitesses rapides dans de grandes cuves de fermentation – a ouvert des voies de production pharmaceutique potentiellement plus efficaces que la production par les organismes sources d’origine. [227]
Utilisations thérapeutiques
Chimiothérapie moderne 
 La moisissure Penicillium rubens était la source de la pénicilline G . [228]
La moisissure Penicillium rubens était la source de la pénicilline G . [228]
De nombreuses espèces produisent des métabolites qui sont des sources majeures de médicaments pharmacologiquement actifs. Les antibiotiques, y compris les pénicillines , un groupe structurellement apparenté d’ antibiotiques β-lactamines qui sont synthétisés à partir de petits peptides , sont particulièrement importants . Bien que les pénicillines naturelles telles que la pénicilline G (produite par Penicillium chrysogenum ) aient un spectre d’activité biologique relativement étroit, une large gamme d’autres pénicillines peuvent être produites par modification chimique des pénicillines naturelles. Les pénicillines modernes sont des composés semi -synthétiques , obtenus initialement par fermentationcultures, mais ensuite structurellement modifiées pour des propriétés souhaitables spécifiques. [229] D’autres antibiotiques produits par des champignons comprennent : la ciclosporine , couramment utilisée comme immunosuppresseur pendant la chirurgie de transplantation ; et l’acide fusidique , utilisé pour aider à contrôler l’infection par la bactérie Staphylococcus aureus résistante à la méthicilline . [230] Utilisation généralisée d’antibiotiques pour le traitement de maladies bactériennes, telles que la tuberculose , la syphilis , la lèpre, et d’autres ont commencé au début du 20ème siècle et continuent à ce jour. Dans la nature, les antibiotiques d’origine fongique ou bactérienne semblent jouer un double rôle : à fortes concentrations, ils agissent comme défense chimique contre la compétition avec d’autres micro-organismes dans des environnements riches en espèces, comme la rhizosphère , et à faibles concentrations, comme molécules de détection de quorum pour signalisation intra- ou inter-espèces. [231] D’autres médicaments produits par des champignons comprennent la griséofulvine isolée de Penicillium griseofulvum , utilisée pour traiter les infections fongiques, [232] et les statines ( inhibiteurs de la HMG-CoA réductase ), utilisées pour inhiber la synthèse du cholestérol .. Des exemples de statines trouvées dans les champignons comprennent la mévastatine de Penicillium citrinum et la lovastatine d’ Aspergillus terreus et du pleurote . [233] Les champignons produisent des composés qui inhibent les virus [234] [235] et les cellules cancéreuses . [236] Des métabolites spécifiques, tels que le polysaccharide-K , l’ ergotamine et les antibiotiques β-lactamines , sont couramment utilisés en médecine clinique. Le champignon shiitake est une source de lentinane, un médicament clinique approuvé pour une utilisation dans le traitement du cancer dans plusieurs pays, dont le Japon . [237] [238] En Europe et au Japon, le polysaccharide-K (nom de marque Krestin), un produit chimique dérivé de Trametes versicolor , est un adjuvant approuvé pour le traitement du cancer. [239]
La médecine traditionnelle



 Les champignons Ganoderma lucidum (à gauche) et Ophiocordyceps sinensis (à droite) sont utilisés dans les pratiques de médecine traditionnelle
Les champignons Ganoderma lucidum (à gauche) et Ophiocordyceps sinensis (à droite) sont utilisés dans les pratiques de médecine traditionnelle
Certains champignons sont utilisés comme thérapeutiques supposées dans les pratiques de la médecine populaire , comme la médecine traditionnelle chinoise . Les champignons avec une histoire d’une telle utilisation comprennent Agaricus subrufescens , [236] [240] Ganoderma lucidum , [241] et Ophiocordyceps sinensis . [242]
Aliments cultivés
La levure de boulanger ou Saccharomyces cerevisiae , un champignon unicellulaire, est utilisée pour faire du pain et d’autres produits à base de blé, comme la pâte à pizza et les boulettes . [243] Les espèces de levure du genre Saccharomyces sont également utilisées pour produire des boissons alcoolisées par fermentation. [244] La moisissure Shoyu koji ( Aspergillus oryzae ) est un ingrédient essentiel dans le brassage du Shoyu ( sauce soja ) et du saké , et dans la préparation du miso , [245] tandis que Rhizopusles espèces sont utilisées pour faire du tempeh . [246] Plusieurs de ces champignons sont des espèces domestiquées qui ont été élevées ou sélectionnées en fonction de leur capacité à fermenter les aliments sans produire de mycotoxines nocives (voir ci-dessous), qui sont produites par des Aspergilli très proches . [247] Quorn , un substitut de viande , est fabriqué à partir de Fusarium venenatum . [248]
Dans la nourriture

 Une sélection de champignons comestibles consommés en Asie
Une sélection de champignons comestibles consommés en Asie
Les champignons comestibles comprennent les champignons cultivés commercialement et récoltés dans la nature. Agaricus bisporus , vendu sous forme de champignons de Paris lorsqu’il est petit ou de champignons Portobello lorsqu’il est plus gros, est l’espèce la plus largement cultivée en Occident, utilisée dans les salades, les soupes et de nombreux autres plats. De nombreux champignons asiatiques sont cultivés commercialement et ont gagné en popularité en Occident. Ils sont souvent disponibles frais dans les épiceries et les marchés, notamment les champignons de paille ( Volvariella volvacea ), les pleurotes ( Pleurotus ostreatus ), les shiitakes ( Lentinula edodes ) et les enokitake ( Flammulina spp.). [249]

 Fromage Stilton veiné de Penicillium roqueforti
Fromage Stilton veiné de Penicillium roqueforti
De nombreuses autres espèces de champignons sont récoltées dans la nature pour la consommation personnelle ou la vente commerciale. Les champignons de lait , les morilles , les girolles , les truffes , les trompettes noires et les cèpes ( Boletus edulis ) (également appelés bolets royaux) demandent un prix élevé sur le marché. Ils sont souvent utilisés dans les plats gastronomiques. [250]
Certains types de fromages nécessitent l’inoculation du caillé de lait avec des espèces fongiques qui confèrent une saveur et une texture uniques au fromage. Les exemples incluent la couleur bleue dans les fromages tels que Stilton ou Roquefort , qui sont fabriqués par inoculation avec Penicillium roqueforti . [251] Les moisissures utilisées dans la production de fromage ne sont pas toxiques et sont donc sans danger pour la consommation humaine ; cependant, les mycotoxines (par exemple, les aflatoxines, la roquefortine C , la patuline ou autres) peuvent s’accumuler en raison de la croissance d’autres champignons pendant l’affinage ou l’entreposage du fromage. [252]
Champignons vénéneux


De nombreuses espèces de champignons sont toxiques pour les humains et provoquent une série de réactions, notamment de légers problèmes digestifs, des réactions allergiques , des hallucinations , une grave défaillance des organes et la mort. Les genres de champignons contenant des toxines mortelles comprennent Conocybe , Galerina , Lepiota et le plus infâme, Amanita . [253] Ce dernier genre comprend l’ange destructeur ( A. virosa ) et le chapeau de mort ( A. phalloides ) , la cause la plus fréquente d’empoisonnement mortel aux champignons. [254] La fausse morille (Gyromitra esculenta ) est parfois considéré comme un mets délicat lorsqu’il est cuit, mais peut être très toxique lorsqu’il est consommé cru. [255] Tricholoma equestre était considéré comme comestible jusqu’à ce qu’il soit impliqué dans des empoisonnements graves provoquant une rhabdomyolyse . [256] Les champignons agaric tue-mouche ( Amanita muscaria ) provoquent également des empoisonnements non mortels occasionnels, principalement à la suite de l’ingestion pour ses propriétés hallucinogènes . Historiquement, l’agaric tue-mouche était utilisé par différents peuples d’Europe et d’Asie et son utilisation actuelle à des fins religieuses ou chamaniques est signalée par certains groupes ethniques tels que le peuple Koryak du nord-est de la Sibérie .[257]
Comme il est difficile d’identifier avec précision un champignon sûr sans une formation et des connaissances appropriées, il est souvent conseillé de supposer qu’un champignon sauvage est toxique et de ne pas le consommer.[258] [259]
Antiparasitaire

 sauterelles tuées par Beauveria bassiana
sauterelles tuées par Beauveria bassiana
En agriculture, les champignons peuvent être utiles s’ils rivalisent activement pour les nutriments et l’espace avec des micro-organismes pathogènes tels que des bactéries ou d’autres champignons via le principe d’exclusion compétitive , [260] ou s’ils sont des Parasites de ces agents pathogènes. Par exemple, certaines espèces peuvent être utilisées pour éliminer ou supprimer la croissance d’agents pathogènes nuisibles aux plantes, tels que les insectes, les acariens , les mauvaises herbes , les nématodes et d’autres champignons qui causent des maladies d’importantes plantes cultivées . [261] Cela a suscité un vif intérêt pour les applications pratiques qui utilisent ces champignons dans la lutte biologique de ces ravageurs agricoles. Les champignons entomopathogènes peuvent être utilisés comme biopesticides , car ils tuent activement les insectes. [262] Exemples qui ont été utilisés comme insecticides biologiquessont Beauveria bassiana , Metarhizium spp., Hirsutella spp., Paecilomyces ( Isaria ) spp., et Lecanicillium lecanii . [263] [264] Champignons endophytes des graminées du genre . Ces alcaloïdes protègent les graminées des herbivores , mais plusieurs alcaloïdes endophytes peuvent empoisonner les animaux au pâturage, comme les bovins et les moutons. [265] L’infection de cultivars de graminées de pâturage ou fourragères avec des endophytes d’ Epichloë est une approche utilisée dans la sélection de graminées Epichloë , tels que E. coenophiala , produisent des alcaloïdes qui sont toxiques pour une gamme d’ herbivores invertébrés et vertébrés ; les souches fongiques sont sélectionnées pour ne produire que des alcaloïdes qui augmentent la résistance aux herbivores tels que les insectes, tout en étant non toxiques pour le bétail. [266] [267]
Bioremédiation
Certains champignons, en particulier les champignons de la pourriture blanche , peuvent dégrader les insecticides , les herbicides , le pentachlorophénol , la créosote , les goudrons de houille et les combustibles lourds et les transformer en dioxyde de carbone , en eau et en éléments basiques. [268] Il a été démontré que les champignons biominéralisent les oxydes d’uranium , suggérant qu’ils pourraient avoir une application dans la bioremédiation des sites pollués par la radioactivité. [269] [270] [271]
Organismes modèles
Plusieurs découvertes cruciales en biologie ont été faites par des chercheurs utilisant des champignons comme organismes modèles , c’est-à-dire des champignons qui se développent et se reproduisent sexuellement rapidement en laboratoire. Par exemple, l’ hypothèse un gène-un enzyme a été formulée par des scientifiques utilisant la moisissure du pain Neurospora crassa pour tester leurs théories biochimiques. [272] D’autres champignons modèles importants sont Aspergillus nidulans et les levures Saccharomyces cerevisiae et Schizosaccharomyces pombe , chacune ayant une longue histoire d’utilisation pour étudier les questions de biologie et de génétique des cellules eucaryotes , telles que la régulation du cycle cellulaire , de la chromatine , etrégulation des gènes . D’autres modèles fongiques ont émergé qui traitent de questions biologiques spécifiques pertinentes pour la médecine , la phytopathologie et les utilisations industrielles ; les exemples incluent Candida albicans , un agent pathogène humain dimorphe et opportuniste, [273] Magnaporthe grisea , un agent pathogène des plantes, [274] et Pichia pastoris , une levure largement utilisée pour la production de protéines eucaryotes .[275]
Autres
Les champignons sont largement utilisés pour produire des produits chimiques industriels tels que les acides citrique , gluconique , lactique et malique , [276] et des enzymes industrielles , telles que les lipases utilisées dans les détergents biologiques , [277] les cellulases utilisées dans la fabrication d’ éthanol cellulosique [278] et les jeans délavés , [279] et amylases , [280] invertases , protéases et xylanases . [281]
Voir également
-
![]()
![]() Portail des champignons
Portail des champignons
- Conservation des champignons
- Champignons fantastiques
- Champignons marins
- Mycose
- Aperçu des champignons
Références
- ^ Moore RT (1980). “Propositions taxonomiques pour la classification des levures marines et autres champignons de type levure, y compris les charbons”. Marina Botanique . 23 : 361–373.
- ^ / ˈ f ʌ n dʒ aɪ / (
![]()
![]() écouter ),/ ˈ f ʌ ŋ ɡ aɪ / (
écouter ),/ ˈ f ʌ ŋ ɡ aɪ / ( ![]()
![]() écouter ),/ ˈ f ʌ ŋ ɡ je / (
écouter ),/ ˈ f ʌ ŋ ɡ je / ( ![]()
![]() écouter )ou/ ˈ f ʌ n dʒ i / (
écouter )ou/ ˈ f ʌ n dʒ i / ( ![]()
![]() écoute ). Les deux premières prononciations sont davantage préférées aux États-Unis et les autres au Royaume-Uni, mais toutes les prononciations peuvent être entendues dans n’importe quel pays anglophone.
écoute ). Les deux premières prononciations sont davantage préférées aux États-Unis et les autres au Royaume-Uni, mais toutes les prononciations peuvent être entendues dans n’importe quel pays anglophone. - ^ “Champignon” . Dictionnaires d’Oxford . Archivé de l’original le 28 juillet 2012 . Récupéré le 26 février 2011 .
- ^ “Re:wild et UICN SSC deviennent les premières organisations mondiales à appeler à la reconnaissance des champignons comme l’un des trois règnes de la vie essentiels à la protection et à la restauration de la Terre” . Union internationale pour la conservation de la nature (UICN) . 3 août 2021.
- ^ un b Hawksworth DL, Lücking R (juillet 2017). “Diversité fongique revisitée : 2,2 à 3,8 millions d’espèces”. Le royaume fongique . Spectre microbiologique . Vol. 5. p. 79–95. doi : 10.1128/microbiolspec.FUNK-0052-2016 . ISBN 978-1-55581-957-6. PMID 28752818 .
- ^ un bc Cheek , Martin; Nic Lughadha, Eimear ; Kirk, Paul; Lindon, Heather; Carretero, Julia; Looney, Brian ; et coll. (2020). “Nouvelles découvertes scientifiques : Plantes et champignons” . Plantes, Personnes, Planète . 2 (5): 371–388. doi : 10.1002/ppp3.10148 .
- ^ “Arrêtez de négliger les champignons” . Microbiologie naturelle . 2 (8) : 17120. 25 juillet 2017. doi : 10.1038/nmicrobiol.2017.120 . PMID 28741610 .
- ^ Simpson DP (1979). Dictionnaire latin de Cassell (5 éd.). Londres, Royaume-Uni : Cassell Ltd. p. 883. _ 978-0-304-52257-6.
- ^ un b Ainsworth, p. 2.
- ^ Mitzka W, éd. (1960). Etymologisches Wörterbuch der deutschen Sprache . Berlin : Walter de Gruyter.
- ^ Alexopoulos et al., p. 1.
- ^ Person, Christiaan Hendrik (1796). Observationes Mycologicae (en latin). Vol. Partie 1. Leipzig, (Allemagne) : Peter Philipp Wolf. Archivé de l’original le 19 décembre 2013 . Récupéré le 30 mars 2019 .
- ^ Greville, Robert Kaye (1824). Flore cryptogamique écossaise : ou figures colorées et descriptions de plantes cryptogamiques, appartenant principalement à l’ordre des champignons . Vol. 2. Edimbourg, Ecosse : Maclachland et Stewart. p. 65. De p. 65 : “Cette petite plante ne sera probablement pas rare en Grande-Bretagne, quand la mycologie sera plus étudiée.”
- ^ Forgeron, James Edward (1836). Hooker, William Jackson; Berkeley, Miles Joseph (éd.). La flore anglaise de Sir James Edward Smith . Vol. 5, partie II : “Classe XXIV. Cryptogamie”. Londres, Angleterre : Longman, Rees, Orme, Brown, Green & Longman. p. 7. De p. 7: “Ceci est né, je pense, en partie de la difficulté pratique de conserver des spécimens pour l’herbier, en partie de l’absence de tout travail général, adapté aux progrès immenses qui ont été réalisés ces dernières années dans l’étude de la mycologie.”
- ^ “LIAS Glossaire” . Archivé de l’original le 11 décembre 2013 . Récupéré le 14 août 2013 .
- ^ Kuhar, Francisco; Furci, Giuliana ; Drechsler-Santos, Elisandro Ricardo ; En lignePfister, Donald H. (2018). “Délimitation de Funga comme terme valable pour la diversité des communautés fongiques : la proposition Fauna, Flora & Funga (FF&F)” . Champignon IMA . 9 (2) : A71–A74. doi : 10.1007/BF03449441 .
- ^ “Acceptation de l’UICN SSC de Fauna Flora Funga” (PDF) . Comité de conservation des champignons, UICN SSC. 2021. La Commission de la sauvegarde des espèces de l’UICN appelle à la reconnaissance appropriée des champignons en tant que composants majeurs de la biodiversité dans la législation et la politique. Il approuve pleinement l’initiative Fauna Flora Funga et demande que les expressions animaux et plantes et faune et flore soient remplacées par animaux, champignons et plantes et faune, flore et champignons .
- ^ Bruns T (octobre 2006). “Biologie évolutive: un royaume révisé” . Nature . 443 (7113): 758–61. Bibcode : 2006Natur.443..758B . doi : 10.1038/443758a . PMID 17051197 . S2CID 648881 .
- ^ Baldauf SL, Palmer JD (décembre 1993). “Les animaux et les champignons sont les parents les plus proches les uns des autres : preuves congruentes de plusieurs protéines” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 90 (24): 11558–62. Bibcode : 1993PNAS…9011558B . doi : 10.1073/pnas.90.24.11558 . PMC 48023 . PMID 8265589 .
- ^ Diacre, p. 4.
- ^ un diacre b , pp. 128–129.
- ^ Alexopoulos et al ., pp. 28–33.
- ^ Alexopoulos et al ., pp. 31-32.
- ^ Shoji JY, Arioka M, Kitamoto K (2006). “Implication possible des réseaux vacuolaires pléiomorphes dans le recyclage des nutriments chez les champignons filamenteux” . Autophagie . 2 (3): 226–7. doi : 10.4161/auto.2695 . PMID 16874107 .
- ^ Diacre, p. 58.
- ^ Zabriskie TM, Jackson MD (février 2000). “La biosynthèse de la lysine et le métabolisme chez les champignons”. Rapports sur les produits naturels . 17 (1): 85–97. doi : 10.1039/a801345d . PMID 10714900 .
- ^ Xu H, Andi B, Qian J, West AH, Cook PF (2006). “La voie alpha-aminoadipate pour la biosynthèse de la lysine chez les champignons”. Biochimie et biophysique cellulaires . 46 (1): 43–64. doi : 10.1385/CBB:46:1:43 . PMID 16943623 . S2CID 22370361 .
- ^ Alexopoulos et al ., pp. 27–28.
- ^ Alexopoulos et al ., p. 685.
- ^ un bc Alexopoulos et al ., p. 30.
- ^ Desjardin DE, Perry BA, Lodge DJ, Stevani CV, Nagasawa E (2010). “Mycena luminescente : espèce nouvelle et remarquable” . Mycologie . 102 (2): 459–77. doi : 10.3852/09-197 . PMID 20361513 . S2CID 25377671 . Archivé de l’original le 11 novembre 2018 . Récupéré le 11 novembre 2018 .
- ^ Alexopoulos et al ., pp. 32–33.
- ^ Alexopoulos et al ., p. 33.
- ^ un b Gow, Neil AR; Latge, Jean-Paul; Munro, Carol A.; Heitman, Joseph (2017). “La paroi cellulaire fongique: structure, biosynthèse et fonction”. Spectre microbiologique . 5 (3). doi : 10.1128/microbiolspec.FUNK-0035-2016 . manche : 2164/8941 . PMID 28513415 .
- ^ Mihail JD, Bruhn JN (novembre 2005). “Comportement de recherche de nourriture des systèmes rhizomorphes d’Armillaria”. Recherche mycologique . 109 (Pt 11): 1195–207. doi : 10.1017/S0953756205003606 . PMID 16279413 .
- ^ un bcd Keller NP , Turner G, Bennett JW (décembre 2005). “Métabolisme secondaire fongique – de la biochimie à la génomique”. Revues naturelles. Microbiologie . 3 (12): 937–47. doi : 10.1038/nrmicro1286 . PMID 16322742 . S2CID 23537608 .
- ^ Wu S, Schalk M, Clark A, Miles RB, Coates R, Chappell J (novembre 2006). “La redirection des précurseurs isoprénoïdes cytosoliques ou plastidiques augmente la production de terpènes dans les plantes”. Biotechnologie naturelle . 24 (11): 1441–7. doi : 10.1038/nbt1251 . PMID 17057703 . S2CID 23358348 .
- ^ Tudzynski B (mars 2005). “La biosynthèse de la gibbérelline dans les champignons: gènes, enzymes, évolution et impact sur la biotechnologie”. Microbiologie appliquée et biotechnologie . 66 (6): 597–611. doi : 10.1007/s00253-004-1805-1 . PMID 15578178 . S2CID 11191347 .
- ^ Vaupotic T, Veranic P, Jenoe P, Plemenitas A (juin 2008). “Médiation mitochondriale de la discrimination des osmolytes environnementaux pendant l’osmoadaptation dans la levure noire extrêmement halotolérante Hortaea werneckii”. Génétique et biologie fongiques . 45 (6): 994-1007. doi : 10.1016/j.fgb.2008.01.006 . PMID 18343697 .
- ^ un b Dadachova E, Bryan RA, Huang X, Moadel T, Schweitzer AD, Aisen P, Nosanchuk JD, Casadevall A (2007). “Le rayonnement ionisant modifie les propriétés électroniques de la mélanine et améliore la croissance des champignons mélanisés” . PLOS ONE . 2 (5) : e457. Bibcode : 2007PLoSO…2..457D . doi : 10.1371/journal.pone.0000457 . PMC 1866175 . PMID 17520016 .
- ^ Raghukumar C, Raghukumar S (1998). “Barotolérance des champignons isolés des sédiments profonds de l’océan Indien” . Écologie microbienne aquatique . 15 (2): 153–163. doi : 10.3354/ame015153 .
- ^ Sancho LG, de la Torre R, Horneck G, Ascaso C, de Los Rios A, Pintado A, Wierzchos J, Schuster M (juin 2007). “Les lichens survivent dans l’espace: résultats de l’expérience 2005 LICHENS”. Astrobiologie . 7 (3): 443–54. Bibcode : 2007AsBio…7..443S . doi : 10.1089/ast.2006.0046 . PMID 17630840 . S2CID 4121180 .
- ^ Fisher, Matthew C.; Garner, Trenton WJ (2020). “Champignons chytrides et déclins mondiaux des amphibiens” . Examens de la nature Microbiologie . 18 (6): 332–343. doi : 10.1038/s41579-020-0335-x . hdl : 10044/1/78596 . PMID 32099078 . S2CID 211266075 .
- ↑ Vargas- Gastélum , Lluvia ; Riquelme, Meritxell (2020). “Le mycobiote des profondeurs marines : ce que les omiques peuvent offrir”. La vie . Vol. 10, non. 11. p. 292. doi : 10.3390/life10110292 . PMC 7699357 . PMID 33228036 .
- ^ Mueller GM, Schmit JP (2006). “Biodiversité fongique : que sait-on ? Que peut-on prédire ?”. Biodiversité et Conservation . 16 : 1–5. doi : 10.1007/s10531-006-9117-7 . S2CID 23827807 .
- ^ un b Kirk et autres ., p. 489.
- ^ un bcdef Hibbett DS , Binder M, Bischoff JF , Blackwell M, Cannon PF, Eriksson OE, et al. (mai 2007). “Une classification phylogénétique de niveau supérieur des champignons” (PDF) . Recherche mycologique . 111 (Pt 5): 509–47. CiteSeerX 10.1.1.626.9582 . doi : 10.1016/j.mycres.2007.03.004 . PMID 17572334 . S2CID 4686378 . Archivé de l’original (PDF) le 26 mars 2009.
- ^ Selon une estimation de 2001, quelque 10 000 maladies fongiques sont connues. Frappé C (2006). “Stratégies d’infection des champignons Parasites des plantes”. Dans Cooke BM, Jones DG, Kaye B (eds.). L’épidémiologie des maladies des plantes . Berlin, Allemagne : Springer. p. 117. ISBN 978-1-4020-4580-6.
- ^ Peintner U, Pöder R, Pümpel T (1998). “Les champignons de l’Iceman”. Recherche mycologique . 102 (10): 1153–1162. doi : 10.1017/S0953756298006546 .
- ^ Ainsworth, p. 1.
- ^ Alexopoulos et al., pp. 1–2.
- ^ Ainsworth, p. 18.
- ^ Hawksworth DL (septembre 2006). “Boîte mycologique de Pandore: séquences moléculaires vs morphologie dans la compréhension des relations fongiques et de la biodiversité”. Revista Iberoamericana de Micologia . 23 (3): 127-133. doi : 10.1016/S1130-1406(06)70031-6 . PMID 17196017 .
- ^ Harris SD (2008). “La ramification des hyphes fongiques : régulation, mécanismes et comparaison avec d’autres systèmes de ramification” . Mycologie . 100 (6): 823–32. doi : 10.3852/08-177 . PMID 19202837 . S2CID 2147525 . Archivé de l’original le 12 avril 2016 . Récupéré le 5 juillet 2011 .
- ^ Diacre, p. 51.
- ^ Diacre, p. 57.
- ^ Chang ST, Miles PG (2004). Champignons : culture, valeur nutritionnelle, effet médicinal et impact environnemental . Boca Raton, Floride : CRC Press. ISBN 978-0-8493-1043-0.
- ^ Bozkurt, Tolga O.; Kamoun, Sophien; Lennon-Duménil, Ana-Maria (2020). “L’interface haustorale plante-pathogène en un coup d’œil” . Journal des sciences cellulaires . 133 (5). doi : 10.1242/jcs.237958 . PMC 7075074 . PMID 32132107 .
- ^ Parniske M (octobre 2008). “Mycorhize arbusculaire: la mère des endosymbioses des racines des plantes”. Revues naturelles. Microbiologie . 6 (10): 763–75. doi : 10.1038/nrmicro1987 . PMID 18794914 . S2CID 5432120 .
- ^ Steenkamp ET, Wright J, Baldauf SL (janvier 2006). “Les origines protistes des animaux et des champignons” . Biologie moléculaire et évolution . 23 (1): 93-106. doi : 10.1093/molbev/msj011 . PMID 16151185 .
- ^ Hanson, pp. 127-141.
- ^ Ferguson BA, Dreisbach TA, Parcs CG, Filip GM, Schmitt CL (2003). “Structure de population à grande échelle d’espèces pathogènes d’ Armillaria dans une forêt mixte de conifères dans les Blue Mountains du nord-est de l’Oregon” . Journal canadien de la recherche forestière . 33 (4): 612–623. doi : 10.1139/x03-065 . Archivé de l’original le 3 juillet 2019 . Récupéré le 3 juillet 2019 .
- ^ Alexopoulos et al ., pp. 204–205.
- ^ Mousse ST (1986). La biologie des champignons marins . Cambridge, Royaume-Uni : Cambridge University Press . p. 76. ISBN 978-0-521-30899-1.
- ^ Peñalva MA, Arst HN (septembre 2002). “Régulation de l’expression des gènes par le pH ambiant dans les champignons filamenteux et les levures” . Examens de microbiologie et de biologie moléculaire . 66 (3) : 426–446, table des matières. doi : 10.1128/MMBR.66.3.426-446.2002 . PMC 120796 . PMID 12208998 .
- ^ un b Howard RJ, Ferrari MA, Roach DH, Money NP (décembre 1991). “Pénétration de substrats durs par un champignon employant d’énormes pressions de turgescence” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 88 (24): 11281–4. Bibcode : 1991PNAS…8811281H . doi : 10.1073/pnas.88.24.11281 . PMC 53118 . PMID 1837147 .
- ^ Argent NP (1998). “Mécanique de la croissance fongique invasive et l’importance de la turgescence dans l’infection des plantes”. Génétique moléculaire des toxines spécifiques à l’hôte dans les maladies des plantes : Actes du 3e Symposium international de Tottori sur les toxines spécifiques à l’hôte, Daisen, Tottori, Japon, 24-29 août 1997 . Pays-Bas : Kluwer Academic Publishers. p. 261–271. ISBN 978-0-7923-4981-5.
- ^ Wang ZY, Jenkinson JM, Holcombe LJ, Soanes DM, Veneault-Fourrey C, Bhambra GK, Talbot NJ (avril 2005). “La biologie moléculaire de la génération de turgescence d’appressorium par le champignon de l’explosion du riz Magnaporthe grisea”. Transactions de la société biochimique . 33 (Pt 2): 384–8. doi : 10.1042/BST0330384 . PMID 15787612 . S2CID 7111935 .
- ^ Pereira JL, Noronha EF, Miller RN, Franco OL (juin 2007). “Nouvelles connaissances sur l’utilisation d’enzymes hydrolytiques sécrétées par des champignons à potentiel biotechnologique” . Lettres en Microbiologie Appliquée . 44 (6): 573–81. doi : 10.1111/j.1472-765X.2007.02151.x . PMID 17576216 .
- ^ Schaller M, Borelli C, Korting HC, Hube B (novembre 2005). “Enzymes hydrolytiques comme facteurs de virulence de Candida albicans”. Mycoses . 48 (6): 365–77. doi : 10.1111/j.1439-0507.2005.01165.x . PMID 16262871 . S2CID 1356254 .
- ^ Farrar JF (octobre 1985). “Métabolisme des glucides dans les pathogènes végétaux biotrophes”. Sciences microbiologiques . 2 (10): 314–7. PMID 3939987 .
- ^ Fischer R, Zekert N, Takeshita N (mai 2008). “Croissance polarisée dans les champignons – interaction entre le cytosquelette, les marqueurs de position et les domaines membranaires”. Microbiologie moléculaire . 68 (4): 813–26. doi : 10.1111/j.1365-2958.2008.06193.x . PMID 18399939 . S2CID 205365895 .
- ^ Christensen MJ, Bennett RJ, Ansari HA, Koga H, Johnson RD, Bryan GT, Simpson WR, Koolaard JP, Nickless EM, Voisey CR (février 2008). “Les endophytes d’Epichloë se développent par extension d’hyphes intercalaires dans des feuilles d’herbe allongées”. Génétique et biologie fongiques . 45 (2): 84–93. doi : 10.1016/j.fgb.2007.07.013 . PMID 17919950 .
- ^ Argent NP (octobre 2002). “Cellules souches de champignons”. Bioessais . 24 (10): 949–52. doi : 10.1002/bies.10160 . PMID 12325127 .
- ^ Willensdorfer M (février 2009). “Sur l’évolution de la multicellularité différenciée”. Évolution; Journal international de l’évolution organique . 63 (2): 306–323. arXiv : 0801.2610 . doi : 10.1111/j.1558-5646.2008.00541.x . PMID 19154376 . S2CID 39155292 .
- ^ Daniels KJ, Srikantha T, Lockhart SR, Pujol C, Soll DR (mai 2006). “Les cellules opaques signalent aux globules blancs de former des biofilms chez Candida albicans ” . La revue EMBO . 25 (10): 2240–52. doi : 10.1038/sj.emboj.7601099 . PMC 1462973 . PMID 16628217 .
- ^ Tudzynski, Bettina (2014). “Régulation de l’azote du métabolisme secondaire fongique chez les champignons” . Frontières en microbiologie . 5 : 656. doi : 10.3389/fmicb.2014.00656 . PMC 4246892 . PMID 25506342 .
- ^ Hynes MJ (1994). “Circuits régulateurs du gène amdS d’ Aspergillus nidulans “. Antoine van Leeuwenhoek . 65 (3): 179–82. doi : 10.1007/BF00871944 . PMID 7847883 . S2CID 45815733 .
- ^ Dadachova E, Casadevall A (décembre 2008). “Radiation ionisante : comment les champignons font face, s’adaptent et exploitent à l’aide de la mélanine” . Opinion actuelle en microbiologie . 11 (6): 525–31. doi : 10.1016/j.mib.2008.09.013 . PMC 2677413 . PMID 18848901 .
- ^ Alexopoulos et al ., pp. 48-56.
- ^ Kirk et al ., p. 633.
- ^ Heitman J (septembre 2006). “Reproduction sexuée et évolution des pathogènes microbiens” . Biologie actuelle . 16 (17) : R711–25. doi : 10.1016/j.cub.2006.07.064 . PMID 16950098 . S2CID 2898102 .
- ^ Alcamo IE, Pommerville J (2004). Fondamentaux de la microbiologie d’Alcamo . Boston, Massachusetts : Jones et Bartlett. p. 590 . ISBN 978-0-7637-0067-6.
- ^ Ulloa, Miguel; Halin, Richard T. (2012). Dictionnaire illustré de mycologie (2e éd.). St. Paul, Minnesota : Société américaine de phytopathologie. p. 156. ISBN 978-0-89054-400-6.
- ^ un b Redecker D, Raab P (2006). « Phylogénie des gloméromycètes (champignons mycorhiziens à arbuscules) : développements récents et nouveaux marqueurs génétiques » . Mycologie . 98 (6): 885–95. doi : 10.3852/mycologia.98.6.885 . PMID 17486965 . Archivé de l’original le 23 septembre 2015 . Récupéré le 5 juillet 2011 .
- ^ Guarro J, Stchigel AM (juillet 1999). “Développements dans la taxonomie fongique” . Examens de microbiologie clinique . 12 (3): 454–500. doi : 10.1128/CMR.12.3.454 . PMC 100249 . PMID 10398676 .
- ^ un b Taylor JW, Jacobson DJ, Kroken S, Kasuga T, Geiser DM, Hibbett DS, Fisher MC (octobre 2000). “Reconnaissance des espèces phylogénétiques et concepts d’espèces chez les champignons”. Génétique et biologie fongiques . 31 (1): 21–32. doi : 10.1006/fgbi.2000.1228 . PMID 11118132 . S2CID 2551424 .
- ^ Metzenberg RL, Verre NL (février 1990). “Type d’accouplement et stratégies d’accouplement dans Neurospora”. Bioessais . 12 (2): 53–9. doi : 10.1002/bies.950120202 . PMID 2140508 . S2CID 10818930 .
- ^ Jennings et Lysek, pp. 107–114.
- ^ Diacre, p. 31.
- ^ Alexopoulos et al ., pp. 492–493.
- ^ Jennings et Lysek, p. 142.
- ^ Diacre, pp. 21-24.
- ^ un b “la Dispersion de Spore dans les Champignons” . botanique.hawaii.edu . Archivé de l’original le 17 novembre 2011 . Récupéré le 28 décembre 2018 .
- ^ “Dispersion” . herbarium.usu.edu . Archivé de l’original le 28 décembre 2018 . Récupéré le 28 décembre 2018 .
- ^ Hassett, Maribeth O.; Fischer, Mark WF; Argent, Nicholas P. (28 octobre 2015). “Champignons comme faiseurs de pluie: comment les spores agissent comme noyaux pour les gouttes de pluie” . PLOS ONE . 10 (10) : e0140407. Bibcode : 2015PLoSO..1040407H . doi : 10.1371/journal.pone.0140407 . ISSN 1932-6203 . PMC 4624964 . PMID 26509436 .
- ^ Kim, Seungho; Parc, Hyunggon; Gruszewski, Hope A.; Schmale, David G.; Jung, Sunghwan (12 mars 2019). “Dispersion induite par le vortex d’un agent pathogène des plantes par impact des gouttes de pluie” . Actes de l’Académie nationale des sciences . 116 (11): 4917–4922. Bibcode : 2019PNAS..116.4917K . doi : 10.1073/pnas.1820318116 . ISSN 0027-8424 . PMC 6421443 . PMID 30804195 .
- ^ Linder MB, Szilvay GR, Nakari-Setälä T, Penttilä ME (novembre 2005). “Hydrophobines: les protéines-amphiphiles des champignons filamenteux” . Examens de microbiologie FEMS . 29 (5): 877–96. doi : 10.1016/j.femsre.2005.01.004 . PMID 16219510 .
- ^ Sentier F (novembre 2007). “Canons fongiques: décharge de spores explosives dans l’Ascomycota” . Lettres de microbiologie FEMS . 276 (1) : 12–8. doi : 10.1111/j.1574-6968.2007.00900.x . PMID 17784861 .
- ^ Pringle A, Patek SN, Fischer M, Stolze J, Money NP (2005). “Le lancement capturé d’une balistospore” . Mycologie . 97 (4): 866–71. doi : 10.3852/mycologia.97.4.866 . PMID 16457355 . Archivé de l’original le 12 avril 2016 . Récupéré le 5 juillet 2011 .
- ^ Kirk et al ., p. 495.
- ^ “Champignons hydnoïdes stipités, Partenariat pour la biodiversité du Hampshire” (PDF) . Archivé (PDF) de l’original le 4 mars 2016 . Récupéré le 13 novembre 2019 .
- ^ Brodie HJ (1975). Les champignons du nid d’oiseau . Toronto, Ontario : Presses de l’Université de Toronto. p. 80. ISBN 978-0-8020-5307-7.
- ^ Alexopoulos et al ., p. 545.
- ^ Dyer PS, O’Gorman CM (janvier 2012). “Développement sexuel et sexualité cryptique chez les champignons: aperçus des espèces d’ Aspergillus ” . Microbiol FEMS. Rév . 36 (1): 165–192. doi : 10.1111/j.1574-6976.2011.00308.x . PMID 22091779 .
- ^ Yun SH, Berbee ML, Yoder OC, Turgeon BG (1999). “Evolution du style de vie reproductif autofertile fongique à partir d’ancêtres autostériles” . Proc Natl Acad Sci USA . 96 (10): 5592–7. Bibcode : 1999PNAS…96.5592Y . doi : 10.1073/pnas.96.10.5592 . PMC 21905 . PMID 10318929 . {{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Richard S, Almeida Jmgcf CO, Luraschi A, Nielsen O, Pagni M, Hauser PM (2018). “Les analyses fonctionnelles et d’expression des gènes Pneumocystis MAT suggèrent une sexualité obligatoire par homothallisme primaire dans les poumons de l’hôte” . mBio . 9 (1). doi : 10.1128/mBio.02201-17 . PMC 5821091 . PMID 29463658 . {{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Heitman, Joseph (2015). « Évolution de la reproduction sexuée : une vue du royaume fongique soutient une époque évolutive avec le sexe avant les sexes » . Revues de biologie fongique . 29 (3–4) : 108–117. doi : 10.1016/j.fbr.2015.08.002 . PMC 4730888 . PMID 26834823 .
- ^ Jennings et Lysek, pp. 114-115.
- ^ Furlaneto MC, Pizzirani-Kleiner AA (janvier 1992). « Hybridation intraspécifique de Trichoderma pseudokoningii par anastomose et par fusion de protoplastes » . Lettres de microbiologie FEMS . 69 (2): 191–5. doi : 10.1111/j.1574-6968.1992.tb05150.x . PMID 1537549 .
- ^ Schardl CL, Craven KD (novembre 2003). “L’hybridation interspécifique dans les champignons et les oomycètes associés aux plantes: une revue”. Écologie moléculaire . 12 (11): 2861–73. doi : 10.1046/j.1365-294X.2003.01965.x . PMID 14629368 . S2CID 25879264 .
- ^ Donoghue MJ; Cracraft J (2004). Assemblage de l’Arbre de Vie . Oxford (Oxfordshire), Royaume-Uni : Oxford University Press. p. 187. ISBN 978-0-19-517234-8.
- ^ Taylor et Taylor, p. 19.
- ^ Taylor et Taylor, pp. 7–12.
- ^ Bengtson, Stefan; Rasmussen, Birger; Ivarsson, Magnus; Muhling, Janet; Broman, Curt ; Marone, Federica; Stampanoni, Marco; Bekker, Andreï (24 avril 2017). “Fossiles mycéliens ressemblant à des champignons dans du basalte vésiculaire vieux de 2,4 milliards d’années” . Écologie de la nature et évolution . 1 (6) : 0141. doi : 10.1038/s41559-017-0141 . PMID 28812648 . S2CID 25586788 . Archivé de l’original le 15 juillet 2019 . Récupéré le 15 juillet 2019 .
- ^ Lücking R, Huhndorf S, Pfister DH, Plata ER, Lumbsch HT (2009). “Les champignons ont évolué sur la bonne voie” . Mycologie . 101 (6): 810-22. doi : 10.3852/09-016 . PMID 19927746 . S2CID 6689439 .
- ^ un bc James TY, Kauff F, Schoch CL, Matheny PB, Hofstetter V, Cox CJ, et al. (octobre 2006). “Reconstruire l’évolution précoce des champignons en utilisant une phylogénie à six gènes”. Nature . 443 (7113): 818–22. Bibcode : 2006Natur.443..818J . doi : 10.1038/nature05110 . PMID 17051209 . S2CID 4302864 .
- ^ Taylor et Taylor, pp. 84–94 et 106–107.
- ^ Schoch CL, Sung GH, López-Giráldez F, Townsend JP, Miadlikowska J, Hofstetter V, et al. (avril 2009). “L’arbre de vie Ascomycota: une phylogénie à l’échelle du phylum clarifie l’origine et l’évolution des traits fondamentaux de la reproduction et de l’écologie” . Biologie Systématique . 58 (2): 224–239. doi : 10.1093/sysbio/syp020 . PMID 20525580 .
- ^ Zimmer, Carl (22 mai 2019). “Comment la vie est-elle arrivée sur terre ? Un champignon vieux d’un milliard d’années peut contenir des indices – Une cache de fossiles microscopiques de l’Arctique indique que les champignons ont atteint la terre bien avant les plantes” . Le New York Times . Archivé de l’original le 23 mai 2019 . Récupéré le 23 mai 2019 .
- ↑ Loron, Corentin C. ; François, Camille; Rainbird, Robert H.; Turner, Elizabeth C.; Borensztajn, Stephan ; Javaux, Emmanuelle J. (22 mai 2019). “Les premiers champignons de l’ère protérozoïque dans l’Arctique canadien”. Nature . Springer Science et Business Media LLC . 570 (7760): 232–235. Bibcode : 2019Natur.570..232L . doi : 10.1038/s41586-019-1217-0 . ISSN 0028-0836 . PMID 31118507 . S2CID 162180486 .
- ^ Timmer, John (22 mai 2019). “Des fossiles vieux d’un milliard d’années pourraient être des champignons précoces” . Ars Technica . Archivé de l’original le 23 mai 2019 . Récupéré le 23 mai 2019 .
- ^ Gan, Tian; Luo, Taiyi; Pang, Ke ; Zhou, Chuanming; Zhou, Guanghong ; Wân, Bin ; Li, Gang ; Yi, Qiru ; Czaja, Andrew D.; Xiao, Shuhai (28 janvier 2021). “Fossiles terrestres cryptiques ressemblant à des champignons du début de la période édiacarienne” . Communication Nature . 12 (1): 641. doi : 10.1038/s41467-021-20975-1 . ISSN 2041-1723 . PMC 7843733 . PMID 33510166 .
- ^ un b Brundrett MC (2002). « Coévolution des racines et des mycorhizes des plantes terrestres » . Nouveau Phytologue . 154 (2): 275–304. doi : 10.1046/j.1469-8137.2002.00397.x . PMID 33873429 .
- ^ Redecker D, Kodner R, Graham LE (septembre 2000). “Champignons glomaléens de l’Ordovicien”. Sciences . 289 (5486): 1920–1. Bibcode : 2000Sci…289.1920R . doi : 10.1126/science.289.5486.1920 . PMID 10988069 . S2CID 43553633 .
- ^ Taylor TN, Taylor EL (1996). “La distribution et les interactions de certains champignons paléozoïques”. Revue de paléobotanique et de palynologie . 95 (1–4) : 83–94. doi : 10.1016/S0034-6667(96)00029-2 .
- ^ Dotzler N, Walker C, Krings M, Hass H, Kerp H, Taylor TN, Agerer R (2009). “Spores de gloméromycotan acaulosporoïdes avec un bouclier de germination du chert Rhynie vieux de 400 millions d’années” (PDF) . Progrès mycologique . 8 (1): 9–18. doi : 10.1007/s11557-008-0573-1 . manche : 1808/13680 . S2CID 1746303 .
- ^ Taylor JW, Berbee ML (2006). “Divergences de datation dans l’arbre de vie fongique: bilan et nouvelles analyses” . Mycologie . 98 (6) : 838–849. doi : 10.3852/mycologia.98.6.838 . PMID 17486961 . Archivé de l’original le 12 avril 2016 . Récupéré le 5 juillet 2011 .
- ^ Blackwell M, Vilgalys R, James TY, Taylor JW (2009). “Champignons. Eumycota : champignons, champignons du sac, levure, moisissures, rouilles, charbons, etc.” . Projet Web Arbre de vie. Archivé de l’original le 13 avril 2009 . Récupéré le 25 avril 2009 .
- ^ Honegger, Rosmarie ; Edwards, Diane; Hache, Lindsey (2013). “Les premiers enregistrements de lichens cyanobactériens et algaux stratifiés en interne du Dévonien inférieur de la frontière galloise”. Nouveau Phytologue . 197 (1): 264–275. doi : 10.1111/nph.12009 . PMID 23110612 .
- ^ Taylor TN, Hass H, Kerp H, Krings M, Hanlin RT (2005). “Ascomycètes périthèces du chert Rhynie vieux de 400 millions d’années: un exemple de polymorphisme ancestral” . Mycologie . 97 (1): 269-285. doi : 10.3852/mycologia.97.1.269 . manche : 1808/16786 . PMID 16389979 . Archivé de l’original le 12 avril 2016 . Récupéré le 5 juillet 2011 .
- ^ Dennis RL (1970). “Un mycélium de basidiomycète du Pennsylvanien moyen avec des connexions de serrage” . Mycologie . 62 (3): 578–584. doi : 10.2307/3757529 . JSTOR 3757529 . Archivé de l’original le 29 septembre 2018 . Récupéré le 5 juillet 2011 .
- ^ Hibbett DS, Grimaldi D, Donoghue MJ (1995). “Champignons du Crétacé dans l’ambre” . Nature . 377 (6549): 487. Bibcode : 1995Natur.377..487H . doi : 10.1038/377487a0 . S2CID 4346359 .
- ^ Hibbett DS, Grimaldi D, Donoghue MJ (1997). “Les champignons fossiles des ambres du Miocène et du Crétacé et l’évolution des homobasidiomycètes” . Journal américain de botanique . 84 (7): 981–991. doi : 10.2307/2446289 . JSTOR 2446289 . PMID 21708653 . S2CID 22011469 .
- ^ Eshet Y, Rampino MR, Visscher H (1995). “Événement fongique et enregistrement palynologique de la crise écologique et de la récupération à travers la limite Permien-Trias”. Géologie . 23 (1): 967–970. Bibcode : 1995Geo….23..967E . doi : 10.1130/0091-7613(1995)023<0967:FEAPRO>2.3.CO;2 . S2CID 58937537 .
- ^ Foster CB, Stephenson MH, Marshall C, Logan GA, Greenwood PF (2002). “Une révision des Reduviasporonites Wilson 1962: description, illustration, comparaison et affinités biologiques”. Palynologie . 26 (1): 35–58. doi : 10.2113/0260035 .
- ^ López-Gómez J, Taylor EL (2005). “Transition Permien-Trias en Espagne : une approche multidisciplinaire”. Paléogéographie, Paléoclimatologie, Paléoécologie . 229 (1–2) : 1–2. doi : 10.1016/j.paleo.2005.06.028 .
- ^ Looy CV, Twitchett RJ, Dilcher DL, Van Konijnenburg-Van Cittert JH, Visscher H (juillet 2001). “La vie dans la zone morte de la fin du Permien” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 98 (14): 7879–83. Bibcode : 2001PNAS…98.7879L . doi : 10.1073/pnas.131218098 . PMC 35436 . PMID 11427710 . Voir l’image 2
- ^ Ward PD, Botha J, Buick R, De Kock MO, Erwin DH, Garrison GH, Kirschvink JL, Smith R (février 2005). “Extinction abrupte et progressive parmi les vertébrés terrestres du Permien supérieur dans le bassin du Karoo, Afrique du Sud”. Sciences . 307 (5710): 709–14. Bibcode : 2005Sci…307..709W . CiteSeerX 10.1.1.503.2065 . doi : 10.1126/science.1107068 . PMID 15661973 . S2CID 46198018 .
- ^ Casadevall, Arturo; Heitman, Joseph (16 août 2012). “Les champignons et la montée des mammifères” . Pathogènes PLOS . 8 (8) : e1002808. doi : 10.1371/journal.ppat.1002808 . PMC 3420938 . PMID 22916007 . Cette calamité écologique s’est accompagnée d’une déforestation massive, un événement suivi d’une prolifération fongique, la terre devenant un compost massif.
- ^ un b Shalchian-Tabrizi K, Minge MA, Espelund M, Orr R, Ruden T, Jakobsen KS, Cavalier-Smith T (2008). « Phylogénie multigénique des choanozoaires et origine des animaux » . PLOS ONE . 3 (5) : e2098. Bibcode : 2008PLoSO…3.2098S . doi : 10.1371/journal.pone.0002098 . PMC 2346548 . PMID 18461162 .
- ^ un b Li Y, Steenwyk JL, Chang Y, Wang Y, James TY, Stajich JE, Spatafora JW, Groenewald M, Dunn CW, Hittinger CT, Shen X, Rokas, A (2021). “Une phylogénie à l’échelle du génome du royaume Fungi” . Biologie actuelle . 31 (8) : 1653-1665. doi : 10.1016/j.cub.2021.01.074 . PMC 8347878 . PMID 33607033 . }}
- ^ Voir Palaeos Fungi: Fungi Archivé le 20 juin 2012 à la Wayback Machine pour une introduction à la taxonomie fongique, y compris les controverses. archive
- ^ Celio GJ, Padamsee M, Dentinger BT, Bauer R, McLaughlin DJ (2006). “Assembling the Fungal Tree of Life: constructing the structural and biochemical database”. Mycologia. 98 (6): 850–9. doi:10.3852/mycologia.98.6.850. PMID 17486962. S2CID 23123595.
- ^ Rossman, Amy Y. (2014). “Lessons learned from moving to one scientific name for fungi”. IMA Fungus. 5 (1): 81–89. doi:10.5598/imafungus.2014.05.01.10. PMC 4107901. PMID 25083410.
- ^ Rousse, Scott; Norvell, Lorelei (2013). “MycoBank, Index Fungorum et Fungal Names recommandés comme référentiels nomenclaturaux officiels pour 2013” . Champignon IMA . 3 (2): 44–45.
- ^ Silar P (2016). Protistes Eucaryotes : Origine, Evolution et Biologie des Microbes Eucaryotes . HAL. p. 462.ISBN _ 978-2-9555841-0-1. Archivé de l’original le 25 septembre 2017 . Récupéré le 7 avril 2016 .
- ^ Esser K (2014). McLaughlin DJ, Spatafora JW (éd.). Le Mycota VII A: Systématique et évolution (2e éd.) . Le Mycote. Springer. p. 461. doi : 10.1007/978-3-642-55318-9 . ISBN 978-3-642-55317-2. S2CID 46141350 .
- ^ Tedersoo, Lého; Sanchez-Ramirez, Santiago ; Koljalg, Ourmas ; Bahram, Mohammed ; Doring, Markus; Schigel, Dimitri ; Mai, Tom ; Ryberg, Martin; Abarenkov, Kessy (22 février 2018). “Classification de haut niveau des Champignons et outil d’analyses écologiques évolutives” . Diversité fongique . 90 (1): 135–159. doi : 10.1007/s13225-018-0401-0 .
- ^ un b Naranjo-Ortiz, Miguel A.; Gabaldón, Toni (2019). « Évolution fongique : diversité, taxonomie et phylogénie des champignons » . Revues biologiques . 94 (6): 2101-2137. doi : 10.1111/brv.12550 . PMC 6899921 . PMID 31659870 .
- ^ Han, Bing; Weiss, Louis M.; Heitman, Joseph; Stukenbrock, Eva Holtgrewe (2017). “Microsporidia: Obligate intracellular pathogens within the fungal kingdom”. Microbiology Spectrum. 5 (2). doi:10.1128/microbiolspec.FUNK-0018-2016. PMC 5613672. PMID 28944750.
- ^ James TY, Letcher PM, Longcore JE, Mozley-Standridge SE, Porter D, Powell MJ, Griffith GW, Vilgalys R (2006). “A molecular phylogeny of the flagellated fungi (Chytridiomycota) and description of a new phylum (Blastocladiomycota)”. Mycologia. 98 (6): 860–71. doi:10.3852/mycologia.98.6.860. PMID 17486963. Archived from the original on 23 September 2015. Retrieved 5 July 2011.
- ^ Lockhart RJ, Van Dyke MI, Beadle IR, Humphreys P, McCarthy AJ (August 2006). “Molecular biological detection of anaerobic gut fungi (Neocallimastigales) from landfill sites”. Applied and Environmental Microbiology. 72 (8): 5659–61. Bibcode:2006ApEnM..72.5659L. doi:10.1128/AEM.01057-06. PMC 1538735. PMID 16885325.
- ^ a b Remy W, Taylor TN, Hass H, Kerp H (December 1994). “Four hundred-million-year-old vesicular arbuscular mycorrhizae”. Proceedings of the National Academy of Sciences of the United States of America. 91 (25): 11841–3. Bibcode:1994PNAS…9111841R. doi:10.1073/pnas.91.25.11841. PMC 45331. PMID 11607500.
- ^ Schüssler A, Schwarzott D, Walker C (2001). “A new fungal phylum, the Glomeromycota: phylogeny and evolution”. Mycological Research. 105 (12): 1413–1421. doi:10.1017/S0953756201005196. S2CID 82128210.
- ^ Alexopoulos et al., p. 145.
- ^ Walther, Grit; Wagner, Lysett; Kurzai, Oliver (2019). “Updates on the taxonomy of Mucorales with an emphasis on clinically important taxa”. Journal of Fungi. 5 (4): 106. doi:10.3390/jof5040106. PMC 6958464. PMID 31739583.
- ^ For an example, see Samuels GJ (February 2006). “Trichoderma: systematics, the sexual state, and ecology”. Phytopathology. 96 (2): 195–206. doi:10.1094/PHYTO-96-0195. PMID 18943925.
- ^ Aramayo, Rodolfo; Selker, Erik U. (2013). “Neurospora crassa, a model system for epigenetics research”. Cold Spring Harbor Perspectives in Biology. 5 (10): a017921. doi:10.1101/cshperspect.a017921. PMC 3783048. PMID 24086046.
- ^ Olicón-Hernández, Dario R.; Araiza-Villanueva, Minerva G.; Pardo, Juan P.; Aranda, Elisabet; Guerra-Sánchez, Guadalupe (2019). “New insights of Ustilago maydis as yeast model for genetic and biotechnological research: A review”. Current Microbiology. 76 (8): 917–926. doi:10.1007/s00284-019-01629-4. PMID 30689003. S2CID 59307118.
- ^ Rhimi, Wafa; Theelen, Bart; Boekhout, Teun; Otranto, Domenico; Cafarchia, Claudia (2020). “Malassezia spp. yeasts of emerging concern in fungemia”. Frontiers in Cellular and Infection Microbiology. 10: 370. doi:10.3389/fcimb.2020.00370. PMC 7399178. PMID 32850475.
- ^ Perfect JR (June 2006). “Cryptococcus neoformans: the yeast that likes it hot”. FEMS Yeast Research. 6 (4): 463–8. doi:10.1111/j.1567-1364.2006.00051.x. PMID 16696642.
- ^ Leontyev, Dmitry V.; Schnittler, Martin (2017). “The phylogeny of Myxomycetes”. In Stephenson, Steven L.; Rojas, Carlos (eds.). Myxomycetes. Biology, Systematics, Biogeography, and Ecology. Academic Press. pp. 83–106. doi:10.1016/B978-0-12-805089-7.00003-2. ISBN 978-0-12-805089-7.
- ^ Blackwell M, Spatafora JW (2004). “Fungi and their allies”. In Bills GF, Mueller GM, Foster MS (eds.). Biodiversity of Fungi: Inventory and Monitoring Methods. Amsterdam: Elsevier Academic Press. pp. 18–20. ISBN 978-0-12-509551-8.
- ^ Amoroso, Maria Julia; Benimeli, Claudia Susana; Cuozzo, Sergio Antonio (2013). Actinobacteria : application in bioremediation and production of industrial enzymes. CRC Press, Taylor & Francis Group. p. 33. ISBN 9781466578739.
- ^ An introduction to soil biology, Actinobacteria
- ^ Gadd GM (January 2007). “Geomycology: biogeochemical transformations of rocks, minerals, metals and radionuclides by fungi, bioweathering and bioremediation”. Mycological Research. 111 (Pt 1): 3–49. doi:10.1016/j.mycres.2006.12.001. PMID 17307120.
- ^ a b Lindahl BD, Ihrmark K, Boberg J, Trumbore SE, Högberg P, Stenlid J, Finlay RD (2007). “Spatial separation of litter decomposition and mycorrhizal nitrogen uptake in a boreal forest”. The New Phytologist. 173 (3): 611–20. doi:10.1111/j.1469-8137.2006.01936.x. PMID 17244056.
- ^ Barea JM, Pozo MJ, Azcón R, Azcón-Aguilar C (July 2005). “Microbial co-operation in the rhizosphere”. Journal of Experimental Botany. 56 (417): 1761–78. doi:10.1093/jxb/eri197. PMID 15911555.
- ^ a b Aanen DK (June 2006). “As you reap, so shall you sow: coupling of harvesting and inoculating stabilizes the mutualism between termites and fungi”. Biology Letters. 2 (2): 209–12. doi:10.1098/rsbl.2005.0424. PMC 1618886. PMID 17148364.
- ^ Nikoh N, Fukatsu T (April 2000). “Interkingdom host jumping underground: phylogenetic analysis of entomoparasitic fungi of the genus cordyceps”. Molecular Biology and Evolution. 17 (4): 629–38. doi:10.1093/oxfordjournals.molbev.a026341. PMID 10742053.
- ^ Perotto S, Bonfante P (December 1997). “Bacterial associations with mycorrhizal fungi: close and distant friends in the rhizosphere”. Trends in Microbiology. 5 (12): 496–501. doi:10.1016/S0966-842X(97)01154-2. PMID 9447662.
- ^ Arnold AE, Mejía LC, Kyllo D, Rojas EI, Maynard Z, Robbins N, Herre EA (December 2003). “Fungal endophytes limit pathogen damage in a tropical tree”. Proceedings of the National Academy of Sciences of the United States of America. 100 (26): 15649–54. Bibcode:2003PNAS..10015649A. doi:10.1073/pnas.2533483100. PMC 307622. PMID 14671327.
- ^ a b Paszkowski U (August 2006). “Mutualism and parasitism: the yin and yang of plant symbioses”. Current Opinion in Plant Biology. 9 (4): 364–70. doi:10.1016/j.pbi.2006.05.008. PMID 16713732.
- ^ a b Hube B (August 2004). “From commensal to pathogen: stage- and tissue-specific gene expression of Candida albicans“. Current Opinion in Microbiology. 7 (4): 336–41. doi:10.1016/j.mib.2004.06.003. PMID 15288621.
- ^ Bonfante P (April 2003). “Plants, mycorrhizal fungi and endobacteria: a dialog among cells and genomes”. The Biological Bulletin. 204 (2): 215–20. doi:10.2307/1543562. JSTOR 1543562. PMID 12700157. S2CID 12377410.
- ^ van der Heijden MG, Streitwolf-Engel R, Riedl R, Siegrist S, Neudecker A, Ineichen K, Boller T, Wiemken A, Sanders IR (2006). “The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland”. The New Phytologist. 172 (4): 739–52. doi:10.1111/j.1469-8137.2006.01862.x. PMID 17096799. S2CID 17048094.
- ^ Heijden, Marcel G. A. van der (15 April 2016). “Underground networking”. Science. 352 (6283): 290–291. Bibcode:2016Sci…352..290H. doi:10.1126/science.aaf4694. ISSN 0036-8075. PMID 27081054. S2CID 133399719.
- ^ Selosse MA, Richard F, He X, Simard SW (November 2006). “Mycorrhizal networks: des liaisons dangereuses?”. Trends in Ecology & Evolution. 21 (11): 621–8. doi:10.1016/j.tree.2006.07.003. PMID 16843567.
- ^ Yong, Ed (14 April 2016). “Trees Have Their Own Internet”. The Atlantic. Archived from the original on 28 March 2019. Retrieved 9 March 2019.
- ^ Merckx V, Bidartondo MI, Hynson NA (December 2009). “Myco-heterotrophy: when fungi host plants”. Annals of Botany. 104 (7): 1255–61. doi:10.1093/aob/mcp235. PMC 2778383. PMID 19767309.
- ^ Schulz B, Boyle C (June 2005). “The endophytic continuum”. Mycological Research. 109 (Pt 6): 661–86. doi:10.1017/S095375620500273X. PMID 16080390. S2CID 23182632.
- ^ Clay K, Schardl C (October 2002). “Evolutionary origins and ecological consequences of endophyte symbiosis with grasses”. The American Naturalist. 160 Suppl 4 (suppl. 4): S99–S127. doi:10.1086/342161. PMID 18707456. S2CID 23909652.
- ^ Brodo IM, Sharnoff SD (2001). Lichens of North America. New Haven, Connecticut: Yale University Press. ISBN 978-0-300-08249-4.
- ^ Raven PH, Evert RF, Eichhorn, SE (2005). “14—Fungi”. Biology of Plants (7 ed.). W. H. Freeman. p. 290. ISBN 978-0-7167-1007-3.
- ^ Deacon, p. 267.
- ^ Purvis W (2000). Lichens. Washington, D.C.: Smithsonian Institution Press in association with the Natural History Museum, London. pp. 49–75. ISBN 978-1-56098-879-3.
- ^ Kirk et al., p. 378.
- ^ Garrido-Benavent, Isaac; Pérez-Ortega, Sergio (2017). “Past, present, and future research in bipolar lichen-forming fungi and their photobionts”. American Journal of Botany. 104 (11): 1660–1674. doi:10.3732/ajb.1700182.
- ^ Deacon, pp. 267–276.
- ^ Chomicki, Guillaume; Renner, Susanne S. (2017). “The interactions of ants with their biotic environment”. Proceedings of the Royal Society B: Biological Sciences. 284 (1850): 20170013. doi:10.1098/rspb.2017.0013. PMC 5360932. PMID 28298352.
- ^ Joseph, Ross; Keyhani, Nemat O. (2021). “Fungal mutualisms and pathosystems: life and death in the ambrosia beetle mycangia”. Applied Microbiology and Biotechnology. 105 (9): 3393–3410. doi:10.1007/s00253-021-11268-0. PMID 33837831. S2CID 233200379.
- ^ Deacon, p. 277.
- ^ “Entomologists: Brazilian Stingless Bee Must Cultivate Special Type of Fungus to Survive”. Sci-News.com. 23 October 2015. Archived from the original on 25 October 2015. Retrieved 25 October 2015.
- ^ Nguyen NH, Suh SO, Blackwell M (2007). “Five novel Candida species in insect-associated yeast clades isolated from Neuroptera and other insects”. Mycologia. 99 (6): 842–58. doi:10.3852/mycologia.99.6.842. PMID 18333508. Archived from the original on 7 May 2017. Retrieved 5 July 2011.
- ^ a b Filipiak, Michał; Weiner, January (March 2017). “Nutritional dynamics during the development of xylophagous beetles related to changes in the stoichiometry of 11 elements”. Physiological Entomology. 42 (1): 73–84. doi:10.1111/phen.12168.
- ^ a b Ulyshen, Michael D. (2018). Saproxylic insects : diversity, ecology and conservation. Springer, Cham. pp. 429–469. doi:10.1007/978-3-319-75937-1_13. ISBN 978-3-319-75937-1.
- ^ a b Ulyshen, Michael D. (2018). Saproxylic Insects Diversity, Ecology and Conservation. Springer, Cham. pp. 377–427. doi:10.1007/978-3-319-75937-1_12. ISBN 978-3-319-75936-4.
- ^ Filipiak, Michał; Sobczyk, Łukasz; Weiner, January (2016). “Fungal transformation of tree stumps into a suitable resource for xylophagous beetles via changes in elemental ratios”. Insects. 7 (2): 13. doi:10.3390/insects7020013. PMC 4931425.
- ^ Jakovlev, Jevgeni (2012). “Fungal hosts of mycetophilids (Diptera: Sciaroidea excluding Sciaridae): a review”. Mycology. 3 (1): 11–23. doi:10.1080/21501203.2012.662533 (inactive 28 February 2022).{{cite journal}}: CS1 maint: DOI inactive as of February 2022 (link)
- ^ Fernandez, Jessie; Orth, Kim (2018). “Rise of a cereal killer: the biology of Magnaporthe oryzae biotrophic growth”. Trends in Microbiology. 26 (7): 582–597. doi:10.1016/j.tim.2017.12.007. PMC 6003838. PMID 29395728.
- ^ Santini, Alberto; Battisti, Andrea (2019). “Complex insect–pathogen interactions in tree pandemics”. Frontiers in Physiology. 10: 550. doi:10.3389/fphys.2019.00550. PMC 6517489. PMID 31133880.
- ^ Rigling, Daniel; Prospero, Simone (2018). “Cryphonectria parasitica, the causal agent of chestnut blight: invasion history, population biology and disease control”. Molecular Plant Pathology. 19 (1): 7–20. doi:10.1111/mpp.12542. PMC 6638123. PMID 28142223.
- ^ Yang Y, Yang E, An Z, Liu X (May 2007). “Evolution of nematode-trapping cells of predatory fungi of the Orbiliaceae based on evidence from rRNA-encoding DNA and multiprotein sequences”. Proceedings of the National Academy of Sciences of the United States of America. 104 (20): 8379–84. Bibcode:2007PNAS..104.8379Y. doi:10.1073/pnas.0702770104. PMC 1895958. PMID 17494736.
- ^ Koeck, M.; Hardham, A.R.; Dodds; P.N. (2011). “The role of effectors of biotrophic and hemibiotrophic fungi in infection”. Cellular Microbiology. 13 (12): 1849–1857. doi:10.1111/j.1462-5822.2011.01665.x. PMC 3218205. PMID 21848815.
- ^ “Asterotremella gen. nov. albida, an anamorphic tremelloid yeast isolated from the agarics Asterophora lycoperdoides and Asterophora parasitica”. ResearchGate. Retrieved 19 April 2019.
- ^ Nielsen K, Heitman J (2007). “Sex and Virulence of Human Pathogenic fungi“. Fungal Genomics. Advances in Genetics. Vol. 57. pp. 143–73. doi:10.1016/S0065-2660(06)57004-X. ISBN 978-0-12-017657-1. PMID 17352904.
- ^ Brakhage AA (December 2005). “Systemic fungal infections caused by Aspergillus species: epidemiology, infection process and virulence determinants”. Current Drug Targets. 6 (8): 875–86. doi:10.2174/138945005774912717. PMID 16375671.
- ^ Kauffman CA (January 2007). “Histoplasmosis: a clinical and laboratory update”. Clinical Microbiology Reviews. 20 (1): 115–32. doi:10.1128/CMR.00027-06. PMC 1797635. PMID 17223625.
- ^ Cushion MT, Smulian AG, Slaven BE, Sesterhenn T, Arnold J, Staben C, Porollo A, Adamczak R, Meller J (2007). “Transcriptome of Pneumocystis carinii during fulminate infection: carbohydrate metabolism and the concept of a compatible parasite”. PLOS ONE. 2 (5): e423. Bibcode:2007PLoSO…2..423C. doi:10.1371/journal.pone.0000423. PMC 1855432. PMID 17487271.
- ^ Cook GC, Zumla AI (2008). Manson’s Tropical Diseases: Expert Consult. Edinburgh, Scotland: Saunders Ltd. p. 347. ISBN 978-1-4160-4470-3.
- ^ Simon-Nobbe B, Denk U, Pöll V, Rid R, Breitenbach M (2008). “The spectrum of fungal allergy”. International Archives of Allergy and Immunology. 145 (1): 58–86. doi:10.1159/000107578. PMID 17709917.
- ^ Thambugala, Kasun M.; Daranagama, Dinushani A.; Phillips, Alan J. L.; Kannangara, Sagarika D.; Promputtha, Itthayakorn (2020). “Fungi vs. fungi in biocontrol: An overview of fungal antagonists applied against fungal plant pathogens”. Frontiers in Cellular and Infection Microbiology. 10: 604923. doi:10.3389/fcimb.2020.604923. PMC 7734056. PMID 33330142.
- ^ Pearson MN, Beever RE, Boine B, Arthur K (January 2009). “Mycoviruses of filamentous fungi and their relevance to plant pathology”. Molecular Plant Pathology. 10 (1): 115–28. doi:10.1111/j.1364-3703.2008.00503.x. PMC 6640375. PMID 19161358.
- ^ Bozarth RF (October 1972). “Mycoviruses: a new dimension in microbiology”. Environmental Health Perspectives. 2 (1): 23–39. doi:10.1289/ehp.720223. PMC 1474899. PMID 4628853.
- ^ Schardl CL, Panaccione DG, Tudzynski P (2006). Ergot alkaloids–biology and molecular biology. The Alkaloids: Chemistry and Biology. Vol. 63. pp. 45–86. doi:10.1016/S1099-4831(06)63002-2. ISBN 978-0-12-469563-4. PMID 17133714.
- ^ Janik, Edyta; Niemcewicz, Marcin; Ceremuga, Michal; Stela, Maksymilian; Saluk-Bijak, Joanna; Siadkowski, Adrian; Bijak, Michal (2020). “Molecular aspects of mycotoxins—a serious problem for human health”. International Journal of Molecular Sciences. 21 (21): 8187. doi:10.3390/ijms21218187. PMC 7662353. PMID 33142955.
- ^ Demain AL, Fang A (2000). “The Natural Functions of Secondary Metabolites”. History of Modern Biotechnology I. Advances in Biochemical Engineering/Biotechnology. Vol. 69. pp. 1–39. doi:10.1007/3-540-44964-7_1. ISBN 978-3-540-67793-2. PMID 11036689.
- ^ Rohlfs M, Albert M, Keller NP, Kempken F (October 2007). “Secondary chemicals protect mould from fungivory”. Biology Letters. 3 (5): 523–5. doi:10.1098/rsbl.2007.0338. PMC 2391202. PMID 17686752.
- ^ Molina L, Kahmann R (July 2007). “An Ustilago maydis gene involved in H2O2 detoxification is required for virulence”. The Plant Cell. 19 (7): 2293–309. doi:10.1105/tpc.107.052332. PMC 1955693. PMID 17616735.
- ^ Kojic M, Zhou Q, Lisby M, Holloman WK (January 2006). “Rec2 interplay with both Brh2 and Rad51 balances recombinational repair in Ustilago maydis”. Molecular and Cellular Biology. 26 (2): 678–88. doi:10.1128/MCB.26.2.678-688.2006. PMC 1346908. PMID 16382157.
- ^ a b Michod RE, Bernstein H, Nedelcu AM (May 2008). “Adaptive value of sex in microbial pathogens” (PDF). Infection, Genetics and Evolution. 8 (3): 267–85. doi:10.1016/j.meegid.2008.01.002. PMID 18295550. Archived (PDF) from the original on 16 May 2017. Retrieved 22 July 2013.
- ^ a b Fan W, Kraus PR, Boily MJ, Heitman J (August 2005). “Cryptococcus neoformans gene expression during murine macrophage infection”. Eukaryotic Cell. 4 (8): 1420–33. doi:10.1128/EC.4.8.1420-1433.2005. PMC 1214536. PMID 16087747.
- ^ a b Lin X, Hull CM, Heitman J (April 2005). “Sexual reproduction between partners of the same mating type in Cryptococcus neoformans“. Nature. 434 (7036): 1017–21. Bibcode:2005Natur.434.1017L. doi:10.1038/nature03448. PMID 15846346. S2CID 52857557.
- ^ Fincham JR (March 1989). “Transformation in fungi”. Microbiological Reviews. 53 (1): 148–70. doi:10.1128/MMBR.53.1.148-170.1989. PMC 372721. PMID 2651864.
- ^ Baghban, Roghayyeh; Farajnia, Safar; Rajabibazl, Masoumeh; Ghasemi, Younes; Mafi, AmirAli; Hoseinpoor, Reyhaneh; Rahbarnia, Leila; Aria, Maryam (2019). “Yeast expression systems: Overview and recent advances”. Molecular Biotechnology. 61 (5): 365–384. doi:10.1007/s12033-019-00164-8. PMID 30805909. S2CID 73501127.
- ^ Huang B, Guo J, Yi B, Yu X, Sun L, Chen W (July 2008). “Heterologous production of secondary metabolites as pharmaceuticals in Saccharomyces cerevisiae“. Biotechnology Letters. 30 (7): 1121–37. doi:10.1007/s10529-008-9663-z. PMID 18512022. S2CID 2222358.
- ^ Pathak A, Nowell RW, Wilson CG, Ryan MJ, Barraclough TG (September 2020). “Comparative genomics of Alexander Fleming’s original Penicillium isolate (IMI 15378) reveals sequence divergence of penicillin synthesis genes”. Scientific Reports. 10 (1): Article 15705. Bibcode:2020NatSR..1015705P. doi:10.1038/s41598-020-72584-5. PMC 7515868. PMID 32973216.
- ^ Brakhage AA, Spröte P, Al-Abdallah Q, Gehrke A, Plattner H, Tüncher A (2004). “Regulation of Penicillin Biosynthesis in Filamentous Fungi”. Molecular Biotechnology of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases. Advances in Biochemical Engineering/Biotechnology. Vol. 88. pp. 45–90. doi:10.1007/b99257. ISBN 978-3-540-22032-9. PMID 15719552.
- ^ Pan A, Lorenzotti S, Zoncada A (January 2008). “Registered and investigational drugs for the treatment of methicillin-resistant Staphylococcus aureus infection”. Recent Patents on Anti-Infective Drug Discovery. 3 (1): 10–33. doi:10.2174/157489108783413173. PMID 18221183.
- ^ Fajardo A, Martínez JL (April 2008). “Antibiotics as signals that trigger specific bacterial responses”. Current Opinion in Microbiology. 11 (2): 161–7. doi:10.1016/j.mib.2008.02.006. PMID 18373943.
- ^ Loo DS (2006). “Systemic antifungal agents: an update of established and new therapies”. Advances in Dermatology. 22: 101–24. doi:10.1016/j.yadr.2006.07.001. PMID 17249298.
- ^ Manzoni M, Rollini M (April 2002). “Biosynthesis and biotechnological production of statins by filamentous fungi and application of these cholesterol-lowering drugs”. Applied Microbiology and Biotechnology. 58 (5): 555–64. doi:10.1007/s00253-002-0932-9. PMID 11956737. S2CID 5761188.
- ^ el-Mekkawy S, Meselhy MR, Nakamura N, Tezuka Y, Hattori M, Kakiuchi N, Shimotohno K, Kawahata T, Otake T (November 1998). “Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum”. Phytochemistry. 49 (6): 1651–7. doi:10.1016/S0031-9422(98)00254-4. PMID 9862140.
- ^ El Dine RS, El Halawany AM, Ma CM, Hattori M (June 2008). “Anti-HIV-1 protease activity of lanostane triterpenes from the vietnamese mushroom Ganoderma colossum”. Journal of Natural Products. 71 (6): 1022–6. doi:10.1021/np8001139. PMID 18547117.
- ^ a b Hetland G, Johnson E, Lyberg T, Bernardshaw S, Tryggestad AM, Grinde B (October 2008). “Effects of the medicinal mushroom Agaricus blazei Murill on immunity, infection and cancer”. Scandinavian Journal of Immunology. 68 (4): 363–70. doi:10.1111/j.1365-3083.2008.02156.x. PMID 18782264. S2CID 3866471.
- ^ Sullivan R, Smith JE, Rowan NJ (2006). “Medicinal mushrooms and cancer therapy: translating a traditional practice into Western medicine”. Perspectives in Biology and Medicine. 49 (2): 159–70. doi:10.1353/pbm.2006.0034. PMID 16702701. S2CID 29723996.
- ^ Halpern GM, Miller A (2002). Medicinal Mushrooms: Ancient Remedies for Modern Ailments. New York, New York: M. Evans and Co. p. 116. ISBN 978-0-87131-981-4.
- ^ Fritz, Heidi; Kennedy, Deborah A.; Ishii, Mami; Fergusson, Dean; Fernandes, Rochelle; Cooley, Kieran; Seely, Dugald (2015). “Polysaccharide K and Coriolus versicolor extracts for lung cancer”. Integrative Cancer Therapies. 14 (3): 201–211. doi:10.1177/1534735415572883. PMID 25784670.
- ^ Firenzuoli F, Gori L, Lombardo G (March 2008). “The Medicinal Mushroom Agaricus blazei Murrill: Review of Literature and Pharmaco-Toxicological Problems”. Evidence-Based Complementary and Alternative Medicine. 5 (1): 3–15. doi:10.1093/ecam/nem007. PMC 2249742. PMID 18317543.
- ^ Lu, Jiahui; He, Rongjun; Sun, Peilong; Zhang, Fuming; Linhardt, Robert J.; Zhang, Anqiang (2020). “Molecular mechanisms of bioactive polysaccharides from Ganoderma lucidum (Lingzhi), a review”. International Journal of Biological Macromolecules. 150: 765–774. doi:10.1016/j.ijbiomac.2020.02.035. PMID 32035956. S2CID 211071754.
- ^ Olatunji, Opeyemi Joshua; Tang, Jian; Tola, Adesola; Auberon, Florence; Oluwaniyi, Omolara; Ouyang, Zhen (2018). “The genus Cordyceps: An extensive review of its traditional uses, phytochemistry and pharmacology”. Fitoterapia. 129: 293–316. doi:10.1016/j.fitote.2018.05.010. PMID 29775778. S2CID 21741034.
- ^ Kulp K (2000). Handbook of Cereal Science and Technology. CRC Press. ISBN 978-0-8247-8294-8.
- ^ Piskur J, Rozpedowska E, Polakova S, Merico A, Compagno C (April 2006). “How did Saccharomyces evolve to become a good brewer?”. Trends in Genetics. 22 (4): 183–6. doi:10.1016/j.tig.2006.02.002. PMID 16499989.
- ^ Abe K, Gomi K, Hasegawa F, Machida M (September 2006). “Impact of Aspergillus oryzae genomics on industrial production of metabolites”. Mycopathologia. 162 (3): 143–53. doi:10.1007/s11046-006-0049-2. PMID 16944282. S2CID 36874528.
- ^ Hachmeister KA, Fung DY (1993). “Tempeh: a mold-modified indigenous fermented food made from soybeans and/or cereal grains”. Critical Reviews in Microbiology. 19 (3): 137–88. doi:10.3109/10408419309113527. PMID 8267862.
- ^ Jørgensen TR (December 2007). “Identification and toxigenic potential of the industrially important fungi, Aspergillus oryzae and Aspergillus sojae“. Journal of Food Protection. 70 (12): 2916–34. doi:10.4315/0362-028X-70.12.2916. PMID 18095455.
- ^ O’Donnell K, Cigelnik E, Casper HH (February 1998). “Molecular phylogenetic, morphological, and mycotoxin data support reidentification of the Quorn mycoprotein fungus as Fusarium venenatum“. Fungal Genetics and Biology. 23 (1): 57–67. doi:10.1006/fgbi.1997.1018. PMID 9501477.
- ^ Stamets P (2000). Growing Gourmet and Medicinal Mushrooms [Shokuyō oyobi yakuyō kinoko no saibai]. Berkeley, California: Ten Speed Press. pp. 233–248. ISBN 978-1-58008-175-7.
- ^ Hall, pp. 13–26.
- ^ Kinsella JE, Hwang DH (November 1976). “Enzymes of Penicillium roqueforti involved in the biosynthesis of cheese flavor”. Critical Reviews in Food Science and Nutrition. 8 (2): 191–228. doi:10.1080/10408397609527222. PMID 21770.
- ^ Erdogan A, Gurses M, Sert S (August 2003). “Isolation of moulds capable of producing mycotoxins from blue mouldy Tulum cheeses produced in Turkey”. International Journal of Food Microbiology. 85 (1–2): 83–5. doi:10.1016/S0168-1605(02)00485-3. PMID 12810273.
- ^ Orr DB, Orr RT (1979). Mushrooms of Western North America. Berkeley, California: University of California Press. p. 17. ISBN 978-0-520-03656-7.
- ^ Vetter J (January 1998). “Toxins of Amanita phalloides”. Toxicon. 36 (1): 13–24. doi:10.1016/S0041-0101(97)00074-3. PMID 9604278.
- ^ Leathem AM, Dorran TJ (March 2007). “Poisoning due to raw Gyromitra esculenta (false morels) west of the Rockies”. Canadian Journal of Emergency Medicine. 9 (2): 127–30. doi:10.1017/s1481803500014937. PMID 17391587.
- ^ Karlson-Stiber C, Persson H (September 2003). “Cytotoxic fungi–an overview”. Toxicon. 42 (4): 339–49. doi:10.1016/S0041-0101(03)00238-1. PMID 14505933.
- ^ Michelot D, Melendez-Howell LM (February 2003). “Amanita muscaria: chemistry, biology, toxicology, and ethnomycology”. Mycological Research. 107 (Pt 2): 131–46. doi:10.1017/S0953756203007305. PMID 12747324. S2CID 41451034.
- ^ Hall, p. 7.
- ^ Ammirati JF, McKenny M, Stuntz DE (1987). The New Savory Wild Mushroom. Seattle, Washington: University of Washington Press. pp. xii–xiii. ISBN 978-0-295-96480-5.
- ^ López-Gómez J, Molina-Meyer M (February 2006). “The competitive exclusion principle versus biodiversity through competitive segregation and further adaptation to spatial heterogeneities”. Theoretical Population Biology. 69 (1): 94–109. doi:10.1016/j.tpb.2005.08.004. PMID 16223517.
- ^ Becker H (1998). “Setting the Stage To Screen Biocontrol Fungi”. United States Department of Agriculture, Agricultural Research Service. Archived from the original on 16 January 2009. Retrieved 23 February 2009.
- ^ Chandler, D. (2017). “Basic and Applied Research on Entomopathogenic Fungi”. In Lacey, Lawrence A. (ed.). Microbial Control of Insect and Mite Pests. Academic Press. pp. 69–89. doi:10.1016/B978-0-12-803527-6.00005-6. ISBN 978-0-12-803527-6.
- ^ Deshpande MV (1999). “Mycopesticide production by fermentation: potential and challenges”. Critical Reviews in Microbiology. 25 (3): 229–43. doi:10.1080/10408419991299220. PMID 10524330.
- ^ Thomas MB, Read AF (May 2007). “Can fungal biopesticides control malaria?”. Nature Reviews. Microbiology. 5 (5): 377–83. doi:10.1038/nrmicro1638. hdl:1842/2089. PMID 17426726. S2CID 14460348.
- ^ Guerre, Philippe (2015). “Ergot alkaloids produced by endophytic fungi of the genus Epichloë“. Toxins. 7 (3): 773–790. doi:10.3390/toxins7030773. PMC 4379524. PMID 25756954.
- ^ Bouton JH, Latch GC, Hill NS, Hoveland CS, McCann MA, Watson RH, Parish JA, Hawkins LL, Thompson FN (2002). “Reinfection of Tall Fescue Cultivars with Non-Ergot Alkaloid–Producing Endophytes”. Agronomy Journal. 94 (3): 567–574. doi:10.2134/agronj2002.5670.
- ^ Parish JA, McCann MA, Watson RH, Hoveland CS, Hawkins LL, Hill NS, Bouton JH (May 2003). “Use of nonergot alkaloid-producing endophytes for alleviating tall fescue toxicosis in sheep”. Journal of Animal Science. 81 (5): 1316–22. doi:10.2527/2003.8151316x. PMID 12772860.
- ^ Zhuo, Rui; Fan, Fangfang (2021). “A comprehensive insight into the application of white rot fungi and their lignocellulolytic enzymes in the removal of organic pollutants”. Science of the Total Environment. 778: 146132. Bibcode:2021ScTEn.778n6132Z. doi:10.1016/j.scitotenv.2021.146132. PMID 33714829. S2CID 232230208.
- ^ “Fungi to fight ‘toxic war zones'”. BBC News. 5 May 2008. Archived from the original on 15 September 2017. Retrieved 12 May 2008.
- ^ Fomina M, Charnock JM, Hillier S, Alvarez R, Gadd GM (July 2007). “Fungal transformations of uranium oxides”. Environmental Microbiology. 9 (7): 1696–710. doi:10.1111/j.1462-2920.2007.01288.x. PMID 17564604.
- ^ Fomina M, Charnock JM, Hillier S, Alvarez R, Livens F, Gadd GM (May 2008). “Role of fungi in the biogeochemical fate of depleted uranium”. Current Biology. 18 (9): R375–7. doi:10.1016/j.cub.2008.03.011. PMID 18460315. S2CID 52805144.
- ^ Beadle GW, Tatum EL (November 1941). “Genetic Control of Biochemical Reactions in Neurospora”. Proceedings of the National Academy of Sciences of the United States of America. 27 (11): 499–506. Bibcode:1941PNAS…27..499B. doi:10.1073/pnas.27.11.499. PMC 1078370. PMID 16588492.
- ^ Datta A, Ganesan K, Natarajan K (1989). “Current Trends in Candida albicans Research”. Current trends in Candida albicans research. Advances in Microbial Physiology. Vol. 30. pp. 53–88. doi:10.1016/S0065-2911(08)60110-1. ISBN 978-0-12-027730-8. PMID 2700541.
- ^ Dean RA, Talbot NJ, Ebbole DJ, Farman ML, Mitchell TK, Orbach MJ, et al. (April 2005). “The genome sequence of the rice blast fungus Magnaporthe grisea”. Nature. 434 (7036): 980–6. Bibcode:2005Natur.434..980D. doi:10.1038/nature03449. PMID 15846337.
- ^ Karbalaei, Mohsen; Rezaee, Seyed A.; Farsiani, Hadi (2020). “Pichia pastoris: A highly successful expression system for optimal synthesis of heterologous proteins”. Journal of Cellular Physiology. 235 (9): 5867–5881. doi:10.1002/jcp.29583. PMC 7228273. PMID 32057111.
- ^ Schlegel HG (1993). General Microbiology. Cambridge, UK: Cambridge University Press. p. 360. ISBN 978-0-521-43980-0.
- ^ Joseph B, Ramteke PW, Thomas G (2008). “Cold active microbial lipases: some hot issues and recent developments”. Biotechnology Advances. 26 (5): 457–70. doi:10.1016/j.biotechadv.2008.05.003. PMID 18571355.
- ^ Kumar R, Singh S, Singh OV (May 2008). “Bioconversion of lignocellulosic biomass: biochemical and molecular perspectives”. Journal of Industrial Microbiology & Biotechnology. 35 (5): 377–91. doi:10.1007/s10295-008-0327-8. PMID 18338189. S2CID 4830678.
- ^ “Trichoderma spp., including T. harzianum, T. viride, T. koningii, T. hamatum and other spp. Deuteromycetes, Moniliales (asexual classification system)”. Biological Control: A Guide to Natural Enemies in North America. Archived from the original on 14 April 2011. Retrieved 10 July 2007.
- ^ Olempska-Beer ZS, Merker RI, Ditto MD, DiNovi MJ (July 2006). “Food-processing enzymes from recombinant microorganisms–a review”. Regulatory Toxicology and Pharmacology. 45 (2): 144–158. doi:10.1016/j.yrtph.2006.05.001. PMID 16769167. Archived from the original on 3 July 2019. Retrieved 3 July 2019.
- ^ Polizeli ML, Rizzatti AC, Monti R, Terenzi HF, Jorge JA, Amorim DS (June 2005). “Xylanases from fungi: properties and industrial applications”. Applied Microbiology and Biotechnology. 67 (5): 577–91. doi:10.1007/s00253-005-1904-7. PMID 15944805. S2CID 22956.
Cited literature
- Ainsworth GC (1976). Introduction to the History of Mycology. Cambridge, UK: Cambridge University Press. ISBN 978-0-521-11295-6.
- Alexopoulos CJ, Mims CW, Blackwell M (1996). Introductory Mycology. John Wiley and Sons. ISBN 978-0-471-52229-4.
- Deacon J (2005). Fungal Biology. Cambridge, Massachusetts: Blackwell Publishers. ISBN 978-1-4051-3066-0.
- Hall IR (2003). Edible and Poisonous Mushrooms of the World. Portland, Oregon: Timber Press. ISBN 978-0-88192-586-9.
- Hanson JR (2008). The Chemistry of Fungi. Royal Society of Chemistry. ISBN 978-0-85404-136-7.
- Jennings DH, Lysek G (1996). Fungal Biology: Understanding the Fungal Lifestyle. Guildford, UK: Bios Scientific Publishers Ltd. ISBN 978-1-85996-150-6.
- Kirk PM, Cannon PF, Minter DW, Stalpers JA (2008). Dictionary of the Fungi (10th ed.). Wallingford, UK: CAB International. ISBN 978-0-85199-826-8.
- Taylor EL, Taylor TN (1993). The Biology and Evolution of Fossil Plants. Englewood Cliffs, New Jersey: Prentice Hall. ISBN 978-0-13-651589-0.
External links
| Wikimedia Commons has media related to Fungi. |
| Look up fungus in Wiktionary, the free dictionary. |
- Tree of Life web project: Fungi
- Mushroom Observer (mushroomobserver.org), a collaborative fungus recording and identification project
- FUNGI in BoDD – Botanical Dermatology Database
