Athérosclérose
L’athérosclérose est un schéma de la maladie artériosclérose [8] dans laquelle la paroi de l’ artère développe des anomalies, appelées lésions . Ces lésions peuvent entraîner un rétrécissement dû à l’accumulation de plaque d’athérome . [9] Au début, il n’y a généralement pas de symptômes, mais s’ils se développent, les symptômes commencent généralement vers l’âge moyen. [1] Lorsqu’elle est grave, elle peut entraîner une maladie coronarienne , un accident vasculaire cérébral , une maladie artérielle périphérique ou des Problèmes rénaux , selon les artères touchées. [1]
| Athérosclérose | |
|---|---|
| Autres noms | Maladie vasculaire artérioscléreuse (ASVD) |
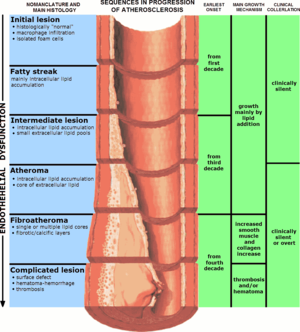 |
|
| La progression de l’athérosclérose (rétrécissement exagéré) | |
| Spécialité | Cardiologie , angiologie |
| Les symptômes | Aucun [1] |
| Complications | Maladie coronarienne , accident vasculaire cérébral , maladie artérielle périphérique , Problèmes rénaux [1] |
| Début habituel | Jeunesse (s’aggrave avec l’âge) [2] |
| causes | Inconnu [1] |
| Facteurs de risque | Hypertension artérielle , diabète , Tabagisme , obésité , antécédents familiaux, mauvaise alimentation (notamment gras trans ), carence chronique en vitamine C [3] [4] |
| La prévention | Alimentation saine , exercice, ne pas fumer, maintenir un poids normal [5] |
| Médicament | Statines , antihypertenseurs , aspirine [6] |
| La fréquence | ≈100% (>65 ans) [7] |
La cause exacte n’est pas connue et est proposée comme étant multifactorielle. [1] Les facteurs de risque comprennent des taux de cholestérol anormaux , des niveaux élevés de Marqueurs inflammatoires , [10] l’Hypertension artérielle , le diabète , le Tabagisme , l’obésité , les antécédents familiaux, la génétique et une alimentation malsaine. [4] La plaque est composée de graisse, de cholestérol , de calcium et d’autres substances présentes dans le sang . [9] Le rétrécissement des artères limite le flux de sang riche en oxygène vers certaines parties du corps. [9]Le diagnostic repose sur un examen physique, un Électrocardiogramme et un Test d’effort , entre autres. [11]
La prévention consiste généralement à adopter une alimentation saine , à faire de l’exercice, à ne pas fumer et à maintenir un poids normal . [5] Le traitement d’une maladie établie peut inclure des médicaments pour abaisser le cholestérol tels que les statines , des médicaments contre l’hypertension ou des médicaments qui diminuent la coagulation, tels que l’aspirine . [6] Un certain nombre de procédures peuvent également être réalisées telles qu’une intervention coronarienne percutanée , un pontage coronarien ou une endartériectomie carotidienne . [6]
L’athérosclérose commence généralement lorsqu’une personne est jeune et s’aggrave avec l’âge. [2] Presque toutes les personnes sont touchées à un certain degré à l’âge de 65 ans. [7] C’est la première cause de décès et d’invalidité dans le Monde développé . [12] Bien qu’il ait été décrit pour la première fois en 1575, [13] il existe des preuves que la maladie s’est produite chez des personnes il y a plus de 5 000 ans. [13]
Signes et symptômes
L’athérosclérose est asymptomatique pendant des décennies parce que les artères grossissent à tous les emplacements de la plaque, il n’y a donc aucun effet sur le flux sanguin. [14] Même la plupart des ruptures de plaque ne produisent pas de symptômes jusqu’à ce qu’un rétrécissement suffisant ou une fermeture d’une artère, due à des caillots , se produise. Les signes et les symptômes n’apparaissent qu’après un rétrécissement ou une fermeture sévère empêchant suffisamment le flux sanguin vers différents organes pour induire des symptômes. [15] La plupart du temps, les patients ne réalisent qu’ils ont la maladie que lorsqu’ils souffrent d’autres troubles cardiovasculaires tels qu’un accident vasculaire cérébral ou une crise cardiaque . Cependant, ces symptômes varient toujours selon l’artère ou l’organe touché.[16]
Les anomalies associées à l’athérosclérose commencent dans l’enfance. Des lésions fibreuses et gélatineuses ont été observées dans les artères coronaires d’enfants âgés de 6 à 10 ans. [17] Des stries graisseuses ont été observées dans les artères coronaires de mineurs âgés de 11 à 15 ans, [17] bien qu’elles apparaissent à un âge beaucoup plus jeune dans l’ aorte . [18]
Cliniquement, compte tenu de l’élargissement des artères pendant des décennies, l’athérosclérose symptomatique est généralement associée aux hommes dans la quarantaine et aux femmes dans la cinquantaine à la soixantaine. Sous-cliniquement , la maladie commence à apparaître dans l’enfance et est rarement déjà présente à la naissance. Des signes visibles peuvent commencer à se développer à la puberté. Bien que les symptômes soient rarement présents chez les enfants, le dépistage précoce des maladies cardiovasculaires chez les enfants pourrait être bénéfique à la fois pour l’enfant et ses proches. [19] Alors que la maladie coronarienne est plus répandue chez les hommes que chez les femmes, l’athérosclérose des artères cérébrales et les accidents vasculaires cérébraux affectent également les deux sexes. [20]
Un rétrécissement marqué des artères coronaires, qui sont chargées d’amener le sang oxygéné vers le cœur, peut produire des symptômes tels que des douleurs thoraciques d’ angor et d’essoufflement, des sueurs, des nausées , des étourdissements ou des étourdissements, un essoufflement ou des palpitations . [16] Les rythmes cardiaques anormaux appelés arythmies – le cœur battant trop lentement ou trop rapidement – sont une autre conséquence de l’ischémie . [21]
Les artères carotides irriguent le cerveau et le cou. [21] Un rétrécissement marqué des artères carotides peut présenter des symptômes tels que : une sensation de faiblesse ; être incapable de penser correctement; difficulté à parler; vertiges; difficulté à marcher ou à se tenir droit; Vision floue; engourdissement du visage, des bras et des jambes; Maux de tête sévères; et perte de conscience. Ces symptômes sont également liés aux accidents vasculaires cérébraux (la mort des cellules cérébrales). L’AVC est causé par un rétrécissement marqué ou une fermeture des artères allant au cerveau; le manque d’apport sanguin adéquat entraîne la mort des cellules du tissu affecté. [22]
Les artères périphériques , qui irriguent les jambes, les bras et le bassin, subissent également un rétrécissement marqué en raison de la rupture de la plaque et des caillots. Les symptômes du rétrécissement sont un engourdissement dans les bras ou les jambes, ainsi que des douleurs. Les artères rénales , qui irriguent les reins, constituent un autre site important de formation de plaque . L’apparition et l’accumulation de plaque entraînent une diminution du débit sanguin rénal et une maladie rénale chronique , qui, comme dans tous les autres domaines, est généralement asymptomatique jusqu’à un stade avancé. [16]
Selon les données des États-Unis pour 2004, chez environ 66 % des hommes et 47 % des femmes, le premier symptôme de la maladie cardiovasculaire athéroscléreuse est une crise cardiaque ou une Mort cardiaque subite (décès dans l’heure suivant l’apparition du symptôme). Les tests de stress cardiaque , traditionnellement la méthode de test non invasive la plus couramment utilisée pour les limitations du débit sanguin, ne détectent en général qu’un rétrécissement de la lumière de ≈75 % ou plus, bien que certains médecins affirment que les méthodes de stress nucléaire peuvent détecter aussi peu que 50 %. [23]
Des études de cas ont inclus des autopsies de soldats américains tués pendant la Seconde Guerre mondiale et la guerre de Corée . Un rapport très cité concernait les autopsies de 300 soldats américains tués en Corée. Bien que l’âge moyen des hommes soit de 22,1 ans, 77,3% présentaient des “preuves flagrantes d’artériosclérose coronarienne”. [24] D’autres études réalisées sur des soldats pendant la guerre du Vietnam ont montré des résultats similaires, bien que souvent pires que ceux des guerres précédentes. Les théories incluent des taux élevés de Tabagisme et (dans le cas des soldats vietnamiens) l’avènement des aliments transformés après la Seconde Guerre mondiale. [ citation nécessaire ]
Facteurs de risque

 Athérosclérose et lipoprotéines
Athérosclérose et lipoprotéines
Le processus athéroscléreux n’est pas bien compris. L’athérosclérose est associée à des processus inflammatoires dans les cellules endothéliales de la paroi vasculaire associées à des particules de lipoprotéines de basse densité (LDL) retenues. [25] [26] Cette rétention peut être une cause, un effet, ou les deux, du processus inflammatoire sous-jacent. [27]
La présence de la plaque induit l’ étirement des cellules musculaires du vaisseau sanguin, compensant le volume supplémentaire. La muqueuse endothéliale s’épaissit alors, augmentant la séparation entre la plaque et la lumière. L’épaississement compense quelque peu le rétrécissement causé par la croissance de la plaque, mais de plus, il provoque un raidissement de la paroi et devient moins souple à l’étirement à chaque battement de cœur. [28]
Modifiable
- Régime alimentaire occidental [29]
- Obésité abdominale [29]
- Résistance à l’insuline [29]
- Diabète [29]
- Dyslipidémie [29]
- HTA [29]
- Gras trans [29]
- Tabagisme [29]
- Infections bactériennes [30]
- VIH/SIDA [31]
Non modifiable
- Ascendance Sud-asiatique [32] [33]
- Âge avancé [29] [34]
- Anomalies génétiques [29]
- Antécédents familiaux [29]
- Anatomie coronaire et modèle de branche [35]
Moins ou incertain
- Thrombophilie [36] [37] [38]
- Acides gras saturés [29] [39]
- Excès de glucides [29] [40]
- Triglycérides élevés [ 29]
- Inflammation systémique [41]
- Hyperinsulinémie [42]
- Privation de sommeil [43]
- Pollution atmosphérique [44] [45]
- Mode de vie sédentaire [29]
- Empoisonnement à l’arsenic [46]
- Alcool [29]
- Stress chronique [29]
- Hypothyroïdie [47]
- Maladie parodontale [48]
Diététique
La relation entre les graisses alimentaires et l’athérosclérose est controversée. L’ USDA , dans sa pyramide alimentaire , promeut une alimentation composée d’environ 64 % de glucides par rapport aux calories totales. L’ American Heart Association , l’ American Diabetes Association et le National Cholesterol Education Program font des recommandations similaires. En revanche, le professeur Walter Willett (Harvard School of Public Health, PI de la deuxième étude sur la santé des infirmières ) recommande des niveaux beaucoup plus élevés de graisses, en particulier de graisses monoinsaturées et polyinsaturées . [49]Ces recommandations diététiques font cependant consensus contre la consommation de gras trans . [ citation nécessaire ]
Le rôle de la consommation de graisses oxydées (graisses rances ) chez l’homme n’est pas clair. Les lapins nourris avec des graisses rances développent plus rapidement l’athérosclérose. [50] Les rats nourris avec des huiles contenant du DHA ont subi des perturbations marquées de leurs systèmes antioxydants et ont accumulé des quantités importantes d’ hydroperoxyde de phospholipides dans leur sang, leur foie et leurs reins. [51]
Les lapins nourris avec des régimes athérogènes contenant diverses huiles se sont avérés subir la plus grande sensibilité oxydative des LDL via les huiles polyinsaturées. [52] Dans une autre étude, des lapins ont nourri de l’huile de soja chauffée “une athérosclérose grossièrement induite et des lésions hépatiques marquées ont été histologiquement et cliniquement démontrées”. [53] Cependant, Fred Kummerow affirme que ce n’est pas le cholestérol alimentaire, mais les oxystérols , ou cholestérols oxydés, provenant des aliments frits et du Tabagisme, qui sont le coupable. [54]
Les graisses et les huiles rances ont un goût très désagréable, même en petites quantités, de sorte que les gens évitent de les manger. [55] Il est très difficile de mesurer ou d’estimer la consommation humaine réelle de ces substances. [56] Les huiles riches en oméga-3 hautement insaturées telles que l’huile de poisson, lorsqu’elles sont vendues sous forme de pilules, peuvent masquer le goût des graisses oxydées ou rances qui pourraient être présentes. Aux États-Unis, les compléments alimentaires de l’industrie des aliments naturels sont autoréglementés et en dehors des réglementations de la FDA. [57] Pour protéger correctement les graisses insaturées de l’oxydation, il est préférable de les conserver au frais et dans des environnements sans oxygène. [58]
Physiopathologie
L’athérogenèse est le processus de développement des plaques d’athérome . Elle se caractérise par un remodelage des artères entraînant une accumulation sous-endothéliale de corps gras appelés plaques. L’accumulation d’une plaque d’athérome est un processus lent, développé sur une période de plusieurs années par une série complexe d’événements cellulaires se produisant dans la paroi artérielle et en réponse à une variété de facteurs circulants vasculaires locaux. Une hypothèse récente suggère que, pour des raisons inconnues, les Leucocytes , tels que les Monocytes ou les basophiles , commencent à attaquer l’ endothélium de la lumière de l’artère dans le muscle cardiaque . L’ inflammation qui s’ensuitconduit à la formation de plaques athéromateuses dans la tunique artérielle intima , une région de la paroi vasculaire située entre l’ endothélium et la tunique médiane . La majeure partie de ces lésions est constituée d’un excès de graisse, de collagène et d’ élastine . Au début, à mesure que les plaques se développent, seul un épaississement de la paroi se produit sans aucun rétrécissement. La sténose est un événement tardif, qui peut ne jamais se produire et est souvent le résultat d’une rupture répétée de la plaque et de réponses de guérison, et pas seulement du processus athéroscléreux en lui-même. [59]
Cellulaire
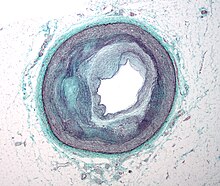
 Micrographie d’une artère qui alimente le cœur montrant une athérosclérose importante et un rétrécissement luminal marqué. Les tissus ont été colorés à l’aide du trichrome de Masson .
Micrographie d’une artère qui alimente le cœur montrant une athérosclérose importante et un rétrécissement luminal marqué. Les tissus ont été colorés à l’aide du trichrome de Masson .
L’athérogenèse précoce est caractérisée par l’adhérence des Monocytes circulants sanguins (un type de globule blanc ) au revêtement du lit vasculaire, l’ endothélium , puis par leur migration vers l’espace sous-endothélial, et une activation ultérieure dans les macrophages dérivés des Monocytes . [60] Le principal moteur documenté de ce processus est les particules de lipoprotéines oxydées dans la paroi, sous les cellules endothéliales , bien que des concentrations supérieures normales ou élevées de glucose sanguin jouent également un rôle majeur et que tous les facteurs ne soient pas entièrement compris. Des traînées grasses peuvent apparaître et disparaître. [ citation nécessaire ]
Les particules de lipoprotéines de basse densité (LDL) présentes dans le plasma sanguin envahissent l’ endothélium et s’oxydent, créant un risque de maladie cardiovasculaire . Un ensemble complexe de réactions biochimiques régule l’oxydation des LDL , impliquant des enzymes (telles que Lp-LpA2 ) et des radicaux libres dans l’endothélium. [61]
Les dommages initiaux à l’endothélium entraînent une réponse inflammatoire. Les Monocytes pénètrent dans la paroi artérielle à partir de la circulation sanguine, les plaquettes adhérant à la zone d’insulte. Cela peut être favorisé par l’induction de signaux redox de facteurs tels que VCAM-1 , qui recrutent des Monocytes circulants, et M-CSF , qui est sélectivement requis pour la différenciation des Monocytes en macrophages. Les Monocytes se différencient en macrophages , qui prolifèrent localement, [62] ingèrent les LDL oxydées, se transformant lentement en grosses ” cellules spumeuses ” – ainsi appelées en raison de leur apparence modifiée résultant des nombreuses vésicules cytoplasmiques interneset la teneur élevée en lipides qui en résulte . Au microscope, la lésion apparaît maintenant comme une traînée graisseuse. Les cellules spumeuses finissent par mourir et propagent davantage le processus inflammatoire. [ citation nécessaire ]
En plus de ces activités cellulaires, il existe également une prolifération et une migration des muscles lisses de la tunique médiane vers l’ intima en réponse aux cytokines sécrétées par les cellules endothéliales endommagées. Cela provoque la formation d’une capsule fibreuse recouvrant la strie graisseuse. L’endothélium intact peut empêcher cette prolifération des muscles lisses en libérant de l’oxyde nitrique . [ citation nécessaire ]
Calcification et lipides
La calcification se forme parmi les cellules musculaires lisses vasculaires de la couche musculaire environnante, en particulier dans les cellules musculaires adjacentes aux athéromes et à la surface des plaques et des tissus d’athérome. [63] Avec le temps, à mesure que les cellules meurent, cela conduit à des dépôts de calcium extracellulaires entre la paroi musculaire et la partie externe des plaques athéromateuses. La plaque athéromateuse interférant avec la régulation du dépôt de calcium, elle s’accumule et cristallise. Une forme similaire de calcification intramurale, présentant l’image d’une phase précoce de l’artériosclérose, semble être induite par de nombreux médicaments ayant un mécanisme d’action antiprolifératif ( Rainer Liedtke 2008). [ citation nécessaire ]
Le cholestérol est délivré dans la paroi vasculaire par des particules de lipoprotéines de basse densité (LDL) contenant du cholestérol. Pour attirer et stimuler les macrophages, le cholestérol doit être libéré des particules de LDL et oxydé, une étape clé du processus inflammatoire en cours. Le processus est aggravé s’il n’y a pas suffisamment de lipoprotéines de haute densité (HDL), la particule de lipoprotéine qui élimine le cholestérol des tissus et le ramène au foie. [61]
Les cellules spumeuses et les plaquettes favorisent la migration et la prolifération des cellules musculaires lisses, qui à leur tour ingèrent des lipides, sont remplacées par du collagène et se transforment elles-mêmes en cellules spumeuses. Une coiffe fibreuse protectrice se forme normalement entre les dépôts graisseux et la muqueuse artérielle (l’ intima ). [ citation nécessaire ]
Ces dépôts graisseux coiffés (maintenant appelés « athéromes ») produisent des enzymes qui font grossir l’artère avec le temps. Tant que l’artère s’agrandit suffisamment pour compenser la surépaisseur de l’athérome, aucun rétrécissement (« sténose ») de l’ouverture (« lumière ») ne se produit. L’artère se dilate avec une section transversale en forme d’œuf, toujours avec une ouverture circulaire. Si l’élargissement est hors de proportion avec l’épaisseur de l’athérome, un anévrisme est alors créé. [64]
Caractéristiques visibles

 Athérosclérose sévère de l’ aorte . Spécimen d’autopsie .
Athérosclérose sévère de l’ aorte . Spécimen d’autopsie .
Bien que les artères ne soient généralement pas étudiées au microscope, deux types de plaques peuvent être distingués : [65]
- La plaque fibro-lipidique (fibro-graisseuse) est caractérisée par une accumulation de cellules chargées de lipides sous l’ intima des artères, généralement sans rétrécissement de la lumière en raison de l’expansion compensatoire de la couche musculaire limitante de la paroi artérielle. Sous l’endothélium, il y a un “capuchon fibreux” recouvrant le “noyau” athéromateux de la plaque. Le noyau est constitué de cellules chargées de lipides (macrophages et cellules musculaires lisses) avec une teneur élevée en cholestérol tissulaire et en esters de cholestérol , fibrine , protéoglycanes , collagène , élastine, et des débris cellulaires. Dans les plaques avancées, le noyau central de la plaque contient généralement des dépôts de cholestérol extracellulaire (libérés par les cellules mortes), qui forment des zones de cristaux de cholestérol avec des fentes vides en forme d’aiguille. À la périphérie de la plaque se trouvent des cellules et des capillaires “mousseux” plus jeunes. Ces plaques causent généralement le plus de dommages à l’individu lorsqu’elles se rompent. Les cristaux de cholestérol peuvent également jouer un rôle. [66]
- La plaque fibreuse est également localisée sous l’intima, dans la paroi de l’artère, entraînant un épaississement et une expansion de la paroi et, parfois, un rétrécissement ponctuel localisé de la lumière avec une certaine atrophie de la couche musculaire. La plaque fibreuse contient des fibres de collagène ( éosinophiles ), des précipités de calcium (hématoxylinophiles), et rarement, des cellules chargées de lipides. [ citation nécessaire ]
En effet, la partie musculaire de la paroi artérielle forme de petits anévrismes juste assez gros pour contenir les athéromes présents. La partie musculaire des parois artérielles reste généralement solide, même après avoir été remodelée pour compenser les plaques d’athérome. [ citation nécessaire ]
Cependant, les athéromes à l’intérieur de la paroi vasculaire sont mous et fragiles avec peu d’élasticité. Les artères se dilatent et se contractent constamment à chaque battement cardiaque, c’est-à-dire le pouls. De plus, les dépôts de calcification entre la partie externe de l’athérome et la paroi musculaire, au fur et à mesure de leur progression, entraînent une perte d’élasticité et une rigidification de l’ensemble de l’artère. [ citation nécessaire ]
Les dépôts de calcification, [67] après qu’ils soient devenus suffisamment avancés, sont partiellement visibles sur la tomodensitométrie de l’artère coronaire ou la tomographie par faisceau d’électrons (EBT) sous forme d’anneaux de densité radiographique accrue, formant des halos autour des bords extérieurs des plaques d’athérome, à l’intérieur de l’artère mur. Au scanner, > 130 unités sur l’ échelle de Hounsfield (certains plaident pour 90 unités) a été la densité radiographique généralement acceptée comme représentant clairement la calcification des tissus dans les artères. Ces dépôts témoignent sans équivoque de la maladie, relativement avancée, même si la lumière de l’artère est souvent encore normale à l’angiographie. [ citation nécessaire ]
Rupture et sténose


Bien que le processus de la maladie ait tendance à évoluer lentement sur des décennies, il reste généralement asymptomatique jusqu’à ce qu’un athérome s’ulcère , ce qui entraîne une coagulation sanguine immédiate au site de l’ulcère d’athérome. Cela déclenche une cascade d’événements qui conduisent à l’élargissement du caillot, ce qui peut rapidement obstruer la circulation du sang. Un blocage complet entraîne une ischémie du muscle myocardique (cœur) et des lésions. Ce processus est l’ infarctus du myocarde ou “crise cardiaque”. [68]
Si la crise cardiaque n’est pas mortelle, il s’ensuit une organisation fibreuse du caillot dans la lumière, recouvrant la rupture mais produisant également une sténose ou une fermeture de la lumière, ou au fil du temps et après des ruptures répétées, entraînant une sténose ou un blocage persistant, généralement localisé. la lumière de l’artère. Les sténoses peuvent être lentement progressives, tandis que l’ulcération de la plaque est un événement soudain qui survient spécifiquement dans les athéromes avec des coiffes fibreuses plus minces/plus faibles qui sont devenues “instables”. [68]
Les ruptures de plaque répétées, celles qui n’entraînent pas la fermeture totale de la lumière, combinées au patch de caillot sur la rupture et la réponse de guérison pour stabiliser le caillot sont le processus qui produit la plupart des sténoses au fil du temps. Les zones sténosées ont tendance à devenir plus stables malgré l’augmentation des vitesses d’écoulement au niveau de ces rétrécissements. La plupart des événements majeurs d’arrêt du flux sanguin se produisent au niveau de grandes plaques qui, avant leur rupture, produisaient très peu ou pas de sténose. [ citation nécessaire ]
D’après les essais cliniques, 20 % est la sténose moyenne au niveau des plaques qui se rompent ensuite avec la fermeture complète de l’artère qui en résulte. Les événements cliniques les plus graves ne se produisent pas au niveau des plaques qui produisent une sténose de haut grade. D’après les essais cliniques, seulement 14 % des crises cardiaques surviennent à la suite de la fermeture d’une artère au niveau de plaques produisant une sténose de 75 % ou plus avant la fermeture du vaisseau. [ citation nécessaire ]
Si le capuchon fibreux séparant un athérome mou de la circulation sanguine dans l’artère se rompt, des fragments de tissu sont exposés et libérés. Ces fragments tissulaires sont très coagulants, contenant du collagène et du facteur tissulaire ; ils activent les plaquettes et activent le système de coagulation . Le résultat est la formation d’un thrombus (caillot sanguin) recouvrant l’athérome, qui obstrue de manière aiguë le flux sanguin. Avec l’obstruction du flux sanguin, les tissus en aval sont privés d’ oxygène et de nutriments. S’il s’agit d’une angine de poitrine (douleur thoracique cardiaque) du myocarde (muscle cardiaque) ou d’un infarctus du myocarde(crise cardiaque) se développe. [ citation nécessaire ]
Croissance accélérée des plaques
La distribution des plaques d’athérosclérose dans une partie de l’endothélium artériel est inhomogène. Le développement multiple et focal des changements athérosclérotiques est similaire à celui du développement des plaques amyloïdes dans le cerveau et à celui des taches de vieillesse sur la peau. La théorie du vieillissement de l’accumulation et de la mauvaise réparation suggère que les mécanismes de mauvaise réparation [69] [70] jouent un rôle important dans le développement focal de l’athérosclérose. [71]Le développement d’une plaque est le résultat de la réparation de l’endothélium lésé. En raison de l’infusion de lipides dans le sous-endothélium, la réparation doit aboutir à un remodelage altéré de l’endothélium local. C’est la manifestation d’une mauvaise réparation. L’important est que ce remodelage altéré rend l’endothélium local plus fragile aux dommages et a une efficacité de réparation réduite. En conséquence, cette partie de l’endothélium présente un facteur de risque accru d’être blessée et mal réparée. Ainsi, l’accumulation de défauts de réparation de l’endothélium est focalisée et auto-accélérée. De cette façon, la croissance d’une plaque est également auto-accélérée. Dans une partie de la paroi artérielle, la plaque la plus ancienne est toujours la plus grande et la plus dangereuse pour provoquer le blocage d’une artère locale. [ citation nécessaire ]
Composants
La plaque est divisée en trois éléments distincts :
- L’ athérome (“morceau de gruau”, du grec ἀθήρα (athera) ‘ gruau ‘), qui est l’accumulation nodulaire d’une matière molle, floconneuse et jaunâtre au centre de grandes plaques, composées de macrophages les plus proches de la lumière de l’artère [ citation nécessaire ]
- Zones sous-jacentes des cristaux de cholestérol [ citation nécessaire ]
- Calcification à la base externe des lésions plus anciennes ou plus avancées . Les lésions athérosclérotiques, ou plaques athéroscléreuses, sont séparées en deux grandes catégories : stables et instables (également appelées vulnérables). [72] La pathobiologie des lésions athérosclérotiques est très compliquée, mais généralement, les plaques athéroscléreuses stables, qui ont tendance à être asymptomatiques, sont riches en matrice extracellulaire et en cellules musculaires lisses . D’autre part, les plaques instables sont riches en macrophages et en cellules spumeuses , et la matrice extracellulaire séparant la lésion de la lumière artérielle (également connue sous le nom de coiffe fibreuse ) est généralement faible et sujette à la rupture. [73]Les ruptures de la coiffe fibreuse exposent le matériel thrombogène, tel que le collagène , [74] à la circulation et induisent éventuellement la formation de thrombus dans la lumière. Lors de leur formation, les thrombus intraluminaux peuvent obstruer les artères (p. ex., occlusion coronarienne), mais le plus souvent, ils se détachent, se déplacent dans la circulation et finissent par obstruer les petites branches en aval provoquant une thromboembolie . [ citation nécessaire ]
En dehors de la thromboembolie, les lésions athéroscléreuses en expansion chronique peuvent entraîner une fermeture complète de la lumière. Les lésions à expansion chronique sont souvent asymptomatiques jusqu’à ce que la sténose de la lumière soit si grave (généralement supérieure à 80 %) que l’apport sanguin aux tissus en aval est insuffisant, entraînant une ischémie . Ces complications de l’athérosclérose avancée sont chroniques, lentement progressives et cumulatives. Le plus souvent, la plaque molle se rompt soudainement (voir plaque vulnérable ), provoquant la formation d’un thrombus qui ralentira ou arrêtera rapidement le flux sanguin, entraînant la mort des tissus alimentés par l’artère en environ cinq minutes. Cet événement s’appelle un infarctus . [ citation nécessaire ]
Diagnostic

 Image CT de l’athérosclérose de l’aorte abdominale. Femme de 70 ans souffrant d’hypertension et de dyslipidémie.
Image CT de l’athérosclérose de l’aorte abdominale. Femme de 70 ans souffrant d’hypertension et de dyslipidémie. 
 Microphotographie de la paroi artérielle avec plaque d’athérosclérose calcifiée (couleur violette) ( coloration à l’ hématoxyline et à l’éosine )
Microphotographie de la paroi artérielle avec plaque d’athérosclérose calcifiée (couleur violette) ( coloration à l’ hématoxyline et à l’éosine )
Les zones de rétrécissement sévère, de sténose , détectables par angiographie , et dans une moindre mesure les ” tests d’effort ” sont depuis longtemps au centre des techniques de diagnostic humain des maladies cardiovasculaires , en général. Cependant, ces méthodes se concentrent sur la détection uniquement d’un rétrécissement sévère, et non sur la maladie sous-jacente de l’athérosclérose. [75] Comme démontré par des études cliniques humaines, les événements les plus graves se produisent dans des endroits avec une plaque épaisse, mais peu ou pas de rétrécissement de la lumière avant que des événements débilitants ne surviennent soudainement. La rupture de la plaque peut entraîner une occlusion de la lumière artérielle en quelques secondes à quelques minutes, une débilité permanente potentielle et parfois une mort subite. [ citation nécessaire ]
Les plaques qui se sont rompues sont appelées lésions compliquées. La matrice extracellulaire de la lésion se rompt, généralement au niveau de l’épaulement de la coiffe fibreuse qui sépare la lésion de la lumière artérielle, où les composants thrombogènes exposés de la plaque, principalement le collagène , déclencheront la formation de thrombus . Le thrombus se déplace ensuite en aval vers d’autres vaisseaux sanguins, où le caillot sanguin peut bloquer partiellement ou complètement le flux sanguin. Si le flux sanguin est complètement bloqué, la mort des cellules se produit en raison du manque d’apport d’ oxygène aux cellules voisines, entraînant une nécrose . [76]Le rétrécissement ou l’obstruction du flux sanguin peut se produire dans n’importe quelle artère du corps. L’obstruction des artères alimentant le muscle cardiaque entraîne une crise cardiaque , tandis que l’obstruction des artères alimentant le cerveau entraîne un accident vasculaire cérébral ischémique . [ citation nécessaire ]

 Échographie Doppler de l’artère carotide interne droite avec des plaques calcifiées et non calcifiées montrant une sténose inférieure à 70 %
Échographie Doppler de l’artère carotide interne droite avec des plaques calcifiées et non calcifiées montrant une sténose inférieure à 70 %
La sténose de la lumière supérieure à 75 % était considérée comme la marque d’une maladie cliniquement significative dans le passé, car les épisodes récurrents d’ angine de poitrine et les anomalies des tests d’effort ne sont détectables qu’à cette gravité particulière de la sténose. Cependant, des essais cliniques ont montré que seulement 14 % environ des événements cliniquement débilitants surviennent sur des sites présentant une sténose supérieure à 75 %. La majorité des événements cardiovasculaires qui impliquent une rupture soudaine de la plaque d’athérome ne présentent aucun rétrécissement évident de la lumière. Ainsi, une plus grande attention a été portée sur la “plaque vulnérable” à partir de la fin des années 1990. [77]
Outre les méthodes de diagnostic traditionnelles telles que l’ angiographie et les tests d’effort, d’autres techniques de détection ont été développées au cours des dernières décennies pour une détection plus précoce de la maladie athéroscléreuse. Certaines des approches de détection comprennent la détection anatomique et la mesure physiologique. [ citation nécessaire ]
Des exemples de méthodes de détection anatomiques comprennent la notation du calcium coronaire par CT , la mesure IMT carotidienne ( épaisseur de la média intimale ) par ultrasons et l’échographie intravasculaire (IVUS). Des exemples de méthodes de mesure physiologiques comprennent l’analyse des sous-classes de lipoprotéines, l’ HbA1c , la hs-CRP et l’homocystéine . [ citation nécessaire ]Les méthodes anatomiques et physiologiques permettent une détection précoce avant l’apparition des symptômes, la stadification de la maladie et le suivi de la progression de la maladie. Les méthodes anatomiques sont plus coûteuses et certaines d’entre elles sont de nature invasive, comme l’IVUS. En revanche, les méthodes physiologiques sont souvent moins chères et plus sûres. Mais ils ne quantifient pas l’état actuel de la maladie ni ne suivent directement la progression. Ces dernières années, les développements des techniques d’imagerie nucléaire telles que la TEP et la SPECT ont fourni des moyens d’estimer la gravité des plaques d’athérosclérose. [75]
La prévention
Jusqu’à 90 % des maladies cardiovasculaires peuvent être évitées si les facteurs de risque établis sont évités. [78] [79] La prise en charge médicale de l’athérosclérose implique d’abord la modification des facteurs de risque, par exemple, via l’arrêt du tabac et les restrictions alimentaires. La prévention consiste généralement à manger sainement, à faire de l’exercice, à ne pas fumer et à maintenir un poids normal. [5]
Régime
Des changements dans le régime alimentaire peuvent aider à prévenir le développement de l’athérosclérose. Des preuves provisoires suggèrent qu’un régime contenant des produits laitiers n’a aucun effet sur ou diminue le risque de maladie cardiovasculaire . [80] [81]
Une alimentation riche en fruits et légumes diminue le risque de maladies cardiovasculaires et de décès. [82] Les preuves suggèrent que le régime méditerranéen peut améliorer les résultats cardiovasculaires. [83] Il existe également des preuves qu’un régime méditerranéen peut être meilleur qu’un régime faible en gras pour provoquer des changements à long terme des facteurs de risque cardiovasculaires (par exemple, un taux de cholestérol et une pression artérielle inférieurs ). [84]
Exercer
Un programme d’exercices contrôlés combat l’athérosclérose en améliorant la circulation et la fonctionnalité des vaisseaux. L’exercice est également utilisé pour gérer le poids chez les patients obèses, abaisser la tension artérielle et diminuer le cholestérol. Souvent, la modification du mode de vie est associée à une thérapie médicamenteuse. Par exemple, les statines aident à réduire le cholestérol. Les médicaments antiplaquettaires comme l’aspirine aident à prévenir les caillots, et une variété de médicaments antihypertenseurs sont couramment utilisés pour contrôler la pression artérielle. Si les efforts combinés de modification des facteurs de risque et de traitement médicamenteux ne sont pas suffisants pour contrôler les symptômes ou lutter contre les menaces imminentes d’événements ischémiques, un médecin peut recourir à des procédures interventionnelles ou chirurgicales pour corriger l’obstruction. [85]
Traitement
Le traitement d’une maladie établie peut inclure des médicaments pour réduire le cholestérol tels que les statines , des médicaments contre l’hypertension ou des médicaments qui diminuent la coagulation, tels que l’aspirine . [6] Un certain nombre de procédures peuvent également être réalisées telles qu’une intervention coronarienne percutanée , un pontage coronarien ou une endartériectomie carotidienne . [6]
Les traitements médicaux se concentrent souvent sur le soulagement des symptômes. Cependant, les mesures qui se concentrent sur la diminution de l’athérosclérose sous-jacente – par opposition au simple traitement des symptômes – sont plus efficaces. [86] Les moyens non pharmaceutiques sont généralement la première méthode de traitement, comme arrêter de fumer et faire de l’exercice régulièrement. [87] [88] Si ces méthodes ne fonctionnent pas, les médicaments sont généralement la prochaine étape dans le traitement des maladies cardiovasculaires et, avec des améliorations, sont devenus de plus en plus la méthode la plus efficace à long terme. [ citation nécessaire ]
La clé des approches les plus efficaces est de combiner plusieurs stratégies de traitement différentes. [89] En outre, pour les approches, telles que les comportements de transport des lipoprotéines, qui se sont révélées les plus efficaces, l’adoption de stratégies de traitement combiné plus agressives prises quotidiennement et indéfiniment a généralement produit de meilleurs résultats, à la fois avant et surtout après les gens sont symptomatiques. [86]
Statines
Le groupe de médicaments appelés statines est largement prescrit pour le traitement de l’athérosclérose. Ils ont montré des avantages dans la réduction des maladies cardiovasculaires et de la mortalité chez les personnes ayant un taux de cholestérol élevé avec peu d’effets secondaires. [90] Le traitement de prévention secondaire, qui comprend des statines à haute intensité et de l’aspirine, est recommandé par les directives multisociétés pour tous les patients ayant des antécédents d’ASCVD (maladie cardiovasculaire athéroscléreuse) afin de prévenir la récurrence de la maladie coronarienne, de l’AVC ischémique ou de la maladie artérielle périphérique. . [91] [92] Cependant, la prescription et l’adhésion à ces thérapies conformes aux directives font défaut, en particulier chez les jeunes patients et les femmes. [93] [94]
Les statines agissent en inhibant l’HMG-CoA (hydroxyméthylglutaryl-coenzyme A) réductase, une enzyme hépatique limitant la vitesse de la voie de production biochimique du cholestérol. En inhibant cette enzyme limitante, le corps est incapable de produire du cholestérol de manière endogène, réduisant ainsi le cholestérol LDL sérique. Cette réduction de la production de cholestérol endogène incite le corps à extraire ensuite le cholestérol d’autres sources cellulaires, augmentant ainsi le cholestérol HDL sérique. [ citation nécessaire ] Ces données concernent principalement les hommes d’âge moyen et les conclusions sont moins claires pour les femmes et les personnes de plus de 70 ans. [95]
Opération
Lorsque l’athérosclérose est devenue sévère et a provoqué une ischémie irréversible , telle qu’une perte de tissu dans le cas d’ une maladie artérielle périphérique , une intervention chirurgicale peut être indiquée. La chirurgie de pontage vasculaire peut rétablir le flux autour du segment d’artère malade, et l’ angioplastie avec ou sans stenting peut rouvrir les artères rétrécies et améliorer le flux sanguin. Le pontage aortocoronarien sans manipulation de l’aorte ascendante a démontré des taux réduits d’accident vasculaire cérébral postopératoire et de mortalité par rapport à la revascularisation coronarienne traditionnelle à la pompe. [96]
Autre
Il existe des preuves que certains anticoagulants , en particulier la warfarine , qui inhibent la formation de caillots en interférant avec le métabolisme de la vitamine K , peuvent en fait favoriser la calcification artérielle à long terme malgré la réduction de la formation de caillots à court terme. [97] En outre, des peptides uniques tels que le 3-hydroxybenzaldéhyde et l’aldéhyde protocatéchuique ont montré des effets vasculoprotecteurs pour réduire le risque d’athérosclérose. [98] [99] [100] [101] [102] [ citations excessives ]
Épidémiologie
Les maladies cardiovasculaires, qui sont principalement la manifestation clinique de l’athérosclérose, sont la principale cause de décès dans le monde. [103]
Étymologie
Les termes suivants sont similaires, mais distincts, tant par leur orthographe que par leur signification, et peuvent être facilement confondus : artériosclérose , artériolosclérose et athérosclérose. L’artériosclérose est un terme général décrivant tout durcissement (et perte d’élasticité) des artères moyennes ou grandes (du grec ἀρτηρία (artēria) « artère » et σκλήρωσις ( sklerosis ) « durcissement ») ; l’ artériolosclérose est tout durcissement (et perte d’élasticité) des artérioles (petites artères); l’ athérosclérose est un durcissement d’une artère dû spécifiquement à une plaque d’athérome (deGrec ancien ἀθήρα (athḗra) ‘bouillie’). Le terme athérogène est utilisé pour les substances ou les processus qui provoquent la formation d’ athérome . [104]
Économie
En 2011, l’athérosclérose coronarienne était l’une des dix affections les plus coûteuses observées lors des hospitalisations aux États-Unis, avec des coûts hospitaliers totaux de 10,4 milliards de dollars. [105]
Rechercher
Lipides
Une indication du rôle des lipoprotéines de haute densité (HDL) sur l’athérosclérose a été avec la rare variante génétique humaine Apo-A1 Milano de cette protéine HDL . Un petit essai à court terme utilisant l’ Apo-A1 Milano HDL humaine synthétisée bactérienne chez des personnes souffrant d’angor instable a produit une réduction assez spectaculaire du volume de plaque coronarienne mesuré en seulement six semaines par rapport à l’augmentation habituelle du volume de plaque chez les personnes randomisées au placebo. L’essai a été publié dans JAMA au début de 2006. [ citation nécessaire ] Les travaux en cours commençant dans les années 1990 pourraient conduire à des essais cliniques sur l’homme, probablement d’ici 2008 environ. [ nécessite une mise à jour ]Ceux-ci peuvent utiliser directement l’Apo-A1 Milano HDL synthétisé, ou ils peuvent utiliser des méthodes de transfert de gène pour transmettre la capacité de synthétiser la lipoprotéine Apo-A1 Milano HDL. [ citation nécessaire ]
Des méthodes pour augmenter les concentrations de particules HDL, qui dans certaines études animales inversent et éliminent en grande partie les athéromes, sont en cours de développement et de recherche. [ citation nécessaire ] Cependant, augmenter le HDL par n’importe quel moyen n’est pas nécessairement utile. Par exemple, le médicament torcetrapib est l’agent le plus efficace actuellement connu pour augmenter le HDL (jusqu’à 60%). Cependant, dans les essais cliniques, il a également augmenté les décès de 60 %. Toutes les études concernant ce médicament ont été arrêtées en décembre 2006. [106]
Les actions des macrophages entraînent la progression de la plaque d’athérosclérose. L’ immunomodulation de l’athérosclérose est le terme désignant les techniques qui modulent la fonction du système immunitaire pour supprimer cette action des macrophages. [107]
L’implication de la réaction en chaîne de peroxydation lipidique dans l’athérogenèse [108] a déclenché des recherches sur le rôle protecteur des Acides gras polyinsaturés isotopes lourds ( deutérés ) (D-PUFA) qui sont moins sujets à l’oxydation que les PUFA ordinaires (H-PUFA). Les AGPI sont des nutriments essentiels – ils sont impliqués dans le métabolisme sous cette forme même lorsqu’ils sont consommés avec de la nourriture. Chez les souris transgéniques , qui sont un modèle pour le métabolisme des lipoprotéines de type humain, l’ajout de D-PUFA à l’alimentation a effectivement réduit le gain de poids corporel, amélioré la gestion du cholestérol et réduit les dommages athérosclérotiques à l’aorte. [109] [110]
miARN
Les microARN (miARN) ont des séquences complémentaires dans les 3’UTR et 5’UTR des ARNm cibles des gènes codant pour les protéines, et provoquent le clivage de l’ARNm ou la répression de la machinerie traductionnelle. Dans les vaisseaux vasculaires malades, les miARN sont dérégulés et fortement exprimés. miR-33 se trouve dans les maladies cardiovasculaires. [111] Il est impliqué dans l’initiation et la progression de l’athérosclérose, y compris le métabolisme des lipides , la signalisation de l’insuline et l’homéostasie du glucose , la progression et la prolifération des types cellulaires et la différenciation des cellules myéloïdes . Il a été constaté chez les rongeurs que l’inhibition de miR-33augmentera le niveau de HDL et l’expression de miR-33 est régulée à la baisse chez les humains atteints de plaques d’athérosclérose. [112] [113] [114]
miR-33a et miR-33b sont situés sur l’ intron 16 du gène SREBP2 (protéine de liaison aux éléments régulateurs du stérol humain 2 ) sur le chromosome 22 et sur l’intron 17 du gène SREBP1 sur le chromosome 17. [115] miR-33a/b régule le cholestérol/les lipides homeostatis en se liant dans les 3’UTR des gènes impliqués dans le transport du cholestérol tels que les transporteurs de la cassette de liaison à l’ATP (ABC) et améliore ou réprime son expression. Des études ont montré que ABCA1médie le transport du cholestérol des tissus périphériques vers l’apolipoprotéine-1 et il est également important dans la voie de transport inverse du cholestérol, où le cholestérol est acheminé des tissus périphériques vers le foie, où il peut être excrété dans la bile ou converti en acides biliaires avant l’excrétion. [111] Par conséquent, nous savons que ABCA1 joue un rôle important dans la prévention de l’accumulation de cholestérol dans les macrophages. En améliorant la fonction de miR-33, le niveau d’ABCA1 est diminué, ce qui entraîne une diminution de l’efflux de cholestérol cellulaire vers l’apoA-1. D’autre part, en inhibant la fonction miR-33, le niveau d’ABCA1 est augmenté et augmente l’efflux de cholestérol vers l’ apoA-1. La suppression de miR-33 conduira à moins de cholestérol cellulaire et à un niveau plasmatique plus élevé de HDL grâce à la régulation de l’expression d’ABCA1. [116]
Le sucre, la cyclodextrine , a éliminé le cholestérol qui s’était accumulé dans les artères des souris nourries avec un régime riche en graisses. [117]
Dommages à l’ADN
Le vieillissement est le facteur de risque le plus important pour les problèmes cardiovasculaires. La base causale par laquelle le vieillissement modifie son impact, indépendamment d’autres facteurs de risque reconnus, reste à déterminer. Les preuves ont été examinées pour un rôle clé des dommages à l’ADN dans le vieillissement vasculaire. [118] [119] [120] Le 8-oxoG , un type courant de dommages oxydatifs dans l’ADN , s’accumule dans les cellules musculaires lisses vasculaires de la plaque , les macrophages et les cellules endothéliales , [121] reliant ainsi les dommages à l’ADN à la formation de la plaque. Les ruptures de brins d’ADN ont également augmenté dans les plaques d’athérosclérose. [121] Syndrome de Werner(WS) est une condition de vieillissement prématuré chez l’homme. [122] WS est causé par un défaut génétique dans une hélicase RecQ qui est utilisée dans plusieurs processus de réparation qui éliminent les dommages de l’ADN . Les patients SW développent une charge considérable de plaques d’athérosclérose dans leurs artères coronaires et leur aorte : une calcification de la valve aortique est également fréquemment observée. [119] Ces résultats établissent un lien entre les dommages excessifs à l’ADN non réparés et le vieillissement prématuré et le développement précoce de la plaque d’athérosclérose (voir la théorie des dommages à l’ADN du vieillissement ). [ citation nécessaire ]
Micro-organismes
Le microbiote – tous les micro -organismes du corps, peut contribuer à l’athérosclérose de plusieurs manières : modulation du système immunitaire , modifications du métabolisme , transformation des nutriments et production de certains métabolites pouvant pénétrer dans la circulation sanguine. [123] L’un de ces métabolites, produit par les bactéries intestinales , est le N-oxyde de triméthylamine (TMAO). Ses niveaux ont été associés à l’athérosclérose dans des études humaines et des recherches sur des animaux suggèrent qu’il peut y avoir une relation causale. Une association entre les gènes bactériens codant pour les triméthylamine lyases – les enzymes impliquées dans la génération de TMAO – et l’athérosclérose a été notée.[124] [123]
Cellules musculaires lisses vasculaires
Les cellules musculaires lisses vasculaires jouent un rôle clé dans l’athérogenèse et étaient historiquement considérées comme bénéfiques pour la stabilité de la plaque en formant une coiffe fibreuse protectrice et en synthétisant les composants de la matrice extracellulaire qui confèrent de la force . [125] [126] Cependant, en plus de la coiffe fibreuse, les cellules musculaires lisses vasculaires donnent également naissance à de nombreux types de cellules trouvées dans le noyau de la plaque et peuvent moduler leur phénotype pour favoriser et réduire la stabilité de la plaque. [125] [127] [128] [129] Les cellules musculaires lisses vasculaires présentent une plasticité prononcée dans la plaque d’athérosclérose et peuvent modifier leur profil d’expression génique pour ressembler à divers autres types de cellules, y compris les macrophages ,myofibroblastes , cellules souches mésenchymateuses et ostéochondrocytes. [130] [131] [125] Il est important de noter que les expériences de traçage de la lignée génétique ont montré sans équivoque que 40 à 90 % des cellules résidentes de la plaque sont dérivées de cellules musculaires lisses vasculaires. [128] [129] Par conséquent, il est important de rechercher le rôle des cellules musculaires lisses vasculaires dans l’athérosclérose pour identifier de nouvelles cibles thérapeutiques. [ citation nécessaire ]
Références
- ^ un bcdef ” Quels sont les signes et les symptômes de l’athérosclérose ? – NHLBI, NIH “ . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 5 novembre 2017 .
- ^ un b “Qu’entraîne l’Athérosclérose ? – NHLBI, NIH” . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 6 novembre 2017 .
- ^ “Le nouveau concept de maladie cardiaque postule une carence en vitamine C comme coupable” . DAIC (Cardiologie Diagnostique et Interventionnelle) . 27 avril 2015 . Récupéré le 06/02/2022 .
- ^ un b “Qui est en danger pour l’Athérosclérose ?” . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 5 novembre 2017 .
- ^ un bc “Comment l’athérosclérose peut-elle être empêchée ou retardée ? – NHLBI, NIH “ . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 6 novembre 2017 .
- ^ un bcd “Comment l’athérosclérose est-elle traitée ? – NHLBI , NIH “ . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 6 novembre 2017 .
- ^ un b Aronow WS, Fleg JL, Rich MW (2013). La maladie cardiovasculaire de Tresch et Aronow chez les personnes âgées, cinquième édition . Presse CRC. p. 171. ISBN 9781842145449.
- ^ “Artériosclérose / athérosclérose – Symptômes et causes” . Clinique Mayo . Récupéré le 06/05/2021 .
- ^ un bc “Qu’est-ce que l’athérosclérose ? – NHLBI, NIH “ . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 6 novembre 2017 .
- ^ Lind, L (août 2003). “Marqueurs circulants de l’inflammation et de l’athérosclérose”. Athérosclérose . 169 (2): 203–214. doi : 10.1016/s0021-9150(03)00012-1 . PMID 12921971 .
- ^ “Comment l’athérosclérose est-elle diagnostiquée ? – NHLBI, NIH” . www.nhlbi.nih.gov . 22 juin 2016 . Récupéré le 6 novembre 2017 .
- ^ Topol EJ, Californie RM (2007). Manuel de médecine cardiovasculaire . Lippincott Williams & Wilkins. p. 2. ISBN 9780781770125.
- ^ un b Shor A (2008). Lésion d’athérosclérose à Chlamydia : découverte, diagnostic et traitement . Springer Science et médias d’affaires. p. 8. ISBN 9781846288104.
- ^ Ross R (avril 1993). « La pathogenèse de l’athérosclérose : une perspective pour les années 1990 ». Nature . 362 (6423): 801–9. Bibcode : 1993Natur.362..801R . doi : 10.1038/362801a0 . PMID 8479518 . S2CID 4282916 .
- ^ Athérosclérose. Publications de santé de Harvard Publications de santé de Harvard. Sujets de santé de A à Z, (2011)
- ^ un bc “l’ Athérosclérose ” . Institut national du cœur, des poumons et du sang. 2011.
- ^ un b Velican, Doina; Velican, C. (juin 1979). “Étude des plaques fibreuses survenant dans les artères coronaires des enfants”. Athérosclérose . 33 (2): 201–215. doi : 10.1016/0021-9150(79)90117-5 . PMID 475879 .
- ^ Stary, HC; Chandler, AB; Glagov, S; Guyton, JR; Insull, W; Rosenfeld, ME ; Schaffer, SA; Schwartz, CJ; Wagner, WD ; Wissler, RW (mai 1994). “Une définition des lésions initiales, grasses et intermédiaires de l’athérosclérose. Un rapport du Comité sur les lésions vasculaires du Conseil sur l’artériosclérose, American Heart Association” . Circulation . 89 (5): 2462–2478. doi : 10.1161/01.cir.89.5.2462 . PMID 8181179 .
- ^ “Les premiers signes de cardiopathie athéroscléreuse peuvent apparaître dans la petite enfance” . News-Medical.net . Février 2012.
- ^ Flora GC, Baker AB, Loewenson RB, Klassen AC (novembre 1968). “Une étude comparative de l’athérosclérose cérébrale chez les hommes et les femmes” . Circulation . 38 (5) : 859–869. doi : 10.1161/01.CIR.38.5.859 . PMID 5697685 .
- ^ une arythmie b . Fondation des maladies du cœur et de l’AVC. “Copie archivée” . Archivé de l’original le 2014-02-03 . Récupéré le 31/01/2014 .{{cite web}}: Maint CS1 : copie archivée comme titre ( lien )(2011)
- ^ Sims NR, Muyderman H (janvier 2010). “Mitochondries, métabolisme oxydatif et mort cellulaire dans les accidents vasculaires cérébraux” (PDF) . Biochimica et Biophysica Acta (BBA) – Base moléculaire de la maladie . 1802 (1) : 80–91. doi : 10.1016/j.bbadis.2009.09.003 . PMID 19751827 .
- ^ Kharabsheh, Suleiman M (janvier-février 2006). “Vue d’ensemble des tests d’effort” . Ann. Méd saoudien . 26 (1): 1–6. doi : 10.5144/0256-4947.2006.1 . PMC 6078558 . PMID 16521867 .
- ^ Enos WF, Holmes RH, Beyer J (1953). “Maladie coronarienne parmi les soldats américains tués au combat en Corée: rapport préliminaire”. JAMA . 152 (12): 1090–93. doi : 10.1001/jama.1953.03690120006002 . PMID 13052433 . L’âge moyen a été calculé à partir de l’âge de 200 ans des soldats. Aucun âge n’a été enregistré chez près de 100 des hommes.
- ^ Li X, Fang P, Li Y, Kuo YM, Andrews AJ, Nanayakkara G, Johnson C, Fu H, Shan H, Du F, Hoffman NE, Yu D, Eguchi S, Madesh M, Koch WJ, Sun J, Jiang X, Wang H, Yang X (juin 2016). “Les espèces d’oxygène réactif mitochondrial assurent la médiation de l’activation des cellules endothéliales induite par la lysophosphatidylcholine” . Artériosclérose, thrombose et biologie vasculaire . 36 (6): 1090–100. doi : 10.1161/ATVBAHA.115.306964 . PMC 4882253 . PMID 27127201 .
- ^ Botts SR, Fish JE, Howe KL (décembre 2021). “Endothélium vasculaire dysfonctionnel en tant que moteur de l’athérosclérose : aperçus émergents de la pathogenèse et du traitement” . Frontières en Pharmacologie . 12 : 787541. doi : 10.3389/fphar.2021.787541 . PMC 8727904 . PMID 35002720 .
- ^ Williams KJ, Tabas I (mai 1995). “L’hypothèse de réponse à la rétention de l’athérogenèse précoce” . Artériosclérose, thrombose et biologie vasculaire . 15 (5): 551–61. doi : 10.1161/01.ATV.15.5.551 . PMC 2924812 . PMID 7749869 .
- ^ Aviram M, Fuhrman B (novembre 1998). “L’oxydation des LDL par les macrophages de la paroi artérielle dépend du statut oxydatif dans la lipoprotéine et dans les cellules : rôle des prooxydants vs antioxydants”. Biochimie Moléculaire et Cellulaire . 188 (1–2): 149–59. doi : 10.1023/A:1006841011201 . PMID 9823020 . S2CID 12222110 .
- ^ un bcdef g h i j k l m n o p q ” L’ athérosclérose | NHLBI , NIH” .
- ^ Campbell LA, Rosenfeld ME (juillet 2015). “Développement de l’infection et de l’athérosclérose” . Arch Med Res . 46 (5) : 339–350. doi : 10.1016/j.arcmed.2015.05.006 . PMC 4524506 . PMID 26004263 .
- ^ Sinha A, Feinstein MJ (mars 2019). “Manifestations de la maladie coronarienne dans le VIH : quoi, comment et pourquoi”. Le Journal canadien de cardiologie . 35 (3): 270-279. doi : 10.1016/j.cjca.2018.11.029 . PMID 30825949 . S2CID 73469601 .
- ^ Enas EA, Kuruvila A, Khanna P, Pitchumoni CS, Mohan V (octobre 2013). “Avantages et risques de la thérapie aux statines pour la prévention primaire des maladies cardiovasculaires chez les Indiens d’Asie – une population présentant le risque le plus élevé de maladie coronarienne prématurée et de diabète” . Le Journal indien de la recherche médicale . 138 (4) : 461–491. PMC 3868060 . PMID 24434254 .
- ^ Indian Heart Association Pourquoi les faits sur les Asiatiques du Sud Web. 30 avril 2015. http://indianheartassociation.org/why-indians-why-south-asians/overview/
- ^ Tyrrell DJ, Blin MB, Song J, Wood SC, Zhang M, Beard DA, Goldstein DR (janvier 2020). “La dysfonction mitochondriale associée à l’âge accélère l’athérogenèse” . Recherche sur la diffusion . 126 (3): 298–314. doi : 10.1161/CIRCRESAHA.119.315644 . PMC 7006722 . PMID 31818196 .
- ^ Vélican, C; Velican, D (mars 1985). “Différences dans le modèle d’implication athérosclérotique entre les régions non ramifiées et les points de ramification adjacents des artères coronaires humaines”. Athérosclérose . 54 (3): 333–342. doi : 10.1016/0021-9150(85)90126-1 . PMID 3994786 .
- ^ Borissoff JI, Spronk HM, Heeneman S, dix Cate H (juin 2009). « La thrombine est-elle un acteur clé dans le labyrinthe « coagulation-athérogenèse » ? . Recherche cardiovasculaire . 82 (3): 392–403. doi : 10.1093/cvr/cvp066 . PMID 19228706 .
- ^ Borissoff JI, Heeneman S, Kilinç E, Kassák P, Van Oerle R, Winckers K, Govers-Riemslag JW, Hamulyák K, Hackeng TM, Daemen MJ, ten Cate H, Spronk HM (août 2010). “L’athérosclérose précoce présente un état procoagulant amélioré” . Circulation . 122 (8) : 821–830. doi : 10.1161/CIRCULATIONAHA.109.907121 . PMID 20697022 .
- ^ Borissoff JI, Spronk HM, dix Cate H (mai 2011). “Le système hémostatique en tant que modulateur de l’athérosclérose”. Le New England Journal of Medicine . 364 (18) : 1746–1760. doi : 10.1056/NEJMra1011670 . PMID 21542745 .
- ^ Conseil de l’alimentation et de la nutrition, institut de médecine des académies nationales (2005). Apports nutritionnels de référence pour l’énergie, les glucides, les fibres, les lipides, les acides gras, le cholestérol, les protéines et les acides aminés (macronutriments) . Presse des académies nationales. p. 481–484. doi : 10.17226/10490 . ISBN 978-0-309-08525-0.
- ^ Mozaffarian D, Rimm EB, Herrington DM (novembre 2004). “Graisses alimentaires, glucides et progression de l’athérosclérose coronarienne chez les femmes ménopausées” . Le tourillon américain de la nutrition clinique . 80 (5): 1175–1184. doi : 10.1093/ajcn/80.5.1175 . PMC 1270002 . PMID 15531663 .
- ^ Bhatt DL, Topol EJ (juillet 2002). “Besoin de tester l’hypothèse de l’inflammation artérielle” . Circulation . 106 (1): 136–140. doi : 10.1161/01.CIR.0000021112.29409.A2 . PMID 12093783 .
- ^ Griffin M, Frazer A, Johnson A, Collins P, Owens D, Tomkin GH (juin 1998). “Synthèse cellulaire du cholestérol – la relation avec le glucose et l’insuline post-prandiaux suite à une perte de poids”. Athérosclérose . 138 (2): 313–8. doi : 10.1016/S0021-9150(98)00036-7 . PMID 9690914 .
- ^ King CR, Knutson KL, Rathouz PJ, Sidney S, Liu K, Lauderdale DS (décembre 2008). “Courte durée du sommeil et calcification incidente de l’artère coronaire” . JAMA . 300 (24): 2859–66. doi : 10.1001/jama.2008.867 . PMC 2661105 . PMID 19109114 .
- ^ Prévôt EB, Madhloum N, Int Panis L, De Boever P, Nawrot TS (2015). “L’épaisseur de l’intima-média carotidien, un marqueur de l’athérosclérose subclinique et l’exposition à la pollution atmosphérique particulaire : les preuves méta-analytiques” . PLOS ONE . 10 (5) : e0127014. Bibcode : 2015PLoSO..1027014P . doi : 10.1371/journal.pone.0127014 . PMC 4430520 . PMID 25970426 .
- ^ Adar SD, Sheppard L, Vedal S, Polak JF, Sampson PD, Diez Roux AV, Budoff M, Jacobs DR, Barr RG, Watson K, Kaufman JD (23 avril 2013). “La pollution de l’air par les particules fines et la progression de l’épaisseur intima-médiale de la carotide : une étude de cohorte prospective à partir de l’étude multiethnique de l’athérosclérose et de la pollution de l’air” . PLO Médecine . 10 (4) : e1001430. doi : 10.1371/journal.pmed.1001430 . PMC 3637008 . PMID 23637576 . Cette première analyse de MESA suggère que des concentrations plus élevées de PM2,5 à long terme sont associées à une progression accrue des IMT et que des réductions plus importantes des PM2,5 sont liées à une progression plus lente des IMT.
- ^ Wang, Chih-Hao; Jeng, Jiann-Shing; Youpi, Ping-Keung ; Chen, Chi-Ling; Hsu, Lin-I; Hsueh, Yu-Mei ; Chiou, Hung-Yi; Wu, Meei-Mann; Chen, Chien-Jen (16 avril 2002). “Gradient biologique entre l’exposition à l’arsenic à long terme et l’athérosclérose carotidienne”. Circulation . 105 (15): 1804-1809. doi : 10.1161/01.cir.0000015862.64816.b2 . PMID 11956123 . S2CID 535580 .
- ^ “Le traitement de l’hypothyroïdie réduit le risque d’athérosclérose” . Médecin de famille américain . 69 (3): 656. 1er février 2004.
- ^ Bale BF, Doneen AL, Vigerust DJ (avril 2017). “Les agents pathogènes parodontaux à haut risque contribuent à la pathogenèse de l’athérosclérose” . Revue médicale postdoctorale . 93 (1098): 215-220. doi : 10.1136/postgradmedj-2016-134279 . PMC 5520251 . PMID 27899684 .
- ^ “Pyramides alimentaires : source de nutrition, École de santé publique de Harvard” . Archivé de l’original le 26 décembre 2007 . Récupéré le 25/11/2007 .
- ^ Staprãns I, Rapp JH, Pan XM, Hardman DA, Feingold KR (avril 1996). “Les lipides oxydés dans l’alimentation accélèrent le développement de stries grasses chez les lapins nourris au cholestérol”. Artériosclérose, thrombose et biologie vasculaire . 16 (4): 533–8. doi : 10.1161/01.atv.16.4.533 . PMID 8624775 .
- ^ Song JH, Fujimoto K, Miyazawa T (décembre 2000). “Les Acides gras polyinsaturés (n-3) sensibles à la peroxydation sont augmentés dans les lipides plasmatiques et tissulaires des rats nourris avec des huiles contenant de l’acide docosahexaénoïque” . Le Journal de l’alimentation . 130 (12): 3028–33. doi : 10.1093/jn/130.12.3028 . PMID 11110863 .
- ^ Yap SC, Choo YM, Hew NF, Yap SF, Khor HT, Ong AS, Goh SH (décembre 1995). “Susceptibilité oxydative des lipoprotéines de basse densité de lapins nourris avec des régimes athérogènes contenant des huiles de noix de coco, de palme ou de soja”. Lipides . 30 (12): 1145–1150. doi : 10.1007/BF02536616 . PMID 8614305 . S2CID 3960289 .
- ^ Greco AV, Mingrone G (1990). “Modèle lipidique sérique et biliaire chez les lapins nourrissant un régime enrichi en acides gras insaturés”. Pathologie Expérimentale . 40 (1): 19–33. doi : 10.1016/S0232-1513(11)80281-1 . PMID 2279534 .
- ^ “Scientifique, 98 ans, défie l’orthodoxie sur les causes des maladies cardiaques” . medicalxpress.com .
- ^ Mattes RD (décembre 2005). “Goût gras et métabolisme des lipides chez l’homme”. Physiologie & Comportement . 86 (5) : 691–7. doi : 10.1016/j.physbeh.2005.08.058 . PMID 16249011 . S2CID 33916150 . L’odeur rance d’une graisse oxydée est facilement détectable
- ^ Dobarganes C, Márquez-Ruiz G (mars 2003). “Graisses oxydées dans les aliments”. Opinion actuelle sur la nutrition clinique et les soins métaboliques . 6 (2): 157–63. doi : 10.1097/00075197-200303000-00004 . PMID 12589185 . S2CID 21085461 .
- ^ suppléments, FDA (4 février 2020). “Compléments alimentaires” . Administration des aliments et des médicaments .
- ^ Khan-Marchand, Nadya; Penumetcha, Meera ; Meilhac, Olivier; Parthasarathy, Sampath (novembre 2002). “Les acides gras oxydés favorisent l’athérosclérose uniquement en présence de cholestérol alimentaire chez les souris knock-out pour les récepteurs des lipoprotéines à faible densité” . Le Journal de l’alimentation . 132 (11): 3257–3258. doi : 10.1093/jn/132.11.3256 . PMID 12421837 .
- ^ “L’athérosclérose” . La bibliothèque de concepts médicaux Lecturio . Récupéré le 2 juillet 2021 .
- ^ Schwartz CJ, Valente AJ, Sprague EA, Kelley JL, Cayatte AJ, Mowery J (décembre 1992). “L’athérosclérose. Cibles potentielles pour la stabilisation et la régression”. Circulation . 86 (6 suppl.) : III117–23. PMID 1424045 .
- ^ un b Linton, MacRae F.; Yancey, Patricia G.; Davies, Sean S.; Jérôme, W. Gray; Linton, Edward F.; Song, Wenliang L.; Doran, Amanda C.; Vickers, Kasey C. (2000). “Le rôle des lipides et des lipoprotéines dans l’athérosclérose”. Endotexte . PMID 26844337 . NBK343489 .
- ^ Robbins CS, Hilgendorf I, Weber GF, Theurl I, Iwamoto Y, Figueiredo JL, Gorbatov R, Sukhova GK, Gerhardt LM, Smyth D, Zavitz CC, Shikatani EA, Parsons M, van Rooijen N, Lin HY, Husain M, Libby P, Nahrendorf M, Weissleder R, Swirski FK (septembre 2013). “La prolifération locale domine l’accumulation lésionnelle de macrophages dans l’athérosclérose” . Médecine naturelle . 19 (9) : 1166–1172. doi : 10.1038/nm.3258 . PMC 3769444 . PMID 23933982 .
- ^ Miller, Jordan D. (juin 2013). “Origines orbiculaires”. Matériaux naturels . 12 (6): 476–478. Bibcode : 2013NatMa..12..476M . doi : 10.1038/nmat3663 . PMID 23695741 .
- ^ Glagov S, Weisenberg E, Zarins CK, Stankunavicius R, Kolettis GJ (mai 1987). “Élargissement compensatoire des artères coronaires athérosclérotiques humaines”. Le New England Journal of Medicine . 316 (22): 1371–5. doi : 10.1056/NEJM198705283162204 . PMID 3574413 .
- ^ “L’athérosclérose coronarienne – la plaque fibreuse avec calcification” . www.pathologyatlas.ro . Récupéré le 25/03/2010 .
- ^ Janoudi A, Shamoun FE, Kalavakunta JK, Abela GS (juillet 2016). “Inflammation artérielle induite par les cristaux de cholestérol et déstabilisation de la plaque d’athérosclérose” . Journal européen du cœur . 37 (25): 1959–67. doi : 10.1093/eurheartj/ehv653 . PMID 26705388 .
- ^ Maton A, Hopkins RL, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Biologie humaine et santé . Falaises d’Englewood, New Jersey : Prentice Hall. ISBN 978-0-13-981176-0. OCLC 32308337 .
- ^ un b “Quels sont les signes et les symptômes de la maladie coronarienne ?” . www.nhlbi.nih.gov . 29 septembre 2014. Archivé de l’original le 24 février 2015 . Récupéré le 2 juillet 2021 .
- ^ Wang, Jicun; Michelitsch, Thomas; Wunderlin, Arne; Mahadeva, Ravi (6 avril 2009). “Vieillissement comme conséquence d’une mauvaise réparation – Une nouvelle théorie du vieillissement”. Précédants de la nature . arXiv : 0904.0575 . doi : 10.1038/npre.2009.2988.2 . S2CID 2179468 .
- ^ Wang-Michelitsch J, Michelitsch T (2015). “Le vieillissement en tant que processus d’accumulation de réparations défectueuses”. 1503 (7163). arXiv : 1503.07163 . Bib code : 2015arXiv150307163W . {{cite journal}}:Cite journal requires |journal= (help)
- ^ Wang-Michelitsch J, Michelitsch T (2015). “Mécanisme de mauvaise réparation dans le développement des plaques d’athérosclérose”. 1505 (1289). arXiv : 1505.01289 . Bib code : 2015arXiv150501289W . {{cite journal}}: Cite journal requires |journal= (help)
- ^ Ross R (janvier 1999). “L’athérosclérose – une maladie inflammatoire”. Le New England Journal of Medicine . 340 (2): 115–26. doi : 10.1056/NEJM199901143400207 . PMID 9887164 .
- ^ Finn AV, Nakano M, Narula J, Kolodgie FD, Virmani R (juillet 2010). “Concept de plaque vulnérable/instable” . Artériosclérose, thrombose et biologie vasculaire . 30 (7) : 1282–1292. doi : 10.1161/ATVBAHA.108.179739 . PMID 20554950 .
- ^ Didangelos A, Simper D, Monaco C, Mayr M (mai 2009). “Protéomique des syndromes coronariens aigus”. Rapports actuels sur l’athérosclérose . 11 (3): 188–95. doi : 10.1007/s11883-009-0030-x . PMID 19361350 . S2CID 41219190 .
- ^ un b Tarkin, Jason M.; Dweck, Marc R.; Evans, Nicholas R.; Takx, Richard AP; Brown, Adam J.; Tawakol, Ahmed; Fayad, Zahi A. ; Rudd, James HF (2016-02-19). “Imagerie de l’athérosclérose” . Recherche sur la diffusion . 118 (4): 750–769. doi : 10.1161/CIRCRESAHA.115.306247 . PMC 4756468 . PMID 26892971 .
- ^ Stary, Herbert C.; Chandler, A. Bleakley; Dinsmore, Robert E.; Fuster, Valentin ; Glagov, Seymour; Insull Jr., William; Rosenfeld, Michael E.; Schwartz, Colin J.; Wagner, William D.; Wissler, Robert W. (1995-09-01). “Une définition des types avancés de lésions athérosclérotiques et une classification histologique de l’athérosclérose – Un rapport du comité sur les lésions vasculaires du Conseil sur l’artériosclérose, American Heart Association” . Circulation . 92 (5): 1355-1374. doi : 10.1161/01.CIR.92.5.1355 . PMID 7648691 .
- ^ Maseri A, Fuster V (avril 2003). « Y a-t-il une plaque vulnérable ? » . Circulation . 107 (16): 2068–71. doi : 10.1161/01.CIR.0000070585.48035.D1 . PMID 12719286 .
- ^ McGill HC, McMahan CA, Gidding SS (mars 2008). “Prévention des maladies cardiaques au 21e siècle : implications de l’étude sur les déterminants pathobiologiques de l’athérosclérose chez les jeunes (PDAY)” . Circulation . 117 (9) : 1216–1227. doi : 10.1161/CIRCULATIONAHA.107.717033 . PMID 18316498 .
- ^ McNeal CJ, Dajani T, Wilson D, Cassidy-Bushrow AE, Dickerson JB, Ory M (janvier 2010). “Hypercholestérolémie chez les jeunes : opportunités et obstacles pour prévenir les maladies cardiovasculaires athéroscléreuses prématurées”. Rapports actuels sur l’athérosclérose . 12 (1): 20–8. doi : 10.1007/s11883-009-0072-0 . PMID 20425267 . S2CID 37833889 .
- ^ Riz BH (2014). “Maladies laitières et cardiovasculaires : un examen de la recherche observationnelle récente” . Rapports nutritionnels actuels . 3 (2): 130–138. doi : 10.1007/s13668-014-0076-4 . PMC 4006120 . PMID 24818071 .
- ^ Kratz M, Baars T, Guyenet S (février 2013). “La relation entre la consommation de produits laitiers riches en matières grasses et l’obésité, les maladies cardiovasculaires et métaboliques”. Journal européen de nutrition . 52 (1): 1–24. doi : 10.1007/s00394-012-0418-1 . PMID 22810464 . S2CID 1360916 .
- ^ Wang X, Ouyang Y, Liu J, Zhu M, Zhao G, Bao W, Hu FB (juillet 2014). “Consommation de fruits et légumes et mortalité toutes causes confondues, maladies cardiovasculaires et cancer : revue systématique et méta-analyse dose-réponse d’études de cohorte prospectives” . BMJ . 349 : g4490. doi : 10.1136/bmj.g4490 . PMC 4115152 . PMID 25073782 .
- ^ Walker C, Reamy BV (avril 2009). “Régimes pour la prévention des maladies cardiovasculaires : quelles sont les preuves ?”. Médecin de famille américain . 79 (7): 571–8. PMID 19378874 .
- ^ Nordmann AJ, Suter-Zimmermann K, Bucher HC, Shai I, Tuttle KR, Estruch R, Briel M (septembre 2011). “Méta-analyse comparant les régimes méditerranéens aux régimes faibles en gras pour la modification des facteurs de risque cardiovasculaire”. Le Journal américain de médecine . 124 (9) : 841–51.e2. doi : 10.1016/j.amjmed.2011.04.024 . PMID 21854893 .
- ^ Paul, Paulin; Williams, Beverly, éd. (2009). “Fonction cardiovasculaire, circulatoire et hématologique” . Brunner & Suddarth’s Textbook of Canadian Medical-surgical Nursing . Lippincott Williams & Wilkins. pp. 730–1047. ISBN 978-0-7817-9989-8.
- ^ un b Fonarow G (2003). “Traitement agressif de l’athérosclérose : le moment est venu”. Clève. Clin. J.Med . 70 (5): 431–434. doi : 10.3949/ccjm.70.5.431 . PMID 12785316 .
- ^ Ambrose JA, Barua RS (mai 2004). « La physiopathologie du Tabagisme et des maladies cardiovasculaires : une mise à jour » . Journal de l’American College of Cardiology . 43 (10): 1731–7. doi : 10.1016/j.jacc.2003.12.047 . PMID 15145091 .
- ^ Pigozzi, F; Rizzo, M; Fagnani, F; Parisi, A; Spataro, A; Casasco, M; Borrione, P (juin 2011). « (Dys)fonction endothéliale : la cible de l’exercice physique pour la prévention et le traitement des maladies cardiovasculaires » . Le Journal de la médecine sportive et de la condition physique . 51 (2): 260-267. PMID 21681161 .
- ^ Koh KK, Han SH, Oh PC, Shin EK, Quon MJ (avril 2010). “Thérapie combinée pour le traitement ou la prévention de l’athérosclérose : focus sur l’interaction lipide-RAAS” . Athérosclérose . 209 (2): 307–313. doi : 10.1016/j.atherosclerosis.2009.09.007 . PMC 2962413 . PMID 19800624 .
- ^ Taylor F, Huffman MD, Macedo AF, Moore TH, Burke M, Davey Smith G, Ward K, Ebrahim S (janvier 2013). “Statines pour la prévention primaire des maladies cardiovasculaires” . La base de données Cochrane des revues systématiques . 1 (1) : CD004816. doi : 10.1002/14651858.CD004816.pub5 . PMC 6481400 . PMID 23440795 .
- ^ Virani, Salim S.; Smith, Sidney C.; Stone, Neil J.; Grundy, Scott M. (7 avril 2020). “Prévention secondaire de la maladie cardiovasculaire athéroscléreuse : comparaison des directives américaines et européennes récentes sur la dyslipidémie” . Circulation . 141 (14): 1121–1123. doi : 10.1161/CIRCULATIONAHA.119.044282 . PMID 32250694 .
- ^ Grundy, Scott M.; Stone, Neil J.; Bailey, Alison L.; Faisceau, Craig ; Birtcher, Kim K.; Blumenthal, Roger S.; Braun, Lynne T.; de Ferranti, Sarah; Faiella-Tommasino, Joseph; Forman, Daniel E.; Goldberg, Ronald; Heidenreich, Paul A.; Hlatky, Mark A.; Jones, Daniel W.; Lloyd-Jones, Donald ; Lopez-Pajares, Nuria ; Ndumele, Chiadi E.; Orringer, Carl E.; Peralta, Carmen A.; Saseen, Joseph J.; Smith, Sidney C.; Sperling, Laurence; Virani, Salim S.; Yeboah, Joseph (juin 2019). “Directive AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA sur la gestion du cholestérol sanguin” 2018 . Journal de l’American College of Cardiology . 73 (24): e285–e350. doi : 10.1016/j.jacc.2018.11.003 . PMID 30423393 .
- ^ Nanna, Michael G.; Wang, Tracy Y.; Xiang, Qun ; Goldberg, Anne C.; Robinson, Jennifer G.; Roger, Véronique L.; Virani, Salim S.; Wilson, Peter WF; Louie, Michael J.; Koren, Andrew; Li, Zhuokai; Peterson, Eric D.; Navar, Ann Marie (août 2019). ” Différences entre les sexes dans l’utilisation des statines dans la pratique communautaire : évaluation du patient et du fournisseur du registre de gestion des lipides ” . Circulation : qualité et résultats cardiovasculaires . 12 (8) : e005562. doi : 10.1161/CIRCOUTCOMES.118.005562 . PMC 6903404 . PMID 31416347 .
- ^ Lee, Michelle T.; Mahtta, Dhruv; Ramsey, David J.; Liu, Jing; Misra, Arunima; Nasir, Khurram ; Samad, Zainab; Itchhaporia, Diptis ; Khan, Safi U.; Schofield, Richard S.; Ballantyne, Christie M.; Petersen, Laura A.; Virani, Salim S. (1 juillet 2021). “Disparités liées au sexe dans les soins de santé cardiovasculaire chez les patients atteints d’une maladie cardiovasculaire athéroscléreuse prématurée” . JAMA Cardiologie . 6 (7): 782–790. doi : 10.1001/jamacardio.2021.0683 . PMC 8060887 . PMID 33881448 .
- ^ Vos E, Rose CP (novembre 2005). “Interroger les bienfaits des statines” . JAMC . 173 (10): 1207, réponse de l’auteur 1210. doi : 10.1503/cmaj.1050120 . PMC 1277053 . PMID 16275976 .
- ^ Zhao DF, Edelman JJ, Seco M, Bannon PG, Wilson MK, Byrom MJ, Thourani V, Lamy A, Taggart DP, Puskas JD, Vallely MP (février 2017). “Greffe de dérivation de l’artère coronaire avec et sans manipulation de l’aorte ascendante : une méta-analyse en réseau” . Journal de l’American College of Cardiology . 69 (8): 924–936. doi : 10.1016/j.jacc.2016.11.071 . PMID 28231944 .
- ^ Vlasschaert, Caitlyn; Goss, Chloé J.; Pilkey, Nathan G.; McKeown, Sandra; Holden, Rachel M. (23 septembre 2020). “Supplémentation en vitamine K pour la prévention des maladies cardiovasculaires : où sont les preuves ? Une revue systématique des essais contrôlés” . Nutriments . 12 (10) : 2909. doi : 10.3390/nu12102909 . PMC 7598164 . PMID 32977548 .
- ^ Kong BS, Cho YH, Lee EJ (2014). “Le récepteur 1 des œstrogènes couplé aux protéines G est impliqué dans l’effet protecteur de l’aldéhyde protocatéchuique contre le dysfonctionnement endothélial” . PLOS ONE . 9 (11) : e113242. Bibcode : 2014PLoSO…9k3242K . doi : 10.1371/journal.pone.0113242 . PMC 4239058 . PMID 25411835 .
- ^ Kong BS, Im SJ, Lee YJ, Cho YH, Do YR, Byun JW, Ku CR, Lee EJ (2016). “Effets vasculoprotecteurs du 3-hydroxybenzaldéhyde contre la prolifération des CMLV et l’inflammation des CE” . PLOS ONE . 11 (3) : e0149394. Bibcode : 2016PLoSO..1149394K . doi : 10.1371/journal.pone.0149394 . PMC 4803227 . PMID 27002821 .
- ^ Price PA, Faus SA, Williamson MK (février 2000). “La calcification artérielle induite par la warfarine est accélérée par la croissance et la vitamine D” . Artériosclérose, thrombose et biologie vasculaire . 20 (2): 317-27. doi : 10.1161/01.ATV.20.2.317 . PMID 10669626 .
- ^ Geleijnse JM, Vermeer C, Grobbee DE, Schurgers LJ, Knapen MH, van der Meer IM, Hofman A, Witteman JC (novembre 2004). “L’apport alimentaire de ménaquinone est associé à un risque réduit de maladie coronarienne : l’étude de Rotterdam” . Le Journal de l’alimentation . 134 (11): 3100–5. doi : 10.1093/jn/134.11.3100 . PMID 15514282 .
- ^ “Vitamine K” . Institut Linus Pauling de l’Université d’État de l’Oregon. Archivé de l’original le 7 avril 2010 . Récupéré le 25/03/2010 .
- ^ “Les 10 principales causes de décès” . www.who.int . Récupéré le 26/01/2020 .
- ^ “Athérogénique” . Dictionnaire Merriam-Webster .
- ^ Pfuntner A, Wier LM, Steiner C (décembre 2013). “Coûts des séjours hospitaliers aux États-Unis, 2011” . Fiche statistique HCUP #168 . Rockville, MD : Agence pour la recherche et la qualité des soins de santé.
- ^ Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJ, Komajda M, Lopez-Sendon J, Mosca L, Tardif JC, Waters DD, Shear CL, Revkin JH, Buhr KA, Fisher MR, Tall AR, Brewer B (novembre 2007). “Effets de torcetrapib chez les patients à haut risque d’événements coronariens”. Le New England Journal of Medicine . 357 (21): 2109–22. doi : 10.1056/NEJMoa0706628 . PMID 17984165 .
- ^ Nilsson J, Hansson GK, Shah PK (janvier 2005). “Immunomodulation de l’athérosclérose : implications pour le développement de vaccins” . Artériosclérose, thrombose et biologie vasculaire . 25 (1): 18-28. doi : 10.1161/01.ATV.0000149142.42590.a2 . PMID 15514204 .
- ^ Spiteller G (novembre 2005). “La relation des processus de peroxydation lipidique avec l’athérogenèse: une nouvelle théorie sur l’athérogenèse”. Nutrition moléculaire et recherche alimentaire . 49 (11): 999-1013. doi : 10.1002/mnfr.200500055 . PMID 16270286 .
- ^ Berbée JF, Mol IM, Milne GL, Pollock E, Hoeke G, Lütjohann D, Monaco C, Rensen PC, van der Ploeg LH, Shchepinov MS (septembre 2017). “Les Acides gras polyinsaturés renforcés au deutérium protègent contre l’athérosclérose en abaissant la peroxydation lipidique et l’hypercholestérolémie” . Athérosclérose . 264 : 100–107. doi : 10.1016/j.atherosclerosis.2017.06.916 . PMID 28655430 .
- ^ Tsikas D (septembre 2017). “Lutter contre l’athérosclérose avec des AGPI lourds : le Deutéron et non le proton est le premier”. Athérosclérose . 264 : 79–82. doi : 10.1016/j.atherosclerosis.2017.07.018 . PMID 28756876 .
- ^ un b Chen WJ, Yin K, Zhao GJ, Fu YC, Tang CK (juin 2012). “La magie et le mystère du microARN-27 dans l’athérosclérose”. Athérosclérose . 222 (2) : 314–323. doi : 10.1016/j.atherosclerosis.2012.01.020 . PMID 22307089 .
- ^ Sacco J, Adeli K (juin 2012). « MicroARN : rôles émergents dans le métabolisme des lipides et des lipoprotéines ». Opinion actuelle en lipidologie . 23 (3) : 220–5. doi : 10.1097/MOL.0b013e3283534c9f . PMID 22488426 . S2CID 23814795 .
- ^ Bommer GT, MacDougald OA (mars 2011). “Régulation de l’homéostasie lipidique par le locus bifonctionnel SREBF2-miR33a” . Métabolisme cellulaire . 13 (3): 241–7. doi : 10.1016/j.cmet.2011.02.004 . PMC 3062104 . PMID 21356514 .
- ^ Rayner KJ, Sheedy FJ, Esau CC, Hussain FN, Temel RE, Parathath S, van Gils JM, Rayner AJ, Chang AN, Suarez Y, Fernandez-Hernando C, Fisher EA, Moore KJ (juillet 2011). “L’antagonisme de miR-33 chez la souris favorise le transport inverse du cholestérol et la régression de l’athérosclérose” . Le Journal d’investigation clinique . 121 (7): 2921–31. doi : 10.1172/JCI57275 . PMC 3223840 . PMID 21646721 .
- ^ Iwakiri Y (mars 2012). “Un rôle de miR-33 pour la progression du cycle cellulaire et la prolifération cellulaire” . Cycle cellulaire . 11 (6): 1057–8. doi : 10.4161/cc.11.6.19744 . PMID 22395363 .
- ^ Singaraja RR, Stahmer B, Brundert M, Merkel M, Heeren J, Bissada N, Kang M, Timmins JM, Ramakrishnan R, Parks JS, Hayden MR, Rinninger F (août 2006). “Le transporteur A1 de cassette de liaison à l’ATP hépatique est une molécule clé dans le métabolisme des esters de cholestérol des lipoprotéines de haute densité chez la souris” . Artériosclérose, thrombose et biologie vasculaire . 26 (8) : 1821–7. doi : 10.1161/01.ATV.0000229219.13757.a2 . PMID 16728652 .
- ^ Zimmer S, Grebe A, Bakke SS, Bode N, Halvorsen B, Ulas T, Skjelland M, De Nardo D, Labzin LI, Kerksiek A, Hempel C, Heneka MT, Hawxhurst V, Fitzgerald ML, Trebicka J, Björkhem I, Gustafsson JÅ, Westerterp M, Tall AR, Wright SD, Espevik T, Schultze JL, Nickenig G, Lütjohann D, Latz E (avril 2016). “La cyclodextrine favorise la régression de l’athérosclérose via la reprogrammation des macrophages” . Science médecine translationnelle . 8 (333): 333ra50. doi : 10.1126/scitranslmed.aad6100 . PMC 4878149 . PMID 27053774 .
- Résumé simplifié dans : Hesman Saey T (8 avril 2016). “Un sucre peut faire fondre le cholestérol” . Science News.org .
- ^ Wu H, Roks AJ (février 2014). “Instabilité génomique et vieillissement vasculaire: un focus sur la réparation par excision de nucléotides”. Tendances en médecine cardiovasculaire . 24 (2) : 61–8. doi : 10.1016/j.tcm.2013.06.005 . PMID 23953979 .
- ^ un b Bautista-Niño PK, Portilla-Fernandez E, Vaughan DE, Danser AH, Roks AJ (mai 2016). “Dommages à l’ADN : un déterminant principal du vieillissement vasculaire” . Journal international des sciences moléculaires . 17 (5): 748. doi : 10.3390/ijms17050748 . PMC 4881569 . PMID 27213333 .
- ^ Shah AV, Bennett MR (décembre 2017). “Mécanismes du vieillissement et de la maladie dépendant des dommages à l’ADN dans la macro et la microvasculature” . Journal européen de pharmacologie . 816 : 116–128. doi : 10.1016/j.ejphar.2017.03.050 . PMID 28347738 . S2CID 1034518 .
- ^ un b Martinet W, Knaapen MW, De Meyer GR, Herman AG, Kockx MM (août 2002). “Niveaux élevés de dommages oxydatifs à l’ADN et d’enzymes de réparation de l’ADN dans les plaques athérosclérotiques humaines” . Circulation . 106 (8): 927–32. doi : 10.1161/01.cir.0000026393.47805.21 . PMID 12186795 .
- ^ Ishida T, Ishida M, Tashiro S, Yoshizumi M, Kihara Y (2014). “Rôle des dommages à l’ADN dans les maladies cardiovasculaires” . Journal de diffusion . 78 (1): 42–50. doi : 10.1253/circj.CJ-13-1194 . PMID 24334614 .
- ^ un b Barrington WT, Lusis AJ (décembre 2017). « Athérosclérose : Association entre le microbiome intestinal et l’athérosclérose » . Revues naturelles. Cardiologie . 14 (12): 699–700. doi : 10.1038/nrcardio.2017.169 . PMC 5815826 . PMID 29099096 .
- ^ Jie Z, Xia H, Zhong SL, Feng Q, Li S, Liang S, et al. (octobre 2017). “Le microbiome intestinal dans les maladies cardiovasculaires athéroscléreuses” . Communication Nature . 8 (1): 845. Bibcode : 2017NatCo…8..845J . doi : 10.1038/s41467-017-00900-1 . PMC 5635030 . PMID 29018189 .
- ^ un bc Harman , Jennifer L.; Jørgensen, Helle F. (octobre 2019). “Le rôle des cellules musculaires lisses dans la stabilité de la plaque : Potentiel de ciblage thérapeutique” . Journal britannique de pharmacologie . 176 (19): 3741–3753. doi : 10.1111/bph.14779 . PMC 6780045 . PMID 31254285 .
- ^ Bennett, Martin R.; Sinha, Sanjay; Owens, Gary K. (19 février 2016). “Cellules musculaires lisses vasculaires dans l’athérosclérose” . Recherche sur la diffusion . 118 (4): 692–702. doi : 10.1161/CIRCRESAHA.115.306361 . PMC 4762053 . PMID 26892967 .
- ^ Gomez, Delphine; Shankman, Laura S; Nguyen, Anh T; Owens, Gary K (février 2013). “Détection de modifications d’histones à des loci de gènes spécifiques dans des cellules individuelles dans des coupes histologiques” . Méthodes naturelles . 10 (2): 171–177. doi : 10.1038/nmeth.2332 . PMC 3560316 . PMID 23314172 .
- ^ un b Wang, Ying; Dubland, Joshua A.; Allahverdien, Sima ; Asonye, Enyinnaya ; Sahin, Basak ; Mâchoire, Jen Erh ; Sin, Don D.; Seidman, Michael A.; Leeper, Nicholas J.; Francis, Gordon A. (mai 2019). “Les cellules musculaires lisses contribuent à la majorité des cellules spumeuses dans l’athérosclérose de souris déficiente en ApoE (apolipoprotéine E)” . Artériosclérose, thrombose et biologie vasculaire . 39 (5): 876–887. doi : 10.1161/ATVBAHA.119.312434 . PMC 6482082 . PMID 30786740 .
- ^ un b Chappell, Joel; Harman, Jennifer L.; Narasimhan, Vagheesh M.; Yu, Haixiang; Foote, Kirsty ; Simons, Benjamin D.; Bennett, Martin R.; Jørgensen, Helle F. (9 décembre 2016). “La prolifération étendue d’un sous-ensemble de cellules musculaires lisses vasculaires médianes différenciées, mais plastiques, contribue à la formation de néointimal dans les modèles de blessures et d’athérosclérose chez la souris” . Recherche sur la diffusion . 119 (12): 1313–1323. doi : 10.1161/CIRCRESAHA.116.309799 . PMC 5149073 . PMID 27682618 .
- ^ Durham, Andrew L; Speer, Mei Y; Scatena, Marta ; Giachelli, Cecilia M; Shanahan, Catherine M (15 mars 2018). “Rôle des cellules musculaires lisses dans la calcification vasculaire : implications dans l’athérosclérose et la rigidité artérielle” . Recherche cardiovasculaire . 114 (4): 590–600. doi : 10.1093/cvr/cvy010 . PMC 5852633 . PMID 29514202 .
- ^ Basatemur, Gemma L.; Jørgensen, Helle F.; Clarke, Murray CH; Bennett, Martin R.; Mallat, Ziad (décembre 2019). “Cellules musculaires lisses vasculaires dans l’athérosclérose” . Revues Nature Cardiologie . 16 (12): 727–744. doi : 10.1038/s41569-019-0227-9 . PMID 31243391 . S2CID 195657448 .
Liens externes
| Wikimedia Commons a des médias liés à l’ athérosclérose . |
-
![]()
![]() Citations liées à l’ athérosclérose sur Wikiquote
Citations liées à l’ athérosclérose sur Wikiquote - Athérosclérose à Curlie
- Physiopathologie de l’ athérosclérose – stades et types
