Anticorps
Un anticorps ( Ab ), également connu sous le nom d’ immunoglobuline ( Ig ), [1] est une grande protéine en forme de Y utilisée par le système immunitaire pour identifier et neutraliser les corps étrangers tels que les bactéries et les virus pathogènes . L’anticorps reconnaît une molécule unique de l’agent pathogène, appelée antigène . [2] [3] Chaque pointe du “Y” d’un anticorps contient un paratope (analogue à une serrure) spécifique d’un épitope particulier(analogue à une clé) sur un antigène, permettant à ces deux structures de se lier avec précision. En utilisant ce mécanisme de liaison, un anticorps peut marquer un Microbe ou une cellule infectée pour qu’il soit attaqué par d’autres parties du système immunitaire, ou peut le neutraliser directement (par exemple, en bloquant une partie d’un virus essentielle à son invasion).
 Chaque anticorps se lie à un antigène spécifique ; une interaction similaire à une serrure et une clé.
Chaque anticorps se lie à un antigène spécifique ; une interaction similaire à une serrure et une clé.
Pour permettre au système immunitaire de reconnaître des millions d’antigènes différents, les sites de liaison à l’antigène aux deux extrémités de l’anticorps sont d’une variété tout aussi large. En revanche, le reste de l’anticorps est relativement constant. Il ne se produit que dans quelques variantes, qui définissent la classe ou l’ isotype de l’anticorps : IgA , IgD , IgE , IgG ou IgM. La région constante au niveau du tronc de l’anticorps comprend des sites impliqués dans des interactions avec d’autres composants du système immunitaire. La classe détermine donc la fonction déclenchée par un anticorps après la liaison à un antigène, en plus de certaines caractéristiques structurelles. Les anticorps de différentes classes diffèrent également par l’endroit où ils sont libérés dans le corps et à quel stade d’une réponse immunitaire.
Avec les lymphocytes B et T , les anticorps constituent la partie la plus importante du système immunitaire adaptatif . Ils se présentent sous deux formes : l’une qui est attachée à une cellule B et l’autre, une forme soluble, qui n’est pas attachée et se trouve dans les fluides extracellulaires tels que le plasma sanguin . Initialement, tous les anticorps sont de la première forme, attachés à la surface d’une cellule B – ceux-ci sont alors appelés récepteurs des cellules B (BCR). Après qu’un antigène se lie à un BCR, la cellule B s’active pour proliférer et se différencier en cellules plasmatiques , qui sécrètent des anticorps solubles avec le même paratope, ou en cellules B mémoire ., qui survivent dans le corps pour permettre une immunité durable contre l’antigène. [4] Des anticorps solubles sont libérés dans le sang et les fluides tissulaires , ainsi que de nombreuses sécrétions . Étant donné que ces fluides étaient traditionnellement connus sous le nom d’ humeurs , l’immunité médiée par les anticorps est parfois connue sous le nom d’ immunité humorale ou considérée comme faisant partie de celle-ci . [5] Les unités solubles en forme de Y peuvent apparaître individuellement sous forme de monomères ou dans des complexes de deux à cinq unités.
Les anticorps sont des glycoprotéines appartenant à la superfamille des immunoglobulines . Les termes anticorps et immunoglobuline sont souvent utilisés de manière interchangeable, [1] bien que le terme « anticorps » soit parfois réservé à la forme sécrétée et soluble, c’est-à-dire à l’exclusion des récepteurs des lymphocytes B. [6]
Structure

 Structure schématique d’un anticorps : deux chaînes lourdes (bleu, jaune) et les deux chaînes légères (vert, rose). Le site de liaison à l’antigène est encerclé.
Structure schématique d’un anticorps : deux chaînes lourdes (bleu, jaune) et les deux chaînes légères (vert, rose). Le site de liaison à l’antigène est encerclé. 


 Une représentation plus précise d’un anticorps (structure 3D au RCSB PDB ). Les Glycanes de la Région FC sont représentés en noir.
Une représentation plus précise d’un anticorps (structure 3D au RCSB PDB ). Les Glycanes de la Région FC sont représentés en noir.
Les anticorps sont des protéines lourdes (~ 150 k Da ) d’environ 10 nm de taille, [7] disposées en trois régions globulaires qui forment grossièrement une forme en Y.
Chez l’homme et la plupart des mammifères , une unité d’anticorps consiste en quatre chaînes polypeptidiques ; deux chaînes lourdes identiques et deux chaînes légères identiques reliées par des ponts disulfure . [8] Chaque chaîne est une série de domaines : des séquences quelque peu similaires d’environ 110 acides aminés chacune. Ces domaines sont généralement représentés dans des schémas simplifiés sous forme de rectangles. Les chaînes légères sont constituées d’un domaine variable V L et d’un domaine constant C L , tandis que les chaînes lourdes contiennent un domaine variable V H et trois à quatre domaines constants C H 1, C H2, … [9]
Structurellement, un anticorps est également divisé en deux fragments de liaison à l’antigène (Fab), contenant chacun un domaine V L , V H , C L et C H 1 , ainsi que le fragment cristallisable (Fc), formant le tronc du Y façonner. [10] Entre elles se trouve une région charnière des chaînes lourdes, dont la flexibilité permet aux anticorps de se lier à des paires d’épitopes à différentes distances, de former des complexes ( dimères , trimères, etc.) et de se lier plus facilement aux molécules effectrices. [11]
Dans un test d’ électrophorèse des Protéines sanguines , les anticorps migrent principalement vers la dernière fraction de gamma globuline . A l’inverse, la plupart des gamma-globulines sont des anticorps, c’est pourquoi les deux termes ont été historiquement utilisés comme synonymes, tout comme les symboles Ig et γ . Cette variante de terminologie est tombée en désuétude en raison de l’inexactitude de la correspondance et de la confusion avec les chaînes lourdes γ qui caractérisent la classe des anticorps IgG . [12] [13]
Site de liaison à l’antigène
Les domaines variables peuvent également être appelés la région Fv . C’est la sous-région de Fab qui se lie à un antigène. Plus précisément, chaque domaine variable contient trois régions hypervariables – les acides aminés qui y sont observés varient le plus d’un anticorps à l’autre. Lorsque la protéine se replie, ces régions donnent naissance à trois boucles de brins β , localisées les unes à côté des autres à la surface de l’anticorps. Ces boucles sont appelées les régions déterminant la complémentarité(CDR), puisque leur forme complète celle d’un antigène. Trois CDR de chacune des chaînes lourdes et légères forment ensemble un site de liaison d’anticorps dont la forme peut être n’importe quoi, d’une poche à laquelle un antigène plus petit se lie, à une surface plus grande, à une saillie qui dépasse dans une rainure d’un antigène. Cependant, seuls quelques résidus contribuent généralement à la majeure partie de l’énergie de liaison. [2]
L’existence de deux sites de liaison d’anticorps identiques permet aux molécules d’anticorps de se lier fortement à l’antigène multivalent (sites répétitifs tels que les polysaccharides dans les parois cellulaires bactériennes ou d’autres sites à une certaine distance l’un de l’autre), ainsi que de former des complexes d’anticorps et de plus grands antigène-anticorps complexes . [2] La réticulation résultante joue un rôle dans l’activation d’autres parties du système immunitaire.
Les structures des CDR ont été regroupées et classées par Chothia et al. [14] et plus récemment par North et al. [15] et Nikoloudis et al. [16] Cependant, décrire le site de liaison d’un anticorps en utilisant une seule structure statique limite la compréhension et la caractérisation de la fonction et des propriétés de l’anticorps. Pour améliorer la prédiction de la structure des anticorps et prendre en compte les mouvements de boucle et d’interface CDR fortement corrélés, les paratopes d’anticorps doivent être décrits comme des états d’interconversion en solution avec des probabilités variables. [17]
Dans le cadre de la théorie des réseaux immunitaires , les CDR sont également appelées idiotypes. Selon la théorie des réseaux immunitaires, le système immunitaire adaptatif est régulé par des interactions entre idiotypes.
Région FC
La Région FC (le tronc de la forme en Y) est composée de domaines constants des chaînes lourdes. Son rôle est de moduler l’activité des cellules immunitaires : c’est là que les molécules effectrices se lient, déclenchant divers effets après que la région Fab de l’anticorps se lie à un antigène. [2] [11] Les cellules effectrices (telles que les macrophages ou les cellules tueuses naturelles ) se lient via leurs récepteurs Fc (FcR) à la Région FC d’un anticorps, tandis que le système du complément est activé en liant le complexe protéique C1q . IgG ou IgM peuvent se lier à C1q, mais pas IgA, donc IgA n’active pas la voie classique du complément . [18]
Un autre rôle de la Région FC est de distribuer sélectivement différentes classes d’anticorps à travers le corps. En particulier, le récepteur Fc néonatal (FcRn) se lie à la Région FC des anticorps IgG pour le transporter à travers le placenta, de la mère au fœtus.
Les anticorps sont des glycoprotéines , [19] c’est-à-dire qu’ils ont des glucides (Glycanes) ajoutés aux résidus d’acides aminés conservés . [19] [20] Ces sites de glycosylation conservés se produisent dans la Région FC et influencent les interactions avec les molécules effectrices. [19] [21]
Structure des protéines
L’ extrémité N-terminale de chaque chaîne est située à la pointe. Chaque domaine d’immunoglobuline a une structure similaire, caractéristique de tous les membres de la superfamille des immunoglobulines : il est composé d’entre 7 (pour les domaines constants) et 9 (pour les domaines variables) brins β , formant deux feuillets bêta dans un motif en clé grecque . Les feuilles créent une forme de “sandwich”, le Pli d’immunoglobuline , maintenus ensemble par une liaison disulfure.
Complexes d’anticorps

 Certains anticorps forment des complexes qui se lient à plusieurs molécules antigéniques.
Certains anticorps forment des complexes qui se lient à plusieurs molécules antigéniques.
Les anticorps sécrétés peuvent se présenter sous la forme d’une seule unité en forme de Y, un monomère . Cependant, certaines classes d’anticorps forment également des dimères avec deux unités d’Ig (comme avec l’IgA), des tétramères avec quatre unités d’Ig (comme les IgM de Poisson téléostéen ) ou des pentamères avec cinq unités d’Ig (comme les IgW de requin ou les IgM de mammifère, qui forment parfois aussi des hexamères ). , avec six unités). [22]
Les anticorps forment également des complexes en se liant à l’antigène : c’est ce qu’on appelle un Complexe antigène-anticorps ou complexe immun . Les petits antigènes peuvent réticuler deux anticorps, conduisant également à la formation de dimères, trimères, tétramères d’anticorps, etc. Les antigènes multivalents (par exemple, les cellules avec plusieurs épitopes) peuvent former des complexes plus grands avec les anticorps. Un exemple extrême est l’agglutination, ou agglutination , des globules rouges avec des anticorps dans le test de Coombs pour déterminer les groupes sanguins : les gros amas deviennent insolubles, conduisant à une précipitation visuellement apparente .
Récepteurs des cellules B
La forme liée à la membrane d’un anticorps peut être appelée immunoglobuline de surface (sIg) ou immunoglobuline membranaire (mIg). Il fait partie du récepteur des cellules B (BCR), qui permet à une cellule B de détecter la présence d’un antigène spécifique dans le corps et de déclencher l’activation des cellules B. [23] Le BCR est composé d’anticorps IgD ou IgM liés à la surface et d’ hétérodimères Ig-α et Ig-β associés , qui sont capables de transduction du signal . [24] Une cellule B humaine typique aura 50 000 à 100 000 anticorps liés à sa surface. [24]Lors de la liaison à l’antigène, ils se regroupent en grandes plaques, qui peuvent dépasser 1 micromètre de diamètre, sur des radeaux lipidiques qui isolent les BCR de la plupart des autres récepteurs de signalisation cellulaire. [24] Ces patchs peuvent améliorer l’efficacité de la réponse immunitaire cellulaire . [25] Chez l’homme, la surface cellulaire est nue autour des récepteurs des cellules B sur plusieurs centaines de nanomètres, [24] ce qui isole davantage les BCR des influences concurrentes.
Des classes
Les anticorps peuvent se présenter sous différentes variétés appelées isotypes ou classes . Chez les mammifères placentaires , il existe cinq classes d’anticorps appelées IgA, IgD, IgE, IgG et IgM, qui sont ensuite subdivisées en sous-classes telles que IgA1, IgA2. Le préfixe « Ig » signifie immunoglobuline , tandis que le suffixe indique le type de chaîne lourde que l’anticorps contient : les types de chaîne lourde α (alpha), γ (gamma), δ (delta), ε (epsilon), μ (mu) donnent respectivement IgA, IgG, IgD, IgE, IgM. Les caractéristiques distinctives de chaque classe sont déterminées par la partie de la chaîne lourde dans la charnière et la Région FC. [2]
Les classes diffèrent par leurs propriétés biologiques, leurs emplacements fonctionnels et leur capacité à traiter différents antigènes, comme illustré dans le tableau. [8] Par exemple, les anticorps IgE sont responsables d’une réponse allergique consistant en la libération d’ histamine par les mastocytes , souvent un seul contributeur à l’asthme (bien que d’autres voies existent, tout comme des symptômes très similaires à l’asthme mais pas techniquement). La région variable de l’anticorps se lie à l’antigène allergique, par exemple les particules d’ acariens , tandis que sa Région FC (dans les chaînes lourdes ε) se lie au récepteur Fc ε sur un mastocyte, déclenchant sa dégranulation: la libération des molécules stockées dans ses granules. [26]
| Classe | Sous-classes | La description |
|---|---|---|
| IgA | 2 | Trouvé dans les zones muqueuses , telles que l’ intestin , les voies respiratoires et les voies urogénitales , et empêche la colonisation par des agents pathogènes . [27] Également trouvé dans la salive, les larmes et le lait maternel. |
| IgD | 1 | Fonctionne principalement comme récepteur d’antigène sur les cellules B qui n’ont pas été exposées à des antigènes. [28] Il a été démontré qu’il active les basophiles et les mastocytes pour produire des facteurs antimicrobiens . [29] |
| IgE | 1 | Se lie aux allergènes et déclenche la libération d’ histamine par les mastocytes et les basophiles , et est impliqué dans les allergies . Les humains et d’autres animaux ont développé des IgE pour se protéger contre les vers parasites , bien qu’à l’heure actuelle, les IgE soient principalement liées aux allergies et à l’asthme. [5] |
| IgG | 4 | Sous ses quatre formes, fournit la majorité de l’immunité à base d’anticorps contre les agents pathogènes envahisseurs. [5] Le seul anticorps capable de traverser le placenta pour donner une immunité passive au fœtus . |
| IgM | 1 | Exprimé à la surface des cellules B (monomère) et sous une forme sécrétée (pentamère) avec une très grande avidité . Élimine les agents pathogènes dans les premiers stades de l’immunité médiée par les cellules B (humorale) avant qu’il y ait suffisamment d’IgG. [5] [28] |
L’isotype d’anticorps d’une cellule B change au cours du développement et de l’activation des cellules. Les cellules B immatures, qui n’ont jamais été exposées à un antigène, expriment uniquement l’isotype IgM sous une forme liée à la surface cellulaire. Le lymphocyte B, sous cette forme prête à répondre, est connu sous le nom de « lymphocyte B naïf ». Le lymphocyte B naïf exprime à la fois les IgM et IgD de surface. La co-expression de ces deux isotypes d’immunoglobuline rend la cellule B prête à répondre à l’antigène. [30] L’activation des cellules B suit l’engagement de la molécule d’anticorps liée à la cellule avec un antigène, provoquant la division et la différenciation de la cellule en une cellule productrice d’anticorps appelée plasmocyte . Dans cette forme activée, la cellule B commence à produire des anticorps dans unforme sécrétée plutôt qu’une forme liée à la membrane . Certaines cellules filles des cellules B activées subissent une commutation d’isotype , un mécanisme qui fait passer la production d’anticorps de l’IgM ou de l’IgD aux autres isotypes d’anticorps, IgE, IgA ou IgG, qui ont des rôles définis dans le système immunitaire.
Types de chaînes légères
Chez les mammifères, il existe deux types de chaîne légère d’immunoglobuline , appelées lambda (λ) et kappa (κ). Cependant, il n’y a pas de différence fonctionnelle connue entre eux, et les deux peuvent se produire avec l’un des cinq principaux types de chaînes lourdes. [2] Chaque anticorps contient deux chaînes légères identiques : les deux κ ou les deux λ. Les proportions de types κ et λ varient selon les espèces et peuvent être utilisées pour détecter une prolifération anormale de clones de cellules B. D’autres types de chaînes légères, telles que la chaîne iota (ι), se trouvent chez d’autres vertébrés comme les requins ( Chondrichthyes ) et les poissons osseux ( Teleostei ).
Chez les animaux non mammifères
Chez la plupart des mammifères placentaires , la structure des anticorps est généralement la même. Les poissons à mâchoires semblent être les animaux les plus primitifs capables de fabriquer des anticorps similaires à ceux des mammifères, bien que de nombreuses caractéristiques de leur immunité adaptative soient apparues un peu plus tôt. [31]
Les poissons cartilagineux (tels que les requins) produisent des anticorps à chaîne lourde uniquement (c’est-à-dire dépourvus de chaînes légères) qui comportent en outre des pentamères à chaîne plus longue (avec cinq unités constantes par molécule). Les camélidés (tels que les chameaux, les lamas, les alpagas) sont également remarquables pour produire des anticorps à chaîne lourde uniquement. [2] [32]
| Classe | Les types | La description |
|---|---|---|
| IgY | Trouvé chez les oiseaux et les reptiles ; liés aux IgG de mammifères. [33] | |
| IgW | Trouvé dans les requins et les raies ; lié à l’IgD de mammifère. [34] | |
| IgT/Z | Trouvé dans les poissons téléostéens [35] |
Interactions anticorps-antigène
Le paratope de l’anticorps interagit avec l’épitope de l’antigène. Un antigène contient généralement différents épitopes le long de sa surface disposés de manière discontinue, et les épitopes dominants sur un antigène donné sont appelés déterminants.
Anticorps et antigène interagissent par complémentarité spatiale (serrure et clé). Les forces moléculaires impliquées dans l’interaction Fab-épitope sont faibles et non spécifiques – par exemple les forces électrostatiques , les liaisons hydrogène , les interactions hydrophobes et les forces de van der Waals . Cela signifie que la liaison entre l’anticorps et l’antigène est réversible et que l’ affinité de l’anticorps envers un antigène est relative plutôt qu’absolue. Une liaison relativement faible signifie également qu’il est possible qu’un anticorps réagisse de manière croisée avec différents antigènes d’affinités relatives différentes.
Une fonction
Les principales catégories d’action des anticorps comprennent les suivantes :


- Les anticorps (A) et les agents pathogènes (B) circulent librement dans le sang.
- Les anticorps se lient aux agents pathogènes, et peuvent le faire dans différentes formations telles que :
- opsonisation,
- neutralisation, et
- agglutination.
- Un phagocyte (C) s’approche de l’agent pathogène et la Région FC (D) de l’anticorps se lie à l’un des récepteurs Fc (E) du phagocyte.
- La phagocytose se produit lorsque l’agent pathogène est ingéré.
- Neutralisation , dans laquelle des anticorps neutralisants bloquent des parties de la surface d’une cellule bactérienne ou d’un virion pour rendre son attaque inefficace
- Agglutination , dans laquelle les anticorps “collent ensemble” des cellules étrangères en amas qui sont des cibles attrayantes pour la phagocytose
- Précipitation , dans laquelle les anticorps “collent ensemble” les antigènes solubles dans le sérum , les forçant à précipiter hors de la solution en amas qui sont des cibles attrayantes pour la phagocytose
- L’activation du complément (fixation), dans laquelle les anticorps qui sont verrouillés sur une cellule étrangère encouragent le complément à l’attaquer avec un complexe d’ attaque membranaire , ce qui conduit à ce qui suit :
- Lyse de la cellule étrangère
- Encouragement de l’inflammation en attirant par chimiotactique les cellules inflammatoires
Plus indirectement, un anticorps peut signaler aux cellules immunitaires de présenter des fragments d’anticorps aux lymphocytes T ou de réguler à la baisse d’autres cellules immunitaires pour éviter l’ auto -immunité .
Les cellules B activées se différencient en cellules productrices d’anticorps appelées plasmocytes qui sécrètent des anticorps solubles ou en cellules mémoire qui survivent dans le corps pendant des années afin de permettre au système immunitaire de se souvenir d’un antigène et de réagir plus rapidement lors d’expositions futures. [4]
Aux stades prénatal et néonatal de la vie, la présence d’anticorps est assurée par l’immunisation passive de la mère. La production précoce d’anticorps endogènes varie selon les différents types d’anticorps et apparaît généralement au cours des premières années de la vie. Comme les anticorps existent librement dans le sang, on dit qu’ils font partie du système immunitaire humoral . Les anticorps circulants sont produits par des cellules B clonales qui répondent spécifiquement à un seul antigène (un exemple est un fragment de protéine de capside virale ). Les anticorps contribuent à l’immunité de trois manières : ils empêchent les agents pathogènes d’entrer ou d’endommager les cellules en se liant à elles ; ils stimulent l’élimination des agents pathogènes enles macrophages et autres cellules en enrobant l’agent pathogène ; et ils déclenchent la destruction des agents pathogènes en stimulant d’autres réponses immunitaires telles que la voie du complément . [36] Les anticorps déclencheront également une dégranulation vasoactive des amines pour contribuer à l’immunité contre certains types d’antigènes (helminthes, allergènes).

 L’ IgM de mammifère sécrétée a cinq unités d’Ig. Chaque unité Ig (marquée 1) possède deux régions Fab de liaison à l’épitope , de sorte que l’IgM est capable de se lier jusqu’à 10 épitopes.
L’ IgM de mammifère sécrétée a cinq unités d’Ig. Chaque unité Ig (marquée 1) possède deux régions Fab de liaison à l’épitope , de sorte que l’IgM est capable de se lier jusqu’à 10 épitopes.
Activation du complément
Les anticorps qui se lient aux antigènes de surface (par exemple, sur les bactéries) attireront le premier composant de la cascade du complément avec leur Région FC et initieront l’activation du système “classique” du complément. [36] Cela entraîne la destruction des bactéries de deux manières. [5] Premièrement, la liaison des molécules d’anticorps et de complément marque le Microbe pour l’ingestion par les phagocytes dans un processus appelé opsonisation ; ces phagocytes sont attirés par certaines molécules du complément générées dans la cascade du complément. Deuxièmement, certains composants du système du complément forment un complexe d’ attaque membranaire pour aider les anticorps à tuer directement la bactérie (bactériolyse).[37]
Activation des cellules effectrices
Pour lutter contre les agents pathogènes qui se répliquent à l’extérieur des cellules, les anticorps se lient aux agents pathogènes pour les lier entre eux, les faisant s’agglutiner . Puisqu’un anticorps a au moins deux paratopes, il peut se lier à plus d’un antigène en se liant à des épitopes identiques portés à la surface de ces antigènes. En enrobant l’agent pathogène, les anticorps stimulent les fonctions effectrices contre l’agent pathogène dans les cellules qui reconnaissent leur Région FC. [5]
Les cellules qui reconnaissent les agents pathogènes revêtus possèdent des récepteurs Fc qui, comme leur nom l’indique, interagissent avec la Région FC des anticorps IgA, IgG et IgE. L’engagement d’un anticorps particulier avec le récepteur Fc sur une cellule particulière déclenche une fonction effectrice de cette cellule ; les phagocytes vont phagocyter , les mastocytes et les neutrophiles vont dégranuler , les cellules tueuses naturelles vont libérer des cytokines et des molécules cytotoxiques ; qui entraînera finalement la destruction du Microbe envahisseur. L’activation des cellules tueuses naturelles par des anticorps initie un mécanisme cytotoxique connu sous le nom decytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) – ce processus peut expliquer l’efficacité des anticorps monoclonaux utilisés dans les thérapies biologiques contre le cancer . Les récepteurs Fc sont spécifiques d’un isotype, ce qui donne une plus grande flexibilité au système immunitaire, n’invoquant que les mécanismes immunitaires appropriés pour des agents pathogènes distincts. [2]
Anticorps naturels
Les humains et les primates supérieurs produisent également des “anticorps naturels” qui sont présents dans le sérum avant l’infection virale. Les anticorps naturels ont été définis comme des anticorps qui sont produits sans aucune infection antérieure, vaccination , autre exposition à un antigène étranger ou immunisation passive . Ces anticorps peuvent activer la voie classique du complément conduisant à la lyse des particules virales enveloppées bien avant que la réponse immunitaire adaptative ne soit activée. De nombreux anticorps naturels sont dirigés contre le disaccharide galactose α(1,3)-galactose (α-Gal), qui se trouve en tant que sucre terminal sur les protéines de surface cellulaire glycosylées , et généré en réponse à la production de ce sucre par des bactéries contenues dans le intestin humain. [38]On pense que le rejet d’ organes xénotransplantés est, en partie, le résultat d’anticorps naturels circulant dans le sérum du receveur se liant aux antigènes α-Gal exprimés sur le tissu du donneur. [39]
Diversité des immunoglobulines
Pratiquement tous les microbes peuvent déclencher une réponse anticorps. La reconnaissance et l’éradication réussies de nombreux types différents de microbes nécessitent une diversité parmi les anticorps; leur composition en acides aminés varie, ce qui leur permet d’interagir avec de nombreux antigènes différents. [40] On a estimé que les humains génèrent environ 10 milliards d’anticorps différents, chacun capable de se lier à un épitope distinct d’un antigène. [41] Bien qu’un vaste répertoire d’anticorps différents soit généré chez un seul individu, le nombre de gènes disponibles pour fabriquer ces protéines est limité par la taille du génome humain. Plusieurs mécanismes génétiques complexes ont évolué qui permettent aux cellules B des vertébrés de générer un pool diversifié d’anticorps à partir d’un nombre relativement restreint de gènes d’anticorps.[42]
Variabilité de domaine


La région chromosomique qui code pour un anticorps est grande et contient plusieurs locus de gènes distincts pour chaque domaine de l’anticorps – la région chromosomique contenant les gènes des chaînes lourdes ( IGH@ ) se trouve sur le chromosome 14 , et les loci contenant les gènes des chaînes légères lambda et kappa ( IGL@ et IGK@ ) se trouvent sur les chromosomes 22 et 2 chez l’homme. L’un de ces domaines est appelé le domaine variable, qui est présent dans chaque chaîne lourde et légère de chaque anticorps, mais peut différer dans différents anticorps générés à partir de cellules B distinctes. Les différences, entre les domaines variables, sont localisées sur trois boucles appelées régions hypervariables (HV-1, HV-2 et HV-3) ourégions déterminant la complémentarité (CDR1, CDR2 et CDR3). Les CDR sont pris en charge dans les domaines variables par des régions de charpente conservées. Le locus de la chaîne lourde contient environ 65 gènes à domaine variable différents qui diffèrent tous par leurs CDR. La combinaison de ces gènes avec un ensemble de gènes pour d’autres domaines de l’anticorps génère une grande cavalerie d’anticorps avec un degré élevé de variabilité. Cette combinaison est appelée recombinaison V(D)J décrite ci-dessous. [43]
Recombinaison V(D)J

 Présentation simplifiée de la recombinaison V(D)J des chaînes lourdes d’immunoglobuline
Présentation simplifiée de la recombinaison V(D)J des chaînes lourdes d’immunoglobuline
La recombinaison somatique des immunoglobulines, également connue sous le nom de recombinaison V(D)J , implique la génération d’une région variable unique d’immunoglobuline. La région variable de chaque chaîne lourde ou légère d’immunoglobuline est codée en plusieurs morceaux, appelés segments de gènes (sous-gènes). Ces segments sont appelés segments variables (V), de diversité (D) et de jonction (J). [42] Les segments V, D et J se trouvent dans les chaînes lourdes d’Ig , mais seuls les segments V et J se trouvent dans les chaînes légères d’Ig . Plusieurs copies des segments de gènes V, D et J existent et sont disposées en tandem dans les génomes des mammifères. Dans la moelle osseuse, chaque cellule B en développement assemblera une région variable d’immunoglobuline en sélectionnant et en combinant au hasard un segment de gène V, un segment D et un segment J (ou un segment V et un segment J dans la chaîne légère). Comme il existe plusieurs copies de chaque type de segment de gène et que différentes combinaisons de segments de gène peuvent être utilisées pour générer chaque région variable d’immunoglobuline, ce processus génère un grand nombre d’anticorps, chacun avec des paratopes différents et donc des spécificités antigéniques différentes. [44] Le réarrangement de plusieurs sous-gènes (c’est-à-dire la famille V2) pour l’immunoglobuline à chaîne légère lambda est couplé à l’activation du microARN miR-650, qui influence davantage la biologie des cellules B.
Les protéines RAG jouent un rôle important avec la recombinaison V(D)J en coupant l’ADN dans une région particulière. [44] Sans la présence de ces protéines, la recombinaison V(D)J ne se produirait pas. [44]
Après qu’une cellule B a produit un gène d’immunoglobuline fonctionnel lors de la recombinaison V(D)J, elle ne peut exprimer aucune autre région variable (un processus connu sous le nom d’ exclusion allélique ), ainsi chaque cellule B peut produire des anticorps contenant un seul type de chaîne variable. [2] [45]
Hypermutation somatique et maturation d’affinité
Après activation avec l’antigène, les cellules B commencent à proliférer rapidement. Dans ces cellules à division rapide, les gènes codant pour les domaines variables des chaînes lourdes et légères subissent un taux élevé de mutations ponctuelles , par un processus appelé hypermutation somatique (SHM). SHM entraîne environ un changement de nucléotide par gène variable, par division cellulaire. [46] En conséquence, toutes les cellules B filles acquerront de légères différences d’acides aminés dans les domaines variables de leurs chaînes d’anticorps.
Cela sert à augmenter la diversité du pool d’anticorps et a un impact sur l’ affinité de liaison à l’antigène de l’anticorps . [47] Certaines mutations ponctuelles entraîneront la production d’anticorps qui ont une interaction plus faible (faible affinité) avec leur antigène que l’anticorps d’origine, et certaines mutations généreront des anticorps avec une interaction plus forte (haute affinité). [48] Les cellules B qui expriment des anticorps de haute affinité à leur surface recevront un signal de survie fort lors des interactions avec d’autres cellules, alors que celles qui ont des anticorps de faible affinité ne le feront pas et mourront par apoptose . [48]Ainsi, les cellules B exprimant des anticorps avec une affinité plus élevée pour l’antigène surpasseront celles ayant des affinités plus faibles pour la fonction et la survie, permettant à l’affinité moyenne des anticorps d’augmenter avec le temps. Le processus de génération d’anticorps avec des affinités de liaison accrues est appelé maturation d’affinité . La maturation d’affinité se produit dans les cellules B matures après la recombinaison V(D)J et dépend de l’aide des cellules T auxiliaires . [49]

 Mécanisme de recombinaison de commutation de classe qui permet la commutation d’isotype dans les cellules B activées
Mécanisme de recombinaison de commutation de classe qui permet la commutation d’isotype dans les cellules B activées
Changement de classe
La commutation d’isotype ou de classe est un processus biologique se produisant après l’activation de la cellule B, qui permet à la cellule de produire différentes classes d’anticorps (IgA, IgE ou IgG). [44]Les différentes classes d’anticorps, et donc les fonctions effectrices, sont définies par les régions constantes (C) de la chaîne lourde de l’immunoglobuline. Initialement, les cellules B naïves expriment uniquement des IgM et IgD de surface cellulaire avec des régions de liaison à l’antigène identiques. Chaque isotype est adapté pour une fonction distincte ; par conséquent, après activation, un anticorps avec une fonction effectrice IgG, IgA ou IgE peut être nécessaire pour éliminer efficacement un antigène. La commutation de classe permet à différentes cellules filles de la même cellule B activée de produire des anticorps d’isotypes différents. Seule la région constante de la chaîne lourde de l’anticorps change pendant le changement de classe ; les régions variables, et donc la spécificité antigénique, restent inchangées. Ainsi la descendance d’une seule cellule B peut produire des anticorps, tous spécifiques d’un même antigène, mais avec la capacité de produire la fonction effectrice appropriée pour chaque provocation antigénique. La commutation de classe est déclenchée par des cytokines ; l’isotype généré dépend des cytokines présentes dans l’environnement des cellules B.[50]
La commutation de classe se produit dans le locus du gène de la chaîne lourde par un mécanisme appelé recombinaison par commutation de classe (CSR). Ce mécanisme repose sur des motifs nucléotidiques conservés , appelés régions de commutation (S) , trouvés dans l’ADN en amont de chaque gène de région constante (sauf dans la chaîne δ). Le brin d’ADN est rompu par l’activité d’une série d’ enzymes au niveau de deux régions S sélectionnées. [51] [52] L’ exon du domaine variable est rejoint par un processus appelé jonction d’extrémité non homologue (NHEJ) à la région constante souhaitée (γ, α ou ε). Ce processus aboutit à un gène d’immunoglobuline qui code pour un anticorps d’un isotype différent. [53]
Désignations de spécificité
Un anticorps peut être appelé monospécifique s’il a une spécificité pour le même antigène ou épitope, [54] ou bispécifique s’il a une affinité pour deux antigènes différents ou deux épitopes différents sur le même antigène. [55] Un groupe d’anticorps peut être appelé polyvalent (ou non spécifique ) s’il a une affinité pour divers antigènes [56] ou micro-organismes. [56] L’immunoglobuline intraveineuse , sauf indication contraire, consiste en une variété d’IgG différentes (IgG polyclonales). En revanche, les anticorps monoclonaux sont des anticorps identiques produits par une seule cellule B.
Anticorps asymétriques
Les anticorps hétérodimères, qui sont également des anticorps asymétriques, permettent une plus grande flexibilité et de nouveaux formats pour attacher une variété de médicaments aux bras d’anticorps. L’un des formats généraux pour un anticorps hétérodimérique est le format “boutons dans les trous”. Ce format est spécifique à la partie chaîne lourde de la région constante des anticorps. La partie “boutons” est conçue en remplaçant un petit acide aminé par un plus grand. Il s’insère dans le “trou”, qui est conçu en remplaçant un gros acide aminé par un plus petit. Ce qui relie les “boutons” aux “trous”, ce sont les liaisons disulfure entre chaque chaîne. La forme “boutons dans les trous” facilite la cytotoxicité à médiation cellulaire dépendante des anticorps. Fragments variables à chaîne unique ( scFv) sont connectés au domaine variable de la chaîne lourde et légère via un court peptide de liaison. Le linker est riche en glycine, ce qui lui donne plus de souplesse, et en sérine/thréonine, ce qui lui donne une spécificité. Deux fragments scFv différents peuvent être connectés ensemble, via une région charnière, au domaine constant de la chaîne lourde ou au domaine constant de la chaîne légère. [57] Cela donne la bispécificité de l’anticorps, permettant les spécificités de liaison de deux antigènes différents. [58] Le format “boutons dans les trous” améliore la formation d’hétérodimères mais ne supprime pas la formation d’homodimères.
Pour améliorer encore la fonction des anticorps hétérodimériques, de nombreux scientifiques se tournent vers des constructions artificielles. Les anticorps artificiels sont des motifs protéiques largement divers qui utilisent la stratégie fonctionnelle de la molécule d’anticorps, mais ne sont pas limités par les contraintes structurelles de boucle et de cadre de l’anticorps naturel. [59] Pouvoir contrôler la conception combinatoire de la séquence et de l’espace tridimensionnel pourrait transcender la conception naturelle et permettre l’attachement de différentes combinaisons de médicaments aux bras.
Les anticorps hétérodimères ont une plus grande gamme de formes qu’ils peuvent prendre et les médicaments qui sont attachés aux bras ne doivent pas nécessairement être les mêmes sur chaque bras, ce qui permet d’utiliser différentes combinaisons de médicaments dans le traitement du cancer. Les produits pharmaceutiques sont capables de produire des anticorps bispécifiques et même multispécifiques hautement fonctionnels. La mesure dans laquelle ils peuvent fonctionner est impressionnante étant donné qu’un tel changement de forme par rapport à la forme naturelle devrait entraîner une diminution de la fonctionnalité.
Histoire
La première utilisation du terme “anticorps” s’est produite dans un texte de Paul Ehrlich . Le terme Antikörper (le mot allemand pour anticorps ) apparaît dans la conclusion de son article « Experimental Studies on Immunity », publié en octobre 1891, qui stipule que, « si deux substances donnent naissance à deux Antikörper différents , alors ils doivent être eux-mêmes différents ». “. [60] Cependant, le terme n’a pas été accepté immédiatement et plusieurs autres termes pour l’anticorps ont été proposés ; ceux-ci comprenaient Immunkörper , Amboceptor , Zwischenkörper , substance sensibilisatrice , copula , Desmon ,philocytase , fixateur et immunosine . [60] Le mot anticorps a une analogie formelle avec le mot antitoxine et un concept similaire à Immunkörper ( corps immunitaire en anglais). [60] En tant que tel, la construction originale du mot contient un défaut logique; l’antitoxine est quelque chose dirigé contre une toxine, tandis que l’anticorps est un corps dirigé contre quelque chose. [60]

 Angel of the West (2008) de Julian Voss-Andreae est une sculpture basée sur la structure des anticorps publiée par E. Padlan. [61] Créé pour le campus de Floride du Scripps Research Institute , [62] l’anticorps est placé dans un anneau faisant référence à l’ homme de Vitruve de Léonard de Vinci, soulignant ainsi la similitude de l’anticorps et du corps humain. [63]
Angel of the West (2008) de Julian Voss-Andreae est une sculpture basée sur la structure des anticorps publiée par E. Padlan. [61] Créé pour le campus de Floride du Scripps Research Institute , [62] l’anticorps est placé dans un anneau faisant référence à l’ homme de Vitruve de Léonard de Vinci, soulignant ainsi la similitude de l’anticorps et du corps humain. [63]
L’étude des anticorps a commencé en 1890 lorsque Emil von Behring et Kitasato Shibasaburō ont décrit l’activité des anticorps contre les toxines diphtérique et tétanique . Von Behring et Kitasato ont avancé la théorie de l’immunité humorale , proposant qu’un médiateur dans le sérum puisse réagir avec un antigène étranger. [64] [65] Son idée a incité Paul Ehrlich à proposer la théorie des chaînes latérales pour l’interaction des anticorps et des antigènes en 1897, lorsqu’il a émis l’hypothèse que les récepteurs (décrits comme des “chaînes latérales”) à la surface des cellules pourraient se lier spécifiquement aux toxines . – dans une interaction « serrure et clé » – et que cette réaction de liaison est le déclencheur de la production d’anticorps. [66] D’autres chercheurs croyaient que les anticorps existaient librement dans le sang et, en 1904, Almroth Wright a suggéré que les anticorps solubles recouvraient les bactéries pour les étiqueter pour la phagocytose et la mise à mort; un processus qu’il nomma opsoninisation . [67]

 Michel Heidelberg
Michel Heidelberg
Dans les années 1920, Michael Heidelberger et Oswald Avery ont observé que les antigènes pouvaient être précipités par des anticorps et ont ensuite montré que les anticorps sont constitués de protéines. [68] Les propriétés biochimiques des interactions antigène-anticorps-liaison ont été examinées plus en détail à la fin des années 1930 par John Marrack . [69] La prochaine avancée majeure a eu lieu dans les années 1940, lorsque Linus Pauling a confirmé la théorie du verrou et de la clé proposée par Ehrlich en montrant que les interactions entre les anticorps et les antigènes dépendent davantage de leur forme que de leur composition chimique. [70] En 1948, Astrid Fagraeus a découvert que les cellules B, sous forme de plasmocytes , étaient responsables de la génération d’anticorps. [71]
D’autres travaux se sont concentrés sur la caractérisation des structures des protéines d’anticorps. Une avancée majeure dans ces études structurales a été la découverte au début des années 1960 par Gerald Edelman et Joseph Gally de la chaîne légère d’ anticorps [72] et leur prise de conscience que cette protéine est la même que la protéine Bence-Jones décrite en 1845 par Henry Bence Jones . [73] Edelman a ensuite découvert que les anticorps sont composés de chaînes lourdes et légères liées par des liaisons disulfure . À peu près au même moment, les régions de liaison aux anticorps (Fab) et de queue d’anticorps (Fc) des IgG ont été caractérisées par Rodney Porter . [74]Ensemble, ces scientifiques ont déduit la structure et la séquence complète d’acides aminés des IgG, un exploit pour lequel ils ont reçu conjointement le prix Nobel de physiologie ou médecine en 1972 . [74] Le fragment Fv a été préparé et caractérisé par David Givol. [75] Alors que la plupart de ces premières études se concentraient sur les IgM et IgG, d’autres isotypes d’immunoglobuline ont été identifiés dans les années 1960 : Thomas Tomasi a découvert l’anticorps sécrétoire ( IgA ); [76] David S. Rowe et John L. Fahey ont découvert l’IgD ; [77] et Kimishige Ishizaka et Teruko Ishizaka ont découvert l’ IgEet a montré qu’il s’agissait d’une classe d’anticorps impliqués dans les réactions allergiques . [78] Dans une série historique d’expériences commençant en 1976, Susumu Tonegawa a montré que le matériel génétique peut se réorganiser pour former la vaste gamme d’anticorps disponibles. [79]
Applications médicales
Diagnostic de la maladie
La détection d’anticorps particuliers est une forme très courante de diagnostic médical et des applications telles que la sérologie dépendent de ces méthodes. [80] Par exemple, dans les tests biochimiques pour le diagnostic de la maladie, [81] un titre d’anticorps dirigés contre le virus d’Epstein-Barr ou la maladie de Lyme est estimé à partir du sang. Si ces anticorps ne sont pas présents, soit la personne n’est pas infectée, soit l’infection s’est produite il y a très longtemps, et les cellules B générant ces anticorps spécifiques se sont naturellement décomposées.
En immunologie clinique , les niveaux de classes individuelles d’immunoglobulines sont mesurés par néphélométrie (ou turbidimétrie ) pour caractériser le profil d’anticorps du patient. [82] Les élévations dans différentes classes d’immunoglobulines sont parfois utiles pour déterminer la cause des lésions hépatiques chez les patients pour lesquels le diagnostic n’est pas clair. [1] Par exemple, une IgA élevée indique une cirrhose alcoolique , une IgM élevée indique une hépatite virale et une cirrhose biliaire primitive , tandis qu’une IgG est élevée dans une hépatite virale, une hépatite auto -immune et une cirrhose.
Les maladies auto-immunes peuvent souvent être attribuées à des anticorps qui se lient aux propres épitopes du corps ; beaucoup peuvent être détectés par des tests sanguins . Les anticorps dirigés contre les antigènes de surface des globules rouges dans l’anémie hémolytique à médiation immunitaire sont détectés par le test de Coombs . [83] Le test de Coombs est également utilisé pour le dépistage des anticorps dans la préparation de la transfusion sanguine et également pour le dépistage des anticorps chez les femmes enceintes . [83]
Pratiquement, plusieurs méthodes d’immunodiagnostic basées sur la détection du Complexe antigène-anticorps sont utilisées pour diagnostiquer les maladies infectieuses, par exemple ELISA , immunofluorescence , Western blot , immunodiffusion , immunoélectrophorèse et immunoessai magnétique . Les anticorps dirigés contre la gonadotrophine chorionique humaine sont utilisés dans les tests de grossesse en vente libre.
La nouvelle chimie du dioxaborolane permet le marquage au fluorure radioactif ( 18 F ) des anticorps, ce qui permet l’imagerie par tomographie par émission de positrons (TEP) du cancer . [84]
Thérapie de la maladie
La thérapie ciblée par anticorps monoclonaux est utilisée pour traiter des maladies telles que la polyarthrite rhumatoïde , [85] la sclérose en plaques , [86] le psoriasis , [87] et de nombreuses formes de cancer, notamment le lymphome non hodgkinien , [88] le cancer colorectal , le cancer de la tête et du cou et cancer du sein . [89]
Certaines déficiences immunitaires, telles que l’agammaglobulinémie liée à l’X et l’ hypogammaglobulinémie , entraînent une absence partielle ou totale d’anticorps. [90] Ces maladies sont souvent traitées en induisant une forme d’ immunité à court terme appelée immunité passive . L’immunité passive est obtenue par le transfert d’anticorps prêts à l’emploi sous forme de sérum humain ou animal , d’immunoglobuline groupée ou d’anticorps monoclonaux , chez l’individu affecté. [91]
Thérapie prénatale
Le facteur Rh , également connu sous le nom d’antigène Rh D, est un antigène présent sur les globules rouges ; les individus Rh-positifs (Rh+) ont cet antigène sur leurs globules rouges et les individus Rh-négatifs (Rh-) n’en ont pas. Lors d’un accouchement normal , d’un traumatisme de l’accouchement ou de complications pendant la grossesse, le sang d’un fœtus peut pénétrer dans le système de la mère. Dans le cas d’une mère et d’un enfant Rh-incompatibles, le mélange sanguin consécutif peut sensibiliser une mère Rh- à l’antigène Rh présent sur les cellules sanguines de l’enfant Rh+, mettant le reste de la grossesse et toute grossesse ultérieure à risque d’ hémolyse . maladie du nouveau-né . [92]
Les anticorps anti- immunoglobuline Rho(D) sont spécifiques de l’antigène RhD humain. [93] Les anticorps anti-RhD sont administrés dans le cadre d’un régime de traitement prénatal pour prévenir la sensibilisation qui peut survenir lorsqu’une mère Rh négatif a un fœtus Rh positif. Le traitement d’une mère avec des anticorps anti-RhD avant et immédiatement après le traumatisme et l’accouchement détruit l’antigène Rh dans le système de la mère du fœtus. Il est important de noter que cela se produit avant que l’antigène ne puisse stimuler les cellules B maternelles à “se souvenir” de l’antigène Rh en générant des cellules B mémoire. Par conséquent, son système immunitaire humoral ne fabriquera pas d’anticorps anti-Rh et n’attaquera pas les antigènes Rh des bébés actuels ou suivants. Le traitement par Rho(D) Immune Globuline prévient la sensibilisation qui peutMaladie Rh , mais ne prévient ni ne traite la maladie sous-jacente elle-même. [93]
Demandes de recherche
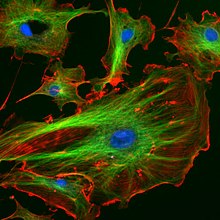
 Image en immunofluorescence du cytosquelette eucaryote . Les microtubules , comme indiqué en vert, sont marqués par un anticorps conjugué à une molécule fluorescente verte, FITC .
Image en immunofluorescence du cytosquelette eucaryote . Les microtubules , comme indiqué en vert, sont marqués par un anticorps conjugué à une molécule fluorescente verte, FITC .
Des anticorps spécifiques sont produits en injectant un antigène à un mammifère , tel qu’une souris , un rat , un lapin , une chèvre , un mouton ou un cheval pour de grandes quantités d’anticorps. Le sang isolé de ces animaux contient des anticorps polyclonaux – plusieurs anticorps qui se lient au même antigène – dans le sérum , qui peut maintenant être appelé antisérum . Des antigènes sont également injectés à des poulets pour générer des anticorps polyclonaux dans le jaune d’œuf . [94]Pour obtenir un anticorps spécifique d’un épitope unique d’un antigène, des lymphocytes sécréteurs d’anticorps sont isolés de l’animal et immortalisés en les fusionnant avec une lignée cellulaire cancéreuse. Les cellules fusionnées sont appelées hybridomes et continueront de croître et de sécréter des anticorps en culture. Des cellules d’hybridome uniques sont isolées par clonage par dilution pour générer des clones cellulaires qui produisent tous le même anticorps ; ces anticorps sont appelés anticorps monoclonaux . [95] Les anticorps polyclonaux et monoclonaux sont souvent purifiés à l’aide de la protéine A/G ou de la chromatographie d’affinité antigénique . [96]
En recherche, les anticorps purifiés sont utilisés dans de nombreuses applications. Les anticorps pour les applications de recherche peuvent être trouvés directement auprès des fournisseurs d’anticorps ou en utilisant un moteur de recherche spécialisé. Les anticorps de recherche sont le plus souvent utilisés pour identifier et localiser les protéines intracellulaires et extracellulaires . Les anticorps sont utilisés en cytométrie en flux pour différencier les types de cellules par les protéines qu’ils expriment ; différents types de cellules expriment différentes combinaisons d’ amas de molécules de différenciation à leur surface et produisent différentes protéines intracellulaires et sécrétables. [97] Ils sont également utilisés en immunoprécipitationpour séparer les protéines et tout ce qui leur est lié (co-immunoprécipitation) des autres molécules dans un lysat cellulaire , [98] dans les analyses Western blot pour identifier les protéines séparées par électrophorèse , [99] et en immunohistochimie ou immunofluorescence pour examiner l’expression des protéines dans des coupes de tissus ou pour localiser des protéines dans les cellules à l’aide d’un microscope . [97] [100] Les protéines peuvent également être détectées et quantifiées avec des anticorps, en utilisant les techniques ELISA et ELISpot . [101] [102]
Les anticorps utilisés dans la recherche sont parmi les réactifs les plus puissants, mais les plus problématiques, avec un nombre considérable de facteurs qui doivent être contrôlés dans toute expérience, y compris la réactivité croisée, ou l’anticorps reconnaissant plusieurs épitopes et affinités, qui peuvent varier considérablement en fonction des conditions expérimentales telles que comme le pH, le solvant, l’état des tissus, etc. De multiples tentatives ont été faites pour améliorer à la fois la manière dont les chercheurs valident les anticorps [103] [104] et la manière dont ils rendent compte des anticorps. Les chercheurs utilisant des anticorps dans leur travail doivent les enregistrer correctement afin de permettre à leur recherche d’être reproductible (et donc testée, et qualifiée par d’autres chercheurs). Moins de la moitié des anticorps de recherche référencés dans des articles universitaires peuvent être facilement identifiés. [105]Les articles publiés dans F1000 en 2014 et 2015 fournissent aux chercheurs un guide pour signaler l’utilisation d’anticorps de recherche. [106] [107] L’article RRID est copublié dans 4 revues qui ont mis en œuvre la norme RRIDs pour la citation des ressources de recherche, qui tire des données de l’anticorpsregistry.org comme source d’identificateurs d’anticorps [108] (voir également le groupe sur Force11 [109] ).
Règlements
Fabrication et test
Traditionnellement, la plupart des anticorps sont produits par des lignées cellulaires d’hybridomes par immortalisation de cellules productrices d’anticorps par fusion induite chimiquement avec des cellules de myélome . Dans certains cas, des fusions supplémentaires avec d’autres lignées ont créé des ” triomes ” et des ” quadromes “. Le procédé de fabrication doit être correctement décrit et validé. Les études de validation doivent au moins inclure :
- La démonstration que le procédé est capable de produire en bonne qualité (le procédé doit être validé)
- L’ efficacité de la purification des anticorps (toutes impuretés et virus doivent être éliminés)
- La caractérisation des anticorps purifiés ( caractérisation physico -chimique, propriétés immunologiques , activités biologiques , contaminants, …)
- Détermination des études de clairance du virus
Avant les essais cliniques
- Tests de sécurité des produits : Stérilité ( bactéries et champignons ), tests in vitro et in vivo de virus adventices, tests de rétrovirus murins …, données de sécurité des produits nécessaires avant le lancement d’essais de faisabilité dans des conditions graves ou mettant immédiatement en jeu le pronostic vital, il sert à évaluer le potentiel dangereux du produit.
- Essais de faisabilité : Il s’agit d’études pilotes dont les objectifs comprennent, entre autres, la caractérisation précoce de l’innocuité et la preuve de concept initiale dans une petite population spécifique de patients (essais in vitro ou in vivo).
Études précliniques
- Tester la réactivité croisée des anticorps : pour mettre en évidence les interactions indésirables (toxicité) des anticorps avec des tissus préalablement caractérisés. Cette étude peut être réalisée in vitro (la réactivité de l’anticorps ou de l’immunoconjugué doit être déterminée avec des tissus adultes surgelés) ou in vivo (avec des modèles animaux appropriés).
- Essais précliniques de pharmacologie et de toxicité : les essais précliniques d’innocuité des anticorps sont conçus pour identifier une éventuelle toxicité chez l’homme, pour estimer la probabilité et la gravité d’événements indésirables potentiels chez l’homme, et pour identifier une dose de départ sûre et une augmentation de la dose, lorsque cela est possible.
- Études de toxicité animale : essais de toxicité aiguë , essais de toxicité à doses répétées, essais de toxicité à long terme
- Tests pharmacocinétiques et pharmacodynamiques : utilisation pour des dosages cliniques déterminés, des activités d’anticorps, l’évaluation des effets cliniques potentiels
Prédiction de structure et conception d’anticorps informatiques
L’importance des anticorps dans les soins de santé et l’ industrie biotechnologique exige une connaissance de leurs structures à haute résolution . Ces informations sont utilisées pour l’ingénierie des protéines , la modification de l’affinité de liaison à l’antigène et l’identification d’un épitope d’un anticorps donné. La cristallographie aux rayons X est une méthode couramment utilisée pour déterminer les structures d’anticorps. Cependant, la cristallisation d’un anticorps est souvent laborieuse et prend du temps. Les approches informatiques offrent une alternative moins chère et plus rapide à la cristallographie, mais leurs résultats sont plus équivoques, car elles ne produisent pas de structures empiriques. Serveurs Web en ligne tels que Web Antibody Modeling (WAM) [110] etLa prédiction de la structure des immunoglobulines (PIGS) [111] permet la modélisation informatique des régions variables des anticorps. Rosetta Antibody est un nouveau serveur de prédiction de la structure de la région F V des anticorps , qui intègre des techniques sophistiquées pour minimiser les boucles CDR et optimiser l’orientation relative des chaînes légères et lourdes, ainsi que des modèles d’ homologie qui prédisent la réussite de l’amarrage des anticorps avec leur antigène unique. [112]Cependant, décrire le site de liaison d’un anticorps en utilisant une seule structure statique limite la compréhension et la caractérisation de la fonction et des propriétés de l’anticorps. Pour améliorer la prédiction de la structure des anticorps et prendre en compte les mouvements de boucle et d’interface CDR fortement corrélés, les paratopes d’anticorps doivent être décrits comme des états d’interconversion en solution avec des probabilités variables. [17]
La capacité de décrire l’anticorps par l’affinité de liaison à l’antigène est complétée par des informations sur la structure de l’anticorps et les séquences d’acides aminés aux fins des revendications de brevet. [113] Plusieurs méthodes ont été présentées pour la conception informatique d’anticorps basés sur les études bioinformatiques structurelles des CDR d’anticorps. [114] [115] [116]
Il existe une variété de méthodes utilisées pour séquencer un anticorps, y compris la dégradation d’Edman , l’ ADNc , etc.; bien que l’une des utilisations modernes les plus courantes de l’identification des peptides/protéines soit la chromatographie liquide couplée à la spectrométrie de masse en tandem (LC-MS/MS). [117] Les méthodes de séquençage d’anticorps à haut volume nécessitent des approches informatiques pour l’analyse des données, y compris le séquençage de novo directement à partir de spectres de masse en tandem [118] et des méthodes de recherche de bases de données qui utilisent des bases de données de séquences de protéines existantes . [119] [120]De nombreuses versions du séquençage des protéines shotgun sont capables d’augmenter la couverture en utilisant des méthodes de fragmentation CID/HCD/ETD [121] et d’autres techniques, et elles ont réalisé des progrès substantiels dans la tentative de séquencer complètement les protéines , en particulier les anticorps. D’autres méthodes ont supposé l’existence de protéines similaires, [122] une séquence de génome connue , [123] ou des approches combinées descendantes et ascendantes. [124] Les technologies actuelles ont la capacité d’assembler des séquences de protéines avec une grande précision en intégrant des peptides de séquençage de novo , l’intensité et les scores de confiance de position à partir de la base de données et de l’ homologierecherches. [125]
Anticorps mimétique
Les mimétiques d’anticorps sont des composés organiques, comme les anticorps, qui peuvent se lier spécifiquement aux antigènes. Ils sont constitués de peptides ou de protéines artificiels, ou de molécules d’acides nucléiques à base d’ aptamères d’une masse molaire d’environ 3 à 20 kDa . Les fragments d’anticorps, tels que Fab et les nanocorps ne sont pas considérés comme des mimétiques d’anticorps . Les avantages communs par rapport aux anticorps sont une meilleure solubilité, une meilleure pénétration dans les tissus, une stabilité à la chaleur et aux enzymes et des coûts de production relativement faibles. Des mimétiques d’anticorps ont été développés et commercialisés en tant qu’agents de recherche, de diagnostic et thérapeutiques. [126]
Ligands optimisants
Les ligands Optimer sont une nouvelle classe de mimétiques d’anticorps . [127] Ces ligands d’affinité à base d’acide nucléique sont développés in vitro pour générer des ligands d’affinité spécifiques et sensibles qui sont appliqués à travers la thérapeutique , [128] [129] l’administration de médicaments , [130] [131] [132] le biotraitement , [133] [134] diagnostic , [135] [136] [137] [138] [139] [140] [141] et recherche fondamentale . [140]
Unité d’anticorps de liaison
BAU (unité d’anticorps de liaison, souvent en BAU/mL) est une unité de mesure définie par l’ OMS pour la comparaison de dosages détectant la même classe d’immunoglobulines avec la même spécificité. [142] [143] [144]
Voir également
- Affirmer
- Anticorps anti-mitochondries
- Anticorps antinucléaires
- Anticorps mimétique
- Aptamère
- Colostrum
- ELISA
- Immunité humorale
- Immunologie
- Médicament immunosuppresseur
- Immunoglobuline intraveineuse (IgIV)
- Immunoessai magnétique
- Microanticorps
- Anticorps monoclonal
- Anticorps neutralisant
- Ligand optimal
- Anticorps secondaires
- Anticorps à domaine unique
- Spectroscopie de pente
- Anticorps synthétique
- Normalisation Western blot
Références
- ^ un bc Rhoades RA, Pflanzer RG (2002). Physiologie humaine (5e éd.). Apprentissage Thomson. p. 584 . ISBN 978-0-534-42174-8.
- ^ un bcdefghi Janeway C ( 2001 ) . _ _ Immunobiologie (5e éd.). Edition Garland. ISBN 978-0-8153-3642-6.
- ^ Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT (janvier 1993). “Diversification phylogénétique des gènes d’immunoglobulines et du répertoire d’anticorps” . Biologie moléculaire et évolution . 10 (1): 60–72. doi : 10.1093/oxfordjournals.molbev.a040000 . PMID 8450761 .
- ^ un b Borghesi L, Milcarek C (2006). “De la cellule B au plasmocyte: régulation de la recombinaison V (D) J et de la sécrétion d’anticorps”. Recherche immunologique . 36 (1–3) : 27–32. doi : 10.1385/IR:36:1:27 . PMID 17337763 . S2CID 27041937 .
- ^ un bcdef Pier GB , Lyczak JB , Wetzler LM (2004). Immunologie, Infection et Immunité . Presse ASM. ISBN 978-1-55581-246-1.
- ^ “Navigateur MeSH – Immunoglobulines” . meshb.nlm.nih.gov . Récupéré le 25 octobre 2020 .
- ^ Reth M (août 2013). “Dimensions cellulaires assorties avec des tailles moléculaires” (PDF) . Immunologie naturelle . 14 (8) : 765–7. doi : 10.1038/ni.2621 . PMID 23867923 . S2CID 24333875 .
- ^ un b Woof JM, Burton DR (février 2004). “Interactions anticorps-récepteur Fc humains éclairées par des structures cristallines”. Revues naturelles. Immunologie . 4 (2): 89–99. doi : 10.1038/nri1266 . PMID 15040582 . S2CID 30584218 .
- ^ Barclay AN (août 2003). “Protéines membranaires avec des domaines de type immunoglobuline – une superfamille principale de molécules d’interaction”. Séminaires en Immunologie . 15 (4) : 215–223. doi : 10.1016/S1044-5323(03)00047-2 . PMID 14690046 .
- ^ Putnam FW, Liu YS, Low TL (avril 1979). “Structure primaire d’une immunoglobuline IgA1 humaine. IV. Protéase IgA1 streptococcique, digestion, fragments Fab et Fc et séquence complète d’acides aminés de la chaîne lourde alpha 1” . Le Journal de chimie biologique . 254 (8): 2865–74. doi : 10.1016/S0021-9258(17)30153-9 . PMID 107164 .
- ^ un b Delves PJ, Martin SJ, Burton DR, Roitt IM (2017). Immunologie essentielle de Roitt (13e éd.). Chichester, West Sussex. ISBN 978-1-118-41577-1. OCLC 949912256 .
- ^ “Navigateur MeSH – gamma-globulines” . meshb.nlm.nih.gov . Récupéré le 18 octobre 2020 .
- ^ “Recommandations pour la nomenclature des immunoglobulines humaines” . Journal d’immunologie . 108 (6) : 1733–4. Juin 1972. PMID 5031329 .
- ^ Al-Lazikani B, Lesk AM, Chothia C (novembre 1997). “Conformations standard pour les structures canoniques des immunoglobulines”. Tourillon de biologie moléculaire . 273 (4): 927–48. doi : 10.1006/jmbi.1997.1354 . PMID 9367782 .
- ^ Nord B, Lehmann A, Dunbrack RL (février 2011). “Un nouveau groupement de conformations de boucle CDR d’anticorps” . Tourillon de biologie moléculaire . 406 (2): 228–256. doi : 10.1016/j.jmb.2010.10.030 . PMC 3065967 . PMID 21035459 .
- ^ Nikoloudis D, Pitts JE, Saldanha JW (2014). “Un regroupement conformationnel complet à plusieurs niveaux de régions déterminant la complémentarité des anticorps” . PeerJ . 2 (e456) : e456. doi : 10.7717/peerj.456 . PMC 4103072 . PMID 25071986 .
- ^ un b Fernández-Quintero ML, Georges G, Varga JM, Liedl KR (2021). “Ensembles en solution comme nouveau paradigme pour la prédiction et la conception de la structure des anticorps” . mAbs . 13 (1) : 1923122. doi : 10.1080/19420862.2021.1923122 . PMC 8158028 . PMID 34030577 .
- ^ Woof JM, Russell RW (2011). « Relations de structure et de fonction dans les IgA » . Immunologie muqueuse . 4 (6): 590–597. doi : 10.1038/mi.2011.39 . PMID 21937984 .
- ^ un bc Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (février 2015). “Glycans dans le système immunitaire et la théorie modifiée des Glycanes sur l’auto-immunité : une revue critique” . Journal de l’auto-immunité . 57 (6): 1–13. doi : 10.1016/j.jaut.2014.12.002 . PMC 4340844 . PMID 25578468 .
- ^ Mattu TS, Pleass RJ, Willis AC, Kilian M, Wormald MR, Lellouch AC, Rudd PM, Woof JM, Dwek RA (janvier 1998). “La glycosylation et la structure des régions sériques humaines IgA1, Fab et Fc et le rôle de la N-glycosylation sur les interactions avec les récepteurs Fcα” . Le Journal de chimie biologique . 273 (4): 2260–72. doi : 10.1074/jbc.273.4.2260 . PMID 9442070 .
- ^ Cobb BA (mars 2020). “L’histoire de la glycosylation des IgG et où nous en sommes maintenant” . Glycobiologie . 30 (4): 202–213. doi : 10.1093/glycob/cwz065 . PMC 7109348 . PMID 31504525 .
- ^ Roux KH (octobre 1999). “Structure et fonction des immunoglobulines telles que révélées par microscopie électronique”. Archives internationales d’allergie et d’immunologie . 120 (2): 85–99. doi : 10.1159/000024226 . PMID 10545762 . S2CID 12187510 .
- ^ Parker DC (1993). “Activation des cellules B dépendante des cellules T”. Revue annuelle d’immunologie . 11 (1): 331–360. doi : 10.1146/annurev.iy.11.040193.001555 . PMID 8476565 .
- ^ un bcd Wintrobe MM ( 2004). Greer JG, Foerster F, Lukens JN, Rodgers GM, Paraskevas F (eds.). L’hématologie clinique de Wintrobe (11e éd.). Hagerstown, MD : Lippincott Williams & Wilkins. p. 453–456. ISBN 978-0-7817-3650-3.
- ^ Tolar P, Sohn HW, Pierce SK (février 2008). “Affichage de l’initiation induite par l’antigène de l’activation des lymphocytes B dans les cellules vivantes” . Revues immunologiques . 221 (1): 64-76. doi : 10.1111/j.1600-065X.2008.00583.x . PMID 18275475 . S2CID 38464264 .
- ^ Williams CM, Galli SJ (mai 2000). “Les divers rôles effecteurs potentiels et immunorégulateurs des mastocytes dans les maladies allergiques” . Le Journal de l’allergie et de l’immunologie clinique . 105 (5) : 847–859. doi : 10.1067/mai.2000.106485 . PMID 10808163 .
- ^ Underdown BJ, Schiff JM (1986). “Immunoglobuline A: initiative de défense stratégique à la surface muqueuse”. Revue annuelle d’immunologie . 4 (1): 389–417. doi : 10.1146/annurev.iy.04.040186.002133 . PMID 3518747 .
- ^ un b Geisberger R, Lamers M, Achatz G (août 2006). “L’énigme de la double expression des IgM et IgD” . Immunologie . 118 (4): 429–37. doi : 10.1111/j.1365-2567.2006.02386.x . PMC 1782314 . PMID 16895553 .
- ^ Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A (août 2009). “L’immunoglobuline D améliore la surveillance immunitaire en activant les programmes antimicrobiens, pro-inflammatoires et de stimulation des cellules B dans les basophiles” . Immunologie naturelle . 10 (8): 889–98. doi : 10.1038/ni.1748 . PMC 2785232 . PMID 19561614 .
- ^ Goding JW (1978). “Allotypes des récepteurs IgM et IgD chez la souris: une sonde pour la différenciation lymphocytaire”. Sujets contemporains en immunobiologie . 8 : 203–43. doi : 10.1007/978-1-4684-0922-2_7 . ISBN 978-1-4684-0924-6. PMID 357078 .
- ^ Litman GW, Rast JP, Fugmann SD (août 2010). “Les origines de l’immunité adaptative des vertébrés” . Revues naturelles. Immunologie . 10 (8): 543–53. doi : 10.1038/nri2807 . PMC 2919748 . PMID 20651744 .
- ^ Litman GW, Rast JP, Fugmann SD (août 2010). “Les origines de l’immunité adaptative des vertébrés” . Revues naturelles. Immunologie . John Wiley & Sons, Ltd. 10 (8) : 543–553. doi : 10.1002/9783527699124.ch4 . ISBN 978-3-527-69912-4. PMC 2919748 . PMID 20651744 .
- ^ Lundqvist ML, Middleton DL, Radford C, Warr GW, Magor KE (2006). « Immunoglobulines des oiseaux non galliformes : expression et répertoire des anticorps chez le canard » . Immunologie développementale et comparée . 30 (1–2) : 93–100. doi : 10.1016/j.dci.2005.06.019 . PMC 1317265 . PMID 16150486 .
- ^ Berstein RM, Schluter SF, Shen S, Marchalonis JJ (avril 1996). “Une nouvelle classe d’immunoglobulines de haut poids moléculaire du requin carcharhinien : implications pour les propriétés de l’immunoglobuline primordiale” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 93 (8): 3289-93. Bibcode : 1996PNAS…93.3289B . doi : 10.1073/pnas.93.8.3289 . PMC 39599 . PMID 8622930 .
- ^ Salinas, I., & Parra, D. (2015). Immunité des muqueuses du poisson : Intestin. Dans Santé des muqueuses en aquaculture. Elsevier Inc. https://doi.org/10.1016/B978-0-12-417186-2.00006-6
- ^ un b Ravetch JV, Bolland S (2001). “Récepteurs IgG Fc”. Revue annuelle d’immunologie . 19 (1): 275–290. doi : 10.1146/annurev.immunol.19.1.275 . PMID 11244038 .
- ^ Rus H, Cudrici C, Niculescu F (2005). “Le rôle du système du complément dans l’immunité innée”. Recherche immunologique . 33 (2): 103–12. doi : 10.1385/IR:33:2:103 . PMID 16234578 . S2CID 46096567 .
- ^ Racaniello, Vincent (6 octobre 2009). “L’anticorps naturel protège contre l’infection virale” . Blog de virologie . Archivé de l’original le 20 février 2010 . Récupéré le 22 janvier 2010 .
- ^ Milland J, Sandrin MS (décembre 2006). “Groupe sanguin ABO et antigènes apparentés, anticorps naturels et transplantation”. Antigènes tissulaires . 68 (6): 459–66. doi : 10.1111/j.1399-0039.2006.00721.x . PMID 17176435 .
- ^ Mian IS, Bradwell AR, Olson AJ (janvier 1991). “Structure, fonction et propriétés des sites de liaison d’anticorps”. Tourillon de biologie moléculaire . 217 (1): 133–51. doi : 10.1016/0022-2836(91)90617-F . PMID 1988675 .
- ^ Fanning LJ, Connor AM, Wu GE (avril 1996). “Développement du répertoire d’immunoglobulines”. Immunologie clinique et immunopathologie . 79 (1): 1–14. doi : 10.1006/clin.1996.0044 . PMID 8612345 .
- ^ un b Nemazee D (octobre 2006). “L’édition des récepteurs dans le développement des lymphocytes et la tolérance centrale”. Revues naturelles. Immunologie . 6 (10): 728–740. doi : 10.1038/nri1939 . PMID 16998507 . S2CID 2234228 .
- ^ Peter Parham. Le système immunitaire . 2e éd. Garland Science: New York, 2005. pg.47–62
- ^ un bcd Market E, Papavasiliou FN (octobre 2003). “Recombinaison V(D)J et évolution du système immunitaire adaptatif” . PLOS Biologie . 1 (1) : E16. doi : 10.1371/journal.pbio.0000016 . PMC 212695 . PMID 14551913 .
- ^ Bergman Y, Cedar H (octobre 2004). “Un processus épigénétique par étapes contrôle l’exclusion allélique des immunoglobulines”. Revues naturelles. Immunologie . 4 (10): 753–61. doi : 10.1038/nri1458 . PMID 15459667 . S2CID 8579156 .
- ^ Diaz M, Casali P (avril 2002). “Hypermutation d’immunoglobuline somatique” . Opinion actuelle en immunologie . 14 (2): 235–240. doi : 10.1016/S0952-7915(02)00327-8 . PMC 4621002 . PMID 11869898 .
- ^ Honjo T, Habu S (1985). « Origine de la diversité immunitaire : variation génétique et sélection ». Revue annuelle de biochimie . 54 (1): 803–30. doi : 10.1146/annurev.bi.54.070185.004103 . PMID 3927822 .
- ^ un b Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J (avril 2007). “Recirculation des cellules B du centre germinal: une stratégie de sélection à plusieurs niveaux pour la maturation des anticorps”. Revues immunologiques . 216 : 130–41. doi : 10.1111/j.1600-065X.2007.00507.x . PMID 17367339 . S2CID 37636392 .
- ^ Neuberger MS, Ehrenstein MR, Rada C, Sale J, Batista FD, Williams G, Milstein C (mars 2000). “Mémoire dans le compartiment des lymphocytes B : maturation de l’affinité des anticorps” . Transactions philosophiques de la Royal Society de Londres. Série B, Sciences biologiques . 355 (1395): 357-60. doi : 10.1098/rstb.2000.0573 . PMC 1692737 . PMID 10794054 .
- ^ Stavnezer J, Amemiya CT (août 2004). « Évolution de la commutation d’isotype ». Séminaires en Immunologie . 16 (4): 257–75. doi : 10.1016/j.smim.2004.08.005 . PMID 15522624 .
- ^ Durandy A (août 2003). “Cytidine désaminase induite par l’activation: un double rôle dans la recombinaison de changement de classe et l’hypermutation somatique”. Journal européen d’immunologie . 33 (8): 2069–73. doi : 10.1002/eji.200324133 . PMID 12884279 . S2CID 32059768 .
- ^ Casali P, Zan H (novembre 2004). “Commutation de classe et translocation Myc : comment l’ADN se brise-t-il ?” . Immunologie naturelle . 5 (11) : 1101–3. doi : 10.1038/ni1104-1101 . PMC 4625794 . PMID 15496946 .
- ^ Lieber MR, Yu K, Raghavan SC (septembre 2006). “Rôles de la jonction d’extrémité d’ADN non homologue, recombinaison V (D) J et recombinaison de commutation de classe dans les translocations chromosomiques”. Réparation de l’ADN . 5 (9–10) : 1234–1245. doi : 10.1016/j.dnarep.2006.05.013 . PMID 16793349 .
- ^ p. 22 dans : Shoenfeld Y, Meroni PL, Gershwin ME (2007). Autoanticorps . Amsterdam; Boston : Elsevier. ISBN 978-0-444-52763-9.
- ^ Spiess C, Zhai Q, Carter PJ (octobre 2015). “Formats moléculaires alternatifs et applications thérapeutiques pour les anticorps bispécifiques” . Immunologie Moléculaire . 67 (2 Pt A): 95–106. doi : 10.1016/j.molimm.2015.01.003 . PMID 25637431 .
- ^ un dictionnaire Farlex b > polyvalent Citant : Le Dictionnaire Médical d’Héritage américain. 2004
- ^ Gunasekaran K, Pentony M, Shen M, Garrett L, Forte C, Woodward A, Ng SB, Born T, Retter M, Manchulenko K, Sweet H, Foltz IN, Wittekind M, Yan W (juin 2010). “Amélioration de la formation d’hétérodimères Fc d’anticorps par des effets de direction électrostatique : applications aux molécules bispécifiques et aux IgG monovalentes” . Le Journal de chimie biologique . 285 (25): 19637–46. doi : 10.1074/jbc.M110.117382 . PMC 2885242 . PMID 20400508 .
- ^ Müller KM (1998). “Le premier domaine constant (CH1 et CL) d’un anticorps utilisé comme domaine d’hétérodimérisation pour des mini-anticorps bispécifiques” . Lettres FEBS . 422 (2): 259–264. doi : 10.1016/s0014-5793(98)00021-0 . PMID 9490020 . S2CID 35243494 .
- ^ Gao C, Mao S, Lo CH, Wirsching P, Lerner RA, Janda KD (mai 1999). “Fabriquer des anticorps artificiels : un format pour l’affichage de phages de réseaux hétérodimères combinatoires” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 96 (11): 6025–30. Bibcode : 1999PNAS…96.6025G . doi : 10.1073/pnas.96.11.6025 . PMC 26829 . PMID 10339535 .
- ^ un bcd Lindenmann J (avril 1984). “Origine des termes ‘anticorps’ et ‘antigène’ “. Journal scandinave d’immunologie . 19 (4): 281–5. doi : 10.1111/j.1365-3083.1984.tb00931.x . PMID 6374880 . S2CID 222200504 .
- ^ Padlan EA (février 1994). “Anatomie de la molécule d’anticorps” . Immunologie Moléculaire . 31 (3): 169-217. doi : 10.1016/0161-5890(94)90001-9 . PMID 8114766 .
- ^ Sauter E (10 novembre 2018). “Une nouvelle sculpture représentant un anticorps humain comme un ange protecteur installé sur le campus de Scripps en Floride” . Nouvelles et points de vue . Vol. 8, non. 34. L’Institut de recherche Scripps. Archivé de l’original le 10 janvier 2011 . Récupéré le 12 décembre 2008 .
- ^ Pescovitz D (22 octobre 2008). “Sculpture protéique inspirée de l’Homme de Vitruve” . boingboing (blog). Archivé de l’original le 4 novembre 2010 . Récupéré le 12 décembre 2008 .
- ^ Emil von Behring – Biographique. Nobel Prize.org. Nobel Media AB 2020. Lun. 20 janvier 2020. < https://www.nobelprize.org/prizes/medicine/1901/behring/biographical/ >
- ^ AGN (août 1931). “Le défunt baron Shibasaburo Kitasato” . Journal de l’Association médicale canadienne . 25 (2) : 206. PMC 382621 . PMID 20318414 .
- ^ Winau F, Westphal O, Winau R (juillet 2004). “Paul Ehrlich – à la recherche de la balle magique”. Microbes et Infection . 6 (8) : 786–9. doi : 10.1016/j.micinf.2004.04.003 . PMID 15207826 .
- ^ Silverstein AM (mai 2003). “Immunologie cellulaire contre humorale: une dispute d’un siècle”. Immunologie naturelle . 4 (5) : 425–8. doi : 10.1038/ni0503-425 . PMID 12719732 . S2CID 31571243 .
- ^ Van Epps HL (janvier 2006). “Michael Heidelberger et la démystification des anticorps” . Le Journal de médecine expérimentale . 203 (1): 5. doi : 10.1084/jem.2031fta . PMC 2118068 . PMID 16523537 .
- ^ Marrack JR (1938). Chimie des antigènes et des anticorps (2e éd.). Londres : Bureau de papeterie de Sa Majesté. OCLC 3220539 .
- ^ “Les Papiers de Linus Pauling : Comment Fonctionnent les Anticorps et les Enzymes” . Archivé de l’original le 5 décembre 2010 . Récupéré le 5 juin 2007 .
- ^ Silverstein AM (décembre 2004). “Antigènes et anticorps marqués: l’évolution des marqueurs magiques et des balles magiques” (PDF) . Immunologie naturelle . 5 (12): 1211–7. doi : 10.1038/ni1140 . PMID 15549122 . S2CID 40595920 . Archivé de l’original (PDF) le 25 mars 2009.
- ^ Edelman GM, Gally JA (août 1962). “La nature des protéines de Bence-Jones. Similitudes chimiques avec les chaînes polypeptidiques des globulines du myélome et des gamma-globulines normales” . Le Journal de médecine expérimentale . 116 (2): 207–227. doi : 10.1084/jem.116.2.207 . PMC 2137388 . PMID 13889153 .
- ^ Stevens FJ, Solomon A, Schiffer M (juillet 1991). “Les protéines de Bence Jones : un outil puissant pour l’étude fondamentale de la chimie et de la physiopathologie des protéines” . Biochimie . 30 (28): 6803–5. doi : 10.1021/bi00242a001 . PMID 2069946 .
- ^ un b Raju TN (septembre 1999). “Les chroniques Nobel. 1972: Gerald M Edelman (né en 1929) et Rodney R Porter (1917–85)”. Lancette . 354 (9183): 1040. doi : 10.1016/S0140-6736(05)76658-7 . PMID 10501404 . S2CID 54380536 .
- ^ Hochman J, Inbar D, Givol D (mars 1973). “Un fragment d’anticorps actif (Fv) composé des parties variables des chaînes lourdes et légères”. Biochimie . 12 (6) : 1130–5. doi : 10.1021/bi00730a018 . PMID 4569769 .
- ^ Tomasi TB (octobre 1992). “La découverte des IgA sécrétoires et du système immunitaire muqueux”. L’immunologie aujourd’hui . 13 (10): 416–8. doi : 10.1016/0167-5699(92)90093-M . PMID 1343085 .
- ↑ Preud’homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E (octobre 2000). “Propriétés structurelles et fonctionnelles de la membrane et des IgD sécrétées”. Immunologie Moléculaire . 37 (15): 871–87. doi : 10.1016/S0161-5890(01)00006-2 . PMID 11282392 .
- ^ Johansson SG (2006). “La découverte de l’immunoglobuline E”. Procédures d’allergie et d’asthme . 27 (2 Suppl 1) : S3–6. PMID 16722325 .
- ^ Hozumi N, Tonegawa S (octobre 1976). “Preuve du réarrangement somatique des gènes d’immunoglobuline codant pour des régions variables et constantes” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 73 (10): 3628–32. Bibcode : 1976PNAS…73.3628H . doi : 10.1073/pnas.73.10.3628 . PMC 431171 . PMID 824647 .
- ^ “Des représentations animées de la façon dont les anticorps sont utilisés dans les tests ELISA” . Cellular Technology Ltd.—Europe . Archivé de l’original le 14 juin 2011 . Récupéré le 8 mai 2007 .
- ^ “Des représentations animées de la façon dont les anticorps sont utilisés dans les tests ELISPOT” . Cellular Technology Ltd.—Europe . Archivé de l’original le 16 mai 2011 . Récupéré le 8 mai 2007 .
- ^ Stern P (2006). “Possibilités actuelles de la turbidimétrie et de la néphélométrie” (PDF) . Klin Biochem Metab . 14 (3): 146-151. Archivé de l’original (PDF) le 10 avril 2008.
- ^ un b doyen L (2005). “Chapitre 4 : Maladie hémolytique du nouveau-né” . Groupes sanguins et antigènes des globules rouges . NCBI Bethesda (MD) : Bibliothèque nationale de médecine (États-Unis).
- ^ Rodriguez EA, Wang Y, Crisp JL, Vera DR, Tsien RY, Ting R (mai 2016). “La nouvelle chimie du dioxaborolane permet [(18)F] -Émission de positons, génération de biomolécules fluorescentes [(18)F]-Multimodalité à partir de la phase solide” . Chimie des bioconjugués . 27 (5): 1390–1399. doi : 10.1021/acs.bioconjchem.6b00164 . PMC 4916912 . PMID 27064381 .
- ^ Feldmann M, Maini RN (2001). « Thérapie anti-TNF alpha de la polyarthrite rhumatoïde : qu’avons-nous appris ? ». Revue annuelle d’immunologie . 19 (1): 163–96. doi : 10.1146/annurev.immunol.19.1.163 . PMID 11244034 .
- ^ Doggrell SA (juin 2003). “Le natalizumab est-il une percée dans le traitement de la sclérose en plaques ?”. Avis d’expert sur la pharmacothérapie . 4 (6): 999-1001. doi : 10.1517/14656566.4.6.999 . PMID 12783595 . S2CID 16104816 .
- ^ Krueger GG, Langley RG, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley LT, Lebwohl M (février 2007). “Un anticorps monoclonal d’interleukine-12/23 humaine pour le traitement du psoriasis”. Le New England Journal of Medicine . 356 (6): 580–92. doi : 10.1056/NEJMoa062382 . PMID 17287478 .
- ^ Plosker GL, Figgitt DP (2003). “Rituximab : un examen de son utilisation dans le lymphome non hodgkinien et la leucémie lymphoïde chronique”. Drogues . 63 (8) : 803–843. doi : 10.2165/00003495-200363080-00005 . PMID 12662126 .
- ^ Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, Slamon DJ, Murphy M, Novotny WF, Burchmore M, Shak S, Stewart SJ (2001). “Monothérapie Herceptin de première ligne dans le cancer du sein métastatique”. Oncologie . 61. 61 (Suppl. 2): 37–42. doi : 10.1159/000055400 . PMID 11694786 . S2CID 24924864 .
- ^ LeBien TW (juillet 2000). “Destins des précurseurs des lymphocytes B humains” . Sang . 96 (1): 9–23. doi : 10.1182/blood.V96.1.9 . PMID 10891425 . Archivé de l’original le 29 avril 2010 . Récupéré le 31 mars 2007 .
- ^ Ghaffer A (26 mars 2006). “Immunisation” . Immunologie — Chapitre 14 . École de médecine de l’Université de Caroline du Sud. Archivé de l’original le 18 octobre 2010 . Récupéré le 6 juin 2007 .
- ^ Urbaniak SJ, Greiss MA (mars 2000). “Maladie hémolytique RhD du fœtus et du nouveau-né”. Critiques de sang . 14 (1): 44–61. doi : 10.1054/blre.1999.0123 . PMID 10805260 .
- ^ a b Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid GJ, Aerde JV, Wilson RD, Davies G, Désilets VA, Summers A , Wyatt P, Young DC (septembre 2003). “Prévention de l’allo-immunisation Rh”. Journal d’obstétrique et gynécologie Canada . 25 (9): 765–73. doi : 10.1016/S1701-2163(16)31006-4 . PMID 12970812 .
- ^ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (mars 2002). “Génération et application d’anticorps de jaune d’oeuf de poulet”. Biochimie et physiologie comparées. Partie A, Physiologie moléculaire et intégrative . 131 (3): 569–74. doi : 10.1016/S1095-6433(01)00508-6 . PMID 11867282 .
- ^ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (juin 1984). “Anticorps monoclonaux humains”. Biochimie Moléculaire et Cellulaire . 62 (2): 109–20. doi : 10.1007/BF00223301 . PMID 6087121 . S2CID 12616168 .
- ^ Kabir S (2002). “Purification d’immunoglobuline par chromatographie d’affinité utilisant des ligands mimétiques de protéine A préparés par synthèse chimique combinatoire”. Recherches immunologiques . 31 (3–4): 263–78. doi : 10.1081/IMM-120016245 . PMID 12472184 . S2CID 12785078 .
- ^ un b Brehm-Stecher BF, Johnson EA (septembre 2004). “Microbiologie unicellulaire : outils, technologies et applications” . Examens de microbiologie et de biologie moléculaire . 68 (3) : 538–559, table des matières. doi : 10.1128/MMBR.68.3.538-559.2004 . PMC 515252 . PMID 15353569 .
- ^ Williams NE (2000). Procédures d’immunoprécipitation . Méthodes en biologie cellulaire. Vol. 62. San Diego, Californie : Academic Press. p. 449–53 . doi : 10.1016/S0091-679X(08)61549-6 . ISBN 978-0-12-544164-3. PMID 10503210 .
- ^ Kurien BT, Scofield RH (avril 2006). “Western blot”. Méthodes . 38 (4) : 283–293. doi : 10.1016/j.ymeth.2005.11.007 . PMID 16483794 .
- ^ Scanziani E (1998). « Coloration immunohistochimique des tissus fixés » . Protocoles mycoplasmes . Méthodes en biologie moléculaire. Vol. 104. Totowa, NJ : Humana Press. p. 133–40 . doi : 10.1385/0-89603-525-5:133 . ISBN 978-0-89603-525-6. PMID 9711649 .
- ^ Reen DJ (1994). “Test d’immunosorbant lié à une enzyme (ELISA)”. Protocoles de base des protéines et des peptides . Méthodes en biologie moléculaire. Vol. 32. pp. 461–6. doi : 10.1385/0-89603-268-X:461 . ISBN 978-0-89603-268-2. PMC 2366430 . PMID 7951745 .
- ^ Kalyuzhny AE (2005). “Chimie et biologie du test ELISPOT”. Manuel d’ELISPOT . Méthodes en biologie moléculaire. Vol. 302. p. 15–31. doi : 10.1385/1-59259-903-6:015 . ISBN 978-1-59259-903-5. PMID 15937343 .
- ^ Saper CB (décembre 2005). “Une lettre ouverte à nos lecteurs sur l’utilisation des anticorps” . Le Journal de neurologie comparée . 493 (4) : 477–8. doi : 10.1002/cne.20839 . PMID 16304632 . S2CID 14082678 .
- ^ “NOT-OD-16-011: Mise en œuvre de la rigueur et de la transparence dans les demandes de subventions de recherche NIH & AHRQ” . grant.nih.gov .
- ^ Vasilevsky NA, Brush MH, Paddock H, Ponting L, Tripathy SJ, Larocca GM, Haendel MA (2 septembre 2013). « De la reproductibilité de la science : identification unique des ressources de recherche dans la littérature biomédicale » . PeerJ . 1 : e148. doi : 10.7717/peerj.148 . PMC 3771067 . PMID 24032093 .
- ^ Bandrowski A, Brush M, Grethe JS, Haendel MA, Kennedy DN, Hill S, et al. (2015). “L’Initiative d’identification des ressources : un changement culturel dans l’édition” . F1000Recherche . 4 : 134. doi : 10.12688/f1000research.6555.2 . PMC 4648211 . PMID 26594330 .
- ^ Helsby MA, Fenn JR, Chalmers AD (23 août 2013). « Rapporter l’utilisation d’anticorps de recherche : comment augmenter la reproductibilité expérimentale » . F1000Recherche . 2 : 153. doi : 10.12688/f1000research.2-153.v2 . PMC 3829129 . PMID 24358895 .
- ^ “Le registre des anticorps” . anticorpsregistry.org .
- ^ “Initiative d’identification des ressources” . FORCE11 . 14 août 2013 . Récupéré le 18 avril 2016 .
- ^ Archivé le 17 juillet 2011 au Wayback Machine
WAM - ^ Marcatili P, Rosi A, Tramontano A (septembre 2008). “PIGS : prédiction automatique des structures d’anticorps” . Bioinformatique . 24 (17): 1953–4. doi : 10.1093/bioinformatique/btn341 . PMID 18641403 . Archivé de l’original le 26 novembre 2010.
Prédiction de la structure des immunoglobulines (PIGS) Archivé le 18 novembre 2010 sur WebCite - ^ Archivé le 19 juillet 2011 à la Wayback Machine
RosettaAntibody - ^ Park H. “Problèmes de description écrite des brevets d’anticorps monoclonaux après Centocor v. Abbott” . secousse.law.harvard.edu . Archivé de l’original le 13 décembre 2014 . Récupéré le 12 décembre 2014 .
- ^ Adolf-Bryfogle J, Kalyuzhniy O, Kubitz M, Weitzner BD, Hu X, Adachi Y, et al. (avril 2018). “RosettaAntibodyDesign (RAbD): Un cadre général pour la conception d’anticorps computationnels” . Biologie computationnelle PLOS . 14 (4) : e1006112. Bibcode : 2018PLSCB..14E6112A . doi : 10.1371/journal.pcbi.1006112 . PMC 5942852 . PMID 29702641 .
- ^ Lapidoth GD, Baran D, Pszolla GM, Norn C, Alon A, Tyka MD, Fleishman SJ (août 2015). « AbDesign : un algorithme pour la conception combinatoire du squelette guidé par des conformations et des séquences naturelles » . Protéines . 83 (8): 1385–406. doi : 10.1002/prot.24779 . PMC 4881815 . PMID 25670500 .
- ^ Li T, Pantazes RJ, Maranas CD (2014). “OptMAVEn – un nouveau cadre pour la conception de novo de modèles de régions variables d’anticorps ciblant des épitopes d’antigènes spécifiques” . PLOS ONE . 9 (8) : e105954. Bibcode : 2014PLoSO…9j5954L . doi : 10.1371/journal.pone.0105954 . PMC 4143332 . PMID 25153121 .
- ^ Pham V, Henzel WJ, Arnott D, Hymowitz S, Sandoval WN, Truong BT, et al. (mai 2006). “Séquençage protéomique de novo d’un anticorps monoclonal élevé contre le ligand OX40”. Biochimie analytique . 352 (1): 77–86. doi : 10.1016/j.ab.2006.02.001 . PMID 16545334 .
- ^ Ma B, Zhang K, Hendrie C, Liang C, Li M, Doherty-Kirby A, Lajoie G (2003). « PEAKS : logiciel puissant pour le séquençage de novo de peptides par spectrométrie de masse en tandem ». Communications rapides en spectrométrie de masse . 17 (20): 2337–42. Bibcode : 2003RCMS…17.2337M . doi : 10.1002/rcm.1196 . PMID 14558135 .
- ^ Zhang J, Xin L, Shan B, Chen W, Xie M, Yuen D, et al. (avril 2012). “PEAKS DB : recherche de base de données assistée par séquençage de novo pour une identification sensible et précise des peptides” . Protéomique moléculaire et cellulaire . 11 (4) : M111.010587. doi : 10.1074/mcp.M111.010587 . PMC 3322562 . PMID 22186715 .
- ^ Perkins DN, Pappin DJ, Creasy DM, Cottrell JS (décembre 1999). “Identification de protéines basée sur les probabilités en recherchant des bases de données de séquences à l’aide de données de spectrométrie de masse”. Électrophorèse . 20 (18): 3551–67. doi : 10.1002/(SICI)1522-2683(19991201)20:18<3551::AID-ELPS3551>3.0.CO;2-2 . PMID 10612281 .
- ^ Bandeira N, Tang H, Bafna V, Pevzner P (décembre 2004). “Séquençage des protéines de fusil de chasse par assemblage de spectres de masse en tandem”. Chimie Analytique . 76 (24): 7221–33. doi : 10.1021/ac0489162 . PMID 15595863 .
- ^ Liu X, Han Y, Yuen D, Ma B (septembre 2009). “Le (re)séquençage automatisé des protéines avec MS/MS et une base de données homologue offre une couverture et une précision presque complètes” . Bioinformatique . 25 (17): 2174–80. doi : 10.1093/bioinformatique/btp366 . PMID 19535534 .
- ^ Castellana NE, Pham V, Arnott D, Lill JR, Bafna V (juin 2010). “Protéogénomique de modèle : séquençage de protéines entières à l’aide d’une base de données imparfaite” . Protéomique moléculaire et cellulaire . 9 (6): 1260–70. doi : 10.1074/mcp.M900504-MCP200 . PMC 2877985 . PMID 20164058 .
- ^ Liu X, Dekker LJ, Wu S, Vanduijn MM, Luider TM, Tolić N, et al. (juillet 2014). “Séquençage de protéines de novo en combinant des spectres de masse en tandem descendants et ascendants”. Journal de recherche sur les protéomes . 13 (7): 3241–8. doi : 10.1021/pr401300m . PMID 24874765 .
- ^ Tran NH, Rahman MZ, He L, Xin L, Shan B, Li M (août 2016). “Assemblage complet de novo de séquences d’anticorps monoclonaux” . Rapports scientifiques . 6 : 31730. Bibcode : 2016NatSR…631730T . doi : 10.1038/srep31730 . PMC 4999880 . PMID 27562653 .
- ^ Gebauer M, Skerra A (juin 2009). “Échafaudages de protéines d’ingénierie comme thérapie d’anticorps de nouvelle génération”. Opinion actuelle en biologie chimique . 13 (3): 245-255. doi : 10.1016/j.cbpa.2009.04.627 . PMID 19501012 .
- ^ “Identification et développement rapides des Optimers sélectifs du SARS-CoV-2” . Groupe Aptamères . 11 décembre 2020 . Récupéré le 3 août 2021 .
- ^ “Le groupe Aptamer collabore avec une société pharmaceutique leader mondiale pour évaluer la technologie Optimer” . News-medical.net . 28 mai 2021 . Récupéré le 11 juillet 2021 .
- ^ “Aptamer Therapeutics et Cancer Research UK annoncent un partenariat pour un programme de développement de médicaments” . Recherche sur le cancer au Royaume-Uni . Récupéré le 11 juillet 2021 .
- ^ “Le Groupe Aptamer collabore avec PinotBio” . Contrat pharmaceutique . Récupéré le 11 juillet 2021 .
- ^ “Aptamer Group et AstraZeneca pour explorer des méthodes avancées d’administration de médicaments” . Fabricant pharmaceutique européen . 5 mars 2021 . Récupéré le 11 juillet 2021 .
- ^ “Aptamer Group et WuXi AppTec collaborent sur la thérapeutique Optimer” . Chimiste manufacturier . Récupéré le 11 juillet 2021 .
- ^ “Surveillance flexible des petites molécules avec des réactifs d’affinité aptamère utilisant l’interférométrie bio-couche” . Youtube . Groupe des Aptamères. Archivé de l’original le 15 novembre 2021 . Récupéré le 1er mars 2021 .
- ^ “Aptamer collabore avec Takeda pour évaluer la technologie Optimer” . Dispositifs médicaux de la N.-É. 31 mai 2021 . Récupéré le 31 mai 2021 .
- ^ “Aptamer Group, Mologic Ink Deal pour développer un test d’antigène de coronavirus” . 360Dx . Récupéré le 2 décembre 2020 .
- ^ “APTAMER GROUP ET CYTIVA POUR COLLABORER SUR LE TEST RAPIDE COVID-19” . Médias d’initiés . Récupéré le 3 juillet 2020 .
- ^ “Integumen dévoile un test respiratoire Covid-19 personnalisé en temps réel” . Partages . Récupéré le 25 septembre 2020 .
- ^ “Recherche d’Octet COVID-19” . Sartorius . Récupéré le 26 juin 2021 .
- ^ “DeepVerge prêt à déployer le système de contamination de l’eau COVID-19 après avoir terminé les essais sur le terrain” . Investisseurs proactifs . 24 juin 2021 . Récupéré le 24 juin 2021 .
- ^ un b Maugi R, Gamble B, Bunka D, Platt M (avril 2021). “Un essai d’aptamère à déplacement simple sur un capteur d’impulsion résistif pour la détection de petites molécules” . Talante . 225 : 122068. doi : 10.1016/j.talanta.2020.122068 . ISSN 0039-9140 . PMID 33592786 . S2CID 231945556 .
- ^ Tartaggia S, Meneghello A, Bellotto O, Poetto AS, Zanchetta M, Posocco B, et al. (mars 2021). “Une enquête SPR sur le suivi thérapeutique du médicament anticancéreux imatinib avec des aptamères sélectifs opérant dans le plasma humain” . L’Analyste . 146 (5) : 1714-1724. Bibcode : 2021Ana…146.1714T . doi : 10.1039/D0AN01860K . PMID 33439175 . S2CID 230533207 .
- ^ Kristiansen, Paul A.; Page, Marc; Bernasconi, Valentina; Mattiuzzo, Giada; Dull, Peter ; Makar, Karen; Plotkin, Stanley; Knezevic, Ivana (10 avril 2021) [2021-02-23]. « Standard international de l’OMS pour l’immunoglobuline anti-SARS-CoV-2 » . Le Lancet . Organisation mondiale de la santé / Elsevier . 397 (10282): 1347–1348. doi : 10.1016/S0140-6736(21)00527-4 . PMC 7987302 . PMID 33770519 .
- ^ Knezevic, Ivana; Mattiuzzo, Giada; Page, Marc; Mineur, Philippe ; Griffiths, Elwyn; Nuebling, Micha ; Moorthy, Vasee (26 octobre 2021). « Standard international de l’OMS pour l’évaluation de la réponse anticorps aux vaccins COVID-19 : appel à une action urgente de la communauté scientifique » . Le Lancet Microbe . Organisation mondiale de la santé / Elsevier . 3 (3) : 235 e – 240 e. doi : 10.1016/S2666-5247(21)00266-4 . PMC 8547804 . PMID 34723229 .
- ^ Knezevic, Ivana (10 novembre 2021). “Webinaire de formation pour l’étalonnage des tests sérologiques quantitatifs à l’aide de l’étalon international de l’OMS pour l’immunoglobuline anti-SARS-CoV-2” (PDF) . Archivé (PDF) de l’original le 18 février 2022 . Récupéré le 5 mars 2022 . (68 pages)
Liens externes
| Wikimedia Commons a des médias liés aux anticorps . |
- Mike’s Immunoglobulin Structure/Function Page à l’Université de Cambridge
- Les anticorps comme molécule PDB du mois Discussion sur la structure des anticorps à la RCSB Protein Data Bank
- Cent ans de thérapie par anticorps Histoire et applications des anticorps dans le traitement des maladies à l’Université d’Oxford
- Comment les lymphocytes produisent des anticorps à partir de cellules vivantes !