vaccin ARNm
Un vaccin à ARNm est un type de vaccin qui utilise une copie d’une molécule appelée ARN messager (ARNm) pour produire une réponse immunitaire. [1] Le vaccin délivre des molécules d’ ARNm codant pour l’ antigène dans les cellules immunitaires , qui utilisent l’ARNm conçu comme modèle pour construire une protéine étrangère qui serait normalement produite par un agent pathogène (tel qu’un virus ) ou par une cellule cancéreuse . Ces molécules protéiques stimulent une Réponse immunitaire adaptative qui apprend au corps à identifier et à détruire l’agent pathogène ou les cellules cancéreuses correspondantes.[1] L’ARNm est délivré par une co-formulation de l’ ARN encapsulé dans des Nanoparticules lipidiques qui protègent les brins d’ARN et favorisent leur absorption dans les cellules. [2] [3]
 Transcription in vitro de l’ ARNm , activation de l’immunité innée et adaptative Vidéo montrant comment fonctionne la vaccination avec un vaccin à ARNm
Transcription in vitro de l’ ARNm , activation de l’immunité innée et adaptative Vidéo montrant comment fonctionne la vaccination avec un vaccin à ARNm
La réactogénicité , la tendance d’un vaccin à produire des effets indésirables, est similaire à celle des vaccins conventionnels sans ARN. [4] Les personnes sensibles à une réponse auto -immune peuvent avoir une réaction indésirable aux vaccins à ARN messager. [4] Les avantages des vaccins à ARNm par rapport aux vaccins traditionnels sont la facilité de conception, la rapidité et le coût de production réduit, l’induction de l’Immunité cellulaire et humorale et l’ absence d’interaction avec l’ ADN génomique . [5] [6] Alors que certains vaccins à ARN messager, comme le vaccin Pfizer–BioNTech COVID-19 , ont l’inconvénient de nécessiter un stockage ultrafroidavant la distribution, [1] d’autres vaccins à ARNm, tels que les vaccins Moderna , CureVac et Walvax COVID-19 , n’ont pas de telles exigences. [7] [8]
Dans la thérapeutique de l’ARN, les vaccins à ARN messager ont suscité un intérêt considérable en tant que vaccins COVID-19 . [1] En décembre 2020, Pfizer–BioNTech et Moderna ont obtenu l’autorisation pour leurs vaccins COVID-19 à base d’ARNm. Le 2 décembre, l’ Agence britannique de réglementation des médicaments et des produits de santé (MHRA) est devenue le premier organisme de réglementation des médicaments à approuver un vaccin à ARNm, autorisant l’utilisation généralisée du vaccin Pfizer-BioNTech. [9] [10] [11] Le 11 décembre, la Food and Drug Administration (FDA) des États-Unis a émis une autorisation d’utilisation d’urgencepour le vaccin Pfizer-BioNTech [12] [13] et une semaine plus tard a également autorisé le vaccin Moderna. [14] [15]
Histoire
Premières recherches
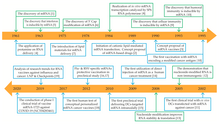
 Chronologie de certaines découvertes et avancées clés dans le développement de la technologie des médicaments à base d’ARNm.
Chronologie de certaines découvertes et avancées clés dans le développement de la technologie des médicaments à base d’ARNm.
La première transfection réussie d’ARNm conçu emballé dans une nanoparticule liposomale dans une cellule a été publiée en 1989. [16] [17] L’ARNm “nu” (ou non protégé) fabriqué en laboratoire a été injecté un an plus tard dans le muscle de souris. [3] [18] Ces études ont été la première preuve que l’ARNm transcrit in vitro avec un gène choisi était capable de fournir l’information génétique pour produire une protéine souhaitée dans le tissu cellulaire vivant [3] et ont conduit à la proposition de concept de vaccins à ARN messager . [19] [20] [21]
L’ARNm encapsulé dans des liposomes codant pour un antigène viral s’est avéré en 1993 stimuler les cellules T chez la souris. [22] [23] L’année suivante, l’ARNm auto-amplifiant a été développé en incluant à la fois un antigène viral et un gène codant pour la réplicase . [22] [24] La méthode a été utilisée chez les souris pour susciter à la fois une réponse immunitaire humorale et cellulaire contre un agent pathogène viral. [22] L’année suivante, il a été démontré que l’ARNm codant pour un antigène tumoral provoquait une réponse immunitaire similaire contre les cellules cancéreuses chez la souris. [25] [26]
Développement
Le premier essai clinique humain utilisant des cellules dendritiques ex vivo transfectées avec de l’ARNm codant pour des antigènes tumoraux ( vaccin thérapeutique à ARNm contre le cancer ) a débuté en 2001. [27] [28] Quatre ans plus tard, l’utilisation réussie de nucléosides modifiés comme méthode de transport de l’ARNm à l’intérieur cellules sans déclencher le système de défense de l’organisme a été signalé. [27] [29] Les résultats des essais cliniques d’un vaccin à ARNm directement injecté dans le corps contre les cellules cancéreuses ont été rapportés en 2008. [30] [31]
BioNTech en 2008, et Moderna en 2010, ont été fondées pour développer des biotechnologies d’ARNm. [32] [33] L’agence de recherche américaine DARPA lance à cette époque le programme de recherche en biotechnologie ADEPT pour développer des technologies émergentes pour l’ armée américaine . [34] [35] L’agence a reconnu le potentiel de la technologie des acides nucléiques pour la défense contre les pandémies et a commencé à investir dans le domaine. [34] Les subventions de la DARPA étaient considérées comme un vote de confiance qui, à son tour, encourageait d’autres agences gouvernementales et des investisseurs privés à investir dans la technologie de l’ARNm. [35]La DARPA a accordé à l’époque une subvention de 25 millions de dollars à Moderna. [36]
Les premiers essais cliniques humains utilisant un vaccin à ARNm contre un agent infectieux ( la rage ) ont commencé en 2013. [37] [38] Au cours des années suivantes, des essais cliniques de vaccins à ARNm pour un certain nombre d’autres virus ont été lancés. Les vaccins à ARNm à usage humain ont été étudiés pour des agents infectieux tels que la grippe [39] , le virus Zika , le cytomégalovirus et le Virus Chikungunya . [40] [41]
En mars 2022 , Moderna a annoncé le développement de vaccins à ARNm pour 15 maladies : Virus Chikungunya , COVID-19 , fièvre hémorragique de Crimée-Congo , dengue , maladie à virus Ebola , VIH , paludisme , maladie à virus Marburg , fièvre de Lassa , coronavirus du syndrome respiratoire du Moyen-Orient ( MERS-CoV) , Maladies Nipah et henipaviral , Fièvre de la vallée du Rift , Fièvre sévère avec syndrome de thrombocytopénie , Tuberculose et Zika .[42] [43]
Accélération
La pandémie de COVID-19 et le séquençage du virus causal SARS-CoV-2 au début de 2020 ont conduit au développement rapide des premiers vaccins à ARNm approuvés. [44] [45] BioNTech et Moderna ont obtenu en décembre de la même année l’approbation de leurs vaccins COVID-19 à base d’ARNm . Le 2 décembre, sept jours après son dernier essai de huit semaines, l’ Agence britannique de réglementation des médicaments et des produits de santé (MHRA) est devenue le premier organisme mondial de réglementation des médicaments de l’histoire à approuver un vaccin à ARNm, accordant une autorisation d’urgence pour le BNT162b2 COVID-19 de Pfizer-BioNTech. vaccin à usage généralisé. [9] [10] [46]Le 11 décembre, la FDA a donné une autorisation d’utilisation d’urgence pour le vaccin Pfizer-BioNTech COVID-19 et une semaine plus tard une approbation similaire pour le vaccin Moderna COVID-19 . [47] D’autres vaccins à ARNm ont continué à être développés.
| Fabricant principal | Pays | Amplification | Phase clinique |
|---|---|---|---|
| Walvax Biotechnologie | Chine | Rien | 3 (amplificateur) |
| Gênes Bio* | Inde | Soi | 2/3 (comparateur) |
| Biotechnologie Vinbiocare** | Viêt Nam | Soi | 1/2/3 (comparateur) |
| Daiichi Sankyo | Japon | Rien | 1/2/3 (amplificateur) |
| BioNe-Asie | Thaïlande | Rien | 2 |
| Providence Thérapeutique | Canada | Rien | 2 |
| Thérapeutique Arcturus** | États-Unis | Soi | 2 |
| Elixirgen Thérapeutique | États-Unis | Soi | 1/2 |
| EyeGene | Corée du Sud | Rien | 1/2 |
| Thérapeutique Stemirna | Chine | Rien | 1/2 |
| Groupe de vaccins AIM | Chine | Inconnue | 1/2 |
| HDT Bio* | États-Unis | Soi | 1 |
| GlaxoSmithKline (GSK) | États-Unis | Soi | 1 |
| Thérapeutique VLP | Japon | Soi | 1 |
| collège impérial de Londres | Angleterre | Soi | 1 |
| Meule Bio | Angleterre | Soi | 1 (amplificateur) |
| Université de Melbourne | Australie | Rien | 1 (amplificateur) |
| CureVac/GSK | Allemagne | Rien | 1 |
*/** indique une technologie partagée
Mécanisme

 Une illustration du mécanisme d’action d’un vaccin à ARN messager
Une illustration du mécanisme d’action d’un vaccin à ARN messager
Le but d’un vaccin est de stimuler le système immunitaire adaptatif pour créer des anticorps qui ciblent précisément ce pathogène particulier . Les marqueurs sur l’agent pathogène que les anticorps ciblent sont appelés antigènes . [49]
Les vaccins traditionnels stimulent une réponse anticorps en injectant soit des antigènes , un Virus atténué (affaibli), un virus inactivé (mort) ou un vecteur viral recombinant codant pour l’antigène (virus porteur inoffensif avec un transgène antigène ) dans le corps. Ces antigènes et virus sont préparés et cultivés à l’extérieur du corps. [50] [51]
En revanche, les vaccins à ARNm introduisent un fragment de courte durée [52] créé synthétiquement de la séquence d’ARN d’un virus chez l’individu vacciné. Ces fragments d’ARNm sont absorbés par les cellules dendritiques par phagocytose . [53] Les cellules dendritiques utilisent leur machinerie interne ( ribosomes ) pour lire l’ARNm et produire les antigènes viraux que l’ARNm code. [4] Le corps dégrade les fragments d’ARNm quelques jours après leur introduction. [54]Bien que les cellules non immunitaires puissent potentiellement aussi absorber l’ARNm du vaccin, produire des antigènes et afficher les antigènes sur leurs surfaces, les cellules dendritiques absorbent les globules d’ARNm beaucoup plus facilement. [55] Les fragments d’ARNm sont traduits dans le cytoplasme et n’affectent pas l’ADN génomique du corps, situé séparément dans le noyau cellulaire . [1] [56]
Une fois que les antigènes viraux sont produits par la cellule hôte, les processus normaux du système immunitaire adaptatif sont suivis. Les antigènes sont décomposés par les Protéasomes . Les molécules du CMH de classe I et de classe II se fixent ensuite à l’antigène et le transportent vers la membrane cellulaire, « activant » la cellule dendritique. [56] Une fois activées, les cellules dendritiques migrent vers les ganglions lymphatiques , où elles présentent l’antigène aux cellules T et aux cellules B. [57] Cela déclenche la production d’anticorps spécifiquement ciblés sur l’antigène, entraînant finalement une immunité . [49]
ARNm

 Composants d’ARNm importants pour l’expression de la séquence antigénique
Composants d’ARNm importants pour l’expression de la séquence antigénique
Le composant central d’un vaccin à ARNm est sa construction d’ARNm. [58] L’ ARNm transcrit in vitro est généré à partir d’un ADN plasmidique modifié, qui a un promoteur d’ARN polymérase et une séquence qui correspond à la construction d’ARNm. En combinant l’ ARN polymérase du phage T7 et l’ADN plasmidique, l’ARNm peut être transcrit en laboratoire. L’efficacité du vaccin dépend de la stabilité et de la structure de l’ARNm conçu. [4]
L’ ARNm transcrit in vitro a les mêmes composants structurels que l’ARNm naturel dans les cellules eucaryotes . Il a une coiffe en 5′ , une région non traduite en 5′ (UTR) et 3′-UTR , un cadre de lecture ouvert (ORF), qui code l’antigène pertinent, et une queue en 3′-poly(A) . En modifiant ces différents composants de l’ARNm synthétique, la stabilité et la capacité de traduction de l’ARNm peuvent être améliorées et, par conséquent, l’efficacité du vaccin améliorée. [58]
L’ARNm peut être amélioré en utilisant des analogues synthétiques de la coiffe 5′ qui améliorent la stabilité et augmentent la traduction des protéines. De même, les éléments régulateurs dans la région non traduite en 5′ et la région non traduite en 3′ peuvent être modifiés, et la longueur de la Queue Poly(A) optimisée, pour stabiliser l’ARNm et augmenter la production de protéines. Les nucléotides d’ ARNm peuvent être modifiés pour à la fois diminuer l’activation immunitaire innée et augmenter la demi-vie de l’ARNm dans la cellule hôte. La séquence d’acide nucléique et l’ utilisation des codons ont un impact sur la traduction des protéines. Enrichissement de la séquence avec une teneur en guanine-cytosineaméliore la stabilité et la demi-vie de l’ARNm et, par conséquent, la production de protéines. Le remplacement de codons rares par des codons synonymes fréquemment utilisés par la cellule hôte améliore également la production de protéines. [4]
Livraison

 Principales méthodes d’administration et molécules porteuses pour les vaccins à ARNm
Principales méthodes d’administration et molécules porteuses pour les vaccins à ARNm
Pour qu’un vaccin réussisse, suffisamment d’ARNm doit pénétrer dans le cytoplasme de la cellule hôte pour stimuler la production des antigènes spécifiques. L’entrée des molécules d’ARNm, cependant, se heurte à un certain nombre de difficultés. Non seulement les molécules d’ARNm sont trop grandes pour traverser la membrane cellulaire par simple diffusion , mais elles sont également chargées négativement comme la membrane cellulaire, ce qui provoque une répulsion électrostatique mutuelle . De plus, l’ARNm est facilement dégradé par les ARNases dans la peau et le sang. [56]
Diverses méthodes ont été développées pour surmonter ces obstacles à la livraison. Le procédé d’administration du vaccin peut être largement classé selon que le transfert d’ARNm dans les cellules se produit à l’intérieur ( in vivo ) ou à l’extérieur ( ex vivo ) de l’organisme. [56] [3]
Ex vivo
Les cellules dendritiques affichent des antigènes sur leurs surfaces , conduisant à des interactions avec les cellules T pour initier une réponse immunitaire. Les cellules dendritiques peuvent être prélevées sur les patients et programmées avec l’ARNm souhaité, puis réinjectées aux patients pour créer une réponse immunitaire. [59]
La façon la plus simple dont les cellules dendritiques ex vivo absorbent les molécules d’ARNm est l’ endocytose , une voie assez inefficace en laboratoire qui peut être considérablement améliorée par l’électroporation . [56]
Invivo
Depuis la découverte que l’administration directe d’ ARNm transcrit in vitro conduit à l’expression d’antigènes dans le corps, des approches in vivo ont été étudiées. [18] Ils offrent certains avantages par rapport aux méthodes ex vivo , notamment en évitant le coût de récolte et d’adaptation des cellules dendritiques des patients et en imitant une infection régulière. [56]
Différentes voies d’ injection , telles que dans la peau , le sang ou les muscles , entraînent des niveaux variables d’absorption d’ARNm, faisant du choix de la voie d’administration un aspect critique de l’administration in vivo . Une étude a montré, en comparant différentes voies, que l’injection dans les ganglions lymphatiques conduit à la plus grande réponse des lymphocytes T. [60]
Injection d’ARNm nu
L’injection d’ARNm nu signifie que l’ administration du vaccin se fait uniquement dans une solution tampon . [61] Ce mode d’absorption d’ARNm est connu depuis les années 1990. [18] Les premières études cliniques mondiales ont utilisé des injections intradermiques d’ARNm nu pour la vaccination. [62] [63] Une variété de méthodes ont été utilisées pour délivrer l’ARNm nu, comme les injections sous-cutanées, intraveineuses et intratumorales. Bien que la délivrance d’ARNm nu provoque une réponse immunitaire, l’effet est relativement faible et, après injection, l’ARNm est souvent rapidement dégradé. [56]
Vecteurs polymères et peptidiques
Les polymères cationiques peuvent être mélangés avec de l’ARNm pour générer des revêtements protecteurs appelés polyplexes . Ceux-ci protègent l’ARNm recombinant des ribonucléases et facilitent sa pénétration dans les cellules. La protamine est un peptide cationique naturel et a été utilisée pour encapsuler l’ARNm pour la vaccination. [64] [ source non primaire nécessaire ] [65]
Vecteur de Nanoparticules lipidiques 
 Assemblage de Nanoparticules lipidiques d’ARN
Assemblage de Nanoparticules lipidiques d’ARN
La première fois que la FDA a approuvé l’utilisation de Nanoparticules lipidiques comme système d’administration de médicaments, c’était en 2018, lorsque l’agence a approuvé le premier médicament à base d’ ARNsi , Onpattro . [66] L’encapsulation de la molécule d’ARNm dans des Nanoparticules lipidiques a été une percée critique pour la production de vaccins à ARNm viables, résolvant un certain nombre d’obstacles techniques clés dans la délivrance de la molécule d’ARNm dans la cellule hôte. [66] [67] La recherche sur l’utilisation des lipides pour délivrer l’ARNsi aux cellules est devenue une base pour une recherche similaire sur l’utilisation des lipides pour délivrer l’ARNm. [68] Cependant, de nouveaux lipides ont dû être inventés pour encapsuler les brins d’ARNm, qui sont beaucoup plus longs que les brins d’ARNsi. [68]
Principalement, le lipide fournit une couche de protection contre la dégradation, permettant une sortie traductionnelle plus robuste. De plus, la personnalisation de la couche externe du lipide permet le ciblage des types de cellules souhaités par le biais d’interactions ligand . Cependant, de nombreuses études ont également mis en évidence la difficulté d’étudier ce type de délivrance, démontrant qu’il existe une incohérence entre les applications in vivo et in vitro des nanoparticules en termes d’apport cellulaire. [69] Les nanoparticules peuvent être administrées au corps et transportées par de multiples voies, comme par voie intraveineuse ou par le système lymphatique . [66]
Un problème avec les Nanoparticules lipidiques est que plusieurs des percées menant à l’utilisation pratique de cette technologie impliquent l’utilisation de la microfluidique . Les chambres de réaction microfluidiques sont difficiles à mettre à l’échelle, car tout l’intérêt de la microfluidique est d’exploiter les comportements à l’échelle microscopique des liquides. Le seul moyen de contourner cet obstacle est de faire fonctionner un grand nombre de chambres de réaction microfluidiques en parallèle, une nouvelle tâche nécessitant un équipement sur mesure. [70] [71] Pour les vaccins à ARNm COVID-19, c’était le principal goulot d’étranglement de la fabrication. Pfizer a utilisé une telle approche parallèle pour résoudre le problème de mise à l’échelle. Après avoir vérifié que les mélangeurs à jet d’impact ne pouvaient pas être directement mis à l’échelle, [72]Pfizer a fabriqué environ 100 des petits mélangeurs (chacun de la taille d’une pièce d’un demi-dollar américain ), les a connectés ensemble avec des pompes et des filtres avec un “labyrinthe de tuyauterie” [73] [74] et a mis en place un système informatique pour réguler le débit et la pression à travers les mélangeurs. [72]
Un autre problème, avec l’utilisation à grande échelle de cette méthode de livraison, est la disponibilité des nouveaux lipides utilisés pour créer des Nanoparticules lipidiques, en particulier des lipides cationiques ionisables. Avant 2020, ces lipides étaient fabriqués en petites quantités mesurées en grammes ou en kilogrammes, et ils étaient utilisés pour la recherche médicale et une poignée de médicaments pour des maladies rares. Alors que la sécurité et l’efficacité des vaccins à ARNm sont devenues claires en 2020, les quelques entreprises capables de fabriquer les lipides requis ont été confrontées au défi d’augmenter la production pour répondre aux commandes de plusieurs tonnes de lipides. [71] [75]
Vecteur viral
En plus des méthodes de délivrance non virales, les virus à ARN ont été conçus pour obtenir des réponses immunologiques similaires. Les virus à ARN typiques utilisés comme vecteurs comprennent les rétrovirus , les lentivirus , les alphavirus et les rhabdovirus , chacun pouvant différer par sa structure et sa fonction. [76] Des études cliniques ont utilisé ces virus sur une gamme de maladies chez des animaux modèles tels que des souris , des poulets et des primates . [77] [78] [79]
Avantages
Vaccins traditionnels
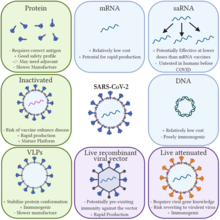
 Avantages et inconvénients des différents types de plateformes vaccinales
Avantages et inconvénients des différents types de plateformes vaccinales
Les vaccins à ARNm offrent des avantages spécifiques par rapport aux vaccins traditionnels . [4] [5] Parce que les vaccins à ARNm ne sont pas construits à partir d’un agent pathogène actif (ou même d’un agent pathogène inactivé), ils ne sont pas infectieux. En revanche, les vaccins traditionnels nécessitent la production d’agents pathogènes, ce qui, s’il est effectué à des volumes élevés, pourrait augmenter les risques d’épidémies localisées du virus sur le site de production. [5] Un autre avantage biologique des vaccins à ARNm est que puisque les antigènes sont produits à l’intérieur de la cellule, ils stimulent l’Immunité cellulaire , ainsi que l’immunité humorale . [6] [80]
Les vaccins à ARNm ont l’avantage de pouvoir être conçus rapidement. Moderna a conçu son vaccin ARNm-1273 contre le COVID-19 en 2 jours. [81] Ils peuvent également être fabriqués plus rapidement, à moindre coût et de manière plus standardisée (avec moins de taux d’erreur dans la production), ce qui peut améliorer la réactivité aux épidémies graves. [4] [5]
Le vaccin Pfizer-BioNTech nécessitait à l’origine 110 jours pour être produit en masse (avant que Pfizer ne commence à optimiser le processus de fabrication à seulement 60 jours), ce qui était nettement plus rapide que les vaccins traditionnels contre la grippe et la poliomyélite. [73] Dans ce délai plus long, le temps de production réel n’est que d’environ 22 jours : deux semaines pour le clonage moléculaire des plasmides d’ADN et la purification de l’ADN, quatre jours pour la transcription ADN-ARN et la purification de l’ARNm, et quatre jours pour encapsuler ARNm dans des Nanoparticules lipidiques suivi d’ un remplissage et d’une finition . [82] La majorité des jours nécessaires à chaque cycle de production sont alloués à un contrôle qualité rigoureux à chaque étape. [73]
vaccins à ADN
En plus de partager les avantages des vaccins à ADN théoriques par rapport aux vaccins traditionnels établis , les vaccins à ARNm présentent également des avantages supplémentaires par rapport aux vaccins à ADN. L’ ARNm est traduit dans le cytosol , il n’est donc pas nécessaire que l’ARN pénètre dans le noyau cellulaire et le risque d’être intégré dans le génome de l’hôte est évité. [3] Des nucléosides modifiés (par exemple, des pseudouridines , des nucléosides 2′-O-méthylés) peuvent être incorporés à l’ARNm pour supprimer la réponse immunitairestimulation pour éviter une dégradation immédiate et produire un effet plus persistant grâce à une capacité de traduction accrue. [29] [83] [84] Le cadre de lecture ouvert (ORF) et les régions non traduites (UTR) de l’ARNm peuvent être optimisés à différentes fins (un processus appelé ingénierie de séquence de l’ARNm), par exemple en enrichissant la teneur en guanine-cytosine ou choisir des UTR spécifiques connus pour augmenter la traduction. [53] Un ORF supplémentaire codant pour un mécanisme de réplication peut être ajouté pour amplifier la traduction de l’antigène et donc la réponse immunitaire, en diminuant la quantité de matériel de départ nécessaire. [85] [86]
Désavantages
Stockage
Parce que l’ARNm est fragile, certains vaccins doivent être conservés à des températures très basses pour éviter de se dégrader et donc de donner peu d’immunité efficace au receveur. Le vaccin à ARNm BNT162b2 de Pfizer-BioNTech doit être conservé entre -80 et -60 ° C (-112 et -76 ° F). [87] [88] Moderna dit que son vaccin ARNm-1273 peut être conservé entre −25 et −15 °C (−13 et 5 °F), [89] ce qui est comparable à un congélateur domestique, [88] et qu’il reste stable entre 2 et 8 °C (36 et 46 °F) jusqu’à 30 jours. [89] [90] En novembre 2020, Natureont rapporté : “Bien qu’il soit possible que des différences dans les formulations de LNP ou les structures secondaires de l’ARNm puissent expliquer les différences de thermostabilité [entre Moderna et BioNtech], de nombreux experts soupçonnent que les deux produits vaccinaux se révéleront finalement avoir des exigences de stockage et des durées de conservation similaires dans diverses conditions de température. ” [80] Plusieurs plates-formes sont à l’étude qui pourraient permettre un stockage à des températures plus élevées. [4]
Récent
Avant 2020, aucune plateforme technologique d’ARNm (médicament ou vaccin) n’avait été autorisée pour une utilisation chez l’homme, il y avait donc un risque d’effets inconnus. [80] La pandémie de COVID-19 de 2020 a nécessité une capacité de production plus rapide des vaccins à ARNm, les a rendus attrayants pour les organisations nationales de santé et a conduit à un débat sur le type d’autorisation initiale que les vaccins à ARNm devraient obtenir (y compris l’autorisation d’utilisation d’urgence ou l’autorisation d’accès élargi ) après la période de huit semaines d’essais sur l’homme post-finale. [91] [92]
Effets secondaires
La réactogénicité est similaire à celle des vaccins conventionnels sans ARN. Cependant, les personnes sensibles à une réponse auto -immune peuvent avoir une réaction indésirable aux vaccins à ARNm. [4] Les brins d’ARNm du vaccin peuvent déclencher une réaction immunitaire involontaire – cela implique que le corps se croit malade et que la personne se sent comme si elle l’était. Pour minimiser cela, les séquences d’ARNm dans les vaccins à ARNm sont conçues pour imiter celles produites par les cellules hôtes. [5]
Des effets réactogènes forts mais transitoires ont été signalés dans les essais de nouveaux vaccins à ARNm COVID-19 ; la plupart des gens ne ressentiront pas d’effets secondaires graves, notamment de la fièvre et de la fatigue. Les effets secondaires graves sont définis comme ceux qui empêchent l’activité quotidienne. [93]
Efficacité
Les vaccins à ARNm COVID-19 de Moderna et Pfizer-BioNTech ont des taux d’efficacité de 90 à 95 %. Avant l’ARNm, les essais de médicaments sur des agents pathogènes autres que le COVID-19 n’étaient pas efficaces et ont dû être abandonnés dans les premières phases des essais. La raison de l’efficacité des nouveaux vaccins à ARNm n’est pas claire. [94]
La médecin-chercheuse Margaret Liu a déclaré que l’efficacité des nouveaux vaccins à ARNm COVID-19 pourrait être due au “volume considérable de ressources” qui ont été mises au point, ou que les vaccins pourraient “déclencher une réponse inflammatoire non spécifique à l’ARNm qui pourrait renforcer sa réponse immunitaire spécifique, étant donné que la technique des nucléosides modifiés a réduit l’inflammation mais ne l’a pas complètement éliminée », et que « cela peut également expliquer les réactions intenses telles que les courbatures et les fièvres signalées chez certains receveurs de l’ARNm SARS-CoV- 2 vaccins”. Ces réactions, bien que graves, étaient transitoires et un autre point de vue est qu’elles étaient considérées comme une réaction aux molécules lipidiques d’administration de médicaments. [94]
Hésitation
Il existe une désinformation impliquant que les vaccins à ARNm pourraient altérer l’ADN dans le noyau. [95] L’ARNm dans le cytosol est très rapidement dégradé avant d’avoir le temps de pénétrer dans le noyau cellulaire. En fait, les vaccins à ARNm doivent être stockés à très basse température pour éviter la dégradation de l’ARNm. Le rétrovirus peut être un ARN simple brin (tout comme le vaccin SARS-CoV-2 est un ARN simple brin) qui pénètre dans le noyau cellulaire et utilise la transcriptase inverse pour fabriquer de l’ADN à partir de l’ARN dans le noyau cellulaire. Un rétrovirus a des mécanismes pour être importé dans le noyau, mais d’autres ARNm n’ont pas ces mécanismes. Une fois à l’intérieur du noyau, la création d’ADN à partir d’ARN ne peut se produire sans une amorce, qui accompagne un rétrovirus, mais qui n’existerait pas pour d’autres ARNm s’il était placé dans le noyau. [96]
Amplification
Les vaccins à ARNm utilisent soit de l’ARNm non amplificateur (conventionnel), soit de l’ARNm auto-amplificateur. [97] Les vaccins Pfizer–BioNTech et Moderna utilisent de l’ARNm non amplificateur. Les deux types d’ARNm continuent d’être étudiés en tant que méthodes vaccinales contre d’autres agents pathogènes potentiels et le cancer. [30]
Non amplificateur

 Mécanisme des vaccins à ARNm non amplifiants et auto-amplifiants
Mécanisme des vaccins à ARNm non amplifiants et auto-amplifiants
Les premiers vaccins à ARNm utilisent une construction d’ARNm non amplifiante. [65] L’ARNm non amplifiant n’a qu’un seul cadre de lecture ouvert qui code pour l’antigène d’intérêt. [97] La quantité totale d’ARNm disponible pour la cellule est égale à la quantité délivrée par le vaccin. La force du dosage est limitée par la quantité d’ARNm qui peut être délivrée par le vaccin. [98] Les vaccins non amplifiants remplacent l’ uridine par la N1-méthylpseudouridine dans le but de réduire la toxicité. [48]
Auto-amplification
Les vaccins à ARNm auto-amplifiés (ARNa) répliquent leur ARNm après transfection. [99] L’ARNm auto-amplifié a deux cadres de lecture ouverts . Le premier cadre, comme l’ARNm classique, code pour l’antigène d’intérêt. La deuxième trame code pour une ARN polymérase dépendante de l’ARN (et ses protéines auxiliaires) qui réplique la construction d’ARNm dans la cellule. Cela permet de plus petites doses de vaccin. [99] Les mécanismes et par conséquent l’évaluation de l’ARNm auto-amplifié peuvent être différents, car l’ARNm auto-amplifié est une molécule beaucoup plus grosse. [3]
Les vaccins SaRNA faisant l’objet de recherches comprennent un vaccin contre le paludisme . [100] Gritstone bio a lancé en 2021 un essai de phase 1 d’un vaccin saRNA COVID-19, utilisé comme vaccin de rappel . Le vaccin est conçu pour cibler à la fois la protéine de pointe du virus SARS‐CoV‐2 et les protéines virales qui peuvent être moins sujettes aux variations génétiques, afin de fournir une meilleure protection contre les variantes du SARS‐CoV‐2. [101] [102] les vaccins saRNA doivent utiliser l’uridine, qui est nécessaire pour que la reproduction se produise. [48]
Voir également
- vaccin ADN
- ARN messager modifié par les nucléosides
- Thérapeutique ARN
- Chronologie des vaccins humains
Références
- ^ un bcde Park KS , Sun X, Aikins ME, Moon JJ (décembre 2020). “Systèmes d’administration de vaccins COVID-19 non viraux” . Examens avancés de l’administration de médicaments . 169 : 137–51. doi : 10.1016/j.addr.2020.12.008 . PMC 7744276 . PMID 33340620 .
- ^ Kowalski PS, Rudra A, Miao L, Anderson DG (avril 2019). « Livrer le messager : Progrès dans les technologies pour la livraison thérapeutique d’ARNm » . Mol Thér . 27 (4): 710–28. doi : 10.1016/j.ymthe.2019.02.012 . PMC 6453548 . PMID 30846391 .
- ^ un bcdef Verbeke R , Lentacker I, De Smedt SC, Dewitte H (octobre 2019). “Trois décennies de développement de vaccins à ARN messager” . Nano aujourd’hui . 28 : 100766. doi : 10.1016/j.nantod.2019.100766 . manche : 1854/LU-8628303 . S2CID 202221207 . Archivé de l’original le 11 janvier 2021 . Récupéré le 8 décembre 2020 .
- ^ un bcdefghi Pardi N , Hogan MJ , Porter FW , Weissman D (avril 2018). “Les vaccins à ARNm – une nouvelle ère en vaccinologie” . La nature examine la découverte de médicaments . 17 (4): 261–279. doi : 10.1038/nrd.2017.243 . ISSN 1474-1784 . PMC 5906799 . PMID 29326426 .
- ^ un bcd Fondation PHG ( 2019 ). “Vaccins à ARN : une introduction” . Université de Cambridge . Archivé de l’original le 6 décembre 2018 . Récupéré le 18 novembre 2020 .
- ^ un b Kramps T, Aînés K (2017). “Introduction aux vaccins à ARN”. Vaccins à ARN : méthodes et protocoles . Méthodes en biologie moléculaire. Vol. 1499. p. 1–11. doi : 10.1007/978-1-4939-6481-9_1 . ISBN 978-1-4939-6479-6. PMID 27987140 .
- ^ Crommelin DJ, Anchordoquy TJ, Volkin DB, Jiskoot W, Mastrobattista E (mars 2021). “Aborder la froide réalité de la stabilité des vaccins à ARNm” . Journal des sciences pharmaceutiques . 110 (3): 997–1001. doi : 10.1016/j.xphs.2020.12.006 . ISSN 0022-3549 . PMC 7834447 . PMID 33321139 .
- ^ “Le Mexique va commencer un essai clinique de stade avancé pour le vaccin ARNm COVID-19 de la Chine” . Reuters . 11 mai 2021. Archivé de l’original le 23 août 2021 . Récupéré le 19 août 2021 .
- ^ un b “Le Royaume-Uni autorise le vaccin Pfizer / BioNTech COVID-19” (Communiqué de presse). Département de la santé et de l’aide sociale . 2 décembre 2020. Archivé de l’original le 2 décembre 2020 . Récupéré le 2 décembre 2020 .
- ^ un b Boseley S, Halliday J (2 décembre 2020). “Le Royaume-Uni approuve le vaccin Pfizer/BioNTech Covid pour un déploiement la semaine prochaine” . Le Gardien . Archivé de l’original le 2 décembre 2020 . Récupéré le 2 décembre 2020 .
- ^ “Conditions d’autorisation pour le vaccin Pfizer / BioNTech COVID-19” (Décision). Agence de réglementation des médicaments et des produits de santé. 8 décembre 2020. Archivé de l’original le 7 décembre 2020 . Récupéré le 10 décembre 2020 .
- ^ “La FDA prend des mesures clés dans la lutte contre le COVID-19 en délivrant une autorisation d’utilisation d’urgence pour le premier vaccin COVID-19″ . Food and Drug Administration (FDA) des États-Unis (Communiqué de presse). 11 décembre 2020. Archivé de l’original le 31 janvier 2021 . Récupéré le 6 février 2021 .
- ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (Décembre 2020). “Recommandation provisoire du Comité consultatif sur les pratiques d’immunisation pour l’utilisation du vaccin Pfizer-BioNTech COVID-19 – États-Unis, décembre 2020” (PDF) . MMWR Morb Mortal Wkly Rep . 69 (50): 1922–24. doi : 10.15585/mmwr.mm6950e2 . PMC 7745957 . PMID 33332292 . Archivé (PDF) de l’original le 19 décembre 2020 . Récupéré le 7 février 2021 .
- ^ “La FDA prend des mesures supplémentaires dans la lutte contre le COVID-19 en délivrant une autorisation d’utilisation d’urgence pour le deuxième vaccin COVID-19″ . Food and Drug Administration (FDA) des États-Unis (Communiqué de presse). 18 décembre 2020. Archivé de l’original le 19 décembre 2020 . Récupéré le 21 décembre 2020 .
- ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (janvier 2021). “Recommandation provisoire du Comité consultatif sur les pratiques de vaccination pour l’utilisation du vaccin Moderna COVID-19 – États-Unis, décembre 2020” (PDF) . MMWR Morb Mortal Wkly Rep . 69 (5152): 1653–56. doi : 10.15585/mmwr.mm695152e1 . PMID 33382675 . S2CID 229945697 . Archivé (PDF) de l’original le 9 février 2021 . Récupéré le 7 février 2021 .
- ^ Xu S, Yang K, Li R, Zhang L (septembre 2020). “Mécanismes de l’ère des vaccins à ARNm, plateforme de médicaments et prospection clinique” . Journal international des sciences moléculaires . 21 (18) : 6582. doi : 10.3390/ijms21186582 . PMC 7554980 . PMID 32916818 . Initiation de la transfection d’ARNm médiée par des lipides cationiques ; Proposition de concept de médicaments à base d’ARNm
- ^ Malone RW , Felgner PL , Verma IM (août 1989). “Transfection d’ARN médiée par les liposomes cationiques” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 86 (16): 6077–81. Bibcode : 1989PNAS…86.6077M . doi : 10.1073/pnas.86.16.6077 . PMC 297778 . PMID 2762315 .
- ^ un bc Wolff JA , Malone RW , Williams P, Chong W, Acsadi G, Jani A, Felgner PL (mars 1990). “Transfert direct de gènes dans le muscle de souris in vivo”. Sciences . 247 (4949 Pt 1): 1465–8. Bib code : 1990Sci …247.1465W . doi : 10.1126/science.1690918 . PMID 1690918 .
- ^ Mai M (31 mai 2021). “Après les succès de COVID-19, les chercheurs poussent à développer des vaccins à ARNm pour d’autres maladies” . Nature . Archivé de l’original le 13 octobre 2021 . Récupéré le 31 juillet 2021 . Lorsque la large gamme de vaccins contre le COVID-19 a été testée dans des essais cliniques, seuls quelques experts s’attendaient à ce que la technologie non éprouvée de l’ARNm soit la star. En 10 mois, les vaccins à ARNm étaient à la fois les premiers à être approuvés et les plus efficaces. Bien qu’il s’agisse des premiers vaccins à ARNm à être approuvés, l’histoire des vaccins à ARNm commence il y a plus de 30 ans, avec de nombreux obstacles en cours de route. En 1990, le regretté médecin-chercheur Jon Wolff et ses collègues de l’Université du Wisconsin ont injecté de l’ARNm à des souris, ce qui a amené les cellules des souris à produire les protéines codées. À bien des égards, ce travail a servi de première étape vers la fabrication d’un vaccin à partir d’ARNm, mais il y avait un long chemin à parcourir – et il y en a encore, pour de nombreuses applications.
- ^ Xu S, Yang K, Li R, Zhang L (septembre 2020). “Mécanismes de l’ère des vaccins à ARNm, plateforme de médicaments et prospection clinique” . Journal international des sciences moléculaires . 21 (18) : 6582. doi : 10.3390/ijms21186582 . PMC 7554980 . PMID 32916818 . Proposition de concept de vaccins à ARNm (1990)
- ^ Brevet : WO1990011092 Archivé le 14 octobre 2021 à la Wayback Machine ; Inventeurs : Philip L. Felgner, Jon Asher Wolff, Gary H. Rhodes, Robert Wallace Malone, Dennis A. Carson ; Cessionnaires : Vical Inc., Wisconsin Alumni Research Foundation ; Titre : « Expression de séquences polynucléotidiques exogènes chez un vertébré Archivé le 9 décembre 2021 à la Wayback Machine”; (Citation : “La présente invention concerne l’introduction de séquences d’ADN et d’ARN nus dans un vertébré pour obtenir l’expression contrôlée d’un polypeptide. Elle est utile en thérapie génique, en vaccination et dans toute situation thérapeutique dans laquelle un polypeptide doit être administré à cellules in vivo » ; Exemple 8 : vaccination par ARNm de souris pour produire la protéine gpl20 du virus VIH) ; Date de priorité : 21 mars 1989 ; Date de publication : 1990-10-04.
- ^ un bc Pascolo S (août 2004). “Vaccins à base d’ARN messager”. Avis d’expert sur la thérapie biologique . 4 (8) : 1285–1294. doi : 10.1517/14712598.4.8.1285 . PMID 15268662 . S2CID 19350848 .
- ^ Martinon F, Krishnan S, Lenzen G, Magné R, Gomard E, Guillet JG, et al. (juillet 1993). “Induction de lymphocytes T cytotoxiques spécifiques au virus in vivo par l’ARNm piégé dans les liposomes”. Journal européen d’immunologie . 23 (7) : 1719–1722. doi : 10.1002/eji.1830230749 . PMID 8325342 . S2CID 42640967 .
- ^ Zhou X, Berglund P, Rhodes G, Parker SE, Jondal M, Liljeström P (décembre 1994). “L’ARN du virus de la forêt de Semliki auto-répliquant comme vaccin recombinant”. Vaccin . 12 (16): 1510–14. doi : 10.1016/0264-410x(94)90074-4 . PMID 7879415 .
- ^ Kallen KJ, Theß A (janvier 2014). “Un développement qui pourrait évoluer vers une révolution en médecine : l’ARNm comme base de nouveaux vaccins et médicaments à base de nucléotides” . Progrès thérapeutiques dans les vaccins . 2 (1): 10–31. doi : 10.1177/2051013613508729 . PMC 3991152 . PMID 24757523 .
- ^ Conry RM, LoBuglio AF, Wright M, Sumerel L, Pike MJ, Johanning F, et al. (Avril 1995). “Caractérisation d’un vecteur de vaccin polynucléotide à ARN messager”. Recherche sur le cancer . 55 (7): 1397–400. PMID 7882341 .
- ^ un b Sahin U, Karikó K, Türeci Ö (octobre 2014). “Thérapeutique à base d’ARNm – développement d’une nouvelle classe de médicaments” . La nature examine la découverte de médicaments . 13 (10): 759–80. doi : 10.1038/nrd4278 . ISSN 1474-1784 . PMID 25233993 .
- ^ Heiser A, Coleman D, Dannull J, Yancey D, Maurice MA, Lallas CD, et al. (février 2002). “Les cellules dendritiques autologues transfectées avec l’ARN de l’antigène spécifique de la prostate stimulent les réponses CTL contre les tumeurs métastatiques de la prostate” . Le Journal d’investigation clinique . 109 (3): 409–17. doi : 10.1172/JCI14364 . ISSN 0021-9738 . PMC 150859 . PMID 11828001 .
- ^ un b Karikó K , Buckstein M, Ni H, Weissman D (août 2005). “Suppression de la reconnaissance de l’ARN par les récepteurs de type Toll : l’impact de la modification des nucléosides et l’origine évolutive de l’ARN” . Immunité . 23 (2): 165–75. doi : 10.1016/j.immuni.2005.06.008 . PMID 16111635 .
- ^ un b Blakney AK, Ip S, Geall AJ (janvier 2021). “Une mise à jour sur le développement de vaccins à ARNm auto-amplifiés” . Vaccins (Bâle) . 9 (2): 97. doi : 10.3390/vaccines9020097 . PMC 7911542 . PMID 33525396 .
- ^ Weide B, Carralot JP, Reese A, Scheel B, Eigentler TK, Hoerr I, et al. (février-mars 2008). “Résultats du premier essai de vaccination clinique de phase I / II avec injection directe d’ARNm”. Journal d’immunothérapie . 31 (2) : 180–8. doi : 10.1097/CJI.0b013e31815ce501 . PMID 18481387 . S2CID 8233422 .
- ^ “Les fondateurs de BioNTech : couple de scientifiques sous les projecteurs mondiaux” . France 24 . 13 novembre 2020. Archivé de l’original le 14 février 2021 . Récupéré le 31 juillet 2021 .
- ^ Gare D (10 novembre 2020). “L’histoire de l’ARNm : comment une idée autrefois rejetée est devenue une technologie de pointe dans la course aux vaccins Covid” . Statistique . Archivé de l’original le 10 novembre 2020 . Récupéré le 16 novembre 2020 .
- ^ un b Sonne P (30 juillet 2020). “Comment une agence secrète du Pentagone a semé le terrain pour une guérison rapide du coronavirus” . Le Washington Post . Archivé de l’original le 2 août 2021 . Récupéré le 21 juin 2021 .
- ^ un b Usdin S (19 mars 2020). “Les paris de la DARPA auraient pu créer les meilleurs espoirs pour arrêter le COVID-19” . BioCentury . Archivé de l’original le 18 juin 2021 . Récupéré le 19 juin 2021 .
- ^ “La DARPA attribue à Moderna Therapeutics une subvention allant jusqu’à 25 millions de dollars pour développer la thérapeutique de l’ARN messager” . 2 octobre 2013. Archivé de l’original le 2 juin 2021 . Récupéré le 31 mai 2021 .
- ^ Dolgin E (septembre 2021). “L’histoire enchevêtrée des vaccins à ARNm”. Nature . 597 (7876): 318–24. Bibcode : 2021Natur.597..318D . doi : 10.1038/d41586-021-02483-w . ISSN 0028-0836 . PMID 34522017 . S2CID 237515383 .
- ^ Alberer M, Gnad-Vogt U, Hong HS, Mehr KT, Backert L, Finak G, et al. (septembre 2017). “Sécurité et immunogénicité d’un vaccin antirabique à ARNm chez des adultes en bonne santé: un essai clinique de phase 1 ouvert, non randomisé, prospectif, premier chez l’homme”. Le Lancet . 390 (10101): 1511–20. doi : 10.1016/S0140-6736(17)31665-3 . PMID 28754494 . S2CID 7700297 .
- ^ Dolgin E (novembre 2021). “Les vaccins contre la grippe ARNm passent aux essais”. La nature examine la découverte de médicaments . 20 (11): 801–3. doi : 10.1038/d41573-021-00176-7 . PMID 34635829 . S2CID 238637957 .
- ^ Hou X, Zaks T, Langer R, Dong Y (août 2021). “Nanoparticules lipidiques pour la livraison d’ARNm” . Nature examine les matériaux . 6 (12): 1078–94. doi : 10.1038/s41578-021-00358-0 . ISSN 2058-8437 . PMC 8353930 . PMID 34394960 .
- ^ “COVID-19 et votre santé” . Centres de contrôle et de prévention des maladies . 11 février 2020. Archivé de l’original le 3 mars 2021 . Récupéré le 26 novembre 2020 .
- ^ “Moderna annonce sa stratégie mondiale de santé publique” . investisseurs.modernatx.com . Récupéré le 15 mars 2022 .
- ^ Steenhuysen, Julie; Erman, Michael (8 mars 2022). “Moderna prépare des vaccins contre 15 agents pathogènes à potentiel pandémique futur” . Reuters . Récupéré le 15 mars 2022 .
- ^ Ball P (janvier 2021). “La quête ultra-rapide des vaccins COVID – et ce que cela signifie pour d’autres maladies”. Nature . 589 (7840): 16–18. doi : 10.1038/d41586-020-03626-1 . PMID 33340018 . S2CID 229324351 .
- ^ Wherry EJ, Jaffee EM, Warren N, D’Souza G, Ribas A (avril 2021). “Comment avons-nous obtenu un vaccin COVID-19 en moins d’un an ?” . Recherche clinique sur le cancer . 27 (8): 2136–38. doi : 10.1158/1078-0432.CCR-21-0079 . ISSN 1078-0432 . PMC 8052930 . PMID 33542081 .
- ^ Roberts M (2 décembre 2020). “Le vaccin Covid Pfizer approuvé pour une utilisation la semaine prochaine au Royaume-Uni” . Nouvelles de la BBC . Archivé de l’original le 2 décembre 2020 . Récupéré le 2 décembre 2020 .
- ^ Bureau du commissaire (18 décembre 2020). “Vaccin Pfizer-BioNTech COVID-19” . FDA . Archivé de l’original le 14 janvier 2021 . Récupéré le 21 décembre 2020 .
- ^ a b c “La nouvelle récolte de vaccins à ARNm COVID-19 pourrait être plus facile à stocker, moins chère à utiliser” . www.science.org . Récupéré le 6 avril 2022 .
- ^ un b Batty CJ, Heise MT, Bachelder EM, Ainslie KM (décembre 2020). “Formulations de vaccins en développement clinique pour la prévention de l’infection par le coronavirus 2 du syndrome respiratoire aigu sévère” . Examens avancés de l’administration de médicaments . 169 : 168–89. doi : 10.1016/j.addr.2020.12.006 . PMC 7733686 . PMID 33316346 .
- ^ Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO (février 2021). “Stratégies vaccinales contre le SRAS-CoV-2 : un examen complet des candidats de phase 3” . Vaccins NPJ . 6 (1): 28. doi : 10.1038/s41541-021-00292-w . PMC 7900244 . PMID 33619260 .
- ^ Bull JJ, Nuismer SL, Antia R (juillet 2019). « Évolution du vaccin à vecteur recombinant » . Biologie computationnelle PLOS . 15 (7) : e1006857. Bibcode : 2019PLSCB..15E6857B . doi : 10.1371/journal.pcbi.1006857 . PMC 6668849 . PMID 31323032 .
- ^ Hajj KA, Whitehead KA (septembre 2017). “Outils de traduction : matériaux non viraux pour la délivrance d’ARNm thérapeutiques” . Nature examine les matériaux . 2 (10): 17056. Bibcode : 2017NatRM…217056H . doi : 10.1038/natrevmats.2017.56 .
- ^ un b Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ (novembre 2012). “Développer des technologies de vaccins à ARNm” . Biologie de l’ARN . 9 (11): 1319–1330. doi : 10.4161/rna.22269 . PMC 3597572 . PMID 23064118 .
- ^ Anand P, vice-président de Stahel (mai 2021). “Revoir l’innocuité des vaccins à ARNm Covid-19 : un bilan” . Sécurité des patients en chirurgie . 15 (1): 20. doi : 10.1186/s13037-021-00291-9 . PMC 8087878 . PMID 33933145 .
- ^ Goldman B (22 décembre 2020). “Comment fonctionnent les nouveaux vaccins COVID-19 ?” . Portée . médecine de Stanford. Archivé de l’original le 30 janvier 2021 . Récupéré le 28 janvier 2021 .
- ^ un bcdefg Xu S , Yang K , Li R, Zhang L (septembre 2020). “L’ère des vaccins à ARNm – Mécanismes, plate-forme de médicaments et prospection clinique”. Journal international des sciences moléculaires. 21(18) : 6582.doi: 10.3390/ijms21186582 . PMC 7554980 . PMID32916818.
- ^ Fiedler K, Lazzaro S, Lutz J, Rauch S, Heidenreich R (2016). “Vaccins contre le cancer à ARNm”. Résultats récents de la recherche sur le cancer. Fortschritte der Krebsforschung. Progrès dans les Recherches Sur le Cancer . Résultats récents de la recherche sur le cancer. 209 : 61–85. doi : 10.1007/978-3-319-42934-2_5 . ISBN 978-3-319-42932-8. PMID 28101688 .
- ^ un b Jackson NA, Kester KE, Casimiro D, Gurunathan S, DeRosa F (février 2020). “La promesse des vaccins à ARNm : une perspective biotechnologique et industrielle” . Vaccins NPJ . 5 (1): 11. doi : 10.1038/s41541-020-0159-8 . ISSN 2059-0105 . PMC 7000814 . PMID 32047656 .
- ^ Benteyn D, Heirman C, Bonehill A, Thielemans K, Breckpot K (février 2015). “Vaccins de cellules dendritiques à base d’ARNm”. Examen d’experts des vaccins . 14 (2): 161–76. doi : 10.1586/14760584.2014.957684 . PMID 25196947 . S2CID 38292712 .
- ^ Kreiter S, Selmi A, Diken M, Koslowski M, Britten CM, Huber C, et al. (novembre 2010). “La vaccination intranodale avec de l’ARN nu codant pour l’antigène suscite une puissante immunité antitumorale prophylactique et thérapeutique” . Recherche sur le cancer . 70 (22): 9031–40. doi : 10.1158/0008-5472.can-10-0699 . PMID 21045153 .
- ^ “Composants du vaccin” . Centre consultatif d’immunisation . 22 septembre 2016. Archivé de l’original le 26 janvier 2021 . Récupéré le 20 décembre 2020 .
- ^ Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, Pascolo S (août 2007). “L’absorption cellulaire spontanée d’ARN messager exogène in vivo est spécifique à l’acide nucléique, saturable et dépendante des ions” . Thérapie génique . 14 (15): 1175–1180. doi : 10.1038/sj.gt.3302964 . PMID 17476302 .
- ^ Lorenz C, Fotin-Mleczek M, Roth G, Becker C, Dam TC, Verdurmen WP, et al. (juillet 2011). “Expression de protéines à partir d’ARNm exogène : absorption par endocytose médiée par les récepteurs et trafic via la voie lysosomale” . Biologie de l’ARN . 8 (4): 627–636. doi : 10.4161/rna.8.4.15394 . PMID 21654214 .
- ^ Weide B, Pascolo S, Scheel B, Derhovanessian E, Pflugfelder A, Eigentler TK, et al. (juin 2009). “Injection directe d’ARNm protégé par la protamine: résultats d’un essai de vaccination de phase 1/2 chez des patients atteints de mélanome métastatique”. Journal d’immunothérapie . 32 (5): 498–507. doi : 10.1097/CJI.0b013e3181a00068 . PMID 19609242 . S2CID 3278811 .
- ^ un b Wang Y, Zhang Z, Luo J, Han X, Wei Y, Wei X (février 2021). “vaccin à ARNm : une stratégie thérapeutique potentielle” . Cancer moléculaire . 20 (1): 33. doi : 10.1186/s12943-021-01311-z . PMC 7884263 . PMID 33593376 .
- ^ un bc Cooney E (1er décembre 2020). “Comment la nanotechnologie aide les vaccins à ARNm Covid-19 à fonctionner” . Statistique . Archivé de l’original le 1er décembre 2020 . Récupéré le 3 décembre 2020 .
- ^ Reichmuth AM, Oberli MA, Jaklenec A, Langer R, Blankschtein D (mai 2016). “livraison de vaccins à ARNm à l’aide de Nanoparticules lipidiques” . Prestation thérapeutique . 7 (5) : 319–334. doi : 10.4155/tde-2016-0006 . PMC 5439223 . PMID 27075952 .
- ^ un b Cross R (6 mars 2021). “Sans ces coquilles lipidiques, il n’y aurait pas de vaccins à ARNm pour le COVID-19” . Nouvelles de la chimie et de l’ingénierie . Société américaine de chimie. Archivé de l’original le 5 mars 2021 . Récupéré le 6 mars 2021 .
- ^ Paunovska K, Sago CD, Monaco CM, Hudson WH, Castro MG, Rudoltz TG, et al. (mars 2018). “Une comparaison directe de la livraison d’acide nucléique in vitro et in vivo médiée par des centaines de nanoparticules révèle une faible corrélation” . Nano-lettres . 18 (3): 2148–57. Bibcode : 2018NanoL..18.2148P . doi : 10.1021/acs.nanolett.8b00432 . PMC 6054134 . PMID 29489381 .
- ^ Lowe D (3 février 2021). “Opinion : une explication simple de la raison pour laquelle davantage de vaccins COVID-19 ne peuvent pas être produits avec l’aide de “dizaines” d’entreprises” . MarketWatch . Archivé de l’original le 5 février 2021 . Récupéré le 5 février 2021 .
- ^ un b King A (23 mars 2021). “Pourquoi fabriquer des vaccins Covid à grande échelle est difficile” . Monde de la Chimie . Société royale de chimie. Archivé de l’original le 24 mars 2021 . Récupéré le 26 mars 2021 .
- ^ un b Sealy A (2 avril 2021). « Fabrication de moonshot : comment Pfizer fabrique ses millions de doses de vaccin contre le Covid-19 » . CNN . Archivé de l’original le 1er avril 2021 . Récupéré le 3 avril 2021 .
- ^ un bc Weise E, Weintraub K (7 février 2021). “Course au vaccin : cycle de vie d’un vaccin COVID-19 : de l’ADN aux doses”. Etats-Unis aujourd’hui. Gannett. Archivéde l’original le 25 février 2021. Récupéré le 24 février 2021.
- ^ Hopkins JS, Eastwood J, Moriarty D (3 mars 2021). “Les vaccins ARNm Covid-19 sont rapides à fabriquer, mais difficiles à mettre à l’échelle” . Le Wall StreetJournal . Archivé de l’original le 4 avril 2021 . Récupéré le 3 avril 2021 .
- ^ Rowland C (18 février 2021). « Pourquoi les grands-parents ne trouvent pas de vaccins : la rareté des ingrédients biotechnologiques de niche » . Le Washington Post . Archivé de l’original le 26 février 2021 . Récupéré le 7 mars 2021 .
- ^ Lundstrom K (mars 2019). “Les virus à ARN comme outils dans la thérapie génique et le développement de vaccins” . Gènes . 10 (3): 189. doi : 10.3390/genes10030189 . PMC 6471356 . PMID 30832256 .
- ^ Huang TT, Parab S, Burnett R, Diago O, Ostertag D, Hofman FM, et al. (février 2015). “L’administration intraveineuse du vecteur de réplication rétroviral, Toca 511, démontre une efficacité thérapeutique dans le modèle de gliome de souris immunocompétent orthotopique” . Thérapie génique humaine . 26 (2): 82–93. doi : 10.1089/hum.2014.100 . PMC 4326030 . PMID 25419577 .
- ^ Schultz-Cherry S, Dybing JK, Davis NL, Williamson C, Suarez DL, Johnston R, Perdue ML (décembre 2000). “L’hémagglutinine du virus de la grippe (A/HK/156/97) exprimée par un système de réplicon d’alphavirus protège les poulets contre une infection mortelle par les virus H5N1 originaires de Hong Kong” . Virologie . 278 (1): 55–59. doi : 10.1006/viro.2000.0635 . PMID 11112481 .
- ^ Geisbert TW, Feldmann H (novembre 2011). “Vaccins recombinants à base de virus de la stomatite vésiculeuse contre les infections à virus Ebola et Marburg” . Le Journal des maladies infectieuses . 204 (Suppl 3) : S1075–81. doi : 10.1093/infdis/jir349 . PMC 3218670 . PMID 21987744 .
- ^ un bc _ E (novembre 2020). “Les vaccins COVID-19 sont prêts pour le lancement, mais l’impact sur la pandémie n’est pas clair”. Biotechnologie naturelle . doi : 10.1038/d41587-020-00022-y . PMID 33239758 . S2CID 227176634 .
- ^ Neilson S, Dunn A, Bendix A (26 novembre 2020). “Le vaccin révolutionnaire contre le coronavirus de Moderna a été conçu en seulement 2 jours” . Initié d’affaires . Archivé de l’original le 11 janvier 2021 . Récupéré le 28 novembre 2020 .
- ^ Rabson M (27 février 2021). “De la science à la seringue : les vaccins COVID-19 sont des miracles de la science et des chaînes d’approvisionnement” . Nouvelles de CTV . Bell Média. Archivé de l’original le 27 février 2021 . Récupéré le 28 février 2021 .
- ^ Karikó K, Muramatsu H, Ludwig J, Weissman D (novembre 2011). “Générer l’ARNm optimal pour la thérapie : la purification par HPLC élimine l’activation immunitaire et améliore la traduction de l’ARNm codant pour les protéines modifié par les nucléosides” . Recherche sur les acides nucléiques . 39 (21) : e142. doi : 10.1093/nar/gkr695 . PMC 3241667 . PMID 21890902 .
- ^ Pardi N, Weissman D (17 décembre 2016). “Vaccins à ARNm modifiés par nucléosides pour les maladies infectieuses”. Vaccins à ARN . Méthodes en biologie moléculaire. Vol. 1499. Springer New York. p. 109–21. doi : 10.1007/978-1-4939-6481-9_6 . ISBN 978-1-4939-6479-6. PMID 27987145 .
- ^ Berglund P, Smerdou C, Fleeton MN, Tubulekas I, Liljeström P (juin 1998). “Améliorer les réponses immunitaires à l’aide de vaccins à ADN suicidaires”. Biotechnologie naturelle . 16 (6): 562–65. doi : 10.1038/nbt0698-562 . PMID 9624688 . S2CID 38532700 .
- ^ Vogel AB, Lambert L, Kinnear E, Busse D, Erbar S, Reuter KC, et al. (février 2018). “Les vaccins à ARN auto-amplifiés offrent une protection équivalente contre la grippe aux vaccins à ARNm mais à des doses beaucoup plus faibles” . Thérapie moléculaire . 26 (2): 446–55. faire : 10.1016/j.ymthe.2017.11.017 . PMC 5835025 . PMID 29275847 .
- ^ “Stockage des vaccins Pfizer-BioNTech COVID-19 et manipulation de la sécurité de la glace carbonique” . Pfizer. Archivé de l’original le 24 janvier 2021 . Récupéré le 17 décembre 2020 .
- ^ un b Simmons-Duffin S. “Pourquoi le vaccin COVID-19 de Pfizer doit-il être maintenu plus froid que l’Antarctique?” . NPR.org . Archivé de l’original le 1er février 2021 . Récupéré le 18 novembre 2020 .
- ^ un b “Fiche d’information pour les fournisseurs de soins de santé administrant le vaccin” (PDF) . ModernaTX, Inc. Archivé de l’original le 28 janvier 2021 . Récupéré le 21 décembre 2020 .
- ^ “Moderna annonce une durée de conservation plus longue pour son candidat vaccin COVID-19 à des températures réfrigérées” . NPR.org . Archivé de l’original le 16 novembre 2020 . Récupéré le 18 novembre 2020 .
- ^ Thomas K (22 octobre 2020). “Les experts disent à la FDA qu’elle devrait recueillir plus de données de sécurité sur les vaccins Covid-19″ . New York Times . Archivé de l’original le 26 janvier 2021 . Récupéré le 21 novembre 2020 .
- ^ Kuchler H (30 septembre 2020). “Le patron de Pfizer met en garde contre le risque d’accélération des vaccins” . Financial Times . Archivé de l’original le 18 novembre 2020 . Récupéré le 21 novembre 2020 .
- ^ Wadman M (novembre 2020). “Le public doit se préparer aux effets secondaires des vaccins” . Sciences . 370 (6520): 1022. doi : 10.1126/science.370.6520.1022 . PMID 33243869 .
- ^ un b Kwon D (25 novembre 2020). “La promesse des vaccins à ARNm” . Le scientifique . Archivé de l’original le 22 janvier 2021 . Récupéré le 27 novembre 2020 .
- ^ Carmichael F, Goodman J (2 décembre 2020). “Rumeurs de vaccin démystifiées : micropuces, ‘ADN altéré’ et plus” (Reality Check). BBC. Archivé de l’original le 13 mars 2021 . Récupéré le 10 décembre 2020 .
- ^ Skalka AM (2014). “Transposition de l’ADN rétroviral : thèmes et variations” . Spectre microbiologique . 2 (5) : 1101–1123. doi : 10.1128/microbiolspec.MDNA3-0005-2014 . ISBN 9781555819200. PMC 4383315 . PMID 25844274 .
- ^ un b Deering RP, Kommareddy S, Ulmer JB, Brito LA, Geall AJ (juin 2014). « Vaccins d’acide nucléique : perspectives pour la livraison non virale des vaccins d’ARNm ». Expert Opin Drug Deliv . 11 (6): 885–99. doi : 10.1517/17425247.2014.901308 . PMID 24665982 . S2CID 33489182 .
- ^ Versteeg L, Almutairi MM, Hotez PJ, Pollet J (septembre 2019). “Engagement de la plate-forme de vaccins à ARNm pour combattre les infections parasitaires” . Vaccins (Bâle) . 7 (4): 122. doi : 10.3390/vaccines7040122 . PCM 6963228 . PMID 31547081 .
- ^ un b Bloom K, van den Berg F, Arbuthnot P (avril 2021). “Vaccins à ARN auto-amplifiés pour les maladies infectieuses” . Thérapie génique . 28 (3–4) : 117–129. doi : 10.1038/s41434-020-00204-y . PMC 7580817 . PMID 33093657 .
- ^ Lowe D (1er mars 2021). “Un candidat vaccin contre le paludisme” . Science médecine translationnelle . Archivé de l’original le 6 mai 2021 . Récupéré le 7 mai 2021 .
- ^ Knapton, Sarah (20 septembre 2021). “Le premier vaccin Covid ‘à l’épreuve des variantes’ commence les essais à Manchester – Le couple de retraités Andrew Clarke, 63 ans, et sa femme Helen, 64 ans, de Bolton, sont devenus les premiers à recevoir le vaccin à ARNm lundi” . Le Daily Telegraph . Archivé de l’original le 20 septembre 2021 . Récupéré le 21 septembre 2021 .
- ^ “Gritstone annonce le dosage du premier volontaire dans un essai évaluant l’ARNm auto-amplifié en tant que rappel de vaccin COVID-19 et renforceur d’immunogénicité” . Examen du pipeline . 20 septembre 2021. Archivé de l’original le 22 septembre 2021 . Récupéré le 21 septembre 2021 .
Lectures complémentaires
- Dolgin E (septembre 2021). “L’histoire enchevêtrée des vaccins à ARNm” . Nature . 597 (9) : 318–324. Bibcode : 2021Natur.597..318D . doi : 10.1038/d41586-021-02483-w . ISSN 0028-0836 . PMID 34522017 .
- Sahin U , Karikó K , Türeci Ö (octobre 2014). “Thérapeutique basée sur l’ARNm – développement d’une nouvelle classe de médicaments” . Nat Rev Drug Discov . 13 (10): 759–80. doi : 10.1038/nrd4278 . PMID 25233993 .
Liens externes
| Scholia a un profil pour le vaccin à ARN (Q85795487) . |
- “Cinq choses que vous devez savoir sur les vaccins à ARNm” . Horizon .
- “Vaccins à ARN : une introduction” . Fondation PHG . Université de Cambridge .
- “Comprendre les vaccins à ARNm COVID-19” . Centres de contrôle et de prévention des maladies . 4 janvier 2022.
- “Arrêter le progrès et les heureux accidents : comment les vaccins à ARNm ont été fabriqués” . Le New York Times .
- Conférence 10 du MIT : Kizzmekia Corbett, Vaccins” sur YouTube
- xkcd webcomic expliquant le fonctionnement du vaccin à l’aide depersonnages et de situations de Star Wars .
Portails : ![]()
![]() Médecine
Médecine ![]()
![]() Virus
Virus ![]()
![]() COVID-19 [feminine]
COVID-19 [feminine]
