Tératome
Un tératome est une tumeur composée de plusieurs types de tissus différents , comme les cheveux , les muscles , les Dents ou les os . [4] Les tératomes se forment généralement dans l’ ovaire , le testicule ou le coccyx . [4]
| Tératome | |
|---|---|
 |
|
| Un petit kyste Dermoïde (4 cm) d’un ovaire, découvert lors d’une Césarienne | |
| Spécialité | Gynécologie , oncologie |
| Les symptômes | Masse minime et indolore [1] [2] |
| Complications | Torsion ovarienne , torsion testiculaire , hydrops fetalis [1] [2] [3] |
| Les types | Matures, immatures [4] |
| causes | Inconnu [2] |
| Méthode diagnostique | Biopsie tissulaire [2] |
| Diagnostic différentiel | Lipome , Dermoïde , Myéloméningocèle [5] |
| Traitement | Chirurgie, chimiothérapie [5] [6] |
| La fréquence | 1 nouveau-né sur 30 000 ( coccyx ) [7] |
Les symptômes
Les symptômes peuvent être minimes si la tumeur est petite. [2] Un tératome testiculaire peut se présenter sous la forme d’une masse indolore. [1] Les complications peuvent inclure une torsion ovarienne , une torsion testiculaire ou un hydrops fetalis . [1] [2] [3]
Il s’agit d’un type de tumeur des cellules germinales (une tumeur qui prend naissance dans les cellules qui donnent naissance aux spermatozoïdes ou aux ovules ). [4] [8] Ils sont divisés en deux types : matures et immatures. [4] Les tératomes matures comprennent les kystes dermoïdes et sont généralement bénins . [8] Les tératomes immatures peuvent être cancéreux . [4] [9] La plupart des tératomes ovariens sont matures. [10] Chez les adultes, les tératomes testiculaires sont généralement cancéreux. [11] Le diagnostic définitif repose sur une Biopsie tissulaire . [2]
Le traitement des tératomes du coccyx, des testicules et des ovaires est généralement chirurgical. [5] [6] [12] Les tératomes testiculaires et ovariens immatures sont également fréquemment traités par chimiothérapie . [6] [10]
Les tératomes surviennent dans le coccyx chez environ un nouveau-né sur 30 000, ce qui en fait l’une des tumeurs les plus courantes dans ce groupe d’âge. [5] [7] Les femmes sont plus souvent touchées que les hommes. [5] Les tératomes ovariens représentent environ un quart des Tumeurs ovariennes et sont généralement observés à l’âge moyen. [10] Les tératomes testiculaires représentent près de la moitié des cancers testiculaires . [13] Ils peuvent survenir chez les enfants et les adultes. [14] Le terme vient du mot grec pour “monstre” [15] plus le suffixe “-oma” utilisé pour les tumeurs.
Les types
Tératome mature

 Tératome ovarien avec poils à l’intérieur
Tératome ovarien avec poils à l’intérieur 
 Tératome mature du médiastin : Une coupe horizontale de la tumeur réséquée révèle un tissu fibro-gras, des zones calcifiées et quelques espaces kystiques tapissés d’une membrane lisse et contenant un cheveu. Dans le coin inférieur gauche, la bronche B5 impliquée est évidente.
Tératome mature du médiastin : Une coupe horizontale de la tumeur réséquée révèle un tissu fibro-gras, des zones calcifiées et quelques espaces kystiques tapissés d’une membrane lisse et contenant un cheveu. Dans le coin inférieur gauche, la bronche B5 impliquée est évidente.
Un tératome mature est un tératome de grade 0. Leur forme et leur histologie sont très variables et peuvent être solides, kystiques ou une combinaison des deux. Un tératome mature contient souvent plusieurs types de tissus différents tels que la peau , les muscles et les os . La peau peut entourer un kyste et faire pousser des cheveux abondants (voir kyste Dermoïde ). Les tératomes matures sont généralement bénins, 0,17 à 2 % des tératomes kystiques matures devenant malins. [16]
Tératome immature
Le tératome immature est la contrepartie maligne du tératome mature et contient des tissus immatures qui présentent généralement une histopathologie neuroectodermique primitive ou embryonnaire. Le tératome immature a l’un des taux les plus bas de mutation somatique de tous les types de tumeurs et résulte de l’un des cinq mécanismes d’échec méiotique. [17]
Gliomatose péritonéale
La gliomatose péritonéale, qui se présente comme un dépôt de cellules gliales matures dans le péritoine, est presque exclusivement associée à des cas de tératome ovarien. Grâce à des études génétiques de la séquence de l’exome, il a été découvert que la gliomatose est génétiquement identique à la tumeur ovarienne parente et développée à partir de cellules qui se disséminent à partir du tératome ovarien. [17]
Kyste Dermoïde
Un kyste Dermoïde est un tératome kystique mature contenant des poils (parfois très abondants) et d’autres structures caractéristiques de la peau normale et d’autres tissus dérivés de l’ ectoderme . Le terme est le plus souvent appliqué au tératome sur les sutures du crâne et dans les ovaires des femmes. [ citation nécessaire ]
Fœtus chez le fœtus et tératome fétiforme
Le fœtus chez le fœtus et le tératome fétiforme sont des formes rares de tératomes matures qui comprennent un ou plusieurs composants ressemblant à un fœtus malformé. Les deux formes peuvent contenir ou sembler contenir des systèmes d’organes complets, même des parties importantes du corps telles qu’un torse ou des membres. Le fœtus chez le fœtus diffère du tératome fétiforme par sa colonne vertébrale apparente et sa Symétrie bilatérale . [18]
La plupart des autorités conviennent que les tératomes fétiformes sont des tératomes matures très développés; l’histoire naturelle du fœtus dans le fœtus est controversée. [18] Il peut également y avoir une différence culturelle, le tératome fétiforme étant signalé plus souvent dans les tératomes ovariens (par les gynécologues) et le fœtus chez le fœtu étant signalé plus souvent dans les tératomes rétropéritonéaux (par les chirurgiens généralistes). Fetus in fetu a souvent été interprété comme un fœtus grandissant dans son jumeau . En tant que telle, cette interprétation suppose une complication particulière du jumelage , l’une des nombreuses regroupées sous le terme de jumeau parasite . À cet égard, dans de nombreux cas, le fœtus en fœtusoccuperait un kyste rempli de liquide dans un tératome mature. [19] [20] [21] [22] Les kystes dans le tératome mature peuvent avoir des systèmes d’organes partiellement développés; les rapports incluent des cas d’ Os crâniens partiels , d’Os longs et d’un cœur battant rudimentaire. [23] [24]
Que le fœtus chez le fœtus et le tératome fétiforme soient une ou deux entités, ils sont distincts et ne doivent pas être confondus avec la grossesse extra-utérine .
Struma ovarien
Un struma ovarii (également connu sous le nom de goitre de l’ovaire ou goitre ovarien) est une forme rare de tératome mature qui contient principalement du tissu thyroïdien . [25]
Epignathe
L’épignathe est un tératome rare originaire de la région oropharyngée qui survient in utero . Il se présente avec une masse dépassant de la bouche à la naissance. Non traitée, la respiration est impossible. Une procédure EXIT est le traitement initial recommandé.
Signes et symptômes
Les tératomes peuvent être trouvés chez les bébés, les enfants et les adultes. Les tératomes d’origine embryonnaire sont le plus souvent retrouvés chez les bébés à la naissance, chez les jeunes enfants et, depuis l’avènement de l’échographie , chez les fœtus.
Les tératomes fœtaux les plus diagnostiqués sont le tératome sacrococcygien (types Altman I, II et III) et le tératome cervical (cou). Parce que ces tératomes se projettent du corps fœtal dans le liquide amniotique environnant , ils peuvent être vus lors d’examens échographiques prénatals de routine. Les tératomes dans le corps du fœtus sont moins facilement visibles par échographie ; pour celles-ci, l’IRM de l’utérus de la femme enceinte est plus informative. [26] [27]
Complications
Les tératomes ne sont pas dangereux pour le fœtus à moins qu’un effet de masse ne se produise ou qu’une grande quantité de sang ne circule à travers la tumeur (connu sous le nom de vol vasculaire). L’effet de masse consiste fréquemment en une obstruction du passage normal des fluides des organes environnants. Le vol vasculaire peut mettre à rude épreuve le cœur en croissance du fœtus, entraînant même une insuffisance cardiaque, et doit donc être surveillé par échocardiographie fœtale .
Les tératomes peuvent provoquer une maladie auto-immune appelée encéphalite à récepteurs N-méthyl-D-aspartate (NMDA). Dans cette condition, les tératomes peuvent contenir des cellules B avec des spécificités de récepteur NMDA. [28]
Après la chirurgie, il existe un risque de repousse en place ou dans les organes voisins. [29]
Physiopathologie
Les tératomes appartiennent à une classe de tumeurs appelées tumeurs germinales non séminomateuses . Toutes les tumeurs de cette classe sont le résultat d’un développement anormal de cellules pluripotentes : cellules germinales et cellules embryonnaires . Les tératomes d’origine embryonnaire sont congénitaux ; les tératomes d’origine germinale peuvent être congénitaux ou non. Le type de cellule pluripotente semble être sans importance, à part limiter l’emplacement du tératome dans le corps.
Les tératomes dérivés des cellules germinales se produisent dans le testicule chez les hommes et les ovaires chez les femmes. Les tératomes dérivés de cellules embryonnaires se produisent généralement sur la ligne médiane du sujet : dans le cerveau, ailleurs dans le crâne , dans le nez, dans la langue, sous la langue et dans le cou (tératome cervical), le médiastin , le Rétropéritoine et attachés au coccyx . Les tératomes peuvent également survenir ailleurs : très rarement dans les organes solides (notamment le cœur et le foie) et les organes creux (comme l’estomac et la vessie), et plus fréquemment sur les sutures du crâne .
Les tératomes comprennent rarement des parties du corps plus compliquées telles que les Dents , la matière cérébrale , [30] les Yeux , [31] [32] ou le torse . [33]
Hypothèses d’origine
Concernant l’origine des tératomes, de nombreuses hypothèses existent. [18] Ces hypothèses ne doivent pas être confondues avec l’hypothèse indépendante selon laquelle le fœtus dans le fœtus (voir ci-dessous) n’est pas du tout un tératome, mais plutôt un jumeau parasite .
Diagnostic
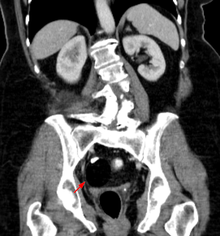
 TDM montrant un tératome de l’ovaire : formation graisseuse à contour lisse, avec une partie dense, éventuellement une dent.
TDM montrant un tératome de l’ovaire : formation graisseuse à contour lisse, avec une partie dense, éventuellement une dent. 
 Micrographie d’un tératome montrant les tissus des trois couches germinales : mésoderme ( cartilage immature – gauche-supérieur), endoderme (glandes gastro-intestinales – centre-bas) et ectoderme (épiderme – droit)
Micrographie d’un tératome montrant les tissus des trois couches germinales : mésoderme ( cartilage immature – gauche-supérieur), endoderme (glandes gastro-intestinales – centre-bas) et ectoderme (épiderme – droit)
On pense que les tératomes proviennent de l’utérus et peuvent donc être considérés comme des tumeurs congénitales . De nombreux tératomes ne sont diagnostiqués que bien plus tard dans l’enfance ou à l’âge adulte. Les grosses tumeurs sont plus susceptibles d’être diagnostiquées tôt. Les tératomes sacrococcygiens et cervicaux sont souvent détectés par échographie prénatale . Des méthodes de diagnostic supplémentaires peuvent inclure l’ imagerie par résonance magnétique prénatale . Dans de rares circonstances, la tumeur est si grosse que le fœtus peut être endommagé ou mourir. Dans le cas de grands tératomes sacrococcygiens, une partie importante du flux sanguin du fœtus est redirigée vers le tératome (un phénomène appelé syndrome de vol ), provoquant une insuffisance cardiaque , ouhydrops , du fœtus. Dans certains cas, une chirurgie fœtale peut être indiquée.
Au-delà de la période néonatale, les symptômes d’un tératome dépendent de sa localisation et de son organe d’origine. Les tératomes ovariens se présentent souvent avec des douleurs abdominales ou pelviennes , causées par une torsion de l’ovaire ou une irritation de ses ligaments. Une affection récemment découverte dans laquelle les tératomes ovariens provoquent une encéphalite associée à des anticorps dirigés contre l’ anticorps récepteur du N-méthyl-D-aspartate (NMDAR) – souvent appelée « encéphalite anti-récepteur NMDA ».”, a été identifié comme une complication grave. Les patients développent une maladie à plusieurs stades qui évolue de la psychose, des déficits de mémoire, des convulsions et de la désintégration du langage vers un état d’absence de réponse avec des caractéristiques catatoniques souvent associées à des mouvements anormaux et à une instabilité autonome et respiratoire. [34] Les tératomes testiculaires se présentent sous la forme d’une masse palpable dans le testicule ; les tératomes médiastinaux provoquent souvent une compression des poumons ou des voies respiratoires et peuvent s’accompagner de douleurs thoraciques et/ou de symptômes respiratoires.
Certains tératomes contiennent des éléments du sac vitellin , qui sécrètent de l’alpha-fœtoprotéine . Sa détection peut aider à confirmer le diagnostic et est souvent utilisée comme marqueur de récidive ou d’efficacité du traitement, mais est rarement la méthode de diagnostic initial. (L’ alpha-foetoprotéine sérique maternelle est un test de dépistage utile pour d’autres affections fœtales, notamment le syndrome de Down , le spina bifida et les malformations de la paroi abdominale telles que le gastroschisis .)
Classification
Quel que soit son emplacement dans le corps, un tératome est classé selon un système de stadification du cancer . Cela indique si une chimiothérapie ou une radiothérapie peut être nécessaire en plus de la chirurgie. Les tératomes sont généralement classés à l’aide du système de notation de Gonzalez-Crussi [18] : 0 ou mature ( bénigne ) ; 1 ou immature, probablement bénigne ; 2 ou immature, éventuellement maligne (cancéreuse); et 3 ou franchement malin. Si elle est franchement maligne, la tumeur est un cancer pour lequel une stadification supplémentaire du cancer s’applique. [ citation nécessaire ]
Les tératomes sont également classés selon leur contenu; un tératome solide ne contient que des tissus (comprenant peut-être des structures plus complexes); un tératome kystique ne contient que des poches de liquide ou semi-fluide comme le liquide céphalo-rachidien , le sébum ou la graisse ; un tératome mixte contient à la fois des parties solides et kystiques. Les tératomes kystiques sont généralement de grade 0 et, à l’inverse, les tératomes de grade 0 sont généralement kystiques.
Les tératomes purs de grades 0, 1 et 2 ont le potentiel de devenir malins (grade 3) et les tératomes purs malins ont le potentiel de métastaser . Ces formes rares de tératome avec transformation maligne peuvent contenir des éléments de malignité somatique (et non des cellules germinales) tels que la leucémie , le carcinome ou le sarcome . [35] Un tératome peut contenir des éléments d’autres tumeurs germinales, auquel cas il ne s’agit pas d’un tératome pur, mais plutôt d’une tumeur germinale mixte et maligne. Chez les nourrissons et les jeunes enfants, ces éléments sont généralement une tumeur du sinus endodermique , suivie d’ un choriocarcinome. Enfin, un tératome peut être pur et non malin mais très agressif ; ceci est illustré par le syndrome de tératome croissant, dans lequel la chimiothérapie élimine les éléments malins d’une tumeur mixte, laissant un tératome pur, qui paradoxalement commence à se développer très rapidement. [36]
Transformation maligne
Un tératome « bénin » de grade 0 (mature) présente néanmoins un risque de malignité. La récidive avec tumeur maligne du sinus endodermique a été rapportée dans des cas de tératome mature autrefois bénin, [37] [38] même dans le tératome fétiforme et le fœtus dans le fœtus. [39] [40] Le carcinome épidermoïde a été trouvé dans un tératome kystique mature au moment de la chirurgie initiale. [41] Un tératome immature de grade 1 qui semble être bénin (par exemple, parce que l’AFP n’est pas élevée) a un risque beaucoup plus élevé de malignité et nécessite un suivi adéquat. [42] [43] [44] [45]Ce grade de tératome peut également être difficile à diagnostiquer correctement. Il peut être confondu avec d’autres néoplasmes à petites cellules rondes tels que le neuroblastome, le carcinome à petites cellules de type hypercalcémique, la tumeur neuroectodermique primitive, la tumeur de Wilm, la tumeur desmoplasique à petites cellules rondes et le lymphome non hodgkinien . [46]
Un tératome avec transformation maligne est une forme très rare de tératome qui peut contenir des éléments de tumeurs malignes somatiques telles que la leucémie, le carcinome ou le sarcome. [35] Sur 641 enfants atteints de tératome pur, neuf ont développé une TMT : [47] cinq carcinomes, deux gliomes et deux carcinomes embryonnaires (ici, ces derniers sont classés parmi les tumeurs germinales).
Épendymome extraspinal
L’ épendymome extraspinal , généralement considéré comme un gliome (un type de tumeur non germinale), peut être une forme inhabituelle de tératome mature. [48]
Traitement
Opération
Le traitement de choix est l’ablation chirurgicale complète ( c’est-à-dire une résection complète). [49] [50] Les tératomes sont normalement bien encapsulés et non invasifs des tissus environnants, ils sont donc relativement faciles à réséquer des tissus environnants. Les exceptions incluent les tératomes dans le cerveau et les très gros tératomes complexes qui se sont enfoncés et se sont entrelacés avec les muscles adjacents et d’autres structures.
La prévention des récidives ne nécessite pas de résection en bloc des tissus environnants.
Chimiothérapie
Pour les tératomes malins, la chirurgie est généralement suivie d’une chimiothérapie.
Les tératomes qui se trouvent dans des endroits chirurgicalement inaccessibles, ou qui sont très complexes, ou qui sont susceptibles d’être malins (en raison d’une découverte et/ou d’un traitement tardifs) sont parfois traités d’abord par chimiothérapie. [ citation nécessaire ]
Suivi
Bien que souvent décrit comme bénin, un tératome a un potentiel malin. Une étude britannique portant sur 351 nourrissons et enfants diagnostiqués avec un tératome « bénin » a rapporté 227 avec MT, 124 avec IT. Cinq ans après la chirurgie, la survie sans événement était de 92,2 % et 85,9 %, respectivement, et la survie globale était de 99 % et 95,1 %. [51] Une étude similaire en Italie a rapporté 183 nourrissons et enfants diagnostiqués avec un tératome. Dix ans après la chirurgie, la survie sans événement et la survie globale étaient respectivement de 90,4 % et 98 %. [52]
Selon le ou les tissus qu’il contient, un tératome peut sécréter une variété de produits chimiques ayant des effets systémiques. Certains tératomes sécrètent « l’hormone de grossesse », la gonadotrophine chorionique humaine (βhCG), qui peut être utilisée en pratique clinique pour surveiller le succès du traitement ou la rechute chez les patients atteints d’un tératome connu sécrétant de l’HCG. Cette hormone n’est pas recommandée comme marqueur diagnostique, car la plupart des tératomes ne la sécrètent pas. Certains tératomes sécrètent de la thyroxine , dans certains cas à un degré tel qu’il peut entraîner une hyperthyroïdie clinique chez le patient. La sécrétion d’ alpha-foetoprotéine (AFP) est particulièrement préoccupante ; dans certaines circonstances, l’AFP peut être utilisée comme marqueur diagnostique spécifique de la présence de sac vitellincellules du tératome. Ces cellules peuvent se développer en une tumeur franchement maligne appelée tumeur du sac vitellin ou tumeur du sinus endodermique .
Un suivi adéquat nécessite une observation étroite, impliquant un examen physique répété, une scintigraphie (échographie, IRM ou TDM) et une mesure de l’AFP et/ou de la βhCG. [53] [54]
Épidémiologie
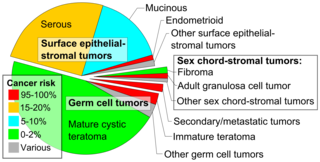
 Tumeurs ovariennes par incidence et risque de cancer de l’ovaire , avec tératome kystique mature en bas et tératome immature à droite. [55]
Tumeurs ovariennes par incidence et risque de cancer de l’ovaire , avec tératome kystique mature en bas et tératome immature à droite. [55]
Les tératomes embryonnaires surviennent le plus souvent dans la région sacro-coccygienne ; Le tératome sacrococcygien est la tumeur la plus fréquente chez les nouveau-nés humains.
Parmi les tératomes sur les sutures du crâne, environ 50 % se trouvent dans ou à côté de l’ orbite . [56] Le Dermoïde limbique est un choristome , pas un tératome.
Le tératome est considéré comme une maladie rare , mais n’est pas extrêmement rare. Le tératome sacrococcygien seul est diagnostiqué à la naissance chez un humain sur 40 000. Compte tenu de la population humaine actuelle et du taux de natalité, cela équivaut à cinq par jour ou 1800 par an. Ajoutez à ce nombre des tératomes sacro-coccygiens diagnostiqués plus tard dans la vie et des tératomes dans d’autres régions, et l’ incidence approche les 10 000 nouveaux diagnostics de tératome par an. [ citation nécessaire ]
Autres animaux
Des tératomes ovariens ont été rapportés chez des juments , [57] des pumas , [58] [59] et des canidés. [60] Teratomas se produisent aussi, rarement, dans d’autres espèces. [61]
Utilisation dans la recherche sur les cellules souches
Les cellules souches pluripotentes, y compris les cellules souches pluripotentes induites par l’homme, ont la propriété unique de pouvoir générer des tératomes lorsqu’elles sont injectées à des rongeurs dans le laboratoire de recherche. [62] Pour cette raison, le soi-disant “test de tératome” est l’un des tests de validation de référence pour les cellules souches pluripotentes. [63] Étant donné que des cellules souches pluripotentes humaines différenciées sont en cours de développement comme base de nombreuses thérapies de médecine régénérative, on craint que les cellules souches indifférenciées résiduelles puissent entraîner la formation de tératomes chez les patients injectés, et les chercheurs travaillent à développer des méthodes pour répondre à cette préoccupation. [64]
Références
- ^ un bcd Raja SG (2007). Accès à la chirurgie : 500 questions à réponse unique en pathologie générale et systématique . PasTest Ltd. p. 508.ISBN _ 9781905635368.
- ^ un bcdefg ” Tératome sacrococcygien “ . _ _ NORD (Organisation Nationale des Maladies Rares) . 2007 . Récupéré le 20 décembre 2017 .
- ^ a b Millet I, Perrochia H, Pages-Bouic E, Curros-Doyon F, Rathat G, Taourel P (2014). “CT et MR des tumeurs bénignes des cellules germinales ovariennes” . Dans Saba L, Acharya UR, Guerriero S, Suri JS (eds.). Imagerie du néoplasme ovarien . Springer Science et médias d’affaires. p. 165. ISBN 9781461486336.
- ^ un bcdef ” NCI Dictionary of Cancer Terms “ . Institut national du cancer . 2011-02-02 . Récupéré le 20 décembre 2017 .
- ^ un bcde Davies M, Inglis G, Jardine L, Koorts P (2012) . Consultations prénatales : Un guide pour les néonatologistes et les pédiatres – E-Book . Sciences de la santé Elsevier. p. 298. ISBN 978-0729581080.
- ^ un bc Price P, Sikora K, Illidge T (2008) . Traitement du cancer (cinquième éd.). Presse CRC. p. 713.ISBN _ 9780340912218.
- ^ un b Corton MM, Leveno KJ, Bloom SL, Hoffman BL (2014). Williams Obstétrique 24/E (EBOOK) . Professionnel McGraw Hill. p. Chapitre 16. ISBN 9780071798945.
- ^ un b “Tératome mûr” . Institut national du cancer . 2011-02-02 . Récupéré le 20 décembre 2017 .
- ^ Noor MR, Hseon TE, Jeffrey LJ, éds. (2014). “Tumeurs des cellules germinales ovariennes” . Cancer gynécologique : un manuel pour les étudiants et les praticiens . Presse CRC. p. 446.ISBN _ 9789814463065.
- ^ un bc Falcone T, Hurd WW (2007). Médecine et chirurgie de la reproduction clinique . Sciences de la santé Elsevier. p. 749.ISBN _ 978-0323033091.
- ^ Oyasu R, Yang XJ, Yoshida O (2009). Questions dans la pratique urologique quotidienne : mises à jour pour les urologues et les pathologistes diagnostiques . Springer Science et médias d’affaires. p. 253.ISBN _ 9784431728191.
- ^ Hillard PJ, Hillard PA (2008). La consultation en obstétrique et Gynécologie de 5 minutes . Lippincott Williams & Wilkins. p. 140. ISBN 9780781769426.
- ^ Hart I, Newton RW (2012). Endocrinologie . Springer Science et médias d’affaires. p. 157. ISBN 9789401092982.
- ^ McDougal WS, Wein AJ, Kavoussi LR, Partin AW, Peters CA, Ramchandani P (2011). Campbell-Walsh Urology (10e éd.). Sciences de la santé Elsevier. p. 663.ISBN _ 978-1455723171.
- ^ Chang AE, Ganz PA, Hayes DF, Kinsella T, Pass HI, Schiller JH, Stone RM, Strecher V (2007). Oncologie : une approche fondée sur des données probantes . Springer Science et médias d’affaires. p. 848. ISBN 9780387310565.
- ^ Mandal S, Badhe BA (2012). “Transformation maligne dans un tératome mature avec dépôts métastatiques dans l’épiploon : à propos d’un cas” . Rapports de cas en pathologie . 2012 : 568062. doi : 10.1155/2012/568062 . PMC 3469088 . PMID 23082264 .
- ^ un b Heskett MB, Sanborn JZ, Boniface C, Goode B, Chapman J, Garg K, et al. (juin 2020). “Le séquençage de l’exome multirégional des tératomes immatures ovariens révèle des génomes quasi diploïdes 2N, la rareté des mutations somatiques et des déséquilibres alléliques étendus partagés entre les composants matures, immatures et disséminés” . Pathologie moderne . 33 (6): 1193-1206. doi : 10.1038/s41379-019-0446-y . PMC 7286805 . PMID 31911616 .
- ^ un bcd Gonzalez- Crussi F (1982) Extragonadal Teratomas . Atlas of Tumor Pathology, Second Series, Fascicule 18. Armed Forces Institute of Pathology , Washington DC
- ^ Abbott TM, Hermann WJ, Scully RE (1984). “Tératome fétiforme ovarien (homoncule) chez une fillette de 9 ans”. Journal international de pathologie gynécologique . 2 (4): 392–402. doi : 10.1097/00004347-198404000-00007 . PMID 6724790 .
- ^ Saito K, Katsumata Y, Hirabuki T, Kato K, Yamanaka M (2007). “Fœtus-in-fetu: parasite ou néoplasme? Une étude de deux cas”. Diagnostic et thérapie fœtale . 22 (5): 383–388. doi : 10.1159/000103301 . PMID 17556829 . S2CID 57099054 .
- ^ Kajbafzadeh AM, Baharnoori M (octobre 2006). “Fœtus dans le fœtu”. Le Journal canadien d’urologie . 13 (5): 3277–3278. PMID 17076951 .
- ^ Chua JH, Chui CH, Sai Prasad TR, Jabcobsen AS, Meenakshi A, Hwang WS (novembre 2005). “Fœtus-in-fetu dans le bassin: rapport d’un cas et revue de la littérature” (PDF) . Annales de l’Académie de médecine, Singapour . 34 (10): 646–649. PMID 16382253 .
- ^ Lee YH, Kim SG, Choi SH, Kim IS, Kim SH (décembre 2003). “Tératome kystique mature ovarien contenant un homoncule: un rapport de cas” (PDF) . Journal des sciences médicales coréennes . 18 (6): 905–907. doi : 10.3346/jkms.2003.18.6.905 . PMC 3055135 . PMID 14676454 . Archivé de l’original (PDF) le 2011-07-22.
- ^ Kazez A, Ozercan IH, Erol FS, Faik Ozveren M, Parmaksiz E (août 2002). “Coeur sacrococccygien: une différenciation très rare dans le tératome”. Journal européen de chirurgie pédiatrique . 12 (4): 278–280. doi : 10.1055/s-2002-34483 . PMID 12369008 .
- ^ Frysak Z, Schovanek J, Halenka M, Metelkova I, Duskova M, Karasek D (2016). “Le goitre ovarien comme cause rare d’hyperthyroïdie” . Acta Endocrinologique . 12 (3): 335–338. doi : 10.4183/aeb.2016.335 . PMC 6535264 . PMID 31149110 .
- ^ Danzer E, Hubbard AM, Hedrick HL, Johnson MP, Wilson RD, Howell LJ, et al. (octobre 2006). “Diagnostic et caractérisation du tératome sacro-coccygien fœtal avec IRM prénatale”. AJR. Journal américain de radiologie . 187 (4) : W350–W356. doi : 10.2214/AJR.05.0152 . PMID 16985105 .
- ^ Kocaoglu M, Frush DP (2006). “Masses présacrées pédiatriques”. Radiographies . 26 (3): 833–857. doi : 10.1148/rg.263055102 . PMID 16702458 .
- ^ Makuch M, Wilson R, Al-Diwani A, Varley J, Kienzler AK, Taylor J, et al. (mars 2018). “Production d’anticorps de récepteur de N-méthyl-D-aspartate à partir de réactions de centre germinatif : implications thérapeutiques” . Annales de Neurologie . 83 (3): 553–561. doi : 10.1002/ana.25173 . PMC 5925521 . PMID 29406578 .
- ^ Choi KW, Jeon WJ, Chae HB, Park SM, Youn SJ, Shin HM, et al. (septembre 2003). “[Un cas récurrent d’un tératome ovarien mature se présentant comme une masse rectale]” (PDF) . The Korean Journal of Gastroenterology = Taehan Sohwagi Hakhoe Chi (en coréen). 42 (3): 242–245. PMID 14532748 .
- ^ Shintaku M, Sakuma T, Ohbayashi C, Maruo M (avril 2017). “Cervelet bien formé et structures de type tronc cérébral dans un tératome ovarien mature: observations neuropathologiques”. Neuropathologie . 37 (2): 122–128. doi : 10.1111/neup.12360 . PMID 28042664 . S2CID 25588284 .
- ^ Chi JG, Lee YS, Park YS, Chang KY (juillet 1984). “Fœtus-in-fetu: rapport d’un cas”. Journal américain de pathologie clinique . 82 (1): 115–119. doi : 10.1093/ajcp/82.1.115 . PMID 6540049 .
- ^ Sergi C, Ehemann V, Beedgen B, Linderkamp O, Otto HF (1999). “Énorme tératome sacro-coccygien fœtal avec un œil complètement formé et une hétérogénéité de ploïdie d’ADN intratumorale”. Pathologie pédiatrique et développementale . 2 (1): 50–57. doi : 10.1007/s100249900089 . PMID 9841706 . S2CID 22847474 .
- ^ Arlikar JD, Mane SB, Dhende NP, Sanghavi Y, Valand AG, Butale PR (mars 2009). “Fetus in fetu: deux rapports de cas et revue de la littérature”. Chirurgie Pédiatrique Internationale . 25 (3): 289–292. doi : 10.1007/s00383-009-2328-8 . PMID 19184054 . S2CID 11210782 .
- ^ Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon R (janvier 2011). “L’expérience clinique et les investigations de laboratoire chez les patients atteints d’encéphalite anti-NMDAR” . Le Lancet. Neurologie . 10 (1): 63–74. doi : 10.1016/S1474-4422(10)70253-2 . PMC 3158385 . PMID 21163445 .
- ^ un b Harms D, Zahn S, Göbel U, Schneider DT (2006). “Pathologie et biologie moléculaire des tératomes de l’enfance et de l’adolescence”. Klinische Padiatrie . 218 (6): 296–302. doi : 10.1055/s-2006-942271 . PMID 17080330 .
- ^ Scavuzzo A, Santana Ríos ZA, Noverón NR, Jimenez Ríos MA (2014). “Syndrome de tératome croissant” . Rapports de cas en urologie . 2014 : 139425. doi : 10.1155/2014/139425 . PMC 4150507 . PMID 25197607 .
- ^ Ohno Y, Kanematsu T (octobre 1998). “Une tumeur du sinus endodermique résultant d’un tératome kystique mature dans le Rétropéritoine chez un enfant : un tératome mature est-il un état précancéreux ?”. Pathologie humaine . 29 (10): 1167–1169. doi : 10.1016/S0046-8177(98)90432-4 . PMID 9781660 .
- ^ Utsuki S, Oka H, Sagiuchi T, Shimizu S, Suzuki S, Fujii K (juin 2007). “Transformation maligne du tératome mature intracrânien en tumeur du sac vitellin après une rechute tardive. Rapport de cas”. Journal de neurochirurgie . 106 (6): 1067-1069. doi : 10.3171/jns.2007.106.6.1067 . PMID 17564180 . S2CID 23864999 .
- ^ Chen YH, Chang CH, Chen KC, Diau GY, Loh IW, Chu CC (mai 2007). “Transformation maligne d’un tératome fétiforme sacro-coccygien bien organisé chez un nouveau-né de sexe masculin” . Journal de l’Association médicale de Formose = Taiwan Yi Zhi . 106 (5): 400–402. doi : 10.1016/S0929-6646(09)60326-0 . PMID 17561476 . [ lien mort permanent ]
- ^ Hopkins KL, Dickson PK, Ball TI, Ricketts RR, O’Shea PA, Abramowsky CR (octobre 1997). “Fœtus-in-fetu avec récidive maligne”. Journal de chirurgie pédiatrique . 32 (10): 1476-1479. doi : 10.1016/S0022-3468(97)90567-4 . PMID 9349774 .
- ^ Arioz DT, Tokyol C, Sahin FK, Koker G, Yilmaz S, Yilmazer M, Ozalp S (2008). “Carcinome épidermoïde survenant dans un tératome kystique mature de l’ovaire chez un jeune patient avec un antigène glucidique élevé 19-9”. Journal européen d’oncologie gynécologique . 29 (3): 282–284. PMID 18592797 .
- ^ Muscatello L, Giudice M, Feltri M (novembre 2005). “Tératome cervical malin : rapport d’un cas chez un nouveau-né”. Archives européennes d’oto-rhino-laryngologie . 262 (11): 899–904. doi : 10.1007/s00405-005-0917-2 . PMID 15895292 . S2CID 11556991 .
- ^ Ukiyama E, Endo M, Yoshida F, Tezuka T, Kudo K, Sato S, et al. (juillet 2005). “Tumeur récurrente du sac vitellin après résection d’un tératome gastrique immature néonatal”. Chirurgie Pédiatrique Internationale . 21 (7): 585–588. doi : 10.1007/s00383-005-1404-y . PMID 15928937 . S2CID 40147917 .
- ^ Bilik R, Shandling B, Pope M, Thorner P, Weitzman S, Ein SH (septembre 1993). “Tératome sacrococcygien néonatal bénin malin”. Journal de chirurgie pédiatrique . 28 (9) : 1158-1160. doi : 10.1016/0022-3468(93)90154-D . PMID 7508500 .
- ^ Hawkins E, Issacs H, Cushing B, Rogers P (novembre 1993). “Malignité occulte dans les tératomes sacrococcygiens néonatals. Un rapport d’une étude combinée du groupe d’oncologie pédiatrique et du groupe du cancer des enfants”. L’American Journal of Pediatric Hematology/Oncology . 15 (4): 406–409. PMID 7692755 .
- ^ Ramalingam P, Teague D, Reid-Nicholson M (août 2008). “Cytologie d’empreinte de tératome ovarien immature de haut grade: un rapport de cas, une revue de la littérature et une distinction par rapport aux autres Tumeurs ovariennes à petites cellules rondes”. Cytopathologie diagnostique . 36 (8): 595–599. doi : 10.1002/dc.20849 . PMID 18618728 . S2CID 21066080 .
- ^ Biskup W, Calaminus G, Schneider DT, Leuschner I, Göbel U (2006). “Tératome avec transformation maligne: expériences des protocoles coopératifs GPOH MAKEI 83/86/89/96”. Klinische Padiatrie . 218 (6): 303–308. doi : 10.1055/s-2006-942272 . PMID 17080331 .
- ^ Aktuğ T, Hakgüder G, Sarioğlu S, Akgür FM, Olguner M, Pabuçcuoğlu U (mars 2000). “Épendymomes extraspinaux sacrococcygiens: le rôle de la coccygectomie”. Journal de chirurgie pédiatrique . 35 (3): 515–518. doi : 10.1016/S0022-3468(00)90228-8 . PMID 10726703 .
- ^ Tapper D, Lack EE (septembre 1983). “Tératomes du nourrisson et de l’enfant. Une expérience de 54 ans au Centre Médical de l’Hôpital des Enfants” . Annales de Chirurgie . 198 (3): 398–410. doi : 10.1097/00000658-198309000-00016 . PMC 1353316 . PMID 6684416 .
- ^ Göbel U, Schneider DT, Calaminus G, Haas RJ, Schmidt P, Harms D (mars 2000). “Tumeurs des cellules germinales dans l’enfance et l’adolescence. GPOH MAKEI et les groupes d’étude MAHO” . Annales d’oncologie . 11 (3): 263–271. doi : 10.1023/a:1008360523160 . PMID 10811491 .
- ^ Mann JR, Gray ES, Thornton C, Raafat F, Robinson K, Collins GS, et al. (juillet 2008). “Tératomes extracrâniens matures et immatures chez les enfants: l’expérience du groupe d’étude sur le cancer des enfants britanniques”. Journal d’oncologie clinique . 26 (21): 3590–3597. doi : 10.1200/JCO.2008.16.0622 . PMID 18541896 .
- ^ Lo Curto M, D’Angelo P, Cecchetto G, Klersy C, Dall’Igna P, Federico A, et al. (avril 2007). “Tératomes matures et immatures: résultats de la première étude pédiatrique italienne”. Chirurgie Pédiatrique Internationale . 23 (4): 315–322. doi : 10.1007/s00383-007-1890-1 . PMID 17333214 . S2CID 1380993 .
- ^ Marina NM, Cushing B, Giller R, Cohen L, Lauer SJ, Ablin A, et al. (juillet 1999). “L’excision chirurgicale complète est un traitement efficace pour les enfants atteints de tératomes immatures avec ou sans éléments malins: une étude intergroupe du groupe d’oncologie pédiatrique / groupe de cancer des enfants”. Journal d’oncologie clinique . 17 (7): 2137–2143. doi : 10.1200/JCO.1999.17.7.2137 . PMID 10561269 .
- ^ Cushing B, Giller R, Ablin A, Cohen L, Cullen J, Hawkins E, et al. (Août 1999). “La résection chirurgicale seule est un traitement efficace du tératome immature de l’ovaire chez les enfants et les adolescents: un rapport du groupe d’oncologie pédiatrique et du groupe de cancer des enfants”. Journal américain d’obstétrique et de Gynécologie . 181 (2): 353–358. doi : 10.1016/S0002-9378(99)70561-2 . PMID 10454682 .
- ^ – Vaidya S, Sharma P, KC S, Vaidya SA (2014). « Spectre des Tumeurs ovariennes dans un hôpital de référence au Népal » . Journal de pathologie du Népal . 4 (7): 539–543. doi : 10.3126/jpn.v4i7.10295 . ISSN 2091-0908 .
– Ajustement mineur pour les tératomes kystiques matures (0,17 à 2 % de risque de cancer de l’ovaire) : Mandal S, Badhe BA (2012). “Transformation maligne dans un tératome mature avec dépôts métastatiques dans l’épiploon : à propos d’un cas” . Rapports de cas en pathologie . 2012 : 568062. doi : 10.1155/2012/568062 . PMC 3469088 . PMID 23082264 . - ^ Kyste Dermoïde orbitaire à eMedicine
- ^ Catone G, Marino G, Mancuso R, Zanghi A (avril 2004). “Caractéristiques clinicopathologiques d’un tératome ovarien équin”. Reproduction chez les animaux domestiques = Zuchthygiene . 39 (2): 65–69. doi : 10.1111/j.1439-0531.2003.00476.x . PMID 15065985 .
- ^ Artemis Moshtaghian (11 janvier 2016). “Le lion de montagne déformé est un mystère” . CNN . Chaine des informations du cable.
- ^ Lefebvre R, Théoret C, Doré M, Girard C, Laverty S, Vaillancourt D (novembre 2005). “Tératome ovarien et endométrite chez une jument” . La Revue vétérinaire canadienne . 46 (11): 1029-1033. PMC 1259148 . PMID 16363331 .
- ^ Gruys E, van Dijk JE (1976). “Quatre tératomes ovariens canins et un tératome félin non ovarien”. Pathologie Vétérinaire . 13 (6): 455–459. doi : 10.1177/030098587601300609 . PMID 1006958 . S2CID 46250641 .
- ^ López RM, Múrcia DB (août 2008). “Première description du tératome rétrobulbaire et intracrânien malin chez un faucon crécerellette (Falco naumanni)”. Pathologie aviaire . 37 (4): 413–414. doi : 10.1080/03079450802216660 . PMID 18622858 . S2CID 748134 .
- ^ Gutierrez-Aranda I, Ramos-Mejia V, Bueno C, Munoz-Lopez M, Real PJ, Mácia A, et al. (septembre 2010). “Les cellules souches pluripotentes induites humaines développent un tératome plus efficacement et plus rapidement que les cellules souches embryonnaires humaines, quel que soit le site d’injection” . Cellules souches . 28 (9) : 1568-1570. doi : 10.1002/stem.471 . PMC 2996086 . PMID 20641038 .
- ^ Knoepfler P (2021-01-14). « Qu’est-ce qu’un tératome ? Recherche et traitement » . Le créneau . Récupéré le 07/02/2021 .
- ^ Lee MO, Moon SH, Jeong HC, Yi JY, Lee TH, Shim SH, et al. (Août 2013). “Inhibition de la formation de tératome dérivé de cellules souches pluripotentes par de petites molécules” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 110 (35) : E3281–E3290. Bibcode : 2013PNAS..110E3281L . doi : 10.1073/pnas.1303669110 . PMC 3761568 . PMID 23918355 .
![]()
![]() Cet article incorpore du matériel du domaine public du document de l’US National Cancer Institute : “Dictionary of Cancer Terms” .
Cet article incorpore du matériel du domaine public du document de l’US National Cancer Institute : “Dictionary of Cancer Terms” .
Liens externes
| Wikimedia Commons a des médias liés à Teratomas . |
| Recherchez tératome dans Wiktionary, le dictionnaire gratuit. |
- images de pathologie humpath #2657 (Tératomes), #4541 (Tératome mature), #5350 (Tératome immature)
- tératome kystique sur eMedicine ( recherchez également dans EMedicine tous les articles contenant le mot tératome )
