Système cristallin cubique
En cristallographie , le système cristallin cubique (ou isométrique ) est un système cristallin où la cellule unitaire a la forme d’un cube . C’est l’une des formes les plus courantes et les plus simples trouvées dans les cristaux et les minéraux .

 Un modèle de réseau d’un système cubique primitif
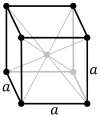
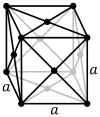
Un modèle de réseau d’un système cubique primitif  Les cellules unitaires primitives et cubiques compactes (également appelées cubiques à faces centrées)
Les cellules unitaires primitives et cubiques compactes (également appelées cubiques à faces centrées)
Il existe trois variétés principales de ces cristaux :
- Cubique primitif (abrégé cP et alternativement appelé cubique simple )
- Cubique centré sur le corps (abrégé cI ou bcc )
- Cubique à faces centrées (abrégé cF ou fcc , et alternativement appelé cubique compact ou ccp )
Chacun est subdivisé en d’autres variantes énumérées ci-dessous. Notez que bien que la cellule unitaire de ces cristaux soit traditionnellement considérée comme un cube, la cellule unitaire primitive ne l’ est souvent pas.
Treillis de Bravais
Les trois réseaux de Bravais dans le système cristallin cubique sont :
| Treillis de Bravais | Cubique primitif | Cubique centré | Cubique face centrée |
|---|---|---|---|
| Symbole poire | CP | cI | FC |
| Cellule unitaire | 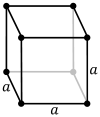  |
  |
  |
Le réseau cubique primitif (cP) consiste en un point de réseau à chaque coin du cube. Chaque atome à un point du réseau est alors partagé également entre huit cubes adjacents, et la cellule unitaire contient donc au total un atome ( 1 ⁄ 8 × 8). [1]
Le réseau cubique centré sur le corps (cI) a un point de réseau au centre de la cellule unitaire en plus des huit points d’angle. Il a un total net de 2 points de réseau par cellule unitaire ( 1 ⁄ 8 × 8 + 1). [1]
Le réseau cubique à faces centrées (cF) a des points de réseau sur les faces du cube, qui donnent chacun exactement une demi-contribution, en plus des points de réseau d’angle, ce qui donne un total de 4 points de réseau par cellule unitaire ( 1 ⁄ 8 × 8 des coins plus 1 ⁄ 2 × 6 des faces). Chaque sphère dans un réseau cF a le numéro de coordination 12. Le numéro de coordination est le nombre de voisins les plus proches d’un atome central dans la structure. [1]
Le réseau cubique à faces centrées est étroitement lié au système hexagonal compact (hcp), où deux systèmes ne diffèrent que par les emplacements relatifs de leurs couches hexagonales. Le plan [111] d’un réseau cubique à faces centrées est une grille hexagonale.
Tenter de créer un treillis cubique centré sur la base (c’est-à-dire mettre un point de treillis supplémentaire au centre de chaque face horizontale) donnerait un simple treillis de Bravais tétragonal .
Cours de cristal
Les noms de classe de système cristallin isométrique , les groupes de points (en notation Schönflies , notation Hermann – Mauguin , orbifold et notation Coxeter ), le type, les exemples, le numéro de groupe d’espace des tables internationales de cristallographie , [2] et les groupes d’espace sont répertoriés dans le tableau ci-dessous . Il y a un total de 36 groupes d’espace cubiques.
| # | Groupe de points | Taper | Exemple | Groupes d’espace | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nom [3] | Schön. | International | Orbe. | Barreur. | Primitif | Centré sur le visage | Centré sur le corps | |||
| 195–197 | Tétartoïde | J | 23 | 332 | [3,3] + | énantiomorphe | Ullmannite , Chlorate de sodium | P23 | F23 | I23 |
| 198–199 | P2 1 3 | I2 1 3 | ||||||||
| 200–204 | diploïde | Th _ | 2/m 3 (m 3 ) |
3*2 | [3 + ,4] | centrosymétrique | Pyrite | Pm 3 , Pn 3 | Fm 3 , Fd 3 | je 3 |
| 205–206 | Pa 3 | Ia 3 | ||||||||
| 207-211 | gyroïde | O | 432 | 432 | [3,4] + | énantiomorphe | Petzite | P432 , P4 2 32 | F432, F4 1 32 | I432 |
| 212–214 | P4 3 32, P4 1 32 | I4 1 32 | ||||||||
| 215–217 | Hextétraédrique | T d | 4 3m | *332 | [3,3] | Sphalérite | P4 3m _ | F4 3m _ | je 4 3m | |
| 218–220 | P4 3n _ | F 4 3c | je 4 3d | |||||||
| 221–230 | Hexoctaédrique | Ohh _ | 4/m 3 2/m (m 3 m) |
*432 | [3,4] | centrosymétrique | Galène , Halite | Pm 3 m, Pn 3 n, Pm 3 n , Pn 3 m | Fm 3 m , Fm 3 c, Fd 3 m, Fd 3 c | Im 3 m, Ia 3 d |
Les autres termes pour hexaoctaédrique sont : classe normale, holoédrique , classe centrale ditessérale, type galène .
Vides dans la cellule unitaire

 Visualisation d’une cellule unitaire cubique en diamant : 1. Composants d’une cellule unitaire, 2. Une cellule unitaire, 3. Un réseau de 3 x 3 x 3 cellules unitaires
Visualisation d’une cellule unitaire cubique en diamant : 1. Composants d’une cellule unitaire, 2. Une cellule unitaire, 3. Un réseau de 3 x 3 x 3 cellules unitaires
Les vides dans la cellule unitaire sont également appelés sites interstitiels ou trous. Ils sont l’espace vide qui existe entre l’emballage des atomes (sphères) dans les cellules unitaires. [4]


Les trous sont faciles à voir si vous essayez d’emballer des cercles ensemble. Peu importe à quel point vous les rapprochez ou comment vous les disposez, vous aurez un espace vide entre les deux. La même chose est vraie dans une cellule unitaire, quelle que soit la disposition des atomes, il y aura des sites interstitiels présents entre les atomes. Ces sites ou trous peuvent être remplis d’autres atomes. L’image avec des cercles remplis n’est qu’une représentation 2D. Dans un réseau cristallin, les atomes (sphères) seraient emballés dans un arrangement 3D. Il en résulte des sites interstitiels de formes différentes en fonction de la disposition des atomes dans le réseau.
Une simple cellule unitaire cubique, avec des empilements d’atomes disposés comme si aux huit coins d’un cube, formerait un seul trou cubique ou vide au centre.
Une cellule unitaire compacte, à la fois cubique à faces centrées et hexagonale compacte, peut former deux trous de formes différentes. En regardant les trois sphères vertes dans l’illustration de l’emballage hexagonal, elles forment un trou en forme de triangle. Si un atome est disposé au-dessus de ce trou triangulaire, il forme un trou interstitiel tétraédrique. Si les trois atomes de la couche au-dessus sont tournés et que leur trou triangulaire se trouve au-dessus de celui-ci, il forme un trou interstitiel octaédrique. [4] Dans une structure compacte, il y a 4 atomes par cellule unitaire et elle aura 4 vides octaédriques (rapport 1:1) et 8 vides tétraédriques (rapport 1:2) par cellule unitaire. [5]Le vide tétraédrique est de plus petite taille et pourrait contenir un atome avec un rayon de 0,225 fois la taille des atomes composant le réseau. Un vide octaédrique pourrait contenir un atome avec un rayon de 0,441 fois la taille des atomes composant le réseau. [5] Un atome qui remplit cet espace vide pourrait être plus grand que ce rapport de rayon idéal, ce qui conduirait à un réseau déformé en raison de l’expulsion des atomes environnants, mais il ne peut pas être inférieur à ce rapport. [5]
Une cellule unitaire cubique centrée sur le corps a six vides octaédriques situés au centre de chaque face de la cellule unitaire, et douze autres situés au milieu de chaque bord de la même cellule, pour un total de six vides octaédriques nets. De plus, il y a 24 vides tétraédriques situés dans un espacement carré autour de chaque vide octaédrique, pour un total de douze vides tétraédriques nets. Ces vides tétraédriques ne sont pas des maxima locaux et ne sont techniquement pas des vides, mais ils apparaissent parfois dans des cellules unitaires multi-atomes.
Une caractéristique importante d’une structure cristalline est son facteur de tassement atomique . Ceci est calculé en supposant que tous les atomes sont des sphères identiques, avec un rayon suffisamment grand pour que chaque sphère bute sur la suivante. Le facteur de garnissage atomique est la proportion d’espace rempli par ces sphères.
En supposant un atome par point de réseau, dans un réseau cubique primitif avec une longueur de côté de cube a , le rayon de la sphère serait a ⁄ 2 et le facteur de remplissage atomique s’avère être d’environ 0,524 (ce qui est assez faible). Cela signifie que le volume de la cellule unitaire réellement occupé par les atomes n’est que de 52,4 %. De même, dans un réseau bcc , le facteur de remplissage atomique est de 0,680 et dans fcc , il est de 0,740. La valeur fcc est la valeur théoriquement la plus élevée possible pour n’importe quel réseau, bien qu’il existe d’autres réseaux qui atteignent également la même valeur, tels que l’hexagone compact ( hcp ) et une version de tétraédrique bcc .
Structures à élément unique
En règle générale, étant donné que les atomes d’un solide s’attirent, les arrangements d’atomes les plus serrés ont tendance à être plus courants. (Des arrangements lâchement emballés se produisent, cependant, par exemple si l’ hybridation orbitale exige certains angles de liaison .) En conséquence, la structure cubique primitive, avec un facteur d’emballage atomique particulièrement faible, est rare dans la nature, mais se trouve dans le polonium . [6] [7] Le bcc et le fcc , avec leurs densités plus élevées, sont tous deux assez courants dans la nature. Des exemples de bcc incluent le fer , le chrome , le tungstène et le niobium . Exemples defcc comprend l’aluminium , le cuivre , l’ or et l’argent .
Une autre structure cristalline cubique importante est la structure cubique du diamant , qui peut apparaître dans le carbone , le silicium , le germanium et l’ étain . Contrairement à fcc et bcc, cette structure n’est pas un réseau, car elle contient plusieurs atomes dans sa Cellule primitive . D’autres structures élémentaires cubiques incluent la structure A15 trouvée dans le tungstène et la structure extrêmement compliquée du manganèse .
Structures multi-éléments
Les composés constitués de plus d’un élément (par exemple , les composés binaires ) ont souvent des structures cristallines basées sur le système cristallin cubique. Certains des plus courants sont répertoriés ici.
Structure du chlorure de césium
Voir aussi: Catégorie: Structure cristalline du chlorure de césium 
 Une cellule unitaire de chlorure de césium . Les deux couleurs des sphères représentent les deux types d’atomes.
Une cellule unitaire de chlorure de césium . Les deux couleurs des sphères représentent les deux types d’atomes.
Une structure est la structure “cubique primitive interpénétrante”, également appelée structure “chlorure de césium”. Cette structure est souvent confondue avec une structure cubique centrée sur le corps, car l’arrangement des atomes est le même. La vraie structure est montrée dans le graphique montrant deux structures cubiques primitives individuelles qui se superposent avec le coin d’une structure au centre du cube de l’autre structure. Cela aide à se convaincre qu’il n’est pas cubique centré car il n’y a pas de symétrie de translation le long du plan 1⁄2, 1⁄2, 1⁄2, le chlorure serait traduit en un césium, pas un autre chlorure. [8]

 Ce graphique montre les réseaux cubiques simples imbriqués de césium et de chlore. Vous pouvez les voir séparément et comme ils sont imbriqués dans ce qui ressemble à un arrangement cubique centré sur le corps
Ce graphique montre les réseaux cubiques simples imbriqués de césium et de chlore. Vous pouvez les voir séparément et comme ils sont imbriqués dans ce qui ressemble à un arrangement cubique centré sur le corps
Cela fonctionne de la même manière pour la structure NaCl décrite dans la section suivante. Si vous enlevez les atomes de Cl, les atomes de Na restants forment toujours une structure FCC, pas une simple structure cubique.
Dans la cellule unitaire de CsCl, chaque ion est au centre d’un cube d’ions de nature opposée, de sorte que le nombre de coordination est de huit. Dans l’ensemble, la disposition des atomes est la même que celle du cubique centré sur le corps, mais avec des types d’atomes alternés sur les différents sites du réseau. Alternativement, on pourrait voir ce réseau comme une simple structure cubique avec un atome secondaire dans son vide cubique.
En plus du chlorure de césium lui-même, la structure apparaît également dans certains autres halogénures alcalins lorsqu’ils sont préparés à basse température ou à haute pression. [9] Généralement, cette structure est plus susceptible d’être formée de deux éléments dont les ions sont à peu près de la même taille (par exemple, rayon ionique de Cs + = 167 pm et Cl – = 181 pm).
Le nombre de coordination de chaque atome dans la structure est 8 : le cation central est coordonné à 8 anions sur les coins d’un cube comme indiqué, et de même, l’anion central est coordonné à 8 cations sur les coins d’un cube.
Le groupe d’espace de la structure du chlorure de césium (CsCl) est appelé Pm 3 m (en notation Hermann-Mauguin ) ou “221” (dans les Tables internationales de cristallographie). La désignation Strukturbericht est “B2”. [dix]
Il existe près d’une centaine de Composés intermétalliques de terres rares qui cristallisent dans la structure CsCl, dont de nombreux composés binaires de terres rares avec du magnésium , [11] et avec des éléments des groupes 11 , 12 , [12] [13] et 13 . D’autres composés présentant une structure semblable au chlorure de césium sont CsBr , CsI , RbCl à haute température , AlCo, AgZn, BeCu, MgCe, RuAl et SrTl. [ citation nécessaire ]
Structure en sel gemme
Voir aussi: Catégorie: Structure cristalline du sel gemme 
 La structure cristalline du sel gemme. Chaque atome a six voisins les plus proches, avec une Géométrie octaédrique .
La structure cristalline du sel gemme. Chaque atome a six voisins les plus proches, avec une Géométrie octaédrique .
Le groupe spatial de la structure de sel gemme (NaCl) est appelé Fm 3 m (en notation Hermann-Mauguin ), ou “225” (dans les Tables internationales de cristallographie). La désignation Strukturbericht est “B1”. [14]
Dans la structure du sel gemme ou du chlorure de sodium ( halite ), chacun des deux types d’atomes forme un réseau cubique à faces centrées séparé, les deux réseaux s’interpénétrant de manière à former un motif en damier 3D. Plus tôt, il a été déclaré qu’il y avait un trou octaédrique par atome dans une structure cubique compacte. Dans le chlorure de sodium, il existe un rapport de 1: 1 entre les atomes de sodium et de chlore. La structure peut également être décrite comme un réseau FCC de sodium avec du chlore occupant chaque vide octaédrique ou vice versa. [8]
Des exemples de composés avec cette structure comprennent le chlorure de sodium lui-même, ainsi que presque tous les autres halogénures alcalins, et “de nombreux oxydes, sulfures, séléniures et tellurures de métaux divalents”. [9] Selon la règle du rapport de rayon , cette structure est plus susceptible de se former si le cation est un peu plus petit que l’anion (un rapport de rayon cation/anion de 0,414 à 0,732).
Le nombre de coordination de chaque atome dans cette structure est 6 : chaque cation est coordonné à 6 anions aux sommets d’un octaèdre , et de même, chaque anion est coordonné à 6 cations aux sommets d’un octaèdre.
La distance interatomique (distance entre le cation et l’anion, ou la moitié de la longueur de cellule unitaire a ) dans certains cristaux à structure de sel gemme est : 2,3 Å (2,3 × 10 −10 m) pour NaF, [15] 2,8 Å pour NaCl, [ 16] et 3,2 Å pour SnTe. [17] La plupart des hydrures et halogénures de métaux alcalins ont la structure du sel gemme, bien que quelques-uns aient à la place la structure du chlorure de césium .
| Hydrures | Fluorures | Chlorures | Bromures | Iodures | |
|---|---|---|---|---|---|
| Lithium | hydrure de lithium | Fluorure de lithium [18] | Chlorure de lithium | Bromure de lithium | Iodure de lithium |
| Sodium | hydrure de sodium | Fluorure de sodium [18] | Chlorure de sodium | Bromure de sodium | Iodure de sodium |
| Potassium | Hydrure de potassium | Fluorure de potassium [18] | Chlorure de potassium | Bromure de potassium | Iodure de potassium |
| Rubidium | hydrure de rubidium | Fluorure de rubidium | Chlorure de rubidium | Bromure de rubidium | Iodure de rubidium |
| Césium | hydrure de césium | Fluorure de césium | (structure CsCl) | ||
| Oxydes | Sulfures | Séléniures | Tellurides | Polonides | |
| Magnésium | L’oxyde de magnésium | Sulfure de magnésium | Séléniure de magnésium [19] | Tellurure de magnésium [20] | (structure NiAs) |
| Calcium | Oxyde de calcium | Sulfure de calcium | Séléniure de calcium [21] | Tellurure de calcium | Polonure de calcium [22] |
| Strontium | Oxyde de strontium | Sulfure de strontium | Séléniure de strontium | Tellurure de strontium | Polonure de strontium [22] |
| Baryum | Oxyde de baryum | Sulfure de baryum | Séléniure de baryum | Tellurure de baryum | Polonure de baryum [22] |
| Nitrures | Phosphures | Arsénides | Antimonides | Bismuthides | |
| Scandium | Nitrure de scandium | Phosphure de scandium | Arséniure de scandium [24] | Antimoniure de scandium [25] | Bismuthure de scandium [26] |
| Yttrium | Nitrure d’yttrium | Phosphure d’yttrium | Arséniure d’yttrium [27] | Antimoniure d’yttrium | Bismuthure d’yttrium [28] |
| Lanthane | Nitrure de lanthane [29] | Phosphure de lanthane [30] | Arséniure de lanthane [27] | Antimoniure de lanthane | Bismuthure de lanthane [31] |
| Cérium | Nitrure de cérium [29] | Phosphure de cérium [30] | Arséniure de cérium [27] | Antimoniure de cérium | Bismuthure de cérium [31] |
| Praséodyme | Nitrure de praséodyme [29] | Phosphure de praséodyme [30] | Arséniure de praséodyme [27] | Antimoniure de praséodyme [32] | Bismuthure de praséodyme [31] |
| Néodyme | Nitrure de néodyme [29] | Phosphure de néodyme [30] | Arséniure de néodyme [27] | Antimoniure de néodyme [32] | Bismuthure de néodyme [31] |
| Prométhium | ? | ? | ? | ? | ? |
| Samarium | Nitrure de samarium [29] | Phosphure de samarium [30] | Arséniure de samarium [27] | Antimoniure de samarium [32] | Bismuthure de samarium [31] |
| Europium | Nitrure d’europium [29] | Phosphure d’europium | ( Structure Na2O2 ) [ 33] | (instable) [34] | |
| Gadolinium | Nitrure de gadolinium [29] | Phosphure de gadolinium | Arséniure de gadolinium [27] | Antimoniure de gadolinium [32] | Bismuthure de gadolinium [31] |
| Terbium | Nitrure de terbium [29] | Phosphure de terbium | Arséniure de terbium [27] | Antimoniure de terbium [32] | Bismuthure de terbium [31] |
| Dysprosium | Nitrure de dysprosium [29] | Phosphure de dysprosium | Arséniure de dysprosium | Antimoniure de dysprosium | Bismuthure de dysprosium [31] |
| Holmium | Nitrure d’holmium [29] | Phosphure d’holmium | Arséniure d’holmium [27] | Antimoniure d’holmium | Bismuthure d’holmium [31] |
| Erbium | Nitrure d’erbium [29] | Phosphure d’erbium | Arséniure d’erbium [27] | Antimoniure d’erbium | Bismuthure d’erbium [31] |
| Thulium | Nitrure de thulium [29] | Phosphure de thulium | Arséniure de thulium | Antimoniure de thulium | Bismuthure de thulium [31] |
| Ytterbium | Nitrure d’ytterbium [29] | Phosphure d’ytterbium | Arséniure d’ytterbium [27] | Antimoniure d’ytterbium | (instable) [35] [36] |
| Lutétium | Nitrure de lutétium [29] | Phosphure de lutétium | Arséniure de lutétium | Antimoniure de lutétium | Bismuthure de lutétium |
| Actinium | ? | ? | ? | ? | ? |
| Thorium | Nitrure de thorium [37] | Phosphure de thorium [37] | Arséniure de thorium [37] | Antimoniure de thorium [37] | (structure CsCl) |
| Protactinium | ? | ? | ? | ? | ? |
| Uranium | Nitrure d’uranium [37] | Monophosphure d’uranium [37] | Arséniure d’uranium [37] | Antimoniure d’uranium [37] | Bismuthure d’uranium [38] |
| Neptunium | Nitrure de neptunium | Phosphure de neptunium | Arséniure de neptunium | Antimoniure de neptunium | Bismuthure de neptunium [38] |
| Plutonium | Nitrure de plutonium [37] | Phosphure de plutonium [37] | Arséniure de plutonium [37] | Antimoniure de plutonium [37] | Bismuthure de plutonium [38] |
| Américium | Nitrure d’américium [38] | Phosphure d’américium [38] | Arséniure d’américium [38] | Antimoniure d’américium [38] | Bismuthure d’américium [38] |
| Curium | Nitrure de curium [39] | Phosphure de curium [39] | Arséniure de curium [39] | Antimoniure de curium [39] | Bismuthure de curium [39] |
| Berkélium | Nitrure de berkélium [39] | Phosphure de berkélium [39] | Arséniure de berkélium [39] | ? | Bismuthure de berkélium [39] |
| Californie | ? | ? | Arséniure de californium [39] | ? | Bismuthure de californium [39] |
| Oxydes | Sulfures | Séléniures | Tellurides | Polonides | |
| Scandium | (instable) [40] | Monosulfure de scandium | |||
| Yttrium | Monosulfure d’yttrium [41] | ||||
| Lanthane | Monosulfure de lanthane [42] | ||||
| Cérium | Monosulfure de cérium [42] | Monoséléniure de cérium [43] | Monotellurure de cérium [43] | ||
| Praséodyme | Monosulfure de praséodyme [42] | Monoséléniure de praséodyme [43] | Monotellurure de praséodyme [43] | ||
| Néodyme | Monosulfure de néodyme [42] | Monoséléniure de néodyme [43] | Monotellurure de néodyme [43] | ||
| Prométhium | ? | ? | ? | ? | |
| Samarium | Monosulfure de samarium [42] | Monoséléniure de samarium | Monotellurure de samarium | Monoponide de samarium [44] | |
| Europium | Monoxyde d’europium | Monosulfure d’europium [42] | Monoséléniure d’europium [45] | Monotellurure d’europium [45] | Monoponide d’europium [44] |
| Gadolinium | (instable) [40] | Monosulfure de gadolinium [42] | |||
| Terbium | Monosulfure de terbium [42] | Monoponide de terbium [44] | |||
| Dysprosium | Monosulfure de dysprosium [42] | Monoponide de dysprosium [44] | |||
| Holmium | Monosulfure d’holmium [42] | Monoponide d’holmium [44] | |||
| Erbium | Monosulfure d’erbium [42] | ||||
| Thulium | Monosulfure de thulium [42] | Monoponide de thulium [44] | |||
| Ytterbium | Monoxyde d’ytterbium | Monosulfure d’ytterbium [42] | Monoponide d’ytterbium [44] | ||
| Lutétium | (instable) [40] [46] | Monosulfure de lutétium [42] | Monoponide de lutétium [44] | ||
| Actinium | ? | ? | ? | ? | |
| Thorium | Monosulfure de thorium [37] | Monoséléniure de thorium [37] | (structure CsCl) [47] | ||
| Protactinium | ? | ? | ? | ? | |
| Uranium | Monosulfure d’uranium [37] | Monoséléniure d’uranium [37] | Monotellurure d’uranium [37] | ||
| Neptunium | Monosulfure de neptunium | Monoséléniure de neptunium | Monotellurure de neptunium | ||
| Plutonium | Monosulfure de plutonium [37] | Monoséléniure de plutonium [37] | Monotellurure de plutonium [37] | ||
| Américium | Monosulfure d’américium [38] | Monoséléniure d’américium [38] | Monotellurure d’américium [38] | ||
| Curium | Monosulfure de curium [39] | Monoséléniure de curium [39] | Monotellurure de curium [39] | ||
| Carbures | Nitrures | ||||
| Titane | Carbure de titane | Nitrure de titane | |||
| Zirconium | Carbure de zirconium | Nitrure de zirconium | |||
| Hafnium | Carbure d’hafnium | Nitrure d’hafnium [48] | |||
| Vanadium | Carbure de vanadium | Nitrure de vanadium | |||
| Niobium | Carbure de niobium | Nitrure de niobium | |||
| Tantale | Carbure de tantale | (Structure CoSn) | |||
| Chrome | (instable) [49] | Nitrure de chrome |
De nombreux monoxydes de métaux de transition ont également la structure du sel gemme ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). Les monocarbures d’actinoïdes précoces ont également cette structure ( ThC , PaC , UC , NpC , PuC ). [39] D’autres composés présentant une structure de type sel gemme sont TiB , [50] ZrB , [51] PbS , PbSe , PbTe , SnTe, AgF , AgCl et AgBr .
Structure en fluorine
Voir aussi : Catégorie : Structure cristalline de la fluorite
Tout comme la structure du sel gemme, la structure de la fluorite (AB 2 ) est également une structure Fm 3 m mais a un rapport d’ions de 1:2. La structure anti-fluorite est presque identique, sauf que les positions des anions et des cations sont inversées dans la structure. Ils sont désignés positions Wyckoff 4a et 8c tandis que les positions de structure de sel gemme sont 4a et 4b. [52] [53]
Structure en zinc mélangé
Voir aussi : Catégorie : Structure cristalline du zincblende 
 Une cellule unitaire en zincblende
Une cellule unitaire en zincblende
Le groupe d’espace de la structure Zincblende est appelé F 4 3m (en notation Hermann-Mauguin ), ou 216. [54] [55] La désignation Strukturbericht est “B3”. [56]
La structure Zincblende (également écrite “zinc blende”) tire son nom du minéral zincblende ( sphalérite ), une forme de sulfure de zinc (β-ZnS). Comme dans la structure du sel gemme, les deux types d’atomes forment deux réseaux cubiques à faces centrées interpénétrés. Cependant, il diffère de la structure du sel gemme par la façon dont les deux réseaux sont positionnés l’un par rapport à l’autre. La structure zincblende a une coordination tétraédrique : les plus proches voisins de chaque atome sont constitués de quatre atomes de type opposé, positionnés comme les quatre sommets d’un tétraèdre régulier . Dans le sulfure de zinc, le rapport zinc/soufre est de 1:1. [8] Dans l’ensemble, la disposition des atomes dans la structure zincblende est la même que celle du diamant cubiquestructure, mais avec des types d’atomes alternés sur les différents sites du réseau.
Des exemples de composés avec cette structure comprennent le zincblende lui-même, le nitrate de plomb (II) , de nombreux semi-conducteurs composés (tels que l’arséniure de gallium et le tellurure de cadmium ) et un large éventail d’autres composés binaires. [ citation nécessaire ] Les pnictogénures du groupe du bore ont généralement une structure zincblende, bien que les nitrures soient plus courants dans la structure wurtzite , et leurs formes zincblende sont des polymorphes moins connus . [57] [58]
| Fluorures | Chlorures | Bromures | Iodures | |
|---|---|---|---|---|
| Cuivre | Fluorure de cuivre(I) | Chlorure de cuivre(I) | Bromure de cuivre(I) | Iodure de cuivre(I) |
| Sulfures | Séléniures | Tellurides | Polonides | |
| Béryllium | Sulfure de béryllium | Séléniure de béryllium | Tellurure de béryllium | Polonure de béryllium [59] [60] |
| Zinc | Sulfure de zinc | Séléniure de zinc | Tellurure de zinc | Poloniure de zinc |
| Cadmium | Sulfure de cadmium | Séléniure de cadmium | Tellurure de cadmium | Polonure de cadmium |
| Mercure | Sulfure de mercure | Séléniure de mercure | Tellurure de mercure | – |
Ce groupe est également connu sous le nom de famille II-VI de composés, dont la plupart peuvent être fabriqués à la fois sous la forme zincblende (cubique) ou wurtzite (hexagonale).
| Nitrures | Phosphures | Arsénides | Antimonides | |
|---|---|---|---|---|
| Bore | Nitrure de bore * | Phosphure de bore | Arséniure de bore | Bore antimoniure |
| Aluminium | Nitrure d’aluminium * | Phosphure d’aluminium | Arséniure d’aluminium | Antimoniure d’aluminium |
| Gallium | Nitrure de gallium * | Phosphure de gallium | Arséniure de gallium | Antimoniure de gallium |
| Indium | Nitrure d’indium * | Phosphure d’indium | Arséniure d’indium | Antimoniure d’indium |
Ce groupe est également connu sous le nom de famille de composés III-V .
Structure Heusler

 La structure des composés de Heusler avec la formule X 2 YZ (par exemple, Co 2 MnSi).
La structure des composés de Heusler avec la formule X 2 YZ (par exemple, Co 2 MnSi).
La structure de Huesler, basée sur la structure de Cu 2 MnAl, est une structure courante pour les composés ternaires impliquant des métaux de transition . Il a le groupe spatial Fm 3 m (n° 225) et la désignation Strukturbericht est L2 1 . Avec les composés étroitement apparentés demi-Heusler et inverse-Huesler, il existe des centaines d’exemples.
Structure monosiliciure de fer
Voir aussi: Catégorie: Type de structure monosiliciure de fer 
 Schéma de la structure du monosiliciure de fer .
Schéma de la structure du monosiliciure de fer .
Le groupe d’espace de la structure monosiliciure de fer est P2 1 3 (n° 198) et la désignation Strukturbericht est B20. Il s’agit d’une structure chirale , et est parfois associée à des propriétés hélimagnétiques . Il y a quatre atomes de chaque élément pour un total de huit atomes dans la cellule unitaire.
Des exemples se produisent parmi les siliciures et les germanures de métaux de transition, ainsi que quelques autres composés tels que le palladure de gallium .
| Siliciures | Germanides | |
|---|---|---|
| Manganèse | Monosiliciure de manganèse | Germaniure de manganèse |
| Fer | Monosiliciure de fer | Germaniure de fer |
| Cobalt | Monosiliciure de cobalt | Germaniure de cobalt |
| Chrome | Siliciure de chrome(IV) | Germaniure de chrome(IV) |
Structure de Weaire-Phelan

 Structure de Weaire-Phelan
Structure de Weaire-Phelan
La structure de Weaire–Phelan a une symétrie Pm 3 n (223).
Il a 3 orientations de tétradécaèdres empilés avec des cellules pyritoédriques dans les interstices. On le trouve sous forme de structure cristalline en chimie où il est généralement connu sous le nom de ” structure de clathrate de type I “. Les hydrates de gaz formés par le méthane, le propane et le dioxyde de carbone à basse température ont une structure dans laquelle les molécules d’eau se trouvent aux nœuds de la structure Weaire-Phelan et sont liées ensemble par de l’hydrogène , et les plus grosses molécules de gaz sont piégées dans les cages polyédriques.
Voir également
- Atomium : bâtiment qui est un modèle de cellule unitaire bcc , à corps diagonal vertical.
- Emballage serré
- Structure en cristal
- Luxations
- Réseau réciproque
Références
- ^ un bc PM de Wolff, NV Belov, EF Bertaut, MJ Buerger, JDH Donnay, W. Fischer, Th. Hahn, VA Koptsik, AL Mackay, H. Wondratschek, AJC Wilson et SC Abrahams (1985). “Nomenclature des familles cristallines, types de réseau de Bravais et classes arithmétiques. Rapport du Comité ad hoc de l’Union internationale de cristallographie sur la nomenclature de la symétrie” . Acta Crystallographica Section A . 41 (3): 278. doi : 10.1107/S0108767385000587 .{{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Prince, E., éd. (2006). Tables internationales de cristallographie . Union Internationale de Cristallographie. doi : 10.1107/97809553602060000001 . ISBN 978-1-4020-4969-9.
- ^ Cristallographie et minéraux arrangés par Crystal Form , Webmineral
- ^ un b “Que voulons-nous dire par Vides à l’état solide?” . Archivé de l’original le 18/06/2016.
- ^ un bc “l’Étude de Vides Interstitiels “ . Archivé de l’original le 2020-08-04.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ La découverte originale était dans J. Chem. Phys. 14 , 569 (1946).
- ^ un bc “les Treillis Cubiques et l’Emballage Fermé” . 3 octobre 2013. Archivé de l’original le 2020-11-01.
- ^ un b Seitz, Théorie moderne des solides (1940), p.49
- ^ La structure CsCl (B2) archivée le 15/09/2008 à la Wayback Machine
- ^ Saccone, A.; Delfino, S.; Maccio, D.; En ligneFerro, R. (1993). “Diagrammes de phase de terre rare au magnésium: étude expérimentale du système Ho-Mg”. Journal des équilibres de phase . Springer Science et Business Media LLC. 14 (3): 280–287. doi : 10.1007/bf02668225 . ISSN 1054-9714 . S2CID 95011597 .
- ^ Kanematu, K; T. Alfieri, G. ; Banks, E. (1969). “Études magnétiques des composés de zinc de terres rares avec structure CsCl”. Journal de la Société de physique du Japon . Société de physique du Japon. 26 (2): 244-248. Bibcode : 1969JPSJ…26..244K . doi : 10.1143/jpsj.26.244 . ISSN 0031-9015 .
- ^ Buschow, KHJ (1974). “Propriétés magnétiques des composés de cadmium de terres rares de type CsCl”. Le Journal de Physique Chimique . Édition AIP. 61 (11): 4666–4670. Bibcode : 1974JChPh..61.4666B . doi : 10.1063/1.1681788 . ISSN 0021-9606 .
- ^ La structure NaCl (B1) archivée le 19/10/2008 à la Wayback Machine
- ^ Sundquist, JJ; Lin, CC (1981). “Structure électronique du centre F dans un cristal de fluorure de sodium”. Journal of Physics C: Physique de l’état solide . 14 (32): 4797–4805. Bibcode : 1981JPhC…14.4797S . doi : 10.1088/0022-3719/14/32/016 .
- ^ Abrahams, SC; Bernstein, JL (1965). “Précision d’un diffractomètre automatique. Mesure des facteurs de structure du chlorure de sodium”. Acta Crystallogr. 18 (5): 926–932. doi : 10.1107/S0365110X65002244 .
- ^ Kao, W.; En lignePeretti, E. (1970). “Le sous-système ternaire Sn4As3-SnAs-SnTe”. Journal des métaux moins courants . 22 : 39–50. doi : 10.1016/0022-5088(70)90174-8 .
- ^ a b c J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, JP Cuer, “Fluorine Compounds, Inorganic” (section 4) dans Ullmann’s Encyclopedia of Industrial Chemistry, Wiley- VCH, Weinheim, 2005. doi : 10.1002/14356007.a11_307 .
- ^ Broch, Einar (1927-06-01). “Präzisionsbestimmungen der Gitterkonstanten der Verbindungen MgO, MgS, MgSe, MnO et MnSe”. Zeitschrift für Physikalische Chemie (en allemand). Walter de Gruyter GmbH. 127U (1) : 446–454. doi : 10.1515/zpch-1927-12724 . ISSN 2196-7156 . S2CID 100227546 .
- ^ Mir, Showkat H.; Jha, Prakash C.; Dabhi, Shweta ; En ligneJha, Prafulla K. (2016). “Étude ab initio de la stabilité de phase, de la dynamique du réseau et des propriétés thermodynamiques des chalcogénures de magnésium”. Chimie et physique des matériaux . Elsevier BV. 175 : 54–61. doi : 10.1016/j.matchemphys.2016.02.066 . ISSN 0254-0584 .
- ^ Louail, L.; Haddadi, K.; Maouche, D.; Ali Sahraoui, F.; En ligneHachemi, A. (2008). “Structure de bande électronique de séléniure de calcium sous pression”. Physique B : Matière Condensée . Elsevier BV. 403 (18): 3022–3026. Bibcode : 2008PhyB..403.3022L . doi : 10.1016/j.physb.2008.03.009 . ISSN 0921-4526 .
- ^ un bc Brown , SA; Brown, PL (2019). La chimie aqueuse du polonium et l’application pratique de sa thermochimie . Sciences Elsevier. p. 25. ISBN 978-0-12-819309-9. Récupéré le 08/01/2022 .
- ^ Hulliger, F. (1979). “Chapitre 33 Pnictures de terres rares”. Manuel de Physique et Chimie des Terres Rares . Vol. 4. Elsevier. p. 153–236. doi : 10.1016/s0168-1273(79)04006-x . ISBN 9780444852168. ISSN 0168-1273 .
- ^ Gschneidner, KA; Calderwood, FW (1986). “Le système As-Sc (Arsenic-Scandium)”. Bulletin des diagrammes de phase d’alliage . Springer Science et Business Media LLC. 7 (4): 348–349. doi : 10.1007/bf02873011 . ISSN 0197-0216 .
- ^ Hayashi, J; Shirotani, je ; Hirano, K; Ishimatsu, N; Shimomura, O; En ligneKikegawa, T (2003). “Transition de phase structurelle de ScSb et YSb avec une structure de type NaCl à haute pression”. Communications à semi-conducteurs . Elsevier BV. 125 (10): 543–546. Bibcode : 2003SSCom.125..543H . doi : 10.1016/s0038-1098(02)00889-x . ISSN 0038-1098 .
- ^ Horovitz, CT (2012). Scandium Son Occurrence, Chimie Physique, Métallurgie, Biologie et Technologie . Sciences Elsevier. p. 273.ISBN _ 978-0-323-14451-3. Récupéré le 06/01/2022 .
- ^ un bcd e f g h i j k Ono , S.; Despault, JG; Calvert, LD ; Taylor, JB (1970). “Arséniures de terres rares”. Journal des métaux moins courants . Elsevier BV. 22 (1): 51–59. doi : 10.1016/0022-5088(70)90175-x . ISSN 0022-5088 .
- ^ Schmidt, FA; McMasters, DO ; Lichtenberg, RR (1969). “Le système d’alliage yttrium-bismuth”. Journal des métaux moins courants . Elsevier BV. 18 (3): 215–220. doi : 10.1016/0022-5088(69)90159-3 . ISSN 0022-5088 .
- ^ un bcd e f g h i j k l m n Natali , F .; Ruck, BJ ; Planche, NOV; Trodahl, HJ; Granville, S.; Meyer, C.; Lambrecht, WRL (2013). “Mononitrures de terres rares”. Progrès en science des matériaux . Elsevier BV. 58 (8) : 1316-1360. arXiv : 1208.2410 . doi : 10.1016/j.pmatsci.2013.06.002 . ISSN 0079-6425 . S2CID 118566136 .
- ^ un bcde Ono , S .; Nomura, K.; En ligneHayakawa, H. (1974). “Synthèses de nouveaux phosphures de terres rares”. Journal des métaux moins courants . Elsevier BV. 38 (2–3) : 119–130. doi : 10.1016/0022-5088(74)90055-1 . ISSN 0022-5088 .
- ^ un bcdefghijk Yoshihara , K .; _ _ _ _ _ _ Taylor, JB; Calvert, LD ; Despault, JG (1975). “Bismuthides de terres rares”. Journal des métaux moins courants . Elsevier BV. 41 (2): 329–337. doi : 10.1016/0022-5088(75)90038-7 . ISSN 0022-5088 .
- ^ un bcde Hayashi , J .; Shirotani, I.; Tanaka, Y.; Adachi, T.; Shimomura, O.; En ligneKikegawa, T. (2000). “Transitions de phase de LnSb (Ln = lanthanide) avec une structure de type NaCl à hautes pressions”. Communications à semi-conducteurs . Elsevier BV. 114 (11): 561–565. Bibcode : 2000SSCom.114..561H . doi : 10.1016/s0038-1098(00)00113-7 . ISSN 0038-1098 .
- ^ Gschneidner, KA; Calderwood, FW (1986). “Le système As−Eu (Arsenic-Europium)”. Bulletin des diagrammes de phase d’alliage . Springer Science et Business Media LLC. 7 (3): 279-283. doi : 10.1007/bf02869009 . ISSN 0197-0216 .
- ^ Taylor, JB; Calvert, LD ; Wang, Y. (1979-04-01). “Données de poudre pour certains nouveaux antimonides et bismuthides d’europium”. Journal de cristallographie appliquée . Union Internationale de Cristallographie (IUCr). 12 (2): 249–251. doi : 10.1107/s0021889879012309 . ISSN 0021-8898 .
- ^ Okamoto, H. (1999). “Bi-Yb (bismuth-ytterbium)”. Journal des équilibres de phase . Springer Science et Business Media LLC. 20 (4): 453. doi : 10.1361/105497199770335640 . ISSN 1054-9714 .
- ^ Duan, Xu; Wu, ventilateur ; Chen, Jia; Zhang, Peiran; Liu, Yang; Yuan, Huqiu ; Cao, Chao (2018-11-02). “Structure électronique accordable et propriétés topologiques de LnPn (Ln=Ce, Pr, Sm, Gd, Yb; Pn=Sb, Bi)” . Physique des communications . Springer Science et Business Media LLC. 1 (1): 71. Bibcode : 2018CmPhy…1…71D . doi : 10.1038/s42005-018-0074-8 . ISSN 2399-3650 .
- ^ un bcd e f g h i j k l m n o p q r s t Kruger , OL ; Moser, JB (1967). “Constantes de réseau et points de fusion des composés IVA-VIA du groupe des actinides avec des structures de type NaCl”. Journal de physique et chimie des solides . Elsevier BV. 28 (11): 2321–2325. Code Bib : 1967JPCS …28.2321K . doi : 10.1016/0022-3697(67)90257-0 . ISSN 0022-3697 .
- ^ un bcd e f g h i j k Vogt , O.; Mattenberger, K. (1995). “Le magnétisme des obus 4f et 5f localisés ou presque localisés”. Journal des alliages et des composés . Elsevier BV. 223 (2): 226–236. doi : 10.1016/0925-8388(94)09005-x . ISSN 0925-8388 .
- ^ un bcd e f g h i j k l m n o Benedict , U.; Holzapfel, WB (1993). “Chapitre 113 Études à haute pression – Aspects structurels”. Lanthanides/Actinides : Physique I . Manuel de Physique et Chimie des Terres Rares. Vol. 17. Elsevier. p. 245–300. doi : 10.1016/s0168-1273(05)80030-3 . ISBN 9780444815026. ISSN 0168-1273 .
- ^ un bc Léger , JM; Yacoubi, N.; En ligneLoriers, J. (1981). “Synthèse des monoxydes de terres rares”. Journal de chimie à l’état solide . Elsevier BV. 36 (3): 261–270. Bibcode : 1981JSSCh..36..261L . doi : 10.1016/0022-4596(81)90436-9 . ISSN 0022-4596 .
- ^ Roedhammer, P.; Reichardt, W.; Holtzberg, F. (1978-02-13). “Comportement en mode doux dans la dispersion des phonons de YS”. Lettres d’examen physique . Société américaine de physique (APS). 40 (7): 465–468. Bibcode : 1978PhRvL..40..465R . doi : 10.1103/physrevlett.40.465 . ISSN 0031-9007 .
- ^ un bcdefghijklmn Didchenko , R .; _ _ _ _ _ _ _ _ _ Gortsema, FP (1963). “Quelques propriétés électriques et magnétiques des monosulfures et nitrures de terres rares”. Journal de physique et chimie des solides . Elsevier BV. 24 (7): 863–870. Bibcode : 1963JPCS…24..863D . doi : 10.1016/0022-3697(63)90062-3 . ISSN 0022-3697 .
- ^ un bcdef Smolensky , GA ; _ Adamjan, VE ; Loginov, GM (1968). “Propriétés antiferromagnétiques des monochalcogénures de terres rares légères”. Journal de physique appliquée . Édition AIP. 39 (2): 786–790. Bibcode : 1968JAP….39..786S . doi : 10.1063/1.2163619 . ISSN 0021-8979 .
- ^ un bcdefgh Kershner , CJ ; _ _ _ DeSando, RJ ; Heidelberg, RF; Steinmeyer, RH (1966). “Polonides de terres rares”. Journal de chimie inorganique et nucléaire . Elsevier BV. 28 (8) : 1581-1588. doi : 10.1016/0022-1902(66)80054-4 . ISSN 0022-1902 .
- ^ un b Wachter, P. (1972). “Les propriétés électriques et magnétiques optiques des chalcogénures d’europium et des pnictures de terres rares”. Examens critiques du CRC en sciences de l’état solide . Informa UK Limited. 3 (2): 189–241. doi : 10.1080/10408437208244865 . ISSN 0011-085X .
- ^ Meyer, G (1991). Synthèse de composés de lanthanides et d’actinides . Dordrecht : Springer Pays-Bas. p. 237. ISBN 978-94-011-3758-4. OCLC 840310000 .
- ^ D’Eye, RWM; Sellman, PG (1954). “Le système thorium-tellure”. J. Chem. Soc . Société royale de chimie (RSC): 3760–3766. doi : 10.1039/jr9540003760 . ISSN 0368-1769 .
- ^ Friedrich, Alexandra; Winkler, Björn; Juarez-Arellano, Erick A.; Bayarjargal, Lkhamsuren (2011-09-28). “Synthèse des nitrures, carbures et borures de métaux de transition binaires à partir des éléments de la cellule d’enclume de diamant chauffée au laser et leurs relations structure-propriété”. Matériaux . MDPI SA. 4 (10): 1648–1692. doi : 10.3390/ma4101648 . ISSN 1996-1944 .
- ^ Venkatraman, M.; Neumann, JP (1990). “Le système C-Cr (carbone-chrome)”. Bulletin des diagrammes de phase d’alliage . Springer Science et Business Media LLC. 11 (2): 152–159. doi : 10.1007/bf02841701 . ISSN 0197-0216 .
- ^ Murray, JL; Liao, PK ; Lance, KE (1986). “Le système B-Ti (bore-titane)”. Bulletin des diagrammes de phase d’alliage . Springer Science et Business Media LLC. 7 (6): 550–555. doi : 10.1007/bf02869864 . ISSN 0197-0216 .
- ^ Glaser, Frank W.; Poste, Benjamin (1953). “Système Zirconium-Bore”. JOM . Springer Science et Business Media LLC. 5 (9): 1117–1118. doi : 10.1007/bf03397597 . ISSN 1047-4838 .
- ^ “Fluorite” . aflow.org . Récupéré le 22/05/2020 .
- ^ “Sel gemme” . aflow.org . Récupéré le 22/05/2020 .
- ^ L. Kantorovitch (2004). Théorie quantique de l’état solide . Springer. p. 32. ISBN 1-4020-2153-4.
- ^ Birkbeck College, Université de Londres
- ^ La structure de Zincblende (B3) Archivée le 19 octobre 2008 à la Wayback Machine
- ^ Wang, LD; Kwok, HS (2000). “Films minces de nitrure d’aluminium cubique et de nitrure de gallium préparés par dépôt laser pulsé”. Sciences appliquées des surfaces . Elsevier BV. 154–155 (1–4): 439–443. Bibcode : 2000ApSS..154..439W . doi : 10.1016/s0169-4332(99)00372-4 . ISSN 0169-4332 .
- ^ Oseki, Masaaki; Okubo, Kana ; Kobayashi, Atsushi; Ohta, Jitsuo ; Fujioka, Hiroshi (2014-02-04). “Transistors à effet de champ à base de nitrure d’indium cubique” . Rapports scientifiques . Springer Science et Business Media LLC. 4 (1): 3951. Bibcode : 2014NatSR…4E3951O . doi : 10.1038/srep03951 . ISSN 2045-2322 . PMC 3912472 . PMID 24492240 .
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1984). Chimie des Eléments . Oxford : Pergame Press . p. 899.ISBN _ 978-0-08-022057-4..
- ^ Moyer, Harvey V. (1956). “Propriétés chimiques du polonium”. Dans Moyer, Harvey V. (éd.). Polonium (Rapport). Oak Ridge, Tenn. : Commission de l’énergie atomique des États-Unis. p. 33–96. doi : 10.2172/4367751 . TID-5221. .
Lectures complémentaires
- Hurlbut, Cornelius S.; Klein, Cornelis, 1985, Manuel de minéralogie , 20e éd., Wiley, ISBN 0-471-80580-7
Liens externes
- Simulations JMol par l’Université de Graz :
- Cube simple
- Cci
- FAC
- HCP
- Créer une structure cristalline avec Molview