Sommeil à mouvements oculaires rapides
Le sommeil à mouvements oculaires rapides ( sommeil paradoxal ou REMS ) est une phase unique du sommeil chez les Mammifères et les oiseaux , caractérisée par un mouvement rapide et aléatoire des Yeux , accompagné d’un faible tonus musculaire dans tout le corps et de la propension du dormeur à rêver vivement.
 Exemple d’ hypnogramme (électroencéphalogramme du sommeil) montrant des cycles de sommeil caractérisés par un sommeil paradoxal (REM) croissant.
Exemple d’ hypnogramme (électroencéphalogramme du sommeil) montrant des cycles de sommeil caractérisés par un sommeil paradoxal (REM) croissant.  EEG d’une souris qui montre que le sommeil paradoxal est caractérisé par un Rythme thêta proéminent
EEG d’une souris qui montre que le sommeil paradoxal est caractérisé par un Rythme thêta proéminent
La phase REM est également connue sous le nom de sommeil paradoxal ( PS ) et parfois de sommeil désynchronisé , en raison de similitudes physiologiques avec les états de veille, notamment les ondes cérébrales désynchronisées rapides à basse tension . L’activité électrique et chimique régulant cette phase semble provenir du Tronc cérébral , et se caractérise notamment par une abondance du neurotransmetteur acétylcholine , associée à une absence quasi totale des neurotransmetteurs monoamines histamine, sérotonine et noradrénaline. [1]
Le sommeil paradoxal est physiologiquement différent des autres phases du sommeil, qui sont collectivement appelées Sommeil non paradoxal (sommeil NREM, NREMS, sommeil synchronisé). Les sommeils REM et non-REM alternent au cours d’un cycle de sommeil, qui dure environ 90 minutes chez l’homme adulte. Au fur et à mesure que les cycles de sommeil se poursuivent, ils évoluent vers une proportion plus élevée de sommeil paradoxal. Le passage au sommeil paradoxal entraîne des changements physiques marqués, à commencer par des sursauts électriques appelés “ondes ponto-géniculo-occipitales” ( ondes PGO ) prenant naissance dans le Tronc cérébral . Les organismes en sommeil paradoxal suspendent l’ homéostasie centrale , permettant de grandes fluctuations de la respiration , de la thermorégulation et de la circulation .qui ne se produisent dans aucun autre mode de sommeil ou de veille. Le corps perd brusquement du tonus musculaire, un état connu sous le nom d’Atonie REM. [1] [2]
En 1953, le professeur Nathaniel Kleitman et son étudiant Eugene Aserinsky ont défini le mouvement rapide des Yeux et l’ont lié aux rêves. Le sommeil paradoxal a été décrit plus en détail par des chercheurs, dont William Dement et Michel Jouvet . De nombreuses expériences ont impliqué de réveiller les sujets de test chaque fois qu’ils commencent à entrer dans la phase REM, produisant ainsi un état connu sous le nom de privation REM. Les sujets autorisés à dormir à nouveau normalement éprouvent généralement un léger rebond REM . Les techniques de neurochirurgie , d’injection chimique, d’ électroencéphalographie , de tomographie par émission de positrons et de rapports de rêveurs au réveil ont toutes été utilisées pour étudier cette phase du sommeil.[3]
Physiologie
Activité électrique dans le cerveau
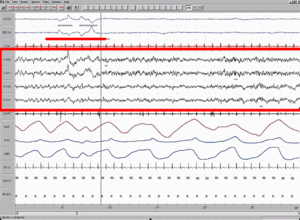
 Enregistrement polysomnographique du sommeil paradoxal. EEG mis en évidence par une boîte rouge. Mouvement des Yeux mis en évidence par une ligne rouge.
Enregistrement polysomnographique du sommeil paradoxal. EEG mis en évidence par une boîte rouge. Mouvement des Yeux mis en évidence par une ligne rouge.
Le sommeil paradoxal est qualifié de “paradoxal” en raison de ses similitudes avec l’état de veille. Bien que le corps soit paralysé, le cerveau agit comme s’il était quelque peu éveillé, les neurones cérébraux s’activant avec la même intensité globale qu’à l’état de veille. [4] [5] L’électroencéphalographie pendant le sommeil profond REM révèle une oscillation neurale rapide, de faible amplitude et désynchronisée (ondes cérébrales) qui ressemble au schéma observé pendant l’éveil, qui diffère du schéma d’ ondes lentes δ (delta) du sommeil profond NREM. [1] [6] Un élément important de ce contraste est le Rythme thêta 3–10 Hz dans l’ hippocampe [7] et 40–60 Hzondes gamma dans le cortex ; des schémas d’activité EEG similaires à ces rythmes sont également observés pendant l’éveil. [8] Les neurones corticaux et thalamiques du cerveau éveillé et du sommeil REM sont plus dépolarisés (s’allument plus facilement) que dans le cerveau du sommeil profond NREM. [9] L’activité des ondes thêta humaines prédomine pendant le sommeil paradoxal à la fois dans l’hippocampe et le cortex. [10] [11]
Pendant le sommeil paradoxal, la connectivité électrique entre les différentes parties du cerveau se manifeste différemment que pendant l’éveil. Les zones frontales et postérieures sont moins cohérentes dans la plupart des fréquences, un fait qui a été cité en relation avec l’expérience chaotique du rêve. Cependant, les zones postérieures sont plus cohérentes entre elles ; tout comme les hémisphères droit et gauche du cerveau, en particulier lors de rêves lucides . [12] [13]
La consommation d’énergie du cerveau pendant le sommeil paradoxal, mesurée par le métabolisme de l’oxygène et du glucose, est égale ou supérieure à la consommation d’énergie au réveil. Le taux de Sommeil non paradoxal est inférieur de 11 à 40 %. [14]
L’activité neuronale pendant le sommeil paradoxal semble provenir du Tronc cérébral , en particulier du tegmentum pontique et du locus coeruleus . Le sommeil paradoxal est ponctué et immédiatement précédé d’ ondes PGO (ponto-géniculo-occipitales) , bouffées d’activité électrique provenant du Tronc cérébral. [15] (Les ondes PGO ont longtemps été mesurées directement chez les chats mais pas chez l’homme en raison des contraintes d’expérimentation ; cependant, des effets comparables ont été observés chez l’homme lors d’événements « phasiques » qui se produisent pendant le sommeil paradoxal, et l’existence d’ondes PGO similaires est ainsi déduit.) [13] Ces ondes se produisent en grappes environ toutes les 6 secondes pendant 1 à 2 minutes pendant la transition du sommeil profond au sommeil paradoxal.[6] Ils présentent leur amplitude la plus élevée en se déplaçant dans le cortex visuel et sont une cause des “mouvements oculaires rapides” dans le sommeil paradoxal. [16] [17] [14] D’autres muscles peuvent également se contracter sous l’influence de ces ondes. [18]
Cerveau antérieur
La recherche dans les années 1990 utilisant la tomographie par émission de positrons (TEP) a confirmé le rôle du Tronc cérébral et a suggéré que, dans le cerveau antérieur , les systèmes limbique et paralimbique montraient plus d’activation que d’autres zones. [4] Les zones activées pendant le sommeil paradoxal sont approximativement inverses à celles activées pendant le sommeil non-REM [14] et affichent une activité plus importante que lors d’un éveil calme. La “zone d’activation REM paralimbique antérieure” (APRA) comprend des zones liées à l’émotion , à la mémoire, à la peur et au sexe, et peut donc être liée à l’expérience du rêve pendant le REMS. [13] [19]Des recherches TEP plus récentes ont indiqué que la distribution de l’activité cérébrale pendant le sommeil paradoxal varie en fonction du type d’activité observé au cours de la période d’éveil précédente. [4]
Le gyrus frontal supérieur , les zones frontales médiales , le sillon intrapariétal et le cortex pariétal supérieur , zones impliquées dans l’activité mentale sophistiquée , montrent une activité égale dans le sommeil paradoxal comme dans l’éveil. L’ amygdale est également active pendant le sommeil paradoxal et peut participer à la génération des ondes PGO, et la suppression expérimentale de l’amygdale entraîne moins de sommeil paradoxal. [20] L’amygdale peut également réguler la fonction cardiaque au lieu du cortex insulaire moins actif . [4]
Produits chimiques dans le cerveau
Par rapport au sommeil à ondes lentes , l’éveil et le sommeil paradoxal impliquent une utilisation plus importante du neurotransmetteur acétylcholine , qui peut provoquer des ondes cérébrales plus rapides. Les neurotransmetteurs Monoamine noradrénaline , sérotonine et histamine sont totalement indisponibles. Les injections d’ inhibiteur de l’acétylcholinestérase , qui augmentent efficacement l’acétylcholine disponible, se sont avérées induire un sommeil paradoxal chez l’homme et d’autres animaux déjà en sommeil à ondes lentes. Carbachol, qui imite l’effet de l’acétylcholine sur les neurones, a une influence similaire. Chez l’homme éveillé, les mêmes injections ne produisent un sommeil paradoxal que si les neurotransmetteurs monoamines ont déjà été épuisés. [1] [21] [22] [23] [24]
Deux autres neurotransmetteurs , l’orexine et l’Acide gamma-aminobutyrique (GABA), semblent favoriser l’éveil, diminuer pendant le sommeil profond et inhiber le sommeil paradoxal. [1] [25]
Contrairement aux transitions abruptes dans les modèles électriques, les changements chimiques dans le cerveau montrent une oscillation périodique continue. [26]
Modèles de régulation REM
Selon l’ hypothèse d’activation-synthèse proposée par Robert McCarley et Allan Hobson en 1975-1977, le contrôle du sommeil paradoxal implique des voies de neurones “REM-on” et “REM-off” dans le Tronc cérébral. Les neurones REM-on sont principalement cholinergiques (c’est-à-dire impliquent l’acétylcholine); Les neurones REM-off activent la sérotonine et la noradrénaline, qui, entre autres fonctions, suppriment les neurones REM-on. McCarley et Hobson ont suggéré que les neurones REM-on stimulent en fait les neurones REM-off, servant ainsi de mécanisme pour le cycle entre le sommeil REM et le sommeil non-REM. [1] [21] [23] [27] Ils ont utilisé les équations Lotka-Volterra pour décrire cette relation inverse cyclique. [28]Kayuza Sakai et Michel Jouvet ont avancé un modèle similaire en 1981. [25] Alors que l’acétylcholine se manifeste dans le cortex de manière égale pendant l’éveil et le REM, elle apparaît à des concentrations plus élevées dans le Tronc cérébral pendant le REM. [29] Le retrait de l’orexine et du GABA peut entraîner l’absence des autres neurotransmetteurs excitateurs ; [30] les chercheurs de ces dernières années incluent de plus en plus la régulation du GABA dans leurs modèles. [31]
Mouvements des yeux
La plupart des mouvements oculaires dans le sommeil à “mouvements oculaires rapides” sont en fait moins rapides que ceux normalement présentés par les humains éveillés. Ils sont également plus courts et plus susceptibles de revenir à leur point de départ. Environ sept de ces boucles se déroulent sur une minute de sommeil paradoxal. Dans le sommeil lent, les Yeux peuvent s’écarter; cependant, les Yeux du dormeur paradoxal bougent en tandem. [32] Ces mouvements oculaires suivent les ondes ponto-géniculo-occipitales provenant du Tronc cérébral. [16] [17] Les mouvements oculaires eux-mêmes peuvent être liés au sens de la vision ressenti dans le rêve, [33]mais une relation directe reste à établir clairement. Les personnes aveugles congénitales, qui n’ont généralement pas d’imagerie visuelle dans leurs rêves, bougent toujours les Yeux pendant le sommeil paradoxal. [14] Une autre explication suggère que le but fonctionnel du sommeil paradoxal est le traitement de la mémoire procédurale et que le mouvement oculaire rapide n’est qu’un effet secondaire du traitement par le cerveau de la mémoire procédurale liée à l’œil. [34] [35]
Circulation, respiration et thermorégulation
D’une manière générale, le corps suspend l’ homéostasie pendant le sommeil paradoxal. La fréquence cardiaque, la pression cardiaque, le débit cardiaque , la pression artérielle et le rythme respiratoire deviennent rapidement irréguliers lorsque le corps entre en sommeil paradoxal. [36] En général, les réflexes respiratoires tels que la réponse à l’ hypoxie diminuent. Dans l’ensemble, le cerveau exerce moins de contrôle sur la respiration ; la stimulation électrique des zones cérébrales liées à la respiration n’influence pas les poumons, comme c’est le cas pendant le Sommeil non paradoxal et l’éveil. [37]Les fluctuations de la fréquence cardiaque et de la pression artérielle ont tendance à coïncider avec les ondes PGO et les mouvements oculaires rapides, les secousses ou les changements soudains de la respiration. [38]
Les érections du pénis ( tumescence pénienne nocturne ou NPT) accompagnent normalement le sommeil paradoxal chez les rats et les humains. [39] Si un homme souffre de dysfonction érectile (ED) alors qu’il est éveillé, mais a des épisodes NPT pendant REM, cela suggérerait que l’ED est d’une cause psychologique plutôt que physiologique. Chez les femmes, l’érection du clitoris ( tumescence clitoridienne nocturne ou NCT) provoque une hypertrophie, accompagnée d’un flux sanguin vaginal et d’une transsudation (c’est-à-dire une lubrification). Au cours d’une nuit normale de sommeil, le pénis et le clitoris peuvent être en érection pendant une durée totale d’une heure à trois heures et demie pendant la REM. [40]
La température corporelle n’est pas bien régulée pendant le sommeil paradoxal et les organismes deviennent donc plus sensibles aux températures en dehors de leur Zone thermoneutre . Les chats et autres petits Mammifères à fourrure trembleront et respireront plus rapidement pour réguler la température pendant le NREMS, mais pas pendant le REMS. [41] Avec la perte de tonus musculaire, les animaux perdent la capacité de réguler la température par les mouvements du corps. (Cependant, même les chats présentant des lésions pontiques empêchant l’Atonie musculaire pendant le REM ne régulaient pas leur température en frissonnant.) [42] faire dans le sommeil et l’éveil NREM. [43]
Par conséquent, des températures environnementales chaudes ou froides peuvent réduire la proportion de sommeil paradoxal, ainsi que la quantité de sommeil total. [44] [45] En d’autres termes, si à la fin d’une phase de sommeil profond, les indicateurs thermiques de l’organisme tombent en dehors d’une certaine plage, il n’entrera pas dans le sommeil paradoxal de peur que la dérégulation ne permette à la température de dériver davantage de la valeur souhaitable. [46] Ce mécanisme peut être “trompé” en réchauffant artificiellement le cerveau. [47]
Le muscle
L’Atonie REM , une paralysie presque complète du corps, est réalisée par l’inhibition des Motoneurones . Lorsque le corps passe au sommeil paradoxal, les Motoneurones de tout le corps subissent un processus appelé hyperpolarisation : [48] leur potentiel membranaire déjà négatif diminue de 2 à 10 millivolts supplémentaires , élevant ainsi le seuil qu’un stimulus doit franchir pour les exciter. L’inhibition musculaire peut résulter de l’indisponibilité des neurotransmetteurs monoamines (limitant l’abondance d’acétylcholine dans le Tronc cérébral) et peut-être des mécanismes utilisés dans l’inhibition musculaire au réveil. [49] La moelle allongée, situé entre le pont et la colonne vertébrale, semble avoir la capacité d’inhibition musculaire à l’échelle de l’organisme. [2] Certaines secousses et réflexes localisés peuvent encore se produire. [50] Contrat élèves. [18]
L’ absence d’ Atonie REM provoque un Trouble du comportement REM , dont les personnes atteintes réalisent physiquement leurs rêves, [51] ou à l’inverse “rêvent leurs actes”, selon une théorie alternative sur la relation entre les impulsions musculaires pendant le REM et l’imagerie mentale associée (qui serait également s’appliquent aux personnes sans condition, sauf que les commandes à leurs muscles sont supprimées). [52] Ceci est différent du somnambulisme conventionnel , qui a lieu pendant le sommeil à ondes lentes, et non REM. [53] La narcolepsie , en revanche, semble impliquer une Atonie REM excessive et indésirable : cataplexie et somnolence diurne excessive pendant l’éveil,hallucinations hypnagogiques avant d’entrer dans le sommeil lent, ou paralysie du sommeil au réveil. [54] D’autres troubles psychiatriques, y compris la dépression, ont été liés à un sommeil paradoxal disproportionné. [55] Les patients suspectés de troubles du sommeil sont généralement évalués par polysomnogramme . [56] [57]
Les lésions du pont pour prévenir l’Atonie ont induit un “Trouble du comportement REM” fonctionnel chez les animaux. [58]
Psychologie
Rêver
Depuis sa découverte, le sommeil à mouvements oculaires rapides (REM) est étroitement associé au rêve . Réveiller les dormeurs pendant une phase REM est une méthode expérimentale courante pour obtenir des rapports de rêve ; 80% des personnes neurotypiques peuvent donner une sorte de rapport de rêve dans ces circonstances. [59] [60] Les dormeurs réveillés de REM ont tendance à donner des descriptions plus longues et plus narratives des rêves qu’ils vivaient et à estimer la durée de leurs rêves comme plus longue. [14] [61] Les rêves lucides sont signalés beaucoup plus souvent dans le sommeil paradoxal. [62] (En fait, ceux-ci pourraient être considérés comme un état hybride combinant des éléments essentiels du sommeil paradoxal et de la conscience éveillée.) [14]Les événements mentaux qui se produisent pendant le REM ont le plus souvent des caractéristiques de rêve, y compris la structure narrative, la conviction (par exemple, la ressemblance expérientielle avec la vie éveillée) et l’incorporation de thèmes instinctifs. [14] Parfois, ils incluent des éléments de l’expérience récente du rêveur tirés directement de la mémoire épisodique . [4] Selon une estimation, 80 % des rêves se produisent pendant le REM. [63]
Hobson et McCarley ont proposé que les ondes PGO caractéristiques du REM “phasique” pourraient fournir au cortex visuel et au cerveau antérieur une excitation électrique qui amplifie les aspects hallucinatoires du rêve. [22] [27] Cependant, les personnes réveillées pendant le sommeil ne rapportent pas beaucoup plus de rêves bizarres pendant le REMS phasique, par rapport au REMS tonique. [61] Une autre relation possible entre les deux phénomènes pourrait être que le seuil plus élevé d’interruption sensorielle pendant le sommeil paradoxal permet au cerveau de voyager plus loin le long de trains de pensée irréalistes et particuliers. [61]
Certains rêves peuvent avoir lieu pendant le Sommeil non paradoxal. Les “dormeurs légers” peuvent rêver pendant le stade 2 du Sommeil non paradoxal, tandis que les “dormeurs profonds”, au réveil au même stade, sont plus susceptibles de déclarer “penser” mais pas “rêver”. Certains efforts scientifiques pour évaluer la nature particulièrement bizarre des rêves vécus pendant le sommeil ont été forcés de conclure que la pensée éveillée pouvait être tout aussi bizarre, en particulier dans des conditions de privation sensorielle . [61] [64]En raison du rêve non-REM, certains chercheurs sur le sommeil ont vigoureusement contesté l’importance de relier le rêve à la phase de sommeil REM. La perspective que des aspects neurologiques bien connus du REM ne provoquent pas eux-mêmes le rêve suggère la nécessité de réexaminer la neurobiologie du rêve en soi . [65] Certains chercheurs (Dement, Hobson, Jouvet, par exemple) ont tendance à résister à l’idée de déconnecter le rêve du sommeil paradoxal. [14] [66]
Effets des ISRS
Des recherches antérieures ont montré que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ont un effet important sur la neurobiologie du sommeil paradoxal et le rêve. [67] Une étude menée à la Harvard Medical School en 2000 a testé les effets de la paroxétine et de la fluvoxamine sur de jeunes hommes et femmes adultes en bonne santé pendant 31 jours : une semaine de référence sans médicament, 19 jours sous paroxétine ou fluvoxamine avec des doses matin et soir, et 5 jours d’arrêt absolu. [68] Les résultats ont montré que le traitement ISRS diminuait la quantité moyenne de fréquence de rappel des rêves par rapport aux mesures de base en raison de la suppression REM sérotoninergique. [68]La fluvoxamine a augmenté la durée des rapports de rêve, la bizarrerie des rêves ainsi que l’intensité du sommeil paradoxal. Ces effets étaient les plus importants pendant l’arrêt aigu par rapport aux jours de traitement et de référence. [68] Cependant, l’ intensité subjective du rêve a augmenté [68] et la propension à entrer dans le sommeil paradoxal a diminué pendant le traitement par ISRS par rapport aux jours de référence et d’arrêt. [68]
La créativité
Après le réveil du sommeil paradoxal, l’esprit semble “hyperassociatif” – plus réceptif aux effets d’ amorçage sémantique . Les personnes réveillées de REM ont mieux performé sur des tâches comme les anagrammes et la résolution créative de problèmes. [69]
Le sommeil facilite le processus par lequel la créativité forme des éléments associatifs dans de nouvelles combinaisons utiles ou répondant à certaines exigences. [70] Cela se produit dans le sommeil REM plutôt que dans le sommeil NREM. [71] [72] Plutôt que d’être dû à des processus de mémoire, cela a été attribué à des changements pendant le sommeil paradoxal dans la neuromodulation cholinergique et noradrénergique . [71] Des niveaux élevés d’acétylcholine dans l’hippocampe suppriment la rétroaction de l’hippocampe vers le néocortex , tandis que des niveaux inférieurs d’acétylcholine et de noradrénaline dans le néocortex encouragent la propagation incontrôlée de l’activité associative dans les zones néocorticales. [73]Cela contraste avec la conscience éveillée, où des niveaux plus élevés de noradrénaline et d’acétylcholine inhibent les connexions récurrentes dans le néocortex. Le sommeil paradoxal à travers ce processus ajoute de la créativité en permettant “aux structures néocorticales de réorganiser les hiérarchies associatives, dans lesquelles les informations de l’hippocampe seraient réinterprétées par rapport aux représentations ou nœuds sémantiques précédents”. [71]
Horaire

 Exemple d’hypnogramme (électroencéphalogramme du sommeil) montrant des cycles de sommeil caractérisés par un sommeil paradoxal (REM) croissant.
Exemple d’hypnogramme (électroencéphalogramme du sommeil) montrant des cycles de sommeil caractérisés par un sommeil paradoxal (REM) croissant.
Dans le cycle de sommeil ultradien , un organisme alterne entre sommeil profond (ondes cérébrales lentes, larges et synchronisées) et sommeil paradoxal (ondes plus rapides et désynchronisées). Le sommeil se produit dans le contexte d’un rythme circadien plus large , qui influence la somnolence et les facteurs physiologiques basés sur des chronomètres dans le corps. Le sommeil peut être réparti sur toute la journée ou regroupé sur une partie du rythme : chez les animaux nocturnes , le jour, et chez les animaux diurnes , la nuit. [74] L’organisme revient à la régulation homéostatique presque immédiatement après la fin du sommeil paradoxal. [75]
Au cours d’une nuit de sommeil, les humains connaissent généralement environ quatre ou cinq périodes de sommeil paradoxal ; ils sont plus courts (~15 min) en début de nuit et plus longs (~25 min) vers la fin. De nombreux animaux et certaines personnes ont tendance à se réveiller ou à vivre une période de sommeil très léger pendant une courte période immédiatement après le REM. La quantité relative de sommeil paradoxal varie considérablement avec l’âge. Un nouveau-né passe plus de 80 % de son temps de sommeil total en REM. [76]
Le sommeil paradoxal occupe généralement 20 à 25 % du sommeil total chez l’homme adulte : environ 90 à 120 minutes de sommeil nocturne. Le premier épisode REM survient environ 70 minutes après l’endormissement. Des cycles d’environ 90 minutes chacun suivent, chaque cycle comprenant une plus grande proportion de sommeil paradoxal. [26] (L’augmentation du sommeil paradoxal plus tard dans la nuit est liée au rythme circadien et se produit même chez les personnes qui n’ont pas dormi dans la première partie de la nuit.) [77] [78]
Dans les semaines qui suivent la naissance d’un bébé humain, à mesure que son système nerveux mûrit, les schémas neuronaux du sommeil commencent à montrer un rythme de sommeil paradoxal et non paradoxal. (Chez les Mammifères qui se développent plus rapidement, ce processus se produit in utero.) [79] Les nourrissons passent plus de temps en sommeil paradoxal que les adultes. La proportion de sommeil paradoxal diminue ensuite significativement dans l’enfance. Les personnes âgées ont tendance à dormir moins dans l’ensemble, mais dorment en REM pendant à peu près le même temps absolu (et passent donc une plus grande proportion de sommeil en REM). [80] [63]
Le sommeil à mouvements oculaires rapides peut être subdivisé en modes tonique et phasique. [81] Le REM tonique est caractérisé par des rythmes thêta dans le cerveau ; Le REM phasique est caractérisé par des ondes PGO et des mouvements oculaires “rapides” réels. Le traitement des stimuli externes est fortement inhibé pendant le REM phasique, et des preuves récentes suggèrent que les dormeurs sont plus difficiles à réveiller du REM phasique que pendant le sommeil à ondes lentes. [17]
Effets de privation
La privation sélective de REMS entraîne une augmentation significative du nombre de tentatives de passage au stade REM pendant le sommeil. Les nuits de récupération, un individu passera généralement plus rapidement au stade 3 et au sommeil paradoxal et connaîtra un rebond REM , qui fait référence à une augmentation du temps passé au stade REM par rapport aux niveaux normaux. Ces résultats sont cohérents avec l’idée que le sommeil paradoxal est biologiquement nécessaire. [82] [83] Cependant, le sommeil REM “de rebond” ne dure généralement pas complètement aussi longtemps que la durée estimée des périodes REM manquées. [77]
Une fois la privation terminée, de légers troubles psychologiques, tels que l’anxiété , l’ irritabilité , des hallucinations et des difficultés de concentration peuvent se développer et l’appétit peut augmenter. Il y a aussi des conséquences positives de la privation de REM. Certains symptômes de la dépression sont supprimés par la privation de REM ; l’agressivité peut augmenter et le comportement alimentaire peut être perturbé. [83] [84] Une noradrénaline plus élevée est une cause possible de ces résultats. [21]La question de savoir si et comment la privation de REM à long terme a des effets psychologiques reste un sujet de controverse. Plusieurs rapports ont indiqué que la privation de REM augmente l’agressivité et le comportement sexuel chez les animaux de laboratoire. [83] Les rats privés de sommeil paradoxal meurent en 4 à 6 semaines (deux fois plus de temps avant la mort en cas de privation totale de sommeil). La température corporelle moyenne chute continuellement pendant cette période. [78]
Il a été suggéré que la privation aiguë de sommeil paradoxal peut améliorer certains types de dépression – lorsque la dépression semble être liée à un déséquilibre de certains neurotransmetteurs. Bien que la privation de sommeil en général agace la plupart de la population, il a été démontré à plusieurs reprises qu’elle atténue la dépression, bien que temporairement. [85] Plus de la moitié des personnes qui ressentent ce soulagement rapportent qu’il est rendu inefficace après avoir dormi la nuit suivante. Ainsi, les chercheurs ont mis au point des méthodes telles que la modification de l’horaire de sommeil pendant plusieurs jours après une période de privation de REM [86] et la combinaison de modifications de l’horaire de sommeil avec la pharmacothérapie [87] pour prolonger cet effet. Antidépresseurs (dontles inhibiteurs sélectifs de la recapture de la sérotonine , les tricycliques et les inhibiteurs de la Monoamine oxydase ) et les stimulants (tels que l’ amphétamine , le méthylphénidate et la cocaïne ) interfèrent avec le sommeil paradoxal en stimulant les neurotransmetteurs monoamines qui doivent être supprimés pour que le sommeil paradoxal se produise. Administrés à des doses thérapeutiques, ces médicaments peuvent arrêter complètement le sommeil paradoxal pendant des semaines ou des mois. Le retrait provoque un rebond REM. [63] [88] La privation de sommeil stimule la neurogenèse hippocampique autant que le font les antidépresseurs, mais on ne sait pas si cet effet est entraîné par le sommeil paradoxal en particulier. [89]
Chez les autres animaux
0:33 Les autruches dorment, avec des phases de sommeil paradoxal et lent . [90] Mouvement oculaire rapide d’un chien
Bien qu’il se manifeste différemment chez différents animaux, le sommeil paradoxal ou quelque chose de similaire se produit chez tous les Mammifères terrestres , ainsi que chez les oiseaux . Les principaux critères utilisés pour identifier le REM sont la modification de l’activité électrique, mesurée par EEG, et la perte de tonus musculaire, entrecoupées d’épisodes de contractions en REM phasique. [91] La quantité de sommeil paradoxal et de cycle varie selon les animaux; les prédateurs éprouvent plus de sommeil paradoxal que les proies. [21] Les animaux plus grands ont également tendance à rester plus longtemps en REM, peut-être parce qu’une inertie thermique plus élevée de leur cerveau et de leur corps leur permet de tolérer une suspension plus longue de la thermorégulation. [92]La période (cycle complet de REM et non-REM) dure environ 90 minutes chez l’homme, 22 minutes chez le chat et 12 minutes chez le rat. [93] In utero, les Mammifères passent plus de la moitié (50 à 80 %) d’une journée de 24 heures en sommeil paradoxal. [26]
Les reptiles endormis ne semblent pas avoir d’ondes PGO ou l’activation cérébrale localisée observée chez les Mammifères REM. Cependant, ils présentent des cycles de sommeil avec des phases d’activité électrique de type REM mesurables par EEG. [91] Une étude récente a trouvé des mouvements oculaires périodiques chez le dragon barbu central d’Australie, amenant ses auteurs à spéculer que l’ancêtre commun des amniotes pourrait donc avoir manifesté un précurseur du REMS. [94]
Les expériences de privation de sommeil sur des animaux non humains peuvent être mises en place différemment de celles sur les humains. La méthode du “pot de fleurs” consiste à placer un animal de laboratoire au-dessus de l’eau sur une plate-forme si petite qu’elle tombe lors de la perte de tonus musculaire. Le réveil naturellement brutal qui en résulte peut provoquer des changements dans l’organisme qui dépassent nécessairement la simple absence d’une phase de sommeil. [95] Cette méthode cesse également de fonctionner après environ 3 jours car les sujets (généralement des rats) perdent leur volonté d’éviter l’eau. [78] Une autre méthode consiste à surveiller par ordinateur les ondes cérébrales, avec une agitation mécanisée automatique de la cage lorsque l’animal de test dérive vers le sommeil paradoxal. [96]
Fonctions possibles
Certains chercheurs affirment que la perpétuation d’un processus cérébral complexe tel que le sommeil paradoxal indique qu’il remplit une fonction importante pour la survie des espèces de Mammifères et d’oiseaux. Il répond à d’importants besoins physiologiques vitaux pour la survie dans la mesure où une privation prolongée de sommeil paradoxal entraîne la mort chez les animaux de laboratoire. Chez les humains et les animaux de laboratoire, la perte de sommeil paradoxal entraîne plusieurs anomalies comportementales et physiologiques. Des pertes de sommeil paradoxal ont été constatées lors de diverses infections naturelles et expérimentales. La capacité de survie des animaux de laboratoire diminue lorsque le sommeil paradoxal est totalement atténué pendant l’infection ; cela conduit à la possibilité que la qualité et la quantité de sommeil paradoxal soient généralement essentielles à la physiologie normale du corps. [97]De plus, l’existence d’un effet “rebond REM” suggère la possibilité d’un besoin biologique de sommeil REM.
Bien que la fonction précise du sommeil paradoxal ne soit pas bien comprise, plusieurs théories ont été proposées.
Mémoire
Le sommeil en général aide la mémoire. Le sommeil paradoxal peut favoriser la préservation de certains types de souvenirs : plus précisément, la mémoire procédurale , la mémoire spatiale et la mémoire émotionnelle . Chez le rat, le sommeil paradoxal augmente suite à un apprentissage intensif, surtout plusieurs heures après, et parfois pendant plusieurs nuits. La privation expérimentale de sommeil paradoxal a parfois inhibé la consolidation de la mémoire , en particulier en ce qui concerne les processus complexes (par exemple, comment s’échapper d’un labyrinthe élaboré). [98]Chez l’homme, la meilleure preuve de l’amélioration de la mémoire REM concerne l’apprentissage des procédures – de nouvelles façons de bouger le corps (comme le saut au trampoline) et de nouvelles techniques de résolution de problèmes. La privation de REM semblait altérer la mémoire déclarative (c’est-à-dire factuelle) uniquement dans des cas plus complexes, tels que des souvenirs d’histoires plus longues. [99] Le sommeil paradoxal contrecarre apparemment les tentatives de suppression de certaines pensées. [69]
Selon l’ hypothèse du double processus du sommeil et de la mémoire, les deux grandes phases du sommeil correspondent à des types de mémoire différents. Des études « demi-nuit » ont testé cette hypothèse avec des tâches de mémoire soit commencées avant le sommeil et évaluées au milieu de la nuit, soit commencées au milieu de la nuit et évaluées le matin. [100] Le sommeil à ondes lentes , qui fait partie du Sommeil non paradoxal, semble être important pour la mémoire déclarative . L’amélioration artificielle du Sommeil non paradoxal améliore le rappel le lendemain des paires de mots mémorisées. [101] Tucker et al. ont démontré qu’une sieste diurne contenant uniquement du Sommeil non paradoxal améliore la mémoire déclarative, mais pas la mémoire procédurale .[102] Selon l’ hypothèse séquentielle , les deux types de sommeil travaillent ensemble pour consolider la mémoire. [103]
Le chercheur sur le sommeil Jerome Siegel a observé qu’une privation extrême de REM n’interfère pas de manière significative avec la mémoire. Une étude de cas d’une personne qui avait peu ou pas de sommeil paradoxal en raison d’une blessure par éclats d’obus au Tronc cérébral n’a pas révélé que la mémoire de l’individu était altérée. Les antidépresseurs, qui suppriment le sommeil paradoxal, ne montrent aucun signe d’altération de la mémoire et peuvent l’améliorer. [88]
Graeme Mitchison et Francis Crick ont proposé en 1983 qu’en vertu de son activité spontanée inhérente, la fonction du sommeil paradoxal “est de supprimer certains modes d’interaction indésirables dans les réseaux de cellules du cortex cérébral” – un processus qu’ils qualifient de ” désapprentissage “. En conséquence, les souvenirs pertinents (dont le substrat neuronal sous-jacent est suffisamment solide pour résister à une telle activation spontanée et chaotique) sont encore renforcés, tandis que les traces de mémoire plus faibles, transitoires et “bruitantes” se désintègrent. [104]La consolidation de la mémoire pendant le sommeil paradoxal est spécifiquement corrélée aux périodes de mouvements oculaires rapides, qui ne se produisent pas de manière continue. Une explication de cette corrélation est que les ondes électriques PGO, qui précèdent les mouvements oculaires, influencent également la mémoire. [16] Le sommeil paradoxal pourrait fournir une opportunité unique pour que le “désapprentissage” se produise dans les réseaux neuronaux de base impliqués dans l’homéostasie, qui sont protégés de cet effet de “réduction synaptique” pendant le sommeil profond. [105]
Ontogénie neurale
Le sommeil paradoxal prévaut surtout après la naissance et diminue avec l’âge. Selon « l’hypothèse ontogénétique », le REM (également connu chez les nouveau- nés sous le nom de sommeil actif ) aide le cerveau en développement en fournissant la stimulation neurale dont les nouveau-nés ont besoin pour former des connexions neurales matures. [106] Des études sur la privation de sommeil ont montré que la privation au début de la vie peut entraîner des problèmes de comportement, une perturbation permanente du sommeil et une diminution de la masse cérébrale. [107] [79] La preuve la plus solide de l’hypothèse ontogénétique provient d’expériences sur la privation de REM et du développement du système visuel dans le noyau géniculé latéral et le cortex visuel primaire .[79]
Immobilisation défensive
Ioannis Tsoukalas de l’Université de Stockholm a émis l’hypothèse que le sommeil paradoxal est une transformation évolutive d’un mécanisme de défense bien connu, le réflexe tonique d’immobilité . Ce réflexe, également connu sous le nom d’hypnose animale ou de simulation de la mort, fonctionne comme la dernière ligne de défense contre un prédateur attaquant et consiste en l’immobilisation totale de l’animal pour qu’il apparaisse mort . Tsoukalas soutient que la neurophysiologie et la phénoménologie de cette réaction présentent des similitudes frappantes avec le sommeil paradoxal ; par exemple, les deux réactions présentent un contrôle du Tronc cérébral, une neurotransmission cholinergique, une paralysie, un Rythme thêta hippocampique et des changements de thermorégulation. [108] [109]
Changement de regard
Selon «l’hypothèse de balayage», les propriétés directionnelles du sommeil paradoxal sont liées à un déplacement du regard dans l’imagerie du rêve. Contre cette hypothèse est que de tels mouvements oculaires se produisent chez les aveugles nés et chez les fœtus malgré le manque de vision. De plus, les REM binoculaires ne sont pas conjugués (c’est-à-dire que les deux Yeux ne pointent pas dans la même direction à la fois) et manquent donc de point de fixation . À l’appui de cette théorie, la recherche révèle que dans les rêves axés sur un objectif, le regard est dirigé vers l’action du rêve, déterminée à partir des corrélations dans les mouvements oculaires et corporels des patients atteints de troubles du comportement en sommeil paradoxal qui réalisent leurs rêves. [110]
Apport d’oxygène à la cornée
Le Dr David M. Maurice , ophtalmologiste et ancien professeur adjoint à l’Université de Columbia, a proposé que le sommeil paradoxal soit associé à l’apport d’oxygène à la cornée et que l’ humeur aqueuse , le liquide entre la cornée et l’iris, était stagnante sinon agitée. [111]Parmi les preuves à l’appui, il a calculé que si l’humeur aqueuse était stagnante, l’oxygène de l’iris devait atteindre la cornée par diffusion à travers l’humeur aqueuse, ce qui n’était pas suffisant. Selon la théorie, lorsque l’organisme est éveillé, le mouvement des Yeux (ou la température ambiante froide) permet à l’humeur aqueuse de circuler. Lorsque l’organisme dort, REM fournit l’agitation indispensable à l’humeur aqueuse. Cette théorie est cohérente avec l’observation selon laquelle les fœtus, ainsi que les nouveau-nés aux Yeux scellés, passent beaucoup de temps en sommeil paradoxal et que pendant un sommeil normal, les épisodes de sommeil paradoxal d’une personne s’allongent progressivement plus profondément dans la nuit. Cependant, les hiboux connaissent le sommeil paradoxal, mais ne bougent pas plus la tête que dans le sommeil non-REM [112] et il est bien connu que les Yeux des hiboux sont presque immobiles.[113]
Autres théories
Une autre théorie suggère que l’arrêt de la Monoamine est nécessaire pour que les récepteurs de la Monoamine dans le cerveau puissent récupérer pour retrouver une sensibilité totale.
L’ hypothèse sentinelle du sommeil paradoxal a été avancée par Frederick Snyder en 1966. Elle est basée sur l’observation que le sommeil paradoxal chez plusieurs Mammifères (le rat, le hérisson, le lapin et le singe rhésus) est suivi d’un bref réveil. Cela ne se produit ni chez les chats ni chez les humains, bien que les humains soient plus susceptibles de se réveiller du sommeil paradoxal que du sommeil NREM. Snyder a émis l’hypothèse que le sommeil paradoxal active périodiquement un animal, pour scanner l’environnement à la recherche d’éventuels prédateurs. Cette hypothèse n’explique pas la paralysie musculaire du sommeil paradoxal ; cependant, une analyse logique pourrait suggérer que la paralysie musculaire existe pour empêcher l’animal de se réveiller complètement inutilement et lui permettre de retourner facilement à un sommeil plus profond. [114] [115] [116]
Jim Horne, chercheur sur le sommeil à l’Université de Loughborough , a suggéré que le REM chez l’homme moderne compense le besoin réduit de recherche de nourriture éveillée . [8]
D’autres théories sont que le sommeil paradoxal réchauffe le cerveau, stimule et stabilise les circuits neuronaux qui n’ont pas été activés pendant l’ éveil , ou crée une stimulation interne pour aider au développement du SNC ; tandis que certains soutiennent que le REM n’a aucun but et résulte simplement d’une activation cérébrale aléatoire. [110] [117]
De plus, les mouvements oculaires jouent un rôle dans certaines psychothérapies telles que la désensibilisation et le retraitement des mouvements oculaires (EMDR).
Voir également
- Neuroscience du sommeil
- Noyau pédonculopontin (PPN)
- Sommeil et apprentissage
Références
- ^ un bcdef Ritchie E. Brown et Robert W. McCarley (2008), “Base neuroanatomique et neurochimique de l’éveil et des systèmes de sommeil paradoxal”, dans Neurochimie du sommeil et de l’éveil éd. Monti et al.
- ^ a b Yuan-Yang Lai & Jerome M. Siegel (1999), “Muscle Atonia in REM Sleep”, dans Rapid Eye Movement Sleep ed. Mallick & Inoué.
- ^ Deboer, T (2007). “Technologies de recherche sur le sommeil” . Cell Mol Life Sci . 64 (10): 1227-1235. doi : 10.1007/s00018-007-6533-0 . PMC 2771137 . PMID 17364139 .
- ^ un bcd e Luca Matarazzo , Ariane Foret, Laura Mascetti, Vincenzo Muto, Anahita Shaffii , & Pierre Maquet, “Une approche systémique du sommeil paradoxal humain” ; dans Mallick et al, éd. (2011).
- ^ Myers, David (2004). Psychologie (7e éd.). New York : Worth Publishers. p. 268 . ISBN 978-0-7167-8595-8. Récupéré le 09/01/2010 . 0716785951.
- ^ un b Steriade & McCarley (1990), “Contrôle du Tronc cérébral de l’éveil et du sommeil”, §1.2 (pp. 7–23).
- ^ Steriade & McCarley (1990), “Contrôle du Tronc cérébral de l’éveil et du sommeil”, §7.2–3 (pp. 206–208).
- ^ a b Jim Horne (2013), “Pourquoi le sommeil paradoxal? Des indices au-delà du laboratoire dans un monde plus difficile”, Biological Psychology 92.
- ^ Steriade & McCarley (1990), “Contrôle du Tronc cérébral de l’éveil et du sommeil”, §8.1 (pp. 232–243).
- ^ Lomas T, Ivtzan I, Fu CH (2015). “Une revue systématique de la neurophysiologie de la pleine conscience sur les oscillations EEG” (PDF) . Examens des neurosciences et du biocomportement . 57 : 401–410. doi : 10.1016/j.neubiorev.2015.09.018 . PMID 26441373 . S2CID 7276590 .
- ^ Hinterberger T, Schmidt S, Kamei T, Walach H (2014). “Une activité électrophysiologique réduite représente l’état conscient de vide dans la méditation” . Frontières en psychologie . 5 : 99. doi : 10.3389/fpsyg.2014.00099 . PMC 3925830 . PMID 24596562 .
- ^ Jayne Gackenbach, “Cohérence EEG interhémisphérique dans le sommeil paradoxal et la méditation : la connexion de rêve lucide” dans Antrobus & Bertini (eds.), La neuropsychologie du sommeil et du rêve .
- ^ un bc Edward F. Pace -Schott, “Sommeil paradoxal et rêver”, dans Mallick et al, eds. (2011).
- ^ un b J. Alan Hobson , Edward F. Pace-Scott et Robert Stickgold (2000), “Le rêve et le cerveau : vers une neuroscience cognitive des états conscients”, Behavioral and Brain Sciences23.
- ^ Steriade & McCarley (1990), “Contrôle du Tronc cérébral de l’éveil et du sommeil”, §9.1–2 (pp. 263–282).
- ^ un bc Subimal Datta (1999), “PGO Wave Generation: Mécanisme et signification fonctionnelle”, dans Rapid Eye Movement Sleep ed. Mallick & Inoué.
- ^ a bc Ummehan Ermis, Karsten Cracovie et Ursula Voss (2010), “Seuils d’éveil pendant le sommeil paradoxal tonique et phasique humain”, Journal of Sleep Research 19.
- ^ un b Siegel JM (2009). « La neurobiologie du sommeil ». Séminaires en Neurologie . 29 (4): 277-296. doi : 10.1055/s-0029-1237118 . PMID 19742406 .
- ^ Nofzinger EA; et coll. (1997). “Activation du cerveau antérieur dans le sommeil paradoxal : une étude FDG PET” . Recherche sur le cerveau . 770 (1–2): 192–201. doi : 10.1016/s0006-8993(97)00807-x . PMID 9372219 . S2CID 22764238 .
- ^ Larry D. Sanford et Richard J. Ross, “Régulation amygdalienne du sommeil paradoxal”; dans Mallick et al. (2011).
- ^ un bcd Birendra N. Mallick, Vibha Madan et Sushil K. Jha (2008), “Régulation rapide du sommeil par mouvement oculaire par modulation du système noradrénergique”, dans Neurochimie du sommeil et de l’éveil éd. Monti et al.
- ^ un b Hobson JA (2009). “Sommeil paradoxal et rêve : vers une théorie de la protoconscience”. Avis sur la nature Neurosciences. 10(11): 803–813. doi:10.1038/nrn2716. PMID19794431. S2CID205505278.
- ^ un b Aston-Jones G., Gonzalez M., & Doran S. (2007). “Rôle du système locus coeruleus-norépinéphrine dans l’éveil et la régulation circadienne du cycle veille-sommeil.” Ch. 6 dans la noradrénaline cérébrale : neurobiologie et thérapeutique . GA Ordway, MA Schwartz et A. Frazer, éds. Cambridge UP. 157–195. Consulté le 21 juillet 2010. Academicdepartments.musc.edu Archivé le 13/12/2011 sur la Wayback Machine
- ^ Siegel JM (2005). “Sommeil paradoxal.” Ch. 10 dans Principes et pratique de la médecine du sommeil . 4e éd. MH Kryger, T. Roth et WC Dement, éd. Elsevier. 120–135.
- ^ un b Pierre-Hervé Luppi et al. (2008), “L’Acide gamma-aminobutyrique et la régulation des mouvements oculaires paradoxaux ou rapides, du sommeil”, dans Neurochimie du sommeil et de l’éveil éd. Monti et al.
- ^ un bc Robert W. McCarley (2007), “Neurobiologie du sommeil REM et NREM”,Sleep Medicine8.
- ^ a b J. Alan Hobson & Robert W. McCarley, “Le cerveau en tant que générateur d’état de rêve: une hypothèse d’activation-synthèse du processus de rêve”, American Journal of Psychiatry 134.12, décembre 1977.
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §12.2 (pp. 369–373).
- ^ Ralph Lydic & Helen A. Baghdoyan, “L’acétylcholine module le sommeil et l’éveil: une perspective synaptique”, dans Neurochimie du sommeil et de l’éveil éd. Monti et al.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 16.
- ^ James T. McKenna, Lichao Chen et Robert McCarley, “Modèles neuronaux du contrôle du sommeil paradoxal : concepts en évolution” ; dans Mallick et al. (2011).
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §10.7.2 (pp. 307–309).
- ↑ Andrillon , Thomas ; et coll. (2015). “Activité neuronale unique et mouvements oculaires pendant le sommeil paradoxal humain et la vision éveillée” . Communication Nature . 6 (1038): 7884. Bibcode : 2015NatCo…6.7884A . doi : 10.1038/ncomms8884 . PMC 4866865 . PMID 26262924 .
- ^ Zhang, Jie (2005). Théorie de l’activation continue du rêve, psychologie dynamique .
- ^ Zhang, Jie (2016). Vers un modèle complet de la mémoire humaine, DOI : 10.13140/RG.2.1.2103.9606 .
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 12–15.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 22–27.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 35–37
- ^ Jouvet (1999), Le paradoxe du sommeil , p. 169-173.
- ^ Brown et al. (2012), “Contrôle du sommeil et de l’éveil”, p. 1127.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 12–13.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , pp. 46–47.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , pp. 51–52.
- ^ Ronald Szymusiak, Md. Noor Alam et Dennis McGinty (1999), “Contrôle thermorégulateur du cycle de sommeil non REM-REM”, dans Rapid Eye Movement Sleep ed. Mallick & Inoué.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , pp. 57–59.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 45. “Par conséquent, il semble que l’apparition du sommeil paradoxal nécessite l’inactivation du thermostat central à la fin du sommeil NREM. Cependant, seule une plage restreinte de températures préoptiques-hypothalamiques à la fin du sommeil NREM est compatible avec l’apparition du sommeil paradoxal. peut être considérée comme une sorte de porte de température pour le sommeil paradoxal, dont la largeur est plus limitée à une température ambiante basse qu’à une température ambiante neutre.”
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 61. “D’autre part, un équilibre entre les charges thermiques hypothalamiques ambiantes et préoptiques-antérieures opposées influençant les thermorécepteurs périphériques et centraux, respectivement, peut être atteint expérimentalement de manière à favoriser le sommeil. En particulier, le réchauffement de la région hypothalamique préoptique-antérieure dans un environnement froid accélère l’apparition du sommeil paradoxal et augmente sa durée (Parmeggiana et al ., 1974, 1980; Sakaguchi et al ., 1979).”
- ^ Brooks, Patricia L.; Peever, John H. (2008-11-01). “Dévoiler les mécanismes de l’Atonie du sommeil paradoxal” . Dormez . 31 (11): 1492–1497. doi : 10.1093/sommeil/31.11.1492 . ISSN 0161-8105 . PMC 2579970 . PMID 19226735 .
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §10.8–9 (pp. 309–324).
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 17. “En d’autres termes, les contrôles fonctionnels nécessitant des niveaux d’intégration hiérarchiques élevés sont les plus affectés pendant le sommeil paradoxal, alors que l’activité réflexe est seulement altérée mais pas effacée.”
- ^ Lapierre O, Montplaisir J (1992). “Caractéristiques polysomnographiques du trouble du comportement en sommeil paradoxal : développement d’une méthode de notation”. Neurologie . 42 (7): 1371–4. doi : 10.1212/wnl.42.7.1371 . PMID 1620348 . S2CID 25312217 .
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §13.3.2.3 (pp. 428–432).
- ^ Jouvet (1999), Le paradoxe du sommeil , p. 102.
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §13.1 (pp. 396–400).
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §13.2 (pp. 400–415).
- ^ Koval’zon VM (juillet-août 2011). “[Mécanismes centraux du cycle veille-sommeil]”. Fiziologiia Cheloveka . 37 (4): 124–34. PMID 21950094 .
- ^ “[Polysomnographie]” . Récupéré le 2 novembre 2011 .
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 87. “Le mode de régulation physiologique en boucle ouverte dans le sommeil paradoxal peut restaurer l’efficacité des différents réseaux neuronaux du Tronc cérébral en exprimant également des schémas génétiquement codés de comportement instinctif qui sont normalement cachés à la vue par l’Atonie des muscles squelettiques. l’activité neuronale cachée a été démontrée par les effets de lésions expérimentales de structures pontiques spécifiques (Hendricks, 1982; Hendricks et al., 1977, 1982; Henley et Morrison, 1974 ; Jouvet et Delorme, 1965 ; Sastre et Jouvet, 1979 ; Villablanca, 1996). Non seulement l’Atonie du muscle squelettique a été supprimée par des fragments moteurs de comportements instinctifs complexes, tels que la marche et l’attaque, qui n’étaient pas motivés de l’extérieur (voir Morrison, 2005).”
- ^ Solms (1997), La neuropsychologie des rêves , pp. 10, 34.
- ^ Edward F. Pace-Schott, “Sommeil paradoxal et rêve”, dans Mallick et al, eds. (2011), p. 8. “Une méta-analyse de 29 études d’éveil par Nielsen (2000) a révélé qu’environ 82 % des réveils de REM entraînent le rappel d’un rêve alors que cette fréquence après les réveils NREM est inférieure à 42 %.”
- ^ un bcd Ruth Reinsel , John Antrobus et Miriam Wollman (1992), “Bizarreness in Dreams and Waking Fantasy”, dans Antrobus & Bertini (eds.), La neuropsychologie du sommeil et du rêve .
- ^ Stephen LaBerge (1992), “Études physiologiques du rêve lucide”, dans Antrobus & Bertini (eds.), La neuropsychologie du sommeil et du rêve .
- ^ un bc Markov D, Goldman M, Doghramji K (2012) . “Sommeil normal et rythmes circadiens : mécanismes neurobiologiques sous-jacents au sommeil et à l’éveil”. Cliniques de médecine du sommeil . 7 : 417–426. doi : 10.1016/j.jsmc.2012.06.015 . {{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Delphine Ouidette et al. (2012), “Rêver sans sommeil paradoxal”, Conscience et Cognition 21.
- ^ Solms (1997), La neuropsychologie des rêves , chapitre 6 : “Le problème du sommeil paradoxal” (pp. 54-57).”
- ↑ Jouvet (1999), Le paradoxe du sommeil , p. 104. “Je soutiens franchement la théorie selon laquelle nous ne rêvons pas toute la nuit, comme le font William Dement et Alan Hobson et la plupart des neurophysiologistes. Je suis plutôt surpris que les publications sur le rappel des rêves pendant le sommeil à ondes lentes augmentent en nombre chaque année. De plus, le classique distinction établie dans les années 1960 entre le rappel de rêve « pauvre », dépourvu de couleur et de détail, pendant le sommeil lent, et le rappel « riche », plein de couleur et de détail, pendant le sommeil paradoxal, commence à disparaître. Je crois que le rappel de rêve pendant le sommeil à ondes lentes pourrait être un rappel d’un sommeil paradoxal antérieur.”
- ^ Tribl, Gotthard G.; Wetter, Thomas C.; Schredl, Michael (2013-04-01). “Rêver sous antidépresseurs: Une revue systématique des preuves chez les patients dépressifs et les volontaires sains”. Avis sur la médecine du sommeil . 17 (2): 133–142. doi : 10.1016/j.smrv.2012.05.001 . ISSN 1087-0792 . PMID 22800769 .
- ^ un bcde Pace – Schott , Edward F .; Gersh, Tamara; Silvestri, Rosalia; Stickgold, Robert; Salzman, Carl; Hobson, J. Allan (2001). “Le traitement ISRS supprime la fréquence de rappel des rêves mais augmente l’intensité subjective des rêves chez les sujets normaux” . Journal de recherche sur le sommeil . 10 (2): 129–142. doi : 10.1046/j.1365-2869.2001.00249.x . ISSN 1365-2869 . PMID 11422727 . S2CID 1612343 .
- ^ a b Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 688.
- ^ Wagner U, Gais S, Haider H, Verleger R, Born J (2004). “Le sommeil inspire la perspicacité”. Nature . 427 (6972): 352–5. Bibcode : 2004Natur.427..352W . doi : 10.1038/nature02223 . PMID 14737168 . S2CID 4405704 .
- ^ un bc Cai DJ, Mednick SA, Harrison EM, Kanady JC, Mednick SC (2009). “Le REM, pas l’incubation, améliore la créativité en amorçant les réseaux associatifs” . Proc Natl Acad Sci USA . 106 (25): 10130–10134. Bibcode : 2009PNAS..10610130C . doi : 10.1073/pnas.0900271106 . PMC 2700890 . PMID 19506253 .
- ^ Walker MP, Liston C, Hobson JA, Stickgold R (novembre 2002). “La flexibilité cognitive à travers le cycle veille-sommeil: amélioration du sommeil paradoxal de la résolution de problèmes d’anagramme”. Recherche sur le cerveau. Recherche sur le cerveau cognitif . 14 (3) : 317–324. doi : 10.1016/S0926-6410(02)00134-9 . PMID 12421655 .
- ^ Hasselmo ME (septembre 1999). « Neuromodulation : acétylcholine et consolidation de la mémoire ». Tendances en sciences cognitives . 3 (9): 351–359. doi : 10.1016/S1364-6613(99)01365-0 . PMID 10461198 . S2CID 14725160 .
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 9–11.
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , p. 17.
- ^ Van Cauter E, Leproult R, Plat L (2000). “Modifications liées à l’âge du sommeil à ondes lentes et du sommeil paradoxal et relation avec les niveaux d’hormone de croissance et de cortisol chez les hommes en bonne santé” . JAMA . 284 (7) : 861–8. doi : 10.1001/jama.284.7.861 . PMID 10938176 .
- ^ un b Daniel Aeschbach, “Régulation du sommeil paradoxal : déterminants circadiens, homéostatiques et non-dépendants du sommeil paradoxal” ; dans Mallick et al. (2011).
- ^ un bc Nishidh Barot & Clete Kushida, “L’importance des études de privation”; dans Mallick et al. (2011).
- ^ un bc Marcos G. Frank, “L’ontogenèse et la (les) fonction ( s ) du sommeil paradoxal”, dans Mallick et al, eds. (2011).
- ^ Kazuo Mishima, Tetsuo Shimizu et Yasuo Hishikawa (1999), “REM Sleep Across Age and Sex”, dans Rapid Eye Movement Sleep ed. Mallick & Inoué.
- ^ Kryger M, Roth T, Dement W (2000). Principes et pratiques de la médecine du sommeil . Société WB Saunders. p. 1, 572.
- ^ Endo T, Roth C, Landolt HP, Werth E, Aeschbach D, Achermann P, Borbély AA (1998). “Privation sélective de sommeil paradoxal chez l’homme: effets sur le sommeil et l’EEG du sommeil”. Le Journal américain de physiologie . 274 (4 Pt 2) : R1186–R1194. doi : 10.1152/ajpregu.1998.274.4.R1186 . PMID 9575987 .
- ^ un bc Steven J. Ellman , Arthur J. Spielman, Dana Luck, Solomon S. Steiner et Ronnie Halperin (1991), “REM Deprivation: A Review”, dans The Mind in Sleep , éd. Elman & Antrobus.
- ^ “Types de privation de sommeil” . Archivé de l’original le 2013-07-05.
- ^ Ringel BL, député de Szuba (2001). “Mécanismes potentiels des thérapies du sommeil pour la dépression”. Dépression et anxiété . 14 (1): 29–36. doi : 10.1002/da.1044 . PMID 11568980 . S2CID 25000558 .
- ^ Riemann D, König A, Hohagen F, Kiemen A, Voderholzer U, Backhaus J, Bunz J, Wesiack B, Hermle L, Berger M (1999). “Comment préserver l’effet antidépresseur de la privation de sommeil : une comparaison de l’avance de la phase de sommeil et du retard de la phase de sommeil”. Archives européennes de psychiatrie et de neurosciences cliniques . 249 (5): 231-237. doi : 10.1007/s004060050092 . PMID 10591988 . S2CID 22514281 .
- ^ Wirz-Justice A, Van den Hoofdakker RH (1999). “Privation de sommeil dans la dépression : que savons-nous, où allons-nous ?”. Psychiatrie Biologique . 46 (4): 445–453. doi : 10.1016/S0006-3223(99)00125-0 . PMID 10459393 . S2CID 15428567 .
- ^ un b Jerome M. Siegel (2001). ” L’hypothèse de consolidation de la mémoire de sommeil REM archivée le 13/09/2010 sur la Wayback Machine “. Sciences Vol. 294.
- ^ Grassi Zucconi G, Cipriani S, Balgkouranidou I, Scattoni R (2006). “La privation de sommeil “d’une nuit” stimule la neurogenèse hippocampique”. Bulletin de recherche sur le cerveau . 69 (4): 375–381. doi : 10.1016/j.brainresbull.2006.01.009 . PMID 16624668 . S2CID 20823755 .
- ^ Lesku, JA; Meyer, LCR; Fuller, A.; Maloney, Sask.; Dell’Omo, G.; Vyssotski, AL; Rattenborg, Caroline du Nord (2011). Balaban, Evan (éd.). “Les autruches dorment comme des ornithorynques” . PLOS ONE . 6 (8) : e23203. Code bib : 2011PLoSO …623203L . doi : 10.1371/journal.pone.0023203 . PMC 3160860 . PMID 21887239 .
- ^ a b Niels C. Rattenborg, John A. Lesku et Dolores Martinez-Gonzalez, “Perspectives évolutives sur la fonction du sommeil paradoxal”, dans Mallick et al, eds. (2011).
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil , pp. 13, 59–61. “Chez les espèces de masse corporelle différente (par exemple, les rats, les lapins, les chats, les humains), la durée moyenne des épisodes de sommeil paradoxal augmente avec l’augmentation du poids corporel et cérébral, un déterminant de l’inertie thermique. Une telle inertie retarde les changements dans le noyau corporel. température si alarmante qu’elle provoque l’éveil du sommeil paradoxal. En outre, d’autres facteurs, tels que la fourrure, la nourriture et les relations prédateur-proie influençant la durée du sommeil paradoxal, doivent être mentionnés ici.
- ^ Steriade & McCarley (1990), Contrôle du Tronc cérébral de l’éveil et du sommeil , §12.1 (p. 363).
- ^ Shein-Idelson, Mark; Ondracek, Janie M.; Liaw, Hua-Peng ; Reiter, Sam; Laurent, Gilles (2016-04-29). “Ondes lentes, ondes pointues, ondulations et REM dans les dragons endormis”. Sciences . 352 (6285): 590–595. Bibcode : 2016Sci…352..590S . doi : 10.1126/science.aaf3621 . ISSN 0036-8075 . PMID 27126045 . S2CID 6604923 .
- ^ Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 686–687.
- ^ Feng Pingfu; Ma Yuxian; Vogel Gerald W (2001). “Ontogénie du rebond REM chez les rats postnatals” . Dormez . 24 (6): 645–653. doi : 10.1093/sommeil/24.6.645 . PMID 11560177 .
- ^ Robert P. Vertes (1986), “Une fonction de maintien de la vie pour le sommeil paradoxal: une théorie”, Neuroscience and Behavioral Reviews 10.
- ^ Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 686. La privation de sommeil paradoxal (principalement sans enregistrement simultané du sommeil) semble altérer principalement la formation de la mémoire sur des tâches complexes, comme l’évitement de la navette bidirectionnelle et les labyrinthes complexes, qui englobent un changement dans le répertoire régulier des animaux (69, 100, 312, 516, 525, 539, 644, 710, 713, 714, 787, 900, 903-906, 992, 1021, 1072, 1111, 1113, 1238, 1352, 1353). En revanche, la mémoire à long terme pour des tâches plus simples, comme l’évitement actif à sens unique et les labyrinthes simples, était moins systématiquement affectée (15, 249, 386, 390, 495, 558, 611, 644, 821, 872, 902, 907– 909, 1072, 1091, 1334).”
- ^ Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 687.
- ^ Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 689. “L’hypothèse du processus double suppose que différentes étapes du sommeil servent à la consolidation de différents types de souvenirs (428, 765, 967, 1096). Plus précisément, il a été supposé que la mémoire déclarative profite du SWS, alors que la consolidation de la mémoire non déclarative est prise en charge par le sommeil paradoxal.” Cette hypothèse a été soutenue principalement par des études chez l’homme, en particulier par celles qui utilisent le «paradigme de la demi-nuit».
- ^ Marshall L, Helgadóttir H, Mölle M, Né J (2006). “Améliorer les oscillations lentes pendant le sommeil potentialise la mémoire”. Nature . 444 (7119): 610–3. Bibcode : 2006Natur.444..610M . doi : 10.1038/nature05278 . PMID 17086200 . S2CID 205211103 .
- ^ Tucker MA, Hirota Y, Wamsley EJ, Lau H, Chaklader A, Fishbein W (2006). “Une sieste diurne contenant uniquement du Sommeil non paradoxal améliore la mémoire déclarative mais pas procédurale” (PDF) . Neurobiologie de l’apprentissage et de la mémoire . 86 (2): 241–7. doi : 10.1016/j.nlm.2006.03.005 . PMID 16647282 . S2CID 17606945 . Consulté le 29 juin 2011 .
- ^ Rasch & Born (2013), “À propos du rôle du sommeil dans la mémoire”, p. 690–691.
- ^ Crick F, Mitchison G (1983). “La fonction du sommeil de rêve”. Nature . 304 (5922): 111–14. Bibcode : 1983Natur.304..111C . doi : 10.1038/304111a0 . PMID 6866101 . S2CID 41500914 .
- ^ Parmeggiani (2011), Homéostase systémique et poïkilostase dans le sommeil, p. 89. “Contrairement au sommeil NREM, la réduction d’échelle des synapses serait produite en sommeil paradoxal par des bouffées aléatoires de décharges neuronales (par exemple, des bouffées sous-jacentes aux ondes ponto-géniculo-occipitales) (voir Tonioni et Cirelli, 2005). / Cette hypothèse est particulièrement enrichie en signification fonctionnelle en considérant à ce stade la nature opposée, homéostatique et poïkilostatique, de la régulation neuronale systémique des fonctions physiologiques dans ces états de sommeil.Le fait important est que l’homéostasie est entièrement préservée dans le sommeil NREM.Cela signifie qu’une synaptique systémique le downcaling (activité électroencéphalographique à ondes lentes) est pratiquement limité aux structures corticales relativement homogènes du télencéphale, tandis que l’ensemble du Tronc cérébral, du diencéphale à la moelle, exerce toujours ses fonctions de base de régulation homéostatique intégrée des fonctions physiologiques somatiques et autonomes. Dans le sommeil paradoxal, cependant, la réduction d’échelle synaptique nécessaire dans le Tronc cérébral est plutôt le résultat d’un déclenchement neuronal aléatoire.”
- ^ Marques et al. 1994
- ^ Mirmiran M, Scholtens J, van de Poll NE, Uylings HB, van der Gugten J, Boer GJ (1983). “Effets de la suppression expérimentale du sommeil actif (REM) au cours du développement précoce sur le cerveau adulte et le comportement chez le rat”. Cerveau Res . 283 (2–3): 277–86. doi : 10.1016/0165-3806(83)90184-0 . PMID 6850353 .
- ^ Tsoukalas I (2012). “L’origine du sommeil paradoxal : Une hypothèse”. Rêver . 22 (4): 253–283. doi : 10.1037/a0030790 .
- ^ Vitelli, R. (2013). « Explorer le mystère du sommeil paradoxal ». Psychology Today , En ligne, 25 mars
- ^ un b Leclair-Visonneau L, Oudiette D, Gaymard B, Leu-Semenescu S, Arnulf I (2010). “Les Yeux scannent-ils des images de rêve pendant le sommeil à mouvements oculaires rapides ? Preuve du modèle de trouble du comportement du sommeil à mouvements oculaires rapides” . Cerveau . 133 (6) : 1737–1746. doi : 10.1093/cerveau/awq110 . PMID 20478849 .
- ^ Maurice, David (1998). “La conférence Von Sallmann 1996: une explication ophtalmologique du sommeil paradoxal” (PDF) . Recherche expérimentale sur les Yeux . 66 (2): 139–145. doi : 10.1006/exer.1997.0444 . PMID 9533840 .
- ↑ Madeleine Scriba ; Anne-Lyse Ducrest ; Isabelle Henri; Alexei L Vyssotski; Niels C Rattenborg; Alexandre Roulin (2013). “Lier le mélanisme au développement du cerveau : l’expression d’un gène lié au mélanisme dans les follicules de plumes de chouette effraie covarie avec l’ontogenèse du sommeil” . Frontières en zoologie . 10 (42): 42. doi : 10.1186/1742-9994-10-42 . PMC 3734112 . PMID 23886007 .; voir Fig. S1
- ^ Steinbach, MJ (2004). “Les Yeux des hiboux bougent” . Le British Journal of Ophthalmology . 88 (8): 1103. doi : 10.1136/bjo.2004.042291 . PMC 1772283 . PMID 15258042 .
- ^ Steven J.Ellman; John S. Antrobus (1991). “Effets de la privation de REM”. L’esprit dans le sommeil : psychologie et psychophysiologie . John Wiley et fils. p. 398.ISBN _ 978-0-471-52556-1.
- ↑ Jouvet (1999), Le paradoxe du sommeil , p. 122-124.
- ^ William H. Moorcroft; Paula Belcher (2003). “Fonctions de REMS et Dreaming”. Comprendre le sommeil et sDreaming . Springer. p. 290. ISBN 978-0-306-47425-5.
- ^ Perrine M. Ruby (2011), “Recherche expérimentale sur le rêve: état de l’art et perspectives neuropsychanalytiques”, Frontiers in Psychology 2.
Sources
- Antrobus, John S. et Mario Bertini (1992). La neuropsychologie du sommeil et du rêve . Hillsdale, New Jersey : Lawrence Erlbaum Associates. ISBN 0-8058-0925-2
- Brown Ritchie E.; Basher Radhika; McKenna James T.; Strecker Robert E.; McCarley Robert W. (2012). “Contrôle du sommeil et de l’éveil” . Examens physiologiques . 92 (3): 1087-1187. doi : 10.1152/physrev.00032.2011 . PMC 3621793 . PMID 22811426 .
- Ellman, Steven J., & Antrobus, John S. (1991). L’esprit dans le sommeil : psychologie et psychophysiologie . Deuxième édition. John Wiley & Sons, Inc. ISBN 0-471-52556-1
- Jouvet, Michel (1999). Le paradoxe du sommeil : l’histoire du rêve . A l’origine Le Sommeil et le Rêve , 1993. Traduit par Laurence Garey. Cambridge : Presse du MIT. ISBN 0-262-10080-0
- Mallick, BN et S. Inoué (1999). Sommeil à mouvements oculaires rapides . New Delhi : maison d’édition Narosa ; distribué aux Amériques, en Europe, en Australie et au Japon par Marcel Dekker Inc (New York).
- Mallick, BN; SR Pandi-Perumal; Robert W. McCarley; et Adrian R. Morrison. Sommeil à mouvements oculaires rapides : régulation et fonction . Cambridge University Press, 2011. ISBN 978-0-521-11680-0
- Monti, Jaime M., SR Pandi-Perumal et Christopher M. Sinton (2008). Neurochimie du sommeil et de l’éveil . La presse de l’Universite de Cambridge. ISBN 978-0-521-86441-1
- Parmeggiani, Pier Luigi (2011). Homéostasie systémique et poïkilostase du sommeil : le sommeil paradoxal est-il un paradoxe physiologique ? Londres : Imperial College Press. ISBN 978-1-94916-572-2
- Rasch, Björn et Jan Born (2013). « À propos du rôle du sommeil dans la mémoire ». Examens physiologiques 93, pp. 681–766.
- Solms, Mark (1997). La neuropsychologie des rêves : une étude clinico-anatomique . Mahwah, New Jersey : Lawrence Erlbaum Associates ; ISBN 0-8058-1585-6
- Steriade, Mircea et Robert W. McCarley (1990). Contrôle du Tronc cérébral de l’éveil et du sommeil . New York : presse plénière. ISBN 0-306-43342-7
- Lee CW, Cuijpers P (2013). “Une méta-analyse de la contribution des mouvements oculaires dans le traitement des souvenirs émotionnels” (PDF) . Journal de thérapie comportementale et de psychiatrie expérimentale. 44 (2): 231–239.
Lectures complémentaires
- Snyder F (1966). “Vers une théorie évolutive du rêve”. Journal américain de psychiatrie . 123 (2): 121–142. doi : 10.1176/ajp.123.2.121 . PMID 5329927 .
- Edward F. Pace-Schott, éd. (2003). Sommeil et Rêve : Avancées Scientifiques et Reconsidérations . La presse de l’Universite de Cambridge. ISBN 978-0-521-00869-3.
- Koulack, D. Attraper un rêve : Explorations du rêve. New York, SUNY, 1991.
- Nguyen TQ, Liang CL, Marks GA (2013). “Les récepteurs GABA(A) impliqués dans le contrôle du sommeil paradoxal expriment un site de liaison aux benzodiazépines” . Cerveau Res . 1527 : 131–40. doi : 10.1016/j.brainres.2013.06.037 . PMC 3839793 . PMID 23835499 .
- Liang CL, Marks GA (2014). “Les récepteurs GABAA sont situés dans les terminaux cholinergiques du noyau pontis oralis du rat: implications pour le contrôle du sommeil paradoxal”. Cerveau Res . 1543 : 58–64. doi : 10.1016/j.brainres.2013.10.019 . PMID 24141149 . S2CID 46317814 .
- Grace KP, Vanstone LE, Horner RL (2014). “L’entrée cholinergique endogène au générateur de sommeil paradoxal pontin n’est pas nécessaire pour que le sommeil paradoxal se produise” . J. Neurosci . 34 (43): 14198–209. doi : 10.1523/JNEUROSCI.0274-14.2014 . PMC 6608391 . PMID 25339734 .
- Carson III, Culley C. , Kirby, Roger S. , Goldstein, Irwin, éditeurs, “Textbook of Erectile Dysfunction” Oxford, Royaume-Uni ; Isis Medical Media, Ltd., 1999 ; Moreland, RB & Nehra, A. ; Physiopathologie de la dysfonction érectile ; une base moléculaire, rôle du NPT dans le maintien de la puissance : pp. 105–15.
Liens externes
| Recherchez le sommeil à mouvements oculaires rapides dans Wiktionary, le dictionnaire gratuit. |
- Épisode NOVA de PBS “What Are Dreams?” Vidéo et transcription
- LSDBase – une base de données ouverte de recherche sur le sommeil avec des images d’enregistrements de sommeil paradoxal.
