Rédox
Redox ( réduction–oxydation , / ˈ r ɛ d ɒ k s / RED -oks , / ˈ r iː d ɒ k s / REE -doks [2] ) est un type de réaction chimique dans laquelle les états d’oxydation du substrat changent. [3]
- L’oxydation est la perte d’électrons ou une augmentation de l’état d’oxydation d’un produit chimique ou des atomes qu’il contient.
- La réduction est le gain d’électrons ou une diminution de l’état d’oxydation d’un produit chimique ou des atomes qu’il contient.
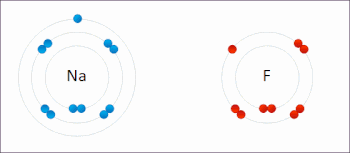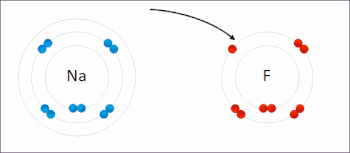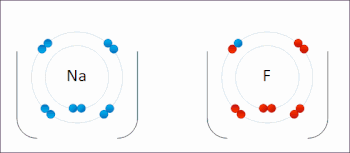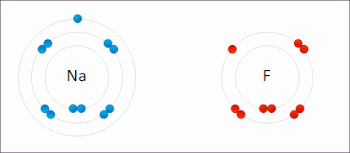 Le sodium et le fluor se lient ioniquement pour former du fluorure de sodium . Le sodium perd son électron externe pour lui donner une configuration électronique stable , et cet électron pénètre dans l’atome de fluor de manière Exothermique . Les ions de charges opposées sont alors attirés les uns vers les autres. Le sodium est oxydé ; et le fluor est réduit. 0:47 Démonstration de la réaction entre un oxydant fort et un réducteur. Lorsque quelques gouttes de glycérol (agent réducteur doux) sont ajoutées au permanganate de potassium en poudre (agent oxydant fort), une violente réaction redox accompagnée d’auto-inflammation se déclenche.
Le sodium et le fluor se lient ioniquement pour former du fluorure de sodium . Le sodium perd son électron externe pour lui donner une configuration électronique stable , et cet électron pénètre dans l’atome de fluor de manière Exothermique . Les ions de charges opposées sont alors attirés les uns vers les autres. Le sodium est oxydé ; et le fluor est réduit. 0:47 Démonstration de la réaction entre un oxydant fort et un réducteur. Lorsque quelques gouttes de glycérol (agent réducteur doux) sont ajoutées au permanganate de potassium en poudre (agent oxydant fort), une violente réaction redox accompagnée d’auto-inflammation se déclenche. 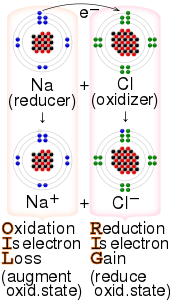 Exemple de réaction de réduction-oxydation entre le sodium et le chlore, avec le mnémonique OIL RIG [1]
Exemple de réaction de réduction-oxydation entre le sodium et le chlore, avec le mnémonique OIL RIG [1]
Il existe deux classes de réactions redox :
- transfert d’électrons où un seul électron (généralement) circule de l’agent réducteur vers l’oxydant. Ce type de réaction redox est souvent discuté en termes de couples redox et de potentiels d’électrode.
- transfert d’atome , où un atome se transfère d’un substrat à un autre. Par exemple, dans la Rouille du fer, l’état d’oxydation des atomes de fer augmente lorsqu’il se transforme en oxyde et simultanément l’état d’oxydation de l’oxygène diminue lorsqu’il accepte les électrons libérés par le fer. Bien que les réactions d’oxydation soient généralement associées à la formation d’oxydes, d’autres espèces chimiques peuvent remplir la même fonction. [4] Dans l’hydrogénation , les liaisons C=C (et autres) sont réduites par transfert d’atomes d’hydrogène.
Terminologie
“Redox” est une combinaison des mots “réduction” et “oxydation”. Le terme “redox” a été utilisé pour la première fois en 1928. [5] Les processus d’oxydation et de réduction se produisent simultanément et ne peuvent pas se produire indépendamment. [4] Dans les processus redox, le réducteur transfère des électrons à l’oxydant. Ainsi, dans la réaction, le réducteur ou agent réducteur perd des électrons et est oxydé, et l’oxydant ou agent oxydant gagne des électrons et est réduit. La paire d’un agent oxydant et réducteur qui est impliquée dans une réaction particulière est appelée une paire redox . Un couple redox est une espèce réductrice et sa forme oxydante correspondante, [6] par exemple,Fe2+
/ Fe3+
.L’oxydation seule et la réduction seule sont appelées chacune une demi-réaction car deux demi-réactions se produisent toujours ensemble pour former une réaction complète.
Oxydants
L’oxydation impliquait à l’origine une réaction avec l’oxygène pour former un oxyde. Plus tard, le terme a été élargi pour englober les substances semblables à l’oxygène qui accomplissaient des réactions chimiques parallèles. En fin de compte, la signification a été généralisée pour inclure tous les processus impliquant la perte d’électrons. Les substances qui ont la capacité d’ oxyder d’autres substances (leur faisant perdre des électrons) sont dites oxydantes ou oxydantes et sont appelées agents oxydants , oxydants ou oxydants. L’oxydant (agent oxydant) enlève des électrons à une autre substance, et est donc lui-même réduit. Et, parce qu’il “accepte” les électrons, l’agent oxydant est aussi appelé accepteur d’électrons. Les oxydants sont généralement des substances chimiques avec des éléments dans des états d’oxydation élevés (par exemple, H2O2, MnO−
4, CrO3, Cr2O2−
7, OsO4), ou bien des éléments fortement électronégatifs ( O 2 , F 2 , Cl 2 , Br 2 ) qui peuvent gagner des électrons supplémentaires en oxydant une autre substance. [ citation nécessaire ]
Les oxydants sont des oxydants mais le terme est principalement réservé aux sources d’oxygène, notamment dans le cadre d’explosions. L’acide nitrique est un oxydant.

 Le pictogramme international des produits chimiques oxydants
Le pictogramme international des produits chimiques oxydants
L’oxygène est l’oxydant par excellence.
Réducteurs
Les substances qui ont la capacité de réduire d’autres substances (leur faire gagner des électrons) sont dites réductrices ou réductrices et sont appelées agents réducteurs, réducteurs ou réducteurs. Le réducteur (agent réducteur) transfère des électrons à une autre substance et est donc lui-même oxydé. Et, parce qu’il donne des électrons, l’agent réducteur est aussi appelé donneur d’électrons . Les donneurs d’électrons peuvent également former des complexes de transfert de charge avec des accepteurs d’électrons. Le mot réduction faisait à l’origine référence à la perte de poids lors du chauffage d’un minerai métallique tel qu’un oxyde métalliquepour extraire le métal. En d’autres termes, le minerai était “réduit” en métal. Antoine Lavoisier a démontré que cette perte de poids était due à la perte d’oxygène sous forme de gaz. Plus tard, les scientifiques ont réalisé que l’atome de métal gagnait des électrons dans ce processus. Le sens de la réduction s’est alors généralisé pour inclure tous les processus impliquant un gain d’électrons. L’équivalent réducteur fait référence aux espèces chimiques qui transfèrent l’équivalent d’un électron dans les réactions redox . Le terme est courant en biochimie. [7] Un équivalent réducteur peut être un électron, un atome d’hydrogène, comme un ion hydrure . [8]
Les réducteurs en chimie sont très divers. Les métaux élémentaires électropositifs , tels que le lithium , le sodium , le magnésium , le fer , le zinc et l’aluminium , sont de bons agents réducteurs. Ces métaux donnent ou donnent des électrons relativement facilement. Ils transfèrent des électrons.
Les réactifs de transfert d’hydrure , tels que NaBH 4 et LiAlH 4 , réduisent par transfert d’atome : ils transfèrent l’équivalent d’hydrure ou H – . Ces réactifs largement utilisés dans [la réduction des composés carbonylés en Alcools . [9] [10] Une méthode connexe de réduction implique l’utilisation de gaz hydrogène (H 2 ) comme sources d’atomes H.
Tarifs, mécanismes et énergies
Les réactions redox peuvent se produire lentement, comme dans la formation de Rouille , ou rapidement, comme dans le cas de la combustion de carburant. Les réactions de transfert d’électrons sont généralement rapides, se produisant pendant le temps de mélange.
Les mécanismes des réactions de transfert d’atomes sont très variables car de nombreux types d’atomes peuvent être transférés. De telles réactions peuvent également être assez complexes, c’est-à-dire impliquer de nombreuses étapes. Les mécanismes des réactions de transfert d’électrons se produisent par deux voies distinctes, le transfert d’électrons dans la sphère interne et le transfert d’électrons dans la sphère externe .
L’analyse des énergies de liaison et des énergies d’ionisation dans l’eau permet de calculer les aspects thermodynamiques des réactions redox. Par exemple, le fait que la combustion du méthane dégage plus de chaleur que la combustion du méthanol. [11] [12]
Potentiels d’électrode standard (potentiels de réduction)
Chaque demi-réaction a un potentiel d’électrode standard ( Eo
cellule), qui est égale à la différence de potentiel ou tension à l’équilibre dans les conditions standards d’une cellule électrochimique dans laquelle la réaction cathodique est la demi-réaction considérée, et l’ anode est une électrode à hydrogène standard où l’hydrogène est oxydé :
1 ⁄ 2 H 2 → H + + e – .
Le potentiel d’électrode de chaque demi-réaction est également appelé son potentiel de réduction E ô
rouge, ou potentiel lorsque la demi-réaction a lieu à une cathode. Le potentiel de réduction est une mesure de la tendance de l’agent oxydant à être réduit. Sa valeur est nulle pour H + + e − → 1 ⁄ 2 H 2 par définition, positive pour les oxydants plus forts que H + (ex : +2,866 V pour F 2 ) et négative pour les oxydants plus faibles que H + (ex : , -0,763 V pour Zn 2+ ). [13]
Pour une réaction redox qui a lieu dans une cellule, la différence de potentiel est :
E o
cellule= E o
cathode–E _ o
anode
Cependant, le potentiel de la réaction à l’anode est parfois exprimé en potentiel d’oxydation :
E ô
bœuf = -E ô
rouge.
Le potentiel d’oxydation est une mesure de la tendance de l’agent réducteur à s’oxyder mais ne représente pas le potentiel physique au niveau d’une électrode. Avec cette notation, l’équation de tension de cellule est écrite avec un signe plus
E o
cellule= E o
rouge (cathode)+ E o
boeuf (anode)
Exemples de réactions redox

 Illustration d’une réaction redox
Illustration d’une réaction redox
Dans la réaction entre l’hydrogène et le fluor , l’hydrogène est oxydé et le fluor est réduit :
H2+ F2→ 2 HF
Cette réaction est spontanée et libère 542 kJ pour 2 g d’hydrogène car la liaison HF est beaucoup plus forte que la liaison FF. Cette réaction peut être analysée en deux demi-réactions . La réaction d’oxydation convertit l’hydrogène en protons :
H2→ 2 H + + 2 e −
La réaction de réduction convertit le fluor en anion fluorure :
F2+ 2 e − → 2 F −
Les demi-réactions sont additionnées de telle sorte que les électrons s’annulent :
| H2 | → | 2 H + + 2 e − |
| F2+ 2 e − | → | 2 F − |
|
|
||
| H2 + F2 _ | → | 2 H + + 2 F − |
Les protons et le fluorure se combinent pour former du fluorure d’hydrogène dans une réaction non redox :
2 H + + 2 F − → 2 HF
La réaction globale est :
H2+ F2→ 2 HF
Déplacement de métal

 Une réaction redox est la force derrière une cellule électrochimique comme la cellule galvanique illustrée. La batterie est constituée d’une électrode de zinc dans une solution de ZnSO 4 reliée par un fil et un disque poreux à une électrode de cuivre dans une solution de CuSO 4 .
Une réaction redox est la force derrière une cellule électrochimique comme la cellule galvanique illustrée. La batterie est constituée d’une électrode de zinc dans une solution de ZnSO 4 reliée par un fil et un disque poreux à une électrode de cuivre dans une solution de CuSO 4 .
Dans ce type de réaction, un atome de métal dans un composé (ou dans une solution) est remplacé par un atome d’un autre métal. Par exemple, le cuivre se dépose lorsque le zinc métallique est placé dans une solution de sulfate de cuivre (II) :
Zn(s)+ CuSO 4 (aq) → ZnSO 4 (aq) + Cu(s)
Dans la réaction ci-dessus, le zinc métallique déplace l’ion cuivre (II) de la solution de sulfate de cuivre et libère ainsi du cuivre métallique libre. La réaction est spontanée et libère 213 kJ pour 65 g de zinc car, par rapport au zinc, le cuivre métallique a une énergie inférieure en raison de la liaison via ses orbitales d partiellement remplies. [11]
L’équation ionique de cette réaction est :
Zn + Cu 2+ → Zn 2+ + Cu
En deux demi-réactions , on voit que le zinc s’oxyde :
Zn → Zn 2+ + 2e −
Et le cuivre est réduit :
Cu 2+ + 2 e − → Cu
Autres exemples
- La réduction du nitrate en azote en présence d’un acide ( dénitrification ) : 2 NON 3 − + dix e − + 12 H + ⟶ N 2 + 6 H 2 O {displaystyle {ce {2NO3- + 10e- + 12H+ -> N2 + 6 H2O}}}
- La combustion des hydrocarbures , comme dans un moteur à combustion interne , produit de l’ eau , du dioxyde de carbone , certaines formes partiellement oxydées comme le monoxyde de carbone et de l ‘ énergie thermique . L’oxydation complète des matériaux contenant du carbone produit du dioxyde de carbone.
- L’oxydation par étapes d’un hydrocarbure par l’oxygène, en chimie organique , produit de l’eau et, successivement : un alcool , un aldéhyde ou une cétone , un acide carboxylique , puis un peroxyde .
Corrosion et Rouille

 Oxydes, tels que l’oxyde de fer(III) ou la Rouille , qui se compose d’ oxydes de fer(III) hydratés Fe 2 O 3 · n H 2 O et d’oxyde-hydroxyde de fer(III) (FeO(OH), Fe(OH) 3 ) , se forme lorsque l’oxygène se combine avec d’autres éléments
Oxydes, tels que l’oxyde de fer(III) ou la Rouille , qui se compose d’ oxydes de fer(III) hydratés Fe 2 O 3 · n H 2 O et d’oxyde-hydroxyde de fer(III) (FeO(OH), Fe(OH) 3 ) , se forme lorsque l’oxygène se combine avec d’autres éléments 

- Le terme corrosion fait référence à l’oxydation électrochimique des métaux en réaction avec un oxydant tel que l’oxygène. La Rouille , la formation d’ oxydes de fer , est un exemple bien connu de corrosion électrochimique ; il se forme à la suite de l’oxydation du fer métallique. La Rouille commune fait souvent référence à l’oxyde de fer(III) , formé lors de la réaction chimique suivante : 4 Fe + 3 O 2 ⟶ 2 Fe 2 O 3 {displaystyle {ce {4Fe + 3O2 -> 2Fe2O3}}}
- L’oxydation du fer(II) en fer(III) par le peroxyde d’hydrogène en présence d’un acide : Fe 2 + ⟶ Fe 3 + + e − {displaystyle {ce {Fe^{2+}->{Fe^{3+}}+e-}}}
H 2 O 2 + 2 e − ⟶ 2 OH − {displaystyle {ce {H2O2 + 2e- -> 2OH-}}}
Équation globale : 2 Fe 2 + + H 2 O 2 + 2 H + ⟶ 2 Fe 3 + + 2 H 2 O {displaystyle {ce {{2Fe^{2+}}+{H2O2}+2H+->{2Fe^{3+}}+2H2O}}}
Disproportion
Une réaction de dismutation est une réaction dans laquelle une seule substance est à la fois oxydée et réduite. Par exemple, l’ion thiosulfate avec le soufre à l’état d’oxydation +2 peut réagir en présence d’acide pour former du soufre élémentaire (état d’oxydation 0) et du dioxyde de soufre (état d’oxydation +4).
S 2 O 3 2- + 2 H + → S + SO 2 + H 2 O
Ainsi, un atome de soufre est réduit de +2 à 0, tandis que l’autre est oxydé de +2 à +4. [14]
Réactions redox dans l’industrie
La protection cathodique est une technique utilisée pour contrôler la corrosion d’une surface métallique en en faisant la cathode d’une cellule électrochimique. Une méthode simple de protection relie le métal protégé à une ” Anode sacrificielle ” plus facilement corrodée pour agir comme anode. Le métal sacrificiel au lieu du métal protégé se corrode alors. Une application courante de la protection cathodique est l’acier galvanisé , dans lequel un revêtement sacrificiel de zinc sur les pièces en acier les protège de la Rouille. [ citation nécessaire ]
L’oxydation est utilisée dans une grande variété d’industries telles que la production de produits de nettoyage et l’oxydation de l’ammoniac pour produire de l’acide nitrique .
Les réactions redox sont à la base des cellules électrochimiques , qui peuvent générer de l’énergie électrique ou soutenir l’électrosynthèse . Les minerais métalliques contiennent souvent des métaux à l’état oxydé tels que des oxydes ou des sulfures, dont les métaux purs sont extraits par fusion à haute température en présence d’un agent réducteur. Le processus de galvanoplastie utilise des réactions redox pour recouvrir les objets d’une fine couche d’un matériau, comme dans les pièces automobiles chromées , les couverts argentés , la galvanisation et les Bijoux plaqués or . [ citation nécessaire ]
Réactions redox en biologie
  |
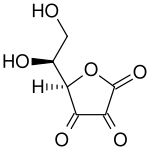  |
Haut : Acide ascorbique ( forme réduite de la vitamine C )
Bas : acide déhydroascorbique ( forme oxydée de la vitamine C ) 
 Le brunissement enzymatique est un exemple de réaction redox qui se produit dans la plupart des fruits et légumes.
Le brunissement enzymatique est un exemple de réaction redox qui se produit dans la plupart des fruits et légumes.
De nombreux processus biologiques importants impliquent des réactions redox. Avant que certains de ces processus puissent commencer, le fer doit être assimilé à partir de l’environnement. [15]
La respiration cellulaire , par exemple, est l’oxydation du glucose (C 6 H 12 O 6 ) en CO 2 et la réduction de l’oxygène en eau . L’équation récapitulative de la respiration cellulaire est la suivante :
C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
Le processus de respiration cellulaire dépend également fortement de la réduction du NAD + en NADH et de la réaction inverse (l’oxydation du NADH en NAD + ). La photosynthèse et la respiration cellulaire sont complémentaires, mais la photosynthèse n’est pas l’inverse de la réaction redox dans la respiration cellulaire :
6 CO 2 + 6 H 2 O + énergie lumineuse → C 6 H 12 O 6 + 6 O 2
L’énergie biologique est souvent stockée et libérée au moyen de réactions redox. La photosynthèse implique la réduction du dioxyde de carbone en sucres et l’oxydation de l’eau en oxygène moléculaire. La réaction inverse, la respiration, oxyde les sucres pour produire du dioxyde de carbone et de l’eau. En tant qu’étapes intermédiaires, les composés carbonés réduits sont utilisés pour réduire le nicotinamide adénine dinucléotide (NAD + ) en NADH, qui contribue ensuite à la création d’un Gradient de protons , qui entraîne la synthèse de l’ adénosine triphosphate (ATP) et est maintenu par la réduction de oxygène. Dans les cellules animales, les Mitochondries remplissent des fonctions similaires. Voir leArticle de potentiel membranaire .
Les réactions radicalaires sont des réactions redox qui se produisent dans le cadre de l’ homéostasie et tuent les micro-organismes, où un électron se détache d’une molécule puis se rattache presque instantanément. Les Radicaux libres font partie des molécules redox et peuvent devenir nocifs pour le corps humain s’ils ne se rattachent pas à la molécule redox ou à un antioxydant . Les Radicaux libres insatisfaits peuvent stimuler la mutation des cellules qu’ils rencontrent et sont, par conséquent, des causes de cancer.
Le terme état redox est souvent utilisé pour décrire l’équilibre GSH/GSSG , NAD + /NADH et NADP + /NADPH dans un système biologique tel qu’une cellule ou un organe. L’état redox se reflète dans l’équilibre de plusieurs ensembles de métabolites (par exemple, le lactate et le Pyruvate , le Bêta-hydroxybutyrate et l’ acétoacétate ), dont l’interconversion dépend de ces rapports. Un état redox anormal peut se développer dans diverses situations délétères, telles que l’ hypoxie , le choc et la septicémie .. Le mécanisme redox contrôle également certains processus cellulaires. Les protéines redox et leurs gènes doivent être co-localisés pour la régulation redox selon l’ hypothèse CoRR pour la fonction de l’ADN dans les Mitochondries et les chloroplastes.
Cycle redox
De larges variétés de composés aromatiques sont réduites par voie enzymatique pour former des Radicaux libres qui contiennent un électron de plus que leurs composés parents. En général, le donneur d’électrons est l’une des nombreuses flavoenzymes et leurs coenzymes . Une fois formés, ces Radicaux libres anioniques réduisent l’oxygène moléculaire en superoxyde et régénèrent le composé parent inchangé. La réaction nette est l’oxydation des coenzymes de la flavoenzyme et la réduction de l’oxygène moléculaire pour former du superoxyde. Ce comportement catalytique a été décrit comme un cycle futile ou cycle redox.
Réactions redox en géologie

 Hauts-fourneaux de l’usine sidérurgique de Třinec , République tchèque
Hauts-fourneaux de l’usine sidérurgique de Třinec , République tchèque
Les minéraux sont généralement des dérivés oxydés de métaux. Le fer est extrait sous forme de magnétite (Fe 3 O 4 ). Le titane est extrait sous forme de dioxyde, généralement sous forme de rutile (TiO 2 ). Pour obtenir les métaux correspondants, ces oxydes doivent être réduits, ce qui est souvent réalisé en chauffant ces oxydes avec du carbone ou du monoxyde de carbone comme agents réducteurs. Les hauts fourneaux sont les réacteurs où les oxydes de fer et le coke (une forme de carbone) sont combinés pour produire du fer en fusion. La principale réaction chimique produisant le fer en fusion est : [16]
Fe 2 O 3 + 3CO → 2Fe + 3CO 2
Réactions redox dans les sols
Les réactions de transfert d’électrons sont au cœur d’une myriade de processus et de propriétés dans les sols, et “l’activité” des électrons, quantifiée par Eh (potentiel d’électrode de platine (tension) par rapport à l’électrode à hydrogène standard) ou pe (analogue au pH en tant qu’activité électronique -log), est une variable maîtresse, avec le pH, qui contrôle et est régie par les réactions chimiques et les processus biologiques. Les premières recherches théoriques avec des applications aux sols inondés et à la production de riz paddy ont été déterminantes pour les travaux ultérieurs sur les aspects thermodynamiques du redox et de la croissance des racines des plantes dans les sols. [17]Des travaux ultérieurs se sont appuyés sur cette base et l’ont élargie pour comprendre les réactions redox liées aux changements d’état d’oxydation des métaux lourds, à la pédogenèse et à la morphologie, à la dégradation et à la formation de composés organiques, à la chimie des Radicaux libres, à la délimitation des zones humides, à l’assainissement des sols et à diverses approches méthodologiques pour caractériser le redox état des sols. [18] [19]
Mnémotechnique
Les termes clés impliqués dans redox peuvent prêter à confusion. [20] [21] Par exemple, un réactif qui est oxydé perd des électrons ; cependant, ce réactif est appelé agent réducteur. De même, un réactif qui est réduit gagne des électrons et est appelé agent oxydant. [22] Ces mnémoniques sont couramment utilisés par les étudiants pour aider à mémoriser la terminologie : [23]
- ” OIL RIG “ — l’ oxydation est une perte d’électrons, la réduction est un gain d’ électrons [20] [21] [22] [23]
- « LEO le lion dit GER [grr] » — la perte d’ électrons est une oxydation , le gain d’ électrons est une réduction [20] [21] [22] [23]
- « LEORA dit GEROA » — la perte d’électrons est appelée oxydation (agent réducteur) ; le gain d’électrons est appelé réduction (agent oxydant). [22]
- “RED CAT” et “AN OX”, ou “AnOx RedCat” (“un chat rouge bœuf”) – la réduction se produit à la cathode et l’anode est destinée à l’oxydation
- “RED CAT gagne ce qu’AN OX perd” – la réduction à la cathode gagne (électrons) ce que l’oxydation anodique perd (électrons)
- “PANIQUE” – L’anode positive et le négatif est la cathode. Cela s’applique aux cellules électrolytiques qui libèrent de l’électricité stockée et peuvent être rechargées en électricité. PANIC ne s’applique pas aux cellules qui peuvent être rechargées avec des matériaux redox. Ces cellules galvaniques ou voltaïques , comme les piles à combustible , produisent de l’électricité à partir de réactions redox internes. Ici, l’électrode positive est la cathode et la négative est l’anode.
Voir également
- Respiration anaérobie
- Procédé Bessemer
- Bioremédiation
- Cycle de Calvin
- Équation chimique
- Combustion en boucle chimique
- Le cycle de l’acide citrique
- Série électrochimique
- Électrochimie
- Électrolyse
- Équivalent électronique
- Chaîne de transport d’électrons
- Electrosynthèse
- Pile galvanique
- Hydrogénation
- Potentiel membranaire
- Pile à combustible microbienne
- Concept Murburn
- Abstraction nucléophile
- Réaction redox organique
- Addition oxydative et élimination réductrice
- La phosphorylation oxydative
- Oxydation partielle
- Pro-oxydant
- Gradient redox
- Potentiel redox
- Agent réducteur
- Atmosphère réductrice
- Potentiel de réduction
- Réaction thermique
- transmétallation
- Cycle du soufre
Références
- ^ “Métaux” . Bouchée . BBC.
- ^ “redox – définition de redox en anglais | Dictionnaires d’Oxford” . Dictionnaires d’Oxford | Anglais . Archivé de l’original le 1er octobre 2017 . Consulté le 15 mai 2017 .
- ^ “Réactions redox” . wiley.com. Archivé de l’original le 30 mai 2012 . Consulté le 9 mai 2012 .
- ^ un b Haustein, Catherine Hinga (2014). “Réaction d’oxydo-réduction” . Dans K. Lee Lerner; Brenda Wilmoth Lerner (dir.). L’Encyclopédie Gale des sciences (5e éd.). Farmington Hills, MI : Groupe Gale.
- ^ Harper, Douglas. “rédox” . Dictionnaire d’étymologie en ligne .
- ^ Pingarrón, José M.; Labuda, Ján ; Barek, Jiří; Brett, Christopher MA; Camões, Maria Filomena; Fojta, Miroslav; Hibbert, D. Brynn (2020). “Terminologie des méthodes d’analyse électrochimiques (Recommandations IUPAC 2019)” . Chimie pure et appliquée . 92 (4): 641–694. doi : 10.1515/pac-2018-0109 .
- ^ Jain JL (2004). Fondamentaux de la biochimie . S. Chand. ISBN 81-219-2453-7.
- ^ Lehninger AL, Nelson DL, Cox MM (1er janvier 2017). Principes de biochimie de Lehninger (septième éd.). New York, NY. ISBN 9781464126116. OCLC 986827885 .
- ^ Hudlický, Miloš (1996). Réductions en chimie organique . Washington, DC : Société américaine de chimie. p. 429. ISBN 978-0-8412-3344-7.
- ^ Hudlický, Milos (1990). Oxydations en chimie organique . Washington, DC : Société américaine de chimie. p. 456 . ISBN 978-0-8412-1780-5.
- ^ un b Schmidt-Rohr, K. (2018). “Comment les batteries stockent et libèrent de l’énergie : Expliquer l’électrochimie de base” . J. Chem. Éduc . 95 (10): 1801–1810. Bibcode : 2018JChEd..95.1801S . doi : 10.1021/acs.jchemed.8b00479 .
- ^ Schmidt-Rohr, K. (2015). “Pourquoi les combustions sont toujours exothermiques, produisant environ 418 kJ par mole d’O 2 ” . J. Chem. Éduc . 92 (12): 2094–2099. Bibcode : 2015JChEd..92.2094S . doi : 10.1021/acs.jchemed.5b00333 .
- ^ Valeurs potentielles d’électrode de : Petrucci, Ralph H. ; Harwood, William S.; Hareng, F. Geoffrey (2002). Chimie générale: principes et applications modernes (8e éd.). Upper Saddle River, New Jersey : Prentice Hall. p. 832 . ISBN 978-0-13-014329-7. RCAC 2001032331 . OCLC 46872308 .
- ^ Petrucci, Ralph H.; Harwood, William S.; Hareng, F. Geoffrey (2002). Chimie générale. Principes et applications modernes (8e éd.). Prentice Hall. p. 158. ISBN 0-13-014329-4.
- ^ “Titres des volumes 1 à 44 dans la série des ions métalliques dans les systèmes biologiques” . Métaux, microbes et minéraux – le côté biogéochimique de la vie . De Gruyter. 2021. pp. xxiii–xxiv. doi : 10.1515/9783110589771-005 . ISBN 9783110588903. S2CID 242013948 .
- ^ Oeters, Franz; Ottow, Manfred; Meiler, Heinrich; Lüngen, Hans Bodo; Koltermann, Manfred; Buhr, Andreas; Yagi, Jun-Ichiro ; Formanek, Lothar; Rose (2006). “Fer”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a14_461.pub2 .
- ^ Ponnamperuma, FN (1992). “La chimie des sols submergés”. Les progrès de l’agronomie . 24 : 29–96. doi : 10.1016/S0065-2113(08)60633-1 . ISBN 9780120007240.
- ^ Bartlett, RJ; En ligneJames, Bruce R. (1991). “Chimie redox des sols”. Les progrès de l’agronomie . 39 : 151–208.
- ^ James, Bruce R.; En ligneBrose, Dominic A. (2012). “Phénomènes d’oxydo-réduction”. À Huang, Pan Ming; Li, Yucong ; Sumner, Malcolm E. (éd.). Manuel des sciences du sol : Propriétés et processus, 2e éd . Boca Raton, Floride : CRC Press. p. 14-1 — 14-24. ISBN 978-1-4398-0305-9.
- ^ un bcRobertson , William (2010). Plus de bases de chimie . Association nationale des professeurs de sciences. p. 82. ISBN 978-1-936137-74-9.
- ^ un bc Phillips , John; Strozak, Victor; Wistrom, Cheryl (2000). Chimie : concepts et applications . Glencoe McGraw-Hill. p. 558.ISBN _ 978-0-02-828210-7.
- ^ un bcd Rodgers , Glen (2012). Chimie descriptive inorganique, de coordination et de l’état solide . Brooks/Cole, Cengage Learning. p. 330. ISBN 978-0-8400-6846-0.
- ^ un bc Zumdahl , Steven; Zumdahl, Susan (2009). Chimie . Houghton Mifflin. p. 160. ISBN 978-0-547-05405-6.
Lectures complémentaires
- Schüring, J.; Schulz, HD; Fischer, WR; Bottcher, J.; Duijnisveld, WH, éd. (1999). Redox : fondamentaux, procédés et applications . Heidelberg : Springer-Verlag. p. 246. hdl : 10013/epic.31694.d001 . ISBN 978-3-540-66528-1.
- Tratnyek, Paul G.; Grundl, Timothy J.; Haderlein, Stefan B., éd. (2011). Chimie Aquatique Redox . Série de symposiums de l’AEC. Vol. 1071. doi : 10.1021/bk-2011-1071 . ISBN 978-0-8412-2652-4.
Liens externes
| Wikiquote a des citations liées à Redox . |
| Wikimedia Commons a des médias liés aux réactions Redox . |
- Équilibreur d’ équations chimiques – Un équilibreur d’équations chimiques open source qui gère les réactions redox.
- Calculateur de réactions redox
- Réactions redox chez Chemguide
- Équilibreur d’équations de réaction redox en ligne, équilibre les équations de n’importe quelle demi-cellule et réactions complètes