Radical (chimie)
En chimie , un radical libre est un atome , une molécule ou un ion qui possède au moins un électron de valence non apparié . [1] [2] À quelques exceptions près, ces électrons non appariés rendent les radicaux hautement réactifs chimiquement . De nombreux radicaux se dimérisent spontanément . La plupart des radicaux organiques ont des durées de vie courtes.
 Le radical hydroxyle , structure de Lewis illustrée, contient un électron non apparié
Le radical hydroxyle , structure de Lewis illustrée, contient un électron non apparié 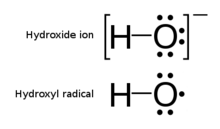 Ion hydroxyde comparé à un radical hydroxyle
Ion hydroxyde comparé à un radical hydroxyle
Un exemple notable de radical est le radical hydroxyle (HO · ), une molécule qui a un électron non apparié sur l’atome d’oxygène. Deux autres exemples sont l’oxygène triplet et le carbène triplet ( ꞉ CH2) qui ont deux électrons non appariés.
Les radicaux peuvent être générés de plusieurs façons, mais les méthodes typiques impliquent des réactions redox . Les rayonnements ionisants , la chaleur, les décharges électriques et l’ électrolyse sont connus pour produire des radicaux. Les radicaux sont des intermédiaires dans de nombreuses réactions chimiques, plus que ne le montrent les équations équilibrées.
Les radicaux sont importants dans la combustion , la chimie atmosphérique , la polymérisation , la chimie du plasma , la biochimie et de nombreux autres processus chimiques. La majorité des produits naturels sont générés par des enzymes génératrices de radicaux. Dans les organismes vivants, les radicaux superoxyde et oxyde nitrique et leurs produits de réaction régulent de nombreux processus, tels que le contrôle du tonus vasculaire et donc de la pression artérielle. Ils jouent également un rôle clé dans le métabolisme intermédiaire de divers composés biologiques. De tels radicaux peuvent même être des messagers dans un processus appelé Signalisation redox . Un radical peut être piégé dans une cage de solvantou être autrement lié.
Formation
Les radicaux sont soit (1) formés à partir de molécules à spin apparié, soit (2) à partir d’autres radicaux. Les radicaux sont formés à partir de molécules à spin apparié par homolyse de liaisons faibles ou transfert d’électrons, également appelé réduction. Les radicaux sont formés à partir d’autres radicaux par des réactions de substitution, d’addition et d’élimination.

 Homolyse d’une molécule de brome produisant deux radicaux brome
Homolyse d’une molécule de brome produisant deux radicaux brome
Formation radicalaire à partir de molécules à spin apparié
Homolyse 
 Homolyse du peroxyde de dibenzoyle produisant deux radicaux benzoyloxy
Homolyse du peroxyde de dibenzoyle produisant deux radicaux benzoyloxy
L’homolyse crée deux nouveaux radicaux à partir d’une molécule à spin apparié en rompant une liaison covalente, laissant chacun des fragments avec l’un des électrons de la liaison. [3] Parce que rompre une liaison chimique nécessite de l’énergie, l’homolyse se produit sous l’effet de la chaleur ou de la lumière. L’ Énergie de dissociation des liaisons associée à l’homolyse dépend de la stabilité d’un composé donné, et certaines liaisons faibles sont capables de s’homolyser à des températures relativement plus basses.
Certaines réactions d’homolyse sont particulièrement importantes car elles servent d’initiateur pour d’autres réactions radicalaires. Un tel exemple est l’homolyse des halogènes, qui se produit sous la lumière et sert de force motrice pour les réactions d’halogénation radicalaire.
Une autre réaction notable est l’homolyse du peroxyde de dibenzoyle, qui entraîne la formation de deux radicaux benzoyloxy et agit comme initiateur de nombreuses réactions radicalaires. [4]

 Réduction d’une cétone pour former un radical cétyle Réduction
Réduction d’une cétone pour former un radical cétyle Réduction
Des radicaux peuvent également se former lorsqu’un seul électron est ajouté à une molécule à spin apparié, ce qui entraîne un transfert d’électrons. Cette réaction, également appelée réduction, se produit généralement avec un métal alcalin donnant un électron à une autre molécule à spin apparié. [5]
Formation radicale à partir d’autres radicaux
Abstraction 
 Abstraction radicalaire entre un radical benzoyloxy et le bromure d’hydrogène
Abstraction radicalaire entre un radical benzoyloxy et le bromure d’hydrogène 
 Addition radicale d’un radical brome à un alcène substitué
Addition radicale d’un radical brome à un alcène substitué
L’abstraction d’hydrogène décrit le moment où un atome d’hydrogène est retiré d’une molécule donneuse d’hydrogène (par exemple, l’étain ou l’hydrure de silicium) avec son électron unique. [6] L’abstraction produit un nouveau radical et une nouvelle molécule à spin apparié. Ceci est différent de l’homolyse, qui se traduit par deux radicaux à partir d’une seule molécule à spin apparié et n’inclut pas de radical comme réactif. L’abstraction d’hydrogène est un processus fondamental en chimie radicalaire car elle sert d’étape de propagation finale dans de nombreuses réactions chimiques, convertissant les radicaux carbonés en molécules stables. La figure de droite montre une abstraction radicale entre un radical benzoyloxy et une molécule de bromure d’hydrogène, aboutissant à la production d’une molécule d’acide benzoïque et d’un radical brome.
Une addition
L’addition radicale décrit le moment où un radical est ajouté à une molécule à spin apparié pour former un nouveau radical. [7] La figure de droite montre l’addition d’un radical brome à un alcène. L’addition radicale suit la règle Anti-Markovnikov , où le substituant est ajouté à l’atome de carbone le moins substitué.
Élimination
L’élimination radicalaire peut être considérée comme l’inverse de l’addition radicalaire. Lors de l’élimination radicalaire, un composé radicalaire instable se décompose en une molécule à spin apparié et un nouveau composé radicalaire. Ci-dessous est un exemple d’une réaction d’élimination radicalaire, où un radical benzoyloxy se décompose en un radical phényle et une molécule de dioxyde de carbone. [8]
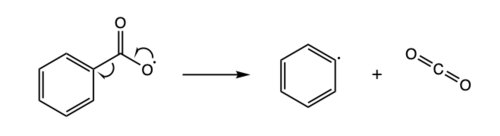
 Une réaction d’élimination radicalaire d’un radical benzoyloxy
Une réaction d’élimination radicalaire d’un radical benzoyloxy
La stabilité
Stabilité des radicaux organiques

 Le radical dérivé de l’α-tocophérol
Le radical dérivé de l’α-tocophérol
Bien que les radicaux organiques soient généralement stables intrinsèquement, leur existence n’est pratiquement que transitoire car ils ont tendance à se dimériser. Certains ont une durée de vie assez longue. Généralement, les radicaux organiques sont stabilisés par l’un ou l’ensemble de ces facteurs : présence d’électronégativité, délocalisation et encombrement stérique. [9] Le composé 2,2,6,6-tétraméthylpipéridinyloxyle illustre la combinaison des trois facteurs. C’est un solide disponible dans le commerce qui, en plus d’être magnétique, se comporte comme un composé organique normal.
Électronégativité
Les radicaux organiques sont intrinsèquement déficients en électrons. Ainsi, plus l’électronégativité de l’atome sur lequel réside l’électron non apparié est grande, moins le radical est stable. [10] Entre le carbone, l’azote et l’oxygène, par exemple, le carbone est le plus stable et l’oxygène le moins stable.
L’électronégativité joue également un rôle dans la stabilité des atomes de carbone de différentes hybridations. Un caractère s plus grand est corrélé à une électronégativité plus élevée de l’atome de carbone (en raison de la proximité des orbitales s avec le noyau), et plus l’électronégativité est grande, moins un radical est stable. [10] Les carbones hybrides sp (50 % de caractère s) forment les radicaux les moins stables par rapport aux carbones hybrides sp3 (25 % de caractère s) qui forment les radicaux les plus stables.
Délocalisation
La délocalisation des électrons à travers la structure d’un radical, également connue sous le nom de sa capacité à former une ou plusieurs structures de résonance, permet de répartir le déficit en électrons sur plusieurs atomes, minimisant ainsi l’instabilité. La délocalisation se produit généralement en présence de groupes donneurs d’électrons, tels que les groupes hydroxyle (-OH), les éthers (-OR), les alcènes adjacents et les amines (-NH 2 ou -NR), ou les groupes attracteurs d’électrons, tels que C =O ou C≡N. [3]

 Diagramme orbital moléculaire d’un radical avec un groupe donneur d’électrons
Diagramme orbital moléculaire d’un radical avec un groupe donneur d’électrons
Les effets de délocalisation peuvent également être compris en utilisant la théorie des orbitales moléculairesen tant que lentille, plus précisément, en examinant l’interaction intramoléculaire de l’électron non apparié avec la paire d’électrons d’un groupe donneur ou l’orbitale π * vide d’un groupe électroattracteur sous la forme d’un diagramme orbital moléculaire. Le HOMO d’un radical est occupé individuellement, c’est pourquoi l’orbitale est à juste titre appelée SOMO, ou orbitale moléculaire occupée individuellement. Pour un groupe donneur d’électrons, le SOMO interagit avec la paire isolée d’énergie inférieure pour former une nouvelle orbitale de liaison remplie d’énergie inférieure et un nouveau SOMO rempli d’une seule fois, plus énergétique que l’original. Alors que l’énergie de l’électron non apparié a augmenté, la diminution de l’énergie de la paire isolée formant la nouvelle orbitale de liaison l’emporte sur l’augmentation de l’énergie du nouveau SOMO, ce qui entraîne une nette diminution de l’énergie de la molécule. Donc,

 Diagramme orbital moléculaire d’un radical avec un groupe électroattracteur
Diagramme orbital moléculaire d’un radical avec un groupe électroattracteur
Avec un groupe plutôt attracteur d’électrons, le SOMO interagit alors avec l’orbitale π* vide. Il n’y a pas d’électrons occupant l’orbite d’énergie supérieure formée, tandis qu’un nouveau SOMO se forme, d’énergie inférieure. Il en résulte une énergie plus faible et une stabilité plus élevée des espèces radicalaires. Les groupes donneurs et les groupes se retirant stabilisent les radicaux.

 Les stabilités relatives des radicaux tertiaires, secondaires, primaires et méthyle.
Les stabilités relatives des radicaux tertiaires, secondaires, primaires et méthyle.
Une autre forme bien connue mais plus faible de délocalisation est l’ hyperconjugaison . En chimie radicalaire, les radicaux sont stabilisés par hyperconjugaison avec des groupes alkyle adjacents. Le don de liaisons sigma (σ) C−H dans les orbitales radicalaires partiellement vides aide à différencier les stabilités des radicaux sur les carbones tertiaires, secondaires et primaires. Les radicaux carbonés tertiaires ont trois liaisons σ CH qui donnent, les radicaux secondaires seulement deux et les radicaux primaires un seul. Par conséquent, les radicaux tertiaires sont les radicaux les plus stables et les radicaux primaires les moins stables.
Encombrement stérique 
 Forme radicalaire de la N -hydroxypipéridine
Forme radicalaire de la N -hydroxypipéridine
Plus simplement, plus l’encombrement stérique est important, plus il est difficile pour les réactions de se produire, et la forme radicale est favorisée par défaut. Par exemple, comparez la forme abstraite d’hydrogène de la N -hydroxypipéridine à la molécule TEMPO . [3] TEMPO, ou (2,2,6,6-tétraméthylpipéridin-1-yl)oxyle, est trop stériquement gêné par les groupes méthyle supplémentaires pour réagir, ce qui le rend suffisamment stable pour être vendu dans le commerce sous sa forme radicalaire. La N -hydroxypipéridine, cependant, n’a pas les quatre groupes méthyle pour empêcher la réaction d’une molécule, de sorte que la structure est instable. [3]
Donneurs d’atomes H faciles
La stabilité de nombreux (ou de la plupart) radicaux organiques n’est pas indiquée par leur isolabilité mais se manifeste par leur capacité à fonctionner comme donneurs de H * . Cette propriété reflète une liaison affaiblie à l’hydrogène, généralement O-H mais parfois NH ou C-H. Ce comportement est important car ces donneurs de H • servent d’antioxydants en biologie et dans le commerce. L’ a-tocophérol ( vitamine E ) en est un exemple. Le radical tocophérol lui-même n’est pas suffisamment stable pour l’isolement, mais la molécule mère est un donneur d’atomes d’hydrogène très efficace. La liaison C-H est affaiblie dans les dérivés de Triphénylméthyle (trityle).

 Le 2,2,6,6-tétraméthylpipéridinyloxyle est un exemple de radical organique robuste.
Le 2,2,6,6-tétraméthylpipéridinyloxyle est un exemple de radical organique robuste.
Radicaux inorganiques
Une grande variété de radicaux inorganiques sont stables et en fait isolables. Les exemples incluent la plupart des complexes de métaux de transition de première rangée.
En ce qui concerne les radicaux du groupe principal, le radical le plus abondant dans l’univers est aussi le produit chimique le plus abondant dans l’univers, H • . La plupart des radicaux du groupe principal ne sont cependant pas isolables , malgré leur stabilité intrinsèque. Les radicaux hydrogène, par exemple, se combinent avidement pour former H 2 . L’oxyde nitrique (NO) est un exemple bien connu de radical inorganique isolable. Le Sel de Fremy (nitrosodisulfonate de potassium, (KSO 3 ) 2 NO) est un exemple connexe. De nombreux radicaux thiazyle sont connus, malgré l’étendue limitée de la Stabilisation de la résonance π . [11] [12]
De nombreux radicaux peuvent être envisagés comme les produits de rupture de liaisons covalentes par homolyse . Les énergies de dissociation des liaisons homolytiques , généralement abrégées en “ΔH ° ” sont une mesure de la force de la liaison. La séparation de H 2 en 2 H • , par exemple, nécessite un Δ H ° de +435 kJ/mol , tandis que la séparation de Cl 2 en deux Cl • nécessite un Δ H ° de +243 kJ/mol. Pour les liaisons faibles, l’homolyse peut être induite thermiquement. Des liaisons fortes nécessitent des photons à haute énergie ou même des flammes pour induire l’homolyse.
Diradicaux
Les diradicaux sont des molécules contenant deux centres radicalaires. Le Dioxygène (O 2 ) est un exemple important de diradical stable. L’oxygène singulet , l’état non radicalaire de plus faible énergie du Dioxygène, est moins stable que le diradical en raison de la règle de Hund de la multiplicité maximale . La stabilité relative du diradical d’oxygène est principalement due à la nature interdite de spin de la transition triplet-singulet nécessaire pour qu’il capte les électrons, c’est-à-dire « s’oxyde ». L’état diradical de l’oxygène se traduit également par son caractère paramagnétique, qui se manifeste par son attraction vers un aimant extérieur. [13] Les diradicaux peuvent également apparaître dans les complexes métal-oxo, se prêtant à l’étude des réactions interdites de spin dans la chimie des métaux de transition . [14] Les carbènes dans leur état triplet peuvent être considérés comme des diradicaux centrés sur le même atome, alors que ce sont généralement des carbènes persistants hautement réactifs connus, les carbènes N-hétérocycliques étant l’exemple le plus courant.
Les carbènes triplet et les nitrènes sont des diradicaux. Leurs propriétés chimiques sont distinctes des propriétés de leurs analogues singulets.
Apparition de radicaux
La combustion

 Spectre de la flamme bleue d’une torche au butane montrant l’émission de bandes radicalaires moléculaires excitées et les bandes Swan
Spectre de la flamme bleue d’une torche au butane montrant l’émission de bandes radicalaires moléculaires excitées et les bandes Swan
Une réaction radicale familière est la combustion . La molécule d’oxygène est un diradical stable , mieux représenté par • O–O • . Parce que les spins des électrons sont parallèles, cette molécule est stable. Alors que l’ état fondamental de l’oxygène est ce diradical non réactif à spin non apparié ( triplet ), un état extrêmement réactif à spin apparié ( singulet ) est disponible. Pour que la combustion se produise, la Barrière énergétique entre ceux-ci doit être surmontée. Cette barrière peut être surmontée par la chaleur, nécessitant des températures élevées. La transition triplet-singulet est également ” interdite”. Cela présente une barrière supplémentaire à la réaction. Cela signifie également que l’oxygène moléculaire est relativement peu réactif à température ambiante, sauf en présence d’un atome lourd catalytique tel que le fer ou le cuivre.
La combustion consiste en diverses réactions radicalaires en chaîne que le radical singulet peut initier. L’ Inflammabilité d’un matériau donné dépend fortement de la concentration en radicaux qu’il faut obtenir avant que dominent les réactions d’initiation et de propagation conduisant à la combustion du matériau. Une fois le combustible consommé, les réactions de terminaison dominent à nouveau et la flamme s’éteint. Comme indiqué, la promotion de réactions de propagation ou de terminaison modifie l’Inflammabilité. Par exemple, parce que le plomb lui-même désactive les radicaux dans le mélange essence-air, le Plomb tétraéthyle était autrefois couramment ajouté à l’essence. Cela évite que la combustion ne s’amorce de façon incontrôlée ou dans les imbrûlés ( cliquetis du moteur) ou un allumage prématuré ( pré -allumage ).
Lorsqu’un hydrocarbure est brûlé, un grand nombre de radicaux oxygène différents sont impliqués. Initialement, des radicaux hydroperoxyles (HOO • ) se forment. Ceux-ci réagissent ensuite davantage pour donner des hydroperoxydes organiques qui se décomposent en radicaux hydroxyles (HO • ).
Polymérisation
De nombreuses réactions de polymérisation sont initiées par des radicaux. La polymérisation implique l’ajout d’un radical initial à un non radical (généralement un alcène) pour donner de nouveaux radicaux. Ce processus est à la base de la réaction radicalaire en chaîne . L’art de la polymérisation implique la méthode par laquelle le radical d’amorçage est introduit. Par exemple, le méthacrylate de méthyle (MMA) peut être polymérisé pour produire du Poly(méthacrylate de méthyle) (PMMA – Plexiglas ou Perspex) via une série répétitive d’ étapes d’ addition radicalaire :
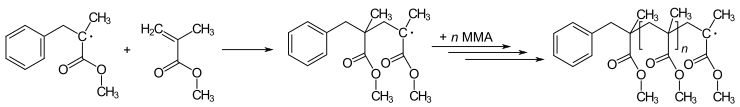
 Intermédiaires radicaux dans la formation du polyméthacrylate (plexiglas ou perspex).
Intermédiaires radicaux dans la formation du polyméthacrylate (plexiglas ou perspex).
Les nouvelles méthodes de polymérisation radicalaire sont connues sous le nom de polymérisation radicalaire vivante . Les variantes comprennent le transfert de chaîne par addition-fragmentation réversible ( RAFT ) et la polymérisation radicalaire par transfert d’atomes ( ATRP ).
Étant un radical répandu, O 2 réagit avec de nombreux composés organiques pour générer des radicaux avec le radical hydroperoxyde . Les huiles siccatives et les peintures alkydes durcissent en raison de la réticulation radicalaire initiée par l’oxygène de l’atmosphère.
Radicaux atmosphériques
Le radical le plus courant dans la basse atmosphère est le Dioxygène moléculaire. La photodissociation des molécules sources produit d’autres radicaux. Dans la basse atmosphère, des radicaux importants sont produits par la photodissociation du dioxyde d’azote en un atome d’oxygène et de l’oxyde nitrique (voir éq. 1.1 ci-dessous), qui joue un rôle clé dans la formation du smog – et la photodissociation de l’ozone pour donner l’atome d’oxygène excité O(1D) (voir éq. 1.2 ci-dessous). Les réactions nettes et de retour sont également présentées ( éq. 1.3 et éq. 1.4 , respectivement).
NON 2 → h v NON + O {displaystyle {ce {NO2 ->[h nu] NON + O}}} ![{displaystyle {ce {NO2 ->[h nu] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1) |
( éq. 1.1 ) |
O + O 2 ⟶ O 3 {displaystyle {ce {O + O2 -> O3}}}  |
( éq. 1.2 ) |
NO 2 + O 2 → h ν NO + O 3 {displaystyle {ce {NO2 + O2 ->[h nu] NON + O3}}} ![{displaystyle {ce {NO2 + O2 ->[h nu] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171) |
( éq. 1.3 ) |
NO + O 3 ⟶ NO 2 + O 2 {displaystyle {ce {NO + O3 -> NO2 + O2}}}  |
( éq. 1.4 ) |
Dans la haute atmosphère, la photodissociation des chlorofluorocarbures (CFC) normalement non réactifs par le Rayonnement ultraviolet solaire est une source importante de radicaux (voir éq. 1 ci-dessous). Ces réactions donnent le radical chlore , Cl • , qui catalyse la conversion de l’ozone en O 2 , facilitant ainsi l’appauvrissement de l’ozone ( éq. 2.2 – éq. 2.4 ci-dessous).
CFCS → h ν Cl ∙ {displaystyle {ce {CFCS->[hnu ]Cl^{bullet}}}} ![{displaystyle {ce {CFCS->[hnu ]Cl^{bullet }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bdfdc999e29261e922e3863cdfa3b4bf84fb5a2) |
( éq. 2.1 ) |
Cl ∙ + O 3 ⟶ ClO ∙ + O 2 {displaystyle {ce {Cl^{bullet }{}+O3->ClO^{bullet }{}+O2}}}  |
( éq. 2.2 ) |
O 3 → h ν O + O 2 {displaystyle {ce {O3 ->[h nu] O + O2}}} ![{displaystyle {ce {O3 ->[h nu] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1) |
( éq. 2.3 ) |
O + ClO ∙ ⟶ Cl ∙ + O 2 {displaystyle {ce {O{}+ClO^{bullet }->Cl^{bullet }{}+O2}}}  |
( éq. 2.4 ) |
2 O 3 → h ν 3 O 2 {displaystyle {ce {2O3 ->[h nu] 3O2}}} ![{displaystyle {ce {2O3 ->[h nu] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40) |
( éq. 2.5 ) |
De telles réactions provoquent l’appauvrissement de la couche d’ozone , d’autant plus que le radical chlore est libre de s’engager dans une autre chaîne réactionnelle ; par conséquent, l’utilisation de chlorofluorocarbures comme réfrigérants a été restreinte.
En biologie

 Structure du radical désoxyadénosyle , un intermédiaire de biosynthèse courant. [15]
Structure du radical désoxyadénosyle , un intermédiaire de biosynthèse courant. [15] 
 Structure approximative de la lignine, qui constitue environ 30 % de la matière végétale. Il est formé par des réactions radicalaires.
Structure approximative de la lignine, qui constitue environ 30 % de la matière végétale. Il est formé par des réactions radicalaires.
Les radicaux jouent un rôle important en biologie. Beaucoup d’entre eux sont nécessaires à la vie, comme la destruction intracellulaire des bactéries par les cellules phagocytaires telles que les granulocytes et les macrophages . Les radicaux sont impliqués dans les processus de signalisation cellulaire , [16] connus sous le nom de Signalisation redox . Par exemple, l’attaque radicale de l’acide linoléique produit une série d’ acides 13-hydroxyoctadécadiénoïques et d’acides 9-hydroxyoctadécadiénoïques , qui peuvent agir pour réguler les réponses inflammatoires et/ou cicatrisantes localisées des tissus, la perception de la douleur et la prolifération des cellules malignes. Les attaques radicales sur l’acide arachidonique et l’acide docosahexaénoïque produisent une gamme similaire mais plus large de produits de signalisation.[17]
Les radicaux peuvent également être impliqués dans la maladie de Parkinson , la surdité sénile et médicamenteuse , la schizophrénie et la maladie d’Alzheimer . [18] Le syndrome classique des radicaux libres, l’ hémochromatose de la maladie du stockage du fer , est généralement associé à une constellation de symptômes liés aux radicaux libres, notamment les troubles du mouvement, la psychose, les anomalies pigmentaires de la mélanine cutanée , la surdité, l’arthrite et le diabète sucré. La théorie des radicaux libres du vieillissement propose que les radicaux sous-tendent le processus de vieillissement lui-même. De même, le processus de mito hormesissuggère que l’exposition répétée aux radicaux peut prolonger la durée de vie.
Parce que les radicaux sont nécessaires à la vie, le corps dispose d’un certain nombre de mécanismes pour minimiser les dommages induits par les radicaux et pour réparer les dommages qui se produisent, tels que les enzymes superoxyde dismutase , catalase , glutathion peroxydase et glutathion réductase . De plus, les antioxydants jouent un rôle clé dans ces mécanismes de défense. Ce sont souvent les trois vitamines, la vitamine A , la vitamine C et la vitamine E et les polyphénols antioxydants . De plus, il existe de bonnes preuves indiquant que la bilirubine et l’acide uriquepeuvent agir comme antioxydants pour aider à neutraliser certains radicaux. La bilirubine provient de la dégradation du contenu des globules rouges , tandis que l’acide urique est un produit de dégradation des purines . Trop de bilirubine, cependant, peut entraîner une jaunisse , qui pourrait éventuellement endommager le système nerveux central, tandis qu’une trop grande quantité d’acide urique provoque la goutte . [19]
Les espèces réactives de l’oxygène
Les espèces réactives de l’oxygène ou ROS sont des espèces telles que le superoxyde , le peroxyde d’hydrogène et le radical hydroxyle , généralement associés à des dommages cellulaires. Les ROS se forment en tant que sous-produit naturel du métabolisme normal de l’ oxygène et jouent un rôle important dans la signalisation cellulaire. Deux radicaux centrés sur l’oxygène importants sont le superoxyde et le radical hydroxyle . Ils dérivent de l’oxygène moléculaire dans des conditions réductrices. Cependant, en raison de leur réactivité, ces mêmes radicaux peuvent participer à des réactions secondaires indésirables entraînant des dommages cellulaires. Des quantités excessives de ces radicaux peuvent entraîner des lésions cellulaires et la mort , ce qui peut contribuer à de nombreuses maladies telles quecancer , accident vasculaire cérébral , infarctus du myocarde , diabète et troubles majeurs. [20] On pense que de nombreuses formes de cancer sont le résultat de réactions entre les radicaux et l’ADN , entraînant potentiellement des mutations qui peuvent affecter négativement le cycle cellulaire et conduire potentiellement à une malignité. [21] Certains des symptômes du vieillissement tels que l’ athérosclérose sont également attribués à l’oxydation induite par les radicaux du cholestérol en 7-cétocholestérol. [22] De plus, les radicaux contribuent à l’atteinte hépatique induite par l’ alcooldommages, peut-être plus que l’alcool lui-même. Les radicaux produits par la fumée de cigarette sont impliqués dans l’inactivation de l’alpha 1-antitrypsine dans les poumons . Ce processus favorise le développement de l’ emphysème .
Il a été constaté que l’ oxybenzone forme des radicaux à la lumière du soleil et peut donc également être associée à des dommages cellulaires. Cela ne s’est produit que lorsqu’il a été combiné avec d’autres ingrédients couramment trouvés dans les écrans solaires, comme l’ oxyde de titane et le méthoxycinnamate d’octyle . [23]
Les ROS attaquent l’ acide gras polyinsaturé , l’acide linoléique , pour former une série de produits d’acide 13-hydroxyoctadécadiénoïque et d’acide 9-hydroxyoctadécadiénoïque qui servent de molécules de signalisation pouvant déclencher des réponses qui contrent la lésion tissulaire qui a causé leur formation. Les ROS attaquent d’autres acides gras polyinsaturés, par exemple l’acide arachidonique et l’acide docosahexaénoïque , pour produire une série similaire de produits de signalisation. [24]
Histoire et nomenclature

 Moses Gomberg (1866-1947), le fondateur de la chimie radicale
Moses Gomberg (1866-1947), le fondateur de la chimie radicale
Jusqu’à la fin du 20e siècle, le mot «radical» était utilisé en chimie pour désigner tout groupe d’atomes connectés, tel qu’un groupe méthyle ou un carboxyle , qu’il fasse partie d’une molécule plus grande ou d’une molécule seule. Le qualificatif “libre” était alors nécessaire pour spécifier le cas non lié. Suite aux récentes révisions de la nomenclature, une partie d’une molécule plus grande est désormais appelée groupe fonctionnel ou substituant , et “radical” implique désormais “libre”. Cependant, l’ancienne nomenclature peut encore apparaître dans certains livres.
Le terme radical était déjà utilisé lorsque la théorie radicale désormais obsolète a été développée. Louis-Bernard Guyton de Morveau a introduit l’expression «radical» en 1785 et l’expression a été employée par Antoine Lavoisier en 1789 dans son Traité Élémentaire de Chimie . Un radical a alors été identifié comme racine de base de certains acides (le mot latin « radix » signifiant « racine »). Historiquement, le terme radical dans la théorie des radicaux était également utilisé pour les parties liées de la molécule, en particulier lorsqu’elles restent inchangées dans les réactions. Ceux-ci sont maintenant appelés groupes fonctionnels . Par exemple, l’alcool méthyliquea été décrit comme consistant en un “radical” méthyle et un “radical” hydroxyle. Les radicaux ne le sont pas non plus au sens chimique moderne, car ils sont liés en permanence les uns aux autres et n’ont pas d’électrons réactifs non appariés; cependant, ils peuvent être observés sous forme de radicaux en spectrométrie de masse lorsqu’ils sont séparés par irradiation avec des électrons énergétiques.
Dans un contexte moderne, le premier radical organique (contenant du carbone) identifié était le radical Triphénylméthyle , (C 6 H 5 ) 3 C • . Cette espèce a été découverte par Moses Gomberg en 1900. En 1933 , Morris S. Kharasch et Frank Mayo ont proposé que les radicaux libres soient responsables de l’addition anti-Markovnikov de bromure d’ hydrogène au bromure d’ allyle . [25] [26]
Dans la plupart des domaines de la chimie, la définition historique des radicaux soutient que les molécules ont un spin électronique non nul. Cependant, dans des domaines tels que la spectroscopie , la réaction chimique et l’ astrochimie , la définition est légèrement différente. Gerhard Herzberg , qui a remporté le prix Nobel pour ses recherches sur la structure électronique et la géométrie des radicaux, a proposé une définition plus lâche des radicaux libres : “toute espèce transitoire (chimiquement instable) (atome, molécule ou ion)”. [27] Le point principal de sa suggestion est qu’il existe de nombreuses molécules chimiquement instables qui ont un spin nul, telles que C 2 , C 3 , CH 2etc. Cette définition est plus pratique pour les discussions sur les processus chimiques transitoires et l’astrochimie ; par conséquent, les chercheurs dans ces domaines préfèrent utiliser cette définition vague. [28]
Représentation dans les réactions chimiques
Dans les équations chimiques, les radicaux sont fréquemment désignés par un point placé immédiatement à droite du symbole atomique ou de la formule moléculaire comme suit :
C l 2 → U V 2 C l ∙ {displaystyle mathrm {Cl} _{2};xrightarrow {UV} ;2{mathrm {Cl} ^{bullet }}} 
Les mécanismes de réaction radicale utilisent des flèches à une tête pour représenter le mouvement des électrons uniques :


Le clivage homolytique de la liaison de rupture est dessiné avec une flèche en «hameçon» pour se distinguer du mouvement habituel de deux électrons représenté par une flèche bouclée standard. Le deuxième électron de la liaison de rupture se déplace également pour s’apparier avec l’électron radical attaquant; ceci n’est pas explicitement indiqué dans ce cas.
Les radicaux participent également à l’addition de radicaux et à la substitution de radicaux en tant qu’intermédiaires réactifs . Les réactions en chaîne impliquant des radicaux peuvent généralement être divisées en trois processus distincts. Ce sont l’initiation , la propagation et la terminaison .
- Les réactions d’ initiation sont celles qui se traduisent par une augmentation nette du nombre de radicaux. Ils peuvent impliquer la formation de radicaux à partir d’espèces stables comme dans la réaction 1 ci-dessus ou ils peuvent impliquer des réactions de radicaux avec des espèces stables pour former plus de radicaux.
- Les réactions de propagation sont les réactions impliquant des radicaux dans lesquelles le nombre total de radicaux reste le même.
- Les réactions de terminaison sont les réactions entraînant une diminution nette du nombre de radicaux. Généralement, deux radicaux se combinent pour former une espèce plus stable, par exemple : 2 Cl • → Cl 2
Voir également
- Paire d’électrons
- Système général harmonisé de classification et d’étiquetage des produits chimiques
- Réaction de Hofmann-Löffler
Recherche sur les radicaux libres
- Centre d’excellence ARC pour la chimie et la biotechnologie des radicaux libres
Références
- ^ IUPAC Gold Book radical (radical libre) PDF Archivé le 02/03/2017 à la Wayback Machine
- ^ Hayyan, M.; Hashim, MA; Anjkut, IM (2016). “Ion superoxyde: génération et implications chimiques” . Chim. Rév . 116 (5): 3029–85. doi : 10.1021/acs.chemrev.5b00407 . PMID 26875845 .
- ^ un bcd Clayden , Jonathan ; Greeves, Nick ; Warren, Stuart G. (2012). Chimie organique (2e éd.). Oxford : presse universitaire d’Oxford. ISBN 978-0-19-927029-3. OCLC 761379371 .
- ^ “Peroxydes de diacyle” . polymerdatabase.com . Récupéré le 08/12/2020 .
- ^ “IV. Réactions non en chaîne : formation radicale par transfert d’électrons” . Chimie LibreTexts . 2015-01-21 . Récupéré le 08/12/2020 .
- ^ “II. Abstraction d’atome” . Chimie LibreTexts . 2015-01-11 . Récupéré le 08/12/2020 .
- ^ “Ajouts Radicaux: Formation de Produit Anti-Markovnikov” . Chimie LibreTexts . 2013-10-02 . Récupéré le 08/12/2020 .
- ^ Su, Wei-Fang (2013), Su, Wei-Fang (éd.), “Polymérisation radicale de la chaîne”, Principes de conception et de synthèse des polymères , Notes de cours en chimie, Berlin, Heidelberg: Springer, vol. 82, pp. 137–183, doi : 10.1007/978-3-642-38730-2_7 , ISBN 978-3-642-38730-2
- ^ Griller, David; Ingold, Keith U. (1976). “Racaux centrés sur le carbone persistants”. Comptes de la recherche chimique . 9 : 13–19. doi : 10.1021/ar50097a003 .
- ^ un Forrester b , AR (1968). Chimie organique des radicaux libres stables . Londres : Academic Press. p. 1–6.
- ^ Oakley, Richard T. (1988). « Thiazènes cycliques et hétérocycliques » (PDF) . Progrès en chimie inorganique . Thiazènes cycliques et hétérocycliques (section). Progrès en chimie inorganique. Vol. 36. pp. 299–391. doi : 10.1002/9780470166376.ch4 . ISBN 978-0-470-16637-6. Archivé de l’original (PDF) le 2015-09-23 . Récupéré le 31/03/2011 .
- ^ Rawson, J; Bannister, A ; Lavande, I (1995). Avancées en chimie hétérocyclique . La chimie des anneaux dithiadiazolylium et dithiadiazolyle (section) =. Progrès de la chimie hétérocyclique. Vol. 62. pp. 137–247. doi : 10.1016/S0065-2725(08)60422-5 . ISBN 978-0-12-020762-6.
- ↑ Cependant, le paramagnétisme n’implique pas nécessairement un caractère radical.
- ^ Linde, C.; Åkermark, B.; Norrby, P.-O.; En ligneSvensson, M. (1999). “Le timing est critique: effet des changements de spin sur la diastéréosélectivité dans l’époxydation catalysée par le Mn (Salen)”. Journal de l’American Chemical Society . 121 (21): 5083–84. doi : 10.1021/ja9809915 .
- ^ Broderick, JB; Duffus, BR; Duschene, KS; Shepard, EM (2014). “Enzymes radicales de S-adénosylméthionine” . Examens chimiques . 114 (8): 4229–317. doi : 10.1021/cr4004709 . PMC 4002137 . PMID 24476342 . {{cite journal}}: CS1 maint: uses authors parameter (link)
- ^ Pacher P, Beckman JS, Liaudet L (2007). “L’oxyde nitrique et le peroxynitrite dans la santé et la maladie” . Physiol. Rév . 87 (1): 315–424. doi : 10.1152/physrev.00029.2006 . PMC 2248324 . PMID 17237348 .
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura ; Opère, Catherine A.; Barrette, Aaron ; Ohia, Sunny E. (2013). « Peroxydation lipidique : implications physiopathologiques et pharmacologiques dans l’œil » . Frontières en physiologie . 4 : 366. doi : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787 .
- ^ Floyd, RA (1999). “Les processus neuro-inflammatoires sont importants dans les maladies neurodégénératives : une hypothèse pour expliquer la formation accrue d’espèces réactives de l’oxygène et de l’azote en tant que facteurs majeurs impliqués dans le développement des maladies neurodégénératives”. Biologie et médecine des radicaux libres . 26 (9–10) : 1346–1355. doi : 10.1016/s0891-5849(98)00293-7 . PMID 10381209 .
- ^ Un aperçu du rôle des radicaux en biologie et de l’utilisation de la résonance de spin électronique dans leur détection peut être trouvé dans Rhodes CJ (2000). Toxicologie de l’environnement humain – le rôle critique des radicaux libres . Londres : Taylor et Francis. ISBN 978-0-7484-0916-7.
- ^ Rajamani Karthikeyan; Manivasagam T ; Anantharaman P ; Balasubramanian T; Somasundaram ST (2011). “Effet chimiopréventif des extraits de Padina boergesenii sur les dommages oxydatifs induits par le nitrilotriacétate ferrique (Fe-NTA) chez les rats Wistar”. J. Appl. Phycol . 23 (2): 257–263. doi : 10.1007/s10811-010-9564-0 . S2CID 27537163 .
- ^ Mukherjee, PK; Marcheselli, VL; Serhan, CN; Bazan, NG (2004). “Neuroprotecin D1: Un docosatriène dérivé de l’acide docosahexanoïque protège les cellules épithéliales pigmentaires rétiniennes humaines du stress oxydatif” . Actes de l’Académie nationale des sciences des États-Unis . 101 (22): 8491–96. Bibcode : 2004PNAS..101.8491M . doi : 10.1073/pnas.0402531101 . PMC 420421 . PMID 15152078 .
- ^ Lyon, MA; Brown, AJ (1999). “7-Kétocholestérol”. Int. J. Biochem. Cell Biol . 31 (3–4) : 369–75. doi : 10.1016/s1357-2725(98)00123-x . PMID 10224662 .
- ^ Serpone, N; Salinaro, A; Émeline, AV ; Horikoshi, S; Hidaka, H; En ligneZhao, JC (2002). “Un examen spectroscopique systématique in vitro des photostabilités d’un ensemble aléatoire de lotions solaires commerciales et de leurs agents actifs chimiques UVB / UVA”. Sciences photochimiques et photobiologiques . 1 (12): 970–81. doi : 10.1039/b206338g . PMID 12661594 .
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura ; Opère, Catherine A.; Barrette, Aaron ; Ohia, Sunny E. (2013). « Peroxydation lipidique : implications physiopathologiques et pharmacologiques dans l’œil » . Frontières en physiologie . 4 : 366. doi : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787 .
- ^ Kharasch, MS (1933). “L’effet peroxyde dans l’addition de réactifs aux composés insaturés. I. L’addition de bromure d’hydrogène au bromure d’allyle”. Journal de l’American Chemical Society . 55 (6): 2468–2496. doi : 10.1021/ja01333a041 .
- ^ Yan, M; Lo, JC ; Edwards, JT; Baran, PS (2016). « Radicaux : Intermédiaires réactifs avec potentiel translationnel » . J Am Chem Soc . 138 (39): 12692–12714. doi : 10.1021/jacs.6b08856 . PMC 5054485 . PMID 27631602 .
- ^ G. Herzberg (1971), “Les spectres et les structures des radicaux libres simples”, ISBN 0-486-65821-X .
- ^ 28e Symposium international sur les radicaux libres Archivé le 16/07/2007 à la Wayback Machine .
