Phenmétrazine
La phenmétrazine ( INN , USAN , BAN ) (nom de marque Preludin et bien d’autres) est un médicament stimulant synthétisé pour la première fois en 1952 et utilisé à l’origine comme Coupe-faim , mais retiré du marché dans les années 1980 en raison d’un abus généralisé . Il a été initialement remplacé par son analogue phendimétrazine (sous le nom de marque Prelu-2) qui fonctionne comme un promédicament de la phenmétrazine, mais maintenant il est rarement prescrit, en raison de problèmes d’abus et de dépendance . Chimiquement, la phenmétrazine est une amphétamine substituée avec un anneau morpholine .
Phenmétrazine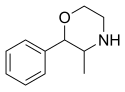 |
|
| Donnée clinique | |
|---|---|
| Voies d’ administration |
Oral, intraveineux , vaporisé , insufflé , suppositoire |
| Code ATC |
|
| Statut légal | |
| Statut légal |
|
| Données pharmacocinétiques | |
| Demi-vie d’ élimination | 8 heures |
| Excrétion | Rénal |
| Identifiants | |
Nom IUPAC
|
|
| Numero CAS |
|
| CID PubChem |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEMBL |
|
| Tableau de bord CompTox ( EPA ) |
|
| Carte d’information de l’ECHA | 100.004.677 |
| Données chimiques et physiques | |
| Formule | C 11 H 15 N O |
| Masse molaire | 177,2456 g · mol -1 |
| Modèle 3D ( JSmol ) |
|
SOURIRES
|
|
InChI
|
|
| |
Histoire
La phenmétrazine a été brevetée pour la première fois en Allemagne en 1952 par Boehringer-Ingelheim , [1] [2] avec quelques données pharmacologiques publiées en 1954. [3] C’était le résultat d’une recherche par Thomä et Wick pour un médicament anorexigène sans les effets secondaires. d’ amphétamine . [4] La phenmétrazine a été introduite en utilisation clinique en 1954 en Europe . [5]
Usage médical
En usage clinique, la phenmétrazine produit moins de nervosité , d’hyperexcitabilité, d’ euphorie et d’ insomnie que les médicaments de la famille des amphétamines. [6] Il a tendance à ne pas augmenter la fréquence cardiaque autant que les autres stimulants. En raison de l’absence relative d’ effets secondaires , une étude l’a trouvé bien toléré chez les enfants. [4] Dans une étude de l’efficacité sur la perte de poids entre la phenmétrazine et la dextroamphétamine , la phenmétrazine s’est avérée légèrement plus efficace. [7]
Pharmacologie
La phenmétrazine agit comme un agent libérant de la noradrénaline et de la dopamine avec des valeurs EC 50 de 50,4 ± 5,4 nM et 131 ± 11 nM, respectivement. [8] Il a une efficacité négligeable en tant que libérateur de sérotonine , avec une valeur EC 50 de seulement 7 765 ± 610 nM. [8]
Après une dose orale, environ 70 % du médicament est excrété par l’organisme dans les 24 heures. Environ 19 % de cette quantité est excrétée sous forme de médicament non métabolisé et le reste sous forme de divers métabolites . [9]
Dans des essais réalisés sur des rats, il a été constaté qu’après administration sous-cutanée de phenmétrazine, les deux isomères optiques sont également efficaces pour réduire la prise alimentaire, mais en administration orale , l’ isomère lévo est plus efficace. En termes de stimulation centrale cependant, l’isomère dextro est environ 4 fois plus efficace dans les deux modes d’administration. [dix]
Le sel qui a été utilisé pour les formulations à libération immédiate est le chlorhydrate de phenmétrazine (Preludin). Les formulations à libération prolongée étaient disponibles sous forme de sels liés à la résine plutôt que de sels solubles. Ces deux formes posologiques partagent une biodisponibilité similaire ainsi qu’un délai d’apparition du pic, cependant, les formulations à libération prolongée offrent une pharmacocinétique améliorée avec une libération régulière de l’ingrédient actif qui se traduit par une concentration maximale plus faible dans le plasma sanguin.
Synthèse


La phenmétrazine peut être synthétisée en trois étapes à partir de la 2-bromopropiophénone et de l’ éthanolamine . L’alcool intermédiaire 3-méthyl-2-phénylmorpholin-2-ol ( 1 ) est converti en sel fumarate ( 2 ) avec de l’acide fumarique , puis réduit avec du borohydrure de sodium pour donner la base libre de phenmétrazine ( 3 ). La base libre peut être transformée en sel fumarate ( 4 ) par réaction avec l’acide fumarique. [11]
Chimie
Sa structure incorpore l’épine dorsale de l’ amphétamine , le stimulant prototypique du SNC qui, comme la phenmétrazine, est un agent libérant de la dopamine et de la noradrénaline. La molécule ressemble également vaguement à l’ éthcathinone , le métabolite actif de l’ amfépramone anorexigène populaire (diéthylpropion). Contrairement à la phenmétrazine, l’éthcathinone (et donc l’amfépramone également) sont principalement sélectifs en tant qu’agents libérant de la noradrénaline.
Utilisation récréative
La phenmétrazine a été utilisée à des fins récréatives dans de nombreux pays, dont la Suède . Lorsque l’usage de stimulants est devenu répandu pour la première fois en Suède dans les années 1950, la phenmétrazine était préférée par les utilisateurs à l’ amphétamine et à la méthamphétamine . [12] Dans le roman autobiographique Rush de Kim Wozencraft , la phenmétrazine intraveineuse est décrite comme le plus euphorique et pro-sexuel des stimulants utilisés par l’auteur.
La phenmétrazine a été classée comme stupéfiant en Suède en 1959 et a été complètement retirée du marché en 1965. Au début, la demande illégale était satisfaite par la contrebande en provenance d’ Allemagne , puis d’ Espagne et d’ Italie . Au début, les comprimés de Preludin étaient passés en contrebande, mais bientôt les contrebandiers ont commencé à importer de la poudre de phenmétrazine brute. Finalement, l’amphétamine est devenue le principal stimulant de l’abus en raison de sa plus grande disponibilité.
La phenmétrazine a été prise par les Beatles au début de leur carrière. Paul McCartney était un utilisateur connu. L’introduction de McCartney à la drogue a commencé à Hambourg , en Allemagne . Les Beatles devaient jouer pendant des heures et ils recevaient souvent la drogue (appelée Prellies ) par la femme de chambre qui nettoyait leur logement, des clients allemands ou par Astrid Kirchherr (dont la mère les avait achetés). McCartney en prenait généralement un, mais John Lennon en prenait souvent quatre ou cinq. [13] Hunter Davies a affirmé, dans sa biographie de 1968 du groupe, [14]que leur utilisation de tels stimulants répondait alors à leur besoin de rester éveillé et de continuer à travailler, plutôt qu’à un simple désir de coups de pied.
Jack Ruby a déclaré qu’il était sous phenmétrazine au moment où il a tué Lee Harvey Oswald . [15]
Preludin a également été utilisé à des fins récréatives aux États-Unis tout au long des années 1960 et 1970. Il pourrait être broyé dans l’eau, chauffé et injecté. Le nom de rue de la drogue à Washington, DC était “Bam”. [16] La phenmétrazine continue d’être utilisée et abusée dans le monde entier, dans des pays comme la Corée du Sud . [17]
Voir également
- Phénylmorpholine substituée
- 3-Benzhydrylmorpholine
- Fenbutrazate
- Édivoxétine
- Phendimétrazine
- Morazon
- Réboxétine
- La consommation de drogue des Beatles à Hambourg
- 3-Fluorophénmétrazine
Références
- ^ GB 773780 , Boehringer A, Boehringer E, “Améliorations dans ou relatives à la préparation de morpholines substituées”
- ^ Brevet américain 2835669 , Thomä O, “Processus pour la production de morpholines substituées”, délivré le 20 mai 1958, attribué à CH Boehringer Sohn
- ^ Thomas O, Wick H (1954). “Über einige Tetrahydro-1,4-oxazine mit sympathicomimetischen Eigenschaften”. Cambre. Exp. Pathol. Pharmacol . 222 (6): 540. doi : 10.1007/BF00246905 . S2CID 25143525 .
- ^ un b Martel A (janvier 1957). “Preludin (phenmétrazine) dans le traitement de l’obésité” . Journal de l’Association médicale canadienne . 76 (2): 117-20. PMC 1823494 . PMID 13383418 .
- ^ Kalant JO (1966). Les amphétamines : toxicité et dépendance . ISBN 0-398-02511-8.
- ^ “Chlorhydrate de PHENMÉTRAZINE”. Journal de l’Association médicale américaine . 163 (5) : 357. Février 1957. PMID 13385162 .
- ^ Hampson J, Loraine JA, Strong JA (juin 1960). “Phenmétrazine et dexamphétamine dans la gestion de l’obésité”. Lancette . 1 (7137): 1265–7. doi : 10.1016/S0140-6736(60)92250-9 . PMID 14399386 .
- ^ un b Rothman RB, Baumann MH (2006). “Potentiel thérapeutique des substrats de transporteur de monoamine” . Sujets actuels en chimie médicinale . 6 (17): 1845–59. doi : 10.2174/156802606778249766 . PMID 17017961 . Archivé de l’original le 2017-03-26 . Récupéré le 05/05/2020 .
- ^ Moffat AC, Osselton MD, Analyse des drogues et des poisons de Widdop D. Clarke . ISBN 0-85369-473-7.
- ^ Engelhardt A (1961). “Etudes du mécanisme de l’action anti-appétit de la phenmétrazine”. Biochimie. Pharmacol . 8 (1): 100. doi : 10.1016/0006-2952(61)90520-2 .
- ^ Bruce E. Blough; Richard Rotman; Antonio Landavazo; Kevin M. Page; Anne Marie Decker. “WO2011146850A1 Phénylmorpholines et leurs analogues” . p. 51, 54–55.
- ^ Brecher EM. “L’expérience suédoise” . Récupéré le 31/10/2009 .
- ^ Miles B (1998). Paul McCartney : dans de nombreuses années . p. 66–67 . ISBN 0-8050-5248-8.
- ^ Davies H (1968). Les Beatles : la biographie autorisée . p. 78 . ISBN 0-07-015457-0.
- ^ Ruby J (1964). Témoignage de Jack Ruby . Vol. 5. Washington : Imprimerie du gouvernement américain. pp. 198–99.
- ^ Tiret L (1996). Rosa Lee . Harper Collins. p. 109.
- ^ Choi H, Baeck S, Jang M, Lee S, Choi H, Chung H (février 2012). “Analyse simultanée des phénylalkylamines psychotropes dans le liquide buccal par GC-MS avec SPE automatisé et son application aux affaires judiciaires”. Sciences médico-légales internationales . 215 (1–3) : 81–7. doi : 10.1016/j.forsciint.2011.02.011 . PMID 21377815 .
