Peroxyde d’hydrogène
Le peroxyde d’hydrogène est un composé chimique de formule H2O2. Dans sa forme pure, c’est un liquide bleu très pâle [ 5] , légèrement plus visqueux que l’eau . Il est utilisé comme Oxydant , agent de blanchiment et antiseptique , généralement sous forme de solution diluée (3 à 6 % en poids) dans de l’eau pour un usage domestique et à des concentrations plus élevées pour un usage industriel. Le peroxyde d’hydrogène concentré, ou “peroxyde à haute épreuve “, se décompose de manière explosive lorsqu’il est chauffé et a été utilisé comme propulseur dans les fusées . [6]
 Une bouteille contenant 100 ml d’eau oxygénée à 3% |
||
 modèle de bâton de balle de la molécule de peroxyde d’hydrogène |
||
|
||
| Des noms | ||
|---|---|---|
| Nom IUPAC Peroxyde d’hydrogène | ||
| Autres noms Dioxidane Oxidanyl Acide perhydroxique 0-hydroxyol Dioxyde de dihydrogène Eau oxygénée Peroxaan |
||
| Identifiants | ||
| Numero CAS |
|
|
| Modèle 3D ( JSmol ) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| Carte d’information de l’ECHA | 100.028.878 |
|
| Numéro CE |
|
|
| IUPHAR/BPS |
|
|
| KEGG |
|
|
| CID PubChem |
|
|
| Numéro RTECS |
|
|
| UNII |
|
|
| Numéro ONU | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) |
|
| Tableau de bord CompTox ( EPA ) |
|
|
InChI
|
||
SOURIRES
|
||
| Propriétés | ||
| Formule chimique | H2O2 _ _ _ | |
| Masse molaire | 34,0147 g/mole | |
| Apparence | Couleur bleu très clair; incolore en solution | |
| Odeur | légèrement pointu | |
| Densité | 1,11 g/cm 3 (20 °C, solution à 30 % (p/p)) [1] 1,450 g/cm 3 (20 °C, pur) |
|
| Point de fusion | −0,43 ° C (31,23 ° F; 272,72 K) | |
| Point d’ébullition | 150,2 ° C (302,4 ° F; 423,3 K) (se décompose) | |
| solubilité dans l’eau | Miscible | |
| Solubilité | soluble dans l’éther , alcool insoluble dans l’éther de pétrole |
|
| journal P | -0,43 [2] | |
| La pression de vapeur | 5 mmHg (30 °C) [3] | |
| Acidité (p K a ) | 11.75 | |
| Susceptibilité magnétique (χ) | −17,7·10 −6 cm 3 /mol | |
| Indice de réfraction ( n D ) | 1.4061 | |
| Viscosité | 1.245 cP ( 20 °C) | |
| Moment dipolaire | 2,26 D | |
| Thermochimie | ||
| Capacité calorifique ( C ) | 1,267 J/(g·K) (gaz) 2,619 J/(g·K) (liquide) |
|
| Enthalpie standard de formation (Δ f H ⦵ 298 ) |
−187,80 kJ/mol | |
| Pharmacologie | ||
| Code ATC | A01AB02 ( OMS ) D08AX01 ( OMS ), D11AX25 ( OMS ), S02AA06 ( OMS ) | |
| Dangers | ||
| Étiquetage SGH : | ||
| Pictogrammes |   |
|
| Mention d’avertissement | Danger | |
| Mentions de danger | H271 , H302 , H314 , H332 , H335 , H412 | |
| Conseils de prudence | P280 , P305+P351+P338 , P310 | |
| NFPA 704 (diamant de feu) |  3 0 3 BŒUF 3 0 3 BŒUF |
|
| point de rupture | Ininflammable | |
| Dose ou concentration létale (DL, CL) : | ||
| DL 50 ( dose médiane ) | 1518 mg/kg [ citation nécessaire ] 2000 mg/kg (oral, souris) [4] |
|
| CL 50 ( concentration médiane ) | 1418 ppm (rat, 4 h) [4] | |
| LC Lo ( plus bas publié ) | 227 ppm (souris) [4] | |
| NIOSH (limites d’exposition pour la santé aux États-Unis) : | ||
| PEL (Autorisé) | TWA 1 ppm (1,4 mg/m 3 ) [3] | |
| REL (recommandé) | TWA 1 ppm (1,4 mg/m 3 ) [3] | |
| DIVS (Danger immédiat) | 75 ppm [3] | |
| Fiche de données de sécurité (FDS) | ICSC 0164 (>60% soln.) | |
| Composés apparentés | ||
| Composés apparentés | Eau Ozone Hydrazine Sulfure d’hydrogène Difluorure de dioxygène |
|
| Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
Le peroxyde d’hydrogène est une espèce réactive de l’oxygène et le peroxyde le plus simple , un composé ayant une simple liaison oxygène-oxygène . Il se décompose lentement lorsqu’il est exposé à la lumière et rapidement en présence de composés organiques ou réactifs. Il est généralement stocké avec un stabilisateur dans une solution faiblement acide dans une bouteille sombre pour bloquer la lumière. Le peroxyde d’hydrogène se trouve dans les systèmes biologiques, y compris le corps humain. Les enzymes qui utilisent ou décomposent le peroxyde d’hydrogène sont classées comme Peroxydases .
Propriétés
Le point d’ébullition de H2O2a été extrapolée comme étant de 150,2 ° C (302,4 ° F), environ 50 ° C (90 ° F) de plus que l’eau. En pratique, le peroxyde d’hydrogène subira une décomposition thermique potentiellement explosive s’il est chauffé à cette température. Il peut être distillé en toute sécurité à des températures plus basses sous pression réduite. [7]
Structure

 Structure et dimensions de H 2 O 2 en phase gazeuse
Structure et dimensions de H 2 O 2 en phase gazeuse 
 Structure et dimensions de H 2 O 2 dans la phase solide (cristalline)
Structure et dimensions de H 2 O 2 dans la phase solide (cristalline)
Peroxyde d’hydrogène ( H2O2) est une molécule non planaire à symétrie C 2 (torsadée) ; cela a été démontré pour la première fois par Paul-Antoine Giguère en 1950 en utilisant la spectroscopie infrarouge . [8] [9] Bien que la liaison O−O soit une liaison simple , la molécule a une barrière rotationnelle relativement élevée de 386 cm −1 (4,62 kJ / mol ) pour la rotation entre énantiomères via la configuration trans , et 2460 cm −1 (29,4 kJ/mol) via la configuration cis . [10] Ces obstacles seraient dus àrépulsion entre les paires isolées des atomes d’oxygène adjacents et effets dipolaires entre les deux liaisons O – H. A titre de comparaison, la barrière rotationnelle pour l’éthane est de 1040 cm -1 (12,4 kJ/mol).
L’ angle dièdre d’ environ 100° entre les deux liaisons O–H rend la molécule chirale . C’est la molécule la plus petite et la plus simple à présenter une énantiomérie . Il a été proposé que les interactions énantiospécifiques de l’un plutôt que de l’autre puissent avoir conduit à l’amplification d’une forme énantiomère d’ acides ribonucléiques et donc à une origine d’ homochiralité dans un monde à ARN . [11]
Les structures moléculaires de H gazeux et cristallin 2O2sont sensiblement différents. Cette différence est attribuée aux effets de la liaison hydrogène , qui est absente à l’état gazeux. [12] Cristaux de H2O2sont tétragonaux avec le groupe d’espace D4
4P4 1 2 1 . _ [13]
Solutions aqueuses
Dans les solutions aqueuses , le peroxyde d’hydrogène diffère de la substance pure en raison des effets de la liaison hydrogène entre l’eau et les molécules de peroxyde d’hydrogène. Le peroxyde d’hydrogène et l’eau forment un mélange eutectique , présentant une dépression du point de congélation aussi bas que -56 ° C; l’eau pure a un point de congélation de 0 °C et le peroxyde d’hydrogène pur de -0,43 °C. Le point d’ébullition des mêmes mélanges est également abaissé par rapport à la moyenne des deux points d’ébullition (125,1 °C). Il se produit à 114 °C. Ce point d’ébullition est supérieur de 14 °C à celui de l’eau pure et inférieur de 36,2 °C à celui du peroxyde d’hydrogène pur. [14]

 Diagramme de phase de H2O2et de l’eau : la zone au-dessus de la ligne bleue est liquide. Les lignes pointillées séparent les phases solide-liquide des phases solide-solide.
Diagramme de phase de H2O2et de l’eau : la zone au-dessus de la ligne bleue est liquide. Les lignes pointillées séparent les phases solide-liquide des phases solide-solide. | H2O2 ( p / p ) _ | Densité (g/cm 3 ) |
Temp. (°C) |
|---|---|---|
| 3% | 1.0095 | 15 |
| 27% | 1.10 | 20 |
| 35% | 1.13 | 20 |
| 50% | 1.20 | 20 |
| 70% | 1.29 | 20 |
| 75% | 1.33 | 20 |
| 96% | 1.42 | 20 |
| 98% | 1.43 | 20 |
| 100% | 1,45 | 20 |
Comparaison avec des analogues
Le peroxyde d’hydrogène a plusieurs analogues structuraux avec des arrangements de liaison H m -X-X-H n (l’eau est également montrée à titre de comparaison). Il a le point d’ébullition (théorique) le plus élevé de cette série (X = O, N, S). Son point de fusion est également assez élevé, étant comparable à celui de l’ hydrazine et de l’eau, seule l’ hydroxylamine cristallisant beaucoup plus facilement, ce qui indique une liaison hydrogène particulièrement forte. Le diphosphane et le disulfure d’hydrogène ne présentent qu’une faible liaison hydrogène et ont peu de similitude chimique avec le peroxyde d’hydrogène. Structurellement, les analogues adoptent tous des structures asymétriques similaires, en raison de la répulsion entre les paires isolées adjacentes .
| Nom | Formule | Masse molaire (g/mol) |
Point de fusion (°C) |
Point d’ébullition (°C) |
|---|---|---|---|---|
| Peroxyde d’hydrogène | HOOH | 34.01 | −0,43 | 150,2* |
| Eau | HOH | 18.02 | 0,00 | 99,98 |
| disulfure d’hydrogène | CSSS | 66.15 | −89,6 | 70,7 |
| Hydrazine | H 2 NNH 2 | 32.05 | 2 | 114 |
| Hydroxylamine | NH2OH _ _ | 33.03 | 33 | 58* |
| Diphosphane | H 2 PPH 2 | 65,98 | −99 | 63,5* |
Découverte
Alexander von Humboldt a rapporté l’un des premiers peroxydes synthétiques, le peroxyde de baryum , en 1799 comme sous-produit de ses tentatives de décomposition de l’air. [ citation nécessaire ] Dix-neuf ans plus tard, Louis Jacques Thénard a reconnu que ce composé pouvait être utilisé pour la préparation d’un composé jusque-là inconnu, qu’il a décrit comme de l’eau oxygénée (“eau oxygénée”) – connue par la suite sous le nom de peroxyde d’hydrogène. [15] [16] [17]Aujourd’hui, le terme “eau oxygénée” peut apparaître sur les emballages de vente au détail en référence à des mélanges contenant soit de l’eau et du peroxyde d’hydrogène, soit de l’eau et de l’oxygène dissous. Cela pourrait entraîner des blessures si la différence n’est pas correctement comprise par l’utilisateur. [18]
Une version améliorée du procédé de Thénard utilisait de l’acide chlorhydrique , suivi de l’ajout d’ acide sulfurique pour précipiter le sous-produit de sulfate de baryum . Ce procédé a été utilisé de la fin du XIXe siècle jusqu’au milieu du XXe siècle. [19]
Thénard et Joseph Louis Gay-Lussac ont synthétisé le peroxyde de sodium en 1811. L’ effet blanchissant des peroxydes et de leurs sels sur les colorants naturels est devenu connu à cette époque, mais les premières tentatives de production industrielle de peroxydes ont échoué. La première usine produisant du peroxyde d’hydrogène a été construite en 1873 à Berlin . La découverte de la synthèse du peroxyde d’hydrogène par électrolyse avec de l’acide sulfurique a introduit la méthode électrochimique la plus efficace. Il a été commercialisé pour la première fois en 1908 à Weißenstein , Carinthie , Autriche. Le procédé à l’anthraquinone, qui est toujours utilisé, a été développé dans les années 1930 par le fabricant allemand de produits chimiques IG Farben à Ludwigshafen . La demande accrue et les améliorations des méthodes de synthèse ont entraîné l’augmentation de la production annuelle de peroxyde d’hydrogène de 35 000 tonnes en 1950, à plus de 100 000 tonnes en 1960, à 300 000 tonnes en 1970; en 1998, elle atteignait 2,7 millions de tonnes. [20]
Les premières tentatives n’ont pas réussi à produire du peroxyde d’hydrogène pur. Le peroxyde d’hydrogène anhydre a d’abord été obtenu par distillation sous vide . [21]
La détermination de la structure moléculaire du peroxyde d’hydrogène s’est avérée très difficile. En 1892, le physico-chimiste italien Giacomo Carrara (1864–1925) a déterminé sa masse moléculaire par dépression du point de congélation , ce qui a confirmé que sa formule moléculaire est H 2 O 2 . [22] Au moins une demi-douzaine de structures moléculaires hypothétiques semblaient être cohérentes avec les preuves disponibles. [23] En 1934, le physicien mathématicien anglais William Penney et le physicien écossais Gordon Sutherland ont proposé une structure moléculaire pour le peroxyde d’hydrogène qui était très similaire à celle actuellement acceptée. [24] [25]
Auparavant, le peroxyde d’hydrogène était préparé industriellement par hydrolyse du persulfate d’ammonium , lui-même obtenu par électrolyse d’une solution de bisulfate d’ammonium ( NH4ASS4) dans l’acide sulfurique : [26]
2 NH 4 HSO 4 → e l e c t r o l y s i s ( NH 4 ) 2 S 2 O 8 + H 2 {displaystyle {ce {2NH4HSO4 ->[{électrolyse}] (NH4)2S2O8 + H2}}} ![{displaystyle {ce {2NH4HSO4 ->[{electrolysis}] (NH4)2S2O8 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db83ccf805527a7d814cc0443fd02e172764a05b)
( NH 4 ) 2 S 2 O 8 + 2 H 2 O → h y d r o l y s i s 2 ( NH 4 ) HSO 4 + H 2 O 2 {displaystyle {ce {(NH4)2S2O8 + 2H2O ->[hydrolyse] 2(NH4)HSO4 + H2O2}}}
![{displaystyle {ce {(NH4)2S2O8 + 2H2O ->[hydrolysis] 2(NH4)HSO4 + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ce4047f30e3c22e3987663c1f4a6f4b12e125ee)
Production

 Cycle catalytique du procédé à l’ anthraquinone pour produire du peroxyde d’hydrogène
Cycle catalytique du procédé à l’ anthraquinone pour produire du peroxyde d’hydrogène
Aujourd’hui, le peroxyde d’hydrogène est fabriqué presque exclusivement par le procédé à l’anthraquinone , développé à l’origine par BASF en 1939. Il commence par la réduction d’une anthraquinone (telle que la 2-éthylanthraquinone ou le dérivé 2-amyle) en l’anthrahydroquinone correspondante, généralement par hydrogénation sur catalyseur au palladium . En présence d ‘ oxygène , l’ anthrahydroquinone subit alors une auto – oxydation : les atomes d’ hydrogène labiles des groupements hydroxytransfert vers la molécule d’oxygène, pour donner du peroxyde d’hydrogène et régénérer l’anthraquinone. La plupart des procédés commerciaux réalisent l’oxydation en faisant barboter de l’air comprimé à travers une solution d’anthrahydroquinone, le peroxyde d’hydrogène étant ensuite extrait de la solution et l’anthraquinone recyclée pour des cycles successifs d’hydrogénation et d’oxydation. [27] [28]
La réaction nette pour le processus catalysé par l’anthraquinone est : [27]
H2+ O2→ H2O2
L’économie du procédé dépend fortement du recyclage efficace des solvants d’extraction, du catalyseur d’hydrogénation et de la quinone coûteuse .

 Conteneur-citerne ISO pour le transport de peroxyde d’hydrogène
Conteneur-citerne ISO pour le transport de peroxyde d’hydrogène 
 Un wagon-citerne conçu pour le transport de peroxyde d’hydrogène par chemin de fer
Un wagon-citerne conçu pour le transport de peroxyde d’hydrogène par chemin de fer
Autres ressources
De petites quantités, mais détectables, de peroxyde d’hydrogène peuvent être formées par plusieurs méthodes. De petites quantités sont formées par électrolyse d’acide dilué autour de la cathode où l’hydrogène évolue si l’oxygène barbote autour d’elle. Il est également produit en exposant l’eau aux rayons ultraviolets d’une lampe à mercure ou à un arc électrique tout en la confinant dans un récipient transparent aux UV (par exemple du quartz). Il est détectable dans l’eau glacée après avoir brûlé un courant d’hydrogène gazeux dirigé vers lui et est également détectable sur de la glace flottante. Un refroidissement rapide de l’air humide soufflé à travers un éclateur à environ 2 000 °C produit des quantités détectables. [29]
Un procédé commercialement viable pour produire du peroxyde d’hydrogène directement à partir de l’environnement suscite l’intérêt depuis de nombreuses années. Une synthèse directe efficace est difficile à réaliser, car la réaction de l’hydrogène avec l’oxygène favorise thermodynamiquement la production d’eau. Des systèmes de synthèse directe ont été développés, dont la plupart utilisent des catalyseurs métalliques finement dispersés similaires à ceux utilisés pour l’hydrogénation de substrats organiques. [30] [31] Un obstacle économique a été que les processus directs donnent une solution diluée non économique pour le transport. Aucun de ceux-ci n’a encore atteint un point où ils peuvent être utilisés pour la synthèse à l’échelle industrielle.
Disponibilité
Le peroxyde d’hydrogène est le plus souvent disponible sous forme de solution dans l’eau. Pour les consommateurs, il est généralement disponible en pharmacie à 3 et 6 % en poidsconcentrations. Les concentrations sont parfois décrites en termes de volume d’oxygène gazeux généré ; un millilitre d’une solution à 20 volumes génère vingt millilitres d’oxygène gazeux lorsqu’il est complètement décomposé. Pour une utilisation en laboratoire, les solutions à 30 % en poids sont les plus courantes. Des qualités commerciales de 70% à 98% sont également disponibles, mais en raison du potentiel de solutions de plus de 68% de peroxyde d’hydrogène à convertir entièrement en vapeur et en oxygène (la température de la vapeur augmentant à mesure que la concentration dépasse 68%) ces grades sont potentiellement beaucoup plus dangereux et nécessitent des soins particuliers dans des zones de stockage dédiées. Les acheteurs doivent généralement autoriser l’inspection par les fabricants commerciaux.
En 1994, la production mondiale de H2O2était d’environ 1,9 million de tonnes et est passé à 2,2 millions en 2006, [32] dont la plupart étaient à une concentration de 70% ou moins. Cette année-là, en vrac 30 % H2O2vendu à environ 0,54 USD / kg , soit 1,50 USD/kg (0,68 USD/ lb ) sur une “base de 100 %” [ clarification nécessaire ] . [27]
Le peroxyde d’hydrogène est présent dans les eaux de surface, les eaux souterraines et dans l’ atmosphère . Il se forme lors de l’illumination ou de l’ action catalytique naturelle des substances contenues dans l’eau. L’eau de mer contient 0,5 à 14 μg/L de peroxyde d’hydrogène, l’eau douce 1 à 30 μg/L et l’air 0,1 à 1 partie par milliard. [20]
Réactions
Décomposition
Le peroxyde d’hydrogène se décompose pour former de l’eau et de l’oxygène avec un Δ H o de –2884,5 kJ / kg [33] et un Δ S de 70,5 J/(mol·K) :
2H _2O2→ 2H2O + O2
La vitesse de décomposition augmente avec l’augmentation de la température, de la concentration et du pH ( H2O2étant instable dans des conditions alcalines), les solutions froides, diluées et acides présentant la meilleure stabilité. La décomposition est catalysée par divers ions ou composés redox actifs, y compris la plupart des métaux de transition et leurs composés (par exemple, le dioxyde de manganèse (MnO 2 ), l’argent et le platine ). [34] Certains ions métalliques, tels que Fe2+
ou Ti3+
, peut amener la décomposition à prendre un chemin différent, avec formation de radicaux libres tels que le radical hydroxyle (HO • ) et hydroperoxyle (HOO • ). Les catalyseurs non métalliques comprennent l’iodure de potassium (KI), qui réagit particulièrement rapidement et constitue la base de la démonstration du dentifrice pour éléphant . Le peroxyde d’hydrogène peut également être décomposé biologiquement par l’ enzyme catalase . La décomposition du peroxyde d’hydrogène libère de l’oxygène et de la chaleur ; cela peut être dangereux, car le déversement de peroxyde d’hydrogène à haute concentration sur une substance inflammable peut provoquer un incendie immédiat.
Réactions redox
Les propriétés redox du peroxyde d’hydrogène dépendent du pH car les conditions acides exacerbent le pouvoir des agents oxydants et les conditions basiques exacerbent le pouvoir des agents réducteurs . Le peroxyde d’hydrogène présentant des propriétés redox ambivalentes, étant à la fois Oxydant ou réducteur, son comportement redox dépend immédiatement du pH.
Dans les solutions acides, H2O2est un Oxydant puissant , plus puissant que le chlore , le dioxyde de chlore et le permanganate de potassium . Lorsqu’elle est utilisée pour nettoyer la verrerie de laboratoire, une solution de peroxyde d’hydrogène et d’acide sulfurique est appelée solution Piranha .
H2O2est une source de radicaux hydroxyles ( • OH), qui sont très réactifs. H2O2est utilisé dans les réactions oscillantes de Briggs–Rauscher [35] [36] et Bray–Liebhafsky [37] [38] .
| Réactif Oxydant |
Produit réduit | Potentiel d’ oxydation (V) |
|---|---|---|
| F 2 | HF | 3.0 |
| O 3 | O 2 | 2.1 |
| H2O2 _ _ _ | H 2 O | 1.8 |
| KMnO 4 | MnO2 _ | 1.7 |
| ClO2 _ | HClO | 1.5 |
| Classe 2 | Cl− _ | 1.4 |
Dans les solutions acides , Fe2+
est oxydé en Fe3+
(peroxyde d’hydrogène jouant le rôle d’agent Oxydant) :
2 Fe2+
(aq) + H2O2+ 2H+
(aq) → 2Fe3+
(aq) + 2 H2O (l)
et sulfite ( SO2−
3) est oxydé en sulfate ( SO2−
4). Cependant, le permanganate de potassium est réduit en Mn2+
par H acide2O2. Dans des conditions alcalines , cependant, certaines de ces réactions s’inversent; par exemple, Mn2+
est oxydé en Mn4+
(comme MnO2).
Dans les solutions basiques, le peroxyde d’hydrogène est un puissant réducteur et peut réduire une variété d’ions inorganiques. Quand H2O2agit comme agent réducteur, de l’oxygène gazeux est également produit. Par exemple, le peroxyde d’hydrogène réduira l’hypochlorite de sodium et le permanganate de potassium , qui est une méthode pratique pour préparer l’oxygène en laboratoire :
NaOCl + H2O2→ O2+ NaCl + H2O 2 KMnO4+ 3H2O2→ 2MnO2+ 2 KOH + 2 H2O + 3 O2
Réactions organiques
Le peroxyde d’hydrogène est fréquemment utilisé comme agent Oxydant . L’oxydation des thioéthers en sulfoxydes est illustrative : [39] [40]
Ph −S−CH3+ H2O2→ Ph −S(O)−CH3+ H2O
Le peroxyde d’hydrogène alcalin est utilisé pour l’ époxydation des alcènes déficients en électrons tels que les dérivés de l’acide acrylique , [41] et pour l’oxydation des alkylboranes en alcools , la deuxième étape de l’ hydroboration-oxydation . C’est aussi le principal réactif du procédé d’oxydation Dakin .
Précurseur d’autres composés de peroxyde
Le peroxyde d’hydrogène est un acide faible, formant des sels d’ hydroperoxyde ou de peroxyde avec de nombreux métaux.
Il convertit également les oxydes métalliques en peroxydes correspondants. Par exemple, lors d’un traitement au peroxyde d’hydrogène, l’acide chromique ( CrO3et H2ALORS4) forme un peroxyde bleu CrO( O2)2.
Ce type de réaction est utilisé industriellement pour produire des peroxoanions. Par exemple, la réaction avec le borax conduit au perborate de sodium , un agent de blanchiment utilisé dans les détergents à lessive :
N / A2B4O7+ 4H2O2+ 2 NaOH → 2 Na2B2O4(OH)4+ H2O
H2O2transforme les acides carboxyliques (RCO 2 H) en peroxyacides (RC(O)O 2 H), eux-mêmes utilisés comme oxydants. Le peroxyde d’hydrogène réagit avec l’acétone pour former du peroxyde d’acétone et avec l’ozone pour former du trioxidane . Le peroxyde d’hydrogène forme des adduits stables avec l’urée ( peroxyde d’hydrogène – urée ), le carbonate de sodium (percarbonate de sodium ) et d’autres composés. [42] Un adduit acide-base avec de l’oxyde de triphénylphosphine est un “support” utile pour H2O2dans certaines réactions.
Le peroxyde d’hydrogène est à la fois un agent Oxydant et un agent réducteur. L’oxydation du peroxyde d’hydrogène par l’ hypochlorite de sodium donne de l’oxygène singulet . La réaction nette d’un ion ferrique avec le peroxyde d’hydrogène est un ion ferreux et de l’oxygène. Cela se produit via une oxydation à un seul électron et des radicaux hydroxyle. Ceci est utilisé dans certaines oxydations de chimie organique, par exemple dans le réactif de Fenton . Seules des quantités catalytiques d’ions fer sont nécessaires car le peroxyde oxyde également les ions ferreux en ions ferriques. La réaction nette du peroxyde d’hydrogène et du permanganate ou du dioxyde de manganèse est l’ion manganeux; cependant, jusqu’à ce que le peroxyde soit épuisé, certains ions manganèse sont réoxydés pour rendre la réaction catalytique. Cela constitue la base du monergol communfusées.
Fonction biologique

 ascaridole
ascaridole
Le peroxyde d’hydrogène se forme chez les humains et d’autres animaux en tant que produit à vie courte dans les processus biochimiques et est toxique pour les cellules . La toxicité est due à l’oxydation des protéines , des lipides membranaires et de l’ADN par les ions peroxydes. [43] La classe d’ enzymes biologiques appelée superoxyde dismutase (SOD) est développée dans presque toutes les cellules vivantes en tant qu’agent antioxydant important. Ils favorisent la disproportionation du superoxyde en oxygène et peroxyde d’hydrogène, qui est ensuite rapidement décomposé par l’enzyme catalaseà l’oxygène et à l’eau. [44]
2 O−
2+ 2H+
→ O2+ H2O2 2H2O2 → O2 + 2H2O _ _ _ _
Les peroxysomes sont des organites présents dans pratiquement toutes les cellules eucaryotes . [45] Ils sont impliqués dans le catabolisme des acides gras à très longue chaîne, des acides gras à chaîne ramifiée , des acides aminés D , des polyamines et de la biosynthèse des plasmalogènes , des éther phospholipides essentiels au fonctionnement normal du cerveau et des poumons des mammifères. [46] Lors de l’oxydation, ils produisent du peroxyde d’hydrogène dans le processus suivant catalysé par la flavine adénine dinucléotide (FAD): [47]
R − CH 2 − CH 2 − CO − SCoA + O 2 → FAD R − CH = CH − CO − SCoA + H 2 O 2 {displaystyle {ce {R-CH2-CH2-CO-SCoA + O2 ->[{ce {FAD}}] R-CH=CH-CO-SCoA + H2O2}}} ![{displaystyle {ce {R-CH2-CH2-CO-SCoA + O2 ->[{ce {FAD}}] R-CH=CH-CO-SCoA + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c81784a048a5c7ac9b29e369eaef884fdf03642f)
La catalase , une autre enzyme peroxysomale, utilise ce H 2 O 2 pour oxyder d’autres substrats, dont les phénols , l’acide formique , le formaldéhyde et l’alcool , au moyen d’une réaction de peroxydation :
H 2 O 2 + R ′ H 2 ⟶ R ′ + 2 H 2 O {displaystyle {ce {H2O2 + R’H2 -> R’ + 2H2O}}} 
éliminant ainsi le peroxyde d’hydrogène toxique dans le processus.
Cette réaction est importante dans les cellules hépatiques et rénales, où les peroxysomes neutralisent diverses substances toxiques qui pénètrent dans le sang. Une partie de l’ éthanol que les humains boivent est ainsi oxydée en acétaldéhyde . [48] De plus, lorsque l’excès de H 2 O 2 s’accumule dans la cellule, la catalase le convertit en H 2 O par cette réaction :
H 2 O 2 → CAT 1 2 O 2 + H 2 O {displaystyle {ce {H2O2 ->[{ce {CAT}}] {1/2O2}+ H2O}}} ![{displaystyle {ce {H2O2 ->[{ce {CAT}}] {1/2O2}+ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df4f002a0680eb6c0668474a565b44dd6b1f7ff9)
Une autre origine du peroxyde d’hydrogène est la dégradation de l’ adénosine monophosphate qui donne l’hypoxanthine . L’hypoxanthine est ensuite catabolisée par oxydation d’abord en xanthine puis en acide urique , et la réaction est catalysée par l’enzyme xanthine oxydase : [49]
Hypoxanthine
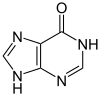

Xanthine oxydase
H2O , O2 _ _ H2O2 _ _ _ 

Xanthine


Xanthine oxydase
H2O , O2 _ _ H2O2 _ _ _ 

Acide urique
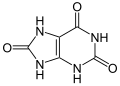
 Dégradation de l’hypoxanthine par la xanthine en acide urique pour former du peroxyde d’hydrogène.
Dégradation de l’hypoxanthine par la xanthine en acide urique pour former du peroxyde d’hydrogène. 
 Scarabée bombardier australien
Scarabée bombardier australien
La dégradation du monophosphate de guanosine donne comme produit intermédiaire la xanthine qui est ensuite transformée de la même manière en acide urique avec formation de peroxyde d’hydrogène. [49]
Les œufs d’oursin , peu après la fécondation par un spermatozoïde, produisent du peroxyde d’hydrogène. Il est alors rapidement dissocié en radicaux OH· . Les radicaux servent d’initiateur de polymérisation radicalaire , qui entoure les œufs d’une couche protectrice de polymère . [50]
Le scarabée bombardier possède un appareil qui lui permet de projeter des bulles corrosives et nauséabondes sur ses ennemis. Le coléoptère produit et stocke de l’ hydroquinone et du peroxyde d’hydrogène, dans deux réservoirs séparés à l’extrémité arrière de son abdomen. Lorsqu’il est menacé, le coléoptère contracte des muscles qui forcent les deux réactifs à travers des tubes à valve dans une chambre de mélange contenant de l’eau et un mélange d’enzymes catalytiques. Lorsqu’ils sont combinés, les réactifs subissent une violente réaction chimique exothermique , élevant la température à près du point d’ébullition de l’eau . Le liquide bouillant et nauséabond se transforme partiellement en gaz ( évaporation flash) et est expulsé par une soupape de sortie avec un fort claquement. [51] [52] [53]
Le peroxyde d’hydrogène est une molécule de signalisation de la défense des plantes contre les agents pathogènes . [54]
Le peroxyde d’hydrogène joue un rôle de molécule de signalisation dans la régulation d’une grande variété de processus biologiques. [55] Le composé est un facteur majeur impliqué dans la théorie des radicaux libres du vieillissement , basée sur la facilité avec laquelle le peroxyde d’hydrogène peut se décomposer en un radical hydroxyle et sur la façon dont les sous-produits du radical superoxyde du métabolisme cellulaire peuvent réagir avec l’eau ambiante pour former du peroxyde d’hydrogène. [56] Ces radicaux hydroxyles à leur tour réagissent facilement avec et endommagent les composants cellulaires vitaux, en particulier ceux des mitochondries . [57] [58] [59]Au moins une étude a également tenté de lier la production de peroxyde d’hydrogène au cancer. [60] Ces études ont souvent été citées dans des demandes de traitement frauduleuses. [ citation nécessaire ]
La quantité de peroxyde d’hydrogène dans les systèmes biologiques peut être dosée à l’aide d’un dosage fluorimétrique . [61]
Les usages
Blanchiment
Environ 60 % de la production mondiale de peroxyde d’hydrogène est utilisée pour le blanchiment de la pâte à papier et du papier . [32] La deuxième application industrielle majeure est la fabrication de percarbonate de sodium et de perborate de sodium , qui sont utilisés comme agents de blanchiment doux dans les détergents à lessive . Le percarbonate de sodium, qui est un produit d’addition de carbonate de sodium et de peroxyde d’hydrogène, est l’ingrédient actif de produits de lessive tels que les détergents à lessive OxiClean et Tide . Lorsqu’il est dissous dans l’eau, il libère du peroxyde d’hydrogène et du carbonate de sodium, [19]En eux-mêmes, ces agents de blanchiment ne sont efficaces qu’à des températures de lavage de 60 ° C (140 ° F) ou plus et sont donc souvent utilisés en conjonction avec des activateurs de blanchiment , qui facilitent le nettoyage à des températures plus basses. Il a également été utilisé comme agent de blanchiment de la farine et agent de blanchiment des dents .
Production de composés organiques
Il est utilisé dans la production de divers peroxydes organiques, le peroxyde de dibenzoyle étant un exemple à volume élevé. Les peroxyacides , tels que l’acide peracétique et l’acide méta-chloroperoxybenzoïque sont également produits à l’aide de peroxyde d’hydrogène. Le peroxyde d’hydrogène a été utilisé pour créer des explosifs à base de peroxyde organique , tels que le peroxyde d’acétone . Il est utilisé comme initiateur dans les polymérisations .
Traitement des eaux usées
Le peroxyde d’hydrogène est utilisé dans certains procédés de traitement des eaux usées pour éliminer les impuretés organiques. Dans le traitement d’oxydation avancé , la réaction de Fenton [62] [63] donne le radical hydroxyle hautement réactif (·OH). Cela dégrade les composés organiques, y compris ceux qui sont habituellement robustes, tels que les composés aromatiques ou halogénés . [64] Il peut également oxyder les composés soufrés présents dans les déchets ; ce qui est bénéfique car il réduit généralement leur odeur. [65]
Désinfectant
Le peroxyde d’hydrogène peut être utilisé pour la stérilisation de diverses surfaces, [66] y compris les outils chirurgicaux, [67] et peut être déployé sous forme de vapeur ( VHP ) pour la stérilisation de la pièce. [68] H 2 O 2 démontre une efficacité à large spectre contre les virus, les bactéries, les levures et les spores bactériennes. [69] [70] En général, une plus grande activité est observée contre les bactéries Gram-positives que les bactéries Gram-négatives ; cependant, la présence de catalase ou d’autres Peroxydases dans ces organismes peut augmenter la tolérance en présence de concentrations plus faibles. [71]Des niveaux de concentration inférieurs (3%) fonctionneront contre la plupart des spores; des concentrations plus élevées (7 à 30 %) et des temps de contact plus longs amélioreront l’activité sporicide. [70] [72]
Le peroxyde d’hydrogène est considéré comme une alternative écologique aux agents de blanchiment à base de chlore , car il se dégrade pour former de l’oxygène et de l’eau et il est généralement reconnu comme sûr en tant qu’agent antimicrobien par la Food and Drug Administration (FDA) des États-Unis. [73]
Propergol

 Système de propulsion au peroxyde d’hydrogène à ceinture de fusée utilisé dans un jet pack
Système de propulsion au peroxyde d’hydrogène à ceinture de fusée utilisé dans un jet pack
H à haute concentration2O2est appelé “peroxyde à haut test” (HTP). Il peut être utilisé soit comme monergol (non mélangé avec du carburant), soit comme composant Oxydant d’une fusée biergol . L’utilisation comme monergol tire parti de la décomposition du peroxyde d’hydrogène à une concentration de 70 à 98% en vapeur et en oxygène. Le propulseur est pompé dans une chambre de réaction, où un catalyseur, généralement un écran d’argent ou de platine, déclenche la décomposition, produisant de la vapeur à plus de 600 ° C (1100 ° F), qui est expulsée à travers une buse , générant une poussée . H2O2le monergol produit une impulsion spécifique maximale ( Isp ) de 161 s (1,6 kN·s /kg). Le peroxyde a été le premier monergol majeur adopté pour être utilisé dans les applications de fusée. L’hydrazine a finalement remplacé les applications de propulseur monopropulseur au peroxyde d’hydrogène principalement en raison d’une augmentation de 25% de l’impulsion spécifique au vide. [74] L’hydrazine (toxique) et le peroxyde d’hydrogène (moins toxique [ACGIH TLV 0,01 et 1 ppm respectivement]) sont les deux seuls monergols (autres que les gaz froids) à avoir été largement adoptés et utilisés pour les applications de propulsion et de puissance. [ citation nécessaire ] La Bell Rocket Belt ,les systèmes de contrôle de réaction pour X-1 , X-15 , Centaur , Mercury , Little Joe , ainsi que les générateurs de gaz à turbo-pompe pour X-1, X-15, Jupiter, Redstone et Viking utilisaient du peroxyde d’hydrogène comme monergol. [75]
En tant que bipropulseur, H2O2est décomposé pour brûler un combustible comme Oxydant. Des impulsions spécifiques aussi élevées que 350 s (3,5 kN·s/kg) peuvent être atteintes, selon le combustible. Le peroxyde utilisé comme Oxydant donne un I sp un peu inférieur à celui de l’oxygène liquide, mais il est dense, stockable, non cryogénique et peut être plus facilement utilisé pour entraîner des turbines à gaz pour donner des pressions élevées en utilisant un cycle fermé efficace . Il peut également être utilisé pour le refroidissement régénératif des moteurs de fusée. Le peroxyde a été utilisé avec beaucoup de succès comme Oxydant dans les moteurs de fusée allemands de la Seconde Guerre mondiale (par exemple , T-Stoff , contenant un stabilisateur d’oxyquinoline, à la fois pour le système de propulseur à monopropulseur externe Walter HWK 109-500 Starthilfe RATO et pour le Walter HWK 109-509série de moteurs-fusées utilisés pour le Me 163 B), le plus souvent utilisé avec C-Stoff dans une combinaison hypergolique à allumage automatique , et pour les lanceurs britanniques Black Knight et Black Arrow à faible coût . Actuellement, le HTP est utilisé sur les fusées suborbitales ILR-33 AMBER [76] et Nucleus [77] .
Dans les années 1940 et 1950, la turbine conçue par Hellmuth Walter KG utilisait du peroxyde d’hydrogène pour une utilisation dans les sous- marins lorsqu’ils étaient immergés; il s’est avéré trop bruyant et nécessitait trop d’entretien par rapport aux systèmes d’alimentation diesel-électriques . Certaines torpilles utilisaient du peroxyde d’hydrogène comme Oxydant ou propulseur. L’erreur de l’opérateur dans l’utilisation de torpilles au peroxyde d’hydrogène a été citée comme cause possible du naufrage du HMS Sidon et du sous-marin russe Koursk . [78] SAAB Underwater Systems fabrique le Torpedo 2000. Cette torpille, utilisée par la marine suédoise, est propulsé par un moteur à pistons propulsé par du HTP comme comburant et du kérosène comme carburant dans un système biergol. [79] [80]
Usage domestique

 Lentilles de contact trempées dans une solution à base de peroxyde d’hydrogène à 3 %. Le boîtier comprend un disque catalytique qui neutralise le peroxyde d’hydrogène dans le temps.
Lentilles de contact trempées dans une solution à base de peroxyde d’hydrogène à 3 %. Le boîtier comprend un disque catalytique qui neutralise le peroxyde d’hydrogène dans le temps.
Le peroxyde d’hydrogène a diverses utilisations domestiques, principalement comme agent de nettoyage et de désinfection.
Décoloration des cheveux
H dilué2O2(entre 1,9% et 12%) mélangé avec de l’ammoniaque a été utilisé pour décolorer les cheveux humains . La propriété de blanchiment du produit chimique donne son nom à l’expression ” blonde peroxyde “. [81] Le peroxyde d’hydrogène est également utilisé pour le blanchiment des dents . On le trouve dans la plupart des dentifrices blanchissants. Le peroxyde d’hydrogène a montré des résultats positifs concernant la luminosité des dents et les paramètres de teinte chroma. [82] Cela fonctionne en Oxydant des pigments colorés sur l’ émail où la teinte de la dent peut devenir plus claire. [ plus d’explications nécessaires ] Le peroxyde d’hydrogène peut être mélangé avec du bicarbonate de soude et du sel pour faire un dentifrice maison. [83]
Enlèvement des taches de sang
Le peroxyde d’hydrogène réagit avec le sang comme agent de blanchiment, et donc si une tache de sang est fraîche ou pas trop ancienne, une application généreuse de peroxyde d’hydrogène, si nécessaire en plus d’une seule application, blanchira complètement la tache. Après environ deux minutes d’application, le sang doit être fermement épongé. [84] [85]
Traitement de l’acnée
Le peroxyde d’hydrogène peut être utilisé pour traiter l’acné , [86] bien que le peroxyde de benzoyle soit un traitement plus courant.
Utilisations de niche


Le peroxyde d’hydrogène réagit avec certains diesters , tels que l’ ester d’oxalate de phényle (cyalume), pour produire une chimiluminescence ; cette application se rencontre le plus souvent sous la forme de bâtons lumineux .
Horticulture
Certains horticulteurs et utilisateurs de culture hydroponique préconisent l’utilisation d’une solution de peroxyde d’hydrogène faible dans les solutions d’arrosage. Sa décomposition spontanée libère de l’oxygène qui améliore le développement des racines d’une plante et aide à traiter la pourriture des racines (mort cellulaire des racines due au manque d’oxygène) et une variété d’autres ravageurs. [87] [88]
Pour les concentrations d’arrosage générales, environ 0,1 % est utilisé et cela peut être augmenté jusqu’à 1 % pour les actions antifongiques. [89] Les tests montrent que le feuillage des plantes peut tolérer en toute sécurité des concentrations allant jusqu’à 3 %. [90]
Poissonnerie
Le peroxyde d’hydrogène est utilisé en aquaculture pour contrôler la mortalité causée par divers microbes. En 2019, la FDA des États-Unis l’a approuvé pour le contrôle de la saprolégniose chez tous les poissons d’eau froide et tous les alevins et adultes d’eau froide et d’eau chaude, pour le contrôle de la maladie columnaris externe chez les poissons d’eau chaude et pour le contrôle de Gyrodactylus spp. chez les salmonidés élevés en eau douce. [91] Des tests en laboratoire menés par des pisciculteurs ont démontré que le peroxyde d’hydrogène domestique courant peut être utilisé en toute sécurité pour fournir de l’oxygène aux petits poissons. Le peroxyde d’hydrogène libère de l’oxygène par décomposition lorsqu’il est exposé à des catalyseurs tels que le dioxyde de manganèse .
Sécurité
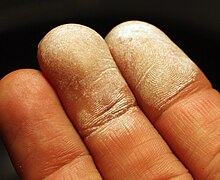
 Peau peu après exposition à 35% H2O2
Peau peu après exposition à 35% H2O2
Les réglementations varient, mais de faibles concentrations, telles que 5 %, sont largement disponibles et légales à l’achat pour un usage médical. La plupart des solutions de peroxyde en vente libre ne conviennent pas à l’ingestion. Des concentrations plus élevées peuvent être considérées comme dangereuses et sont généralement accompagnées d’une fiche de données de sécurité (FDS). À des concentrations élevées, le peroxyde d’hydrogène est un Oxydant agressif et corrodera de nombreux matériaux, y compris la peau humaine. En présence d’ un agent réducteur , de fortes concentrations de H2O2réagira violemment. [92]
Les flux de peroxyde d’hydrogène à haute concentration, généralement supérieurs à 40 %, doivent être considérés comme dangereux car le peroxyde d’hydrogène concentré répond à la définition d’un Oxydant DOT selon la réglementation américaine, s’il est rejeté dans l’environnement. La quantité à déclarer (RQ) de l’ EPA pour les déchets dangereux D001 est de 100 livres (45 kg), soit environ 10 gallons US (38 L), de peroxyde d’hydrogène concentré.
Le peroxyde d’hydrogène doit être stocké dans un endroit frais, sec et bien ventilé et à l’écart de toute substance inflammable ou combustible. Il doit être stocké dans un récipient composé de matériaux non réactifs tels que l’acier inoxydable ou le verre (d’autres matériaux dont certains plastiques et alliages d’aluminium peuvent également convenir). [93] Parce qu’il se décompose rapidement lorsqu’il est exposé à la lumière, il doit être stocké dans un récipient opaque, et les formulations pharmaceutiques se présentent généralement dans des bouteilles brunes qui bloquent la lumière. [94]
Le peroxyde d’hydrogène, qu’il soit sous forme pure ou diluée, peut présenter plusieurs risques, le principal étant qu’il forme des mélanges explosifs au contact de composés organiques. [95] La distillation du peroxyde d’hydrogène à des pressions normales est très dangereuse. Il est également corrosif, surtout lorsqu’il est concentré, mais même les solutions à usage domestique peuvent irriter les yeux, les muqueuses et la peau. [96] L’ingestion de solutions de peroxyde d’hydrogène est particulièrement dangereuse, car la décomposition dans l’estomac libère de grandes quantités de gaz (dix fois le volume d’une solution à 3 %), entraînant des ballonnements internes. L’inhalation de plus de 10 % peut provoquer une grave irritation pulmonaire. [97]
Avec une pression de vapeur importante (1,2 kPa à 50 °C), [98] la vapeur de peroxyde d’hydrogène est potentiellement dangereuse. Selon le NIOSH américain, la limite de danger immédiat pour la vie et la santé (IDLH) est de seulement 75 ppm. [99] L’ Occupational Safety and Health Administration (OSHA) des États-Unis a établi une limite d’exposition admissible de 1,0 ppm calculée comme une moyenne pondérée dans le temps sur 8 heures (29 CFR 1910.1000, tableau Z-1). [95] Le peroxyde d’hydrogène a également été classé par la Conférence américaine des hygiénistes industriels gouvernementaux (ACGIH) comme un “cancérigène animal connu, avec une pertinence inconnue pour les humains”. [100]Pour les lieux de travail où il existe un risque d’exposition aux concentrations dangereuses des vapeurs, des moniteurs continus de peroxyde d’hydrogène doivent être utilisés. Des informations sur les dangers du peroxyde d’hydrogène sont disponibles auprès de l’OSHA [95] et de l’ATSDR. [101]
Effets indésirables sur les plaies
Historiquement, le peroxyde d’hydrogène était utilisé pour désinfecter les plaies, en partie à cause de son faible coût et de sa disponibilité rapide par rapport aux autres antiseptiques . On pense maintenant qu’il inhibe la cicatrisation et induit des cicatrices , car il détruit les cellules cutanées nouvellement formées. [102] [ douteux – discuter ] Une étude a révélé que seules de très faibles concentrations (solution à 0,03 %, il s’agit d’une dilution de peroxyde à 3 % typique par 100 fois) peuvent induire la guérison, et seulement si elles ne sont pas appliquées à plusieurs reprises. Une solution à 0,5 % s’est avérée entraver la cicatrisation. [103] L’utilisation chirurgicale peut entraîner la formation d’ embolies gazeuses . [104] [105]Malgré cela, il est encore utilisé pour le traitement des plaies dans de nombreux pays en développement, [106] [107] et, aux États-Unis, il est répandu comme antiseptique majeur de premiers secours.
L’exposition cutanée à des solutions diluées de peroxyde d’hydrogène provoque un blanchiment ou un blanchiment de la peau dû à une microembolie causée par des bulles d’oxygène dans les capillaires. [108]
Utilisation en médecine alternative
Les praticiens de la médecine alternative ont préconisé l’utilisation du peroxyde d’hydrogène pour diverses affections, notamment l’ emphysème , la grippe , le sida et, en particulier , le cancer . [109] Il n’y a aucune preuve d’efficacité et dans certains cas, cela s’est avéré fatal. [110] [111] [112] [113] [114]
L’efficacité et la sécurité de la thérapie au peroxyde d’hydrogène sont scientifiquement discutables. Le peroxyde d’hydrogène est produit par le système immunitaire, mais de manière soigneusement contrôlée. Les cellules appelées phagocytes engloutissent les agents pathogènes et utilisent ensuite le peroxyde d’hydrogène pour les détruire. Le peroxyde est toxique à la fois pour la cellule et pour l’agent pathogène et est donc conservé dans un compartiment spécial, appelé phagosome . Le peroxyde d’hydrogène libre endommagera tous les tissus qu’il rencontre via le stress oxydatif , un processus qui a également été proposé comme cause de cancer. [115]Les affirmations selon lesquelles la thérapie au peroxyde d’hydrogène augmente les niveaux d’oxygène dans les cellules n’ont pas été étayées. Les quantités administrées devraient fournir très peu d’oxygène supplémentaire par rapport à celui disponible à partir de la respiration normale. Il est également difficile d’augmenter le niveau d’oxygène autour des cellules cancéreuses dans une tumeur, car l’apport sanguin a tendance à être faible, une situation connue sous le nom d’ hypoxie tumorale .
De fortes doses orales de peroxyde d’hydrogène à une concentration de 3% peuvent provoquer une irritation et des cloques à la bouche, à la gorge et à l’abdomen ainsi que des douleurs abdominales, des vomissements et de la diarrhée. [110] L’ingestion de peroxyde d’hydrogène à des concentrations de 35 % ou plus a été impliquée comme cause de nombreux événements d’embolie gazeuse entraînant une hospitalisation. Dans ces cas, l’oxygénothérapie hyperbare a été utilisée pour traiter les embolies. [116]
L’injection intraveineuse de peroxyde d’hydrogène a été liée à plusieurs décès. [112] [113] [114] L’ American Cancer Society déclare qu'”il n’y a aucune preuve scientifique que le peroxyde d’hydrogène soit un traitement contre le cancer sûr, efficace ou utile”. [111] De plus, la thérapie n’est pas approuvée par la FDA américaine.
Incidents historiques
- Le 16 juillet 1934, à Kummersdorf , en Allemagne, un réservoir de propergol contenant un mélange expérimental de monergol composé de peroxyde d’hydrogène et d’éthanol explose lors d’un essai, tuant trois personnes. [117]
- Pendant la Seconde Guerre mondiale , les médecins des camps de concentration allemands ont expérimenté l’utilisation d’injections de peroxyde d’hydrogène pour tuer des sujets humains. [118]
- En avril 1992, une explosion s’est produite à l’usine de peroxyde d’hydrogène de Jarrie en France, en raison d’une défaillance technique du système de contrôle informatisé et entraînant un décès et une vaste destruction de l’usine. [119]
- Plusieurs personnes ont été légèrement blessées après un déversement de peroxyde d’hydrogène à bord d’un vol entre les villes américaines d’Orlando et de Memphis le 28 octobre 1998. [120]
- Le sous-marin russe K-141 Koursk a navigué pour effectuer un exercice de tir de torpilles factices sur le Pyotr Velikiy , un croiseur de bataille de classe Kirov . Le 12 août 2000, à 11 h 28 heure locale (07 h 28 UTC), une explosion s’est produite lors de la préparation du tir des torpilles. Le seul rapport crédible à ce jour est que cela était dû à la panne et à l’explosion d’une des torpilles alimentées au peroxyde d’hydrogène du Koursk. On pense que HTP, une forme de peroxyde d’hydrogène hautement concentré utilisé comme propulseur pour la torpille, s’est infiltrée à travers son conteneur, endommagée soit par la rouille, soit lors de la procédure de chargement sur terre où un incident impliquant l’une des torpilles touchant accidentellement le sol n’a pas été signalé. Le navire a été perdu de toutes les mains. Un incident similaire fut responsable de la perte du HMS Sidon en 1955. [121]
- Le 15 août 2010, un déversement d’environ 30 gallons américains (110 L) de liquide de nettoyage s’est produit au 54e étage du 1515 Broadway, à Times Square, New York. Le déversement, qui, selon un porte-parole des pompiers de New York, était du peroxyde d’hydrogène, a fermé Broadway entre les rues West 42nd et West 48th alors que les pompiers répondaient à la situation des matières dangereuses . Aucun blessé n’a été signalé. [122]
Voir également
- Réactif FOX , utilisé pour mesurer les niveaux de peroxyde d’hydrogène dans les systèmes biologiques
- Chalcogénure d’hydrogène
- Retrobright , un procédé utilisant du peroxyde d’hydrogène pour restaurer le plastique jauni
Références
Remarques
- ^ Easton, MF; Mitchell, AG ; Wynne-Jones, WFK (1952). “Le comportement des mélanges de peroxyde d’hydrogène et d’eau. Partie 1.?Détermination des masses volumiques des mélanges de peroxyde d’hydrogène et d’eau” . Transactions de la société Faraday . 48 : 796–801. doi : 10.1039/TF9524800796 . S2CID 96669623 . Archivé de l’original le 15 février 2022 . Récupéré le 30 novembre 2019 .
- ^ “Peroxyde d’hydrogène” . www.chemsrc.com . Archivé de l’original le 8 août 2017 . Récupéré le 3 mai 2018 .
- ^ un bcd Guide de poche NIOSH sur les risques chimiques. “#0335” . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ un bc “Le peroxyde d’hydrogène” . Concentrations immédiatement dangereuses pour la vie ou la santé (IDLH) . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Housecroft, Catherine E.; Sharpe, Alan G. (2005). Chimie inorganique (2e éd.). Pearson Prentice-Hall. p. 443.ISBN _ 0130-39913-2.
- ^ Colline, CN (2001). Un empire vertical: l’histoire du lancement de la fusée britannique et du programme spatial, 1950–1971 . Presse du Collège Impérial. ISBN 978-1-86094-268-6. Archivé de l’original le 13 avril 2021 . Récupéré le 24 août 2020 .
- ^ Brauer, Georg, éd. (1963). Manuel de chimie inorganique préparative . Vol. 1. Traduction éditée par Reed F. (2e éd.). New York : Presse académique. p. 140. ISBN 978-0-12-126601-1.
- ^ Giguère, Paul A. (1950). “Le spectre infrarouge du peroxyde d’hydrogène” (PDF) . Journal de physique chimique . 18 (1): 88. Bibcode : 1950JChPh..18…88G . doi : 10.1063/1.1747464 . Archivé (PDF) de l’original le 2 décembre 2017 . Récupéré le 31 décembre 2018 .
- ^ Giguère, Paul A. (1983). “Association moléculaire et structure du peroxyde d’hydrogène”. Journal d’éducation chimique . 60 (5): 399–401. Bibcode : 1983JChEd..60..399G . doi : 10.1021/ed060p399 .
- ^ Hunt, Robert H.; Leacock, Robert A.; Peters, C. Wilbur; Hecht, Karl T. (1965). “Rotation interne dans le peroxyde d’hydrogène : le spectre infrarouge lointain et la détermination du potentiel gênant” (PDF) . Le Journal de Physique Chimique . 42 (6): 1931. Bibcode : 1965JChPh..42.1931H . doi : 10.1063/1.1696228 . hdl : 2027.42/71115 . Archivé (PDF) de l’original le 9 avril 2014 . Récupéré le 9 avril 2014 .
- ^ Boule, Rowena; Brindley, John (2016). “L’histoire de la vie du peroxyde d’hydrogène III: chiralité et effets physiques à l’aube de la vie”. Origines de la vie et évolution des biosphères . 46 (1): 81–93. Bibcode : 2016OLEB…46…81B . doi : 10.1007/s11084-015-9465-y . PMID 26399407 . S2CID 9564774 .
- ^ Dougherty, Dennis A.; En ligneAnslyn, Eric V. (2005). Physique Chimie Organique Moderne . Sciences universitaires. p. 122. ISBN 978-1-891389-31-3.
- ^ Abrahams, SC; Collin, RL; Lipscomb, WN (1er janvier 1951). “La structure cristalline du peroxyde d’hydrogène” . Acta Crystallographica . 4 (1): 15–20. doi : 10.1107/S0365110X51000039 .
- ^ “Bibliothèque technique de peroxyde d’hydrogène” (PDF) . Archivé de l’original (PDF) le 29 décembre 2009 . Récupéré le 3 mars 2016 .
- ^ Gilbert, LW (1820). “Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser” . Annales de physique (en allemand). 65–66 (1): 3. Bibcode : 1820AnP….64….1T . doi : 10.1002/andp.18200640102 .
- ^ Thénard, LJ (1818). “Observations sur des nouvelles combinaisons entre l’oxigène et divers acides” . Annales de chimie et de physique . 2ème série. 8 : 306–312. Archivé de l’original le 3 septembre 2016 . Récupéré le 9 février 2016 .
- ^ Giguère, Paul A. “Peroxyde d’hydrogène” . Accédez aux Sciences . McGraw Hill Education. doi : 10.1036/1097-8542.329200 . Archivé de l’original le 30 novembre 2018 . Récupéré le 28 novembre 2018 . Le peroxyde d’hydrogène a été découvert en 1818 par le chimiste français Louis-Jacques Thenard, qui l’a nommé eau oxygénée (eau oxygénée).
- ^ Preiato, Daniel (5 mars 2020). « Qu’est-ce que l’eau oxygénée ? » . Ligne Santé . Média Healthline. Archivé de l’original le 31 octobre 2020 . Récupéré le 23 septembre 2020 .
- ^ un b Jones, CW; Clark, JH (1999). Applications du peroxyde d’hydrogène et des dérivés . Société royale de chimie. ISBN 978-0-85404-536-5.
- ^ un b Offermanns, Heribert ; Dittrich, Gunther; Steiner, Norbert (2000). “Wasserstoffperoxid dans Umweltschutz und Synthese”. Chemie in unserer Zeit . 34 (3): 150. doi : 10.1002/1521-3781(200006)34:3<150::AID-CIUZ150>3.0.CO;2-A .
- ^ Wolffenstein, Richard (octobre 1894). “Concentration et distillation de Wasserstoffsuperoxyd” . Berichte der Deutschen Chemischen Gesellschaft (en allemand). 27 (3): 3307–3312. doi : 10.1002/cber.189402703127 . Archivé de l’original le 13 février 2016 . Récupéré le 29 juin 2014 .
- ^ G. Carrara (1892) “Sul peso molecolare e sul potere rifrangente dell’ acqua ossigenata” Archivé le 4 septembre 2016 à la Wayback Machine (Sur le poids moléculaire et sur le pouvoir de réfraction de l’eau oxygénée [c’est-à-dire le peroxyde d’hydrogène]), Atti della Reale Accademia dei Lincei , série 5, 1 (2) : 19–24.
Les découvertes de Carrara ont été confirmées par : WR Orndorff et John White (1893) “Le poids moléculaire du peroxyde d’hydrogène et du peroxyde de benzoyle,” Archivé le 4 septembre 2016 au Wayback Machine American Chemical Journal , 15 : 347–356. - ^ Voir, par exemple :
- En 1882, Kingzett proposa comme structure H 2 O=O. Voir : Thomas Kingzett, Charles (29 septembre 1882). “Sur l’activité de l’oxygène et le mode de formation du dioxyde d’hydrogène” . L’actualité chimique . 46 (1192): 141–142. Archivé de l’original le 3 septembre 2016 . Récupéré le 9 février 2016 .
- Dans son manuel de 1922, Joseph Mellor a considéré trois structures moléculaires hypothétiques pour le peroxyde d’hydrogène, admettant (p. 952): “… la constitution de ce composé n’a pas encore été établie par des expériences sans équivoque”. Voir : Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry , vol. 1 (Londres, Angleterre : Longmans, Green and Co., 1922), p. 952–956. Archivé le 3 septembre 2016 sur la Wayback Machine
- WC Schumb, CN Satterfield et RL Wentworth (1er décembre 1953) “Rapport n° 43 : peroxyde d’hydrogène, deuxième partie” Archivé le 26 février 2015 à la Wayback Machine , Office of Naval Research, contrat n° N5ori-07819 à la p. 178, les auteurs présentent six modèles hypothétiques pour la structure moléculaire du peroxyde d’hydrogène. Dans. 184, la structure actuelle est considérée comme presque certainement correcte, bien qu’un petit doute subsiste. (Remarque : Le rapport de Schumb et al. a été réimprimé sous le titre : WC Schumb, CN Satterfield et RL Wentworth, Hydrogen Peroxide (New York, New York : Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- ^ Penney, WG; Sutherland, GBBM (1934). “La théorie de la structure du peroxyde d’hydrogène et de l’hydrazine”. Journal de physique chimique . 2 (8): 492–498. Bibcode : 1934JChPh…2..492P . doi : 10.1063/1.1749518 .
- ^ Penney, WG; Sutherland, GBBM (1934). “Une note sur la structure de H 2 O 2 et H 4 N 2 avec une référence particulière aux moments électriques et à la rotation libre”. Transactions de la société Faraday . 30 : 898–902. doi : 10.1039/tf934300898b .
- ^ “Préparer pour fabriquer du peroxyde d’hydrogène” (PDF) . IDC Technologies . Archivé (PDF) de l’original le 3 août 2021 . Récupéré le 14 février 2022 .
- ^ un bc Campos -Martin, José M.; Blanco-Brieva, Gema ; Fierro, José LG (2006). “Synthèse de peroxyde d’hydrogène: une perspective au-delà du procédé à l’anthraquinone”. Angewandte Chemie International Edition . 45 (42): 6962–6984. doi : 10.1002/anie.200503779 . PMID 17039551 .
- ^ H. Riedl et G. Pfleiderer, brevet américain 2 158 525 (2 octobre 1936 aux États-Unis et 10 octobre 1935 en Allemagne) à IG Farbenindustrie, Allemagne
- ^ Mellor, Joseph Guillaume (1922). Chimie inorganique moderne . Longmans, Green and Co. pp. 192–195.
- ^ Noritaka Mizuno Gabriele Centi, Siglinda Perathoner, Salvatore Abate “Synthèse directe du peroxyde d’hydrogène: avancées récentes” dans la catalyse d’oxydation hétérogène moderne: conception, réactions et caractérisation 2009, Wiley-VCH. doi : 10.1002/9783527627547.ch8
- ^ Edwards, Jennifer K.; Solsona, Benjamin; N, Edwin Ntainjua; Carley, Albert F.; Herzing, Andrew A.; Kiely, Christopher J.; Hutchings, Graham J. (20 février 2009). “Éteindre l’hydrogénation du peroxyde d’hydrogène dans le processus de synthèse directe” . Sciences . 323 (5917): 1037–1041. Bibcode : 2009Sci…323.1037E . doi : 10.1126/science.1168980 . PMID 19229032 . S2CID 1828874 . Archivé de l’original le 15 février 2022 . Récupéré le 30 novembre 2019 .
- ^ un b Hage, Ronald; Lienke, Achim (21 décembre 2005). “Applications des catalyseurs de métaux de transition au blanchiment des textiles et de la pâte de bois” . Angewandte Chemie International Edition . 45 (2): 206–222. doi : 10.1002/anie.200500525 . PMID 16342123 . Archivé de l’original le 25 janvier 2022 . Récupéré le 14 février 2022 .
- ^ “Décomposition du peroxyde d’hydrogène – Cinétique et examen des catalyseurs choisis” (PDF) . Archivé (PDF) de l’original le 22 décembre 2018 . Récupéré le 30 août 2019 .
- ^ Petrucci, Ralph H. (2007). Chimie générale: principes et applications modernes (9e éd.). Prentice Hall. p. 606 . ISBN 978-0-13-149330-8.
- ^ Csepei, LI; Bolla, Cs. (2015). “L’amidon n’est-il qu’un indicateur visuel de l’iode dans la réaction oscillante de Briggs-Rauscher ?” (PDF) . Studia UBB Chimie . 60 (2): 187–199. Archivé (PDF) de l’original le 30 décembre 2021 . Récupéré le 14 février 2022 .
- ^ Csepei, LI; Bolla, Cs (2011). “L’effet de l’acide salicylique sur la réaction oscillante de Briggs-Rauscher”. Studia UBB Chimie . 53 (1): 285–300.
- ^ Pejić, Nataša; Kolar-Anic, Ljiljana ; Maksimovic, Jelena ; Jankovic, Marija ; Vukojevic, Vladana ; Anic, Slobodan (1er juin 2016). “Transitions dynamiques dans la réaction oscillante de Bray-Liebhafsky. Effet du peroxyde d’hydrogène et de la température sur la bifurcation”. Cinétique, mécanismes et catalyse de réaction . 118 (1): 15-26. doi : 10.1007/s11144-016-0984-y . ISSN 1878-5204 . S2CID 101519047 .
- ^ Maćešić, Stevan; Čupić, Željko; Ivanović-Šašić, Ana; Anic, Slobodan ; Radenković, Mirjana; Pejić, Nataša ; Kolar-Anić, Ljiljana (1er février 2018). “Analyse de bifurcation: un outil pour déterminer les paramètres du modèle du processus considéré”. Cinétique, mécanismes et catalyse de réaction . 123 (1): 31–45. doi : 10.1007/s11144-017-1324-6 . ISSN 1878-5204 . S2CID 104287864 .
- ^ Ravikumar, Kabayadi S.; Kesavan, Venkitasamy ; Crousse, Benoît; Bonnet-Delpon, Danièle; Bégué, Jean-Pierre (2003). “Oxydation douce et sélective des composés soufrés dans le trifluoroéthanol: disulfure de diphényle et sulfoxyde de méthylphényle”. Org. Synthé . 80 : 184. doi : 10.15227/orgsyn.080.0184 .
- ^ Xu, WL; Li, YZ; Zhang, QS; Zhu, HS (2004). “Une conversion sélective, pratique et efficace des sulfures en sulfoxydes”. Synthèse (2): 227–232. doi : 10.1055/s-2004-44387 .
- ^ Mayer, Robert J.; Ofial, Armin R. (22 février 2018). “Réactivités nucléophiles des réactifs de blanchiment”. Lettres organiques . 20 (10): 2816–2820. doi : 10.1021/acs.orglett.8b00645 . PMID 29741385 .
- ^ Chernyshov, Ivan Yu.; Vener, Mikhail V.; Prikhodchenko, Petr V.; Medvedev, Alexandre G. ; Lev, Ovadia ; Churakov, Andrei V. (4 janvier 2017). “Peroxosolvates: critères de formation, liaison hydrogène H2O2 et isomorphisme avec les hydrates correspondants”. Croissance et conception de cristal . 17 (1): 214–220. doi : 10.1021/acs.cgd.6b01449 . ISSN 1528-7483 .
- ^ Löffler G. et Petrides, PE Physiologische Chemie . 4 éd., p. 288, Springer, Berlin 1988, ISBN 3-540-18163-6 (en allemand)
- ^ Löffler G. et Petrides, PE Physiologische Chemie . 4 éd., pp. 321–322, Springer, Berlin 1988, ISBN 3-540-18163-6 (en allemand)
- ^ Gabaldón T (2010). « Diversité et évolution des peroxysomes » . Philos Trans R Soc Lond B Biol Sci . 365 (1541): 765–773. doi : 10.1098/rstb.2009.0240 . PMC 2817229 . PMID 20124343 .
- ^ Wanders RJ, Waterham HR (2006). “La biochimie des peroxysomes de mammifères revisitée”. Annu. Rév. Biochem . 75 (1): 295–332. doi : 10.1146/annurev.biochem.74.082803.133329 . PMID 16756494 .
- ^ Nelson, David; Cox, Michael ; Lehninger, Albert L. et Cox, Michael M. Lehninger Biochemie Archivé le 28 février 2017 à la Wayback Machine , pp. 663–664, Springer, 2001, ISBN 3-540-41813-X (en allemand)
- ^ Riley, Edward P. et al . (ed.) Fetal Alcoholspectrum Disorder Fasd: Management and Policy Perspectives Archivé le 28 février 2017 à la Wayback Machine , Wiley-VCH, 2010, ISBN 3-527-32839-4 p. 112
- ^ un b Nelson, David; Cox, Michael ; Lehninger, Albert L. et Cox, Michael M. Lehninger Biochemie , p. 932, Springer, 2001, ISBN 3-540-41813-X (en allemand)
- ^ Kröger, M. (1989). “Histoire”. Chemie in unserer Zeit . 23 : 34–35. doi : 10.1002/ciuz.19890230106 .
- ^ Schildknecht, H.; En ligneHoloubek, K. (1961). “Le scarabée bombardier et son explosion chimique”. Angewandte Chimie . 73 : 1–7. doi : 10.1002/ange.19610730102 .
- ^ Weber CG (hiver 1981). “Le mythe du scarabée bombardier a explosé” . Création/Évolution . 2 (1) : 1–5. Archivé de l’original le 29 septembre 2017 . Récupéré le 12 novembre 2017 .
- ^ Isaac, Mark (30 mai 2003). “Les Coccinelles Bombardier et l’Argument du Design” . Archives TalkOrigins . Archivé de l’original le 16 novembre 2017 . Récupéré le 12 novembre 2017 .
- ^ “Wie Pflanzen sich schützen, Helmholtz-Institut de pathologie végétale biochimique (en allemand)” (PDF) (en allemand). Helmholtz-Institut de pathologie végétale biochimique. Archivé de l’original (PDF) le 23 juillet 2011 . Récupéré le 14 février 2022 .
- ^ Veau EA, Day AM, Morgan BA (avril 2007). “Détection et signalisation du peroxyde d’hydrogène” . Mol. Cellule . 26 (1): 1–14. doi : 10.1016/j.molcel.2007.03.016 . PMID 17434122 .
- ^ Weindruch, Richard (1er décembre 2006). « Restriction calorique et vieillissement » . Archivé de l’original le 14 février 2022 . Récupéré le 14 février 2022 .
- ^ Giorgio M, Trinei M, Migliaccio E, Pelicci PG (septembre 2007). “Le peroxyde d’hydrogène : un sous-produit métabolique ou un médiateur commun des signaux du vieillissement ?” . Nat. Rév. Mol. Cell Biol . 8 (9): 722–728. doi : 10.1038/nrm2240 . PMID 17700625 . S2CID 6407526 . Archivé de l’original le 15 février 2022 . Récupéré le 7 février 2020 .
- ^ González, D.; Béjarano, I. ; Barriga, C.; Rodríguez, AB; Pariente, JA (2010). “Les caspases induites par le stress oxydatif sont régulées dans les cellules myéloïdes humaines HL-60 par le signal calcique”. Thérapie de transduction du signal de courant . 5 (2): 181–186. doi : 10.2174/157436210791112172 .
- ^ Bejarano, je; Espino, J; Gonzalez-Flores, D ; Casado, JG; Redondo, CP ; Rosado, JA ; Barriga, C; Pariente, JA ; Rodríguez, AB (2009). “Rôle des signaux de calcium sur l’apoptose induite par le peroxyde d’hydrogène dans les cellules myéloïdes humaines HL-60” . Journal international des sciences biomédicales . 5 (3): 246-256. PMC 3614781 . PMID 23675144 .
- ^ López-Lázaro M (juillet 2007). “Double rôle du peroxyde d’hydrogène dans le cancer: pertinence possible pour la chimioprévention et la thérapie du cancer”. Cancer Lett . 252 (1): 1–8. doi : 10.1016/j.canlet.2006.10.029 . PMID 17150302 .
- ^ Rapoport, R.; Hanukoglu, I.; Sklan, D. (mai 1994). “Un dosage fluorométrique pour le peroxyde d’hydrogène, adapté aux systèmes redox générant des superoxydes dépendants du NAD (P) H” . Biochimie anale . 218 (2): 309–313. doi : 10.1006/abio.1994.1183 . PMID 8074285 . Archivé de l’original le 18 mars 2020 . Récupéré le 1er juillet 2019 .
- ^ Tarr, Matthew A., éd. (2003). Méthodes de dégradation chimique des déchets et polluants applications environnementales et industrielles . New York : M. Dekker. p. 165. ISBN 978-0-203-91255-3.
- ^ Pignatello, Joseph J.; Oliveros, Esther ; MacKay, Allison (janvier 2006). “Processus d’oxydation avancés pour la destruction des contaminants organiques basés sur la réaction de Fenton et la chimie associée”. Examens critiques en sciences et technologies de l’environnement . 36 (1): 1–84. doi : 10.1080/10643380500326564 . S2CID 93052585 .
- ^ Pera-Titus, Marc; Garcia-Molina, Verónica ; Baños, Miguel A; Gimenez, Jaime; Esplugas, Santiago (février 2004). “Dégradation des chlorophénols au moyen de procédés d’oxydation avancés: une revue générale”. Catalyse appliquée B : Environnement . 47 (4): 219–256. doi : 10.1016/j.apcatb.2003.09.010 .
- ^ Goor, G.; Glenneberg, J.; En ligneJacobi, S. (2007). “Peroxyde d’hydrogène”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a13_443.pub2 . ISBN 978-3-527-30673-2.
- ^ Ascenzi, Joseph M., éd. (1996). Manuel des désinfectants et antiseptiques . New York : M. Dekker. p. 161. ISBN 978-0-8247-9524-5.
- ^ Rutala, WA; Weber, DJ (1er septembre 2004). « Désinfection et stérilisation dans les établissements de santé : ce que les cliniciens doivent savoir » . Maladies infectieuses cliniques . 39 (5): 702–709. doi : 10.1086/423182 . PMID 15356786 .
- ^ Falagas, moi; Thomaidis, PC ; Kotsantis, IK ; Sgouros, K.; Samonis, G.; Karageorgopoulos, DE (juillet 2011). “Peroxyde d’hydrogène en suspension dans l’air pour la désinfection de l’environnement hospitalier et le contrôle des infections : une revue systématique”. Journal des infections hospitalières . 78 (3): 171–177. doi : 10.1016/j.jhin.2010.12.006 . PMID 21392848 .
- ^ Bloc, Seymour S., éd. (2000). “Chapitre 9: Composés peroxygénés”. Désinfection, stérilisation et conservation (5e éd.). Philadelphie : Lea & Febiger. p. 185–204. ISBN 978-0-683-30740-5.
- ^ un b “Désinfectants Chimiques | Directives de Désinfection et de Stérilisation | Bibliothèque de Directives | Contrôle d’Infection | CDC” . www.cdc.gov . 4 avril 2019. Archivé de l’original le 1er juillet 2017 . Récupéré le 12 avril 2020 .
- ^ McDonnell, G; Russell, AD (janvier 1999). « Antiseptiques et désinfectants : activité, action et résistance » . Examens de microbiologie clinique . 12 (1): 147–79. doi : 10.1128/cmr.12.1.147 . PMC 88911 . PMID 9880479 .
- ^ Bloc, Seymour S., éd. (2000). “Chapitre 27: Agents chimiques sporicides et sporostatiques”. Désinfection, stérilisation et conservation (5e éd.). Philadelphie : Lea & Febiger. p. 529–543. ISBN 978-0-683-30740-5.
- ^ “Sec. 184.1366 Peroxyde d’hydrogène” . Imprimerie du gouvernement américain via GPO Access. 1er avril 2001. Archivé de l’original le 3 juillet 2007 . Récupéré le 7 juillet 2007 .
- ^ Wernimont, Eric J (9-12 juillet 2006). Comparaison des paramètres commerciaux du système des monergols : peroxyde d’hydrogène par rapport à l’hydrazine et autres (PDF) . 42e conférence et exposition sur la propulsion conjointe AIAA/ASME/SAE/ASEE. Sacramento, Californie. Archivé de l’original (PDF) le 10 décembre 2014.
- ^ Ventura, M.; Mullens, P. (19 juin 1999). “L’utilisation du peroxyde d’hydrogène pour la propulsion et la puissance” (PDF) . Général Kinetics, LLC. Archivé de l’original (PDF) le 10 décembre 2014 . Récupéré le 10 décembre 2014 .
- ^ Cieśliński, Dawid (2021). “Aperçu du développement des fusées civiles polonaises” . Archivé de l’original le 6 février 2022 . Récupéré le 15 février 2022 .
- ^ “Nucleus : une manière très différente de se lancer dans l’espace” . Nammo . Archivé de l’original le 6 février 2022 . Récupéré le 6 février 2022 .
- ^ “Accident de peroxyde – Site Web de Walter” . Histarmar.com.ar. Archivé de l’original le 10 décembre 2014 . Récupéré le 14 février 2015 .
- ^ Scott, Richard (novembre 1997). “Instincts de ralliement” . La vapeur de la marine de Jane générée par la décomposition catalytique de 80 à 90% de peroxyde d’hydrogène a été utilisée pour entraîner les turbines de la turbopompe des fusées V-2, des avions-fusées X-15, des premiers moteurs Centaur RL-10 et est toujours utilisée sur Soyouz à cette fin Aujourd’hui. Internationale . Archivé de l’original le 17 juillet 2011 . Récupéré le 12 mai 2007 .
- ^ Soyouz utilisant un propulseur de peroxyde d’hydrogène Archivé le 5 août 2013 sur la Wayback Machine ( site Web de la NASA )
- ^ Voie, Nick (2003). L’oxygène : la molécule qui a fait le monde (première édition en poche, réimprimée). Oxford : presse universitaire d’Oxford. p. 117. ISBN 978-0-19-860783-0. Archivé de l’original le 13 avril 2021 . Récupéré le 12 novembre 2020 .
- ^ Sulieman, M.; Addy, M.; MacDonald, E.; Rees, JS (7 janvier 2004). “L’effet de la concentration de peroxyde d’hydrogène sur les résultats du blanchiment des dents : une étude in vitro” . Journal de dentisterie . Elsevier Ltd. 32 (4): 295–299. doi : 10.1016/j.jdent.2004.01.003 . PMID 15053912 . Archivé de l’original le 15 février 2022 . Récupéré le 30 septembre 2021 .
- ^ Berger, Steven. “Brosse sur la maladie des gencives” . Consommateur FDA. Archivé de l’original le 14 mai 2007 . Récupéré le 7 juillet 2007 .
- ^ Gibbs, Karen B. (14 novembre 2016). “Comment enlever les taches de sang sur les vêtements et les meubles” . Today.com . Archivé de l’original le 20 mai 2021 . Récupéré le 5 août 2021 .
- ^ Mayntz, Mélissa. « Élimination des taches de sang séché » . Lovetoknow.com . Archivé de l’original le 17 août 2021 . Récupéré le 5 août 2021 .
- ^ Capizzi, R.; Landi, F.; Milani, M.; En ligneAmerio, P. (2004). “Tolérabilité cutanée et efficacité de la thérapie combinée avec de la crème stabilisée au peroxyde d’hydrogène et du gel d’adapalène par rapport à la crème de peroxyde de benzoyle et au gel d’adapalène dans l’acné commune. Un essai contrôlé randomisé, masqué par un chercheur”. Journal britannique de dermatologie . 151 (2): 481–484. doi : 10.1111/j.1365-2133.2004.06067.x . PMID 15327558 . S2CID 2611939 .
- ^ “Manières d’utiliser le peroxyde d’hydrogène dans le jardin” . Utilisation de peroxyde d’hydrogène . Archivé de l’original le 4 mars 2016 . Récupéré le 3 mars 2016 .
- ^ Bhattarai SP, Su N, Midmore DJ (2005). L’oxygation libère le potentiel de rendement des cultures dans des sols à faible teneur en oxygène . Les progrès de l’agronomie. Vol. 88. pp. 313–377. doi : 10.1016/S0065-2113(05)88008-3 . ISBN 978-0-12-000786-8.
- ^ “Peroxyde d’hydrogène pour les plantes et le jardin” . 7 septembre 2019. Archivé de l’original le 10 mai 2021 . Récupéré le 10 mai 2021 .
- ^ “Effet de la pulvérisation de peroxyde d’hydrogène sur Hydrocotyle ranunculoides” . Archivé de l’original le 24 mars 2020 . Récupéré le 10 mai 2021 .
- ^ “La FDA approuve des indications supplémentaires pour 35% PEROX-AID (peroxyde d’hydrogène) à utiliser dans certains poissons à nageoires” . FDA . 26 juillet 2019. Archivé de l’original le 12 décembre 2019 . Récupéré le 19 décembre 2019 .
- ^ Greene, Ben; Baker, David; Frazier, Wayne. “Accidents et incidents de peroxyde d’hydrogène: ce que nous pouvons apprendre de l’histoire” (PDF) . NASA. Archivé (PDF) de l’original le 6 avril 2019 . Récupéré le 6 avril 2019 .
- ^ “Compatibilité matérielle avec le peroxyde d’hydrogène” . Archivé de l’original le 4 mars 2016 . Récupéré le 3 mars 2016 .
- ^ “Le bain de bouche au peroxyde d’hydrogène est-il sûr?” . Archivé de l’original le 20 décembre 2013 . Récupéré le 30 octobre 2013 .
- ^ un bc ” Ligne directrice de sécurité et de santé au travail pour le peroxyde d’hydrogène” . Archivé de l’original le 13 mai 2013.
- ^ Par exemple, consultez une fiche signalétique pour une solution de peroxyde à 3% Archivée le 15 avril 2012 sur la Wayback Machine .
- ^ Toxicité et dangers du H 2 O 2 Archivé le 5 juin 2012 sur lesite Web de la Wayback Machine Agency for Toxic Substances and Disease Registry
- ^ Manuel CRC de chimie et de physique, 76e édition, 1995–1996
- ^ “CDC – Concentrations immédiatement dangereuses pour la vie ou la santé (IDLH): Liste des produits chimiques et documentation des valeurs IDLH révisées – Publications et produits NIOSH” . 25 octobre 2017. Archivé de l’original le 17 novembre 2012 . Récupéré le 20 octobre 2018 .
- ^ “Valeurs limites de seuil pour les substances chimiques et les agents physiques et les indices d’exposition biologique, ACGIH” (PDF) . Archivé de l’original (PDF) le 2 juin 2013.
- ^ “ATSDR – Redirection – MMG : Peroxyde d’hydrogène” . Archivé de l’original le 3 mars 2016 . Récupéré le 3 mars 2016 .
- ^ Wilgus TA, Bergdall VK, Dipietro LA, Oberyszyn TM (2005). “Le peroxyde d’hydrogène perturbe la réparation des plaies fœtales sans cicatrice”. Régénération de la réparation des plaies . 13 (5): 513–519. doi : 10.1111/j.1067-1927.2005.00072.x . PMID 16176460 . S2CID 1028923 .
- ^ Loo, Alvin Eng Kiat; Wong, Yee Ting; Ho, Rongjian ; Wasser, Martin; Du, Tiehua ; Ng, petit string ; Halliwell, Barry; Sastre, Juan (13 novembre 2012). “Effets du peroxyde d’hydrogène sur la cicatrisation des plaies chez la souris en relation avec les dommages oxydatifs” . PLOS ONE . 7 (11) : e49215. Code bib : 2012PLoSO …749215L . doi : 10.1371/journal.pone.0049215 . PMC 3496701 . PMID 23152875 .
- ^ Shaw, A; Cooperman, A; Fusco, J (1967). « Embolie gazeuse produite par le peroxyde d’hydrogène ». N Engl J Med . 277 (5): 238–241. doi : 10.1056/nejm196708032770504 . PMID 6029311 .
- ^ “Peroxyde d’hydrogène: rappel du risque d’embolie gazeuse lorsqu’il est utilisé en chirurgie” . www.gov.uk. _ Archivé de l’original le 18 septembre 2016 . Récupéré le 31 juillet 2016 .
- ^ Rahman, Géorgie; Adigun, Iowa ; Yusuf, SI; Ofoegbu, CKP (28 mai 2010). « Pansements où il y a limitation de choix » . Journal nigérian de recherche chirurgicale . 8 (3–4). doi : 10.4314/njsr.v8i3-4.54882 .
- ^ Velding, K.; Klis, S.-A.; Abass, KM ; Tuah, W.; Stienstra, Y.; van der Werf, T. (9 juin 2014). « Soins des plaies dans l’ulcère de Buruli au Ghana et au Bénin » . Journal américain de médecine tropicale et d’hygiène . 91 (2): 313–318. doi : 10.4269/ajtmh.13-0255 . PMC 4125255 . PMID 24914002 .
- ^ “Peroxyde d’hydrogène: effets sur la santé, gestion des incidents et toxicologie” . Archivé de l’original le 25 janvier 2014 . Récupéré le 3 mars 2016 .
- ^ Douglass, Guillaume Campbell (1995). Le peroxyde d’hydrogène : miracle médical . Atlanta, GA: Deuxième publication d’opinion. ISBN 978-1-885236-07-4.
- ^ un peroxyde d’hydrogène b , 3%. 3. Identification des dangers Centre des sciences halieutiques du sud-est, agence filiale de la NOAA .
- ^ un b “Méthodes discutables de gestion de cancer : le peroxyde d’hydrogène et d’autres thérapies” d’hyperoxygénation “” . CA : Un journal sur le cancer pour les cliniciens . 43 (1): 47–56. 1993. doi : 10.3322/canjclin.43.1.47 . PMID 8422605 . S2CID 36911297 .
- ^ un b Cooper, Anderson (12 janvier 2005). « Une ordonnance pour la mort ? » . Nouvelles de CBS. Archivé de l’original le 17 juillet 2007 . Récupéré le 7 juillet 2007 .
- ^ un b Mikkelson, Barbara (30 avril 2006). “Peroxyde d’hydrogène” . Snopes.com . Archivé de l’original le 15 février 2022 . Récupéré le 7 juillet 2007 .
- ^ un b “Le Naturopathe Condamné pour l’Injection d’Adolescent avec du Peroxyde d’Hydrogène – 7NEWS Denver” . Thedenverchannel.com. 27 mars 2006. Archivé de l’original le 20 mars 2014 . Récupéré le 14 février 2015 .
- ^ Halliwell, Barry (1er janvier 2007). “Stress oxydatif et cancer : a-t-on avancé ?” . Journal biochimique . 401 (1): 1–11. doi : 10.1042/BJ20061131 . PMID 17150040 . S2CID 850978 . Archivé de l’original le 15 février 2022 . Récupéré le 30 novembre 2019 .
- ^ Français, Loren Keith; Horowitz, B. Zane; McKeown, Nathanaël J. (juillet 2010). “Ingestion de peroxyde d’hydrogène associée au gaz veineux portal et traitement à l’oxygène hyperbare : une série de cas et revue de la littérature” . Toxicologie clinique (Philadelphie, Pennsylvanie) . 48 (6): 533–538. doi : 10.3109/15563650.2010.492526 . ISSN 1556-9519 . PMID 20575671 . S2CID 25148041 . Archivé de l’original le 4 janvier 2022 . Récupéré le 4 janvier 2022 .
- ^ “Heeresversuchsstelle Kummersdorf” . UrbEx | Oublié & Abandonné . 23 mars 2008. Archivé de l’original le 29 juin 2018 . Récupéré le 1er juin 2018 .
- ^ “Les docteurs nazis : le meurtre médical et la psychologie du génocide” . Robert Jay Lifton. Archivé de l’original le 27 juin 2018 . Récupéré le 26 juin 2018 .
- ^ “Explosion et incendie dans une usine de peroxyde d’hydrogène” . ARIA. Novembre 2007. Archivé de l’original le 14 février 2022.
- ^ “Numéro d’accident: DCA-99-MZ-001” (PDF) . Bureau national de la sécurité des transports des États-Unis. Archivé (PDF) de l’original le 3 novembre 2015 . Récupéré le 30 octobre 2015 .
- ^ Mizokami, Kyle (28 septembre 2018). “La véritable histoire de la catastrophe du sous-marin russe Koursk” . Archivé de l’original le 14 février 2022.
- ^ Wheaton, Sarah (16 août 2010). “Le déversement d’eau de Javel ferme une partie de Times Square” . Le New York Times . Archivé de l’original le 1er décembre 2017 . Récupéré le 24 février 2017 .
Bibliographie
- J. Drabowicz; et coll. (1994). G.Capozzi; et coll. (éd.). Les synthèses des sulfones, des sulfoxydes et des sulfures cycliques . Chichester Royaume-Uni : John Wiley & Sons. p. 112–6. ISBN 978-0-471-93970-2.
- NN Greenwood; A. Earnshaw (1997). Chimie des éléments (2e éd.). Oxford Royaume-Uni : Butterworth-Heinemann.Une excellente description des propriétés et de la chimie de H2O2.
- J. March (1992). Chimie organique avancée (4e éd.). New York : Wiley. p. 723.
- WT Hess (1995). “Peroxyde d’hydrogène”. Encyclopédie Kirk-Othmer de la technologie chimique . Vol. 13 (4e éd.). New York : Wiley. pp. 961–995.
Liens externes
| Wikimedia Commons a des médias liés au peroxyde d’hydrogène . |
| Wikiversité a des ressources d’apprentissage sur l’observation des effets de la concentration sur l’activité enzymatique |
- Peroxyde d’hydrogène au tableau périodique des vidéos (Université de Nottingham)
- Fiche de données de sécurité
- FAQ de l’Agence ATSDR pour les substances toxiques et le registre des maladies
- Carte internationale de sécurité chimique 0164
- Guide de poche NIOSH sur les risques chimiques
- Organigramme du processus de production de peroxyde d’hydrogène par auto-oxydation à l’anthrahydroquinone
- Manuel sur le peroxyde d’hydrogène par Rocketdyne
- Etude spectroscopique IR J. Phys. Chim.