Mousse
Les mousses sont de petites plantes sans fleurs non vasculaires de la division taxonomique Bryophyta ( / b r aɪ ˈ ɒ f ə t ə / , [3] / ˌ b r aɪ . ə ˈ f aɪ t ə / ) Sensu stricto . Bryophyta ( Sensu lato , Schimp . 1879 [4] ) peut également faire référence au groupe parent des bryophytes , qui comprennent les hépatiques , mousses et hornworts . [5] Les mousses forment généralement des touffes ou des tapis verts denses, souvent dans des endroits humides ou ombragés. Les plantes individuelles sont généralement composées de feuilles simples qui n’ont généralement qu’une seule cellule d’épaisseur, attachées à une tige qui peut être ramifiée ou non ramifiée et n’a qu’un rôle limité dans la conduite de l’eau et des nutriments. Bien que certaines espèces aient des tissus conducteurs, ceux-ci sont généralement peu développés et structurellement différents des tissus similaires trouvés dans les Plantes vasculaires . [6] Les mousses n’ont pas de graines et après la fécondation développent des sporophytes avec des tiges non ramifiées surmontées de capsules simples contenant des spores. Ils mesurent généralement de 0,2 à 10 cm (0,1 à 3,9 po) de hauteur, bien que certaines espèces soient beaucoup plus grandes. Dawsonia , la plus haute mousse du monde, peut atteindre 50 cm (20 po) de hauteur. Il en existe environ 12 000 espèces. [2]
| Mousse Plage temporelle : Carbonifère [1] – présent PréꞒ Ꞓ O S ré C P J J K Pg N |
|
|---|---|
 |
|
| Touffes de mousse sur le sol et la base des arbres dans la forêt nationale d’Allegheny , Pennsylvanie, États-Unis | |
| Classement scientifique |
|
| Royaume: | Plantes |
| Clade : | Embryophytes |
| Clade : | Setaphyta |
| Division: | Bryophyta Schimp. Sensu stricto |
| Cours [2] | |
|
|
| Synonymes | |
|
Les mousses sont souvent confondues avec les hépatiques, les anthocérotes et les lichens . [7] Les mousses sont regroupées avec les hornworts et les hépatiques en tant que plantes “non vasculaires” dans une division , toutes ayant la génération de gamétophytes haploïdes comme phase dominante du cycle de vie (bien qu’en fait de nombreuses mousses aient des systèmes vasculaires avancés [8 ] [9] ). Cela contraste avec le schéma de toutes les Plantes vasculaires (plantes à graines et ptéridophytes ), où la génération de sporophytes diploïdes est dominante. Les lichens peuvent ressembler superficiellement à des mousses et ont parfois des noms communs qui incluent le mot « mousse » (p.mousse de renne ” ou ” mousse d’Islande “), mais ils ne sont pas apparentés aux mousses. [7] : 3
La principale importance commerciale des mousses est en tant que constituant principal de la tourbe (principalement du genre Sphagnum ), bien qu’elles soient également utilisées à des fins décoratives, comme dans les jardins et dans le commerce des fleuristes . Utilisations traditionnelles des mousses incluses comme isolant et pour la capacité d’absorber des liquides jusqu’à 20 fois leur poids.
Caractéristiques physiques
La description

 Chloroplastes et granules d’amidon accumulés dans le capillaire de Bryum
Chloroplastes et granules d’amidon accumulés dans le capillaire de Bryum
Botaniquement, les mousses sont des plantes non vasculaires de la division des plantes terrestres Bryophyta. Ce sont de petites plantes herbacées ( de quelques centimètres de haut) (non ligneuses) qui absorbent l’eau et les nutriments principalement par leurs feuilles et récoltent le dioxyde de carbone et la lumière du soleil pour créer de la nourriture par photosynthèse . [10] [11] Ils diffèrent des Plantes vasculaires par l’absence de Trachéides ou de vaisseaux de xylème porteurs d’eau . Comme chez les hépatiques et les anthocérotes , la génération de gamétophytes haploïdes est la phase dominante du cycle de vie . Cela contraste avec le schéma de toutes les Plantes vasculaires (plantes à graines et ptéridophytes ), où la génération de sporophytes diploïdes est dominante. Les mousses se reproduisent à l’aide de spores et non de graines et n’ont pas de fleurs.
Les gamétophytes des mousses ont des tiges qui peuvent être simples ou ramifiées et dressées ou prostrées. Leurs feuilles sont simples, généralement une seule couche de cellules sans espaces d’air internes, souvent avec des nervures médianes plus épaisses. Ils n’ont pas de racines propres, mais des rhizoïdes filiformes qui les ancrent à leur substrat. Les mousses n’absorbent pas l’eau ou les nutriments de leur substrat par leurs rhizoïdes. [ citation nécessaire ] Ils peuvent être distingués des hépatiques ( Marchantiophyta ou Hepaticae) par leurs rhizoïdes multicellulaires. Les capsules de spores ou les sporanges des mousses sont portées individuellement sur de longues tiges non ramifiées, les distinguant ainsi desles polysporangiophytes , qui comprennent toutes les Plantes vasculaires. Les sporophytes porteurs de spores (c’est-à-dire la génération multicellulaire diploïde ) ont une courte durée de vie et dépendent du gamétophyte pour l’approvisionnement en eau et la nutrition. De plus, dans la plupart des mousses, la capsule porteuse de spores grossit et mûrit après l’allongement de sa tige, tandis que chez les hépatiques, la capsule grossit et mûrit avant que sa tige ne s’allonge. [11] D’autres différences ne sont pas universelles pour toutes les mousses et toutes les hépatiques, mais la présence d’une tige clairement différenciée avec des feuilles non vasculaires de forme simple qui ne sont pas disposées en trois rangs, tout indique que la plante est une mousse.
Cycle de vie
Les Plantes vasculaires ont deux ensembles de chromosomes dans leurs cellules végétatives et sont dites diploïdes , c’est-à-dire que chaque chromosome a un partenaire qui contient la même information génétique ou une information similaire. En revanche, les mousses et autres bryophytes n’ont qu’un seul ensemble de chromosomes et sont donc haploïdes (c’est-à-dire que chaque chromosome existe en une copie unique dans la cellule). Il y a une période dans le cycle de vie des mousses où elles ont un double ensemble de chromosomes appariés, mais cela ne se produit que pendant le stade sporophyte .
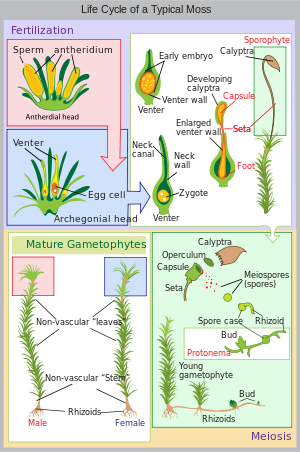
 Cycle de vie d’une mousse typique ( Polytrichum commune )
Cycle de vie d’une mousse typique ( Polytrichum commune )
Le cycle de vie de la mousse commence par une spore haploïde qui germe pour produire un protonema ( pl. protonemata), qui est soit une masse de filaments filiformes, soit un thalloïde (plat et semblable à un thalle). Les protonèmes de mousse massifs ressemblent généralement à un fin feutre vert et peuvent pousser sur un sol humide, de l’écorce d’arbre, des rochers, du béton ou presque toute autre surface raisonnablement stable. Il s’agit d’une étape transitoire dans la vie d’une mousse, mais à partir du protonema se développe le gamétophore («porteur de gamètes») qui se différencie structurellement en tiges et en feuilles. Un seul tapis de protonemata peut développer plusieurs pousses de gamétophores, résultant en une touffe de mousse.
À partir des extrémités des tiges ou des branches du gamétophore se développent les organes sexuels des mousses. Les organes femelles sont connus sous le nom d’ archegonia ( sing. archegonium ) et sont protégés par un groupe de feuilles modifiées connues sous le nom de perichaetum (pluriel, perichaeta). Les archégones sont de petits amas de cellules en forme de flacon avec un col ouvert (venter) dans lequel nagent les spermatozoïdes mâles. Les organes mâles sont connus sous le nom d’ anthéridies ( sing. antheridium ) et sont entourés de feuilles modifiées appelées périgonium ( pl. perigonia). Les feuilles environnantes de certaines mousses forment une coupe anti-éclaboussures, permettant au sperme contenu dans la coupe d’être éclaboussé sur les tiges voisines par la chute de gouttelettes d’eau. [citation nécessaire ]La croissance de la pointe des gamétophores est perturbée par lachitine. [12][13][14]Galottoet al. , 2020 appliquentle chitooctaoseet constatent que les pointes détectent et réagissent à ce dérivé de la chitine en modifiantl’expression des gènes. [12][13][14]Ils trouvent que cette réponse de défense est probablementconservéede l’ancêtre commun le plus récentdesbryophytesettrachéophytes. [12]Orret al. , 2020 constatent que lesmicrotubulesdes cellules de pointe en croissance sont structurellement similaires à la F-actine et servent un objectif similaire. [13]
Les mousses peuvent être dioïques (comparer dioïque dans les plantes à graines) ou monoïques (comparer monoïque ). Chez les mousses dioïques, les organes sexuels mâles et femelles sont portés sur différentes plantes gamétophytes. Dans les mousses monoïques (également appelées autoïques), les deux sont portées sur la même plante. En présence d’eau, les spermatozoïdes des anthéridies nagent vers les archégones et la fécondation se produit, conduisant à la production d’un sporophyte diploïde. Le sperme des mousses est biflagellé, c’est-à-dire qu’elles ont deux flagelles qui aident à la propulsion. Puisque le sperme doit nager jusqu’à l’archégone, la fécondation ne peut pas se produire sans eau. Certaines espèces (par exemple Mnium hornum ou plusieurs espèces de Polytrichum) conservent leurs anthéridies dans ce que l’on appelle des “gobelets anti-éclaboussures”, des structures en forme de bol sur les extrémités des pousses qui propulsent le sperme sur plusieurs décimètres lorsque des gouttelettes d’eau le frappent, augmentant ainsi la distance de fécondation. [15]
Après la fécondation, le sporophyte immature se fraye un chemin hors du venter archégonial. Il faut environ un quart à six mois pour que le sporophyte mûrisse. Le corps du sporophyte comprend une longue tige, appelée soie, et une capsule coiffée d’un capuchon appelé opercule . La capsule et l’opercule sont à leur tour gainés par une calyptre haploïde qui est le reste du venter archégonial. Le calyptra tombe généralement lorsque la capsule est mature. Dans la capsule, les cellules productrices de spores subissent une méiose pour former des spores haploïdes, sur lesquelles le cycle peut recommencer. L’embouchure de la capsule est généralement entourée d’un ensemble de dents appelé péristome. Cela peut être absent dans certaines mousses.
La plupart des mousses comptent sur le vent pour disperser les spores. Dans le genre Sphagnum , les spores sont projetées à environ 10–20 cm (4–8 po) du sol par l’air comprimé contenu dans les capsules; les spores sont accélérées à environ 36 000 fois l’ accélération gravitationnelle terrestre g . [16] [17]


Il a récemment été découvert que les microarthropodes, tels que les collemboles et les acariens , peuvent effectuer la fertilisation de la mousse [18] et que ce processus est médié par les odeurs émises par la mousse. Les mousses de feu mâles et femelles , par exemple, émettent des odeurs organiques volatiles différentes et complexes. [19] Les plantes femelles émettent plus de composés que les plantes mâles. Il a été constaté que les collemboles choisissent préférentiellement les plantes femelles, et une étude a révélé que les collemboles améliorent la fertilisation de la mousse, suggérant une relation médiée par l’odeur analogue à la relation plante-pollinisateur trouvée dans de nombreuses plantes à graines. [19] L’espèce de mousse puante Splachnum sphaericumdéveloppe davantage la pollinisation par les insectes en attirant les mouches vers ses sporanges avec une forte odeur de charogne et en fournissant un signal visuel fort sous la forme de colliers gonflés de couleur rouge sous chaque capsule de spores. Les mouches attirées par la mousse transportent ses spores vers les excréments frais d’herbivores, habitat privilégié des espèces de ce genre. [20]
Dans de nombreuses mousses, par exemple, Ulota phyllantha , des structures végétatives vertes appelées gemmes sont produites sur les feuilles ou les branches, qui peuvent se détacher et former de nouvelles plantes sans avoir besoin de passer par le cycle de fertilisation. C’est un moyen de reproduction asexuée , et les unités génétiquement identiques peuvent conduire à la formation de populations clonales .
Mâles nains
Les mâles nains de mousse (également connus sous le nom de nannandry ou phyllodioïque ) proviennent de spores mâles dispersées par le vent qui se déposent et germent sur la pousse femelle où leur croissance est limitée à quelques millimètres. Chez certaines espèces, le nanisme est génétiquement déterminé, en ce sens que toutes les spores mâles deviennent naines. [21] Plus souvent, il est déterminé par l’environnement en ce que les spores mâles qui atterrissent sur une femelle deviennent naines, tandis que celles qui atterrissent ailleurs se développent en grands mâles de la taille d’une femelle. [21] [22] [23] [24]Dans ce dernier cas, les mâles nains qui sont transplantés des femelles sur un autre substrat se développent en grandes pousses, suggérant que les femelles émettent une substance qui inhibe la croissance des mâles en germination et accélère peut-être aussi leur début de maturation sexuelle. [23] [24] La nature d’une telle substance est inconnue, mais la phytohormone auxine peut être impliquée [21]
Le fait que les mâles grandissent comme des nains sur la femelle devrait augmenter l’efficacité de la fécondation en minimisant la distance entre les organes reproducteurs mâles et femelles. Ainsi, il a été observé que la fréquence de fécondation est positivement associée à la présence de mâles nains chez plusieurs espèces phyllodioïques . [25] [26]
Les mâles nains sont présents dans plusieurs lignées non apparentées [26] [27] et se révèlent plus courants qu’on ne le pensait auparavant. [26] Par exemple, on estime qu’entre un quart et la moitié de tous les pleurocarpes dioïques ont des mâles nains. [26]
Réparation de l’ADN
La mousse Physcomitrella patens a été utilisée comme organisme modèle pour étudier comment les plantes réparent les dommages causés à leur ADN, en particulier le mécanisme de réparation connu sous le nom de recombinaison homologue . Si la plante ne peut pas réparer les dommages à l’ADN, par exemple les cassures double brin , dans leurs cellules somatiques , les cellules peuvent perdre leurs fonctions normales ou mourir. Si cela se produit pendant la méiose (partie de la reproduction sexuée), ils pourraient devenir stériles. Le génome de P. patens a été séquencé, ce qui a permis d’identifier plusieurs gènes impliqués dans la réparation de l’ADN. [28] P. patensdes mutants défectueux dans les étapes clés de la recombinaison homologue ont été utilisés pour déterminer le fonctionnement du mécanisme de réparation chez les plantes. Par exemple, une étude des mutants de P. patens défectifs en Rp RAD51, un gène qui code pour une protéine au cœur de la réaction de réparation recombinatoire, a indiqué que la recombinaison homologue est essentielle pour réparer les cassures double brin de l’ADN chez cette plante. [29] De même, des études sur des mutants défectueux en Ppmre11 ou Pprad50 (qui codent pour des protéines clés du complexe MRN , le principal capteur des cassures double brin de l’ADN) ont montré que ces gènes sont nécessaires à la réparation des dommages à l’ADN ainsi qu’à la croissance normale. et développement. [30]
Classification
Plus récemment, les mousses ont été regroupées avec les hépatiques et les anthocérotes dans la division Bryophyta ( bryophytes , ou Bryophyta Sensu lato ). [5] [31] [32] [33] [34] [35] [36] [37] [38] [ citations excessives ] La division des bryophytes elle-même contient trois (anciennes) divisions : Bryophyta (mousses), Marchantiophyta (hépatiques ) et Anthocerotophyta (hornworts); il a été proposé que ces dernières divisions soient déclassées dans les classes Bryopsida, Marchantiopsida et Anthocerotopsida, respectivement.[5] Les mousses et les hépatiques sont maintenant considérées comme appartenant à un clade appelé Setaphyta . [32] [39] [40]
Les mousses, (Bryophyta Sensu stricto), sont divisées en huit classes :
| division Bryophyta classe Takakiopsida classe Sphagnopsida classe Andreaeopsida classe Andreaeobryopsida classe Oedipodiopsida classe Polytrichopsida classe Tetraphidopsida classe Bryopsida |
|
|||||||||||||||||||||||
| La phylogénie actuelle et la composition des Bryophyta. [2] [41] |

 “Muscinae” de Ernst Haeckel ‘s Kunstformen der Natur , 1904
“Muscinae” de Ernst Haeckel ‘s Kunstformen der Natur , 1904
Six des huit classes ne contiennent qu’un ou deux genres chacune. Polytrichopsida comprend 23 genres et Bryopsida comprend la majorité de la diversité des mousses avec plus de 95% des espèces de mousses appartenant à cette classe.
Les Sphagnopsida, les mousses de tourbe, comprennent les deux genres vivants Ambuchanania et Sphagnum , ainsi que des taxons fossiles. La sphaigne est une variété diversifiée, répandue et économiquement importante. Ces grosses mousses forment de vastes tourbières acides dans les marécages tourbeux. Les feuilles de Sphagnum ont de grandes cellules mortes alternant avec des cellules photosynthétiques vivantes. Les cellules mortes aident à stocker l’eau. Outre ce caractère, le protonema ramifié unique, thallose (plat et expansé) et le sporange à rupture explosive le distinguent des autres mousses.
Andreaeopsida et Andreaeobryopsida se distinguent par les rhizoïdes bisériés (deux rangées de cellules), le protonema multisérié (plusieurs rangées de cellules) et le sporange qui se divise le long de lignes longitudinales. La plupart des mousses ont des capsules qui s’ouvrent au sommet.
Les Polytrichopsida ont des feuilles avec des ensembles de lamelles parallèles, des volets de cellules contenant des chloroplastes qui ressemblent aux ailettes d’un dissipateur thermique. Ceux-ci réalisent la photosynthèse et peuvent aider à conserver l’humidité en enfermant partiellement les surfaces d’échange gazeux. Le Polytrichopsida diffère également des autres mousses par d’autres détails de son développement et de son anatomie, et peut également devenir plus gros que la plupart des autres mousses, avec par exemple Polytrichum commune formant des coussins jusqu’à 40 cm (16 po) de haut. La mousse terrestre la plus haute, membre des Polytrichidae, est probablement Dawsonia superba , originaire de Nouvelle-Zélande et d’autres parties de l’Australasie .
Histoire géologique

 Bristly Haircap moss, un hiver originaire de la lande des vallées du Yorkshire
Bristly Haircap moss, un hiver originaire de la lande des vallées du Yorkshire
Les archives fossiles de mousse sont rares, en raison de leur nature à parois souples et fragiles. Des fossiles de mousse sans ambiguïté ont été récupérés dès le Permien de l’Antarctique et de la Russie, et un cas est avancé pour les mousses du Carbonifère . [42] Il a en outre été affirmé que les fossiles en forme de tube du Silurien sont les restes macérés de calyptræ de mousse . [43] Les mousses semblent également évoluer 2 à 3 fois plus lentement que les fougères, les gymnospermes et les angiospermes. [44]
Des recherches récentes montrent que la mousse ancienne pourrait expliquer pourquoi les périodes glaciaires de l’ Ordovicien se sont produites. Lorsque les ancêtres de la mousse d’aujourd’hui ont commencé à se répandre sur terre il y a 470 millions d’années, ils ont absorbé le CO 2 de l’atmosphère et extrait des minéraux en sécrétant des acides organiques qui ont dissous les roches sur lesquelles ils poussaient. Ces roches altérées chimiquement ont à leur tour réagi avec le CO 2 atmosphériqueet formé de nouvelles roches carbonatées dans l’océan grâce à l’altération des ions calcium et magnésium des roches silicatées. Les roches altérées ont également libéré des quantités importantes de phosphore et de fer qui se sont retrouvées dans les océans, où elles ont provoqué une prolifération massive d’algues, entraînant l’enfouissement du carbone organique, extrayant davantage de dioxyde de carbone de l’atmosphère. De petits organismes se nourrissant des nutriments ont créé de vastes zones sans oxygène, ce qui a provoqué une extinction massive d’espèces marines, tandis que les niveaux de CO 2 ont chuté partout dans le monde, permettant la formation de calottes glaciaires sur les pôles. [45] [46]
Écologie
Habitat
-
![]()
![]()
Colonies denses de mousse dans une forêt côtière fraîche
-
![]()
![]()
Une forêt de mousse fraîche de haute altitude/latitude ; le sol de la forêt est couvert de mousse, sous les conifères
-
![]()
![]()
La mousse colonise une coulée de basalte , en Islande
-
![]()
![]()
Mousse poussant le long des suintements et des sources dans la roche basaltique nouvellement déposée , Islande.
-
![]()
![]()
Mousse poussant le long du ruisseau à partir d’une source karstique ; le travertin se dépose à partir de l’eau du ruisseau et la mousse l’envahit, formant cette crête, avec le ruisseau au-dessus.
-
![]()
![]()
Mousse avec sporophytes sur brique
-
![]()
![]()
Jeunes sporophytes de la mousse commune Tortula muralis (vis-mousse murale)
-
![]()
![]()
Mur de soutènement recouvert de mousse
-
![]()
![]()
Une petite touffe de mousse sous un conifère (un endroit ombragé, généralement sec)
-
![]()
![]()
Mousse sur un mur en béton
Comme les gamétophytes des mousses sont autotrophes , ils ont besoin de suffisamment de lumière solaire pour effectuer la photosynthèse . [47] La tolérance à l’ ombre varie selon les espèces, tout comme elle le fait avec les plantes supérieures. Dans la plupart des régions, les mousses poussent principalement dans les zones humides et ombragées, telles que les zones boisées et au bord des cours d’eau, mais elles peuvent pousser n’importe où dans les climats frais, humides et nuageux, et certaines espèces sont adaptées aux zones ensoleillées et saisonnièrement sèches comme les zones alpines. rochers ou dunes de sable stabilisées.
Le choix du substrat varie également selon les espèces. Les espèces de mousse peuvent être classées comme poussant sur : des rochers, des sols minéraux exposés, des sols perturbés, des sols acides, des sols calcaires, des zones de suintements de falaises et de cascades, des bords de cours d’eau, des sols humifères ombragés , des bûches abattues, des souches brûlées, des bases de troncs d’arbres, des troncs d’arbres supérieurs , et des branches d’arbres ou dans des tourbières . Les espèces de mousse qui poussent sur ou sous les arbres sont souvent spécifiques quant aux espèces d’arbres sur lesquelles elles poussent, comme préférer les conifères aux feuillus , les chênes aux aulnes ou vice versa. [11] Alors que les mousses poussent souvent sur les arbres en tant qu’épiphytes , elles ne sont jamais parasites sur l’arbre.
Les mousses se trouvent également dans les fissures entre les pavés des rues humides des villes et sur les toits. Certaines espèces adaptées aux zones perturbées et ensoleillées sont bien adaptées aux conditions urbaines et se trouvent couramment dans les villes. Des exemples seraient Rhytidiadelphus squarrosus , une mauvaise herbe de jardin dans les régions de Vancouver et de Seattle; Bryum argenteum , la mousse cosmopolite des trottoirs, et Ceratodon purpureus , la mousse rouge des toits, une autre espèce cosmopolite. Quelques espèces sont entièrement aquatiques, telles que Fontinalis antipyretica , mousse d’eau commune; et d’autres comme la sphaigne habitent les tourbières, les marais et les cours d’eau très lents. [11]Ces mousses aquatiques ou semi-aquatiques peuvent largement dépasser la gamme normale de longueurs observée chez les mousses terrestres. Les plantes individuelles de 20 à 30 cm (8 à 12 po) ou plus de long sont courantes chez les espèces de sphaignes par exemple.
Partout où elles se trouvent, les mousses ont besoin d’eau liquide pendant au moins une partie de l’année pour compléter la fertilisation. De nombreuses mousses peuvent survivre à la dessiccation , parfois pendant des mois, revenant à la vie quelques heures après la réhydratation. [47]
On pense généralement que dans l’ hémisphère nord , le côté nord des arbres et des rochers aura généralement une croissance de mousse plus luxuriante en moyenne que les autres côtés. [48] On suppose que la raison en est que le soleil du côté sud provoque un environnement sec. L’inverse serait vrai dans l’ hémisphère sud . Certains naturalistes pensent que les mousses poussent sur le côté plus humide des arbres et des rochers. [10] Dans certains cas, comme les climats ensoleillés dans les régions tempéréeslatitudes nord, ce sera le côté nord ombragé de l’arbre ou du rocher. Sur les pentes raides, il peut s’agir du côté montant. Pour les mousses qui poussent sur les branches d’arbres, il s’agit généralement de la face supérieure de la branche sur les sections à croissance horizontale ou près de l’entrejambe. Dans les climats frais, humides et nuageux, tous les côtés des troncs d’arbres et des rochers peuvent être suffisamment humides pour la croissance de la mousse. Chaque espèce de mousse nécessite une certaine quantité d’humidité et de lumière solaire et poussera donc sur certaines sections du même arbre ou rocher.
Certaines mousses poussent sous l’eau ou sont complètement gorgées d’eau. Beaucoup préfèrent les endroits bien drainés. Il existe des mousses qui poussent préférentiellement sur les rochers et les troncs d’arbres de diverses chimies. [49]
Relation avec les cyanobactéries
Dans les forêts boréales , certaines espèces de mousse jouent un rôle important dans la fourniture d’azote pour l’écosystème en raison de leur relation avec les cyanobactéries fixatrices d’azote . Les cyanobactéries colonisent la mousse et reçoivent un abri en échange de l’apport d’azote fixé. La mousse libère l’azote fixé, ainsi que d’autres nutriments, dans le sol “lors de perturbations telles que le séchage-réhumidification et les incendies”, le rendant disponible dans tout l’écosystème. [50]
Cultivation

 Une pelouse de mousse dans un jardin au Japon
Une pelouse de mousse dans un jardin au Japon 
 Le jardin de mousse à la réserve de Bloedel, Bainbridge Island, État de Washington.
Le jardin de mousse à la réserve de Bloedel, Bainbridge Island, État de Washington.
La mousse est souvent considérée comme une mauvaise herbe dans les pelouses, mais elle est délibérément encouragée à pousser selon des principes esthétiques illustrés par le jardinage japonais . Dans les jardins des anciens temples, la mousse peut tapisser une scène forestière. On pense que la mousse ajoute une sensation de calme, d’âge et d’immobilité à une scène de jardin. La mousse est également utilisée en bonsaï pour couvrir le sol et renforcer l’impression d’âge. [51] Les règles de culture ne sont pas largement établies. Les collectes de mousses sont bien souvent commencées à partir d’échantillons transplantés dans la nature dans un sac de rétention d’eau. Certaines espèces de mousse peuvent être extrêmement difficiles à maintenir loin de leurs sites naturels avec leurs exigences uniques en matière de combinaisons de lumière, d’humidité, de chimie du substrat, d’abri contre le vent, etc.
La croissance de la mousse à partir de spores est encore moins contrôlée. Les spores de mousse tombent sous une pluie constante sur les surfaces exposées; les surfaces qui accueillent une certaine espèce de mousse seront généralement colonisées par cette mousse en quelques années d’exposition au vent et à la pluie. Les matériaux poreux et qui retiennent l’humidité, comme la brique , le bois et certains mélanges de béton grossier, sont propices à la mousse. Les surfaces peuvent également être préparées avec des substances acides, notamment du babeurre , du yogourt , de l’urine et des mélanges légèrement réduits en purée d’échantillons de mousse, d’eau et de compost éricacé .
Dans le Pacifique Nord-Ouest frais, humide et nuageux , la mousse est parfois autorisée à pousser naturellement sous forme de pelouse de mousse , qui nécessite peu ou pas de tonte, de fertilisation ou d’arrosage. Dans ce cas, l’herbe est considérée comme la mauvaise herbe. [52] Les paysagistes de la région de Seattle ramassent parfois des rochers et des bûches abattues faisant pousser des mousses pour les installer dans les jardins et les paysages. Les jardins boisés dans de nombreuses régions du monde peuvent inclure un tapis de mousses naturelles. [47] La réserve de Bloedel sur l’île de Bainbridge, dans l’État de Washington, est célèbre pour son jardin de mousse. Le jardin de mousse a été créé en enlevant les sous-bois arbustifs et les couvre-sol herbacés, en éclaircissant les arbres et en permettant aux mousses de se remplir naturellement. [53]
Toits et murs végétalisés
Les mousses sont parfois utilisées dans les toits verts . Les avantages des mousses par rapport aux plantes plus hautes dans les toits verts comprennent des charges de poids réduites, une absorption d’eau accrue, aucun besoin d’engrais et une tolérance élevée à la sécheresse. Étant donné que les mousses n’ont pas de vraies racines, elles nécessitent moins de milieu de plantation que les plantes plus hautes avec des systèmes racinaires étendus. Avec une sélection appropriée des espèces pour le climat local, les mousses des toits verts ne nécessitent aucune irrigation une fois établies et nécessitent peu d’entretien. [54] Les mousses sont également utilisées sur les murs verts .
Mosserie
Une mode passagère pour la collecte de mousse à la fin du 19e siècle a conduit à la création de mousseries dans de nombreux jardins britanniques et américains. La mousserie est généralement construite en bois à lattes, avec un toit plat, ouvert sur le côté nord (maintien de l’ombre). Des échantillons de mousse ont été installés dans les fissures entre les lattes de bois. L’ensemble de la mousse serait alors régulièrement humidifié pour maintenir la croissance.
Aquascaping
Aquascaping utilise de nombreuses mousses aquatiques. Ils réussissent mieux à de faibles niveaux de nutriments, de lumière et de chaleur, et se propagent assez facilement. Ils aident à maintenir une chimie de l’eau adaptée aux poissons d’aquarium. [55] Ils poussent plus lentement que de nombreuses plantes d’aquarium et sont assez robustes. [56]
Inhibition de la croissance
La mousse peut être une mauvaise herbe gênante dans les pépinières et les serres en conteneurs. [57] La croissance vigoureuse de la mousse peut inhiber l’émergence des semis et la pénétration de l’eau et des engrais dans les racines des plantes.
La croissance de la mousse peut être inhibée par un certain nombre de méthodes :
- Diminution de la disponibilité de l’eau par drainage .
- Augmentation de la lumière directe du soleil.
- Augmentation du nombre et des ressources disponibles pour les plantes compétitives comme les graminées .
- Augmenter le pH du sol avec l’application de chaux .
- Trafic intense ou dérangement manuel du lit de mousse avec un râteau
- Application de produits chimiques tels que le sulfate ferreux (par exemple, dans les pelouses) ou l’eau de javel (par exemple, sur les surfaces solides).
- Dans les pépinières en conteneurs, les matériaux minéraux grossiers tels que le sable, le gravier et les copeaux de roche sont utilisés comme pansement supérieur à drainage rapide dans les conteneurs de plantes pour décourager la croissance de la mousse.
L’application de produits contenant du sulfate ferreux ou du sulfate ferreux d’ammonium tuera la mousse; ces ingrédients se trouvent généralement dans les produits commerciaux anti-mousse et les engrais . Le soufre et le fer sont des nutriments essentiels pour certaines plantes concurrentes comme les graminées. Tuer la mousse n’empêchera pas la repousse à moins que les conditions favorables à leur croissance ne soient modifiées. [58]
Les usages

 Mur recouvert de mousse
Mur recouvert de mousse
Traditionnel
Les sociétés préindustrielles utilisaient les mousses qui poussaient dans leurs régions.
Les Lapons, les tribus nord-américaines et d’autres peuples circumpolaires utilisaient des mousses pour la literie. [10] [47] Les mousses ont également été utilisées comme isolant tant pour les habitations que pour les vêtements. Traditionnellement, la mousse séchée était utilisée dans certains pays nordiques et en Russie comme isolant entre les rondins dans les cabanes en rondins , et les tribus du nord-est des États-Unis et du sud-est du Canada utilisaient de la mousse pour combler les interstices des maisons longues en bois. [47] Les peuples circumpolaires et alpins ont utilisé des mousses pour l’isolation des bottes et des mitaines. Ötzi l’homme des glaces avait des bottes pleines de mousse. [47]
La capacité des mousses séchées à absorber les fluides a rendu leur utilisation pratique à la fois médicale et culinaire. Les tribus nord-américaines utilisaient les mousses pour les couches, les pansements et l’absorption des fluides menstruels. [47] Les tribus du nord-ouest du Pacifique aux États-Unis et au Canada utilisaient des mousses pour nettoyer le saumon avant de le sécher et emballaient de la mousse humide dans des fours à fosse pour faire cuire à la vapeur des bulbes de camas . Les paniers de stockage des aliments et les paniers bouillants étaient également remplis de mousses. [47]
Des recherches récentes portant sur les restes de Néandertal récupérés à El Sidrón ont fourni la preuve que leur régime alimentaire se composait principalement de pignons de pin, de mousse et de champignons. Ceci est contrasté par des preuves provenant d’autres endroits européens qui indiquent un régime alimentaire plus carnivore. [59]
En Finlande , les mousses de tourbe ont été utilisées pour faire du pain pendant les famines . [60]
Commercial
Il existe un marché substantiel de mousses récoltées dans la nature. Les utilisations de la mousse intacte sont principalement dans le commerce des fleuristes et pour la décoration de la maison. La mousse en décomposition du genre Sphagnum est également le principal composant de la tourbe , qui est “extraite” pour être utilisée comme carburant , comme additif pour le sol horticole et pour fumer le malt dans la production de whisky écossais .
La mousse de sphaigne , généralement les espèces S. cristatum et S. subnitens , est récoltée alors qu’elle est encore en croissance et est séchée pour être utilisée dans les pépinières et l’horticulture comme milieu de croissance des plantes.
Certaines mousses de sphaigne peuvent absorber jusqu’à 20 fois leur propre poids en eau. [61] Pendant la Première Guerre mondiale , les mousses de sphaigne étaient utilisées comme pansements de premiers secours sur les blessures des soldats, car ces mousses absorbaient les liquides trois fois plus vite que le coton, retenaient mieux les liquides, distribuaient mieux les liquides uniformément sur elles-mêmes et étaient plus fraîches, plus douce et moins irritante. [61] On prétend également qu’il a des propriétés antibactériennes. [62] Les Amérindiens étaient l’un des peuples à utiliser la sphaigne pour les couches et les serviettes, ce qui se fait encore au Canada . [63]
Dans les régions rurales du Royaume- Uni , Fontinalis antipyretica était traditionnellement utilisé pour éteindre les incendies car on pouvait le trouver en quantités substantielles dans les rivières à courant lent et la mousse retenait de grands volumes d’eau qui aidaient à éteindre les flammes. Cette utilisation historique se reflète dans son nom latin / grec spécifique , dont le sens approximatif est “contre le feu”.
Au Mexique , la mousse est utilisée comme décoration de Noël .

 Bioréacteur à mousse cultivant la mousse Physcomitrella patens
Bioréacteur à mousse cultivant la mousse Physcomitrella patens
Physcomitrella patens est de plus en plus utilisé en biotechnologie . Des exemples frappants sont l’identification de gènes de mousse ayant des implications pouramélioration des cultures ou la santé humaine [64] et la production sûre de produits biopharmaceutiques complexes dans le bioréacteur de mousse, développé par Ralf Reski et ses collègues. [65]
Londres a installé plusieurs structures appelées «City Trees»: des murs remplis de mousse, dont chacun prétend avoir «la capacité de purification de l’air de 275 arbres réguliers» en consommant des oxydes d’azote et d’autres types de pollution de l’air et en produisant de l’oxygène. [66]
Voir également
- Embryophyte
- Lichen
Références
- ^ Hubers, M.; En ligneKerp, H. (2012). “Les plus anciennes mousses connues découvertes dans les strates du Mississippien (Viséen tardif) d’Allemagne”. Géologie . 40 (8): 755–58. Bibcode : 2012Geo….40..755H . doi : 10.1130/G33122.1 .
- ^ un bc Goffinet , Bernard; William R. Buck (2004). Systématique des Bryophytes (Mousses) : Des molécules à une classification révisée . Monographies en botanique systématique . Systématique moléculaire des bryophytes. Vol. 98. Presse du jardin botanique du Missouri. p. 205–239. ISBN 978-1-930723-38-2.
- ^ “Bryophyta” . Dictionnaire Merriam-Webster .
- ^ Schimper, WP (1879). “Bryophyta”. Dans Zittel, KA (éd.). Manuel de paléontologie . Vol. 2. R. Oldenbourg.
- ^ un bc de Sousa , Filipe; et coll. (2019). “Les phylogénies des protéines nucléaires soutiennent la monophylie des trois groupes de bryophytes (Bryophyta Schimp.)” . Nouveau Phytologue . 222 (1): 565–75. doi : 10.1111/nph.15587 . hdl : 1983/0b471d7e-ce54-4681-b791-1da305d9e53b . PMID 30411803 . S2CID 53240320 .
- ^ Ligrone, R.; Duckett, JG; En ligneRenzaglia, KS (2000). “Tissus conducteurs et relations phylétiques des bryophytes” . Philos Trans R Soc Lond B Biol Sci . 355 (1398): 795–813. doi : 10.1098/rstb.2000.0616 . PMC 1692789 . PMID 10905610 .
- ^ un b Lichens d’Amérique du Nord, Irwin M. Brodo, Sylvia Duran Sharnoff, ISBN 978-0300082494 , 2001
- ^ Bell, NE et Hyvönen, J. (2010). « Phylogénie de la classe de mousse Polytrichopsida (BRYOPHYTA) : structure de niveau générique et arbres génétiques incongrus » . Phylogénétique moléculaire et évolution . 55 (2): 381–398. doi : 10.1016/j.ympev.2010.02.004 . PMID 20152915 .
- ^ Bodribb, TJ; et coll. (2020). “Fonction vasculaire avancée découverte dans une mousse répandue”. Plantes naturelles . 6 (3): 273–279. doi : 10.1038/s41477-020-0602-x . PMID 32170283 . S2CID 212641738 .
- ^ un bc Mathews , Daniel (1994). Histoire Naturelle Cascade-Olympique . Portland, Oregon : Audubon Society of Portland/Raven Editions. ISBN 978-0-9620782-0-0.
- ^ un bcd Pojar et MacKinnon (1994). Plantes de la côte nord-ouest du Pacifique . Vancouver, Colombie-Britannique : Lone Pine Publishing. ISBN 978-1-55105-040-9.
- ^ un bc Delaux , Pierre-Marc; Schornack, Sébastien (2021-02-19). “L’évolution des plantes entraînée par les interactions avec les microbes symbiotiques et pathogènes”. Sciences . Association américaine pour l’avancement des sciences (AAAS). 371 (6 531) : 1–10. doi : 10.1126/science.aba6605 . ISSN 0036-8075 . S2CID 231955632 .
- ^ un bc Bibeau , Jeffrey P.; Galotto, Giulia; Wu, Min ; Tuzel, Erkan; Vidali, Luis (2021-04-06). “Biologie cellulaire quantitative de la croissance de la pointe dans la mousse”. Biologie Moléculaire Végétale . Springer . 107 (4–5) : 227–244. doi : 10.1007/s11103-021-01147-7 . ISSN 0167-4412 .
- ^ un soleil b , Guiling; Bai, Shenglong; Guan, Yanlong ; Wang, Shuanghua ; Wang, Qia ; Liu, Yang; Liu, Huan ; Goffinet, Bernard; Zhou, Yun ; Paoletti, Mathieu; Hu, Xiangyang; Haas, Fabian B.; Fernandez-Pozo, Noé ; Czyrt, Alia ; Soleil, pendre ; Rensing, Stefan A.; Huang, Jinling (2020-07-31). “Les régions génomiques dérivées de champignons sont-elles liées à l’antagonisme envers les champignons dans les mousses?”. Nouveau Phytologue . Nouvelle fondation phytologiste ( Wiley ). 228 (4): 1169–1175. doi : 10.1111/nph.16776 . ISSN 0028-646X . PMID 32578878 . S2CID 220047618 .
- ^ van der Velde, M.; Pendant, HJ; van de Zande, L.; En ligneBijlsma, R. (2001). “La biologie reproductive de Polytrichum formosum: structure clonale et paternité révélées par les microsatellites”. Écologie moléculaire . 10 (10): 2423–2434. doi : 10.1046/j.0962-1083.2001.01385.x . PMID 11742546 . S2CID 19716812 .
- ^ Johan L. van Leeuwen (23 juillet 2010). “Lancé à 36 000 g “. Sciences . 329 (5990): 395–6. doi : 10.1126/science.1193047 . PMID 20651138 .
- ^ Dwight K. Whitaker et Joan Edwards (23 juillet 2010). ” La mousse de sphaigne disperse les spores avec des anneaux de vortex” . Sciences . 329 (5990): 406. Bibcode : 2010Sci…329..406W . doi : 10.1126/science.1190179 . PMID 20651145 . S2CID 206526774 .
- ^ Cronberg, N.; Natcheva, R.; En ligneHedlund, K. (2006). “Les microarthropodes interviennent dans le transfert de sperme dans les mousses” . Sciences . 313 (5791): 1255. doi : 10.1126/science.1128707 . PMID 16946062 . S2CID 11555211 .
- ^ un Rosenstiel b , TN; Shortlidge, EE; Melnychenko, AN; Pankow, JF; En ligneEppley, SM (2012). “Les composés volatils spécifiques au sexe influencent la fertilisation de la mousse par les microarthropodes”. Nature . 489 (7416): 431–433. Bibcode : 2012Natur.489..431R . doi : 10.1038/nature11330 . PMID 22810584 . S2CID 4419337 .
- ^ Vaizey, JR (1890). “Sur la Morphologie du Sporophyte de Splachnum luteum “. Annales de Botanique . 1 : 1–8. doi : 10.1093/oxfordjournals.aob.a090623 .
- ^ un bcUne , Kouji (1985). “Dimorphisme sexuel chez les espèces japonaises de Macromitrium Brid. (Musci: Orthotrichaceae)” . Le journal du laboratoire botanique Hattori consacré à la bryologie et à la lichénologie . 59 : 487–513.
- ^ Blackstock, TH (1987). “Les gamétophores mâles de Leucobryum glaucum (Hedw.) Ångstr. Et L. juniperoideum (Brid.) C. Muell. Dans deux forêts galloises”. Journal de bryologie . 14 (3): 535–541. doi : 10.1179/jbr.1987.14.3.535 .
- ^ un Loveland b , Hugh Frank (1956). Dimorphisme sexuel chez le genre de mousse Dicranum Hedw. (Dissertation) . Université du Michigan.
- ^ un b Wallace, MH (1970). Morphologie du développement et dimorphisme sexuel chez Homalothecium megaptilum (Sull.) Robins. (Dissertation) . Université de l’État de Washington.
- ^ Sagmo Solli, IM; Söderström, Lars; Bakken, Solveig; Flatberg, Kjell Ivar; Pedersen, Bård (1998). “Les études de fertilité de Dicranum majus dans deux populations avec une production de sporophytes contrastée”. Journal de bryologie . 22 (1): 3–8. doi : 10.1179/jbr.2000.22.1.3 . S2CID 85349694 .
- ^ un bcd Hedenäs , Lars ; Bisang, Irène (2011). “Les mâles nains négligés dans les mousses – uniques parmi les plantes vertes”. Perspectives en écologie végétale, évolution et systématique . 13 (2): 121–135. doi : 10.1016/j.ppees.2011.03.001 .
- ^ Ramsay, Helen P.; Berrie, GK (1982). “Détermination du sexe chez les bryophytes”. Journal du Laboratoire botanique Hattori . 52 : 255–274.
- ^ Rensing, SA; Lang, D; Zimmer, AD ; Terry, A.; Salamov, A; Shapiro, H.; Nishiyama, T.; et coll. (janvier 2008). “Le génome de Physcomitrella révèle des informations évolutives sur la conquête des terres par les plantes” (PDF) . Sciences . 319 (5859) : 64–9. Bibcode : 2008Sci…319…64R . doi : 10.1126/science.1150646 . hdl : 11858/00-001M-0000-0012-3787-A . PMID 18079367 . S2CID 11115152 .
- ^ Markmann-Mulisch U, Wendeler E, Zobell O, Schween G, Steinbiss HH, Reiss B (octobre 2007). “Exigences différentielles pour RAD51 dans le développement de Physcomitrella patens et Arabidopsis thaliana et la réparation des dommages à l’ADN” . Cellule végétale . 19 (10): 3080–9. doi : 10.1105/tpc.107.054049 . PMC 2174717 . PMID 17921313 .
- ^ Kamisugi Y, Schaefer DG, Kozak J, Charlot F, Vrielynck N, Holá M, Angelis KJ, Cuming AC, Nogué F (avril 2012). “MRE11 et RAD50, mais pas NBS1, sont essentiels pour le ciblage des gènes dans la mousse Physcomitrella patens” . Nucleic Acids Res . 40 (8): 3496–510. doi : 10.1093/nar/gkr1272 . PMC 3333855 . PMID 22210882 .
- ^ Cox, Cymon J.; et coll. (2014). “Les phylogénies conflictuelles pour les premières plantes terrestres sont causées par des biais de composition parmi les substitutions synonymes” . Biologie Systématique . 63 (2): 272–279. doi : 10.1093/sysbio/syt109 . PMC 3926305 . PMID 24399481 .
- ^ un b Puttick, Mark N.; et coll. (2018). “Les Interrelations des Plantes Terrestres et la Nature de l’Embryophyte Ancestral”. Biologie actuelle . 28 (5) : 733–745.e2. doi : 10.1016/j.cub.2018.01.063 . hdl : 1983/ad32d4da-6cb3-4ed6-add2-2415f81b46da . PMID 29456145 . S2CID 3269165 .
- ^ Leebens-Mack, James H.; et coll. (2019). « Mille transcriptomes végétaux et la phylogénomique des plantes vertes » . Nature . 574 (7780): 679–685. doi : 10.1038/s41586-019-1693-2 . PMC 6872490 . PMID 31645766 .
- ^ Zhang, Jian; et coll. (2020). “Le génome de la cornifle et l’évolution précoce des plantes terrestres” . Plantes naturelles . 6 (2): 107–118. doi : 10.1038/s41477-019-0588-4 . PMC 7027989 . PMID 32042158 .
- ^ Harris, Brogan J.; et coll. (2020). “Preuve phylogénomique pour la monophylie des bryophytes et l’évolution réductrice des stomates”. Biologie actuelle . 30 (11) : P2201–2012.E2. doi : 10.1016/j.cub.2020.03.048 . hdl : 1983/fbf3f371-8085-4e76-9342-e3b326e69edd . PMID 32302587 . S2CID 215798377 .
- ^ Li, Fay-Wei; et coll. (2020). “Les génomes d’Anthoceros éclairent l’origine des plantes terrestres et la biologie unique des hornworts” . Plantes naturelles . 6 (3): 259–272. doi : 10.1038/s41477-020-0618-2 . manche : 10261/234303 . PMC 8075897 . PMID 32170292 .
- ^ Sousa, Filipe; et coll. (2020). “La phylogénie des plantes terrestres chloroplastiques: analyses utilisant des modèles de composition hétérogènes d’arbres et de sites mieux adaptés” . Frontières en sciences végétales . 11 : 1062. doi : 10.3389/fpls.2020.01062 . PMC 7373204 . PMID 32760416 .
- ^ Su, Danian; et coll. (2021). “Les analyses phylogénomiques à grande échelle révèlent la monophylie des bryophytes et l’origine néoprotérozoïque des plantes terrestres” . Biologie moléculaire et évolution . 38 (8): 3332–3344. doi : 10.1093/molbev/msab106 . PMC 8321542 . PMID 33871608 .
- ^ Sousa, Filipe; et coll. (2020). “La phylogénie mitochondriale des plantes terrestres montre un soutien pour Setaphyta dans des modèles de substitution de composition hétérogène” . PeerJ . 8 (4) : e8995. doi : 10.7717/peerj.8995 . PMC 7194085 . PMID 32377448 .
- ^ Cox, Cymon J. (2018). “Phylogénétique moléculaire des plantes terrestres: une revue avec des commentaires sur l’évaluation de l’incongruence parmi les phylogénies”. Revues critiques en sciences végétales . 37 (2–3) : 113–127. doi : 10.1080/07352689.2018.1482443 . hdl : 10400.1/14557 . S2CID 92198979 .
- ^ Buck, William R. & Bernard Goffinet. (2000). “Morphologie et classification des mousses”, pages 71-123 dans A. Jonathan Shaw & Bernard Goffinet (Eds.), Bryophyte Biology . (Cambridge : Cambridge University Press). ISBN 0-521-66097-1 .
- ^ Thomas, BA (1972). “Une mousse probable du Carbonifère inférieur de la forêt de Dean, Gloucestershire”. Annales de Botanique . 36 (1): 155–161. doi : 10.1093/oxfordjournals.aob.a084568 . ISSN 1095-8290 . JSTOR 42752024 .
- ^ Kodner, RB; Graham, LE (2001). “Les restes de Polytrichum (Musci, Polytrichaceae) hydrolysés à l’acide à haute température ressemblent à des microfossiles tubulaires énigmatiques du Silurien-Dévonien” . Journal américain de botanique . 88 (3): 462–466. doi : 10.2307/2657111 . JSTOR 2657111 . PMID 11250824 . Archivé de l’original le 2009-03-03.
- ^ Stenøien, HK (2008). “Lente évolution moléculaire de l’ADNr 18S, des gènes rbcL et nad5 des mousses par rapport aux plantes supérieures” . Journal de biologie évolutive . 21 (2): 566-571. doi : 10.1111/j.1420-9101.2007.01479.x . PMID 18205784 .
- ^ “Les premières plantes terrestres ont plongé la Terre dans l’ère glaciaire” . Newscientist.com. Archivé de l’original le 2013-09-23 . Récupéré le 11/09/2013 .
- ^ “Les premières plantes ont causé des périodes glaciaires, de nouvelles recherches révèlent” . Sciencedaily.com. 2012-02-01. Archivé de l’original le 2013-10-03 . Récupéré le 11/09/2013 .
- ^ un bcdefgh Kimmerer , Robin Wall ( 2003 ). Cueillir de la mousse . Corvallis, Oregon : Presse universitaire de l’État de l’Oregon. ISBN 978-0-87071-499-3.
- ^ Porley, Ron; Hodgetts, Nick (2005). Mousses et hépatiques . Londres : Collins. p. 80–81. ISBN 978-0-00-220212-1.
- ^ Fletcher, Michael (2006). Manuel des producteurs de mousse (3e éd.). Lecture Berkshire: SevenTy Press. ISBN 0-9517176-0-X.
- ^ Rousk, Kathrin; Jones, Davey L.; DeLuca, Thomas H. (2013-01-01). “Les associations mousse-cyanobactéries comme sources biogéniques d’azote dans les écosystèmes de la forêt boréale” . Frontières en microbiologie . 4 : 150. doi : 10.3389/fmicb.2013.00150 . ISSN 1664-302X . PMC 3683619 . PMID 23785359 .
- ^ Chan, Peter (1993). Classe de maître Bonsaï . New York: Sterling Publishing Co.ISBN 978-0-8069-6763-9.
- ^ Smith, Sally W. (1998). Résolveur de problèmes de jardin occidental au coucher du soleil . Menlo Park, Californie: Sunset Books. ISBN 978-0-376-06132-4.
- ^ “La réserve de Bloedel” . Archivé de l’original le 16 avril 2011 . Récupéré le 24 avril 2011 .
- ^ “RoofTopGarden” . Archivé de l’original le 24 avril 2011 . Récupéré le 22 mai 2011 .
- ^ “Un guide pour garder et faire pousser de la mousse aquatique” . L’amour de l’aquascaping . 12 avril 2016.
- ^ “Mousses” . www.aquasabi.com .
- ^ Haglund, William A.; Russell et Holland (été 1981). “Lutte contre la mousse dans les semis de conifères cultivés en conteneur” (PDF) . Notes du planteur d’arbres (USFS) . 32 (3): 27–29. Archivé (PDF) de l’original le 19 juillet 2011 . Récupéré le 24 avril 2011 .
- ^ Steve Whitcher; Maître jardinier (1996). « Contrôle de la mousse dans les pelouses » . Jardinage dans l’ouest de Washington . Université de l’État de Washington. Archivé de l’original le 2007-02-05 . Récupéré le 10/02/2007 .
- ^ Weyrich, Laura S.; Duchêne, Sébastien ; Soubrier, Julien; Arriola, Luis; Lamas, Bastien; Breen, James; Morris, Alan G.; Alt, Kurt W. ; Caramelli, David; Dresley, Veit ; Farrell, Milly; Farrer, Andrew G.; Francken, Michael; Gully, Neville; Haak, Wolfgang; Hardy, Karen; Harvati, Katerina; Tenu, Pétra ; Holmes, Edward C.; Kaidonis, Jean; Lalueza-Fox, Carles; de la Rasilla, Marco; Rosas, Antonio; Sémal, Patrick ; Soltysiak, Arkadiusz; Townsend, subvention ; Usai, Donatella; Wahl, Joachim; Huson, Daniel H.; et coll. (2017). “Comportement, régime alimentaire et maladie de Néandertal déduits de l’ADN ancien dans le calcul dentaire” (PDF) . Nature . 544 (7650): 357–361. Bibcode : 2017Natur.544..357W . est ce que je : 10.1038/nature21674 . manche : 10261/152016 . PMID 28273061 . S2CID 4457717 .
- ^ Engman, Max; DG Kirby (1989). Finlande : peuple, nation, État . C. Hurst & Co. p. 45. ISBN 0-253-32067-4 .
- ^ a b The Plant Underworld, Sphagnum and Water, Australian Botanic Garden Archivé le 17/02/2014 à la Wayback Machine
- ^ Stalheim, T.; Ballance, S.; Christensen, BE ; Granum, Î.-P.-É. (2009-03-01). “La sphaigne – un polymère de type pectine isolé de la mousse de sphaigne peut inhiber la croissance de certaines bactéries typiques de détérioration des aliments et d’intoxication alimentaire en abaissant le pH”. Journal de microbiologie appliquée . 106 (3): 967–976. doi : 10.1111/j.1365-2672.2008.04057.x . ISSN 1365-2672 . PMID 19187129 . S2CID 1545021 .
- ^ Hotson, JW (1921). “La sphaigne utilisée comme pansement chirurgical en Allemagne pendant la guerre mondiale (conclu)”. Le bryologue . 24 (6) : 89–96. doi : 10.1639/0007-2745(1921)24[89:suasdi]2.0.co;2 . JSTOR 3237483 .
- ^ Ralf Reski et Wolfgang Frank (2005): Génomique fonctionnelle de la mousse ( Physcomitrella patens ) – Découverte de gènes et développement d’outils avec des implications pour les plantes cultivées et la santé humaine. Briefings en génomique fonctionnelle et protéomique 4, 48-57.
- ^ Decker, EL; En ligneReski, R. (2007). “Bioréacteurs de mousse produisant des produits biopharmaceutiques améliorés”. Opinion actuelle en biotechnologie . 18 (5): 393–398. doi : 10.1016/j.copbio.2007.07.012 . PMID 17869503 .
- ^ Landon, Alex (2020-01-07). “City Trees: Londres a de nouveaux arbres artificiels qui mangent la pollution” . Londres secrète . Récupéré le 09/02/2020 .
Liens externes
| Wikimedia Commons a des médias liés à Bryophyta . |
| Wikispecies contient des informations relatives à Bryophyta . |
| Recherchez la mousse dans Wiktionary, le dictionnaire gratuit. |
- Informations, schémas et photos
- Manuel du producteur de mousse – 2,39 Mo, fichier PDF
- La société britannique de bryologie
- Galerie de photos de mousses
- World of Mosses – Peintures à l’aquarelle de mousse par Robert Muma










