Mammifère
Les mammifères (du latin mamma , ‘sein’) sont un groupe de vertébrés constituant la classe Mammalia ( / m ə ˈ m eɪ l i ə / ), caractérisés par la présence de glandes mammaires qui, chez les femelles , produisent du lait pour nourrir (allaiter) leurs jeune, un néocortex (une région du cerveau), de la fourrure ou des cheveux et trois os de l’oreille moyenne . Ces caractéristiques les distinguent des reptiles (dontoiseaux ) dont ils ont divergé au Carbonifère , il y a plus de 300 millions d’années. Environ 6 400 espèces de mammifères existantes ont été décrites. Les commandes les plus importantes sont les rongeurs , les chauves -souris et les eulipotyphles ( hérissons , taupes , musaraignes et autres). Les trois suivants sont les primates (y compris les humains , les grands singes , les singes et autres), les artiodactyles ( cétacés et ongulés à doigts égaux), et les Carnivores ( chats , chiens , phoques , et autres).
| Mammifères Plage temporelle : Trias tardif – Récent ; 225 ou 167–0 Ma Voir la discussion des dates dans le texte PréꞒ Ꞓ O S ré C P J J K Pg N |
|
|---|---|
  |
|
| Classement scientifique |
|
| Royaume: | Animalier |
| Phylum: | Chordonnées |
| Clade : | Amniota |
| Clade : | Synapside |
| Clade : | Mammaliaformes |
| Classe: | Mammalia Linnaeus , 1758 |
| Sous-groupes vivants | |
|
En termes de cladistique , qui reflète l’histoire de l’évolution, les mammifères sont les seuls membres vivants des Synapsida (synapsides) ; ce clade , avec Sauropsida (reptiles et oiseaux), constitue le plus grand clade Amniota . Les premières synapsides étaient des sphénacodontes , un groupe qui comprenait le célèbre Dimetrodon . Les synapsides se sont divisées en plusieurs groupes divers de synapsides non mammifères – traditionnellement et incorrectement appelées reptiles ressemblant à des mammifères ou par le terme pélycosaures, et maintenant connues sous le nom de mammifères souches ou protomammifères – avant de donner naissance à des thérapsides au début du Permien moyen.période. Les mammifères sont issus des cynodontes , un groupe avancé de thérapsides, au début du Jurassique . Les ordres de mammifères modernes sont apparus au Paléogène et au Néogène de l’ ère cénozoïque , après l’ extinction des dinosaures non aviaires , et ont été le groupe animal terrestre dominant d’il y a 66 millions d’années à nos jours.
Le type de corps de base est quadrupède , et la plupart des mammifères utilisent leurs quatre extrémités pour la locomotion terrestre ; mais chez certains, les extrémités sont adaptées à la vie en mer , dans les airs , dans les arbres , sous terre ou sur deux jambes . Les mammifères varient en taille de la chauve-souris bourdon de 30 à 40 mm (1,2 à 1,6 po) à la baleine bleue de 30 m (98 pi) – peut-être le plus gros animal à avoir jamais vécu. La durée de vie maximale varie de deux ans pour la musaraigne à 211 ans pour la baleine boréale . Tous les mammifères modernes donnent naissance à des jeunes vivants, à l’exception des cinq espèces de monotrèmes, qui sont des mammifères ovipares. Le groupe de mammifères le plus riche en espèces, la cohorte appelée placentaires , possède un placenta , qui permet l’alimentation du fœtus pendant la gestation .
La plupart des mammifères sont intelligents , certains possédant de gros cerveaux, une conscience de soi et l’utilisation d’outils . Les mammifères peuvent communiquer et vocaliser de plusieurs façons, y compris la production d’ ultrasons , le marquage olfactif , les signaux d’alarme , le chant et l’ écholocation . Les mammifères peuvent s’organiser en sociétés de fission-fusion , en harems et en hiérarchies , mais peuvent aussi être solitaires et territoriaux . La plupart des mammifères sont polygames , mais certains peuvent être monogames ou polyandres .
La domestication de nombreux types de mammifères par l’homme a joué un rôle majeur dans la révolution néolithique et a conduit l’agriculture à remplacer la chasse et la cueillette comme principale source de nourriture pour l’homme. Cela a conduit à une restructuration majeure des sociétés humaines de nomades à sédentaires, avec plus de coopération entre des groupes de plus en plus grands, et finalement le développement des premières civilisations . Les mammifères domestiqués fournissaient et continuent de fournir de l’énergie pour le transport et l’agriculture, ainsi que de la nourriture ( viande et produits laitiers ), de la fourrure et du cuir . Les mammifères sont aussi chasséset courus pour le sport, et sont utilisés comme organismes modèles en science. Les mammifères sont représentés dans l’art depuis l’époque paléolithique et apparaissent dans la littérature, le cinéma, la mythologie et la religion. Le déclin du nombre et l’extinction de nombreux mammifères sont principalement dus au braconnage humain et à la destruction de l’habitat , principalement la déforestation .
Classification

 Plus de 70 % des espèces de mammifères proviennent des ordres Rodentia , rongeurs (bleu) ; Chiroptera , chauves-souris (rouge); et Soricomorpha , musaraignes (jaune).
Plus de 70 % des espèces de mammifères proviennent des ordres Rodentia , rongeurs (bleu) ; Chiroptera , chauves-souris (rouge); et Soricomorpha , musaraignes (jaune).
| Rodentia Chiroptères Soricomorphe Primates Carnivore Artiodactyles Diprotodontie Lagomorphe Didelphimorphie Cétacé Dasyuromorphie | Afrosoricida Erinaceomorpha Cingulata Péramélémorphie Scandentia Périssodactyle Macroscélide Pilosa Monotremata Sirénie proboscide |
La classification des mammifères a subi plusieurs révisions depuis que Carl Linnaeus a initialement défini la classe, et à l’heure actuelle, aucun système de classification n’est universellement accepté. McKenna & Bell (1997) et Wilson & Reeder (2005) fournissent des recueils récents utiles. [1] Simpson (1945) [2] fournit une systématique des origines et des relations des mammifères qui avait été enseignée universellement jusqu’à la fin du 20e siècle. Cependant, depuis 1945, une grande quantité d’informations nouvelles et plus détaillées ont été progressivement trouvées : Le dossier paléontologiquea été recalibré, et les années qui ont suivi ont vu beaucoup de déBats et de progrès concernant les fondements théoriques de la systématisation elle-même, en partie grâce au nouveau concept de cladistique . Bien que les travaux de terrain et de laboratoire aient progressivement dépassé la classification de Simpson, elle reste la chose la plus proche d’une classification officielle des mammifères, malgré ses problèmes connus. [3]
La plupart des mammifères, y compris les six ordres les plus riches en espèces , appartiennent au groupe placentaire. Les trois plus grands ordres en nombre d’espèces sont Rodentia : souris , rats , porcs- épics , castors , capybaras et autres mammifères rongeurs ; Chiroptères : chauves-souris ; et Soricomorpha : musaraignes , taupes et solénodons . Les trois plus grands ordres suivants, selon le schéma de classification biologique utilisé, sont les primates : singes , singes et lémuriens .; les Cetartiodactyla : baleines et ongulés égaux ; et le Carnivora qui comprend les chats , les chiens , les belettes , les ours , les phoques et leurs alliés. [4] Selon Mammal Species of the World , 5 416 espèces ont été identifiées en 2006. Celles-ci ont été regroupées en 1 229 genres , 153 familles et 29 ordres. [4] En 2008, l’ Union internationale pour la conservation de la nature (UICN) a achevé une évaluation mondiale des mammifères sur cinq ans pour sa Liste rouge de l’UICN, qui comptait 5 488 espèces. [5] Selon une étude publiée dans le Journal of Mammalogy en 2018, le nombre d’espèces de mammifères reconnues est de 6 495, dont 96 récemment éteintes. [6]
Définitions
Le mot « mammifère » est moderne, issu du nom scientifique Mammalia inventé par Carl Linnaeus en 1758, dérivé du latin mamma (« tétine, bouillie »). Dans un article influent de 1988, Timothy Rowe a défini Mammalia phylogénétiquement comme le groupe couronne de mammifères, le clade composé de l’ ancêtre commun le plus récent des monotrèmes vivants ( échidnés et ornithorynques ) et des mammifères therians ( marsupiaux et placentaires ) et de tous les descendants de cet ancêtre. [7]Étant donné que cet ancêtre vivait à l’ époque jurassique , la définition de Rowe exclut tous les animaux du Trias antérieur , malgré le fait que les fossiles triasiques de l’ Haramiyida sont référés aux Mammalia depuis le milieu du XIXe siècle. [8] Si Mammalia est considéré comme le groupe de la couronne, son origine peut être approximativement datée comme la première apparition connue d’animaux plus étroitement liés à certains mammifères existants qu’à d’autres. Ambondro est plus étroitement lié aux monotrèmes qu’aux mammifères therians tandis qu’Amphilestes et Amphitherium sont plus étroitement liés aux therians; car les fossiles des trois genres sont datés d’environ 167 millions d’annéesau Jurassique moyen , il s’agit d’une estimation raisonnable de l’apparition du groupe de la couronne. [9]
TS Kemp a fourni une définition plus traditionnelle : « les synapsides qui possèdent une articulation dentaire – squamosale de la mâchoire et une occlusion entre les molaires supérieures et inférieures avec une composante transversale au mouvement » ou, de manière équivalente selon Kemp, le clade provenant du dernier ancêtre commun de Sinoconodon et mammifères vivants. [10] La plus ancienne synapside connue répondant aux définitions de Kemp est Tikitherium , datée de 225 Ma , de sorte que l’apparition de mammifères dans ce sens plus large peut être donnée à cette date du Trias tardif . [11] [12]
Classement McKenna/Bell
En 1997, les mammifères ont été complètement révisés par Malcolm C. McKenna et Susan K. Bell, ce qui a abouti à la classification McKenna/Bell. Les auteurs ont travaillé ensemble en tant que paléontologues au Musée américain d’histoire naturelle . McKenna a hérité du projet de Simpson et, avec Bell, a construit un système hiérarchique complètement mis à jour, couvrant les taxons vivants et éteints, qui reflète la généalogie historique de Mammalia. [3] Leur livre de 1997, Classification of Mammals above the Species Level , [13]est un travail complet sur la systématique, les relations et les occurrences de tous les taxons de mammifères, vivants et éteints, jusqu’au rang de genre, bien que les données génétiques moléculaires remettent en question plusieurs des groupements.
Dans la liste suivante, les groupes éteints sont marqués d’un poignard (†).
Classe Mammifère
- Sous-classe Prototheria : monotrèmes : les échidnés et l’ ornithorynque
- Sous -classe Theriiformes : mammifères vivants et leurs parents préhistoriques
- Infraclasse † Allotheria : multituberculés
- Infraclasse † Eutriconodonta : eutriconodontes
- Infraclasse Holotheria : mammifères vivants modernes et leurs parents préhistoriques
- Superlégion † Kuehneotheria
- Supercohort Theria : mammifères vivants
- Cohorte Marsupialia : marsupiaux
- Magnorder Australidelphia : les marsupiaux australiens et le monito del monte
- Magnorder Ameridelphia : marsupiaux du Nouveau Monde. Maintenant considéré comme paraphylétique, les opossums musaraignes étant plus proches des australidelphiens. [14]
- Cohorte Placentalia : placentaires
- Magnorder Xenarthra : xenarthrans
- Magnorder Epitheria : epitheres
- Super-ordre † Leptictida
- Super -ordre Preptotheria
- Grand -ordre Anagalida : lagomorphes , rongeurs et musaraignes éléphants
- Grandorder Ferae : carnivores , pangolins , † créodontes et apparentés
- Grand -ordre Lipotyphla : insectivores
- Grand -ordre Archonta : chauves -souris , primates , colugos et musaraignes (désormais considérés comme paraphylétiques, les chauves-souris étant plus proches des autres groupes)
- Grand -ordre Ungulata : ongulés
- Commander Tubulidentata incertae sedis : oryctérope
- Mirorder Eparctocyona : † condylarthes , baleines et artiodactyles (ongulés à doigts pairs)
- Mirorder † Meridiungulata : Ongulés sud-américains
- Mirorder Altungulata : périssodactyles (ongulés aux doigts impairs), éléphants , lamantins et damans
- Cohorte Marsupialia : marsupiaux
Classification moléculaire des placentaires
Dès le début du 21e siècle, des études moléculaires basées sur l’analyse de l’ADN ont suggéré de nouvelles relations entre les familles de mammifères. La plupart de ces résultats ont été validés de manière indépendante par les données de présence/absence de rétrotransposon . [15] Les systèmes de classification basés sur des études moléculaires révèlent trois grands groupes ou lignées de mammifères placentaires – Afrotheria , Xenarthra et Boreoeutheria – qui ont divergé au Crétacé . Les relations entre ces trois lignées sont controversées et les trois hypothèses possibles ont été proposées en ce qui concerne le groupe basal . Ces hypothèses sontAtlantogenata (Boreoeutheria basale), Epitheria (Xenarthra basale) et Exafroplacentalia (Afrotheria basale). [16] Boreoeutheria contient à son tour deux lignées majeures – Euarchontoglires et Laurasiatheria .
Les estimations des temps de divergence entre ces trois groupes placentaires vont de 105 à 120 millions d’années, selon le type d’ADN utilisé (tel que nucléaire ou mitochondrial ) [17] et les différentes interprétations des données paléogéographiques . [16]
| Mammifère |
|
Le cladogramme ci-dessus est basé sur Tarver et al . (2016) [18]
Évolution
Origines
Synapsida , un clade qui contient des mammifères et leurs parents disparus, est né pendant la sous- période pennsylvanienne (il y a environ 323 millions à environ 300 millions d’années), lorsqu’ils se sont séparés de la lignée des reptiles. Les mammifères du groupe de la couronne ont évolué à partir de formes de mammifères antérieures au début du Jurassique . Le cladogramme considère Mammalia comme le groupe de la couronne. [19]
| Mammaliaformes |
|
Évolution à partir d’amniotes plus âgés

 La structure originale du crâne synapside contient une ouverture temporelle derrière les orbitales , dans une position assez basse sur le crâne (en bas à droite sur cette image). Cette ouverture aurait pu aider à contenir les muscles de la mâchoire de ces organismes, ce qui aurait pu augmenter leur force de morsure.
La structure originale du crâne synapside contient une ouverture temporelle derrière les orbitales , dans une position assez basse sur le crâne (en bas à droite sur cette image). Cette ouverture aurait pu aider à contenir les muscles de la mâchoire de ces organismes, ce qui aurait pu augmenter leur force de morsure.
Les premiers vertébrés entièrement terrestres étaient des amniotes . Comme leurs premiers prédécesseurs tétrapodes amphibies, ils avaient des poumons et des membres. Les œufs amniotiques, cependant, ont des membranes internes qui permettent à l’ embryon en développement de respirer tout en retenant l’eau. Par conséquent, les amniotes peuvent pondre sur des terres sèches, tandis que les amphibiens doivent généralement pondre leurs œufs dans l’eau.
Les premiers amniotes sont apparemment apparus dans la sous-période pennsylvanienne du Carbonifère . Ils descendent de tétrapodes amphibies reptiliomorphes antérieurs, [20] qui vivaient sur des terres déjà habitées par des insectes et d’autres invertébrés ainsi que des fougères , des mousses et d’autres plantes. En quelques millions d’années, deux importantes lignées d’amniotes se sont distinguées : les synapsides , qui comprendront plus tard l’ancêtre commun des mammifères ; et les sauropsides , qui comprennent désormais les tortues , les lézards , les serpents , les crocodiliens et lesdinosaures (y compris les oiseaux ). [21] Les synapsides ont un seul trou ( fenestra temporale ) bas de chaque côté du crâne. Les synapsides primitives comprenaient les animaux les plus grands et les plus féroces du début du Permien , tels que Dimetrodon . [22] Les synapsides non mammifères étaient traditionnellement – et à tort – appelées “reptiles ressemblant à des mammifères” ou pelycosaures ; nous savons maintenant qu’ils n’étaient ni des reptiles ni une partie de la lignée des reptiles. [23] [24]
Les thérapsides , un groupe de synapsides, ont évolué au Permien moyen , il y a environ 265 millions d’années, et sont devenus les vertébrés terrestres dominants. [23] Ils diffèrent des eupelycosaurs basaux par plusieurs caractéristiques du crâne et des mâchoires, notamment: des crânes et des incisives plus grands qui sont de taille égale chez les thérapsides, mais pas pour les eupelycosaures. [23] La lignée thérapside menant aux mammifères est passée par une série d’étapes, commençant par des animaux très similaires à leurs premiers ancêtres synapsides et se terminant par des cynodontes probainognathes , dont certains pouvaient facilement être confondus avec des mammifères. Ces étapes étaient caractérisées par : [25]
- Le développement progressif d’un palais secondaire osseux .
- Progression vers une posture des membres dressés, qui augmenterait l’endurance des animaux en évitant la contrainte de Carrier . Mais ce processus était lent et irrégulier : par exemple, tous les thérapsides herbivores non mammifères conservaient des membres tentaculaires (certaines formes tardives pouvaient avoir des membres postérieurs semi-dressés) ; Les thérapsides carnivores du Permien avaient des membres antérieurs tentaculaires, et certains du Permien tardif avaient également des membres postérieurs semi-tentaculaires. En fait, les monotrèmes modernes ont encore des membres semi-étendus.
- Le dentaire est progressivement devenu l’os principal de la mâchoire inférieure qui, au Trias, a progressé vers la mâchoire entièrement mammifère (la partie inférieure constituée uniquement du dentaire) et l’oreille moyenne (qui est construite par les os qui étaient auparavant utilisés pour construire les mâchoires). de reptiles).
Premiers mammifères
L’ événement d’extinction du Permien-Trias il y a environ 252 millions d’années, qui était un événement prolongé en raison de l’accumulation de plusieurs impulsions d’extinction, a mis fin à la domination des thérapsides carnivores. [26] Au début du Trias, la plupart des niches de carnivores terrestres de taille moyenne à grande ont été occupées par des archosaures [27] qui, sur une longue période (35 millions d’années), en sont venus à inclure les crocodylomorphes , [28] les ptérosaures et les dinosaures ; [29] cependant, de grands cynodontes comme le Trucidocynodon et les traversodontidésoccupaient encore respectivement des niches carnivores et herbivores de grande taille. Au Jurassique, les dinosaures en étaient venus à dominer également les grandes niches d’herbivores terrestres. [30]
Les premiers mammifères (au sens de Kemp) sont apparus à l’époque du Trias supérieur (il y a environ 225 millions d’années), 40 millions d’années après les premiers thérapsides. Ils se sont développés hors de leur niche d’ insectivore nocturne à partir du milieu du Jurassique; [31] Le Jurassic Castorocauda , par exemple, était un proche parent de vrais mammifères qui avaient des adaptations pour nager, creuser et attraper des poissons. [32] On pense que la plupart, sinon tous, sont restés nocturnes (le goulot d’étranglement nocturne ), ce qui explique une grande partie des traits typiques des mammifères. [33] La majorité des espèces de mammifères qui existaient à l’ ère mésozoïque étaient des multituberculés, des eutriconodontes et des spalacothériides.. [34] Le métathérien le plus ancien connu est Sinodelphys , trouvé dans le schiste du Crétacé précoce vieux de 125 millions d’années dans la province du Liaoning, au nord-est de la Chine . Le fossile est presque complet et comprend des touffes de fourrure et des empreintes de tissus mous. [35]

 Restauration de Juramaia sinensis , le plus ancien euthérien connu (160 MYA) [36]
Restauration de Juramaia sinensis , le plus ancien euthérien connu (160 MYA) [36]
Le plus ancien fossile connu parmi les Eutheria (“vraies bêtes”) est la petite musaraigne Juramaia sinensis , ou “mère jurassique de Chine”, datée d’il y a 160 millions d’années à la fin du Jurassique. [36] Un parent euthérien ultérieur, Eomaia , daté d’il y a 125 millions d’années au début du Crétacé, possédait certaines caractéristiques en commun avec les marsupiaux mais pas avec les placentaires, preuve que ces caractéristiques étaient présentes chez le dernier ancêtre commun des deux groupes mais ont ensuite été perdus dans la lignée placentaire. [37] En particulier, les os épipubiens s’étendent vers l’avant à partir du bassin. On ne les trouve dans aucun placentaire moderne, mais on les trouve chez les marsupiaux, les monotrèmes, d’autres mammifères non thériens etUkhaatherium , un animal du début du Crétacé dans l’ordre euthérien Asioryctheria . Ceci s’applique également aux multituberculés. [38] Ils sont apparemment une caractéristique ancestrale, qui a ensuite disparu dans la lignée placentaire. Ces os épipubiens semblent fonctionner en raidissant les muscles pendant la locomotion, réduisant la quantité d’espace présenté, dont les placentaires ont besoin pour contenir leur fœtus pendant les périodes de gestation. Une sortie pelvienne étroite indique que les jeunes étaient très petits à la naissance et que la grossesse était donc courte, comme chez les marsupiaux modernes. Cela suggère que le placenta était un développement ultérieur. [39]
L’un des premiers monotrèmes connus était Teinolophos , qui vivait il y a environ 120 millions d’années en Australie. [40] Les monotrèmes ont certaines caractéristiques qui peuvent être héritées des amniotes d’origine, telles que le même orifice pour uriner, déféquer et se reproduire ( cloaque ) – comme le font également les lézards et les oiseaux – [41] et ils pondent des œufs coriaces et non calcifiés. [42]
Premières apparitions de fonctionnalités
Hadrocodium , dont les fossiles datent d’environ 195 millions d’années, au début du Jurassique , fournit la première preuve claire d’une articulation de la mâchoire formée uniquement par les os squamosal et dentaire ; il n’y a pas d’espace dans la mâchoire pour l’articulaire, un os impliqué dans les mâchoires de toutes les premières synapsides. [43]

 Fossile de Thrinaxodon au Muséum national d’histoire naturelle
Fossile de Thrinaxodon au Muséum national d’histoire naturelle
La première preuve claire de cheveux ou de fourrure se trouve dans les fossiles de Castorocauda et de Megaconus , datant d’il y a 164 millions d’années au milieu du Jurassique. Dans les années 1950, il a été suggéré que les foramens (passages) dans les maxillaires et les prémaxillaires (os à l’avant de la mâchoire supérieure) des cynodontes étaient des canaux qui alimentaient les vaisseaux sanguins et les nerfs des vibrisses ( moustaches ) et étaient donc des preuves de cheveux ou fourrure; [44] [45] il a été rapidement souligné, cependant, que les foramina ne montrent pas nécessairement qu’un animal avait des vibrisses, car le lézard moderne Tupinambis a des foramina qui sont presque identiques à ceux trouvés chez le cynodonte non mammifère Thrinaxodon. [24] [46] Des sources populaires, néanmoins, continuent d’attribuer des moustaches à Thrinaxodon . [47] Des études sur les coprolithes permiens suggèrent que les synapsides non mammifères de l’époque avaient déjà de la fourrure, remontant peut-être l’évolution des poils jusqu’aux dicynodontes . [48]
La date d’apparition de l’ endothermie dans l’évolution des mammifères est incertaine, bien qu’il soit généralement admis qu’elle a d’abord évolué chez des thérapsides non mammifères . [48] [49] Les monotrèmes modernes ont des températures corporelles plus basses et des taux métaboliques plus variables que les marsupiaux et les placentaires, [50] mais il existe des preuves que certains de leurs ancêtres, y compris peut-être des ancêtres des therians, peuvent avoir eu des températures corporelles comme celles de thériens modernes. [51] De même, certains therians modernes comme les afrotheres et les xenarthrans ont secondairement développé des températures corporelles plus basses. [52]
L’évolution des membres dressés chez les mammifères est incomplète – les monotrèmes vivants et fossiles ont des membres tentaculaires. La posture des membres parasagittal (non tentaculaire) est apparue à la fin du Jurassique ou au début du Crétacé ; on le trouve dans l’euthérien Eomaia et le métathérien Sinodelphys , tous deux datés d’il y a 125 millions d’années. [53] Les os épipubiens , une caractéristique qui a fortement influencé la reproduction de la plupart des clades de mammifères, sont d’abord trouvés chez les Tritylodontidae , suggérant qu’il s’agit d’une synapomorphie entre eux et les mammaliformes . Ils sont omniprésents chez les mammifères non placentaires, bien que Megazostrodon et Erythrotheriumsemblent en avoir manqué. [54]
Il a été suggéré que la fonction originale de la lactation ( production de lait ) était de garder les œufs humides. Une grande partie de l’argument est basé sur les monotrèmes, les mammifères pondeurs d’œufs. [55] [56] Dans les femelles humaines, les glandes mammaires deviennent entièrement développées pendant la puberté, indépendamment de la grossesse. [57]
Montée des mammifères
Les mammifères therians ont pris le contrôle des niches écologiques de taille moyenne à grande du Cénozoïque , après que l’ événement d’extinction du Crétacé-Paléogène il y a environ 66 millions d’années a vidé l’espace écologique autrefois rempli par des dinosaures non aviaires et d’autres groupes de reptiles, ainsi que divers autres groupes de mammifères, [58] et a subi une augmentation exponentielle de la taille du corps ( mégafaune ). [59] Puis les mammifères se sont diversifiés très rapidement ; les oiseaux et les mammifères montrent une augmentation exponentielle de la diversité. [58] Par exemple, la première chauve-souris connue date d’il y a environ 50 millions d’années, seulement 16 millions d’années après l’extinction des dinosaures non aviaires. [60]
Les études de phylogénétique moléculaire ont initialement suggéré que la plupart des ordres placentaires ont divergé il y a environ 100 à 85 millions d’années et que les familles modernes sont apparues dans la période allant de la fin de l’ Éocène au Miocène . [61] Cependant, aucun fossile placentaire n’a été trouvé avant la fin du Crétacé. [62] Les premiers fossiles incontestés de placentaires proviennent du début du Paléocène , après l’extinction des dinosaures non aviaires. [62] En particulier, les scientifiques ont identifié un animal du Paléocène précoce nommé Protungulatum donnae comme l’un des premiers mammifères placentaires. [63] cependant, il a été reclassé comme euthérien non placentaire.[64] Les recalibrages des taux de diversité génétique et morphologique ont suggéré une origine du Crétacé supérieur pour les placentaires et une origine du Paléocène pour la plupart des clades modernes. [65]
Le plus ancien ancêtre connu des primates est Archicebus achilles [66] d’il y a environ 55 millions d’années. [66] Ce minuscule primate pesait 20 à 30 grammes (0,7 à 1,1 once) et pouvait tenir dans une paume humaine. [66]
Anatomie
Caractéristiques distinctives
Les espèces vivantes de mammifères peuvent être identifiées par la présence de glandes sudoripares , y compris celles qui sont spécialisées dans la production de lait pour nourrir leurs petits. [67] Dans la classification des fossiles, cependant, d’autres caractéristiques doivent être utilisées, puisque les glandes des tissus mous et de nombreuses autres caractéristiques ne sont pas visibles dans les fossiles. [68]
De nombreux traits communs à tous les mammifères vivants sont apparus parmi les premiers membres du groupe :
- Articulation de la mâchoire – Le dentaire (l’os de la mâchoire inférieure, qui porte les dents) et le squamosal (un petit os crânien ) se rencontrent pour former l’articulation. Dans la plupart des gnathostomes , y compris les premiers thérapsides , l’articulation se compose de l’ articulaire (un petit os à l’arrière de la mâchoire inférieure) et du carré (un petit os à l’arrière de la mâchoire supérieure). [43]
- Oreille moyenne – Chez les mammifères du groupe de la couronne, le son est transporté du tympan par une chaîne de trois os, le marteau , l’ enclume et l’ étrier . Ancestralement, le marteau et l’enclume sont dérivés des os articulaires et carrés qui constituaient l’articulation de la mâchoire des premiers thérapsides. [69]
- Remplacement des dents – Les dents peuvent être remplacées une fois ( diphyodontie ) ou (comme chez les baleines à dents et les rongeurs muridés ) pas du tout ( monophyodontie ). [70] Les éléphants, les lamantins et les kangourous poussent continuellement de nouvelles dents tout au long de leur vie ( polyphyodontie ). [71]
- Émail prismatique – Le revêtement d’ émail à la surface d’une dent se compose de prismes, de structures solides en forme de bâtonnets s’étendant de la dentine à la surface de la dent. [72]
- Condyles occipitaux – Deux boutons à la base du crâne s’insèrent dans la vertèbre supérieure du cou ; la plupart des autres tétrapodes , en revanche, n’ont qu’un seul bouton de ce type. [73]
Pour la plupart, ces caractéristiques n’étaient pas présentes chez les ancêtres triasiques des mammifères. [74] Presque toutes les formes de mammifères possèdent un os épipubien, à l’exception des placentaires modernes. [75]
Dimorphisme sexuel
En moyenne, les mammifères mâles sont plus gros que les femelles, les mâles étant au moins 10 % plus gros que les femelles dans plus de 45 % des espèces étudiées. La plupart des ordres de mammifères présentent également un dimorphisme sexuel biaisé par les mâles , bien que certains ordres ne montrent aucun biais ou soient significativement biaisés par les femelles ( Lagomorpha ). Le dimorphisme de taille sexuelle augmente avec la taille corporelle chez les mammifères ( règle de Rensch), suggérant qu’il existe des pressions de sélection parallèles sur la taille des hommes et des femmes. Le dimorphisme biaisé par les mâles concerne la sélection sexuelle des mâles par le biais de la compétition mâle-mâle pour les femelles, car il existe une corrélation positive entre le degré de sélection sexuelle, tel qu’indiqué par les systèmes d’accouplement, et le degré de dimorphisme de taille biaisé par les mâles. Le degré de sélection sexuelle est également corrélé positivement avec la taille des mâles et des femelles chez les mammifères. De plus, une pression de sélection parallèle sur la masse féminine est identifiée dans la mesure où l’âge au sevrage est significativement plus élevé chez les femmes plus polygames.espèces, même en corrigeant la masse corporelle. De plus, le taux de reproduction est plus faible pour les femelles plus grandes, ce qui indique que la sélection de la fécondité sélectionne les femelles plus petites chez les mammifères. Bien que ces modèles soient valables pour l’ensemble des mammifères, il existe des variations considérables d’un ordre à l’autre. [76]
Systèmes biologiques

 Poumons de raton laveur gonflés manuellement
Poumons de raton laveur gonflés manuellement
La majorité des mammifères ont sept vertèbres cervicales (os du cou). Les exceptions sont le lamantin et le paresseux à deux doigts , qui en ont six, et le paresseux à trois doigts qui en a neuf. [77] Tous les cerveaux de mammifères possèdent un néocortex , une région cérébrale unique aux mammifères. [78] Les cerveaux placentaires ont un corps calleux , contrairement aux monotrèmes et aux marsupiaux. [79]
Les poumons des mammifères sont spongieux et alvéolés. La respiration est principalement réalisée avec le diaphragme , qui sépare le thorax de la cavité abdominale, formant un dôme convexe au thorax. La contraction du diaphragme aplatit le dôme, augmentant le volume de la cavité pulmonaire. L’air pénètre par les cavités buccale et nasale et se déplace à travers le larynx, la trachée et les bronches , et dilate les alvéoles . La relaxation du diaphragme a l’effet inverse, diminuant le volume de la cavité pulmonaire, provoquant l’expulsion de l’air des poumons. Pendant l’exercice, la paroi abdominale se contracte , augmentant la pression sur le diaphragme, ce qui expulse l’air plus rapidement et avec plus de force. La cage thoraciqueest capable de dilater et de contracter la cavité thoracique grâce à l’action d’autres muscles respiratoires. Par conséquent, l’air est aspiré ou expulsé des poumons, descendant toujours son gradient de pression. [80] [81] Ce type de poumon est connu sous le nom de poumon à soufflet en raison de sa ressemblance avec le soufflet de forgeron . [81]
Le cœur des mammifères a quatre chambres, deux oreillettes supérieures , les chambres de réception, et deux ventricules inférieurs , les chambres de décharge. [82] Le cœur a quatre valves, qui séparent ses chambres et assurent le flux sanguin dans la bonne direction à travers le cœur (empêchant le reflux). Après échange gazeux dans les capillaires pulmonaires (vaisseaux sanguins dans les poumons), le sang riche en oxygène retourne dans l’oreillette gauche via l’une des quatre veines pulmonaires. Le sang reflue presque continuellement dans l’oreillette, qui agit comme la chambre de réception, et de là à travers une ouverture dans le ventricule gauche. La plupart du sang circule passivement dans le cœur pendant que les oreillettes et les ventricules sont détendus, mais vers la fin de la période de relaxation ventriculaire , l’oreillette gauche se contracte, pompant le sang dans le ventricule. Le cœur a également besoin de nutriments et d’oxygène présents dans le sang, comme les autres muscles, et est alimenté par les artères coronaires . [83]






 Modèles didactiques d’un cœur de mammifère
Modèles didactiques d’un cœur de mammifère 
 Peau de mammifère : 1 — poils , 2 — épiderme , 3 — glande sébacée , 4 — muscle pili arrecteur , 5 — derme , 6 — follicule pileux , 7 — glande sudoripare , 8 (non étiqueté, la couche inférieure) — hypoderme , montrant rond adipocytes
Peau de mammifère : 1 — poils , 2 — épiderme , 3 — glande sébacée , 4 — muscle pili arrecteur , 5 — derme , 6 — follicule pileux , 7 — glande sudoripare , 8 (non étiqueté, la couche inférieure) — hypoderme , montrant rond adipocytes
Le système tégumentaire (peau) est composé de trois couches : l’ épiderme le plus externe , le derme et l’ hypoderme . L’épiderme est généralement épais de 10 à 30 cellules; sa fonction principale est de fournir une couche imperméable. Ses cellules les plus externes sont constamment perdues ; ses cellules les plus basses se divisent et poussent constamment vers le haut. La couche intermédiaire, le derme, est 15 à 40 fois plus épaisse que l’épiderme. Le derme est composé de nombreux composants, tels que des structures osseuses et des vaisseaux sanguins. L’hypoderme est constitué de tissu adipeux , qui stocke les lipides et assure le rembourrage et l’isolation. L’épaisseur de cette couche varie considérablement d’une espèce à l’autre; [84] : 97 mammifères marinsnécessitent un hypoderme épais ( graisse ) pour l’isolation, et les baleines franches ont le lard le plus épais à 20 pouces (51 cm). [85] Bien que d’autres animaux aient des caractéristiques telles que des moustaches, des plumes , des soies ou des cils qui lui ressemblent superficiellement, aucun animal autre que les mammifères n’a de poils . C’est une caractéristique définitive de la classe, bien que certains mammifères en aient très peu. [84] : 61



 Les carnassiers (dents tout au fond de la bouche) du protèle insectivore (à gauche) vs celui d’un loup gris (à droite) qui consomme de gros vertébrés
Les carnassiers (dents tout au fond de la bouche) du protèle insectivore (à gauche) vs celui d’un loup gris (à droite) qui consomme de gros vertébrés
Les herbivores ont développé une gamme variée de structures physiques pour faciliter la consommation de matériel végétal . Pour briser les tissus végétaux intacts, les mammifères ont développé des structures dentaires qui reflètent leurs préférences alimentaires. Par exemple, les frugivores (animaux qui se nourrissent principalement de fruits) et les herbivores qui se nourrissent de feuillage mou ont des dents à couronne basse spécialisées pour broyer le feuillage et les graines . Les animaux au pâturage qui ont tendance à manger des herbes dures et riches en silice ont des dents à couronne haute, capables de broyer les tissus végétaux durs et ne s’usent pas aussi rapidement que les dents à couronne basse. [86] La plupart des mammifères carnivores ont des carnassialiformesdents (de longueur variable selon le régime alimentaire), canines longues et modèles de remplacement de dents similaires. [87]
L’estomac des ongulés à doigts pairs (Artiodactyles) est divisé en quatre sections : le rumen , le réticulum , l’ omasum et la caillette (seuls les ruminants ont un rumen). Une fois consommée, la matière végétale est mélangée à la salive dans le rumen et le réticulum et se sépare en matière solide et liquide. Les solides s’agglutinent pour former un bolus (ou cud ) et sont régurgités. Lorsque le bolus pénètre dans la bouche, le liquide est expulsé avec la langue et avalé à nouveau. Les aliments ingérés passent dans le rumen et le réticulum où les microbes cellulolytiques ( bactéries , protozoaireset champignons ) produisent de la cellulase , qui est nécessaire pour décomposer la cellulose dans les plantes. [88] Les périssodactyles , contrairement aux ruminants, stockent les aliments digérés qui ont quitté l’estomac dans un caecum élargi , où ils sont fermentés par des bactéries. [89] Les carnivores ont un estomac simple adapté pour digérer principalement la viande, par rapport aux systèmes digestifs élaborés des animaux herbivores, qui sont nécessaires pour décomposer les fibres végétales dures et complexes. Le caecum est soit absent, soit court et simple, et le gros intestin n’est pas sacculé ou beaucoup plus large que l’intestin grêle. [90]

 Rein de bovin
Rein de bovin
Le système excréteur des mammifères implique de nombreux composants. Comme la plupart des autres animaux terrestres, les mammifères sont uréotériques et convertissent l’ammoniac en urée , ce qui est fait par le foie dans le cadre du cycle de l’ urée . [91] La bilirubine , un déchet dérivé des cellules sanguines , passe par la bile et l’urine à l’aide d’enzymes excrétées par le foie. [92] Le passage de la bilirubine via la bile à travers le tractus intestinal donne aux excréments de mammifères une coloration brune distinctive. [93]Les caractéristiques distinctives du rein des mammifères comprennent la présence du bassinet du rein et des pyramides rénales , ainsi que d’ un cortex et d’ une médulla clairement distinguables , ce qui est dû à la présence d’ anses allongées de Henle . Seul le rein des mammifères a une forme de haricot, bien qu’il y ait quelques exceptions, comme les reins multilobés réniculés des pinnipèdes, des cétacés et des ours. [94] [95] La plupart des mammifères placentaires adultes n’ont aucune trace restante du cloaque . Dans l’embryon, le cloaque embryonnairese divise en une région postérieure qui devient une partie de l’anus, et une région antérieure qui connaît des destins différents selon le sexe de l’individu : chez la femme, elle se développe en vestibule qui reçoit l’ urètre et le vagin , tandis que chez l’homme elle forme l’intégralité de l’ urètre pénien . [95] Cependant, les tenrecs , les taupes dorées et certaines musaraignes conservent un cloaque à l’âge adulte. [96] Chez les marsupiaux, le tractus génital est séparé de l’anus, mais une trace du cloaque d’origine reste à l’extérieur. [95] Les monotrèmes, qui se traduisent du grec par “trou unique”, ont un véritable cloaque.[97]
Réalisation sonore
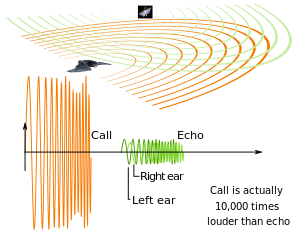
 Un diagramme des signaux ultrasonores émis par une chauve-souris et l’écho d’un objet proche
Un diagramme des signaux ultrasonores émis par une chauve-souris et l’écho d’un objet proche
Comme chez tous les autres tétrapodes, les mammifères ont un larynx qui peut s’ouvrir et se fermer rapidement pour produire des sons, et un conduit vocal supralaryngé qui filtre ce son. Les poumons et la musculature environnante fournissent le flux d’air et la pression nécessaires pour phoner . Le larynx contrôle la hauteur et le volume du son, mais la force exercée par les poumons pour expirer contribue également au volume. Les mammifères plus primitifs, tels que l’échidné, ne peuvent que siffler, car le son est obtenu uniquement en expirant à travers un larynx partiellement fermé. D’autres mammifères phonent en utilisant les cordes vocales . Le mouvement ou la tension des cordes vocales peut entraîner de nombreux sons tels que le ronronnementet hurlant . Les mammifères peuvent changer la position du larynx, leur permettant de respirer par le nez tout en avalant par la bouche, et de former des sons oraux et nasaux ; les sons nasaux, comme un gémissement de chien, sont généralement des sons doux, et les sons oraux, comme un aboiement de chien, sont généralement forts. [98]
0:17 Sons d’écholocation des bélugas
Certains mammifères ont un grand larynx et donc une voix grave, à savoir la chauve-souris à tête de marteau ( Hypsignathus monstrosus ) où le larynx peut occuper l’intégralité de la cavité thoracique tout en poussant les poumons, le cœur et la trachée dans l’ abdomen . [99] De grands coussinets vocaux peuvent également abaisser le ton, comme dans les rugissements graves des grands félins . [100] La production d’ infrasons est possible chez certains mammifères comme l’ éléphant d’Afrique ( Loxodonta spp.) et les baleines à fanons . [101] [102]Les petits mammifères avec de petits larynx ont la capacité de produire des ultrasons , qui peuvent être détectés par des modifications de l’ oreille moyenne et de la cochlée . Les ultrasons sont inaudibles pour les oiseaux et les reptiles, ce qui aurait pu être important au cours du Mésozoïque, lorsque les oiseaux et les reptiles étaient les prédateurs dominants. Ce canal privé est utilisé par certains rongeurs dans, par exemple, la communication mère-chiot, et par les chauves-souris lors de l’écholocalisation. Les baleines à dents utilisent également l’écholocation, mais, contrairement à la membrane vocale qui s’étend vers le haut à partir des cordes vocales, elles ont un melon pour manipuler les sons. Certains mammifères, à savoir les primates, ont des sacs aériens attachés au larynx, qui peuvent fonctionner pour abaisser les résonances ou augmenter le volume du son. [98]
Le système de production vocale est contrôlé par les noyaux des nerfs crâniens dans le cerveau, et alimenté par le nerf laryngé récurrent et le nerf laryngé supérieur , branches du nerf vague . Le conduit vocal est alimenté par le nerf hypoglosse et les nerfs faciaux . La stimulation électrique de la région grise périaqueducale (PEG) du mésencéphale des mammifères provoque des vocalisations. La capacité d’apprendre de nouvelles vocalisations n’est illustrée que chez les humains, les phoques, les cétacés, les éléphants et éventuellement les chauves-souris; chez l’homme, c’est le résultat d’une connexion directe entre le cortex moteur , qui contrôle le mouvement, et lemotoneurones de la moelle épinière. [98]
Fourrure

 Les porcs- épics utilisent leurs épines pour se défendre.
Les porcs- épics utilisent leurs épines pour se défendre.
La fonction principale de la fourrure des mammifères est la thermorégulation. D’autres incluent la protection, les objectifs sensoriels, l’imperméabilisation et le camouflage. [103] Différents types de fourrure ont des objectifs différents : [84] : 99
- Définitif – qui peut être perdu après avoir atteint une certaine longueur
- Vibrissae – poils sensoriels, le plus souvent des moustaches
- Pelage – poils de garde, sous-fourrure et poils d’arête
- Épines – poils de garde raides utilisés pour la défense (comme chez les porcs- épics )
- Soies – poils longs généralement utilisés dans les signaux visuels. (comme la crinière d’un lion )
- Velli – souvent appelé “fourrure de duvet” qui isole les mammifères nouveau-nés
- Laine – longue, douce et souvent bouclée
Thermorégulation
La longueur des poils n’est pas un facteur de thermorégulation : par exemple, certains mammifères tropicaux comme les paresseux ont la même longueur de fourrure que certains mammifères arctiques mais avec moins d’isolation ; et, à l’inverse, d’autres mammifères tropicaux à poil court ont la même valeur isolante que les mammifères arctiques. La densité de la fourrure peut augmenter la valeur isolante d’un animal, et les mammifères arctiques en particulier ont une fourrure dense; par exemple, le bœuf musqué a des poils de garde mesurant 30 cm (12 po) ainsi qu’un sous-poil dense, qui forme un pelage hermétique, leur permettant de survivre à des températures de -40 ° C (-40 ° F). [84] : 162–163 Certains mammifères du désert, comme les chameaux, utilisent une fourrure dense pour empêcher la chaleur solaire d’atteindre leur peau, permettant à l’animal de rester au frais. la fourrure d’un chameau peut atteindre 70 ° C (158 ° F) en été, mais la peau reste à 40 ° C (104 ° F). [84] : 188 Les mammifères aquatiques , à l’inverse, emprisonnent l’air dans leur fourrure pour conserver la chaleur en gardant la peau sèche. [84] : 162–163


Les manteaux des mammifères sont colorés pour diverses raisons, les principales pressions sélectives comprenant le camouflage , la sélection sexuelle , la communication et la thermorégulation. La coloration des cheveux et de la peau des mammifères est principalement déterminée par le type et la quantité de mélanine ; les eumélanines pour les couleurs brunes et noires et la phéomélanine pour une gamme de couleurs jaunâtres à rougeâtres, donnant aux mammifères un ton terreux . [104] [105] Certains mammifères ont des couleurs plus vives ; certains singes tels les mandrills et les singes vervets , et les opossums tels que les opossums souris mexicains et , les opossums laineux de Derby , ont la peau bleue due à la diffraction de la lumière dansfibres de collagène . [106] De nombreux paresseux semblent verts parce que leur fourrure abrite des algues vertes ; cela peut être une relation symbiotique qui offre un camouflage aux paresseux.[107]
Le camouflage a une influence puissante sur un grand nombre de mammifères, car il aide à dissimuler les individus aux prédateurs ou aux proies. [108] Chez les mammifères arctiques et subarctiques tels que le renard arctique ( Alopex lagopus ), le lemming à collier ( Dicrostonyx groenlandicus ), l’hermine ( Mustela erminea ) et le lièvre d’Amérique ( Lepus americanus ), changement de couleur saisonnier entre le brun en été et le blanc en hiver est principalement motivé par le camouflage. [109] Certains mammifères arboricoles, notamment les primates et les marsupiaux , ont des nuances de peau violette, verte ou bleue sur certaines parties de leur corps, indiquant un avantage distinct dans leur habitat principalement arboricole en raison deévolution convergente . [106]
L’aposématisme , mettant en garde contre d’éventuels prédateurs, est l’explication la plus probable du pelage noir et blanc de nombreux mammifères capables de se défendre, comme la mouffette nauséabonde et le blaireau puissant et agressif . [110] La couleur du pelage est parfois sexuellement dimorphe , comme chez de nombreuses espèces de primates . [111] Les différences dans la couleur du pelage des femelles et des mâles peuvent indiquer des niveaux nutritionnels et hormonaux, importants dans la sélection des partenaires. [112]La couleur du pelage peut influencer la capacité à retenir la chaleur, en fonction de la quantité de lumière réfléchie. Les mammifères avec un pelage de couleur plus foncée peuvent absorber plus de chaleur du rayonnement solaire et rester au chaud, et certains mammifères plus petits, tels que campagnols , ont une fourrure plus foncée en hiver. La fourrure blanche et sans pigment des mammifères arctiques, comme l’ours polaire, peut refléter plus de rayonnement solaire directement sur la peau. [84] : 166–167 [103] Les rayures noires et blanches éblouissantes des zèbres semblent fournir une certaine protection contre les mouches piqueuses. [113]
Système reproducteur

 Les chevreaux restent avec leur mère jusqu’à ce qu’ils soient sevrés.
Les chevreaux restent avec leur mère jusqu’à ce qu’ils soient sevrés.
Les mammifères sont uniquement gonochoriques (un animal naît avec des organes génitaux mâles ou femelles, par opposition aux hermaphrodites où il n’y a pas un tel schisme). [114] Dans les placentaires masculins, le pénis est utilisé à la fois pour la miction et la copulation. Selon l’espèce, une érection peut être alimentée par le flux sanguin dans les tissus vasculaires et spongieux ou par l’action musculaire. Un pénis peut être contenu dans un prépuce lorsqu’il n’est pas en érection, et certains placentaires ont également un os de pénis ( baculum ). [115] Les marsupiaux ont généralement des pénis fourchus, [116] tandis que l’ échidné a généralement quatre têtes avec seulement deux qui fonctionnent.[117] Les testicules de la plupart des mammifères descendent dans le scrotum qui est typiquement postérieur au pénis mais est souvent antérieur chez les marsupiaux. Les mammifères femelles ont généralement un clitoris , des grandes lèvres et des petites lèvres à l’extérieur, tandis que le système interne contient des oviductes appariés , 1–2 utérus , 1–2 cols et un vagin . Les marsupiaux ont deux vagins latéraux et un vagin médial. Le “vagin” des monotrèmes est mieux compris comme un “sinus urogénital”. Le système utérin des mammifères placentaires peut varier entre un duplex, où se trouvent deux utérus et des cols qui s’ouvrent dans le vagin, un bipartite, où deux cornes utérinesavoir un seul col qui se connecte au vagin, un bicorne , qui consiste en deux cornes utérines qui sont connectées distalement mais séparées médialement créant une forme en Y, et un simplex, qui a un seul utérus. [118] [119] [84] : 220–221, 247

 Kangourou arboricole de Matschie avec jeune en poche
Kangourou arboricole de Matschie avec jeune en poche
La condition ancestrale pour la reproduction des mammifères est la naissance d’œufs relativement peu développés, soit par viviparité directe, soit pendant une courte période sous forme d’œufs à coquille molle. Cela est probablement dû au fait que le torse ne pouvait pas se dilater en raison de la présence d’ os épipubiens . La plus ancienne démonstration de ce style de reproduction est avec Kayentatherium , qui a produit des périnates non développés , mais à des tailles de portée beaucoup plus élevées que n’importe quel mammifère moderne, 38 spécimens. [120] La plupart des mammifères modernes sont vivipares , donnant naissance à des jeunes vivants. Cependant, les cinq espèces de monotrème, l’ornithorynque et les quatre espèces d’échidné, pondent des œufs. Les monotrèmes ont un système de détermination du sexe différents de ceux de la plupart des autres mammifères. [121] En particulier, les chromosomes sexuelsd’un ornithorynque ressemblent plus à celles d’un poulet qu’à celles d’un mammifère therian. [122]
Les mammifères vivipares appartiennent à la sous-classe Theria ; ceux qui vivent aujourd’hui appartiennent aux infraclasses marsupiales et placentaires. Les marsupiaux ont une courte période de gestation , généralement plus courte que son cycle œstral et donnant généralement naissance à un certain nombre de nouveau-nés non développés qui subissent ensuite un développement ultérieur; chez de nombreuses espèces, cela se produit dans un sac en forme de poche, le marsupium , situé à l’avant de l’ abdomen de la mère . C’est la condition plésiomorphe chez les mammifères vivipares ; la présence d’os épipubiens chez tous les mammifères non placentaires empêche l’expansion du torse nécessaire à une grossesse complète. [75] Même les euthériens non placentaires se sont probablement reproduits de cette façon. [38]Les placentaires donnent naissance à des jeunes relativement complets et développés, généralement après de longues périodes de gestation. [123] Ils tirent leur nom du placenta , qui relie le fœtus en développement à la paroi utérine pour permettre l’absorption des nutriments. [124] Chez les mammifères placentaires, l’épipubien est soit complètement perdu, soit converti en baculum ; permettant au torse de pouvoir se dilater et ainsi donner naissance à une progéniture développée. [120]
Les glandes mammaires des mammifères sont spécialisées dans la production de lait, principale source de nutrition des nouveau-nés. Les monotrèmes se sont ramifiés tôt à partir d’autres mammifères et n’ont pas les mamelons que l’ on voit chez la plupart des mammifères, mais ils ont des glandes mammaires. Les jeunes lèchent le lait d’une tache mammaire sur le ventre de la mère. [125] Comparé aux mammifères placentaires, le lait des marsupiaux change considérablement à la fois dans le taux de production et dans la composition nutritionnelle, en raison des jeunes sous-développés. De plus, les glandes mammaires ont plus d’autonomie leur permettant de fournir des laits séparés aux petits à différents stades de développement. [126] Oligosaccharides de lactose est le principal sucre du lait placentaire des mammifères tandis que le lait monotrème et marsupial est dominé par . [127] Sevrage est le processus par lequel un mammifère devient moins dépendant du lait de sa mère et plus des aliments solides. [128]
Endothermie
Presque tous les mammifères sont endothermiques (“à sang chaud”). La plupart des mammifères ont aussi des poils pour les garder au chaud. Comme les oiseaux, les mammifères peuvent se nourrir ou chasser dans des conditions météorologiques et des climats trop froids pour les reptiles et les insectes ectothermes («à sang froid»). L’endothermie nécessite beaucoup d’énergie alimentaire, de sorte que les mammifères mangent plus de nourriture par unité de poids corporel que la plupart des reptiles. [129] Les petits mammifères insectivores mangent des quantités prodigieuses pour leur taille. Une rare exception, le rat-taupe nu produit peu de chaleur métabolique, il est donc considéré comme un poïkilotherme opérationnel . [130] Les oiseaux sont également endothermiques, donc l’endothermie n’est pas propre aux mammifères. [131]
Durée de vie des espèces
Parmi les mammifères, la durée de vie maximale des espèces varie considérablement (par exemple, la musaraigne a une durée de vie de deux ans, alors que la baleine boréale la plus âgée aurait 211 ans). [132] Bien que la base sous-jacente de ces différences de durée de vie soit encore incertaine, de nombreuses études indiquent que la capacité à réparer les dommages à l’ADN est un déterminant important de la durée de vie des mammifères. Dans une étude réalisée en 1974 par Hart et Setlow, [133] , il a été constaté que la capacité de réparation par excision de l’ADN augmentait systématiquement avec la durée de vie des espèces parmi sept espèces de mammifères. Il a été observé que la durée de vie des espèces était fortement corrélée à la capacité de reconnaître les cassures double brin de l’ADN ainsi qu’au niveau de la protéine de réparation de l’ADN. Ku80 . [132] Dans une étude des cellules de seize espèces de mammifères, on a constaté que les gènes employés dans la réparation de l’ADN étaient régulés positivement chez les espèces à plus longue durée de vie. [134] Le niveau cellulaire de l’enzyme de réparation de l’ADNLa poly ADP ribose polymérase s’est avérée corrélée à la durée de vie des espèces dans une étude portant sur 13 espèces de mammifères. [135] Trois études supplémentaires d’une variété d’espèces de mammifères ont également signalé une corrélation entre la durée de vie des espèces et la capacité de réparation de l’ADN. [136] [137] [138]
Locomotion
Terrestre 
 Démarche de course . Photographies d’ Eadweard Muybridge , 1887.
Démarche de course . Photographies d’ Eadweard Muybridge , 1887.
La plupart des vertébrés – les amphibiens, les reptiles et certains mammifères comme les humains et les ours – sont plantigrades , marchant sur l’ensemble du dessous du pied. De nombreux mammifères, comme les chats et les chiens, sont digitigrades , marchant sur la pointe des pieds, la plus grande longueur de foulée permettant plus de vitesse. Les mammifères digitigrades sont également souvent adeptes des mouvements silencieux. [139] Certains animaux comme les chevaux sont unguligrades , marchant sur la pointe des pieds. Cela augmente encore leur longueur de foulée et donc leur vitesse. [140] Quelques mammifères, à savoir les grands singes, sont également connus pour marcher sur leurs phalanges , du moins pour leurs pattes avant. Fourmiliers géants [141]et les ornithorynques [142] sont également des marcheurs d’articulation. Certains mammifères sont bipèdes , n’utilisant que deux membres pour la locomotion, ce que l’on peut voir, par exemple, chez les humains et les grands singes. Les espèces bipèdes ont un champ de vision plus large que les quadrupèdes, conservent plus d’énergie et ont la capacité de manipuler des objets avec leurs mains, ce qui facilite la recherche de nourriture. Au lieu de marcher, certains bipèdes sautillent, comme les kangourous et les rats kangourous . [143] [144]
Les animaux utiliseront différentes allures pour différentes vitesses, terrains et situations. Par exemple, les chevaux présentent quatre allures naturelles, l’ allure la plus lente du cheval est le pas , puis il y a trois allures plus rapides qui, de la plus lente à la plus rapide, sont le trot , le galop et le galop . Les animaux peuvent également avoir des allures inhabituelles qui sont utilisées occasionnellement, comme pour se déplacer latéralement ou vers l’arrière. Par exemple, les principales allures humaines sont la marche et la course bipèdes , mais elles emploient occasionnellement de nombreuses autres allures, y compris le crawl à quatre pattes dans des espaces restreints. [145] Les mammifères présentent une vaste gamme d’ allures, l’ordre qu’ils placent et soulèvent leurs appendices dans la locomotion. Les démarches peuvent être regroupées en catégories en fonction de leurs schémas de séquence d’appui. Pour les quadrupèdes, il existe trois catégories principales : les allures de marche, les allures de course et les allures de saut . [146] La marche est la démarche la plus courante, où certains pieds sont sur le sol à un moment donné, et que l’on retrouve chez presque tous les animaux à pattes. La course est considérée comme se produisant lorsqu’à certains points de la foulée, tous les pieds ne touchent pas le sol dans un moment de suspension. [145]
Arboricole 
 Les gibbons sont de très bons brachiateurs car leurs membres allongés leur permettent de se balancer facilement et de s’agripper aux branches.
Les gibbons sont de très bons brachiateurs car leurs membres allongés leur permettent de se balancer facilement et de s’agripper aux branches.
Les animaux arboricoles ont souvent des membres allongés qui les aident à traverser les espaces, à atteindre les fruits ou d’autres ressources, à tester la fermeté du support à venir et, dans certains cas, à se brachier (se balancer entre les arbres). [147] De nombreuses espèces arboricoles, telles que les porcs-épics arboricoles, les fourmiliers soyeux , les singes araignées et les opossums , utilisent des queues préhensiles pour saisir les branches. Chez le singe araignée, le bout de la queue a soit un patch nu, soit un tampon adhésif, ce qui augmente la friction. Les griffes peuvent être utilisées pour interagir avec des substrats rugueux et réorienter la direction des forces appliquées par l’animal. C’est ce qui permet aux écureuilsgrimper sur des troncs d’arbres si grands qu’ils sont essentiellement plats du point de vue d’un si petit animal. Cependant, les griffes peuvent interférer avec la capacité d’un animal à saisir de très petites branches, car elles peuvent s’enrouler trop loin et piquer la patte de l’animal. La préhension par friction est utilisée par les primates, en s’appuyant sur le bout des doigts sans poils. Presser la branche entre le bout des doigts génère une force de friction qui maintient la main de l’animal sur la branche. Cependant, ce type de préhension dépend de l’angle de la force de frottement, donc du diamètre de la branche, des branches plus grandes entraînant une capacité de préhension réduite. Pour contrôler la descente, en particulier le long des branches de grand diamètre, certains animaux arboricoles tels que les écureuils ont développé des articulations de la cheville très mobiles qui permettent de faire pivoter le pied dans une posture «inversée». Cela permet aux griffes de s’accrocher à la surface rugueuse de l’écorce, s’opposant à la force de gravité. La petite taille offre de nombreux avantages aux espèces arboricoles : comme l’augmentation de la taille relative des branches par rapport à l’animal, un centre de masse plus bas, une stabilité accrue, une masse plus faible (permettant le mouvement sur des branches plus petites) et la capacité de se déplacer dans un habitat plus encombré.[147] La taille liée au poids affecte les animaux planeurs comme le phalanger volant . [148] Certaines espèces de primates, de chauves-souris et toutes les espèces de paresseux atteignent une stabilité passive en se suspendant sous la branche. Le tangage et le basculement deviennent sans objet, car la seule méthode d’échec serait de perdre leur adhérence. [147]
Aérien 1:42 Ralenti et vitesse normale des chauves-souris frugivores égyptiennes volant
Les chauves-souris sont les seuls mammifères qui peuvent vraiment voler. Ils volent dans les airs à une vitesse constante en déplaçant leurs ailes de haut en bas (généralement avec un mouvement avant-arrière également). Parce que l’animal est en mouvement, il y a un certain flux d’air par rapport à son corps qui, combiné à la vitesse des ailes, génère un flux d’air plus rapide se déplaçant sur l’aile. Cela génère un vecteur de force de portance pointant vers l’avant et vers le haut, et un vecteur de force de traînée pointant vers l’arrière et vers le haut. Les composants vers le haut de ceux-ci contrecarrent la gravité, gardant le corps dans les airs, tandis que le composant avant fournit une poussée pour contrer à la fois la traînée de l’aile et du corps dans son ensemble. [149]
Les ailes des chauves-souris sont beaucoup plus fines et se composent de plus d’os que celles des oiseaux, ce qui permet aux chauves-souris de manœuvrer avec plus de précision et de voler avec plus de portance et moins de traînée. [150] [151] En repliant les ailes vers l’intérieur vers leur corps lors de la montée, ils utilisent 35% moins d’énergie pendant le vol que les oiseaux. [152] Les membranes sont délicates, se déchirent facilement ; cependant, le tissu de la membrane de la chauve-souris est capable de repousser, de sorte que de petites déchirures peuvent guérir rapidement. [153] La surface de leurs ailes est équipée de récepteurs tactiles sur de petites bosses appelées cellules de Merkel, également trouvé sur le bout des doigts humains. Ces zones sensibles sont différentes chez les chauves-souris, car chaque bosse a un petit poil au centre, ce qui la rend encore plus sensible et permet à la chauve-souris de détecter et de collecter des informations sur l’air circulant sur ses ailes, et de voler plus efficacement en changeant la forme. de ses ailes en réponse. [154]
Fossoriaux et souterrains 


 Wombat semi-fouisseur ( à gauche) vs taupe orientale entièrement fouisseuse (à droite)
Wombat semi-fouisseur ( à gauche) vs taupe orientale entièrement fouisseuse (à droite)
Un fouisseur (du latin fossor , signifiant « creuseur ») est un animal adapté au creusement qui vit principalement, mais pas uniquement, sous terre. Quelques exemples sont les blaireaux et les rats-taupes nus . De nombreuses espèces de rongeurs sont également considérées comme des fouisseurs car elles vivent dans des terriers la plupart du temps, mais pas toute la journée. Les espèces qui vivent exclusivement sous terre sont souterraines, et celles qui ont des adaptations limitées à un mode de vie fouisseur sous-fossorielles. Certains organismes sont fouisseurs pour aider à la régulation de la température tandis que d’autres utilisent l’habitat souterrain pour se protéger des prédateurs ou pour stocker de la nourriture . [155]
Les mammifères fouisseurs ont un corps fusiforme, plus épais au niveau des épaules et effilé au niveau de la queue et du nez. Incapables de voir dans les terriers sombres, la plupart ont des yeux dégénérés, mais la dégénérescence varie selon les espèces; les gaufres de poche , par exemple, ne sont que semi-fouisseurs et ont des yeux très petits mais fonctionnels, dans la taupe marsupiale entièrement fouisseuse, les yeux sont dégénérés et inutiles, les taupes talpa ont des yeux résiduels et la taupe cape dorée a une couche de peau couvrant les yeux . Les oreillettes externes sont également très petites ou absentes. Les mammifères vraiment fouisseurs ont des pattes courtes et robustes, car la force est plus importante que la vitesse pour un mammifère fouisseur, mais les mammifères semi-fouisseurs ont des pattes cursives.jambes. Les pattes avant sont larges et ont de fortes griffes pour aider à détacher la saleté lors de l’excavation des terriers, et les pattes arrière ont des sangles, ainsi que des griffes, ce qui aide à projeter la saleté décollée vers l’arrière. La plupart ont de grandes incisives pour empêcher la saleté de voler dans leur bouche. [156]
De nombreux mammifères fouisseurs tels que les musaraignes, les hérissons et les taupes ont été classés dans l’ordre désormais obsolète Insectivora . [157]
Aquatique Un groupe de dauphins communs à bec court nageant
Les mammifères entièrement aquatiques, les cétacés et les siréniens , ont perdu leurs pattes et ont une nageoire caudale pour se propulser dans l’eau. Le mouvement des batteurs est continu. Les baleines nagent en déplaçant leur nageoire caudale et le bas de leur corps de haut en bas, se propulsant par un mouvement vertical, tandis que leurs nageoires sont principalement utilisées pour la direction. Leur anatomie squelettique leur permet d’être des nageurs rapides. La plupart des espèces ont une nageoire dorsale pour s’empêcher de se retourner dans l’eau. [158] [159] Les douves des siréniens sont soulevées de haut en bas en longs coups pour faire avancer l’animal, et peuvent être tordues pour tourner. Les membres antérieurs sont des nageoires en forme de pagaie qui aident à tourner et à ralentir. [160]
Les mammifères semi-aquatiques , comme les pinnipèdes, ont deux paires de nageoires à l’avant et à l’arrière, les nageoires antérieures et les nageoires postérieures. Les coudes et les chevilles sont enfermés dans le corps. [161] [162] Les pinnipèdes ont plusieurs adaptations pour réduire la traînée . En plus de leur corps profilé, ils ont des réseaux lisses de faisceaux musculaires dans leur peau qui peuvent augmenter le flux laminaire et leur permettre de glisser plus facilement dans l’eau. Ils manquent également de pili arrecteur , de sorte que leur fourrure peut être profilée pendant qu’ils nagent. [163] Ils comptent sur leurs nageoires antérieures pour la locomotion à la manière d’une aile similaire aux pingouins et aux tortues marines .[164] Le mouvement de la nageoire avant n’est pas continu et l’animal glisse entre chaque coup. [162] Par rapport aux carnivores terrestres, les membres antérieurs sont de longueur réduite, ce qui donne aux muscles locomoteurs des articulations de l’épaule et du coude un plus grand avantage mécanique; [161] les nageoires postérieures servent de stabilisateurs. [163] D’autres mammifères semi-aquatiques comprennent les castors, les hippopotames , les loutres et les ornithorynques. [165] Les hippopotames sont de très grands mammifères semi-aquatiques, et leurs corps en forme de tonneau ontdes structures squelettiques graviportales , [166] adaptées pour porter leur poids énorme, et leur gravité spécifiqueleur permet de couler et de se déplacer au fond d’une rivière. [167]
Comportement
Communication et vocalisation


De nombreux mammifères communiquent en vocalisant. La communication vocale sert à de nombreuses fins, y compris dans les rituels d’accouplement, comme appels d’avertissement , [169] pour indiquer les sources de nourriture et à des fins sociales. Les mâles appellent souvent pendant les rituels d’accouplement pour éloigner les autres mâles et attirer les femelles, comme dans le rugissement des lions et des cerfs rouges . [170] Les chants de la baleine à bosse peuvent être des signaux pour les femelles ; [171] ils ont différents dialectes dans différentes régions de l’océan. [172] Les vocalisations sociales comprennent les appels territoriaux des gibbons et l’utilisation de la fréquence dansgrandes chauves-souris à nez de lance pour distinguer les groupes. [173] Le singe vervet lance un appel d’alarme distinct pour chacun d’au moins quatre prédateurs différents, et les réactions des autres singes varient en fonction de l’appel. Par exemple, si un cri d’alarme signale un python, les singes grimpent dans les arbres, tandis que l’alarme de l’aigle amène les singes à chercher une cachette au sol. [168] Les chiens de prairie ont également des appels complexes qui signalent le type, la taille et la vitesse d’un prédateur qui approche. [174] Les éléphants communiquent socialement avec une variété de sons, notamment des reniflements, des cris, des barrissements, des rugissements et des grondements. Certains des appels grondants sont infrasonores, en dessous de la portée auditive des humains, et peut être entendu par d’autres éléphants jusqu’à 9,7 km (6 miles) de distance à des moments fixes près du lever et du coucher du soleil. [175]
0:30 Appel d’Orca, y compris des clics d’écholocation occasionnels
Les mammifères signalent par une variété de moyens. Beaucoup émettent des signaux visuels anti-prédateurs , comme lorsque les cerfs et les gazelles se taisent , indiquant honnêtement leur condition physique et leur capacité à s’échapper, [176] [177] ou lorsque le cerf de Virginie et d’autres mammifères proies signalent avec des marques de queue bien visibles lorsqu’ils sont alarmés, informant le prédateur qu’il a été détecté. [178] De nombreux mammifères utilisent le marquage olfactif , parfois peut-être pour aider à défendre le territoire, mais probablement avec une gamme de fonctions à la fois au sein et entre les espèces. [179] [180] [181] Microchiroptères et baleines à dentsy compris les dauphins océaniques vocalisent à la fois socialement et en écholocation . [182] [183] [184]
Alimentation
Un échidné à bec court en quête d’insectes.
Maintenir une température corporelle élevée et constante coûte de l’énergie – les mammifères ont donc besoin d’une alimentation nutritive et abondante. Alors que les premiers mammifères étaient probablement des prédateurs, différentes espèces se sont depuis adaptées pour répondre à leurs besoins alimentaires de diverses manières. Certains mangent d’autres animaux – il s’agit d’un régime carnivore (et comprend les régimes insectivores). D’autres mammifères, appelés herbivores , se nourrissent de plantes, qui contiennent des glucides complexes comme la cellulose. Un régime herbivore comprend des sous-types tels que le granivore (manger des graines), le folivory (manger des feuilles), le frugivory (manger des fruits), le nectarivory (manger du nectar), le gummivory (manger de la gomme) etmycophagie (manger des champignons). Le tube digestif d’un herbivore est l’hôte de bactéries qui fermentent ces substances complexes et les rendent disponibles pour la digestion, qui sont soit logées dans l’ estomac à plusieurs chambres, soit dans un gros caecum. [88] Certains mammifères sont coprophages , consommant des matières fécales pour absorber les nutriments non digérés lors de la première ingestion de la nourriture. [84] : 131–137 Un omnivore mange à la fois des proies et des plantes. Les mammifères carnivores ont un tube digestif simple car les protéines , les lipides et les minérauxtrouvés dans la viande nécessitent peu de digestion spécialisée. Les exceptions à cela incluent les baleines à fanons qui abritent également la flore intestinale dans un estomac à plusieurs chambres, comme les herbivores terrestres. [185]
La taille d’un animal est également un facteur dans la détermination du type de régime alimentaire ( règle d’Allen ). Étant donné que les petits mammifères ont un rapport élevé entre la surface qui perd de la chaleur et le volume qui génère de la chaleur, ils ont tendance à avoir des besoins énergétiques élevés et un taux métabolique élevé . Les mammifères qui pèsent moins d’environ 18 onces (510 g; 1,1 lb) sont pour la plupart insectivores car ils ne peuvent pas tolérer le processus digestif lent et complexe d’un herbivore. Les animaux plus gros, en revanche, génèrent plus de chaleur et moins de cette chaleur est perdue. Ils peuvent donc tolérer soit un processus de collecte plus lent (carnivores qui se nourrissent de grands vertébrés), soit un processus digestif plus lent (herbivores). [186]De plus, les mammifères qui pèsent plus de 18 onces (510 g; 1,1 lb) ne peuvent généralement pas collecter suffisamment d’insectes pendant leurs heures d’éveil pour subvenir à leurs besoins. Les seuls grands mammifères insectivores sont ceux qui se nourrissent d’immenses colonies d’insectes ( fourmis ou termites ). [187]



 L’ ours noir américain hypocarnivore ( Ursus americanus ) vs l’ ours polaire hypercarnivore ( Ursus maritimus ) [188]
L’ ours noir américain hypocarnivore ( Ursus americanus ) vs l’ ours polaire hypercarnivore ( Ursus maritimus ) [188]
Certains mammifères sont omnivores et présentent divers degrés de carnivore et d’herbivorie, penchant généralement en faveur de l’un plus que de l’autre. Étant donné que les plantes et la viande sont digérées différemment, il y a une préférence pour l’un par rapport à l’autre, comme chez les ours où certaines espèces peuvent être principalement carnivores et d’autres principalement herbivores. [189] Ils sont regroupés en trois catégories : mésocarnivorie (50 à 70 % de viande), hypercarnivore (70 % et plus de viande) et hypocarnivore (50 % ou moins de viande). La dentition des hypocarnivores se compose de dents carnassières ternes et triangulaires destinées à broyer les aliments. Les hypercarnivores, cependant, ont des dents coniques et des carnassiers pointus destinés à couper, et dans certains cas des mâchoires fortes pour écraser les os, comme dans le cas deles hyènes , leur permettant de consommer des os ; certains groupes éteints, notamment les Machairodontinae , avaient des canines en forme de sabre . [188]
Certains carnivores physiologiques consomment de la matière végétale et certains herbivores physiologiques consomment de la viande. D’un point de vue comportemental, cela en ferait des omnivores, mais d’un point de vue physiologique, cela peut être dû à la zoopharmacognosie . Physiologiquement, les animaux doivent être capables d’obtenir à la fois de l’énergie et des nutriments à partir de matières végétales et animales pour être considérés comme omnivores. Ainsi, ces animaux peuvent toujours être classés comme carnivores et herbivores alors qu’ils ne font qu’obtenir des nutriments à partir de matériaux provenant de sources qui ne complètent apparemment pas leur classification. [190] Par exemple, il est bien documenté que certains ongulés tels que les girafes, les chameaux et les bovins rongeront les os pour consommer des minéraux et des nutriments particuliers. [191]De plus, les chats, qui sont généralement considérés comme des carnivores obligés, mangent occasionnellement de l’herbe pour régurgiter les matières indigestes (comme les boules de poils ), aider à la production d’hémoglobine et comme laxatif. [192]
De nombreux mammifères, en l’absence de besoins alimentaires suffisants dans un environnement, suppriment leur métabolisme et conservent leur énergie dans un processus connu sous le nom d’ hibernation . [193] Au cours de la période précédant l’hibernation, les grands mammifères, tels que les ours, deviennent polyphages pour augmenter les réserves de graisse, tandis que les petits mammifères préfèrent collecter et stocker de la nourriture. [194] Le ralentissement du métabolisme s’accompagne d’une diminution du rythme cardiaque et respiratoire, ainsi que d’une baisse des températures internes, qui peuvent se situer autour de la température ambiante dans certains cas. Par exemple, les températures internes des spermophiles arctiques en hibernation peuvent chuter à -2,9 ° C (26,8 ° F), mais la tête et le cou restent toujours au-dessus de 0 ° C (32 ° F). [195]Quelques mammifères des milieux chauds estivent en période de sécheresse ou de chaleur extrême, par exemple le lémurien nain à queue grasse ( Cheirogaleus medius ). [196]
Intelligence
Chez les mammifères intelligents, tels que les primates , le cerveau est plus gros par rapport au reste du cerveau. L’intelligence elle-même n’est pas facile à définir, mais les indications de l’intelligence incluent la capacité d’apprendre, associée à une flexibilité comportementale. Les rats , par exemple, sont considérés comme très intelligents, car ils peuvent apprendre et effectuer de nouvelles tâches, une capacité qui peut être importante lorsqu’ils colonisent pour la première fois un habitat frais . Chez certains mammifères, la cueillette de nourriture semble être liée à l’intelligence : un cerf se nourrissant de plantes a un cerveau plus petit qu’un chat, qui doit réfléchir pour déjouer sa proie. [187]

 Un bonobo pêchant les termites avec un bâton
Un bonobo pêchant les termites avec un bâton
L’utilisation d’outils par les animaux peut indiquer différents niveaux d’ apprentissage et de cognition . La loutre de mer utilise les roches comme éléments essentiels et réguliers de son comportement de recherche de nourriture (écraser les ormeaux des rochers ou casser des coquilles ouvertes), certaines populations passant 21% de leur temps à fabriquer des outils. [197] D’autres utilisations d’outils, telles que les chimpanzés utilisant des brindilles pour “pêcher” les termites, peuvent être développées en regardant les autres utiliser des outils et peuvent même être un véritable exemple d’enseignement animal. [198] Des outils peuvent même être utilisés pour résoudre des énigmes dans lesquelles l’animal semble vivre un “moment Eureka” . [199]D’autres mammifères qui n’utilisent pas d’outils, comme les chiens, peuvent également vivre un moment Eurêka. [200]
La taille du cerveau était auparavant considérée comme un indicateur majeur de l’intelligence d’un animal. Étant donné que la majeure partie du cerveau est utilisée pour maintenir les fonctions corporelles, des rapports plus élevés entre la masse cérébrale et la masse corporelle peuvent augmenter la quantité de masse cérébrale disponible pour des tâches cognitives plus complexes. L’analyse allométrique indique que la taille du cerveau des mammifères évolue à environ l’ exposant 2 ⁄ 3 ou 3 ⁄ 4 de la masse corporelle. La comparaison de la taille du cerveau d’un animal particulier avec la taille du cerveau attendue sur la base d’une telle analyse allométrique fournit un quotient d’encéphalisation qui peut être utilisé comme une autre indication de l’intelligence animale. [201] Les cachalots ont la plus grande masse cérébrale de tous les animaux sur terre, avec une moyenne de 8 000 centimètres cubes (490 pouces 3 ) et 7,8 kilogrammes (17 livres) chez les mâles matures. [202]
La conscience de soi semble être un signe de pensée abstraite. La conscience de soi, bien qu’elle ne soit pas bien définie, est considérée comme un précurseur de processus plus avancés tels que le raisonnement métacognitif . La méthode traditionnelle pour mesurer cela est le test du miroir , qui détermine si un animal possède la capacité d’auto-reconnaissance. [203] Les mammifères qui ont réussi le test du miroir comprennent les éléphants d’Asie (certains réussissent, d’autres non); [204] chimpanzés ; [205] bonobos ; [206] orangs-outans ; [207] humains , à partir de 18 mois ( stade miroir ) ; [208] grands dauphins [a][209] orques; [210] et faux épaulards. [210]
Structure sociale

 Les éléphantes femelles vivent en groupes stables, avec leur progéniture.
Les éléphantes femelles vivent en groupes stables, avec leur progéniture.
L’eusocialité est le plus haut niveau d’organisation sociale. Ces sociétés ont un chevauchement des générations adultes, la division du travail reproductif et la prise en charge coopérative des jeunes. Habituellement, les insectes, tels que les abeilles , les fourmis et les termites, ont un comportement eusocial, mais il est démontré chez deux espèces de rongeurs : le rat-taupe nu [211] et le rat-taupe du Damaraland . [212]
La présocialité se produit lorsque les animaux présentent plus que de simples interactions sexuelles avec des membres de la même espèce, mais ne sont pas qualifiés d’eusociaux. Autrement dit, les animaux présociaux peuvent afficher une vie communautaire, des soins coopératifs aux jeunes ou une division primitive du travail reproductif, mais ils ne présentent pas les trois traits essentiels des animaux eusociaux. Les humains et certaines espèces de Callitrichidae ( ouistitis et tamarins ) sont uniques parmi les primates dans leur degré de coopération avec les jeunes. [213] Harry Harlow a mis en place une expérience avec des singes rhésus, primates présociaux, en 1958 ; les résultats de cette étude ont montré que les rencontres sociales sont nécessaires pour que les jeunes singes se développent à la fois mentalement et sexuellement. [214]
Une société de fission-fusion est une société qui change fréquemment de taille et de composition, constituant un groupe social permanent appelé « groupe parent ». Les réseaux sociaux permanents se composent de tous les membres individuels d’une communauté et varient souvent pour suivre les changements dans leur environnement. Dans une société de fission-fusion, le groupe parent principal peut se fracturer (fission) en sous-groupes ou individus stables plus petits pour s’adapter aux circonstances environnementales ou sociales. Par exemple, un certain nombre de mâles peuvent se détacher du groupe principal afin de chasser ou de chercher de la nourriture pendant la journée, mais la nuit, ils peuvent revenir rejoindre (fusionner) le groupe principal pour partager de la nourriture et participer à d’autres activités. De nombreux mammifères le présentent, comme les primates (par exemple les orangs-outans et les singes araignées), [215] éléphants, [216] hyènes tachetées , [217] lions, [218] et dauphins. [219]
Les animaux solitaires défendent un territoire et évitent les interactions sociales avec les membres de son espèce, sauf pendant la saison de reproduction. Il s’agit d’éviter la concurrence des ressources, car deux individus de la même espèce occuperaient la même niche, et d’éviter l’épuisement de la nourriture. [220] Un animal solitaire, lorsqu’il se nourrit, peut également être moins visible pour les prédateurs ou les proies. [221]

 Les kangourous rouges “boxent” pour la domination
Les kangourous rouges “boxent” pour la domination
Dans une hiérarchie , les individus sont soit dominants, soit soumis. Une hiérarchie despotique est celle où un individu est dominant tandis que les autres sont soumis, comme chez les loups et les lémuriens, [222] et un ordre hiérarchique est un classement linéaire des individus où il y a un individu supérieur et un individu inférieur. Les ordres de picorage peuvent également être classés par sexe, où l’individu le plus bas d’un sexe a un classement plus élevé que l’individu le plus haut de l’autre sexe, comme chez les hyènes. [223] Les individus dominants, ou alphas, ont de fortes chances de succès reproducteur, en particulier dans les harems où un ou quelques mâles (mâles résidents) ont des droits de reproduction exclusifs sur les femelles d’un groupe. [224]Les mâles non-résidents peuvent également être acceptés dans les harems, mais certaines espèces, comme la chauve- souris vampire commune ( Desmodus rotundus ), peuvent être plus strictes. [225]
Certains mammifères sont parfaitement monogames , ce qui signifie qu’ils s’accouplent pour la vie et ne prennent aucun autre partenaire (même après la mort du compagnon d’origine), comme les loups, les castors eurasiens et les loutres. [226] [227] Il existe trois types de polygamie : un ou plusieurs mâles dominants ont des droits de reproduction ( polygynie ), plusieurs mâles avec lesquels les femelles s’accouplent (polyandrie), ou plusieurs mâles ont des relations exclusives avec plusieurs femelles ( polygynandrie ). Il est beaucoup plus courant que des accouplements polygynes se produisent, ce qui, à l’exclusion des leks , est estimé se produire chez jusqu’à 90% des mammifères. [228]L’accouplement de lek se produit lorsque les mâles se rassemblent autour des femelles et essaient de les attirer avec diverses parades nuptiales et vocalisations, comme chez les phoques communs. [229]
Tous les mammifères supérieurs (à l’exception des monotrèmes) partagent deux adaptations majeures pour les soins aux jeunes : la naissance vivante et la lactation. Celles-ci impliquent un choix à l’échelle du groupe d’un degré de garde parentale . Ils peuvent construire des nids et creuser des terriers pour y élever leurs petits, ou les nourrir et les garder souvent pendant une période prolongée. De nombreux mammifères sont K-sélectionnés et investissent plus de temps et d’énergie dans leurs petits que ne le font les r-sélectionnés.animaux. Lorsque deux animaux s’accouplent, ils partagent tous deux un intérêt pour le succès de la progéniture, bien que souvent à des extrêmes différents. Les femelles mammifères présentent un certain degré d’agressivité maternelle, un autre exemple de soins parentaux, qui peuvent être ciblés contre d’autres femelles de l’espèce ou les jeunes d’autres femelles; cependant, certains mammifères peuvent “tanter” les bébés d’autres femelles et s’occuper d’eux. Les mâles mammifères peuvent jouer un rôle dans l’éducation des enfants, comme pour les tenrecs, mais cela varie d’une espèce à l’autre, même au sein du même genre. Par exemple, les mâles du macaque à queue de cochon du sud ( Macaca nemestrina ) ne participent pas à la garde des enfants, contrairement aux mâles du macaque japonais ( M. fuscata ). [230]
Humains et autres mammifères
Dans la culture humaine

 Peinture rupestre du Paléolithique supérieur d’une variété de grands mammifères, Lascaux , c. 17 300 ans
Peinture rupestre du Paléolithique supérieur d’une variété de grands mammifères, Lascaux , c. 17 300 ans
Les mammifères non humains jouent une grande variété de rôles dans la culture humaine. Ils sont les animaux de compagnie les plus populaires , avec des dizaines de millions de chiens, de chats et d’autres animaux, dont des lapins et des souris, gardés par des familles du monde entier. [231] [232] [233] Les mammifères tels que les mammouths , les chevaux et les cerfs sont parmi les premiers sujets d’art, trouvés dans les peintures rupestres du Paléolithique supérieur comme à Lascaux . [234] Des artistes majeurs comme Albrecht Dürer , George Stubbs et Edwin Landseer sont connus pour leurs portraits de mammifères. [235]De nombreuses espèces de mammifères ont été chassées pour le sport et pour la nourriture ; le cerf et le sanglier sont particulièrement appréciés comme gibier . [236] [237] [238] Les mammifères tels que les chevaux et les chiens sont largement courus pour le sport, souvent combinés avec des paris sur le résultat . [239] [240] Il existe une tension entre le rôle des animaux en tant que compagnons des humains et leur existence en tant qu’individus avec des droits qui leur sont propres . [241] Les mammifères jouent en outre une grande variété de rôles dans la littérature, [242] [243] [244] le cinéma, [245]la mythologie et la religion. [246] [247] [248]
Utilisations et importance

 Les bovins sont élevés pour le lait depuis des milliers d’années.
Les bovins sont élevés pour le lait depuis des milliers d’années.
La domestication des mammifères a joué un rôle déterminant dans le développement néolithique de l’agriculture et de la civilisation , obligeant les agriculteurs à remplacer les chasseurs-cueilleurs dans le monde entier. [b] [250] Cette transition de la chasse et de la cueillette à l’élevage de troupeaux et à la culture de cultures a été une étape majeure dans l’histoire humaine. Les nouvelles économies agricoles, basées sur les mammifères domestiqués, ont provoqué “une restructuration radicale des sociétés humaines, des altérations mondiales de la biodiversité et des changements significatifs dans les reliefs de la Terre et son atmosphère … des résultats capitaux”. [251]
Les mammifères domestiques constituent une grande partie du bétail élevé pour la viande dans le monde. Ils comprennent (2009) environ 1,4 milliard de bovins , 1 milliard d’ ovins , 1 milliard de porcs domestiques , [252] [253] et (1985) plus de 700 millions de lapins. [254] Les animaux domestiques de travail, y compris les bovins et les chevaux, ont été utilisés pour le travail et le transport depuis les origines de l’agriculture, leur nombre diminuant avec l’arrivée des transports mécanisés et des machines agricoles .. En 2004, ils fournissaient encore quelque 80 % de l’électricité pour les petites exploitations du tiers monde, pour la plupart, et quelque 20 % des transports mondiaux, encore une fois principalement dans les zones rurales. Dans les régions montagneuses inadaptées aux véhicules à roues, les bêtes de somme continuent de transporter des marchandises. [255] Les peaux de mammifères fournissent du cuir pour les chaussures , les vêtements et les tissus d’ ameublement . [256] La laine de mammifères, dont les moutons, les chèvres et les alpagas , est utilisée depuis des siècles pour l’habillement. [257] [258]

 Les mammifères sauvages ne représentent que 4 % de tous les mammifères, tandis que les humains et leur bétail représentent 96 % de tous les mammifères en termes de biomasse. [259]
Les mammifères sauvages ne représentent que 4 % de tous les mammifères, tandis que les humains et leur bétail représentent 96 % de tous les mammifères en termes de biomasse. [259]
Les mammifères jouent un rôle majeur dans la science en tant qu’animaux de laboratoire , à la fois dans la recherche biologique fondamentale, comme la génétique, [260] et dans le développement de nouveaux médicaments, qui doivent être testés de manière exhaustive pour démontrer leur innocuité . [261] Des millions de mammifères, en particulier des souris et des rats, sont utilisés chaque année dans des expériences . [262] Une souris knock-out est une souris génétiquement modifiée avec un gène inactivé , remplacé ou perturbé par un morceau d’ADN artificiel. Ils permettent l’étude de gènes séquencés dont les fonctions sont inconnues. [263]Un petit pourcentage des mammifères sont des primates non humains, utilisés dans la recherche pour leur similitude avec les humains. [264] [265] [266]
Malgré les avantages que les mammifères domestiqués avaient pour le développement humain, les humains ont un effet de plus en plus néfaste sur les mammifères sauvages à travers le monde. Il a été estimé que la masse de tous les mammifères sauvages a diminué à seulement 4% de tous les mammifères, 96% des mammifères étant désormais des humains et leur bétail (voir figure). En fait, les mammifères sauvages terrestres ne représentent que 2 % de tous les mammifères. [267] [259]
Hybrides



 Un vrai quagga , 1870 (à gauche) contre un quagga de race , 2014 (à droite)
Un vrai quagga , 1870 (à gauche) contre un quagga de race , 2014 (à droite)
Les hybrides sont des descendants résultant de la reproduction de deux individus génétiquement distincts, ce qui se traduira généralement par un degré élevé d’hétérozygotie, bien que hybride et hétérozygote ne soient pas synonymes. L’hybridation délibérée ou accidentelle de deux ou plusieurs espèces d’animaux étroitement apparentés par l’élevage en captivité est une activité humaine qui existe depuis des millénaires et qui s’est développée à des fins économiques. [268] Hybrides entre différentes sous-espèces au sein d’une même espèce (comme entre le tigre du Bengale et le tigre de Sibérie) sont appelés hybrides intra-spécifiques. Les hybrides entre différentes espèces d’un même genre (comme entre les lions et les tigres) sont appelés hybrides ou croisements interspécifiques. Les hybrides entre différents genres (comme entre les moutons et les chèvres) sont appelés hybrides intergénériques. [269] Des hybrides naturels se produiront dans des zones hybrides , où deux populations d’espèces du même genre ou d’espèces vivant dans les mêmes zones ou dans des zones adjacentes se croiseront. Certains hybrides ont été reconnus comme des espèces, comme le loup rouge (bien que cela soit controversé). [270]
La sélection artificielle , l’ élevage sélectif délibéré d’animaux domestiques, est utilisée pour reproduire des animaux récemment éteints dans le but d’obtenir une race animale avec un phénotype qui ressemble à cet ancêtre de type sauvage éteint. Un hybride de reproduction (intraspécifique) peut être très similaire au type sauvage éteint en apparence, en niche écologique et dans une certaine mesure en génétique, mais le pool génétique initial de ce type sauvage est perdu à jamais avec son extinction . En conséquence, les races reproduites sont au mieux de vagues sosies de types sauvages disparus, comme le sont les bovins Heck des aurochs . [271]
Les espèces sauvages de race pure ayant évolué vers une écologie spécifique peuvent être menacées d’extinction [272] par le processus de pollution génétique , l’hybridation incontrôlée, l’ introgression génétique submergeant qui conduit à l’homogénéisation ou à la concurrence des espèces hybrides hétérosiques . [273] Lorsque de nouvelles populations sont importées ou reproduites sélectivement par les humains, ou lorsque la modification de l’habitat met en contact des espèces précédemment isolées, l’extinction de certaines espèces, en particulier des variétés rares, est possible. [274] Le métissage peut inonder le pool génétique plus rare et créer des hybrides, épuisant le pool génétique de race pure. Par exemple, les espèces en voie de disparitionLe buffle d’eau sauvage est le plus menacé d’extinction par la pollution génétique du buffle d’eau domestique . De telles extinctions ne sont pas toujours apparentes d’un point de vue morphologique . Un certain degré de flux de gènes est un processus évolutif normal, néanmoins, l’hybridation menace l’existence d’espèces rares. [275] [276]
Des menaces

 Biodiversité des espèces de grands mammifères par continent avant et après l’arrivée de l’homme
Biodiversité des espèces de grands mammifères par continent avant et après l’arrivée de l’homme
La perte d’espèces des communautés écologiques, la défaunation , est principalement motivée par l’activité humaine. [277] Cela a abouti à des forêts vides , des communautés écologiques appauvries de grands vertébrés. [278] [279] Dans l’ événement d’extinction du Quaternaire , la mortalité massive de la variété mégafaune a coïncidé avec l’apparition des humains, suggérant une influence humaine. Une hypothèse est que les humains ont chassé de grands mammifères, comme le mammouth laineux , jusqu’à leur extinction. [280] [281] Rapport d’évaluation mondial 2019 sur la biodiversité et les services écosystémiques de l’ IPBESaffirme que la biomasse totale des mammifères sauvages a diminué de 82 % depuis le début de la civilisation humaine. [282] [283] Les animaux sauvages ne représentent que 4 % de la biomasse des mammifères sur terre, tandis que les humains et leurs animaux domestiques en représentent 96 %. [259]
On prévoit que diverses espèces disparaîtront dans un proche avenir , [284] parmi lesquelles le rhinocéros , [285] les girafes , [286] et des espèces de primates [287] et de pangolins . [288] Selon le rapport Planète Vivante 2020 du WWF, les populations d’ animaux sauvages vertébrés ont diminué de 68 % depuis 1970 en raison des activités humaines, en particulier la surconsommation , la croissance démographique et l’agriculture intensive , ce qui est la preuve que les humains ont déclenché une sixième extinction de masse.un événement. [289] [290] La chasse à elle seule menace des centaines d’espèces de mammifères dans le monde. [291] [292] Les scientifiques affirment que la demande croissante de viande contribue à la perte de biodiversité car il s’agit d’un facteur important de déforestation et de destruction de l’habitat ; des habitats riches en espèces, tels que des portions importantes de la forêt amazonienne , sont convertis en terres agricoles pour la production de viande. [293] [294] [295] Une autre influence est la chasse excessive et le braconnage , qui peuvent réduire la population globale de gibier, [296]surtout ceux situés près des villages, [297] comme dans le cas des pécaris . [298] Les effets du braconnage sont particulièrement visibles dans le commerce de l’ivoire avec les éléphants d’Afrique. [299] Les mammifères marins sont exposés au risque d’enchevêtrement dans les engins de pêche, notamment les cétacés , avec des mortalités par rejet allant de 65 000 à 86 000 individus par an. [300]
Une attention particulière est accordée aux espèces menacées dans le monde, notamment par le biais de la Convention sur la diversité biologique , également connue sous le nom d’Accord de Rio, qui comprend 189 pays signataires qui se concentrent sur l’identification des espèces et des habitats menacés. [301] Une autre organisation de conservation notable est l’UICN, qui compte plus de 1 200 organisations gouvernementales et non gouvernementales . [302]
Les extinctions récentes peuvent être directement attribuées aux influences humaines. [303] [277] L’UICN caractérise les extinctions « récentes » comme celles qui se sont produites après le seuil de 1500, [304] et environ 80 espèces de mammifères ont disparu depuis cette époque et 2015. [305] Certaines espèces, comme le cerf du Père David [306] sont éteints à l’état sauvage , et ne survivent qu’en populations captives. D’autres espèces, telles que la panthère de Floride , sont écologiquement éteintes , survivant en si petit nombre qu’elles n’ont essentiellement aucun impact sur l’écosystème. [307] : 318 Les autres populations ne sont quelocalement éteint (disparu), existant toujours ailleurs, mais à distribution réduite, [307] : 75–77 comme avec l’extinction des baleines grises dans l’ Atlantique . [308]
Remarques
- ^ Une latence réduite pour s’approcher du miroir, des cercles répétitifs de la tête et une vision rapprochée des zones marquées étaient considérés comme des signes d’auto-reconnaissance car ils n’ont pas de bras et ne peuvent pas toucher les zones marquées. [209]
- ^ Diamond a discuté de cette question plus en détail dans son livre de 1997 Guns, Germs, and Steel . [249]
Voir également
- Liste des genres de mammifères – mammifères vivants
- Liste des mammalogistes
- Liste des monotrèmes et marsupiaux
- Liste des mammifères placentaires
- Liste des mammifères préhistoriques
- Liste des mammifères menacés des États-Unis
- Listes de mammifères par taille de population
- Listes des mammifères par région
- Mammifères décrits dans les années 2000
- Mammifères en culture
- Petit mammifère
Références
- ^ Vaughan TA, Ryan JM, Czaplewski NJ (2013). “Classification des Mammifères”. Mammologie (6 éd.). Jones et Bartlett Learning. ISBN 978-1-284-03209-3.
- ^ Simpson GG (1945). “Principes de classification et une classification des mammifères”. Musée américain d’histoire naturelle . 85 .
- ^ un b Szalay FS (1999). « Classification des mammifères au-dessus du niveau de l’espèce : examen ». Journal de paléontologie des vertébrés . 19 (1): 191–195. doi : 10.1080/02724634.1999.10011133 . JSTOR 4523980 .
- ^ un b Wilson D , Reeder D, eds. (2005). “Préface et matériel d’introduction” . Espèces de mammifères du monde: une référence taxonomique et géographique (3e éd.). Presse universitaire Johns Hopkins. p. xxvi. ISBN 978-0-8018-8221-0. OCLC 62265494 .
- ^ “Mammifères” . La liste rouge de l’UICN des espèces menacées . Union internationale pour la conservation de la nature (UICN). avril 2010 . Récupéré le 23 août 2016 .
- ^ Burgin CJ, Colella JP, Kahn PL, Upham NS (1er février 2018). « Combien d’espèces de mammifères y a-t-il ? » . Journal de Mammalogie . 99 (1): 1–14. doi : 10.1093/jmammal/gyx147 .
- ^ Rowe T (1988). “Définition, diagnostic et origine des mammifères” (PDF) . Journal de paléontologie des vertébrés . 8 (3): 241-264. doi : 10.1080/02724634.1988.10011708 .
- ^ Lyell C (1871). Les éléments de géologie de l’étudiant . Londres, Royaume-Uni : John Murray. p. 347.ISBN _ 978-1-345-18248-4.
- ^ Cifelli RL, Davis BM (décembre 2003). “Paléontologie. Origines marsupiales”. Sciences . 302 (5652): 1899–900. doi : 10.1126/science.1092272 . PMID 14671280 . S2CID 83973542 .
- ^ Kemp TS (2005). L’origine et l’évolution des mammifères (PDF) . Royaume-Uni : Oxford University Press. p. 3. ISBN 978-0-19-850760-4. OCLC 232311794 .
- ^ Datta PM (2005). “Le premier mammifère avec une molaire supérieure élargie transversalement de la formation de Tiki du Trias tardif (Carnian), bassin de South Rewa Gondwana, Inde”. Journal de paléontologie des vertébrés . 25 (1): 200–207. doi : 10.1671/0272-4634(2005)025[0200:EMWTEU]2.0.CO;2 .
- ^ Luo ZX, Martin T (2007). “Analyse de la structure molaire et de la phylogénie des genres Docodont” (PDF) . Bulletin du Carnegie Museum of Natural History . 39 : 27–47. doi : 10.2992/0145-9058(2007)39[27:AOMSAP]2.0.CO;2 . Archivé de l’original (PDF) le 3 mars 2016 . Récupéré le 8 avril 2013 .
- ^ McKenna MC, Bell SG (1997). Classification des mammifères au-dessus du niveau d’espèce . New York, NY : Columbia University Press. ISBN 978-0-231-11013-6. OCLC 37345734 .
- ^ Nilsson MA, Churakov G, Sommer M, Tran NV, Zemann A, Brosius J, Schmitz J (juillet 2010). “Suivi de l’évolution marsupiale à l’aide d’insertions de rétroposons génomiques archaïques” . PLOS Biologie . 8 (7) : e1000436. doi : 10.1371/journal.pbio.1000436 . PMC 2910653 . PMID 20668664 .
- ^ Kriegs JO, Churakov G, Kiefmann M, Jordan U, Brosius J, Schmitz J (avril 2006). “Éléments rétroposés comme archives pour l’histoire évolutive des mammifères placentaires” . PLOS Biologie . 4 (4) : e91. doi : 10.1371/journal.pbio.0040091 . PMC 1395351 . PMID 16515367 .
- ^ un b Nishihara H, Maruyama S, Okada N (mars 2009). “L’analyse des rétroposons et les données géologiques récentes suggèrent une divergence quasi simultanée des trois super-ordres de mammifères” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 106 (13): 5235–40. Bibcode : 2009PNAS..106.5235N . doi : 10.1073/pnas.0809297106 . PMC 2655268 . PMID 19286970 .
- ^ Springer MS, Murphy WJ, Eizirik E, O’Brien SJ (février 2003). “La diversification des mammifères placentaires et la limite Crétacé-Tertiaire” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 100 (3): 1056–61. Bibcode : 2003PNAS..100.1056S . doi : 10.1073/pnas.0334222100 . PMC 298725 . PMID 12552136 .
- ^ Tarver JE, Dos Reis M, Mirarab S, Moran RJ, Parker S, O’Reilly JE, et al. (janvier 2016). “Les Interrelations des Mammifères Placentaires et les Limites de l’Inférence Phylogénétique” . Biologie et évolution du génome . 8 (2) : 330–344. doi : 10.1093/gbe/evv261 . hdl : 1983/64d6e437-3320-480d-a16c-2e5b2e6b61d4 . PMC 4779606 . PMID 26733575 .
- ^ Meng J, Wang Y, Li C (avril 2011). “Oreille moyenne de mammifère de transition d’un nouvel eutriconodont Jehol du Crétacé”. Nature . 472 (7342): 181–5. Bibcode : 2011Natur.472..181M . doi : 10.1038/nature09921 . PMID 21490668 . S2CID 4428972 .
- ^ Ahlberg PE, Milner AR (avril 1994). “L’origine et la diversification précoce des tétrapodes”. Nature . 368 (6471): 507–514. Bibcode : 1994Natur.368..507A . doi : 10.1038/368507a0 . S2CID 4369342 .
- ^ “Amniota – Paléos” . Archivé de l’original le 2010-12-20.
- ^ “Aperçu de Synapsida – Palaeos” . Archivé de l’original le 2010-12-20.
- ^ un bc Kemp TS (juillet 2006). “L’origine et le rayonnement précoce des reptiles ressemblant à des mammifères thérapsides: une hypothèse paléobiologique” (PDF) . Journal de biologie évolutive . 19 (4): 1231–1247. doi : 10.1111/j.1420-9101.2005.01076.x . PMID 16780524 . S2CID 3184629 . Archivé de l’original (PDF) le 2021-03-08 . Récupéré le 14/01/2012 .
- ^ un b Bennett AF, Ruben JA (1986). “Le statut métabolique et thermorégulateur des thérapsides”. Dans Hotton III N, MacLean JJ, Roth J, Roth EC (eds.). L’écologie et la biologie des reptiles ressemblant à des mammifères . Washington, D.C. : Smithsonian Institution Press. p. 207–218. ISBN 978-0-87474-524-5.
- ^ Kermack DM, Kermack KA (1984). L’évolution des caractères des mammifères . Washington DC : Croom Helm. ISBN 978-0-7099-1534-8. OCLC 10710687 .
- ^ Tanner LH, Lucas SG, Chapman MG (2004). “Évaluer le dossier et les causes des extinctions du Trias tardif” (PDF) . Revues des sciences de la Terre . 65 (1–2) : 103–139. Bibcode : 2004ESRv…65..103T . doi : 10.1016/S0012-8252(03)00082-5 . Archivé de l’original le 25 octobre 2007. {{cite journal}}: CS1 maint: unfit URL (link)
- ^ Brusatte SL, Benton MJ, Ruta M, Lloyd GT (septembre 2008). “Supériorité, concurrence et opportunisme dans le rayonnement évolutif des dinosaures” (PDF) . Sciences . 321 (5895): 1485–8. Bibcode : 2008Sci…321.1485B . doi : 10.1126/science.1161833 . hdl : 20.500.11820/00556baf-6575-44d9-af39-bdd0b072ad2b . PMID 18787166 . S2CID 13393888 .
- ^ Gauthier JA (1986). « La monophylie saurischienne et l’origine des oiseaux ». Dans Padian K (éd.). L’origine des oiseaux et l’évolution du vol. Mémoires de l’Académie des sciences de Californie . Vol. 8. San Francisco : Académie des sciences de Californie. p. 1–55.
- ^ Sereno PC (1991). “Archosaures basaux: relations phylogénétiques et implications fonctionnelles”. Mémoires de la Société de paléontologie des vertébrés . 2 : 1–53. doi : 10.2307/3889336 . JSTOR 3889336 .
- ^ MacLeod N, Rawson PF, Forey PL, Banner FT, Boudagher-Fadel MK, Bown PR, et al. (1997). “La transition biotique Crétacé-Tertiaire”. Journal de la Société géologique . 154 (2): 265-292. Bibcode : 1997JGSoc.154..265M . doi : 10.1144/gsjgs.154.2.0265 . S2CID 129654916 .
- ^ Hunt DM, Hankins MW, Collin SP, Marshall NJ (4 octobre 2014). Évolution des pigments visuels et non visuels . Londres : Springer. p. 73. ISBN 978-1-4614-4354-4. OCLC 892735337 .
- ^ Bakalar N (2006). ” Jurassic ” Beaver ” trouvé; réécrit l’histoire des mammifères ” . Nouvelles géographiques nationales . Récupéré le 28 mai 2016 .
- ^ Hall MI, Kamilar JM, Kirk EC (décembre 2012). “La forme des yeux et le goulot d’étranglement nocturne des mammifères” . Actes de la Royal Society B: Sciences biologiques . 279 (1749): 4962–8. doi : 10.1098/rspb.2012.2258 . PMC 3497252 . PMID 23097513 .
- ^ Luo ZX (décembre 2007). “Transformation et diversification dans l’évolution précoce des mammifères”. Nature . 450 (7172): 1011–9. Bibcode : 2007Natur.450.1011L . doi : 10.1038/nature06277 . PMID 18075580 . S2CID 4317817 .
- ^ Pickrell J (2003). “Le plus ancien fossile de marsupial trouvé en Chine” . Nouvelles géographiques nationales . Récupéré le 28 mai 2016 .
- ^ un b Luo ZX, Yuan CX, Meng QJ, Ji Q (août 2011). “Un mammifère euthérien du Jurassique et divergence des marsupiaux et des placentaires”. Nature. 476(7361): 442–5. Bibcode:2011Natur.476..442L. doi:10.1038/nature10291. PMID21866158. S2CID205225806.
- ^ Ji Q, Luo ZX, Yuan CX, Wible JR, Zhang JP, Georgi JA (avril 2002). “Le premier mammifère euthérien connu”. Nature . 416 (6883): 816–22. Bibcode : 2002Natur.416..816J . doi : 10.1038/416816a . PMID 11976675 . S2CID 4330626 .
- ^ un b Novacek MJ, Rougier GW, Wible JR, McKenna MC, Dashzeveg D, Horovitz I (octobre 1997). “Os épipubiens chez les mammifères euthériens du Crétacé supérieur de Mongolie”. Nature . 389 (6650): 483–6. Bibcode : 1997Natur.389..483N . doi : 10.1038/39020 . PMID 9333234 . S2CID 205026882 .
- ^ Puissance ML, Schulkin J (2012). “Evolution de la naissance vivante chez les mammifères” . Évolution du placenta humain . Baltimore : presse universitaire Johns Hopkins. p. 68. ISBN 978-1-4214-0643-5.
- ^ Rowe T, Rich TH, Vickers-Rich P, Springer M, Woodburne MO (janvier 2008). “L’ornithorynque le plus ancien et son incidence sur le moment de divergence des clades d’ornithorynque et d’échidné” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 105 (4): 1238–1242. Bibcode : 2008PNAS..105.1238R . doi : 10.1073/pnas.0706385105 . PMC 2234122 . PMID 18216270 .
- ^ Grant T (1995). “Reproduction” . L’ornithorynque : un mammifère unique . Sydney : Université de Nouvelle-Galles du Sud. p. 55. ISBN 978-0-86840-143-0. OCLC 33842474 .
- ^ Goldman AS (juin 2012). “Evolution des fonctions immunitaires de la glande mammaire et protection du nourrisson”. Médecine de l’allaitement . 7 (3): 132–42. doi : 10.1089/bfm.2012.0025 . PMID 22577734 .
- ^ un b Rose KD (2006). Le début de l’ère des mammifères . Baltimore : presse universitaire Johns Hopkins. p. 82–83. ISBN 978-0-8018-8472-6. OCLC 646769601 .
- ^ Brink AS (1955). « Une étude sur le squelette de Diademodon ». Paléontologie Africaine . 3 : 3–39.
- ^ Kemp TS (1982). Reptiles ressemblant à des mammifères et origine des mammifères . Londres : Academic Press. p. 363.ISBN _ 978-0-12-404120-2. OCLC 8613180 .
- ^ Estes R (1961). “Anatomie crânienne du reptile cynodonte Thrinaxodon liorhinus “. Bulletin du Musée de zoologie comparée (1253): 165–180.
- ^ ” Thrinaxodon : Le Mammifère Émergent ” . Nouvelles quotidiennes du National Geographic. 11 février 2009 . Consulté le 26 août 2012 .
- ^ un b Bajdek P, Qvarnström M, Owocki K, Sulej T, Sennikov AG, Golubev VK, Niedźwiedzki G (2015). “Microbiote et résidus alimentaires, y compris des preuves possibles de poils pré-mammifères dans les coprolites du Permien supérieur de Russie”. Léthaïa . 49 (4): 455–477. doi : 10.1111/let.12156 .
- ^ Botha-Brink J, Angielczyk KD (2010). “Est-ce que des taux de croissance extraordinairement élevés chez les dicynodontes du Permo-Trias (Therapsida, Anomodontia) expliquent leur succès avant et après l’extinction de la fin du Permien?” . Journal zoologique de la Linnean Society . 160 (2): 341–365. doi : 10.1111/j.1096-3642.2009.00601.x .
- ^ Paul GS (1988). Dinosaures prédateurs du monde . New York : Simon et Schuster. p. 464 . ISBN 978-0-671-61946-6. OCLC 18350868 .
- ^ Watson JM, Graves JA (1988). “Cycles cellulaires monotrèmes et évolution de l’homéothermie”. Journal australien de zoologie . 36 (5): 573–584. doi : 10.1071/ZO9880573 .
- ^ McNab BK (1980). “L’énergétique et les limites de la distribution tempérée chez les tatous”. Journal de Mammalogie . 61 (4): 606–627. doi : 10.2307/1380307 . JSTOR 1380307 .
- ^ Kielan-Jaworowska Z, Hurum JH (2006). “Posture des membres chez les premiers mammifères : tentaculaire ou parasagittal” (PDF) . Acta Palaeontologica Polonica . 51 (3): 10237–10239.
- ^ Lillegraven JA, Kielan-Jaworowska Z, Clemens WA (1979). Mammifères mésozoïques : les deux premiers tiers de l’histoire des mammifères . Presse de l’Université de Californie. p. 321.ISBN _ 978-0-520-03951-3.OCLC 5910695 .
- ^ Oftedal OT (juillet 2002). “La glande mammaire et son origine au cours de l’évolution synapside”. Journal of Mammary Gland Biology and Neoplasia . 7 (3) : 225–252. doi : 10.1023/A:1022896515287 . PMID 12751889 . S2CID 25806501 .
- ^ Oftedal OT (juillet 2002). “L’origine de la lactation comme source d’eau pour les œufs en coquille de parchemin”. Journal of Mammary Gland Biology and Neoplasia . 7 (3): 253–266. doi : 10.1023/A:1022848632125 . PMID 12751890 . S2CID 8319185 .
- ^ “Développement des seins” . Hôpital pour enfants du Texas . Archivé de l’original le 13/01/2021 . Récupéré le 13 janvier 2021 .
- ^ un b Sahney S, Benton MJ, Ferry PA (août 2010). “Liens entre la diversité taxonomique globale, la diversité écologique et l’expansion des vertébrés sur terre” . Lettres de biologie . 6 (4) : 544–7. doi : 10.1098/rsbl.2009.1024 . PMC 2936204 . PMID 20106856 .
- ^ Smith FA, Boyer AG, Brown JH, Costa DP, Dayan T, Ernest SK, et al. (novembre 2010). “L’évolution de la taille corporelle maximale des mammifères terrestres”. Sciences . 330 (6008) : 1216–9. Bib code : 2010Sci …330.1216S . CiteSeerX 10.1.1.383.8581 . doi : 10.1126/science.1194830 . PMID 21109666 . S2CID 17272200 .
- ^ Simmons NB, Seymour KL, Habersetzer J, Gunnell GF (février 2008). “Chauve-souris primitive de l’Éocène précoce du Wyoming et l’évolution du vol et de l’écholocation” . Nature . 451 (7180): 818–21. Bibcode : 2008Natur.451..818S . doi : 10.1038/nature06549 . hdl : 2027.42/62816 . PMID 18270539 . S2CID 4356708 .
- ^ Bininda-Emonds OR, Cardillo M, Jones KE, MacPhee RD, Beck RM, Grenyer R, et al. (mars 2007). “L’augmentation retardée des mammifères actuels” (PDF) . Nature . 446 (7135): 507–12. Bibcode : 2007Natur.446..507B . doi : 10.1038/nature05634 . PMID 17392779 . S2CID 4314965 .
- ^ un b Wible JR, Rougier GW, Novacek MJ, Asher RJ (juin 2007). “Euthériens du Crétacé et origine Laurasienne pour les mammifères placentaires près de la limite K / T”. Nature . 447 (7147): 1003–6. Bibcode : 2007Natur.447.1003W . doi : 10.1038/nature05854 . PMID 17581585 . S2CID 4334424 .
- ^ O’Leary MA, Bloch JI, Flynn JJ, Gaudin TJ, Giallombardo A, Giannini NP, et al. (Février 2013). “L’ancêtre mammifère placentaire et le rayonnement post-K-Pg des placentaires” . Sciences . 339 (6120): 662–7. Bibcode : 2013Sci…339..662O . doi : 10.1126/science.1229237 . manche : 11336/7302 . PMID 23393258 . S2CID 206544776 .
- ^ Halliday TJ, Upchurch P, Goswami A (février 2017). “Résoudre les relations des mammifères placentaires du Paléocène” . Examens biologiques de la Cambridge Philosophical Society . 92 (1): 521–550. doi : 10.1111/brv.12242 . PMC 6849585 . PMID 28075073 .
- ^ Halliday TJ, Upchurch P, Goswami A (juin 2016). “Les euthériens ont connu des taux d’évolution élevés immédiatement après l’extinction massive du Crétacé-Paléogène” . Procédure. Sciences Biologiques . 283 (1833) : 20153026. doi : 10.1098/rspb.2015.3026 . PMC 4936024 . PMID 27358361 .
- ^ un bc Ni X, Gebo DL, Dagosto M, Meng J, Tafforeau P, Flynn JJ, Beard KC (juin 2013). “Le plus ancien squelette de primate connu et l’évolution précoce de l’haplorhine”. Nature . 498 (7452): 60–4. Bibcode : 2013Natur.498…60N . doi : 10.1038/nature12200 . PMID 23739424 . S2CID 4321956 .
- ^ Romer SA, Parsons TS (1977). Le corps des vertébrés . Philadelphie : Holt-Saunders International. p. 129–145. ISBN 978-0-03-910284-5. OCLC 60007175 .
- ^ Purves WK, Sadava DE, Orians GH, Helle HC (2001). La vie: La science de la biologie (6 éd.). New York : Sinauer Associates, Inc. p. 593.ISBN _ 978-0-7167-3873-2. OCLC 874883911 .
- ^ Anthwal N, Joshi L, Tucker AS (janvier 2013). « Évolution de l’oreille moyenne et de la mâchoire des mammifères : adaptations et nouvelles structures » . Revue d’Anatomie . 222 (1): 147–60. doi : 10.1111/j.1469-7580.2012.01526.x . PMC 3552421 . PMID 22686855 .
- ^ van Nievelt AF, Smith KK (2005). “Remplacer ou ne pas remplacer: l’importance du remplacement fonctionnel réduit des dents chez les mammifères marsupiaux et placentaires”. Paléobiologie . 31 (2): 324–346. doi : 10.1666/0094-8373(2005)031[0324:trontr]2.0.co;2 .
- ^ Libertini G, Ferrara N (avril 2016). “Vieillissement des cellules pérennes et des parties d’organes selon le paradigme du vieillissement programmé” . Âge . 38 (2): 35. doi : 10.1007/s11357-016-9895-0 . PMC 5005898 . PMID 26957493 .
- ^ Mao F, Wang Y, Meng J (2015). “Une étude systématique sur les microstructures de l’émail dentaire de Lambdopsalis bulla (multituberculé, Mammalia) – Implications pour la biologie et la phylogénie multituberculées” . PLOS ONE . 10 (5) : e0128243. Bibcode : 2015PLoSO..1028243M . doi : 10.1371/journal.pone.0128243 . PMC 4447277 . PMID 26020958 .
- ^ Osborn HF (1900). “Origine des mammifères, III. Condyles occipitaux de type tripartite reptilien” . Le naturaliste américain . 34 (408): 943–947. doi : 10.1086/277821 . JSTOR 2453526 .
- ^ Crompton AW, Jenkins Jr FA (1973). “Mammifères de Reptiles: Une Revue des Origines Mammifères”. Revue annuelle des sciences de la Terre et des planètes . 1 : 131–155. Bibcode : 1973AREPS…1..131C . faire : 10.1146/annurev.ea.01.050173.001023 .
- ^ un b Puissance ML, Schulkin J (2013). L’évolution du placenta humain . Baltimore : presse universitaire Johns Hopkins. pages 1890–1891. ISBN 978-1-4214-0643-5. OCLC 940749490 .
- ^ Lindenfors P, Gittleman JL, Jones KE (2007). “Dimorphisme de taille sexuelle chez les mammifères”. Sexe, taille et rôles de genre : études évolutives du dimorphisme sexuel de taille . Oxford : presse universitaire d’Oxford. p. 16–26. ISBN 978-0-19-920878-4.
- ^ Dierauf LA, Gulland FM (2001). CRC Handbook of Marine Mammal Medicine: Health, Disease, and Rehabilitation (2 éd.). Boca Raton : CRC Press. p. 154. ISBN 978-1-4200-4163-7. OCLC 166505919 .
- ^ Lui JH, Hansen DV, Kriegstein AR (juillet 2011). “Développement et évolution du néocortex humain” . Cellule . 146 (1): 18–36. doi : 10.1016/j.cell.2011.06.030 . PMC 3610574 . PMID 21729779 .
- ^ Keeler CE (juin 1933). “Absence du corps calleux en tant que personnage mendelisant chez la souris domestique” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 19 (6) : 609–611. Bibcode : 1933PNAS…19..609K . doi : 10.1073/pnas.19.6.609 . JSTOR 86284 . PMC 1086100 . PMID 16587795 .
- ^ Levitzky MG (2013). “Mécanique de la respiration”. Physiologie pulmonaire (8 éd.). New York : McGraw-Hill Medical. ISBN 978-0-07-179313-1. OCLC 940633137 .
- ^ a b Umesh KB (2011). “Pulmonary Anatomy and Physiology”. Handbook of Mechanical Ventilation (1 ed.). New Delhi: Jaypee Brothers Medical Publishing. p. 12. ISBN 978-93-80704-74-6. OCLC 945076700.
- ^ Standring S, Borley NR (2008). Gray’s anatomy: the anatomical basis of clinical practice (40 ed.). London: Churchill Livingstone. pp. 960–962. ISBN 978-0-8089-2371-8. OCLC 213447727.
- ^ Betts JF, Desaix P, Johnson E, Johnson JE, Korol O, Kruse D, et al. (2013). Anatomy & physiology. Houston: Rice University Press. pp. 787–846. ISBN 978-1-938168-13-0. OCLC 898069394.
- ^ a b c d e f g h i Feldhamer GA, Drickamer LC, Vessey SH, Merritt JF, Krajewski C (2007). Mammalogy: Adaptation, Diversity, Ecology (3 ed.). Baltimore: Johns Hopkins University Press. ISBN 978-0-8018-8695-9. OCLC 124031907.
- ^ Tinker SW (1988). Whales of the World. Brill Archive. p. 51. ISBN 978-0-935848-47-2.
- ^ Romer AS (1959). The vertebrate story (4 ed.). Chicago: University of Chicago Press. ISBN 978-0-226-72490-4.
- ^ de Muizon C, Lange-Badré B (1997). “Carnivorous dental adaptations in tribosphenic mammals and phylogenetic reconstruction”. Lethaia. 30 (4): 353–366. doi:10.1111/j.1502-3931.1997.tb00481.x.
- ^ a b Langer P (July 1984). “Comparative anatomy of the stomach in mammalian herbivores”. Quarterly Journal of Experimental Physiology. 69 (3): 615–25. doi:10.1113/expphysiol.1984.sp002848. PMID 6473699.
- ^ Vaughan TA, Ryan JM, Czaplewski NJ (2011). “Perissodactyla”. Mammalogy (5 ed.). Jones and Bartlett. p. 322. ISBN 978-0-7637-6299-5. OCLC 437300511.
- ^ Flower WH, Lydekker R (1946). An Introduction to the Study of Mammals Living and Extinct. London: Adam and Charles Black. p. 496. ISBN 978-1-110-76857-8.
- ^ Sreekumar S (2010). Basic Physiology. PHI Learning Pvt. Ltd. pp. 180–181. ISBN 978-81-203-4107-4.
- ^ Cheifetz AS (2010). Oxford American Handbook of Gastroenterology and Hepatology. Oxford: Oxford University Press, US. p. 165. ISBN 978-0-19-983012-1.
- ^ Kuntz E (2008). Hepatology: Textbook and Atlas. Germany: Springer. p. 38. ISBN 978-3-540-76838-8.
- ^ Ortiz RM (June 2001). “Osmoregulation in marine mammals”. The Journal of Experimental Biology. 204 (Pt 11): 1831–44. doi:10.1242/jeb.204.11.1831. PMID 11441026.
- ^ a b c Roman AS, Parsons TS (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. pp. 396–399. ISBN 978-0-03-910284-5.
- ^ Biological Reviews – Cambridge Journals
- ^ Dawkins R, Wong Y (2016). The Ancestor’s Tale: A Pilgrimage to the Dawn of Evolution (2nd ed.). Boston: Mariner Books. p. 281. ISBN 978-0-544-85993-7.
- ^ a b c Fitch WT (2006). “Production of Vocalizations in Mammals” (PDF). In Brown K (ed.). Encyclopedia of Language and Linguistics. Oxford: Elsevier. pp. 115–121.
- ^ Langevin P, Barclay RM (1990). “Hypsignathus monstrosus“. Mammalian Species. 357 (357): 1–4. doi:10.2307/3504110. JSTOR 3504110.
- ^ Weissengruber GE, Forstenpointner G, Peters G, Kübber-Heiss A, Fitch WT (September 2002). “Hyoid apparatus and pharynx in the lion (Panthera leo), jaguar (Panthera onca), tiger (Panthera tigris), cheetah (Acinonyxjubatus) and domestic cat (Felis silvestris f. catus)”. Journal of Anatomy. 201 (3): 195–209. doi:10.1046/j.1469-7580.2002.00088.x. PMC 1570911. PMID 12363272.
- ^ Stoeger AS, Heilmann G, Zeppelzauer M, Ganswindt A, Hensman S, Charlton BD (2012). “Visualizing sound emission of elephant vocalizations: evidence for two rumble production types”. PLOS ONE. 7 (11): e48907. Bibcode:2012PLoSO…748907S. doi:10.1371/journal.pone.0048907. PMC 3498347. PMID 23155427.
- ^ Clark CW (2004). “Baleen whale infrasonic sounds: Natural variability and function”. Journal of the Acoustical Society of America. 115 (5): 2554. Bibcode:2004ASAJ..115.2554C. doi:10.1121/1.4783845.
- ^ a b Dawson TJ, Webster KN, Maloney SK (February 2014). “The fur of mammals in exposed environments; do crypsis and thermal needs necessarily conflict? The polar bear and marsupial koala compared”. Journal of Comparative Physiology B. 184 (2): 273–84. doi:10.1007/s00360-013-0794-8. PMID 24366474. S2CID 9481486.
- ^ Slominski A, Tobin DJ, Shibahara S, Wortsman J (October 2004). “Melanin pigmentation in mammalian skin and its hormonal regulation”. Physiological Reviews. 84 (4): 1155–228. doi:10.1152/physrev.00044.2003. PMID 15383650. S2CID 21168932.
- ^ Hilton Jr B (1996). “South Carolina Wildlife”. Animal Colors. Hilton Pond Center. 43 (4): 10–15. Retrieved 26 November 2011.
- ^ a b Prum RO, Torres RH (May 2004). “Structural colouration of mammalian skin: convergent evolution of coherently scattering dermal collagen arrays” (PDF). The Journal of Experimental Biology. 207 (Pt 12): 2157–72. doi:10.1242/jeb.00989. hdl:1808/1599. PMID 15143148. S2CID 8268610.
- ^ Suutari M, Majaneva M, Fewer DP, Voirin B, Aiello A, Friedl T, et al. (March 2010). “Molecular evidence for a diverse green algal community growing in the hair of sloths and a specific association with Trichophilus welckeri (Chlorophyta, Ulvophyceae)”. BMC Evolutionary Biology. 10 (86): 86. doi:10.1186/1471-2148-10-86. PMC 2858742. PMID 20353556.
- ^ Caro T (2005). “The Adaptive Significance of Coloration in Mammals”. BioScience. 55 (2): 125–136. doi:10.1641/0006-3568(2005)055[0125:tasoci]2.0.co;2.
- ^ Mills LS, Zimova M, Oyler J, Running S, Abatzoglou JT, Lukacs PM (April 2013). “Camouflage mismatch in seasonal coat color due to decreased snow duration”. Proceedings of the National Academy of Sciences of the United States of America. 110 (18): 7360–5. Bibcode:2013PNAS..110.7360M. doi:10.1073/pnas.1222724110. PMC 3645584. PMID 23589881.
- ^ Caro T (February 2009). “Contrasting coloration in terrestrial mammals”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 364 (1516): 537–48. doi:10.1098/rstb.2008.0221. PMC 2674080. PMID 18990666.
- ^ Plavcan JM (2001). “Sexual dimorphism in primate evolution”. American Journal of Physical Anthropology. Suppl 33 (33): 25–53. doi:10.1002/ajpa.10011. PMID 11786990.
- ^ Bradley BJ, Gerald MS, Widdig A, Mundy NI (2012). “Coat Color Variation and Pigmentation Gene Expression in Rhesus Macaques (Macaca Mulatta)” (PDF). Journal of Mammalian Evolution. 20 (3): 263–270. doi:10.1007/s10914-012-9212-3. S2CID 13916535. Archived from the original (PDF) on 2015-09-24.
- ^ Caro T, Izzo A, Reiner RC, Walker H, Stankowich T (April 2014). “The function of zebra stripes”. Nature Communications. 5: 3535. Bibcode:2014NatCo…5.3535C. doi:10.1038/ncomms4535. PMID 24691390. S2CID 9849814.
- ^ Kobayashi K, Kitano T, Iwao Y, Kondo M (2018-06-01). Reproductive and Developmental Strategies: The Continuity of Life. Springer. p. 290. ISBN 978-4-431-56609-0.
- ^ Lombardi J (30 November 1998). Comparative Vertebrate Reproduction. Springer Science & Business Media. ISBN 978-0-7923-8336-9.
- ^ Tyndale-Biscoe H, Renfree M (30 January 1987). Reproductive Physiology of Marsupials. Cambridge University Press. ISBN 978-0-521-33792-2.
- ^ Johnston SD, Smith B, Pyne M, Stenzel D, Holt WV (2007). “One‐Sided Ejaculation of Echidna Sperm Bundles” (PDF). The American Naturalist. 170 (6): E162–E164. doi:10.1086/522847. PMID 18171162. S2CID 40632746.
- ^ Maxwell KE (2013). The Sex Imperative: An Evolutionary Tale of Sexual Survival. Springer. pp. 112–113. ISBN 978-1-4899-5988-1.
- ^ Vaughan TA, Ryan JP, Czaplewski NJ (2011). Mammalogy. Jones & Bartlett Publishers. p. 387. ISBN 978-0-03-025034-7.
- ^ a b Hoffman EA, Rowe TB (September 2018). “Jurassic stem-mammal perinates and the origin of mammalian reproduction and growth”. Nature. 561 (7721): 104–108. Bibcode:2018Natur.561..104H. doi:10.1038/s41586-018-0441-3. PMID 30158701. S2CID 205570021.
- ^ Wallis MC, Waters PD, Delbridge ML, Kirby PJ, Pask AJ, Grützner F, et al. (2007). “Sex determination in platypus and echidna: autosomal location of SOX3 confirms the absence of SRY from monotremes”. Chromosome Research. 15 (8): 949–59. doi:10.1007/s10577-007-1185-3. PMID 18185981. S2CID 812974.
- ^ Marshall Graves JA (2008). “Weird animal genomes and the evolution of vertebrate sex and sex chromosomes” (PDF). Annual Review of Genetics. 42: 565–86. doi:10.1146/annurev.genet.42.110807.091714. PMID 18983263. Archived from the original (PDF) on 2012-09-04.
- ^ Sally M (2005). “Mammal Behavior and Lifestyle”. Mammals. Chicago: Raintree. p. 6. ISBN 978-1-4109-1050-9. OCLC 53476660.
- ^ Verma PS, Pandey BP (2013). ISC Biology Book I for Class XI. New Delhi: S. Chand and Company. p. 288. ISBN 978-81-219-2557-0.
- ^ Oftedal OT (July 2002). “The mammary gland and its origin during synapsid evolution”. Journal of Mammary Gland Biology and Neoplasia. 7 (3): 225–52. doi:10.1023/a:1022896515287. PMID 12751889. S2CID 25806501.
- ^ Krockenberger A (2006). “Lactation”. In Dickman CR, Armati PJ, Hume ID (eds.). Marsupials. p. 109. ISBN 978-1-139-45742-2.
- ^ Schulkin J, Power ML (2016). Milk: The Biology of Lactation. Johns Hopkins University Press. p. 66. ISBN 978-1-4214-2042-4.
- ^ Thompson KV, Baker AJ, Baker AM (2010). “Paternal Care and Behavioral Development in Captive Mammals”. In Kleiman DG, Thompson KV, Baer CK (eds.). Wild Mammals in Captivity Principles and Techniques for Zoo Management (2nd ed.). University of Chicago Press. p. 374. ISBN 978-0-226-44011-8.
- ^ Campbell NA, Reece JB (2002). Biology (6th ed.). Benjamin Cummings. p. 845. ISBN 978-0-8053-6624-2. OCLC 47521441.
- ^ Buffenstein R, Yahav S (1991). “Is the naked mole-rat Hererocephalus glaber an endothermic yet poikilothermic mammal?”. Journal of Thermal Biology. 16 (4): 227–232. doi:10.1016/0306-4565(91)90030-6.
- ^ Schmidt-Nielsen K, Duke JB (1997). “Temperature Effects”. Animal Physiology: Adaptation and Environment (5 ed.). Cambridge. p. 218. ISBN 978-0-521-57098-5. OCLC 35744403.
- ^ a b Lorenzini A, Johnson FB, Oliver A, Tresini M, Smith JS, Hdeib M, et al. (2009). “Significant correlation of species longevity with DNA double strand break recognition but not with telomere length”. Mechanisms of Ageing and Development. 130 (11–12): 784–92. doi:10.1016/j.mad.2009.10.004. PMC 2799038. PMID 19896964.
- ^ Hart RW, Setlow RB (June 1974). “Correlation between deoxyribonucleic acid excision-repair and life-span in a number of mammalian species”. Proceedings of the National Academy of Sciences of the United States of America. 71 (6): 2169–73. Bibcode:1974PNAS…71.2169H. doi:10.1073/pnas.71.6.2169. PMC 388412. PMID 4526202.
- ^ Ma S, Upneja A, Galecki A, Tsai YM, Burant CF, Raskind S, et al. (November 2016). “Cell culture-based profiling across mammals reveals DNA repair and metabolism as determinants of species longevity”. eLife. 5. doi:10.7554/eLife.19130. PMC 5148604. PMID 27874830.
- ^ Grube K, Bürkle A (December 1992). “Poly(ADP-ribose) polymerase activity in mononuclear leukocytes of 13 mammalian species correlates with species-specific life span”. Proceedings of the National Academy of Sciences of the United States of America. 89 (24): 11759–63. Bibcode:1992PNAS…8911759G. doi:10.1073/pnas.89.24.11759. PMC 50636. PMID 1465394.
- ^ Francis AA, Lee WH, Regan JD (June 1981). “The relationship of DNA excision repair of ultraviolet-induced lesions to the maximum life span of mammals”. Mechanisms of Ageing and Development. 16 (2): 181–9. doi:10.1016/0047-6374(81)90094-4. PMID 7266079. S2CID 19830165.
- ^ Treton JA, Courtois Y (March 1982). “Correlation between DNA excision repair and mammalian lifespan in lens epithelial cells”. Cell Biology International Reports. 6 (3): 253–60. doi:10.1016/0309-1651(82)90077-7. PMID 7060140.
- ^ Maslansky CJ, Williams GM (February 1985). “Ultraviolet light-induced DNA repair synthesis in hepatocytes from species of differing longevities”. Mechanisms of Ageing and Development. 29 (2): 191–203. doi:10.1016/0047-6374(85)90018-1. PMID 3974310. S2CID 23988416.
- ^ “Leg and feet”. Avian Skeletal Adaptations. Archived from the original on 2008-04-04. Retrieved 3 August 2008.
- ^ Walker WF, Homberger DG (1998). Anatomy and Dissection of the Fetal Pig (5 ed.). New York: W. H. Freeman and Company. p. 3. ISBN 978-0-7167-2637-1. OCLC 40576267.
- ^ Orr CM (November 2005). “Knuckle-walking anteater: a convergence test of adaptation for purported knuckle-walking features of African Hominidae”. American Journal of Physical Anthropology. 128 (3): 639–58. doi:10.1002/ajpa.20192. PMID 15861420.
- ^ Fish FE, Frappell PB, Baudinette RV, MacFarlane PM (February 2001). “Energetics of terrestrial locomotion of the platypus Ornithorhynchus anatinus” (PDF). The Journal of Experimental Biology. 204 (Pt 4): 797–803. doi:10.1242/jeb.204.4.797. hdl:2440/12192. PMID 11171362.
- ^ Dhingra P (2004). “Comparative Bipedalism – How the Rest of the Animal Kingdom Walks on two legs”. Anthropological Science. 131 (231).
- ^ Alexander RM (May 2004). “Bipedal animals, and their differences from humans”. Journal of Anatomy. 204 (5): 321–30. doi:10.1111/j.0021-8782.2004.00289.x. PMC 1571302. PMID 15198697.
- ^ a b Dagg AI (1973). “Gaits in Mammals”. Mammal Review. 3 (4): 135–154. doi:10.1111/j.1365-2907.1973.tb00179.x.
- ^ Roberts TD (1995). Understanding Balance: The Mechanics of Posture and Locomotion. San Diego: Nelson Thornes. p. 211. ISBN 978-1-56593-416-0. OCLC 33167785.
- ^ a b c Cartmill M (1985). “Climbing”. In Hildebrand M, Bramble DM, Liem KF, Wake DB (eds.). Functional Vertebrate Morphology. Cambridge: Belknap Press. pp. 73–88. ISBN 978-0-674-32775-7. OCLC 11114191.
- ^ Vernes K (2001). “Gliding Performance of the Northern Flying Squirrel (Glaucomys sabrinus) in Mature Mixed Forest of Eastern Canada”. Journal of Mammalogy. 82 (4): 1026–1033. doi:10.1644/1545-1542(2001)082<1026:GPOTNF>2.0.CO;2.
- ^ Barba LA (October 2011). “Bats – the only flying mammals”. Bio-Aerial locomotion. Retrieved 20 May 2016.
- ^ “Bats In Flight Reveal Unexpected Aerodynamics”. ScienceDaily. 2007. Retrieved July 12, 2016.
- ^ Hedenström A, Johansson LC (March 2015). “Bat flight: aerodynamics, kinematics and flight morphology” (PDF). The Journal of Experimental Biology. 218 (Pt 5): 653–63. doi:10.1242/jeb.031203. PMID 25740899. S2CID 21295393.
- ^ “Bats save energy by drawing in wings on upstroke”. ScienceDaily. 2012. Retrieved July 12, 2016.
- ^ Karen T (2008). Hanging with Bats: Ecobats, Vampires, and Movie Stars. Albuquerque: University of New Mexico Press. p. 14. ISBN 978-0-8263-4403-8. OCLC 191258477.
- ^ Sterbing-D’Angelo S, Chadha M, Chiu C, Falk B, Xian W, Barcelo J, et al. (July 2011). “Bat wing sensors support flight control”. Proceedings of the National Academy of Sciences of the United States of America. 108 (27): 11291–6. Bibcode:2011PNAS..10811291S. doi:10.1073/pnas.1018740108. PMC 3131348. PMID 21690408.
- ^ Damiani, R, 2003, Earliest evidence of cynodont burrowing, The Royal Society Publishing, Volume 270, Issue 1525
- ^ Shimer HW (1903). “Adaptations to Aquatic, Arboreal, Fossorial and Cursorial Habits in Mammals. III. Fossorial Adaptations”. The American Naturalist. 37 (444): 819–825. doi:10.1086/278368. JSTOR 2455381. S2CID 83519668.
- ^ Stanhope MJ, Waddell VG, Madsen O, de Jong W, Hedges SB, Cleven GC, et al. (August 1998). “Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals”. Proceedings of the National Academy of Sciences of the United States of America. 95 (17): 9967–72. Bibcode:1998PNAS…95.9967S. doi:10.1073/pnas.95.17.9967. PMC 21445. PMID 9707584.
- ^ Perry DA (1949). “The anatomical basis of swimming in Whales”. Journal of Zoology. 119 (1): 49–60. doi:10.1111/j.1096-3642.1949.tb00866.x.
- ^ Fish FE, Hui CA (1991). “Dolphin swimming – a review” (PDF). Mammal Review. 21 (4): 181–195. doi:10.1111/j.1365-2907.1991.tb00292.x. Archived from the original (PDF) on 2006-08-29.
- ^ Marsh H (1989). “Chapter 57: Dugongidae” (PDF). Fauna of Australia. Vol. 1. Canberra: Australian Government Publications. ISBN 978-0-644-06056-1. OCLC 27492815. Archived from the original on 2013-05-11.{{cite book}}: CS1 maint: bot: original URL status unknown (link)
- ^ a b Berta A (April 2012). “Pinniped Diversity: Evolution and Adaptations”. Return to the Sea: The Life and Evolutionary Times of Marine Mammals. University of California Press. pp. 62–64. ISBN 978-0-520-27057-2.
- ^ a b Fish FE, Hurley J, Costa DP (February 2003). “Maneuverability by the sea lion Zalophus californianus: turning performance of an unstable body design”. The Journal of Experimental Biology. 206 (Pt 4): 667–74. doi:10.1242/jeb.00144. PMID 12517984.
- ^ a b Riedman M (1990). The Pinnipeds: Seals, Sea Lions, and Walruses. University of California Press. ISBN 978-0-520-06497-3. OCLC 19511610.
- ^ Fish FE (1996). “Transitions from drag-based to lift-based propulsion in mammalian swimming”. Integrative and Comparative Biology. 36 (6): 628–641. doi:10.1093/icb/36.6.628.
- ^ Fish FE (2000). “Biomechanics and energetics in aquatic and semiaquatic mammals: platypus to whale” (PDF). Physiological and Biochemical Zoology. 73 (6): 683–98. CiteSeerX 10.1.1.734.1217. doi:10.1086/318108. PMID 11121343. S2CID 49732160. Archived from the original (PDF) on 2016-08-04.
- ^ Eltringham SK (1999). “Anatomy and Physiology”. The Hippos. London: T & AD Poyser Ltd. p. 8. ISBN 978-0-85661-131-5. OCLC 42274422.
- ^ “Hippopotamus Hippopotamus amphibius“. National Geographic. Archived from the original on 2014-11-25. Retrieved 30 April 2016.
- ^ a b Seyfarth RM, Cheney DL, Marler P (1980). “Vervet Monkey Alarm Calls: Semantic communication in a Free-Ranging Primate”. Animal Behaviour. 28 (4): 1070–1094. doi:10.1016/S0003-3472(80)80097-2. S2CID 53165940.
- ^ Zuberbühler K (2001). “Predator-specific alarm calls in Campbell’s monkeys, Cercopithecus campbelli“. Behavioral Ecology and Sociobiology. 50 (5): 414–442. doi:10.1007/s002650100383. JSTOR 4601985. S2CID 21374702.
- ^ Slabbekoorn H, Smith TB (April 2002). “Bird song, ecology and speciation”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 357 (1420): 493–503. doi:10.1098/rstb.2001.1056. PMC 1692962. PMID 12028787.
- ^ Bannister JL (2008). “Baleen Whales (Mysticetes)”. In Perrin WF, Würsig B, Thewissen JG (eds.). Encyclopedia of Marine Mammals (2nd ed.). Academic Press. pp. 80–89. ISBN 978-0-12-373553-9.
- ^ Scott N (2002). “Creatures of Culture? Making the Case for Cultural Systems in Whales and Dolphins”. BioScience. 52 (1): 9–14. doi:10.1641/0006-3568(2002)052[0009:COCMTC]2.0.CO;2.
- ^ Boughman JW (February 1998). “Vocal learning by greater spear-nosed Bats“. Proceedings. Biological Sciences. 265 (1392): 227–33. doi:10.1098/rspb.1998.0286. PMC 1688873. PMID 9493408.
- ^ “Prairie dogs’ language decoded by scientists”. CBC News. 21 June 2013. Retrieved 20 May 2015.
- ^ Mayell H (3 March 2004). “Elephants Call Long-Distance After-Hours”. National Geographic. Retrieved 15 November 2016.
- ^ Smith JM, Harper D (2003). Animal Signals. Oxford Series in Ecology and Evolution. Oxford University Press. pp. 61–63. ISBN 978-0-19-852684-1. OCLC 54460090.
- ^ FitzGibbon CD, Fanshawe JH (1988). “Stotting in Thomson’s gazelles: an honest signal of condition” (PDF). Behavioral Ecology and Sociobiology. 23 (2): 69–74. doi:10.1007/bf00299889. S2CID 2809268. Archived from the original (PDF) on 2014-02-25.
- ^ Bildstein KL (May 1983). “Why White-Tailed Deer Flag Their Tails”. The American Naturalist. 121 (5): 709–715. doi:10.1086/284096. JSTOR 2460873. S2CID 83504795.
- ^ Gosling LM (January 1982). “A reassessment of the function of scent marking in territories”. Zeitschrift für Tierpsychologie. 60 (2): 89–118. doi:10.1111/j.1439-0310.1982.tb00492.x.
- ^ Zala SM, Potts WK, Penn DJ (March 2004). “Scent-marking displays provide honest signals of health and infection”. Behavioral Ecology. 15 (2): 338–44. doi:10.1093/beheco/arh022. hdl:10.1093/beheco/arh022.
- ^ Johnson RP (August 1973). “Scent Marking in Mammals”. Animal Behaviour. 21 (3): 521–535. doi:10.1016/S0003-3472(73)80012-0.
- ^ Schevill WE, McBride AF (1956). “Evidence for echolocation by cetaceans”. Deep-Sea Research. 3 (2): 153–154. Bibcode:1956DSR…..3..153S. doi:10.1016/0146-6313(56)90096-x.
- ^ Wilson W, Moss C (2004). Thomas J (ed.). Echolocation in Bats and Dolphins. Chicago University Press. p. 22. ISBN 978-0-226-79599-7. OCLC 50143737.
- ^ Au WW (1993). The Sonar of Dolphins. Springer-Verlag. ISBN 978-3-540-97835-0. OCLC 26158593.
- ^ Sanders JG, Beichman AC, Roman J, Scott JJ, Emerson D, McCarthy JJ, Girguis PR (September 2015). “Baleen whales host a unique gut microbiome with similarities to both carnivores and herbivores”. Nature Communications. 6: 8285. Bibcode:2015NatCo…6.8285S. doi:10.1038/ncomms9285. PMC 4595633. PMID 26393325.
- ^ Speaksman JR (1996). “Energetics and the evolution of body size in small terrestrial mammals” (PDF). Symposia of the Zoological Society of London (69): 69–81. Archived from the original (PDF) on 2021-06-02. Retrieved 2016-05-31.
- ^ a b Wilson DE, Burnie D, eds. (2001). Animal: The Definitive Visual Guide to the World’s Wildlife (1st ed.). DK Publishing. pp. 86–89. ISBN 978-0-7894-7764-4. OCLC 46422124.
- ^ a b Van Valkenburgh B (July 2007). “Deja vu: the evolution of feeding morphologies in the Carnivora”. Integrative and Comparative Biology. 47 (1): 147–63. doi:10.1093/icb/icm016. PMID 21672827.
- ^ Sacco T, van Valkenburgh B (2004). “Ecomorphological indicators of feeding behaviour in the bears (Carnivora: Ursidae)”. Journal of Zoology. 263 (1): 41–54. doi:10.1017/S0952836904004856.
- ^ Singer MS, Bernays EA (2003). “Understanding omnivory needs a behavioral perspective”. Ecology. 84 (10): 2532–2537. doi:10.1890/02-0397.
- ^ Hutson JM, Burke CC, Haynes G (2013-12-01). “Osteophagia and bone modifications by giraffe and other large ungulates”. Journal of Archaeological Science. 40 (12): 4139–4149. doi:10.1016/j.jas.2013.06.004.
- ^ “Why Do Cats Eat Grass?”. Pet MD. Retrieved 13 January 2017.
- ^ Geiser F (2004). “Metabolic rate and body temperature reduction during hibernation and daily torpor”. Annual Review of Physiology. 66: 239–74. doi:10.1146/annurev.physiol.66.032102.115105. PMID 14977403. S2CID 22397415.
- ^ Humphries MM, Thomas DW, Kramer DL (2003). “The role of energy availability in Mammalian hibernation: a cost-benefit approach”. Physiological and Biochemical Zoology. 76 (2): 165–79. doi:10.1086/367950. PMID 12794670. S2CID 14675451.
- ^ Barnes BM (June 1989). “Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator”. Science. 244 (4912): 1593–5. Bibcode:1989Sci…244.1593B. doi:10.1126/science.2740905. PMID 2740905.
- ^ Fritz G (2010). “Aestivation in Mammals and Birds”. In Navas CA, Carvalho JE (eds.). Aestivation: Molecular and Physiological Aspects. Progress in Molecular and Subcellular Biology. Vol. 49. Springer-Verlag. pp. 95–113. doi:10.1007/978-3-642-02421-4. ISBN 978-3-642-02420-7.
- ^ Mann J, Patterson EM (November 2013). “Tool use by aquatic animals”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1630): 20120424. doi:10.1098/rstb.2012.0424. PMC 4027413. PMID 24101631.
- ^ Raffaele P (2011). Among the Great Apes: Adventures on the Trail of Our Closest Relatives. New York: Harper. p. 83. ISBN 978-0-06-167184-5. OCLC 674694369.
- ^ Köhler W (1925). The Mentality of Apes. Liveright. ISBN 978-0-87140-108-3. OCLC 2000769.
- ^ McGowan RT, Rehn T, Norling Y, Keeling LJ (May 2014). “Positive affect and learning: exploring the “Eureka Effect” in dogs”. Animal Cognition. 17 (3): 577–87. doi:10.1007/s10071-013-0688-x. PMID 24096703. S2CID 15216926.
- ^ Karbowski J (May 2007). “Global and regional brain metabolic scaling and its functional consequences”. BMC Biology. 5 (18): 18. arXiv:0705.2913. Bibcode:2007arXiv0705.2913K. doi:10.1186/1741-7007-5-18. PMC 1884139. PMID 17488526.
- ^ Marino L (June 2007). “Cetacean brains: how aquatic are they?”. Anatomical Record. 290 (6): 694–700. doi:10.1002/ar.20530. PMID 17516433. S2CID 27074107.
- ^ Gallop GG (January 1970). “Chimpanzees: self-recognition”. Science. 167 (3914): 86–7. Bibcode:1970Sci…167…86G. doi:10.1126/science.167.3914.86. PMID 4982211. S2CID 145295899.
- ^ Plotnik JM, de Waal FB, Reiss D (November 2006). “Self-recognition in an Asian elephant” (PDF). Proceedings of the National Academy of Sciences of the United States of America. 103 (45): 17053–7. Bibcode:2006PNAS..10317053P. doi:10.1073/pnas.0608062103. PMC 1636577. PMID 17075063.
- ^ Robert S (1986). “Ontogeny of mirror behavior in two species of great apes”. American Journal of Primatology. 10 (2): 109–117. doi:10.1002/ajp.1350100202. PMID 31979488. S2CID 85330986.
- ^ Walraven V, van Elsacker L, Verheyen R (1995). “Reactions of a group of pygmy chimpanzees (Pan paniscus) to their mirror images: evidence of self-recognition”. Primates. 36: 145–150. doi:10.1007/bf02381922. S2CID 38985498.
- ^ Leakey R (1994). “The Origin of the Mind”. The Origin Of Humankind. New York: BasicBooks. p. 150. ISBN 978-0-465-05313-1. OCLC 30739453.
- ^ Archer J (1992). Ethology and Human Development. Rowman & Littlefield. pp. 215–218. ISBN 978-0-389-20996-6. OCLC 25874476.
- ^ a b Marten K, Psarakos S (1995). “Evidence of self-awareness in the bottlenose dolphin (Tursiops truncatus)”. In Parker ST, Mitchell R, Boccia M (eds.). Self-awareness in Animals and Humans: Developmental Perspectives. Cambridge: Cambridge University Press. pp. 361–379. ISBN 978-0-521-44108-7. OCLC 28180680.
- ^ a b Delfour F, Marten K (April 2001). “Mirror image processing in three marine mammal species: killer whales (Orcinus orca), false killer whales (Pseudorca crassidens) and California sea lions (Zalophus californianus)”. Behavioural Processes. 53 (3): 181–190. doi:10.1016/s0376-6357(01)00134-6. PMID 11334706. S2CID 31124804.
- ^ Jarvis JU (May 1981). “Eusociality in a mammal: cooperative breeding in naked mole-rat colonies”. Science. 212 (4494): 571–3. Bibcode:1981Sci…212..571J. doi:10.1126/science.7209555. JSTOR 1686202. PMID 7209555. S2CID 880054.
- ^ Jacobs DS, Bennett NC, Jarvis JU, Crowe TM (1991). “The colony structure and dominance hierarchy of the Damaraland mole-rat, Cryptomys damarensis (Rodentia: Bathyergidae) from Namibia”. Journal of Zoology. 224 (4): 553–576. doi:10.1111/j.1469-7998.1991.tb03785.x.
- ^ Hardy SB (2009). Mothers and Others: The Evolutionary Origins of Mutual Understanding. Boston: Belknap Press of Harvard University Press. pp. 92–93.
- ^ Harlow HF, Suomi SJ (July 1971). “Social recovery by isolation-reared monkeys”. Proceedings of the National Academy of Sciences of the United States of America. 68 (7): 1534–8. Bibcode:1971PNAS…68.1534H. doi:10.1073/pnas.68.7.1534. PMC 389234. PMID 5283943.
- ^ van Schaik CP (January 1999). “The socioecology of fission-fusion sociality in Orangutans”. Primates; Journal of Primatology. 40 (1): 69–86. doi:10.1007/BF02557703. PMID 23179533. S2CID 13366732.
- ^ Archie EA, Moss CJ, Alberts SC (March 2006). “The ties that bind: genetic relatedness predicts the fission and fusion of social groups in wild African elephants”. Proceedings. Biological Sciences. 273 (1586): 513–22. doi:10.1098/rspb.2005.3361. PMC 1560064. PMID 16537121.
- ^ Smith JE, Memenis SK, Holekamp KE (2007). “Rank-related partner choice in the fission–fusion society of the spotted hyena (Crocuta crocuta)” (PDF). Behavioral Ecology and Sociobiology. 61 (5): 753–765. doi:10.1007/s00265-006-0305-y. S2CID 24927919. Archived from the original (PDF) on 2014-04-25.
- ^ Matoba T, Kutsukake N, Hasegawa T (2013). Hayward M (ed.). “Head rubbing and licking reinforce social bonds in a group of captive African lions, Panthera leo”. PLOS ONE. 8 (9): e73044. Bibcode:2013PLoSO…873044M. doi:10.1371/journal.pone.0073044. PMC 3762833. PMID 24023806.
- ^ Krützen M, Barré LM, Connor RC, Mann J, Sherwin WB (July 2004). “‘O father: where art thou?’–Paternity assessment in an open Fission-fusion society of wild bottlenose dolphins (Tursiops sp.) in Shark Bay, Western Australia”. Molecular Ecology. 13 (7): 1975–90. doi:10.1111/j.1365-294X.2004.02192.x. PMID 15189218. S2CID 4510393.
- ^ Martin C (1991). The Rainforests of West Africa: Ecology – Threats – Conservation (1 ed.). Springer. doi:10.1007/978-3-0348-7726-8. ISBN 978-3-0348-7726-8.
- ^ le Roux A, Cherry MI, Gygax L (5 May 2009). “Vigilance behaviour and fitness consequences: comparing a solitary foraging and an obligate group-foraging mammal”. Behavioral Ecology and Sociobiology. 63 (8): 1097–1107. doi:10.1007/s00265-009-0762-1. S2CID 21961356.
- ^ Palagi E, Norscia I (2015). Samonds KE (ed.). “The Season for Peace: Reconciliation in a Despotic Species (Lemur catta)”. PLOS ONE. 10 (11): e0142150. Bibcode:2015PLoSO..1042150P. doi:10.1371/journal.pone.0142150. PMC 4646466. PMID 26569400.
- ^ East ML, Hofer H (2000). “Male spotted hyenas (Crocuta crocuta) queue for status in social groups dominated by females”. Behavioral Ecology. 12 (15): 558–568. doi:10.1093/beheco/12.5.558.
- ^ Samuels A, Silk JB, Rodman P (1984). “Changes in the dominance rank and reproductive behavior of male bonnet macaques (Macaca radiate)”. Animal Behaviour. 32 (4): 994–1003. doi:10.1016/s0003-3472(84)80212-2. S2CID 53186523.
- ^ Delpietro HA, Russo RG (2002). “Observations of the common vampire bat (Desmodus rotundus) and the hairy-legged vampire bat (Diphylla ecaudata) in captivity”. Mammalian Biology. 67 (2): 65–78. doi:10.1078/1616-5047-00011.
- ^ Kleiman DG (March 1977). “Monogamy in mammals”. The Quarterly Review of Biology. 52 (1): 39–69. doi:10.1086/409721. PMID 857268. S2CID 25675086.
- ^ Holland B, Rice WR (February 1998). “Perspective: Chase-Away Sexual Selection: Antagonistic Seduction Versus Resistance” (PDF). Evolution; International Journal of Organic Evolution. 52 (1): 1–7. doi:10.2307/2410914. JSTOR 2410914. PMID 28568154. Archived from the original (PDF) on 2019-06-08. Retrieved 2016-07-08.
- ^ Clutton-Brock TH (May 1989). “Mammalian mating systems”. Proceedings of the Royal Society of London. Series B, Biological Sciences. 236 (1285): 339–72. Bibcode:1989RSPSB.236..339C. doi:10.1098/rspb.1989.0027. PMID 2567517. S2CID 84780662.
- ^ Boness DJ, Bowen D, Buhleier BM, Marshall GJ (2006). “Mating tactics and mating system of an aquatic-mating pinniped: the harbor seal, Phoca vitulina“. Behavioral Ecology and Sociobiology. 61: 119–130. doi:10.1007/s00265-006-0242-9. S2CID 25266746.
- ^ Klopfer PH (1981). “Origins of Parental Care”. In Gubernick DJ (ed.). Parental Care in Mammals. New York: Plenum Press. ISBN 978-1-4613-3150-6. OCLC 913709574.
- ^ Murthy R, Bearman G, Brown S, Bryant K, Chinn R, Hewlett A, et al. (May 2015). “Animals in healthcare facilities: recommendations to minimize potential risks” (PDF). Infection Control and Hospital Epidemiology. 36 (5): 495–516. doi:10.1017/ice.2015.15. PMID 25998315. S2CID 541760.
- ^ The Humane Society of the United States. “U.S. Pet Ownership Statistics”. Retrieved 27 April 2012.
- ^ USDA. “U.S. Rabbit Industry profile” (PDF). Archived from the original (PDF) on 7 August 2019. Retrieved 10 July 2013.
- ^ McKie R (26 May 2013). “Prehistoric cave art in the Dordogne”. The Guardian. Retrieved 9 November 2016.
- ^ Jones J (27 June 2014). “The top 10 animal portraits in art”. The Guardian. Retrieved 24 June 2016.
- ^ “Deer Hunting in the United States: An Analysis of Hunter Demographics and Behavior Addendum to the 2001 National Survey of Fishing, Hunting, and Wildlife-Associated Recreation Report 2001-6”. Fishery and Wildlife Service (USA). Retrieved 24 June 2016.
- ^ Shelton L (2014-04-05). “Recreational Hog Hunting Popularity Soaring”. The Natchez Democrat. Gramd View Outdoors. Archived from the original on 12 December 2017. Retrieved 24 June 2016.
- ^ Nguyen J, Wheatley R (2015). Hunting For Food: Guide to Harvesting, Field Dressing and Cooking Wild Game. F+W Media. pp. 6–77. ISBN 978-1-4403-3856-4. Chapters on hunting deer, wild hog (boar), rabbit, and squirrel.
- ^ “Horse racing”. The Encyclopædia Britannica. Archived from the original on 21 December 2013. Retrieved 6 May 2014.
- ^ Genders R (1981). Encyclopaedia of Greyhound Racing. Pelham Books. ISBN 978-0-7207-1106-6. OCLC 9324926.
- ^ Plous S (1993). “The Role of Animals in Human Society”. Journal of Social Issues. 49 (1): 1–9. doi:10.1111/j.1540-4560.1993.tb00906.x.
- ^ Fowler KJ (26 March 2014). “Top 10 books about intelligent animals”. The Guardian. Retrieved 9 November 2016.
- ^ Gamble N, Yates S (2008). Exploring Children’s Literature (2 ed.). Los Angeles: Sage. ISBN 978-1-4129-3013-0. OCLC 71285210.
- ^ “Books for Adults”. Seal Sitters. Retrieved 9 November 2016.
- ^ Paterson J (2013). “Animals in Film and Media”. Oxford Bibliographies. doi:10.1093/obo/9780199791286-0044.
- ^ Johns C (2011). Cattle: History, Myth, Art. London: The British Museum Press. ISBN 978-0-7141-5084-0. OCLC 665137673.
- ^ van Gulik RH. Hayagrīva: The Mantrayānic Aspect of Horse-cult in China and Japan. Brill Archive. p. 9.
- ^ Grainger R (24 June 2012). “Lion Depiction across Ancient and Modern Religions”. ALERT. Archived from the original on 23 September 2016. Retrieved November 6, 2016.
- ^ Diamond JM (1997). “Part 2: The rise and spread of food production”. Guns, Germs, and Steel: the Fates of Human Societies (1 ed.). New York: W.W. Norton & Company. ISBN 978-0-393-03891-0. OCLC 35792200.
- ^ Larson G, Burger J (April 2013). “A population genetics view of animal domestication” (PDF). Trends in Genetics. 29 (4): 197–205. doi:10.1016/j.tig.2013.01.003. PMID 23415592.
- ^ Zeder MA (August 2008). “Domestication and early agriculture in the Mediterranean Basin: Origins, diffusion, and impact”. Proceedings of the National Academy of Sciences of the United States of America. 105 (33): 11597–604. Bibcode:2008PNAS..10511597Z. doi:10.1073/pnas.0801317105. PMC 2575338. PMID 18697943.
- ^ “Graphic detail Charts, maps and infographics. Counting chickens”. The Economist. 27 July 2011. Retrieved 6 November 2016.
- ^ “Breeds of Cattle at CATTLE TODAY”. Cattle Today. Cattle-today.com. Retrieved November 6, 2016.
- ^ Lukefahr SD, Cheeke PR. “Rabbit project development strategies in subsistence farming systems”. Food and Agriculture Organization. Retrieved November 6, 2016.
- ^ Pond WG (2004). Encyclopedia of Animal Science. CRC Press. pp. 248–250. ISBN 978-0-8247-5496-9. OCLC 57033325.
- ^ “History of Leather”. Moore & Giles. Retrieved 10 November 2016.
- ^ Braaten AW (2005). “Wool”. In Steele V (ed.). Encyclopedia of Clothing and Fashion. Vol. 3. Thomson Gale. pp. 441–443. ISBN 978-0-684-31394-8. OCLC 963977000.
- ^ Quiggle C (Fall 2000). “Alpaca: An Ancient Luxury”. Interweave Knits: 74–76.
- ^ a b c Bar-On YM, Phillips R, Milo R (June 2018). “The biomass distribution on Earth”. Proceedings of the National Academy of Sciences of the United States of America. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ^ “Genetics Research”. Animal Health Trust. Archived from the original on December 12, 2017. Retrieved November 6, 2016.
- ^ “Drug Development”. Animal Research.info. Retrieved November 6, 2016.
- ^ “EU statistics show decline in animal research numbers”. Speaking of Research. 2013. Retrieved November 6, 2016.
- ^ Pilcher HR (2003). “It’s a knockout”. Nature. doi:10.1038/news030512-17. Retrieved November 6, 2016.
- ^ “The supply and use of primates in the EU”. European Biomedical Research Association. 1996. Archived from the original on 2012-01-17.
- ^ Carlsson HE, Schapiro SJ, Farah I, Hau J (August 2004). “Use of primates in research: a global overview”. American Journal of Primatology. 63 (4): 225–37. doi:10.1002/ajp.20054. PMID 15300710. S2CID 41368228.
- ^ Weatherall D, et al. (2006). The use of non-human primates in research (PDF) (Report). London, UK: Academy of Medical Sciences. Archived from the original (PDF) on 2013-03-23.
- ^ Ritchie H, Roser M (2021-04-15). “Biodiversity”. Our World in Data.
- ^ Price E (2008). Principles and applications of domestic animal behavior: an introductory text. Sacramento: Cambridge University Press. ISBN 978-1-84593-398-2. OCLC 226038028.
- ^ Taupitz J, Weschka M (2009). Chimbrids – Chimeras and Hybrids in Comparative European and International Research. Heidelberg: Springer. p. 13. ISBN 978-3-540-93869-9. OCLC 495479133.
- ^ Chambers SM, Fain SR, Fazio B, Amaral M (2012). “An account of the taxonomy of North American wolves from morphological and genetic analyses”. North American Fauna. 77: 2. doi:10.3996/nafa.77.0001.
- ^ van Vuure T (2005). Retracing the Aurochs – History, Morphology and Ecology of an extinct wild Ox. Pensoft Publishers. ISBN 978-954-642-235-4. OCLC 940879282.
- ^ Mooney HA, Cleland EE (May 2001). “The evolutionary impact of invasive species”. Proceedings of the National Academy of Sciences of the United States of America. 98 (10): 5446–51. Bibcode:2001PNAS…98.5446M. doi:10.1073/pnas.091093398. PMC 33232. PMID 11344292.
- ^ Le Roux JJ, Foxcroft LC, Herbst M, MacFadyen S (January 2015). “Genetic analysis shows low levels of hybridization between African wildcats (Felis silvestris lybica) and domestic cats (F. s. catus) in South Africa”. Ecology and Evolution. 5 (2): 288–99. doi:10.1002/ece3.1275. PMC 4314262. PMID 25691958.
- ^ Wilson A (2003). Australia’s state of the forests report. p. 107.
- ^ Rhymer JM, Simberloff D (November 1996). “Extinction by Hybridization and Introgression”. Annual Review of Ecology and Systematics. 27: 83–109. doi:10.1146/annurev.ecolsys.27.1.83.
- ^ Potts BM (2001). Barbour RC, Hingston AB (eds.). Genetic pollution from farm forestry using eucalypt species and hybrids : a report for the RIRDC/L&WA/FWPRDC Joint Venture Agroforestry Program. Rural Industrial Research and Development Corporation of Australia. ISBN 978-0-642-58336-9. OCLC 48794104.
- ^ a b Dirzo R, Young HS, Galetti M, Ceballos G, Isaac NJ, Collen B (July 2014). “Defaunation in the Anthropocene” (PDF). Science. 345 (6195): 401–6. Bibcode:2014Sci…345..401D. doi:10.1126/science.1251817. PMID 25061202. S2CID 206555761.
- ^ Primack R (2014). Essentials of Conservation Biology (6 ed.). Sunderland, MA: Sinauer Associates, Inc. Publishers. pp. 217–245. ISBN 978-1-60535-289-3. OCLC 876140621.
- ^ Vignieri S (July 2014). “Vanishing fauna. Introduction”. Science. 345 (6195): 392–5. Bibcode:2014Sci…345..392V. doi:10.1126/science.345.6195.392. PMID 25061199.
- ^ Burney DA, Flannery TF (July 2005). “Fifty millennia of catastrophic extinctions after human contact” (PDF). Trends in Ecology & Evolution. 20 (7): 395–401. doi:10.1016/j.tree.2005.04.022. PMID 16701402. Archived from the original on 2010-06-10.{{cite journal}}: CS1 maint: bot: original URL status unknown (link)
- ^ Diamond J (1984). “Historic extinctions: a Rosetta stone for understanding prehistoric extinctions”. In Martin PS, Klein RG (eds.). Quaternary extinctions: A prehistoric revolution. Tucson: University of Arizona Press. pp. 824–862. ISBN 978-0-8165-1100-6. OCLC 10301944.
- ^ Watts J (May 6, 2019). “Human society under urgent threat from loss of Earth’s natural life”. The Guardian. Retrieved July 1, 2019.
- ^ McGrath M (May 6, 2019). “Nature crisis: Humans ‘threaten 1m species with extinction'”. BBC. Retrieved July 1, 2019.
- ^ Main D (22 November 2013). “7 Iconic Animals Humans Are Driving to Extinction”. Live Science.
- ^ Platt JR (25 October 2011). “Poachers Drive Javan Rhino to Extinction in Vietnam”. Scientific American. Archived from the original on 6 April 2015.
- ^ Carrington D (December 8, 2016). “Giraffes facing extinction after devastating decline, experts warn”. The Guardian.
- ^ Estrada A, Garber PA, Rylands AB, Roos C, Fernandez-Duque E, Di Fiore A, et al. (January 2017). “Impending extinction crisis of the world’s primates: Why primates matter”. Science Advances. 3 (1): e1600946. Bibcode:2017SciA….3E0946E. doi:10.1126/sciadv.1600946. PMC 5242557. PMID 28116351.
- ^ Fletcher M (January 31, 2015). “Pangolins: why this cute prehistoric mammal is facing extinction”. The Telegraph. Archived from the original on 2022-01-10.
- ^ Greenfield P (September 9, 2020). “Humans exploiting and destroying nature on unprecedented scale – report”. The Guardian. Retrieved October 13, 2020.
- ^ McCarthy D (October 1, 2020). “Terrifying wildlife losses show the extinction end game has begun – but it’s not too late for change”. The Independent. Retrieved October 13, 2020.
- ^ Pennisi E (October 18, 2016). “People are hunting primates, Bats, and other mammals to extinction”. Science. Retrieved 3 February 2017.
- ^ Ripple WJ, Abernethy K, Betts MG, Chapron G, Dirzo R, Galetti M, et al. (October 2016). “Bushmeat hunting and extinction risk to the world’s mammals”. Royal Society Open Science. 3 (10): 160498. Bibcode:2016RSOS….360498R. doi:10.1098/rsos.160498. hdl:1893/24446. PMC 5098989. PMID 27853564.
- ^ Williams M, Zalasiewicz J, Haff PK, Schwägerl C, Barnosky AD, Ellis EC (2015). “The Anthropocene Biosphere”. The Anthropocene Review. 2 (3): 196–219. doi:10.1177/2053019615591020. S2CID 7771527.
- ^ Morell V (August 11, 2015). “Meat-eaters may speed worldwide species extinction, study warns”. Science. Retrieved 3 February 2017.
- ^ Machovina B, Feeley KJ, Ripple WJ (December 2015). “Biodiversity conservation: The key is reducing meat consumption”. The Science of the Total Environment. 536: 419–431. Bibcode:2015ScTEn.536..419M. doi:10.1016/j.scitotenv.2015.07.022. PMID 26231772.
- ^ Redford KH (1992). “The empty forest” (PDF). BioScience. 42 (6): 412–422. doi:10.2307/1311860. JSTOR 1311860.
- ^ Peres CA, Nascimento HS (2006). “Impact of Game Hunting by the Kayapo ́ of South-eastern Amazonia: Implications for Wildlife Conservation in Tropical Forest Indigenous Reserves”. Human Exploitation and Biodiversity Conservation. Topics in Biodiversity and Conservation. Vol. 3. pp. 287–313. ISBN 978-1-4020-5283-5. OCLC 207259298.
- ^ Altrichter M, Boaglio G (2004). “Distribution and Relative Abundance of Peccaries in the Argentine Chaco: Associations with Human Factors”. Biological Conservation. 116 (2): 217–225. doi:10.1016/S0006-3207(03)00192-7.
- ^ Gobush K. “Effects of Poaching on African elephants”. Center For Conservation Biology. University of Washington. Retrieved 12 May 2021.
- ^ Alverson DL, Freeburg MH, Murawski SA, Pope JG (1996) [1994]. “Bycatch of Marine Mammals”. A global assessment of fisheries bycatch and discards. Rome: Food and Agriculture Organization of the United Nations. ISBN 978-92-5-103555-9. OCLC 31424005.
- ^ Glowka L, Burhenne-Guilmin F, Synge HM, McNeely JA, Gündling L (1994). IUCN environmental policy and law paper. Guide to the Convention on Biodiversity. International Union for Conservation of Nature. ISBN 978-2-8317-0222-3. OCLC 32201845.
- ^ “About IUCN”. International Union for Conservation of Nature. 2014-12-03. Retrieved 3 February 2017.
- ^ Ceballos G, Ehrlich PR, Barnosky AD, García A, Pringle RM, Palmer TM (June 2015). “Accelerated modern human-induced species losses: Entering the sixth mass extinction”. Science Advances. 1 (5): e1400253. Bibcode:2015SciA….1E0253C. doi:10.1126/sciadv.1400253. PMC 4640606. PMID 26601195.
- ^ Fisher DO, Blomberg SP (April 2011). “Correlates of rediscovery and the detectability of extinction in mammals”. Proceedings. Biological Sciences. 278 (1708): 1090–7. doi:10.1098/rspb.2010.1579. PMC 3049027. PMID 20880890.
- ^ Ceballos G, Ehrlich AH, Ehrlich PR (2015). The Annihilation of Nature: Human Extinction of Birds and Mammals. Baltimore: Johns Hopkins University Press. p. 69. ISBN 978-1-4214-1718-9.
- ^ Jiang, Z.; Harris, R.B. (2016). “Elaphurus davidianus“. IUCN Red List of Threatened Species. 2016: e.T7121A22159785. doi:10.2305/IUCN.UK.2016-2.RLTS.T7121A22159785.en. Retrieved 12 November 2021.
- ^ a b McKinney ML, Schoch R, Yonavjak L (2013). “Conserving Biological Resources”. Environmental Science: Systems and Solutions (5 ed.). Jones & Bartlett Learning. ISBN 978-1-4496-6139-7. OCLC 777948078.
- ^ Perrin WF, Würsig BF, Thewissen JG (2009). Encyclopedia of marine mammals. Academic Press. p. 404. ISBN 978-0-12-373553-9. OCLC 455328678.
As of this edit, this article uses content from “Anatomy and Physiology”, which is licensed in a way that permits reuse under the Creative Commons Attribution-ShareAlike 3.0 Unported License, but not under the GFDL. All relevant terms must be followed.
Further reading
- Brown WM (2001). “Natural selection of mammalian brain components”. Trends in Ecology and Evolution. 16 (9): 471–473. doi:10.1016/S0169-5347(01)02246-7.
- McKenna MC, Bell SK (1997). Classification of Mammals Above the Species Level. New York: Columbia University Press. ISBN 978-0-231-11013-6. OCLC 37345734.
- Nowak RM (1999). Walker’s mammals of the world (6 ed.). Baltimore: Johns Hopkins University Press. ISBN 978-0-8018-5789-8. OCLC 937619124.
- Simpson GG (1945). “The principles of classification and a classification of mammals”. Bulletin of the American Museum of Natural History. 85: 1–350.
- Murphy WJ, Eizirik E, O’Brien SJ, Madsen O, Scally M, Douady CJ, et al. (December 2001). “Resolution of the early placental mammal radiation using Bayesian phylogenetics”. Science. 294 (5550): 2348–51. Bibcode:2001Sci…294.2348M. doi:10.1126/science.1067179. PMID 11743200. S2CID 34367609.
- Springer MS, Stanhope MJ, Madsen O, de Jong WW (August 2004). “Molecules consolidate the placental mammal tree” (PDF). Trends in Ecology & Evolution. 19 (8): 430–8. doi:10.1016/j.tree.2004.05.006. PMID 16701301. Archived from the original (PDF) on 2016-07-29. Retrieved 2005-01-21.
- Vaughan TA, Ryan JM, Capzaplewski NJ (2000). Mammalogy (4 ed.). Fort Worth, Texas: Saunders College Publishing. ISBN 978-0-03-025034-7. OCLC 42285340.
- Kriegs JO, Churakov G, Kiefmann M, Jordan U, Brosius J, Schmitz J (April 2006). “Retroposed elements as archives for the evolutionary history of placental mammals”. PLOS Biology. 4 (4): e91. doi:10.1371/journal.pbio.0040091. PMC 1395351. PMID 16515367.
- MacDonald DW, Norris S (2006). The Encyclopedia of Mammals (3 ed.). London: Brown Reference Group. ISBN 978-0-681-45659-4. OCLC 74900519.
External links
| The Wikibook Dichotomous Key has a page on the topic of: Mammalia |
| Wikisource has the text of the 1911 Encyclopædia Britannica article “Mammalia“. |
- Biodiversitymapping.org – All mammal orders in the world with distribution maps Archived 2016-09-26 at the Wayback Machine
- Paleocene Mammals, a site covering the rise of the mammals, paleocene-mammals.de
- Evolution of Mammals, a brief introduction to early mammals, enchantedlearning.com
- European Mammal Atlas EMMA from Societas Europaea Mammalogica, European-mammals.org
- Marine Mammals of the World – An overview of all marine mammals, including descriptions, both fully aquatic and semi-aquatic, noaa.gov
- Mammalogy.org The American Society of Mammalogists was established in 1919 for the purpose of promoting the study of mammals, and this website includes a mammal image library
Portal: ![]() Mammals
Mammals

