Histologie
L’histologie , [aide 1] également appelée anatomie microscopique ou microanatomie , [1] est la branche de la biologie qui étudie l’ anatomie microscopique des tissus biologiques . [2] [3] [4] [5] L’histologie est la contrepartie microscopique de l’ anatomie macroscopique , qui examine les structures plus grandes visibles sans microscope . [5] [6] Bien que l’on puisse diviser l’anatomie microscopique en organologie , l’étude des organes, l’histologie , l’étude des tissus et la Cytologie, l’étude des cellules , l’usage moderne place tous ces sujets dans le domaine de l’histologie. [5] En médecine , l’ histopathologie est la branche de l’histologie qui comprend l’identification et l’étude microscopiques des tissus malades. [5] [6] Dans le domaine de la paléontologie , le terme paléohistologie fait référence à l’histologie des organismes fossiles . [7] [8]
 Spécimen histologique placé sur la platine d’un microscope optique .
Spécimen histologique placé sur la platine d’un microscope optique .  Tissu pulmonaire humain coloré avec de l’Hématoxyline et de l’éosine vu au microscope.
Tissu pulmonaire humain coloré avec de l’Hématoxyline et de l’éosine vu au microscope.
Tissus biologiques
Classification des tissus animaux
Il existe quatre types de tissus animaux : le tissu musculaire , le tissu nerveux, le tissu conjonctif et le Tissu épithélial . [5] [9] Tous les tissus animaux sont considérés comme des sous-types de ces quatre principaux types de tissus (par exemple, le sang est classé comme tissu conjonctif, puisque les cellules sanguines sont en suspension dans une matrice extracellulaire , le plasma ). [9]
- Épithélium
- Épithélium simple
- Épithélium pavimenteux simple
- Épithélium cubique simple
- Épithélium cylindrique simple
- Épithélium cylindrique pseudostratifié
- Épithélium stratifié
- Épithélium pavimenteux stratifié
- Épithélium cubique stratifié
- Épithélium cylindrique stratifié
- Épithélium de transition
- Glandes multicellulaires
- Épithélium simple
- Tissu musculaire
- Muscle lisse
- Muscle squelettique
- Muscle cardiaque
- Tissu conjonctif
- Tissu conjonctif général
- Tissu conjonctif lâche
- Tissu conjonctif dense
- Tissu conjonctif spécial
- Cartilage
- Os
- Hématopoïétique
- Sang
- Lymphe
- Tissu conjonctif général
- Tissu nerveux
- Système nerveux central
- Système nerveux périphérique
- Récepteurs spéciaux
Classification des tissus végétaux

 Coupe histologique d’une tige de plante ( Alliaria petiolata ).
Coupe histologique d’une tige de plante ( Alliaria petiolata ).
Pour les végétaux, l’étude de leurs tissus relève du domaine de l’Anatomie végétale , avec les quatre grands types suivants :
- Tissu dermique
- Tissu vasculaire
- Tissu broyé
- Tissu méristématique
Histologie médicale
L’histopathologie est la branche de l’histologie qui comprend l’identification et l’étude microscopiques des tissus malades. [5] [6] C’est une partie importante de la pathologie anatomique et de la pathologie chirurgicale , car un diagnostic précis du cancer et d’autres maladies nécessite souvent un examen histopathologique d’échantillons de tissus. [10] Des médecins formés, souvent des pathologistes agréés , effectuent un examen histopathologique et fournissent des informations de diagnostic basées sur leurs observations.
Professions
Le domaine de l’histologie qui comprend la préparation des tissus pour l’examen microscopique est connu sous le nom d’histotechnologie. Les titres d’emploi pour le personnel formé qui prépare les spécimens histologiques pour examen sont nombreux et comprennent les histotechniciens, les histotechnologues, [11] les techniciens et technologues en histologie, les techniciens de laboratoire médical et les scientifiques biomédicaux .
La préparation des échantillons
La plupart des échantillons histologiques nécessitent une préparation avant l’observation microscopique ; ces méthodes dépendent du spécimen et de la méthode d’observation. [9]
Fixation

 Coupe histologique d’un invertébré fossilisé. Bryozoaire de l’ Ordovicien .
Coupe histologique d’un invertébré fossilisé. Bryozoaire de l’ Ordovicien .
Les fixateurs chimiques sont utilisés pour préserver et maintenir la structure des tissus et des cellules ; la fixation durcit également les tissus, ce qui aide à couper les fines sections de tissu nécessaires à l’observation au microscope. [5] [12] Les fixateurs préservent généralement les tissus (et les cellules) en réticulant de manière irréversible les protéines. [12] Le fixateur le plus largement utilisé pour la microscopie optique est le Formol tamponné neutre à 10 % , ou NBF ( formaldéhyde à 4 % dans une Solution saline tamponnée au phosphate ). [13] [12] [9]
Pour la microscopie électronique, le fixateur le plus couramment utilisé est le glutaraldéhyde , généralement sous forme de solution à 2,5 % dans une Solution saline tamponnée au phosphate . [9] D’autres fixateurs utilisés pour la microscopie électronique sont le tétroxyde d’osmium ou l’acétate d’uranyle . [9]
L’action principale de ces fixateurs aldéhydiques est de réticuler les groupes amino des protéines par la formation de ponts méthylène (-CH 2 -), dans le cas du formaldéhyde, ou par des réticulations C 5 H 10 dans le cas du glutaraldéhyde. Ce processus, tout en préservant l’intégrité structurelle des cellules et des tissus, peut endommager la fonctionnalité biologique des protéines, en particulier des Enzymes .
La fixation au Formol conduit à la dégradation de l’ARNm, du miARN et de l’ADN ainsi qu’à la dénaturation et à la modification des protéines dans les tissus. Cependant, l’extraction et l’analyse des acides nucléiques et des protéines à partir de tissus fixés au Formol et inclus en paraffine sont possibles en utilisant des protocoles appropriés. [14] [15]
Sélection et parage

 Éléments utilisés pour soumettre les échantillons : enveloppe (de biopsie), éponge (de biopsie), cassette (de traitement des tissus) et sac (de biopsie).
Éléments utilisés pour soumettre les échantillons : enveloppe (de biopsie), éponge (de biopsie), cassette (de traitement des tissus) et sac (de biopsie).
La sélection est le choix du tissu pertinent dans les cas où il n’est pas nécessaire de soumettre toute la masse tissulaire d’origine à un traitement ultérieur. Le reste peut rester fixé au cas où il devrait être examiné ultérieurement.
Le rognage est la découpe d’échantillons de tissus afin d’exposer les surfaces pertinentes pour une coupe ultérieure. Il crée également des échantillons de tissus de taille appropriée pour tenir dans des cassettes. [16]
Intégration
Les tissus sont noyés dans un milieu plus dur à la fois comme support et pour permettre la découpe de fines tranches de tissus. [9] [5] En général, l’eau doit d’abord être retirée des tissus (déshydratation) et remplacée par un milieu qui se solidifie directement ou par un fluide intermédiaire (nettoyage) qui est Miscible avec le milieu d’enrobage. [12]
Paraffine 
 Échantillon histologique intégré dans de la cire de paraffine (le tissu est maintenu au fond d’un moule en métal, et plus de paraffine fondue est versée dessus pour le remplir).
Échantillon histologique intégré dans de la cire de paraffine (le tissu est maintenu au fond d’un moule en métal, et plus de paraffine fondue est versée dessus pour le remplir).
Pour la microscopie optique, la cire de paraffine est le matériau d’enrobage le plus fréquemment utilisé. [12] [13] La paraffine n’est pas Miscible avec l’eau, le principal constituant du tissu biologique, elle doit donc d’abord être éliminée dans une série d’étapes de déshydratation. [12] Les échantillons sont transférés à travers une série de bains d’ éthanol de plus en plus concentrés , jusqu’à 100 % d’éthanol pour éliminer les traces d’eau restantes. [9] [12] La déshydratation est suivie d’un agent de clarification (généralement du xylène [13] bien que d’autres substituts sans danger pour l’environnement soient utilisés [13] ) qui élimine l’alcool et est miscibleavec la cire, on ajoute enfin de la paraffine fondue pour remplacer le xylène et infiltrer les tissus. [9] Dans la plupart des laboratoires d’histologie ou d’histopathologie, la déshydratation, le nettoyage et l’infiltration de cire sont effectués dans des processeurs de tissus qui automatisent ce processus. [13] Une fois infiltrés dans la paraffine, les tissus sont orientés dans des moules remplis de cire ; une fois positionnée, la cire est refroidie, solidifiant le bloc et le tissu. [13] [12]
Autres matériaux
La cire de paraffine ne fournit pas toujours une matrice suffisamment dure pour couper des coupes très fines (ce qui est particulièrement important pour la microscopie électronique). [12] La cire de paraffine peut également être trop molle par rapport au tissu, la chaleur de la cire fondue peut altérer le tissu de manière indésirable, ou les produits chimiques déshydratants ou de compensation peuvent endommager le tissu. [12] Les alternatives à la cire de paraffine comprennent l’ époxy , l’acrylique , l’ agar , la gélatine , la celloïdine et d’autres types de cires. [12] [17]
En microscopie électronique, les résines époxy sont les milieux d’enrobage les plus couramment utilisés [9] , mais les résines acryliques sont également utilisées, en particulier lorsque l’ immunohistochimie est nécessaire.
Pour les tissus à couper à l’état congelé, les tissus sont placés dans un milieu d’enrobage à base d’eau. Les tissus précongelés sont placés dans des moules avec le matériau d’enrobage liquide, généralement un glycol à base d’eau, OCT , TBS , Cryogel ou résine, qui est ensuite congelé pour former des blocs durcis.
Sectionnement

 Échantillon histologique coupé sur un microtome.
Échantillon histologique coupé sur un microtome.
Pour la microscopie optique, un couteau monté dans un microtome est utilisé pour couper des sections de tissu (généralement entre 5 et 15 micromètres d’épaisseur) qui sont montées sur une lame de microscope en verre . [9] Pour la microscopie électronique à transmission (MET), un couteau en diamant ou en verre monté dans un Ultramicrotome est utilisé pour couper entre 50 et 150 nanomètres d’épaisseur. [9]
Coloration
Le tissu biologique a peu de contraste inhérent au microscope optique ou électronique. [17] La coloration est employée pour donner à la fois un contraste au tissu et pour mettre en évidence des caractéristiques particulières d’intérêt. Lorsque la coloration est utilisée pour cibler un composant chimique spécifique du tissu (et non la structure générale), le terme Histochimie est utilisé. [9]
Microscopie optique 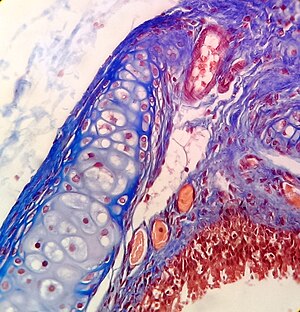
 Coloration Trichrome de Masson sur trachée de rat .
Coloration Trichrome de Masson sur trachée de rat .
L’Hématoxyline et l’éosine ( coloration H&E ) sont l’une des colorations les plus couramment utilisées en histologie pour montrer la structure générale du tissu. [9] [18] L’Hématoxyline colore les noyaux cellulaires en bleu ; l’éosine, un colorant acide , colore le cytoplasme et d’autres tissus dans différentes taches de rose. [9] [12]
Contrairement à H&E, qui est utilisé comme coloration générale, il existe de nombreuses techniques qui colorent plus sélectivement les cellules, les composants cellulaires et les substances spécifiques. [12] Une technique histochimique couramment réalisée qui cible un produit chimique spécifique est la réaction au Bleu de Prusse de Perls , utilisée pour démontrer les dépôts de fer [12] dans des maladies comme l’Hémochromatose . La méthode Nissl pour la substance Nissl et la méthode de Golgi (et les taches d’argent associées ) sont utiles pour identifier les neurones sont d’autres exemples de taches plus spécifiques. [12]
Historadiographie
En historadiographie , une lame (parfois colorée par Histochimie) est radiographiée. Plus couramment, l’ autoradiographie est utilisée pour visualiser les emplacements vers lesquels une substance radioactive a été transportée dans le corps, comme les cellules en phase S (en cours de réplication de l’ADN ) qui incorporent de la thymidine tritiée , ou les sites auxquels les sondes d’acide nucléique radiomarquées se lient in situ hybridation . Pour l’autoradiographie au niveau microscopique, la lame est généralement plongée dans une émulsion liquide des voies nucléaires, qui sèche pour former le film d’exposition. Les grains d’argent individuels dans le film sont visualisés par microscopie à fond noir .
Immunohistochimie
Récemment, des anticorps ont été utilisés pour visualiser spécifiquement les protéines, les glucides et les lipides. Ce processus est appelé immunohistochimie ou, lorsque le colorant est une molécule fluorescente , immunofluorescence . Cette technique a considérablement augmenté la capacité d’identifier des catégories de cellules au microscope. D’autres techniques avancées, telles que l’ hybridation in situ non radioactive , peuvent être combinées à l’immunochimie pour identifier des molécules d’ADN ou d’ARN spécifiques avec des sondes ou des étiquettes fluorescentes pouvant être utilisées pour l’immunofluorescence et l’amplification de fluorescence liée à une enzyme (en particulier l’amplification du signal de la phosphatase alcaline et de la tyramide). Microscopie à fluorescenceet la microscopie confocale sont utilisées pour détecter les signaux fluorescents avec de bons détails intracellulaires.
Microscopie électronique
Pour la microscopie électronique, les métaux lourds sont généralement utilisés pour colorer les coupes de tissus. [9] L’acétate d’uranyle et le citrate de plomb sont couramment utilisés pour conférer un contraste aux tissus au microscope électronique. [9]
Techniques spécialisées
Cryosection
Semblable à la procédure de coupe congelée utilisée en médecine, la cryosection est une méthode pour congeler, couper et monter rapidement des coupes de tissu pour l’histologie. Le tissu est généralement sectionné sur un cryostat ou un microtome de congélation. [12] Les coupes congelées sont montées sur une lame de verre et peuvent être colorées pour améliorer le contraste entre les différents tissus. Les coupes congelées non fixées peuvent être utilisées pour des études nécessitant la localisation d’Enzymes dans les tissus et les cellules. La fixation des tissus est nécessaire pour certaines procédures telles que la coloration par immunofluorescence liée aux anticorps. Des coupes congelées sont souvent préparées lors de l’ablation chirurgicale des tumeurs pour permettre une identification rapide des marges tumorales, comme dansChirurgie de Mohs , ou détermination de la malignité d’une tumeur, lorsqu’une tumeur est découverte fortuitement au cours d’une intervention chirurgicale.
Ultramicrotomie 
 Algues vertes au microscope électronique à transmission
Algues vertes au microscope électronique à transmission
L’ultramicrotomie est une méthode de préparation de coupes extrêmement fines pour l’analyse au microscope électronique à transmission (MET). Les tissus sont généralement intégrés dans de l’ époxy ou une autre résine plastique. [9] Des sections très minces (moins de 0,1 micromètre d’épaisseur) sont coupées à l’aide de couteaux en diamant ou en verre sur un Ultramicrotome . [12]
Artefacts
Les artefacts sont des structures ou des caractéristiques des tissus qui interfèrent avec l’examen histologique normal. Les artefacts interfèrent avec l’histologie en modifiant l’apparence des tissus et en cachant les structures. Les artefacts de traitement des tissus peuvent inclure des pigments formés par des fixateurs, [12] un rétrécissement, un lavage des composants cellulaires, des changements de couleur dans différents types de tissus et des altérations des structures dans le tissu. Un exemple est le pigment de mercure laissé après avoir utilisé le fixateur de Zenker pour fixer une section. [12] La fixation au Formol peut également laisser un pigment brun à noir dans des conditions acides. [12]
Histoire

 Santiago Ramón y Cajal dans son laboratoire.
Santiago Ramón y Cajal dans son laboratoire.
Au XVIIe siècle, l’Italien Marcello Malpighi utilisait des microscopes pour étudier de minuscules entités biologiques ; certains le considèrent comme le fondateur des domaines de l’histologie et de la pathologie microscopique. [19] [20] Malpighi a analysé plusieurs parties des organes de chauves-souris, de grenouilles et d’autres animaux au microscope. En étudiant la structure du poumon, Malpighi a remarqué ses alvéoles membraneuses et les connexions en forme de cheveux entre les veines et les artères, qu’il a nommées capillaires. Sa découverte a établi comment l’oxygène inspiré pénètre dans la circulation sanguine et sert le corps. [21]
Au XIXe siècle, l’histologie était une discipline académique à part entière. L’anatomiste français Xavier Bichat a introduit le concept de tissu dans l’anatomie en 1801, [22] et le terme « histologie » ( allemand : Histologie ), inventé pour désigner « l’étude des tissus », est apparu pour la première fois dans un livre de Karl Meyer en 1819 [23] [ 24] [19] Bichat a décrit vingt et un tissus humains, qui peuvent être subsumés sous les quatre catégories actuellement acceptées par les histologues. [25] L’usage des illustrations en histologie, jugé inutile par Bichat, a été promu par Jean Cruveilhier . [26] [lorsque? ]
Au début des années 1830 , Purkynĕ a inventé un microtome de haute précision. [24]
Au cours du XIXe siècle, de nombreuses techniques de fixation ont été développées par Adolph Hannover (solutions de chromates et d’ acide chromique ), Franz Schulze et Max Schultze ( acide osmique ), Alexander Butlerov ( formaldéhyde ) et Benedikt Stilling ( congélation ). [24]
Les techniques de montage ont été développées par Rudolf Heidenhain (1824-1898), qui a introduit la gomme arabique ; Salomon Stricker (1834-1898), qui préconise un mélange de cire et d’huile ; et Andrew Pritchard (1804-1884) qui, en 1832, utilise un mélange gomme/ colle de Chine. La même année, le baume du Canada fait son apparition et, en 1869, Edwin Klebs (1834-1913) rapporte qu’il a depuis quelques années enrobé ses spécimens dans de la paraffine. [27]
Le prix Nobel de physiologie ou médecine de 1906 a été décerné aux histologues Camillo Golgi et Santiago Ramon y Cajal . Ils avaient des interprétations contradictoires de la structure neurale du cerveau basées sur des interprétations différentes des mêmes images. Ramón y Cajal a remporté le prix pour sa théorie correcte et Golgi pour la technique de coloration à l’argent qu’il a inventée pour rendre cela possible. [28]
Directions futures
Histologie in vivo
Actuellement, on s’intéresse vivement au développement de techniques d’ histologie in vivo (utilisant principalement l’ IRM ), qui permettraient aux médecins de recueillir de manière non invasive des informations sur les tissus sains et malades chez les patients vivants, plutôt qu’à partir d’échantillons de tissus fixes. [29] [30] [31] [32]
Remarques
- ↑ Le mot histologie ( / h ɪ s t ˈ ɒ l ə dʒ i / ) est du nouveau latin utilisant les formes combinées d’ histo- + -logy , donnant « étude des tissus », desmots grecs ἱστός histos , « tissu », et -λογία , “étudier”.
Références
- ^ “Définition et signification de la microanatomie” . Dictionnaire anglais Collins .
- ^ “Histologie | physiologie” . Encyclopédie Britannica . Récupéré le 29/10/2018 .
- ^ “DefinedTerm : Histologie” . Terme défini . Archivé de l’original le 2018-10-29 . Récupéré le 29/10/2018 .
- ^ Maximow, Alexandre A.; Bloom, Guillaume (1957). Un manuel d’histologie (septième éd.). Philadelphie : WB Saunders Company.
- ^ un bcdefgh Leeson , Thomas S .; _ _ En ligneLeeson, C. Roland (1981). Histologie (quatrième éd.). Société WB Saunders. p. 600. ISBN 978-0721657042.
- ^ un bc le dictionnaire médical de Stedman (le 27ème rédacteur). Lippincott Williams & Wilkins. 2006. ISBN 978-0683400076.
- ^ Padian, Kevin; Lamm, Ellen-Thérèse, éd. (2013). Histologie osseuse des tétrapodes fossiles : méthodes avancées, analyse et interprétation (1ère éd.). Presse de l’Université de Californie. p. 298. ISBN 978-0-520-27352-8.
- ^ Canoville A, Chinsamy A (2015). “La microstructure osseuse du Stereospondyl Lydekkerina Huxleyi révèle des stratégies adaptatives à l’environnement difficile d’extinction post-permienne”. Le dossier anatomique . 298 (7) : 1237–1254. doi : 10.1002/ar.23160 . PMID 25857487 . S2CID 43628074 .
- ^ un bcdefghijklmnopqr Ross , Michael H .; _ _ _ _ _ _ _ _ _ _ _ _ Pawlina, Wojciech (2016). Histologie : un texte et un atlas : avec la biologie cellulaire et moléculaire corrélée (7e éd.). Wolters Kluwer. p. 984p. ISBN 978-1451187427.
- ^ Rosai J (2007). “Pourquoi la microscopie restera une pierre angulaire de la pathologie chirurgicale” . Lab Invest . 87 (5) : 403–8. doi : 10.1038/labinvest.3700551 . PMID 17401434 . S2CID 27399409 .
- ^ Titford, Michael; Bowman, Blythe (2012). “Que peut l’avenir réserver aux histotechnologues ?” . Médecine de laboratoire . 43 (supplément 2): e5–e10. doi : 10.1309/LMXB668WDCBIAWJL . ISSN 0007-5027 .
- ^ un bcd e f g h i j k l m n o p q r s t Bancroft , John; Stevens, Alan, éd. (1982). La théorie et la pratique des techniques histologiques (2e éd.). Groupe Longman Limité.
- ^ un bcdef Wick , Mark R. ( 2019 ). “La coloration à l’Hématoxyline et à l’éosine en pathologie anatomique – Un objectif souvent négligé de l’assurance qualité en laboratoire”. Séminaires en Pathologie Diagnostique . 36 (5): 303–311. doi : 10.1053/j.semdp.2019.06.003 . ISSN 0740-2570 . PMID 31230963 . S2CID 195326749 .
- ^ Weiss AT, Delcour NM, Meyer A, Klopfleisch R (juillet 2011). “Extraction efficace et rentable de l’ADN génomique à partir de tissus fixés au Formol et inclus en paraffine” . Pathologie Vétérinaire . 48 (4): 834–8. doi : 10.1177/0300985810380399 . PMID 20817894 . S2CID 34974790 .
- ^ Bennike TB, Kastaniegaard K, Padurariu S, Gaihede M, Birkelund S, Andersen V, Stensballe A (mars 2016). “Comparaison du protéome d’échantillons de tissus humains congelés, ARNlater conservés et fixés au Formol et inclus en paraffine” . EuPA Open Protéomique . 10 : 9–18. doi : 10.1016/j.euprot.2015.10.001 . PMC 5988570 . PMID 29900094 .
- ^ Slaoui, Mohamed; Fiette, Laurence (2011). “Procédures d’histopathologie : de l’échantillonnage de tissus à l’évaluation histopathologique”. Évaluation de l’innocuité des médicaments . Méthodes en biologie moléculaire. Vol. 691. p. 69–82. doi : 10.1007/978-1-60761-849-2_4 . ISBN 978-1-60327-186-8. ISSN 1064-3745 . PMID 20972747 .
- ^ un b Drury, RAB; Wallington, EA (1980). Technique histologique de Carleton (5e éd.). Presse universitaire d’Oxford. p. 520.ISBN _ 0-19-261310-3.
- ^ Dapson RW, Horobin RW (2009). “Les colorants dans une perspective du XXIe siècle”. Biotech Histochem . 84 (4): 135–7. doi : 10.1080/10520290902908802 . PMID 19384743 . S2CID 28563610 .
- ^ un b Bracegirdle B (1977). “L’histoire de l’histologie: une brève enquête sur les sources”. Histoire des Sciences . 15 (2): 77–101. Bibcode : 1977HisSc..15…77B . doi : 10.1177/007327537701500201 . S2CID 161338778 .
- ^ Motta PM (1998). “Marcello Malpighi et les fondements de la microanatomie fonctionnelle” . Anat Rec . 253 (1) : 10–2. doi : 10.1002/(SICI)1097-0185(199802)253:1<10::AID-AR7>3.0.CO;2-I . PMID 9556019 .
- ^ Adelmann HB, Malpighi M (1966). Marcello Malpighi et l’évolution de l’embryologie . Vol. 5. Ithaca, NY : Cornell University Press. OCLC 306783 .
- ^ Bichat X (1801). “Considérations générales” . Anatomie générale appliquée à la physiologie et à la médecine . Paris : Chez Brosson, Gabon et Cie, Libraires, rue Pierre-Sarrazin, no. 7, et place de l’École de Médecine. p. cvj–cxj.
- ^ AF Mayer (1819). Ueber Histologie und eine neue Eintheilung der Gewebe des menschlichen Körpers (en allemand). Bonn : Adolf Marcus.
- ^ un bc Bock O (2015). “Une histoire du développement de l’histologie jusqu’à la fin du XIXe siècle” . Recherche . 2 : 1283. doi : 10.13070/rs.en.2.1283 (inactif le 28 février 2022). {{cite journal}}: Maint CS1 : DOI inactif depuis février 2022 ( lien )
- ^ Plutôt LJ (1978). La genèse du cancer : une étude dans l’histoire des idées . Baltimore : presse universitaire Johns Hopkins. ISBN 9780801821035.La plupart des vingt et un tissus de Bichat peuvent être subsumés dans les quatre catégories généralement acceptées par les histologues contemporains ; épithélium, tissu conjonctif, muscle et nerf. Quatre des tissus de Bichat relèvent de l’épithélium (épidermoïde, muqueux, séreux et synovial) ; six sous tissu conjonctif (dermoïde, fibreux, fibrocartilagineux, cartilagineux, osseux et cellulaire); deux sous le muscle ; et deux sous nerf — la distinction entre la vie « animale » qui gouverne la vie nerveuse et la vie « organique » qui gouverne la vie nerveuse correspond à celle entre les systèmes nerveux volontaire et involontaire. Les artères et les veines, longtemps sources de contention, sont aujourd’hui classées comme tissus composés. Les absorbants et les exhalants (que Bichat considérait comme des vases ouverts) ont disparu ou ont été remplacés par les lymphatiques.
- ^ Meli DB (2017). Visualiser la maladie : l’art et l’histoire des illustrations pathologiques . Chicago : Presse de l’Université de Chicago. [ page nécessaire ]
- ^ Bock, Ortwin (2015-01-05). “Une histoire du développement de l’histologie jusqu’à la fin du XIXe siècle” . Recherche .
- ^ “Le prix Nobel de physiologie ou médecine 1906” . PrixNobel.org .
- ^ Domietto, Marco; Rudin, Markus (2014). « La résonance magnétique pourrait-elle fournir une histologie in vivo ? » . Frontières en génétique . 4 : 298. doi : 10.3389/fgene.2013.00298 . ISSN 1664-8021 . PMC 3888945 . PMID 24454320 .
- ^ Delnoij, Thijs; van Suylen, Robert Jan; Cleutjens, Jack PM ; Schalla, Simon; Bekkers, Sebastiaan CAM (octobre 2009). “Histologie in vivo par imagerie par résonance magnétique cardiovasculaire” . Journal européen du cœur . 30 (20): 2492. doi : 10.1093/eurheartj/ehp319 . ISSN 1522-9645 . PMID 19696188 .
- ^ Pont, Holly; Claire, Stuart (2006-01-29). « IRM haute résolution : histologie in vivo ? . Transactions philosophiques de la Royal Society B: Sciences biologiques . 361 (1465): 137–146. doi : 10.1098/rstb.2005.1777 . ISSN 0962-8436 . PMC 1626544 . PMID 16553313 .
- ^ Deistung, Andreas; Schäfer, Andreas; Schweser, Ferdinand; Biedermann, Uta; Turner, Robert; Reichenbach, Jürgen R. (janvier 2013). “Vers l’histologie in vivo: une comparaison de la cartographie de susceptibilité quantitative (QSM) avec l’imagerie de magnitude, de phase et R2⁎ à une intensité de champ magnétique ultra-élevée”. NeuroImage . 65 : 299–314. doi : 10.1016/j.neuroimage.2012.09.055 . PMID 23036448 . S2CID 140122831 .
-
![icon]()
![icon]() Portail de la médecine
Portail de la médecine
