Essai clinique
Les essais cliniques sont des expériences ou des observations faites dans le cadre de la recherche clinique . Ces études prospectives de recherche biomédicale ou comportementale sur des participants humains sont conçues pour répondre à des questions spécifiques sur les interventions biomédicales ou comportementales, y compris les nouveaux traitements (tels que les nouveaux vaccins , les médicaments , les choix alimentaires , les compléments alimentaires et les dispositifs médicaux ) et les interventions connues qui justifient une étude plus approfondie. et comparaison. Les essais cliniques génèrent des données sur la posologie, l’innocuité et l’ efficacité . [1] Ils ne sont menés qu’après avoir reçu l’avis de l’autorité sanitaire/du comité d’éthiquel’approbation dans le pays où l’approbation de la thérapie est demandée. Ces autorités sont chargées de vérifier le rapport bénéfice/risque de l’essai. Leur approbation ne signifie pas que la thérapie est « sûre » ou efficace, mais seulement que l’essai peut être mené.
 Un participant à un essai clinique reçoit une injection
Un participant à un essai clinique reçoit une injection
Selon le type de produit et le stade de développement, les chercheurs recrutent initialement des volontaires ou des patients dans de petites études pilotes , puis mènent des études comparatives à plus grande échelle. Les essais cliniques peuvent varier en taille et en coût, et ils peuvent impliquer un seul centre de recherche ou plusieurs centres , dans un pays ou dans plusieurs pays. La conception de l’étude clinique vise à assurer la validité scientifique et la reproductibilité des résultats.
Les coûts des essais cliniques peuvent atteindre des milliards de dollars par médicament approuvé. [2] Le promoteur peut être une organisation gouvernementale ou une société pharmaceutique , biotechnologique ou de dispositifs médicaux . Certaines fonctions nécessaires à l’essai, telles que la surveillance et les travaux de laboratoire, peuvent être gérées par un partenaire externalisé, tel qu’un organisme de recherche sous contrat ou un laboratoire central. Seulement 10 pour cent de tous les médicaments lancés dans les essais cliniques humains deviennent des médicaments approuvés . [3]
Aperçu
Essais de médicaments
Certains essais cliniques impliquent des sujets en bonne santé sans Conditions médicales préexistantes . D’autres essais cliniques concernent des personnes ayant des problèmes de santé spécifiques qui sont prêtes à essayer un traitement expérimental. Des expériences pilotes sont menées pour mieux comprendre la conception de l’essai clinique à suivre.
Les tests de traitements médicaux ont deux objectifs : savoir s’ils fonctionnent suffisamment bien, ce que l’on appelle « l’efficacité » ou « l’efficacité » ; et pour savoir s’ils sont suffisamment sûrs, appelés “sécurité”. Ni l’un ni l’autre n’est un critère absolu; l’innocuité et l’efficacité sont évaluées en fonction de la manière dont le traitement est destiné à être utilisé, des autres traitements disponibles et de la gravité de la maladie ou de l’état. Les avantages doivent l’emporter sur les risques. [4] [5] : 8 Par exemple, de nombreux médicaments pour traiter le cancer ont des effets secondaires graves qui ne seraient pas acceptables pour un analgésique en vente libre, mais les médicaments anticancéreux ont été approuvés car ils sont utilisés sous les soins d’un médecin et sont utilisés pour une maladie potentiellement mortelle. [6]
Aux États-Unis, les personnes âgées constituent 14 % de la population, alors qu’elles consomment plus du tiers des médicaments. [7] Les personnes de plus de 55 ans (ou d’un âge limite similaire) sont souvent exclues des essais parce que leurs problèmes de santé plus importants et leur consommation de drogue compliquent l’interprétation des données, et parce qu’elles ont des capacités physiologiques différentes de celles des personnes plus jeunes. Les enfants et les personnes souffrant de troubles médicaux non liés sont également fréquemment exclus. [8] Les femmes enceintes sont souvent exclues en raison des risques potentiels pour le fœtus .
Le promoteur conçoit l’essai en coordination avec un panel d’investigateurs cliniques experts, y compris les traitements alternatifs ou existants à comparer au nouveau médicament et le(s) type(s) de patients qui pourraient en bénéficier. Si le promoteur ne peut pas obtenir suffisamment de sujets de test à un endroit, des investigateurs à d’autres endroits sont recrutés pour participer à l’étude.
Au cours de l’essai, les enquêteurs recrutent des sujets présentant les caractéristiques prédéterminées, administrent le ou les traitements et collectent des données sur la santé des sujets pendant une période de temps définie. Les données comprennent des mesures telles que les signes vitaux , la concentration du médicament à l’étude dans le sang ou les tissus, les modifications des symptômes et l’amélioration ou l’aggravation de l’état ciblé par le médicament à l’étude. Les chercheurs envoient les données au promoteur de l’essai, qui analyse ensuite les données regroupées à l’aide de tests statistiques .
Des exemples d’objectifs d’essais cliniques comprennent l’évaluation de l’innocuité et de l’efficacité relative d’un médicament ou d’un dispositif :
- Sur un type de patient spécifique
- A dosage variable
- Pour une nouvelle indication
- Évaluation de l’efficacité améliorée dans le traitement d’une affection par rapport à la thérapie standard pour cette affection
- Évaluation du médicament ou du dispositif à l’étude par rapport à au moins deux interventions déjà approuvées/communes pour cette affection
Alors que la plupart des essais cliniques testent une alternative à la nouvelle intervention, certains s’étendent à trois ou quatre et peuvent inclure un placebo .
À l’exception des petits essais à site unique, la conception et les objectifs sont spécifiés dans un document appelé Protocole d’essai clinique . Le protocole est le “manuel d’utilisation” de l’essai et garantit que tous les chercheurs effectuent l’essai de la même manière sur des sujets similaires et que les données sont comparables entre tous les sujets.
Comme un essai est conçu pour tester des hypothèses et surveiller et évaluer rigoureusement les résultats, il peut être considéré comme une application de la méthode scientifique , en particulier l’étape expérimentale.
Les essais cliniques les plus courants évaluent de nouveaux produits pharmaceutiques , des dispositifs médicaux, des produits biologiques , des Thérapies psychologiques ou d’autres interventions. Des essais cliniques peuvent être nécessaires avant qu’une autorité réglementaire nationale [9] n’approuve la commercialisation de l’innovation.
Essais d’appareils
Comme pour les médicaments, les fabricants de dispositifs médicaux aux États-Unis sont tenus de mener des essais cliniques pour une approbation préalable à la commercialisation . [10] Les essais d’appareils peuvent comparer un nouvel appareil à une thérapie établie, ou peuvent comparer des appareils similaires les uns aux autres. Un exemple de la première dans le domaine de la chirurgie vasculaire est l’essai Open versus Endovascular Repair (OVER) pour le traitement de l’anévrisme de l’aorte abdominale , qui a comparé l’ancienne technique de réparation de l’aorte ouverte au nouveau dispositif de réparation endovasculaire des anévrismes . [11] Un exemple de ces derniers sont les essais cliniques sur les dispositifs mécaniques utilisés dans la prise en charge de l’incontinence urinaire chez la femme adulte. [12]
Essais de procédures
Comme pour les médicaments, les procédures médicales ou chirurgicales peuvent être soumises à des essais cliniques, [13] tels que des études cas-témoins pour des Interventions chirurgicales. [14]
Histoire
Les concepts derrière les essais cliniques sont anciens. Le livre de Daniel chapitre 1, versets 12 à 15, par exemple, décrit une expérience planifiée avec des observations de base et de suivi de deux groupes qui ont soit consommé, soit non consommé, “la viande du roi” pendant une période d’essai. de dix jours. Le médecin persan Avicenne , dans Le Canon de la médecine (1025) a donné des conseils similaires pour déterminer l’efficacité des médicaments et des substances médicales . [15]
Développement
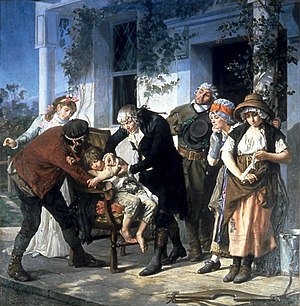
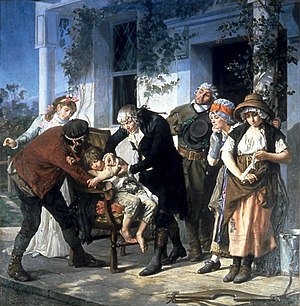 Edward Jenner vaccinant James Phipps , un garçon de huit ans, le 14 mai 1796. Jenner n’a pas utilisé de groupe témoin .
Edward Jenner vaccinant James Phipps , un garçon de huit ans, le 14 mai 1796. Jenner n’a pas utilisé de groupe témoin .
Bien que des expérimentations médicales précoces aient souvent été réalisées, l’utilisation d’un groupe témoin pour fournir une comparaison précise pour la démonstration de l’efficacité de l’intervention faisait généralement défaut. Par exemple, Lady Mary Wortley Montagu , qui a fait campagne pour l’introduction de l’ inoculation (alors appelée variolation) pour prévenir la variole , s’est arrangée pour que sept prisonniers qui avaient été condamnés à mort subissent une variolation en échange de leur vie. Bien qu’ils aient survécu et n’aient pas contracté la variole, il n’y avait pas de groupe témoin pour évaluer si ce résultat était dû à l’inoculation ou à un autre facteur. Des expériences similaires réalisées par Edward Jenner sur son vaccin contre la varioleétaient tout aussi erronés sur le plan conceptuel. [15]
Le premier véritable essai clinique a été mené par le médecin écossais James Lind . [16] La maladie du scorbut , désormais connue pour être causée par une carence en vitamine C , aurait souvent des effets terribles sur le bien-être de l’équipage des voyages océaniques au long cours. En 1740, le résultat catastrophique de la circumnavigation d’ Anson attira beaucoup d’attention en Europe ; sur 1900 hommes, 1400 étaient morts, la plupart d’entre eux auraient contracté le scorbut. [17] John Woodall , un chirurgien militaire anglais de la British East India Company , avait recommandé la consommation d’ Agrumes (il a une action Antiscorbutique effet) à partir du 17ème siècle, mais leur usage ne s’est pas généralisé. [18]
Lind a mené le premier essai clinique systématique en 1747. [19] Il a inclus un complément alimentaire de qualité acide dans l’expérience après deux mois en mer, alors que le navire était déjà atteint de scorbut. Il répartit douze marins scorbutiques en six groupes de deux. Ils recevaient tous le même régime alimentaire mais, en plus, le groupe un recevait un litre de cidre par jour, le groupe deux vingt-cinq gouttes d’élixir de vitriol ( acide sulfurique ), le groupe trois six cuillerées de vinaigre , le groupe quatre un demi-litre d’eau de mer , le groupe cinq a reçu deux oranges et un citron , et le dernier groupe une pâte épicée plus un verre d’ eau d’orge. Le traitement du groupe cinq s’est arrêté après six jours lorsqu’ils ont manqué de fruits, mais à ce moment-là, un marin était apte au travail tandis que l’autre avait presque récupéré. En dehors de cela, seul le groupe un a également montré un effet de son traitement. [20]
Après 1750, la discipline commence à prendre sa forme moderne. [21] [22] Le médecin anglais John Haygarth a démontré l’importance d’un groupe témoin pour l’identification correcte de l’ Effet placebo dans sa célèbre étude du remède inefficace appelé les tracteurs de Perkin . D’autres travaux dans cette direction ont été menés par l’éminent médecin Sir William Gull, 1er baronnet dans les années 1860. [15]
Frederick Akbar Mahomed (décédé en 1884), qui a travaillé au Guy’s Hospital de Londres , a apporté des contributions substantielles au processus d’essais cliniques, où “il a séparé la néphrite chronique avec hypertension secondaire de ce que nous appelons maintenant l’hypertension essentielle ” . Record pour la British Medical Association ; cette organisation a collecté des données auprès de médecins exerçant en dehors du cadre hospitalier et a été le précurseur des essais cliniques collaboratifs modernes.” [23]
Essais modernes

 Austin Bradford Hill a joué un rôle central dans le développement moderne des essais cliniques.
Austin Bradford Hill a joué un rôle central dans le développement moderne des essais cliniques.
Sir Ronald A. Fisher , alors qu’il travaillait pour la Station expérimentale de Rothamsted dans le domaine de l’agriculture, a développé ses principes de conception expérimentale dans les années 1920 en tant que méthodologie précise pour la conception appropriée des expériences. Parmi ses principales idées, figurait l’importance de la randomisation – l’assignation aléatoire d’individus à différents groupes pour l’expérience; [24] réplication — pour réduire l’incertitude , les mesures doivent être répétées et les expériences reproduites pour identifier les sources de variation ; [25] blocage— organiser les unités expérimentales en groupes d’unités similaires les unes aux autres, et ainsi réduire les sources de variation non pertinentes ; utilisation d’ expériences factorielles — efficaces pour évaluer les effets et les interactions possibles de plusieurs facteurs indépendants. [15]
Le British Medical Research Council a officiellement reconnu l’importance des essais cliniques à partir des années 1930. Le conseil a créé le comité des essais thérapeutiques pour conseiller et aider à l’organisation d’essais cliniques correctement contrôlés sur de nouveaux produits qui semblent susceptibles, sur des bases expérimentales, d’avoir une valeur dans le traitement de la maladie. [15]
Le premier essai curatif randomisé a été réalisé à l’unité de recherche sur la tuberculose du MRC par Sir Geoffrey Marshall (1887-1982). L’essai, mené entre 1946 et 1947, visait à tester l’efficacité de la streptomycine chimique pour guérir la tuberculose pulmonaire . L’essai était à la fois en double aveugle et contrôlé par placebo . [26]
La méthodologie des essais cliniques a été développée plus avant par Sir Austin Bradford Hill , qui avait participé aux essais sur la streptomycine. À partir des années 1920, Hill applique les statistiques à la médecine, assistant entre autres aux cours du célèbre mathématicien Karl Pearson . Il est devenu célèbre pour une étude marquante menée en collaboration avec Richard Doll sur la corrélation entre le tabagisme et le cancer du poumon . Ils ont mené une étude cas-témoins en 1950, qui comparait des patients atteints d’un cancer du poumon à des témoins appariés, et a également lancé une étude prospective à long terme sur la question plus large du tabagisme et de la santé, qui impliquaitétudiant les habitudes tabagiques et la santé de plus de 30 000 médecins sur une période de plusieurs années. Son certificat d’élection à la Royal Society l’appelait “… le chef de file dans le développement en médecine des méthodes expérimentales précises maintenant utilisées à l’échelle nationale et internationale dans l’évaluation de nouveaux agents thérapeutiques et prophylactiques “.
La Journée internationale des essais cliniques est célébrée le 20 mai. [27]
Les acronymes utilisés dans le titre des essais cliniques sont souvent artificiels et ont fait l’objet de dérision. [28]
Les types
Les essais cliniques sont classés selon l’objectif de recherche créé par les investigateurs. [29]
- Dans une étude observationnelle , les chercheurs observent les sujets et mesurent leurs résultats. Les chercheurs ne gèrent pas activement l’étude. [30]
- Dans une étude interventionnelle , les chercheurs donnent aux sujets de recherche un médicament expérimental, une intervention chirurgicale, l’utilisation d’un dispositif médical, un diagnostic ou une autre intervention pour comparer les sujets traités avec ceux qui ne reçoivent aucun traitement ou le traitement standard. Ensuite, les chercheurs évaluent l’évolution de la santé des sujets. [30]
Les essais sont classés selon leur objectif. Une fois l’approbation de la recherche humaine accordée au promoteur de l’essai, la Food and Drug Administration (FDA) des États-Unis organise et surveille les résultats des essais selon leur type : [29]
- Les essais de prévention cherchent des moyens de prévenir la maladie chez les personnes qui n’ont jamais eu la maladie ou d’empêcher la récidive de la maladie. Ces approches peuvent inclure des médicaments , des vitamines ou d’autres micronutriments , des vaccins ou des changements de mode de vie.
- Les essais de dépistage testent les moyens d’identifier certaines maladies ou certains problèmes de santé.
- Des essais de diagnostic sont menés pour trouver de meilleurs tests ou procédures pour diagnostiquer une maladie ou un état particulier.
- Les essais de traitement testent des médicaments expérimentaux, de nouvelles combinaisons de médicaments ou de nouvelles approches de chirurgie ou de radiothérapie .
- Les essais sur la qualité de vie (essais sur les soins de soutien) évaluent comment améliorer le confort et la qualité des soins pour les personnes atteintes d’une maladie chronique .
- Des essais génétiques sont menés pour évaluer l’exactitude de la prédiction des troubles génétiques rendant une personne plus ou moins susceptible de développer une maladie.
- Les essais épidémiologiques ont pour objectif d’identifier les causes générales, les schémas ou le contrôle des maladies chez un grand nombre de personnes.
- Les essais d’ utilisation compassionnelle ou les essais d’ accès élargi fournissent des traitements partiellement testés et non approuvés à un petit nombre de patients qui n’ont pas d’autres options réalistes. Habituellement, il s’agit d’une maladie pour laquelle aucun traitement efficace n’a été approuvé, ou d’un patient qui a déjà échoué à tous les traitements standards et dont la santé est trop compromise pour se qualifier pour participer à des essais cliniques randomisés. [31] Habituellement, une approbation au cas par cas doit être accordée à la fois par la FDA et la société pharmaceutique pour de telles exceptions.
- Les essais fixes ne prennent en compte les données existantes que pendant la conception de l’essai, ne modifient pas l’essai une fois qu’il a commencé et n’évaluent pas les résultats tant que l’étude n’est pas terminée.
- Les essais cliniques adaptatifs utilisent les données existantes pour concevoir l’essai, puis utilisent les résultats intermédiaires pour modifier l’essai au fur et à mesure de son déroulement. Les modifications comprennent la posologie, la taille de l’échantillon, le médicament en cours d’essai, les critères de sélection des patients et le mélange « cocktail ». [32] Les essais adaptatifs emploient souvent une conception expérimentale bayésienne pour évaluer les progrès de l’essai. Dans certains cas, les essais sont devenus un processus continu qui ajoute et supprime régulièrement des thérapies et des groupes de patients à mesure que davantage d’informations sont obtenues. [33] L’objectif est d’identifier plus rapidement les médicaments qui ont un effet thérapeutique et de cibler les populations de patients pour lesquelles le médicament est approprié. [34] [35]
Les essais cliniques sont généralement menés en quatre phases, chaque phase utilisant un nombre différent de sujets et ayant un objectif différent pour se concentrer sur l’identification d’un effet spécifique. [29]
Étapes
Vidéo de l’ Institut national du cancer sur les phases des essais cliniques
Les essais cliniques impliquant de nouveaux médicaments sont généralement classés en cinq phases. Chaque phase du processus d’approbation des médicaments est traitée comme un essai clinique distinct. Le processus de développement de médicaments passera normalement par les phases I à IV sur de nombreuses années, impliquant souvent une décennie ou plus. Si le médicament passe avec succès les phases I, II et III, il sera généralement approuvé par l’autorité réglementaire nationale pour une utilisation dans la population générale. [29] Les essais de phase IV sont effectués après la commercialisation du médicament, du diagnostic ou de l’appareil nouvellement approuvé, fournissant une évaluation des risques, des avantages ou des meilleures utilisations. [29]
| Phase | Objectif | Remarques |
|---|---|---|
| Phase 0 | Pharmacodynamique et pharmacocinétique chez l’homme | Les essais de phase 0 sont des premiers essais chez l’homme facultatifs. Des doses sous-thérapeutiques uniques du médicament à l’étude ou du traitement sont administrées à un petit nombre de sujets (généralement 10 à 15) pour recueillir des données préliminaires sur la pharmacodynamique de l’agent (ce que le médicament fait au corps) et la pharmacocinétique (ce que le corps fait aux médicaments ). [36] Pour un médicament test, l’essai documente l’absorption, la distribution, la métabolisation et la clairance (excrétion) du médicament, ainsi que les interactions du médicament dans le corps, pour confirmer qu’elles semblent être comme prévu. |
| La phase I | Dépistage pour la sécurité | Il s’agit souvent d’essais en personne. Tests au sein d’un petit groupe de personnes (généralement 20 à 80) pour évaluer la sécurité, déterminer les plages de dosage sûres et identifier les effets secondaires . [29] |
| Phase II | Établir l’efficacité préliminaire du médicament dans un “groupe de traitement” , généralement par rapport à un groupe témoin placebo | La phase IIa est spécifiquement conçue pour évaluer les besoins de dosage (la quantité de médicament à administrer), [29] [37] tandis qu’un essai de phase IIb est conçu pour déterminer l’efficacité et étudie l’efficacité du médicament à la ou aux doses prescrites, établir une gamme de doses thérapeutiques. [37] |
| Phase III | Confirmation finale de l’innocuité et de l’efficacité | Tester avec de grands groupes de personnes (généralement 1 000 à 3 000) pour confirmer son efficacité, évaluer son efficacité, surveiller les effets secondaires, le comparer aux traitements couramment utilisés et collecter des informations qui permettront de l’utiliser en toute sécurité. [29] |
| Phase IV | Etudes de sécurité lors des soldes | Les études post-commercialisation délimitent les risques, les avantages et l’utilisation optimale. En tant que tels, ils se poursuivent pendant la durée de vie de l’utilisation médicale active du médicament. [29] |
Conception d’essai
Une distinction fondamentale dans la pratique fondée sur des données probantes est entre les études observationnelles et les essais contrôlés randomisés . [38] Les types d’études observationnelles en épidémiologie , telles que l’ étude de cohorte et l’ étude cas-témoin , fournissent des preuves moins convaincantes que l’essai contrôlé randomisé. [38] Dans les études observationnelles, les enquêteurs évaluent rétrospectivement les associations entre les traitements administrés aux participants et leur état de santé, avec un potentiel d’erreurs considérables dans la conception et l’interprétation. [39]
Un essai contrôlé randomisé peut fournir des preuves convaincantes que le traitement à l’étude a un effet sur la santé humaine. [38]
Actuellement, certains essais de phase II et la plupart des essais de phase III sont conçus comme randomisés, en double aveugle et contrôlés par placebo .
- Vidéo de l’ Institut national du cancer sur la randomisation des essais cliniques Randomisé : chaque sujet de l’étude est assigné au hasard pour recevoir soit le traitement à l’étude, soit un placebo.
- Aveugle : les sujets impliqués dans l’étude ne savent pas quel traitement à l’étude ils reçoivent. Si l’étude est en double aveugle, les chercheurs ne savent pas non plus quel traitement un sujet reçoit. Cette intention est d’empêcher les chercheurs de traiter les deux groupes différemment. Une forme d’étude en double aveugle appelée conception “double factice” permet une assurance supplémentaire contre les biais. Dans ce type d’étude, tous les patients reçoivent à la fois un placebo et des doses actives en alternance.
- Contre placebo : L’utilisation d’un placebo (traitement fictif) permet aux chercheurs d’isoler l’effet du traitement à l’étude de l’ Effet placebo .
Les études cliniques ayant un petit nombre de sujets peuvent être «parrainées» par des chercheurs uniques ou un petit groupe de chercheurs, et sont conçues pour tester des questions simples ou la faisabilité d’élargir la recherche pour un essai contrôlé randomisé plus complet. [40]
Études de contrôle actif
Dans de nombreux cas, donner un placebo à une personne souffrant d’une maladie peut être contraire à l’éthique. [41] Pour résoudre ce problème, il est devenu une pratique courante de mener des essais de « comparateur actif » (également appelés « contrôles actifs »). Dans les essais avec un groupe témoin actif, les sujets reçoivent soit le traitement expérimental, soit un traitement préalablement approuvé dont l’efficacité est connue.
Protocole maître
Dans de telles études, plusieurs traitements expérimentaux sont testés dans un seul essai. Les tests génétiques permettent aux chercheurs de regrouper les patients en fonction de leur profil génétique, d’administrer des médicaments en fonction de ce profil à ce groupe et de comparer les résultats. Plusieurs entreprises peuvent participer, chacune apportant un médicament différent. La première de ces approches cible le cancer des cellules squameuses , qui comprend des perturbations génétiques variables d’un patient à l’autre. Amgen, AstraZeneca et Pfizer sont impliqués, la première fois qu’ils ont travaillé ensemble dans un essai de stade avancé. Les patients dont les profils génomiques ne correspondent à aucun des médicaments à l’essai reçoivent un médicament conçu pour stimuler le système immunitaire afin qu’il attaque le cancer. [42]
Protocole d’essai clinique
Un Protocole d’essai clinique est un document utilisé pour définir et gérer l’essai. Il est préparé par un panel d’experts. Tous les investigateurs de l’étude doivent respecter strictement le protocole.
Le protocole décrit la justification scientifique, les objectifs, la conception, la méthodologie, les considérations statistiques et l’organisation de l’essai prévu. Les détails de l’essai sont fournis dans des documents référencés dans le protocole, comme une brochure de l’investigateur .
Le protocole contient un plan d’étude précis pour assurer la sécurité et la santé des sujets de l’essai et pour fournir un modèle exact pour la conduite de l’essai par les investigateurs. Cela permet de combiner les données de tous les investigateurs/sites. Le protocole informe également les administrateurs de l’étude (souvent un organisme de recherche sous contrat ).
Le format et le contenu des protocoles d’essais cliniques parrainés par des sociétés pharmaceutiques, biotechnologiques ou de dispositifs médicaux aux États-Unis, dans l’Union européenne ou au Japon ont été normalisés pour suivre les directives de bonnes pratiques cliniques [43] publiées par la Conférence internationale sur l’harmonisation des exigences techniques pour Enregistrement des produits pharmaceutiques à usage humain (ICH). [44] Les autorités réglementaires du Canada et de l’Australie suivent également les lignes directrices de l’ICH. Des revues telles que Trials , encouragent les chercheurs à publier leurs protocoles.
Caractéristiques de conception
Consentement éclairé 
 Exemple de document de consentement éclairé de l’ essai PARAMOUNT
Exemple de document de consentement éclairé de l’ essai PARAMOUNT
Les essais cliniques recrutent des sujets d’étude pour signer un document représentant leur « consentement éclairé ». [45] Le document comprend des détails tels que son objectif, sa durée, les procédures requises, les risques, les avantages potentiels, les contacts clés et les exigences institutionnelles. [46] Le participant décide alors de signer ou non le document. Le document n’est pas un contrat, le participant pouvant se retirer à tout moment sans pénalité.
Le consentement éclairé est un processus juridique dans lequel une recrue est informée des faits clés avant de décider de participer ou non. Les chercheurs expliquent les détails de l’étude dans des termes que le sujet peut comprendre. Les informations sont présentées dans la langue maternelle du sujet. En règle générale, les enfants ne peuvent pas donner de manière autonome un consentement éclairé, mais en fonction de leur âge et d’autres facteurs, ils peuvent être tenus de fournir un consentement éclairé.
Puissance statistique
| Apprendre encore plus Cette section ne cite aucune source . ( novembre 2014 ) Please help improve this section by adding citations to reliable sources. Unsourced material may be challenged and removed. (Learn how and when to remove this template message) |
Dans tout essai clinique, le nombre de sujets, également appelé taille de l’échantillon, a un impact important sur la capacité à détecter et à mesurer de manière fiable les effets de l’intervention. Cette capacité est décrite comme sa « puissance », qui doit être calculée avant de lancer une étude pour déterminer si l’étude en vaut la peine. [47] En général, une taille d’échantillon plus grande augmente la puissance statistique, ainsi que le coût.
La puissance statistique estime la capacité d’un essai à détecter une différence d’une taille particulière (ou plus) entre les groupes de traitement et de contrôle. Par exemple, un essai d’un médicament hypolipidémiant versus placebo avec 100 patients dans chaque groupe pourrait avoir une puissance de 0,90 pour détecter une différence entre le placebo et les groupes d’essai recevant une dose de 10 mg/dL ou plus, mais seulement 0,70 pour détecter une différence. différence de 6 mg/dL.
Groupes placebo
Le simple fait de donner un traitement peut avoir des effets non spécifiques. Ceux-ci sont contrôlés par l’inclusion de patients qui ne reçoivent qu’un placebo. Les sujets sont assignés au hasard sans les informer à quel groupe ils appartenaient. De nombreux essais sont en double aveugle, de sorte que les chercheurs ne savent pas à quel groupe un sujet est affecté.
L’assignation d’un sujet à un groupe placebo peut poser un problème éthique si cela viole son droit de recevoir le meilleur traitement disponible. La Déclaration d’Helsinki fournit des lignes directrices sur cette question.
Durée

 Chronologie des différentes pistes d’approbation et phases de recherche aux États-Unis
Chronologie des différentes pistes d’approbation et phases de recherche aux États-Unis
Les essais cliniques ne représentent qu’une petite partie de la recherche nécessaire au développement d’un nouveau traitement. Les médicaments potentiels, par exemple, doivent d’abord être découverts, purifiés, caractérisés et testés en laboratoire (dans des études cellulaires et animales) avant de subir des essais cliniques. Au total, environ 1 000 médicaments potentiels sont testés avant qu’un seul n’atteigne le point d’être testé dans un essai clinique. [48] Par exemple, un nouveau médicament anticancéreux a, en moyenne, six ans de recherche derrière lui avant même d’atteindre les essais cliniques. Mais le principal obstacle à la mise à disposition de nouveaux médicaments anticancéreux est le temps nécessaire pour terminer les essais cliniques eux-mêmes. En moyenne, environ huit ans s’écoulent entre le moment où un médicament anticancéreux entre dans les essais cliniques et celui où il reçoit l’approbation des organismes de réglementation pour la vente au public. [49]Les médicaments pour d’autres maladies ont des délais similaires.
Quelques raisons pour lesquelles un essai clinique peut durer plusieurs années :
- Pour les maladies chroniques telles que le cancer, il faut des mois, voire des années, pour voir si un traitement contre le cancer a un effet sur un patient.
- Pour les médicaments dont on ne s’attend pas à ce qu’ils aient un effet important (ce qui signifie qu’un grand nombre de patients doivent être recrutés pour observer « n’importe quel » effet), recruter suffisamment de patients pour tester l’efficacité du médicament (c’est-à-dire obtenir une puissance statistique) peut prendre plusieurs années.
- Seules certaines personnes atteintes de la maladie cible sont éligibles pour participer à chaque essai clinique. Les chercheurs qui traitent ces patients particuliers doivent participer à l’essai. Ensuite, ils doivent identifier les patients souhaitables et obtenir leur consentement ou celui de leur famille pour participer à l’essai.
Un essai clinique peut également inclure une période de suivi post-étude prolongée de plusieurs mois à plusieurs années pour les personnes qui ont participé à l’essai, une soi-disant “phase d’extension”, qui vise à identifier l’impact à long terme du traitement. [50]
Le plus grand obstacle à l’achèvement des études est la pénurie de personnes qui y participent. Tous les essais de médicaments et de nombreux dispositifs ciblent un sous-ensemble de la population, ce qui signifie que tout le monde ne peut pas participer. Certains essais de médicaments exigent que les patients présentent des combinaisons inhabituelles de caractéristiques de la maladie. Il est difficile de trouver les patients appropriés et d’obtenir leur consentement, en particulier lorsqu’ils ne reçoivent aucun avantage direct (parce qu’ils ne sont pas payés, que le médicament à l’étude n’a pas encore prouvé son efficacité ou que le patient peut recevoir un placebo). Dans le cas des patients atteints de cancer, moins de 5 % des adultes atteints de cancer participeront à des essais de médicaments. Selon la Pharmaceutical Research and Manufacturers of America (PhRMA), environ 400 médicaments anticancéreux ont été testés dans des essais cliniques en 2005. Tous ne se révéleront pas utiles,[51]
Pour les essais cliniques impliquant un potentiel d’influences saisonnières (telles que les allergies aéroportées , les troubles affectifs saisonniers , la grippe et les maladies de la peau ), l’étude peut être réalisée pendant une partie limitée de l’année (comme le printemps pour les allergies au pollen), lorsque le médicament peut être testé. [52] [53]
Les essais cliniques qui n’impliquent pas un nouveau médicament ont généralement une durée beaucoup plus courte. (Les exceptions sont les études épidémiologiques, telles que l’ étude sur la santé des infirmières ).
Administration
| Apprendre encore plus Cette section ne cite aucune source . ( novembre 2014 ) Please help improve this section by adding citations to reliable sources. Unsourced material may be challenged and removed. (Learn how and when to remove this template message) |
Les essais cliniques conçus par un chercheur local et (aux États-Unis) les essais cliniques financés par le gouvernement fédéral sont presque toujours administrés par le chercheur qui a conçu l’étude et demandé la subvention. Les études sur les dispositifs à petite échelle peuvent être administrées par l’entreprise commanditaire. Les essais cliniques de nouveaux médicaments sont généralement administrés par une organisation de recherche sous contrat (CRO) engagée par la société commanditaire. Le promoteur assure la surveillance médicamenteuse et médicale. Un CRO est engagé pour effectuer tout le travail administratif d’un essai clinique. Pour les Phases II–IV le CRO recrute les chercheurs participants, les forme, les fournit en matériel, coordonne l’administration de l’étude et la collecte des données, organise des réunions, surveille la conformité des sites avec le protocole clinique et s’assure que le promoteur reçoit les données de chaque site. Des organisations de gestion de site spécialisées peuvent également être embauchées pour assurer la coordination avec le CRO afin d’assurer une approbation rapide de l’IRB/IEC et une initiation du site et un recrutement des patients plus rapides. Les essais cliniques de phase I de nouveaux médicaments sont souvent menés dans une clinique d’essais cliniques spécialisée, avec des pharmacologues dédiés, où les sujets peuvent être observés par du personnel à temps plein. Ces cliniques sont souvent dirigées par un CRO spécialisé dans ces études.
Dans un site participant, un ou plusieurs assistants de recherche (souvent des infirmières) effectuent la majeure partie du travail de conduite de l’essai clinique. Le travail de l’assistant de recherche peut inclure tout ou partie des éléments suivants : fournir au comité d’examen institutionnel (IRB) local la documentation nécessaire pour obtenir son autorisation de mener l’étude, aider au démarrage de l’étude, identifier les patients éligibles, obtenir leur consentement ou leurs familles, administrer le(s) traitement(s) de l’étude, collecter et analyser statistiquement les données, maintenir et mettre à jour les fichiers de données pendant le suivi et communiquer avec l’IRB, ainsi qu’avec le sponsor et le CRO.
Qualité
Dans le contexte d’un essai clinique, la qualité se réfère généralement à l’absence d’erreurs qui peuvent avoir un impact sur la prise de décision, à la fois pendant la conduite de l’essai et dans l’utilisation des résultats de l’essai. [54]
Commercialisation
Janet Yang utilise le modèle de justice interactionnelle pour tester les effets de la volonté de parler avec un médecin et de l’inscription à un essai clinique. [55]Les résultats ont révélé que les candidats potentiels aux essais cliniques étaient moins susceptibles de s’inscrire à des essais cliniques si le patient était plus disposé à parler avec son médecin. Le raisonnement derrière cette découverte peut être que les patients sont satisfaits de leurs soins actuels. Une autre raison de la relation négative entre l’équité perçue et l’inscription aux essais cliniques est le manque d’indépendance vis-à-vis du prestataire de soins. Les résultats ont révélé qu’il existe une relation positive entre le manque de volonté de parler avec leur médecin et l’inscription aux essais cliniques. Le manque de volonté de parler des essais cliniques avec les prestataires de soins actuels peut être dû à l’indépendance des patients vis-à-vis du médecin. Les patients qui sont moins susceptibles de parler d’essais cliniques sont plus enclins à utiliser d’autres sources d’information pour mieux comprendre les traitements alternatifs.
Informatique
La dernière décennie a vu une prolifération de l’utilisation des technologies de l’information dans la planification et la conduite des essais cliniques. Les systèmes de gestion des essais cliniques sont souvent utilisés par les promoteurs de recherche ou les CRO pour aider à planifier et à gérer les aspects opérationnels d’un essai clinique, en particulier en ce qui concerne les sites de recherche. L’analyse avancée pour identifier les chercheurs et les sites de recherche ayant une expertise dans un domaine donné utilise des informations publiques et privées sur la recherche en cours. [56] La capture électronique de données (EDC) basée sur le Web et les systèmes de gestion des données cliniques sont utilisés dans la majorité des essais cliniques [57]pour collecter les données des rapports de cas des sites, gérer leur qualité et les préparer pour l’analyse. Les systèmes de réponse vocale interactifs sont utilisés par les sites pour enregistrer l’inscription des patients à l’aide d’un téléphone et pour affecter les patients à un bras de traitement particulier (bien que les téléphones soient de plus en plus remplacés par des outils Web (IWRS) qui font parfois partie du système EDC) . Alors que les résultats rapportés par les patients étaient souvent sur papier dans le passé, les mesures sont de plus en plus collectées à l’aide de portails Web ou d’ appareils ePRO (ou eDiary) portables, parfois sans fil. [58] Logiciel statistiqueest utilisé pour analyser les données collectées et les préparer pour la soumission réglementaire. L’accès à bon nombre de ces applications est de plus en plus regroupé dans des portails d’essais cliniques en ligne . En 2011, la FDA a approuvé un essai de phase I qui utilisait la télésurveillance, également connue sous le nom de surveillance à distance des patients, pour collecter des données biométriques au domicile des patients et les transmettre par voie électronique à la base de données de l’essai. Cette technologie fournit beaucoup plus de points de données et est beaucoup plus pratique pour les patients, car ils ont moins de visites sur les sites d’essai.
Aspects éthiques
Les essais cliniques sont étroitement supervisés par les autorités réglementaires compétentes. Toutes les études impliquant une intervention médicale ou thérapeutique sur des patients doivent être approuvées par un comité d’éthique de supervision avant que l’autorisation ne soit accordée pour mener l’essai. Le comité d’éthique local a toute latitude pour superviser les études non interventionnelles (études observationnelles ou utilisant des données déjà collectées). Aux États-Unis, cet organisme s’appelle l’ Institutional Review Board (IRB); dans l’UE, ils sont appelés comités d’éthique . La plupart des IRB sont situés dans l’hôpital ou l’établissement du chercheur local, mais certains promoteurs autorisent l’utilisation d’un IRB central (indépendant/à but lucratif) pour les chercheurs qui travaillent dans des établissements plus petits.
Pour être éthiques, les chercheurs doivent obtenir le consentement plein et éclairé des sujets humains participants. (L’une des principales fonctions de l’IRB est de s’assurer que les patients potentiels sont correctement informés de l’essai clinique.) Si le patient n’est pas en mesure de donner son consentement, les chercheurs peuvent demander le consentement du représentant légal du patient. En Californie , l’État a donné la priorité aux personnes pouvant servir de représentant légalement autorisé. [59]
Dans certains endroits aux États-Unis, l’IRB local doit certifier les chercheurs et leur personnel avant de pouvoir mener des essais cliniques. Ils doivent comprendre la loi fédérale sur la confidentialité des patients ( HIPAA ) et les bonnes pratiques cliniques. L’International Conference of Harmonisation Guidelines for Good Clinical Practice est un ensemble de normes utilisées à l’échelle internationale pour la conduite d’essais cliniques. Les lignes directrices visent à garantir que “les droits, la sécurité et le bien-être des sujets de l’essai sont protégés”.
La notion de consentement éclairé des sujets humains participants existe dans de nombreux pays mais sa définition précise peut encore varier.
Le consentement éclairé est clairement une condition « nécessaire » pour une conduite éthique mais ne « garantit » pas une conduite éthique. Dans les essais d’usage compassionnel , ce dernier devient un problème particulièrement difficile. L’objectif final est de servir la communauté des patients ou futurs patients de la meilleure façon possible et la plus responsable. Voir aussi Accès étendu . Cependant, il peut être difficile de transformer cet objectif en une fonction objective bien définie et quantifiée. Dans certains cas, cela peut être fait, cependant, par exemple, pour les questions de savoir quand arrêter les traitements séquentiels (voir Algorithme de cotes ), puis les méthodes quantifiées peuvent jouer un rôle important.
Des préoccupations éthiques supplémentaires sont présentes lors de la réalisation d’essais cliniques sur des enfants ( pédiatrie ) et dans des situations d’urgence ou d’épidémie. [60] [61]
Équilibrer éthiquement les droits de plusieurs parties prenantes peut être difficile. Par exemple, lorsque les essais de médicaments échouent, les sponsors peuvent avoir le devoir d’informer immédiatement les investisseurs actuels et potentiels, ce qui signifie que le personnel de recherche et les participants inscrits peuvent d’abord entendre parler de la fin d’un essai par le biais d’ informations commerciales publiques . [62]
Conflits d’intérêts et études défavorables
En réponse à des cas spécifiques dans lesquels des données défavorables issues de recherches parrainées par des sociétés pharmaceutiques n’ont pas été publiées, Pharmaceutical Research and Manufacturers of America a publié de nouvelles directives exhortant les sociétés à signaler toutes les découvertes et à limiter l’implication financière des chercheurs dans les sociétés pharmaceutiques. [63] Le Congrès américain a promulgué un projet de loi qui exige que les essais cliniques de phase II et de phase III soient enregistrés par le promoteur sur le site Web clinicaltrials.gov compilé par les National Institutes of Health . [64]
Les chercheurs en médicaments qui ne sont pas directement employés par les sociétés pharmaceutiques recherchent souvent des subventions auprès des fabricants, et les fabricants se tournent souvent vers des chercheurs universitaires pour mener des études au sein de réseaux d’universités et de leurs hôpitaux, par exemple, pour la recherche translationnelle sur le cancer. De même, la concurrence pour les postes universitaires permanents, les subventions gouvernementales et le prestige créent des conflits d’intérêts parmi les scientifiques universitaires. [65] Selon une étude, environ 75 % des articles retirés pour des raisons liées à une inconduite n’ont aucun soutien financier déclaré de l’industrie. [66] Les essais d’ensemencement sont particulièrement controversés. [67]
Aux États-Unis, tous les essais cliniques soumis à la FDA dans le cadre d’un processus d’approbation de médicaments sont évalués de manière indépendante par des experts cliniques au sein de la Food and Drug Administration, [68] y compris des inspections de la collecte de données primaires sur des sites d’essais cliniques sélectionnés. [69]
En 2001, les éditeurs de 12 grandes revues ont publié un éditorial commun, publié dans chaque revue, sur le contrôle des essais cliniques exercé par les promoteurs, ciblant notamment l’utilisation de contrats permettant aux promoteurs de revoir les études avant publication et de suspendre la publication. Ils ont renforcé les restrictions éditoriales pour contrer l’effet. L’éditorial notait que les organisations de recherche sous contrat avaient, en 2000, reçu 60% des subventions des sociétés pharmaceutiques aux États-Unis. Les chercheurs peuvent être empêchés de contribuer à la conception de l’essai, d’accéder aux données brutes et d’interpréter les résultats. [70]
Malgré les recommandations explicites des parties prenantes sur des mesures visant à améliorer les normes de la recherche médicale parrainée par l’industrie [71] , en 2013, Tohen a mis en garde contre la persistance d’un manque de crédibilité des conclusions découlant des essais cliniques financés par l’industrie et a appelé à garantir une le respect des normes éthiques dans les collaborations industrielles avec le milieu universitaire, afin d’éviter une nouvelle érosion de la confiance du public. [72] Les questions portées à l’attention à cet égard comprennent le biais d’observation potentiel, la durée du temps d’observation pour les études d’entretien, la sélection des populations de patients, les facteurs qui affectent la réponse au placebo et les sources de financement. [73] [74] [75]
Pendant les crises de santé publique
La conduite d’essais cliniques de vaccins pendant les épidémies et les pandémies est sujette à des préoccupations éthiques. Pour les maladies à taux de mortalité élevé comme Ebola, l’assignation d’individus à un groupe placebo ou témoin peut être considérée comme une condamnation à mort. En réponse aux préoccupations éthiques concernant la recherche clinique pendant les épidémies, la National Academy of Medicine a rédigé un rapport identifiant sept considérations éthiques et scientifiques. Ces considérations sont : [76]
- Valeur scientifique
- Valeur sociale
- Respect des personnes
- Engagement communautaire
- Souci du bien-être et des intérêts des participants
- Un équilibre entre les avantages et les risques
- Accès post-essai aux thérapies testées qui avaient été refusées pendant l’essai
Femmes enceintes et enfants
Les femmes enceintes et les enfants sont généralement exclus des essais cliniques en tant que populations vulnérables, bien que les données à l’appui de leur exclusion ne soient pas solides. En les excluant des essais cliniques, les informations sur la sécurité et l’efficacité des thérapies pour ces populations font souvent défaut. Au début de l’histoire du VIH/SIDAépidémique, un scientifique a noté qu’en excluant ces groupes d’un traitement potentiellement vital, ils étaient “protégés jusqu’à la mort”. Des projets tels que Research Ethics for Vaccines, Epidemics, and New Technologies (PREVENT) ont plaidé pour l’inclusion éthique des femmes enceintes dans les essais de vaccins. L’inclusion d’enfants dans les essais cliniques comporte des considérations morales supplémentaires, car les enfants manquent d’autonomie de décision. Les procès du passé avaient été critiqués pour avoir utilisé des enfants hospitalisés ou des orphelins; ces préoccupations éthiques ont effectivement arrêté les recherches futures. Afin de maintenir des soins pédiatriques efficaces, plusieurs pays européens et les États-Unis ont des politiques visant à inciter ou à contraindre les sociétés pharmaceutiques à mener des essais pédiatriques. Les directives internationales recommandent des essais pédiatriques éthiques en limitant les dommages, en tenant compte des risques variés,[76]
Sécurité
La responsabilité de la sécurité des sujets d’un essai clinique est partagée entre le promoteur, les investigateurs du site local (s’ils sont différents du promoteur), les divers IRB qui supervisent l’étude et (dans certains cas, si l’étude porte sur un médicament commercialisable ou appareil), l’organisme de réglementation du pays où le médicament ou l’appareil sera vendu.
Un examen systématique et simultané de la sécurité est fréquemment utilisé pour assurer la sécurité des participants à la recherche. La conduite et l’examen continu sont conçus pour être proportionnels au risque de l’essai. En règle générale, ce rôle est rempli par un comité des données et de la sécurité , un contrôleur de la sécurité médicale nommé de l’extérieur, [77] un agent de sécurité indépendant ou, pour les études de petite taille ou à faible risque, le chercheur principal. [78]
Pour des raisons de sécurité, de nombreux essais cliniques de médicaments [79] sont conçus pour exclure les femmes en âge de procréer, les femmes enceintes ou les femmes qui tombent enceintes au cours de l’étude. Dans certains cas, les partenaires masculins de ces femmes sont également exclus ou tenus de prendre des mesures de contraception.
Parrainer
Tout au long de l’essai clinique, le promoteur est responsable d’informer avec précision les enquêteurs du site local du véritable historique de sécurité du médicament, du dispositif ou d’autres traitements médicaux à tester, et de toute interaction potentielle du ou des traitements à l’étude avec des médicaments déjà approuvés. traitements. Cela permet aux enquêteurs locaux de porter un jugement éclairé sur la participation ou non à l’étude. Le promoteur est également responsable du suivi des résultats de l’étude au fur et à mesure qu’ils arrivent des différents sites au fur et à mesure que l’essai progresse. Dans les essais cliniques plus importants, un promoteur utilisera les services d’un comité de surveillance des données (DMC, connu aux États-Unis sous le nom de comité de surveillance de la sécurité des données). Ce groupe indépendant de cliniciens et de statisticiens se réunit périodiquement pour examiner lesdonnées non masquées que le promoteur a reçues jusqu’à présent. Le DMC a le pouvoir de recommander l’arrêt de l’étude sur la base de son examen, par exemple si le traitement à l’étude cause plus de décès que le traitement standard, ou semble causer des événements indésirables graves inattendus et liés à l’étude . Le promoteur est chargé de recueillir les rapports d’ événements indésirables de tous les investigateurs du site de l’étude et d’informer tous les investigateurs du jugement du promoteur quant à savoir si ces événements indésirables étaient liés ou non au traitement de l’étude.
Le promoteur et les enquêteurs du site local sont conjointement responsables de la rédaction d’un consentement éclairé spécifique au site qui informe avec précision les sujets potentiels des risques réels et des avantages potentiels de la participation à l’étude, tout en présentant le matériel aussi brièvement que possible et en langage ordinaire. Les réglementations de la FDA stipulent que la participation aux essais cliniques est volontaire, le sujet ayant le droit de ne pas participer ou de mettre fin à sa participation à tout moment. [80]
Enquêteurs du site local
| Apprendre encore plus Cette section ne cite aucune source . ( novembre 2014 ) Please help improve this section by adding citations to reliable sources. Unsourced material may be challenged and removed. (Learn how and when to remove this template message) |
Le principe éthique de primum non-nocere (“d’abord, ne pas nuire”) guide l’essai, et si un investigateur pense que le traitement à l’étude peut nuire aux sujets de l’étude, l’investigateur peut cesser de participer à tout moment. D’autre part, les enquêteurs ont souvent un intérêt financier à recruter des sujets et pourraient agir de manière contraire à l’éthique pour obtenir et maintenir leur participation.
Les enquêteurs locaux sont chargés de mener l’étude conformément au protocole d’étude et de superviser le personnel de l’étude pendant toute la durée de l’étude. L’investigateur local ou son personnel d’étude sont également chargés de s’assurer que les sujets potentiels de l’étude comprennent les risques et les avantages potentiels de la participation à l’étude. En d’autres termes, ils (ou leurs représentants légalement autorisés) doivent donner un consentement véritablement éclairé.
Les enquêteurs locaux sont chargés d’examiner tous les rapports d’événements indésirables envoyés par le promoteur. Ces rapports d’événements indésirables contiennent les opinions de l’investigateur (sur le site où l’événement indésirable s’est produit) et du promoteur, concernant la relation entre l’événement indésirable et les traitements à l’étude. Les enquêteurs locaux sont également chargés de porter un jugement indépendant sur ces rapports et d’informer rapidement l’IRB local de tous les événements indésirables graves et liés au traitement de l’étude.
Lorsqu’un investigateur local est le promoteur, il se peut qu’il n’y ait pas de rapports officiels d’événements indésirables, mais le personnel de l’étude à tous les endroits est chargé d’informer l’investigateur coordinateur de tout événement inattendu. L’investigateur local est responsable d’être véridique envers l’IRB local dans toutes les communications relatives à l’étude.
Comités d’examen institutionnels (IRB)
L’approbation d’un comité d’ examen institutionnel (IRB) ou d’un comité d’ éthique indépendant (CEI) est nécessaire avant que toutes les recherches, sauf les plus informelles, puissent commencer. Dans les essais cliniques commerciaux, le protocole d’étude n’est pas approuvé par un IRB avant que le promoteur ne recrute des sites pour mener l’essai. Cependant, le protocole et les procédures de l’étude ont été adaptés pour répondre aux exigences génériques de soumission de l’IRB. Dans ce cas, et en l’absence de sponsor indépendant, chaque investigateur du site local soumet le protocole d’étude, le(s) consentement(s), les formulaires de collecte de données et les pièces justificatives à l’IRB local. Les universités et la plupart des hôpitaux ont des IRB internes. D’autres chercheurs (comme dans les cliniques sans rendez-vous) utilisent des IRB indépendants.
L’IRB examine l’étude à la fois pour la sécurité médicale et pour la protection des patients impliqués dans l’étude, avant d’autoriser le chercheur à commencer l’étude. Cela peut nécessiter des changements dans les procédures d’étude ou dans les explications données au patient. Un rapport annuel requis de « révision continue » de l’investigateur informe l’IRB de l’avancement de l’étude et de toute nouvelle information sur l’innocuité liée à l’étude.
Les organismes de réglementation
Aux États-Unis, la FDA peut vérifier les dossiers des enquêteurs du site local après qu’ils ont fini de participer à une étude, pour voir s’ils suivaient correctement les procédures d’étude. Cet audit peut être aléatoire, ou motivé (parce que l’investigateur est suspecté de données frauduleuses). Le fait d’éviter un audit est une incitation pour les enquêteurs à suivre les procédures de l’étude. Une « étude clinique couverte » fait référence à un essai soumis à la FDA dans le cadre d’une demande de mise sur le marché (par exemple, dans le cadre d’une NDA ou 510(k) ), pour lequel la FDA peut exiger la divulgation de l’intérêt financier de l’ investigateur cliniquedans le résultat de l’étude. Par exemple, le demandeur doit divulguer si un investigateur détient des capitaux propres dans le promoteur ou détient un droit de propriété sur le produit faisant l’objet de l’enquête. La FDA définit une étude couverte comme “… toute étude d’un médicament, d’un produit biologique ou d’un dispositif chez l’homme soumis dans une demande de mise sur le marché ou une requête de reclassification sur laquelle le demandeur ou la FDA s’appuie pour établir que le produit est efficace (y compris les études qui montrent l’équivalence à un produit efficace) ou toute étude dans laquelle un seul investigateur apporte une contribution significative à la démonstration de l’innocuité.” [81]
Alternativement, de nombreuses sociétés pharmaceutiques américaines ont déplacé certains essais cliniques à l’étranger. Les avantages de la conduite d’essais à l’étranger comprennent des coûts inférieurs (dans certains pays) et la possibilité de mener des essais plus importants dans des délais plus courts, alors qu’un inconvénient potentiel existe dans la gestion d’essais de moindre qualité. [82] Différents pays ont des exigences réglementaires et des capacités d’exécution différentes. On estime que 40 % de tous les essais cliniques ont désormais lieu en Asie, en Europe de l’Est et en Amérique centrale et du Sud. “Il n’y a pas de système d’enregistrement obligatoire pour les essais cliniques dans ces pays et beaucoup ne suivent pas les directives européennes dans leurs opérations”, déclare Jacob Sijtsma de WEMOS, une organisation de défense de la santé basée aux Pays-Bas, qui suit les essais cliniques dans les pays en développement. [83]
À partir des années 1980, l’harmonisation des protocoles d’essais cliniques s’est avérée réalisable dans tous les pays de l’Union européenne. Dans le même temps, la coordination entre l’Europe, le Japon et les États-Unis a conduit à une initiative conjointe de la réglementation et de l’industrie sur l’harmonisation internationale nommée après 1990 sous le nom de Conférence internationale sur l’harmonisation des exigences techniques pour l’enregistrement des produits pharmaceutiques à usage humain (ICH) [84]Actuellement, la plupart des programmes d’essais cliniques suivent les directives de l’ICH, qui visent à « garantir que des médicaments de bonne qualité, sûrs et efficaces sont développés et enregistrés de la manière la plus efficace et la plus rentable. Ces activités sont menées dans l’intérêt du consommateur et de la santé publique, afin d’éviter la duplication inutile d’essais cliniques chez l’homme et de minimiser le recours aux tests sur les animaux sans compromettre les obligations réglementaires de sécurité et d’efficacité.” [85]
Agrégation des données de sécurité au cours du développement clinique
Il est important d’agréger les données d’innocuité des essais cliniques au cours du développement du médicament, car les essais sont généralement conçus pour se concentrer sur la détermination de l’efficacité du médicament. Les données d’innocuité recueillies et agrégées dans plusieurs essais au fur et à mesure du développement du médicament permettent au promoteur, aux chercheurs et aux organismes de réglementation de surveiller le profil d’innocuité global des médicaments expérimentaux au fur et à mesure de leur développement. La valeur de l’évaluation des données de sécurité globales est la suivante : a) les décisions basées sur l’évaluation globale de la sécurité pendant le développement du médicament peuvent être prises tout au long du développement du médicament et b) cela permet au promoteur et aux régulateurs de bien évaluer la sécurité du médicament après l’approbation du médicament . [86] [87] [88] [89] [90]
Économie
Les coûts des essais cliniques varient selon la phase d’essai, le type d’essai et la maladie étudiée. Une étude d’essais cliniques menée aux États-Unis de 2004 à 2012 a révélé que le coût moyen des essais de phase I se situait entre 1,4 et 6,6 millions de dollars, selon le type de maladie. Les essais de phase II variaient de 7 à 20 millions de dollars et les essais de phase III de 11 à 53 millions de dollars. [91]
Parrainer
Le coût d’une étude dépend de nombreux facteurs, en particulier du nombre de sites menant l’étude, du nombre de patients impliqués et du fait que le traitement à l’étude est déjà approuvé pour un usage médical.
Les dépenses encourues par une entreprise pharmaceutique pour administrer un essai clinique de phase III ou IV peuvent comprendre, entre autres :
- production du ou des médicaments ou dispositifs évalués
- les salaires du personnel pour les concepteurs et les administrateurs de l’essai
- paiements à l’organisme de recherche sous contrat, à l’organisme de gestion du site (le cas échéant) et à tout consultant extérieur
- paiements aux chercheurs locaux et à leur personnel pour le temps et les efforts qu’ils ont consacrés au recrutement des sujets de test et à la collecte de données pour le sponsor
- le coût des matériaux d’étude et les frais encourus pour les expédier
- communication avec les chercheurs locaux, y compris la surveillance sur place par le CRO avant et (dans certains cas) plusieurs fois pendant l’étude
- une ou plusieurs réunions de formation des enquêteurs
- dépenses encourues par les chercheurs locaux, telles que les frais de pharmacie, les frais d’IRB et les frais postaux
- tout paiement aux sujets inscrits à l’essai
- les frais de traitement d’un sujet de test qui développe une condition médicale causée par le médicament à l’étude
Ces dépenses sont engagées sur plusieurs années.
Aux États-Unis, les promoteurs peuvent recevoir un crédit d’impôt de 50 % pour les essais cliniques menés sur des médicaments en cours de développement pour le traitement de maladies orphelines . [92] Les agences nationales de santé, telles que les National Institutes of Health des États-Unis , offrent des subventions aux chercheurs qui conçoivent des essais cliniques qui tentent de répondre à des questions de recherche présentant un intérêt pour l’agence. Dans ces cas, l’investigateur qui rédige la subvention et administre l’étude agit en tant que sponsor et coordonne la collecte de données à partir de tous les autres sites. Ces autres sites peuvent ou non être rémunérés pour participer à l’étude, en fonction du montant de la subvention et de l’effort attendu de leur part. L’utilisation des ressources Internet peut, dans certains cas, réduire la charge économique.[93]
Les enquêteurs
Les chercheurs sont souvent rémunérés pour leur travail dans les essais cliniques. Ces montants peuvent être modestes, ne couvrant qu’une partie du salaire des assistants de recherche et le coût de toutes les fournitures (généralement le cas avec les études des agences nationales de santé), ou être substantiels et inclure des « frais généraux » qui permettent au chercheur de payer le personnel de recherche pendant les périodes entre les essais cliniques. [ citation nécessaire ]
Sujets
Les participants aux essais de médicaments de phase I ne retirent aucun avantage direct pour la santé de leur participation. Ils sont généralement rémunérés pour leur temps, avec des paiements réglementés et non liés à un risque encouru. Les motivations des volontaires en bonne santé ne se limitent pas à la récompense financière et peuvent inclure d’autres motivations telles que la contribution à la science et autres. [94] Dans les essais de phase ultérieure, les sujets peuvent ne pas être payés pour garantir leur motivation à participer avec un potentiel de bénéfice pour la santé ou à contribuer aux connaissances médicales. De petits paiements peuvent être effectués pour les dépenses liées à l’étude telles que les voyages ou en compensation pour leur temps à fournir des informations de suivi sur leur santé après la fin du traitement d’essai.
Recrutement et participation des participants


Les essais de médicaments de phase 0 et de phase I recherchent des volontaires sains. La plupart des autres essais cliniques recherchent des patients qui ont une maladie ou une condition médicale spécifique. La diversité observée dans la société devrait se refléter dans les essais cliniques grâce à l’inclusion appropriée des populations de minorités ethniques . [95] Le recrutement des patients ou le recrutement des participants joue un rôle important dans les activités et les responsabilités des sites menant des essais cliniques. [96]
Tous les volontaires considérés pour un essai doivent se soumettre à un examen médical. Les exigences diffèrent selon les besoins de l’essai, mais les volontaires seraient généralement sélectionnés dans un laboratoire médical pour : [97]
- Mesure de l’activité électrique du cœur (ECG)
- Mesure de la pression artérielle, de la fréquence cardiaque et de la température corporelle
- Prise de sang
- Prélèvement d’urine
- Mesure du poids et de la taille
- Test de toxicomanie
- Test de grossesse
Il a été observé que les participants aux essais cliniques sont disproportionnellement blancs. Une revue systématique récente de la littérature a révélé que la race/ethnicité ainsi que le sexe n’étaient pas bien représentés ni parfois même suivis en tant que participants à un grand nombre d’essais cliniques sur la gestion de la perte auditive chez les adultes. [98] Cela peut réduire la validité des résultats en ce qui concerne les patients non blancs [99] en ne représentant pas adéquatement la population plus large.
Localisation des essais
Selon le type de participants requis, les promoteurs d’essais cliniques ou les organisations de recherche sous contrat travaillant en leur nom, essayez de trouver des sites avec du personnel qualifié ainsi qu’un accès aux patients qui pourraient participer à l’essai. En travaillant avec ces sites, ils peuvent utiliser diverses stratégies de recrutement, notamment des bases de données de patients, des publicités dans les journaux et à la radio, des dépliants, des affiches dans des endroits où les patients pourraient se rendre (comme les cabinets de médecins) et le recrutement personnel de patients par les enquêteurs.
Les volontaires souffrant de conditions ou de maladies spécifiques disposent de ressources en ligne supplémentaires pour les aider à localiser les essais cliniques. Par exemple, Fox Trial Finder relie les essais sur la maladie de Parkinson dans le monde entier à des volontaires qui ont un ensemble spécifique de critères tels que l’emplacement, l’âge et les symptômes. [100] D’autres services spécifiques à une maladie existent pour que les bénévoles trouvent des essais liés à leur état. [101] Les volontaires peuvent rechercher directement sur ClinicalTrials.gov pour localiser des essais à l’aide d’un registre géré par les National Institutes of Health et la National Library of Medicine des États-Unis .
Rechercher
Le modèle de recherche et de traitement des informations sur les risques (RISP) analyse les implications sociales qui affectent les attitudes et la prise de décision concernant les essais cliniques. [102] Les personnes qui détiennent un enjeu ou un intérêt plus élevé dans le traitement fourni dans un essai clinique ont montré une plus grande probabilité de rechercher des informations sur les essais cliniques. Les patients cancéreux ont rapporté des attitudes plus optimistes envers les essais cliniques que la population générale. Avoir une vision plus optimiste des essais cliniques conduit également à une plus grande probabilité d’inscription. [102]
Voir également
- Mesure des résultats
- Algorithme de cotes
Références
- ^ “Essais cliniques” (PDF) . Fondation Bill et Melinda Gates . Récupéré le 1er janvier 2014 .
- ^ Dimasi, Joseph A; Grabowski, Henry G; Hansen, Ronald W (2016). “Innovation dans l’industrie pharmaceutique : Nouvelles estimations des coûts de R&D”. Journal d’économie de la santé . 47 : 20–33. doi : 10.1016/j.jhealeco.2016.01.012 . manche : 10161/12742 . PMID 26928437 .
- ^ Emanuel EJ (9 septembre 2015). “La solution aux prix des médicaments” . Le New York Times . Parmi les médicaments lancés dans des essais cliniques sur des humains, seuls 10% ont obtenu l’approbation de la FDA. …
- ^ Dernière mise à jour de la page de la FDA le 25 avril 2014 Processus d’examen des médicaments de la FDA : suite
- ^ PhRMA. Février 2007 Découverte et développement de médicaments
- ^ Manuel Merck. Dernière révision/révision complète en octobre 2013 par Daniel A. Hussar, PhD Présentation des médicaments en vente libre
- ^ Avorn J. (2004). Médicaments puissants , pp. 129–33. Alfred A. Knopf.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (mars 2007). “Critères d’éligibilité des essais contrôlés randomisés publiés dans des revues médicales générales à fort impact : une revue d’échantillonnage systématique”. JAMA . 297 (11): 1233–1240. doi : 10.1001/jama.297.11.1233 . PMID 17374817 .
- ^ L’autorité de réglementation aux États-Unis est la Food and Drug Administration ; au Canada, Santé Canada ; dans l’ Union européenne , l’ Agence européenne des médicaments ; et au Japon, le ministère de la Santé, du Travail et des Affaires sociales
- ^ “Dispositifs médicaux, études cliniques de précommercialisation pour l’exemption de dispositif expérimental” . Administration américaine des aliments et médicaments. 17 mars 2017 . Récupéré le 2 octobre 2017 .
- ^ Lederle FA, Freischlag JA, Kyriakides TC, Padberg FT, Matsumura JS, Kohler TR, Lin PH, Jean-Claude JM, Cikrit DF, Swanson KM, Peduzzi PN (octobre 2009). “Résultats après réparation endovasculaire vs ouverte d’un anévrisme de l’aorte abdominale : un essai randomisé” . JAMA . 302 (14): 1535–42. doi : 10.1001/jama.2009.1426 . PMID 19826022 .
- ^ Lipp A, Shaw C, Glavind K (décembre 2014). “Dispositifs mécaniques pour l’incontinence urinaire chez la femme” . La base de données Cochrane des revues systématiques (12) : CD001756. doi : 10.1002/14651858.CD001756.pub6 . PMC 7061494 . PMID 25517397 .
- ^ Farrokhyar F, Karanicolas PJ, Thoma A, Simunovic M, Bhandari M, Devereaux PJ, Anvari M, Adili A, Guyatt G (mars 2010). “Essais contrôlés randomisés d’Interventions chirurgicales“. Annales de Chirurgie . 251 (3) : 409–416. doi : 10.1097/SLA.0b013e3181cf863d . PMID 20142732 . S2CID 17084906 .
- ^ Cao AM, Cox MR, Eslick GD (mars 2016). « Conception d’études en chirurgie factuelle : quel est le rôle des études cas-témoins ? » . Journal mondial de méthodologie . 6 (1) : 101–4. doi : 10.5662/wjm.v6.i1.101 . PMC 4804244 . PMID 27019801 .
- ^ un bcde Meinert CL , Tonascia S (1986). Essais cliniques : conception, conduite et analyse . Oxford University Press, États-Unis. p. 3. ISBN 978-0-19-503568-1.
- ^ Simon, Harvey B. (2002). Le guide de la Harvard Medical School sur la santé masculine . New York : Presse gratuite . p. 31 . ISBN 978-0-684-87181-3.
- ^ Brown, Stephen R. (2003). Scorbut : comment un chirurgien, un marin et un gentleman ont résolu le plus grand mystère médical de l’ère de la voile . New York, NY : Presse de Saint-Martin. ISBN 0-312-31391-8
- ^ Rogers, Everett M. (1995). Diffusion des Innovations . New York, NY : La presse gratuite. ISBN 0-7432-2209-1 . p. 7.
- ^ Carlisle, Rodney (2004). Inventions et découvertes scientifiques américaines , John Wiley & Songs, Inc., New Jersey. p. 393. ISBN 0-471-24410-4 .
- ^ “James Lind : Un Traité du Scorbut (1754)” . 2001 . Récupéré le 9 septembre 2007 .
- ^ Vert S, Crowley J, Benedetti J, Smith A (30 juillet 2002). Essais cliniques en oncologie, deuxième édition . Presse CRC. p. 1–. ISBN 978-1-4200-3530-8.
- ^ Gad SC (17 juin 2009). Manuel des essais cliniques . John Wiley et fils. p. 118–. ISBN 978-0-470-46635-3.
- ^ O’Rourke MF (février 1992). “Frédéric Akbar Mahomed” . Hypertension . 19 (2) : 212–7. doi : 10.1161/01.HYP.19.2.212 . PMID 1737655 .
- ^ Creswell, JW (2008). Recherche en éducation : planifier, mener et évaluer des recherches quantitatives et qualitatives (3e). Upper Saddle River, New Jersey : Prentice Hall. 2008, p. 300. ISBN 0-13-613550-1
- ^ Hani (2009). “Etude de réplication” . Archivé de l’original le 2 juin 2012 . Récupéré le 27 octobre 2011 .
- ^ Metcalfe NH (février 2011). “Sir Geoffrey Marshall (1887-1982): pneumologue, catalyseur du développement de l’anesthésie, médecin du Premier ministre et du roi, et commandant de barge de la Première Guerre mondiale”. Journal de biographie médicale . 19 (1) : 10–4. doi : 10.1258/jmb.2010.010019 . PMID 21350072 . S2CID 39878743 .
- ^ Pharmabiz.com, 19 mai 2014, Mumbai ISCR publie un guide pour les participants aux essais cliniques lors de la Journée internationale des essais cliniques (consulté le 20 mai 2014)
- ^ Pottegard, Anton; Haastrup, Maija Bruun; Scène, Tore Bjerregaard; Hansen, Morten Rix; Larsen, Kasper Soltoft ; Meegaard, Peter Martin; Meegaard, Line Haugaard Vrdlovec; Horneberg, Henrik; Gils, Charlotte ; Dideriksen, Dorthe; Aagaard, Lise; Almarsdottir, Anna Birna; Hallas, Jesper ; Damkier, Per (16 décembre 2014). “Recherche d’acronymes humoristiques et extravagants et de noms tout à fait inappropriés pour des essais cliniques importants (SCIENTIFIQUE) : étude systématique qualitative et quantitative” . BMJ . 349 : g7092. doi : 10.1136/bmj.g7092 . PMC 4267482 . PMID 25516539 .
- ^ un bcdefghi ” Quels sont les différents types de recherche clinique ?” . Administration américaine des aliments et médicaments. 2019 . Récupéré le 24 mai 2019 .
- ^ un b “Qu’est-ce qu’une étude clinique ?” . Bibliothèque nationale de médecine, Instituts nationaux de la santé des États-Unis. 1 mars 2019 . Récupéré le 24 mai 2019 .
- ^ Hélène S (2010). “Programmes d’utilisation compassionnelle de l’UE (CUP): cadre réglementaire et points à considérer avant la mise en œuvre du CUP” . Pharm Med . 24 (4): 223–229. doi : 10.1007/BF03256820 . S2CID 31439802 . Archivé de l’original le 7 juillet 2012.
- ^ Brennan Z (5 juin 2013). “Les ORC évoluent lentement vers des conceptions d’essais cliniques adaptatifs” . Externalisation-pharma.com . Récupéré le 5 janvier 2014 .
- ^ “Essais cliniques adaptatifs pour surmonter les défis de la recherche” . News-medical.net. 17 septembre 2013 . Récupéré le 4 janvier 2014 .
- ^ Wang, Shirley S. (30 décembre 2013). “Santé : les scientifiques cherchent à améliorer le coût et la durée des essais de médicaments – WSJ.com” . Online.wsj.com. Archivé de l’original le 14 mars 2016 . Récupéré le 4 janvier 2014 .
- ^ Huber PW (12 novembre 2013). Le remède dans le code : comment la loi du 20e siècle sape la médecine du 21e siècle . Livres de base. ISBN 978-0-465-06981-1.
- ^ Le Lancet (juillet 2009). “Essais de phase 0 : une plateforme pour le développement de médicaments ?”. Lancette . 374 (9685): 176. doi : 10.1016/S0140-6736(09)61309-X . PMID 19616703 . S2CID 30939770 .
- ^ un b “L’essai clinique de Phase IIa et de Phase IIb” . www.musculardystrophyuk.org . Récupéré le 10 août 2020 .
- ^ un bc Hannan EL (juin 2008). “Essais cliniques randomisés et études observationnelles : lignes directrices pour évaluer les forces et les limites respectives” . JACC. Interventions cardiovasculaires . 1 (3): 211–7. doi : 10.1016/j.jcin.2008.01.008 . PMID 19463302 .
- ^ Sessler DI, Imrey PB (octobre 2015). “Méthodologie de recherche clinique 2 : recherche clinique observationnelle”. Anesthésie et Analgésie . 121 (4) : 1043–1051. doi : 10.1213/ANE.0000000000000861 . PMID 26378704 . S2CID 19333613 .
- ^ Eldridge SM, Lancaster GA, Campbell MJ, Thabane L, Hopewell S, Coleman CL, Bond CM (2016). “Définir la faisabilité et les études pilotes en préparation d’essais contrôlés randomisés : développement d’un cadre conceptuel” . PLOS ONE . 11 (3) : e0150205. Bibcode : 2016PLoSO..1150205E . doi : 10.1371/journal.pone.0150205 . PMC 4792418 . PMID 26978655 .
- ^ “Contrôle actif / Comparateur actif” . 3 mars 2017.
- ^ Jeune, Susan. “Foundation Medicine rejoint la coalition visant à secouer les essais de médicaments anticancéreux | MIT Technology Review” . Technologyreview.com . Récupéré le 14 novembre 2013 .
- ^ Directive ICH pour les bonnes pratiques cliniques: directives consolidées Archivé le 21 septembre 2008 à la Wayback Machine
- ^ “Site Web officiel de l’ICH : ICH” . ich.org .
- ^ “En savoir plus sur les études cliniques” . essais cliniques.gov . Archivé de l’original le 10 avril 2012.
- ^ Maloney, Dennis M (1984). Protection des sujets humains de recherche : Guide pratique des lois et règlements fédéraux . Boston, MA : Springer États-Unis. p. 151. ISBN 9781461327035.
- ^ Dorey, Frédéric (2011). « Statistiques en bref : la puissance statistique : qu’est-ce que c’est et quand doit-elle être utilisée ? » . Orthopédie clinique et recherche connexe . 469 (2): 619–620. doi : 10.1007/s11999-010-1435-0 . PMC 3018227 . PMID 20585913 .
- ^ Norwitz ER, Greenberg JA (2011). « Approbation de la FDA pour l’utilisation de médicaments pendant la grossesse : une bataille difficile » . Examens en obstétrique et gynécologie . 4 (2): 39–41. PMC 3218552 . PMID 22102925 .
- ^ “Foire aux questions | Centre de cancérologie de l’Université de l’Arizona” . Azcc.arizona.edu. Archivé de l’original le 2 décembre 2013 . Récupéré le 14 novembre 2013 .
- ^ Miseta, Ed (17 décembre 2019). “Janssen utilise la géolocalisation pour surveiller les patients des essais cliniques” . Chef clinique . Pennsylvanie, États-Unis : VertMarkets . Récupéré le 26 janvier 2020 .
- ^ Unger, JM; Cuisinier, E; Tai, E; En ligneBleyer, A (2016). « Le rôle de la participation aux essais cliniques dans la recherche sur le cancer : obstacles, preuves et stratégies » . Livre éducatif de la société américaine d’oncologie clinique. Société américaine d’oncologie clinique. Réunion annuelle . Société américaine d’oncologie clinique. 35 (36): 185–198. doi : 10.1200/EDBK_156686 . PMC 5495113 . PMID 27249699 .
- ^ Weiss SC, Rowell R, Krochmal L (2008). “Impact de la saisonnalité sur la conduite d’études cliniques en dermatologie”. Cliniques en Dermatologie . 26 (5) : 565–9. doi : 10.1016/j.clindermatol.2008.01.016 . PMID 18755376 .
- ^ Khan Y, Tilly S. “Saisonnalité: le défi logistique du directeur des essais cliniques” (PDF) . Pharm Olam International. Archivé de l’original (PDF) le 15 juillet 2011 . Récupéré le 26 avril 2010 .
- ^ Marshall, Megan (19 décembre 2019). “Mise en œuvre de QbD dans votre essai clinique ? 4 questions auxquelles répondre en premier” . Chef clinique . Pennsylvanie : VertMarkets . Récupéré le 26 janvier 2020 .
- ^ Yang, ZJ, et al. (2010). “Motivation pour la recherche et le traitement d’informations sur la santé concernant l’inscription aux essais cliniques”. Communication sur la santé 25(5) : 423–436.
- ^ “BIO pour utiliser ViS Analytics pour rationaliser la recherche clinique pédiatrique – WSJ.com” . Online.wsj.com. 7 mai 2013. Archivé de l’original le 4 février 2014 . Récupéré le 14 novembre 2013 .
- ^ Life Sciences Strategy Group, “Clinical Trial Technology Utilization, Purchasing Preferences & Growth Outlook” Publication syndiquée, mai 2009
- ^ “Résultats rapportés par les patients électroniques (ePRO) – Changer le visage des essais cliniques” . Med-Quest.org . Récupéré le 20 mai 2015 .
- ^ “Le projet de loi de l’Assemblée n ° 2328” (PDF) .
- ^ Hayden CE (novembre 2014). “Dilemme éthique pour les essais de médicaments Ebola” . Nature . 515 (7526): 177–8. Bibcode : 2014Natur.515..177C . doi : 10.1038/515177a . PMID 25391940 .
- ^ Pattinson, Shaun D. (2012). “La recherche d’urgence et les intérêts des participants” (PDF) . Droit Médical International . 12 (2): 121–141. doi : 10.1177/0968533212465615 . S2CID 71853867 .
- ^ Span, Paula (3 mars 2020). “Quand une étude de drogue se termine brusquement, les volontaires doivent faire face” . Le New York Times . ISSN 0362-4331 . Récupéré le 23 avril 2020 .
- ^ Moynihan, R. (2003). « Qui paie la pizza ? Redéfinir les relations entre médecins et firmes pharmaceutiques. 2 : Désenchevêtrement » . Journal médical britannique . 326 (7400): 1193–1196. doi : 10.1136/bmj.326.7400.1193 . PMC 1126054 . PMID 12775622 .
- ^ “Mise à jour Hogan & Hartson sur l’enregistrement des essais pharmaceutiques” (PDF) . 3 mars 2008. Archivé de l’original (PDF) le 25 juin 2008 . Récupéré le 2 juin 2008 .
- ^ “L’augmentation des rétractions de revues scientifiques invite à la réforme” . Le New York Times . 16 avril 2012 . Récupéré le 22 mai 2018 .
- ^ Woolley KL, Lew RA, Stretton S, Ely JA, Bramich NJ, Keys JR, Monk JA, Woolley MJ (juin 2011). “Manque d’implication des rédacteurs médicaux et de l’industrie pharmaceutique dans les publications rétractées pour faute: une étude systématique, contrôlée et rétrospective”. Recherche médicale actuelle et opinion . 27 (6): 1175–1182. doi : 10.1185/03007995.2011.573546 . PMID 21473670 . S2CID 2583905 .
- ^ Sox HC, Rennie D (août 2008). ” Essais d’ensemencement : dites simplement “non” ” . Annals of Internal Medicine . 149 (4): 279–80. doi : 10.7326/0003-4819-149-4-200808190-00012 . PMID 18711161 .
- ^ “Processus de développement et d’approbation (drogues)” . Administration américaine des aliments et médicaments . Récupéré le 22 mai 2018 .
- ^ “Guide de la fiche d’information pour les IRB, les enquêteurs cliniques et les sponsors: Inspections de la FDA des enquêteurs cliniques” (PDF) . Administration des aliments et des médicaments . juin 2010 . Récupéré le 16 octobre 2014 .
- ^ Davidoff F, DeAngelis CD, Drazen JM, Nicholls MG, Hoey J, Højgaard L, Horton R, Kotzin S, Nylenna M, Overbeke AJ, Sox HC, Van Der Weyden MB, Wilkes MS (septembre 2001). “Parrainage, paternité et responsabilité” . JAMC . 165 (6) : 786–8. PMC 81460 . PMID 11584570 .
- ^ Mansi, Bernadette A.; Clark, Juli; David, Frank S.; Gesell, Thomas M.; Glasser, Susan; Gonzalez, John; Haller, Daniel G.; Laine, Christine; Miller, Charles L.; Mooney, LaVerne A.; Zecevic, Maja (mai 2012). “Dix recommandations pour combler l’écart de crédibilité dans les rapports sur la recherche clinique parrainée par l’industrie : une revue conjointe et une perspective de l’industrie pharmaceutique” . Actes de la clinique Mayo . 87 (5): 424–429. doi : 10.1016/j.mayocp.2012.02.009 . ISSN 1942-5546 . PMC 3538468 . PMID 22560521 .
- ^ Tohen, Mauricio (septembre 2013). “Crédibilité des essais cliniques financés par l’industrie” . Le Journal international de neuropsychopharmacologie . 16 (8) : 1879–1884. doi : 10.1017/S1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ Tohen, Mauricio (1er février 2017). “Directives de traitement dans les troubles bipolaires et l’importance d’une conception d’essai clinique appropriée” . Le Journal international de neuropsychopharmacologie . 20 (2): 95–97. doi : 10.1093/ijnp/pyx002 . ISSN 1469-5111 . PMC 5356994 . PMID 28927197 .
- ^ Tohen, Mauricio (2018). “La gravité des symptômes dans les directives mania-cliniques et les implications de la conception de l’étude” . Troubles bipolaires . 20 (2): 171–172. doi : 10.1111/bdi.12598 . ISSN 1399-5618 . PMID 29327798 .
- ^ Tohen, Mauricio (2013). “Crédibilité des essais cliniques financés par l’industrie” . Le Journal international de neuropsychopharmacologie . 16 (8) : 1879–1884. doi : 10.1017/S1461145713000461 . ISSN 1469-5111 . PMID 23672957 .
- ^ un b Edwards, Kathryn M.; Kochhar, Sonali (2020). “Éthique de la conduite de la recherche clinique dans un contexte d’épidémie” . Revue annuelle de virologie . 7 (1): 475–494. doi : 10.1146/annurev-virology-013120-013123 . PMID 32212920 .
- ^ “Lignes directrices NINDS pour la surveillance dans les essais cliniques | Institut national des troubles neurologiques et des accidents vasculaires cérébraux” . ninds.nih.gov . Récupéré le 25 novembre 2019 .
- ^ “Manuel de formation du Conseil de surveillance des données et de la sécurité pour les études initiées par les enquêteurs – Tufts CTSI” . tuftsctsi.wpengine.com . Récupéré le 25 novembre 2019 .
- ^ Concevoir et mener des essais cliniques – Un aperçu . 2019. ISBN 9781096489085.
- ^ “Pour les Patients : Consentement Éclairé pour les Essais Cliniques” . Administration américaine des aliments et médicaments. 25 février 2016 . Récupéré le 9 août 2017 .
- ^ Guidance for Industry: Financial Disclosure by Clinical Investigators , Food and Drug Administration , 20 mars 2001
- ^ Lang T, Siribaddana S (2012). « Les essais cliniques se sont mondialisés : est-ce une bonne chose ? . PLO Médecine . 9 (6) : e1001228. doi : 10.1371/journal.pmed.1001228 . PMC 3373653 . PMID 22719228 .
- ^ “L’Inde : Destination Principale pour les Essais Cliniques Non éthiques” . Rêves communs . Archivé de l’original le 15 décembre 2007 . Récupéré le 16 décembre 2007 .
- ^ Pmda.go.jp 独立行政法人医薬品医療機器総合機構 (en japonais) Archivé le 17 décembre 2008 à la Wayback Machine
- ^ PCI Archivé le 30 juin 2007 à la Wayback Machine
- ^ “Gestion des informations de sécurité des essais cliniques: rapport du groupe de travail VI du CIOMS” . Publications du CIOMS . 2005.
- ^ “Demande de nouveau médicament d’investigation (IND) – Règle finale: Exigences de rapport de sécurité de nouveau médicament de recherche pour les médicaments humains et les produits biologiques et exigences de rapport de sécurité pour les études de biodisponibilité et de bioéquivalence chez l’homme” . fda.gov . Centre d’évaluation et de recherche sur les médicaments. 29 septembre 2010 . Récupéré le 11 novembre 2017 .
- ^ “Conseils pour l’industrie et les enquêteurs Exigences de rapport de sécurité pour les études IND et BA / BE Guide de conformité des petites entités” (PDF) . Administration des aliments et des médicaments =. Décembre 2012.
- ^ “Évaluation de la sécurité pour les directives de rapport de sécurité IND pour l’industrie” (PDF) . Administration des aliments et des médicaments. Décembre 2015.
- ^ “Synthèse des preuves et méta-analyse: rapport du groupe de travail X du CIOMS” . Publications du CIOMS. 2016.
- ^ Sertkaya, Aylin; Wong, Hui-Hsing; Jessup, Ambre ; Beleche, Trinité (2016). “Inducteurs de coût clés des essais cliniques pharmaceutiques aux États-Unis”. Essais cliniques . 13 (2): 117–126. doi : 10.1177/1740774515625964 . PMID 26908540 . S2CID 24308679 .
- ^ “Crédit d’impôt pour les dépenses de test pour les médicaments pour les maladies ou conditions rares” . Administration des aliments et des médicaments . 17 avril 2001 . Récupéré le 27 mars 2007 .
- ^ Paul J, Seib R, Prescott T (mars 2005). “Internet et essais cliniques : contexte, ressources en ligne, exemples et enjeux” . Journal de recherche médicale sur Internet . 7 (1) : e5. doi : 10.2196/jmir.7.1.e5 . PMC 1550630 . PMID 15829477 .
- ^ Stunkel, Leanne; Grady, Christine (mai 2011). “Plus que l’argent : une revue de la littérature examinant les motivations des volontaires sains” . Essais cliniques contemporains . 32 (3): 342–352. doi : 10.1016/j.cct.2010.12.003 . PMC 4943215 . PMID 21146635 .
- ^ Liu JJ, Davidson E, Cheikh A (2011). « Atteindre la diversité ethnique dans le recrutement à l’essai » . Pharm Med . 25 (4): 215–222. doi : 10.1007/BF03256863 . S2CID 19557355 . Archivé de l’original le 14 novembre 2011.
- ^ McDonald AM, Knight RC, Campbell MK, Entwistle VA, Grant AM, Cook JA, Elbourne DR, Francis D, Garcia J, Roberts I, Snowdon C (avril 2006). “Qu’est-ce qui influence le recrutement dans les essais contrôlés randomisés ? Une revue des essais financés par deux agences de financement britanniques” . Essais . 7 : 9. doi : 10.1186/1745-6215-7-9 . PMC 1475627 . PMID 16603070 .
- ^ “Volontariat pour un essai clinique” . Boston, Massachusetts : CenterWatch. 2016. Archivé de l’original le 25 novembre 2016 . Récupéré le 26 novembre 2016 .
- ^ Pittman, Corinne A.; Roura, Raúl; Prix, Carrie ; Lin, Frank R.; Marrone, Nicole; Nieman, Carrie L. (1er juillet 2021). “Représentation raciale/ethnique et sexuelle dans les essais cliniques basés aux États-Unis sur la gestion de la perte auditive chez les adultes : une revue systématique” . JAMA Oto-rhino-laryngologie – Chirurgie de la tête et du cou . 147 (7): 656–662. doi : 10.1001/jamaoto.2021.0550 . ISSN 2168-6181 . PMID 33885733 . S2CID 233351877 .
- ^ “Comment arrêter un manque de diversité minant les données d’essais cliniques” . Financial Times . 18 janvier 2019 . Récupéré le 26 février 2019 .
- ^ “Essais cliniques sur la maladie de Parkinson” . Chercheur d’essai Fox . Récupéré le 14 novembre 2013 .
- ^ “Informations médicales sur Internet” . Mlanet.org. Archivé de l’original le 3 octobre 2013 . Récupéré le 14 novembre 2013 .
- ^ un b Yang ZJ, McComas KA, Gay GK, Leonard JP, Dannenberg AJ, Dillon H (2012). “Comparer la prise de décision entre les patients atteints de cancer et la population générale : pensées, émotions ou influence sociale ?”. Journal de la communication sur la santé . 17 (4): 477–94. doi : 10.1080/10810730.2011.635774 . PMID 22376222 . S2CID 1344880 .
Lectures complémentaires
- Chow SC, Liu JP (2004). Conception et analyse des essais cliniques : concepts et méthodologies . ISBN 978-0-471-24985-6.
- Finn R (1999). Essais cliniques sur le cancer : traitements expérimentaux et comment ils peuvent vous aider . Sébastopol : O’Reilly & Associates. ISBN 978-1-56592-566-3.
- Henninger D (2002). “Drug Lag” . Dans Henderson DR (éd.). Encyclopédie concise de l’économie (1ère éd.). Bibliothèque d’économie et de liberté . OCLC 317650570 , 50016270 , 163149563
- Pocock , SJ (2004). Essais cliniques : une approche pratique . John Wiley et fils. ISBN 978-0-471-90155-6.
- Rang HP, Dale MM, Ritter JM, Moore PK (2003). Pharmacologie (5 éd.). Édimbourg : Churchill Livingstone. ISBN 978-0-443-07145-4.
Liens externes
| Wikimedia Commons a des médias liés aux essais cliniques . |
- La Conférence internationale sur l’harmonisation des exigences techniques pour l’enregistrement des produits pharmaceutiques à usage humain (ICH)
- ClinicalTrials.gov
- Essais cliniques pour la recherche sur le cancer
