Engrais
Un engrais ( anglais américain ) ou un engrais ( anglais britannique ; voir les différences d’orthographe ) est tout matériau d’origine naturelle ou synthétique qui est appliqué au sol ou aux tissus végétaux pour fournir des éléments nutritifs aux plantes . Les engrais peuvent être distincts des matériaux de chaulage ou d’autres amendements de sol non nutritifs . De nombreuses sources d’engrais existent, à la fois naturelles et produites industriellement. [1] Pour la plupart des pratiques agricoles modernes, la fertilisation se concentre sur trois macronutriments principaux : l’ azote (N), le phosphore (P) et le potassium .(K) avec ajout occasionnel de suppléments comme la poussière de roche pour les micronutriments. Les agriculteurs appliquent ces engrais de diverses manières : par des procédés d’application secs, granulés ou liquides, en utilisant de gros équipements agricoles ou des méthodes d’outils manuels.
 Un agriculteur épandant du fumier pour améliorer la fertilité du sol
Un agriculteur épandant du fumier pour améliorer la fertilité du sol
Historiquement, la fertilisation provenait de sources naturelles ou organiques : compost , fumier animal , fumier humain , minéraux récoltés, rotations des cultures et sous-produits des industries de la nature humaine (c’est-à-dire les déchets de transformation du poisson ou la farine de sang provenant de l’abattage des animaux). Cependant, à partir du 19e siècle, après les innovations en matière de nutrition des plantes , une industrie agricole se développe autour d’engrais synthétiques. Cette transition a été importante dans la transformation du système alimentaire mondial , permettant une agriculture industrielle à plus grande échelle avec de gros rendements. En particulier les procédés chimiques fixateurs d’azote tels que laLe procédé Haber au début du XXe siècle, amplifié par les capacités de production créées pendant la Seconde Guerre mondiale, a conduit à un boom de l’utilisation des engrais azotés. Dans la seconde moitié du 20e siècle, l’utilisation accrue d’engrais azotés (augmentation de 800 % entre 1961 et 2019) a été un élément crucial de l’augmentation de la productivité des Systèmes alimentaires conventionnels (plus de 30 % par habitant) dans le cadre du soi- appelée « révolution verte ». [2]
Histoire

 Production totale d’engrais par type. [3]
Production totale d’engrais par type. [3] 
 Population mondiale soutenue avec et sans engrais azotés de synthèse. [4]
Population mondiale soutenue avec et sans engrais azotés de synthèse. [4] 

La gestion de la fertilité des sols préoccupe les agriculteurs depuis des milliers d’années. Les Égyptiens, les Romains, les Babyloniens et les premiers Allemands sont tous enregistrés comme utilisant des minéraux ou du fumier pour améliorer la productivité de leurs fermes. [1] La science de la nutrition des plantes a commencé bien avant les travaux du chimiste allemand Justus von Liebig , bien que son nom soit le plus mentionné. Nicolas Théodore de Saussure et ses collègues scientifiques de l’époque n’ont pas tardé à réfuter les simplifications de Justus von Liebig . Il existait une compréhension scientifique complexe de la nutrition des plantes, où le rôle de l’humus et des interactions organo-minérales était centrale, et qui s’inscrivait dans la lignée des découvertes plus récentes à partir de 1990. [5]Les scientifiques éminents sur lesquels Justus von Liebig s’est appuyé étaient Carl Ludwig Sprenger et Hermann Hellriegel . Dans ce domaine, une « érosion des connaissances » [6] s’est produite, en partie entraînée par un mélange d’économie et de recherche. [7] John Bennet Lawes , un Entrepreneur anglais , a commencé à expérimenter les effets de divers engrais sur les plantes poussant dans des pots en 1837, et un an ou deux plus tard, les expériences ont été étendues aux cultures en plein champ. Une conséquence immédiate fut qu’en 1842 il breveta un engrais formé en traitant des phosphates avec de l’acide sulfurique, et fut ainsi le premier à créer l’industrie de l’engrais artificiel. L’année suivante, il s’adjoint les services deJoseph Henri Gilbert ; ensemble, ils ont effectué des expériences sur les cultures à l’ Institut de recherche sur les cultures arables . [8]
Le processus Birkeland – Eyde était l’un des processus industriels concurrents au début de la production d’engrais à base d’azote. [9] Ce processus a été utilisé pour fixer l’ azote atmosphérique (N 2 ) dans l’acide nitrique (HNO 3 ), l’un des nombreux processus chimiques généralement appelés fixation de l’azote . L’acide nitrique résultant a ensuite été utilisé comme source de nitrate (NO 3 – ). Une usine basée sur le procédé a été construite à Rjukan et Notodden en Norvège, associée à la construction de grandes installations hydroélectriques . [dix]
Les années 1910 et 1920 ont vu la montée du processus Haber et du Processus d’Ostwald . Le procédé Haber produit de l’ammoniac (NH 3 ) à partir du gaz méthane (CH 4 ) ( gaz naturel ) et de l’azote moléculaire (N 2 ) de l’air. L’ammoniac du procédé Haber est ensuite partiellement converti en acide nitrique (HNO 3 ) dans le procédé d’Ostwald . [11] Après la Seconde Guerre mondiale, les usines de production d’azote qui s’étaient intensifiées pour la fabrication de bombes en temps de guerre ont été réorientées vers des utilisations agricoles. [12]L’utilisation d’engrais azotés synthétiques a augmenté régulièrement au cours des 50 dernières années, augmentant de près de 20 fois pour atteindre le taux actuel de 100 millions de Tonnes d’azote par an. [13]
Le développement des engrais azotés synthétiques a considérablement soutenu la croissance démographique mondiale – on estime que près de la moitié des habitants de la planète sont actuellement nourris grâce à l’utilisation d’engrais azotés synthétiques. [14] L’utilisation d’engrais phosphatés est également passée de 9 millions de Tonnes par an en 1960 à 40 millions de Tonnes par an en 2000. Une culture de maïs produisant 6 à 9 Tonnes de céréales par hectare (2,5 acres) nécessite 31 à 50 kilogrammes ( 68 à 110 lb) d’ engrais phosphaté à appliquer ; les cultures de soja en nécessitent environ la moitié, soit 20 à 25 kg par hectare. [15] Yara International est le plus grand producteur mondial d’engrais azotés. [16]
Mécanisme

 Six plants de tomates cultivés avec et sans engrais nitré sur un sol sableux/argileux pauvre en nutriments. L’une des plantes du sol pauvre en éléments nutritifs est morte.
Six plants de tomates cultivés avec et sans engrais nitré sur un sol sableux/argileux pauvre en nutriments. L’une des plantes du sol pauvre en éléments nutritifs est morte. 
 Utilisation d’engrais inorganiques par région [17]
Utilisation d’engrais inorganiques par région [17]
Les engrais favorisent la croissance des plantes. Cet objectif est atteint de deux manières, la traditionnelle étant des additifs qui fournissent des nutriments. Le second mode d’action de certains engrais est d’augmenter l’efficacité du sol en modifiant sa rétention d’eau et son aération. Cet article, comme beaucoup sur les engrais, met l’accent sur l’aspect nutritionnel. Les engrais fournissent généralement, dans des proportions variables : [18]
- trois principaux macronutriments :
- Azote (N) : croissance des feuilles
- Phosphore (P) : Développement des racines, fleurs, graines, fruits ;
- Potassium (K) : Forte croissance des tiges, mouvement de l’eau dans les plantes, promotion de la floraison et de la fructification ;
- trois macronutriments secondaires : calcium (Ca), magnésium (Mg) et soufre (S) ;
- micronutriments : cuivre (Cu), fer (Fe), manganèse (Mn), molybdène (Mo), zinc (Zn), bore (B). D’importance occasionnelle sont le silicium (Si), le cobalt (Co) et le vanadium (V).
Les nutriments nécessaires à une vie végétale saine sont classés en fonction des éléments, mais les éléments ne sont pas utilisés comme engrais. Au lieu de cela , les composés contenant ces éléments sont à la base des engrais. Les macronutriments sont consommés en plus grande quantité et sont présents dans les tissus végétaux en quantités allant de 0,15 % à 6,0 % sur une base de matière sèche (MS) (0 % d’humidité). Les plantes sont composées de quatre éléments principaux : l’hydrogène, l’oxygène, le carbone et l’azote. Le carbone, l’hydrogène et l’oxygène sont largement disponibles sous forme d’eau et de dioxyde de carbone. Bien que l’azote constitue la majeure partie de l’atmosphère, il se trouve sous une forme qui n’est pas disponible pour les plantes. L’azote est l’engrais le plus important puisque l’azote est présent dans les protéines , l’ADN et d’autres composants (par exemple,chlorophylle ). Pour être nutritif pour les plantes, l’azote doit être rendu disponible sous une forme “fixe”. Seules certaines bactéries et leurs plantes hôtes (notamment les légumineuses ) peuvent fixer l’azote atmosphérique (N 2 ) en le transformant en ammoniac . Le phosphate est nécessaire à la production d’ADN et d’ ATP , principal vecteur énergétique des cellules, ainsi que de certains lipides.
Considérations microbiologiques
Deux séries de réactions enzymatiques sont très pertinentes pour l’efficacité des engrais azotés.
Uréase
Le premier est l’hydrolyse (réaction avec l’eau) de l’urée. De nombreuses bactéries du sol possèdent l’enzyme uréase , qui catalyse la conversion de l’urée en ion ammonium (NH 4 + ) et en ion bicarbonate (HCO 3 − ).
Oxydation de l’ammoniac
Les bactéries oxydant l’ammoniac (AOB), telles que les espèces de Nitrosomonas , oxydent l’ammoniac en nitrite , un processus appelé nitrification . [19] Les bactéries oxydant les nitrites, en particulier Nitrobacter , oxydent le nitrite en nitrate, qui est extrêmement mobile et est une cause majeure d’ eutrophisation .
Classification
Les engrais sont classés de plusieurs manières. Ils sont classés selon qu’ils fournissent un seul élément nutritif (par exemple, K, P ou N), auquel cas ils sont classés comme « engrais simples ». Les « engrais multinutriments » (ou « engrais complexes ») fournissent deux nutriments ou plus, par exemple N et P. Les engrais sont également parfois classés comme inorganiques (le sujet de la majeure partie de cet article) par rapport aux organiques. Les engrais inorganiques excluent les matériaux contenant du carbone à l’exception des urées . Les engrais organiques sont généralement des matières (recyclées) d’origine végétale ou animale. Les engrais inorganiques sont parfois appelés engrais synthétiques car divers traitements chimiques sont nécessaires à leur fabrication. [20]
Engrais à un seul nutriment (“simple”)
Le principal engrais simple à base d’azote est l’ammoniac ou ses solutions. Le nitrate d’ammonium (NH 4 NO 3 ) est également largement utilisé. L’urée est une autre source d’azote populaire, ayant l’avantage d’être solide et non explosive, contrairement à l’ammoniac et au nitrate d’ammonium, respectivement. Quelques pourcents du marché des engrais azotés (4 % en 2007) [21] sont couverts par le nitrate d’ammonium calcique ( Ca(NO 3 ) 2 · NH 4 · 10 H 2 O ).
Les principaux engrais phosphatés simples sont les superphosphates . Le « superphosphate simple » (SSP) est constitué de 14 à 18 % de P 2 O 5 , toujours sous la forme de Ca(H 2 PO 4 ) 2 , mais aussi de phosphogypse ( Ca SO 4 · 2 H 2 O ). Le Superphosphate triple (TSP) se compose généralement de 44 à 48% de P 2 O 5 et pas de gypse. Un mélange de superphosphate simple et de Superphosphate triple est appelé superphosphate double. Plus de 90% d’un engrais superphosphate typique est soluble dans l’eau.
Le principal engrais simple à base de potassium est le muriate de potasse (MOP). Le muriate de potasse se compose de 95 à 99% de KCl et est généralement disponible sous forme d’engrais 0-0-60 ou 0-0-62.
Engrais multinutriments
Ces engrais sont courants. Ils sont constitués de deux éléments nutritifs ou plus.
Engrais binaires (NP, NK, PK)
Les principaux engrais à deux composants fournissent à la fois de l’azote et du phosphore aux plantes. Ceux-ci sont appelés engrais NP. Les principaux engrais NP sont le Phosphate monoammonique (MAP) et le phosphate diammonique (DAP). L’ingrédient actif du MAP est le NH 4 H 2 PO 4 . L’ingrédient actif du DAP est (NH 4 ) 2 HPO 4 . Environ 85% des engrais MAP et DAP sont solubles dans l’eau.
Engrais NPK
Les engrais NPK sont des engrais à trois composants fournissant de l’azote, du phosphore et du potassium. Il existe deux types d’engrais NPK : les composés et les mélanges. Les engrais NPK composés contiennent des ingrédients chimiquement liés, tandis que les engrais NPK mélangés sont des mélanges physiques de composants nutritifs uniques.
La notation NPK est un système de notation décrivant la quantité d’azote, de phosphore et de potassium dans un engrais. Les cotes NPK consistent en trois nombres séparés par des tirets (par exemple, 10-10-10 ou 16-4-8) décrivant le contenu chimique des engrais. [22] [23] Le premier chiffre représente le pourcentage d’azote dans le produit ; le deuxième nombre, P 2 O 5 ; le troisième, K 2 O. Les engrais ne contiennent pas réellement P 2 O 5 ou K 2O, mais le système est un raccourci conventionnel pour la quantité de phosphore (P) ou de potassium (K) dans un engrais. Un sac de 50 livres (23 kg) d’engrais étiqueté 16-4-8 contient 8 livres (3,6 kg) d’azote (16% des 50 livres), une quantité de phosphore équivalente à celle de 2 livres de P 2 O 5 (4 % de 50 livres) et 4 livres de K 2 O (8 % de 50 livres). La plupart des engrais sont étiquetés selon cette convention NPK, bien que la convention australienne, suivant un système NPKS, ajoute un quatrième chiffre pour le soufre et utilise des valeurs élémentaires pour toutes les valeurs, y compris P et K. [24]
Micronutriments
Les micronutriments sont consommés en plus petites quantités et sont présents dans les tissus végétaux de l’ordre de parties par million (ppm), allant de 0,15 à 400 ppm ou moins de 0,04 % de matière sèche. [25] [26] Ces éléments sont souvent requis pour les enzymes essentielles au métabolisme de la plante. Parce que ces éléments activent les catalyseurs (enzymes), leur impact dépasse de loin leur pourcentage en poids. Les micronutriments typiques sont le bore, le zinc, le molybdène, le fer et le manganèse. [18] Ces éléments sont fournis sous forme de sels hydrosolubles. Le fer présente des problèmes particuliers car il se transforme en composés insolubles (bio-indisponibles) à un pH du sol et à des concentrations de phosphate modérés. Pour cette raison, le fer est souvent administré sous forme de complexe chélaté , p.Dérivés EDTA ou EDDHA . Les besoins en micronutriments dépendent de la plante et de l’environnement. Par exemple, les betteraves à sucre semblent avoir besoin de bore et les légumineuses ont besoin de cobalt , [1] tandis que les conditions environnementales telles que la chaleur ou la sécheresse rendent le bore moins disponible pour les plantes. [27]
Environnement
Les engrais synthétiques utilisés dans l’agriculture ont des conséquences environnementales de grande portée . Selon le rapport spécial du Groupe d’experts intergouvernemental sur l’évolution du climat (GIEC) sur le changement climatique et les terres , la production de ces engrais et les pratiques d’ utilisation des terres associées sont des moteurs du réchauffement climatique . [2] L’utilisation d’engrais a également entraîné un certain nombre de conséquences environnementales directes : le Ruissellement agricole qui entraîne des effets en aval tels que les zones mortes des océans et la contamination des voies navigables, la dégradation du Microbiome du sol , [28]et l’accumulation de toxines dans les écosystèmes. Les impacts environnementaux indirects comprennent : les impacts environnementaux de la fracturation hydraulique pour le gaz naturel utilisé dans le procédé Haber , le boom agricole est en partie responsable de la croissance rapide de la population humaine et les pratiques agricoles industrielles à grande échelle sont associées à la destruction de l’habitat , la pression sur la biodiversité et l’agriculture Perte de sol .
Afin d’atténuer les préoccupations environnementales et de sécurité alimentaire , la communauté internationale a inclus les systèmes alimentaires dans l’objectif de développement durable 2 qui se concentre sur la création d’un système de production alimentaire durable et respectueux du climat . [29] La plupart des approches politiques et réglementaires pour résoudre ces problèmes se concentrent sur l’orientation des pratiques agricoles vers des pratiques agricoles durables ou régénératives : celles-ci utilisent moins d’engrais synthétiques, une meilleure gestion des sols (par exemple l’agriculture sans labour ) et davantage d’engrais organiques.
Production
Engrais azotés

 Consommation totale d’engrais azotés par région, mesurée en Tonnes de nutriments totaux par an.
Consommation totale d’engrais azotés par région, mesurée en Tonnes de nutriments totaux par an.
| Pays | Utilisation totale de N (Mt pa) |
Amt. utilisé pour l’ alimentation/pâturage (Mt pa) |
|---|---|---|
| Chine | 18.7 | 3.0 |
| Inde | 11.9 | S/O [31] |
| NOUS | 9.1 | 4.7 |
| France | 2.5 | 1.3 |
| Allemagne | 2.0 | 1.2 |
| Brésil | 1.7 | 0,7 |
| Canada | 1.6 | 0,9 |
| Turquie | 1.5 | 0,3 |
| ROYAUME-UNI | 1.3 | 0,9 |
| Mexique | 1.3 | 0,3 |
| Espagne | 1.2 | 0,5 |
| Argentine | 0,4 | 0,1 |
Les engrais azotés sont fabriqués à partir d’ ammoniac (NH 3 ) produit par le procédé Haber-Bosch . [21] Dans ce processus à forte intensité énergétique, le gaz naturel (CH 4 ) fournit généralement l’hydrogène et l’azote (N 2 ) est dérivé de l’air . Cet ammoniac est utilisé comme Matière première pour tous les autres engrais azotés, comme le nitrate d’ammonium anhydre (NH 4 NO 3 ) et l’urée (CO(NH 2 ) 2 ).
Des gisements de nitrate de sodium (NaNO 3 ) ( salpêtre chilien ) se trouvent également dans le Désert d’Atacama au Chili et étaient l’un des premiers (1830) engrais riches en azote utilisés. [32] Il est toujours exploité pour l’engrais. [33] Les nitrates sont également produits à partir d’ammoniac par le procédé d’Ostwald .
Engrais phosphatés

 Une mine d’apatite à Siilinjärvi , en Finlande.
Une mine d’apatite à Siilinjärvi , en Finlande.
Les engrais phosphatés sont obtenus par extraction de la Roche phosphatée , qui contient deux principaux minéraux contenant du phosphore, la fluorapatite Ca 5 (PO 4 ) 3 F (CFA) et l’ hydroxyapatite Ca 5 (PO 4 ) 3 OH. Ces minéraux sont transformés en sels de phosphate hydrosolubles par traitement avec des acides sulfurique (H 2 SO 4 ) ou phosphorique (H 3 PO 4 ). La grande production d’ acide sulfurique est principalement motivée par cette application. [34]Dans le procédé au nitrophosphate ou procédé Odda (inventé en 1927), la Roche phosphatée contenant jusqu’à 20 % de phosphore (P) est dissoute avec de l’acide nitrique (HNO 3 ) pour produire un mélange d’acide phosphorique (H 3 PO 4 ) et de calcium nitrate (Ca(NO 3 ) 2 ). Ce mélange peut être combiné avec un engrais potassique pour produire un engrais composé avec les trois macronutriments N, P et K sous forme facilement soluble. [35]
Engrais potassiques
La potasse est un mélange de minéraux potassiques utilisés pour fabriquer des engrais potassiques (symbole chimique : K). La potasse est soluble dans l’eau, donc l’effort principal pour produire ce nutriment à partir du minerai implique certaines étapes de purification; par exemple, pour éliminer le chlorure de sodium (NaCl) ( sel ordinaire ). Parfois, la potasse est appelée K 2 O, par souci de commodité pour ceux qui décrivent la teneur en potassium. En fait, les engrais potassiques sont généralement du chlorure de potassium , du sulfate de potassium , du carbonate de potassium ou du nitrate de potassium . [36]
Engrais NPK
Il existe quatre grandes voies de fabrication des engrais NPK : 1) granulation à la vapeur, 2) granulation chimique, 3) compactage, 4) mélange en vrac. Les trois premiers processus sont utilisés pour produire des NPK composés. Pendant la granulation à la vapeur, les matières premières sont mélangées et ensuite granulées en utilisant de la vapeur comme liant. Le processus de granulation chimique est basé sur des réactions chimiques entre les matières premières liquides (telles que l’acide phosphorique, l’acide sulfurique, l’ammoniac) et les matières premières solides (telles que le chlorure de potassium, les matières recyclées). Le compactage met en œuvre une haute pression pour agglomérer les matériaux pulvérulents secs. Enfin, les mélanges en vrac sont produits en mélangeant des engrais simples.
Engrais organiques



 Une grande opération commerciale de compostage
Une grande opération commerciale de compostage
Les « engrais organiques » peuvent décrire les engrais d’origine organique – biologique – c’est-à-dire les engrais dérivés de matières vivantes ou anciennement vivantes. Les engrais organiques peuvent également décrire des produits disponibles dans le commerce et fréquemment emballés qui s’efforcent de suivre les attentes et les restrictions adoptées par « l’agriculture biologique » et le jardinage « respectueux de l’environnement » – des systèmes de production alimentaire et végétale liés qui limitent considérablement ou évitent strictement l’utilisation d’engrais et de pesticides de synthèse. Les produits “engrais organiques”contiennent généralement à la fois des matières organiques ainsi que des additifs acceptables tels que des poudres de roche nutritives, des coquillages broyés (crabe, huître, etc.), d’autres produits préparés tels que de la farine de graines ou du varech, et des micro-organismes cultivés et leurs dérivés.
Les engrais d’origine organique (première définition) comprennent les déchets animaux , les déchets végétaux issus de l’agriculture, les algues , le compost et les boues d’épuration traitées ( biosolides ). Au-delà des fumiers, les sources animales peuvent inclure des produits provenant de l’abattage d’animaux – la farine de sang , la farine d’os, la farine de plumes , les peaux, les sabots et les cornes sont tous des composants typiques. [18]Les matériaux d’origine organique disponibles pour l’industrie, tels que les boues d’épuration, peuvent ne pas être des composants acceptables de l’agriculture et du jardinage biologiques, en raison de facteurs allant des contaminants résiduels à la perception du public. D’un autre côté, les “engrais organiques” commercialisés peuvent inclure et promouvoir des produits organiques transformés parce que les matériaux sont attrayants pour le consommateur. Peu importe la définition ou la composition, la plupart de ces produits contiennent des nutriments moins concentrés et les nutriments ne sont pas aussi facilement quantifiables. Ils peuvent offrir des avantages de renforcement du sol et être attrayants pour ceux qui essaient de cultiver/jardiner plus “naturellement”. [37]
En termes de volume, la tourbe est l’amendement de sol organique conditionné le plus utilisé. C’est une forme immature de charbon qui améliore le sol par aération et absorption d’eau mais ne confère aucune valeur nutritive aux plantes. Il ne s’agit donc pas d’un engrais tel que défini en début d’article, mais plutôt d’un amendement. Coco, (dérivés de coques de noix de coco), d’écorce et de sciure de bois lorsqu’ils sont ajoutés au sol agissent tous de la même manière (mais pas de manière identique) à la tourbe et sont également considérés comme des amendements organiques du sol – ou des texturants – en raison de leurs apports nutritifs limités. Certains additifs organiques peuvent avoir un effet inverse sur les nutriments – la sciure de bois fraîche peut consommer les nutriments du sol lorsqu’elle se décompose et peut abaisser le pH du sol – mais ces mêmes texturants organiques (ainsi que le compost, etc.) peuvent augmenter la disponibilité des nutriments grâce à une meilleure échange de cations, ou par une croissance accrue de micro-organismes qui, à leur tour, augmentent la disponibilité de certains éléments nutritifs des plantes. Les engrais organiques tels que les composts et les fumiers peuvent être distribués localement sans entrer dans la production industrielle, ce qui rend la consommation réelle plus difficile à quantifier.
Application

 Application manuelle d’engrais superphosphate , Nouvelle-Zélande, 1938
Application manuelle d’engrais superphosphate , Nouvelle-Zélande, 1938
Les engrais sont couramment utilisés pour la culture de toutes les cultures, avec des taux d’application dépendant de la fertilité du sol, généralement mesurée par une analyse de sol et en fonction de la culture particulière. Les légumineuses, par exemple, fixent l’azote de l’atmosphère et ne nécessitent généralement pas d’engrais azoté.
Liquide vs solide
Les engrais sont appliqués aux cultures à la fois sous forme solide et sous forme liquide. Environ 90 % des engrais sont appliqués sous forme solide. Les engrais inorganiques solides les plus largement utilisés sont l’urée , le phosphate diammonique et le chlorure de potassium. [38] L’engrais solide est généralement granulé ou en poudre. Souvent, les solides sont disponibles sous forme de granulés , un globule solide. Les engrais liquides comprennent l’ammoniac anhydre, les solutions aqueuses d’ammoniac, les solutions aqueuses de nitrate d’ammonium ou d’urée. Ces produits concentrés peuvent être dilués avec de l’eau pour former un engrais liquide concentré (p. ex. UAN ). Les avantages de l’engrais liquide sont son effet plus rapide et sa couverture plus facile. [18] L’ajout d’engrais à l’eau d’irrigation est appelé “fertirrigation “. [36]
Urée
L’urée est très soluble dans l’eau et convient donc parfaitement à une utilisation dans des solutions d’engrais (en combinaison avec du nitrate d’ammonium : UAN), par exemple dans des engrais « foliaires ». Pour l’utilisation d’engrais, les granulés sont préférés aux granulés en raison de leur distribution granulométrique plus étroite, ce qui est un avantage pour l’application mécanique.
L’urée est généralement épandue à des taux compris entre 40 et 300 kg/ha (35 à 270 lb/acre), mais les taux varient. Les petites applications entraînent des pertes moindres dues à la lixiviation. Pendant l’été, l’urée est souvent épandue juste avant ou pendant la pluie pour minimiser les pertes par volatilisation (un processus dans lequel l’azote est perdu dans l’atmosphère sous forme de gaz ammoniac).
En raison de la concentration élevée d’azote dans l’urée, il est très important d’obtenir une répartition uniforme. Le semis ne doit pas se faire au contact ou à proximité des semences, en raison du risque de dégâts de germination. L’urée se dissout dans l’eau pour être appliquée sous forme de pulvérisation ou par l’intermédiaire de systèmes d’irrigation.
Dans les cultures céréalières et cotonnières, l’urée est souvent appliquée au moment de la dernière culture avant la plantation. Dans les zones à fortes précipitations et sur les sols sablonneux (où l’azote peut être perdu par lessivage) et où de bonnes précipitations en saison sont attendues, l’urée peut être appliquée sur le côté ou sur le dessus pendant la saison de croissance. Le top-dressing est également populaire sur les pâturages et les cultures fourragères. Dans la culture de la canne à sucre, l’urée est enrobée après la plantation et appliquée sur chaque culture de raton .
Parce qu’elle absorbe l’humidité de l’atmosphère, l’urée est souvent stockée dans des récipients fermés.
Un surdosage ou le fait de placer de l’urée près des graines est nocif. [39]
Engrais à libération lente et contrôlée
Cette section est un extrait de Engrais à libération contrôlée . [ modifier ] 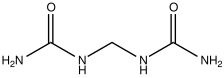
 Le méthylène diurée (MDU) est un composant des engrais à libération contrôlée les plus populaires . [40] Un engrais à libération contrôlée (CRF) est un engrais granulé qui libère progressivement les éléments nutritifs dans le sol (c’est-à-dire avec une période de libération contrôlée ). [41] L’engrais à libération contrôlée est également appelé engrais à disponibilité contrôlée, engrais à libération retardée, engrais à libération dosée ou engrais à action lente. Habituellement, le CRF fait référence aux engrais à base d’azote. Les libérations lentes et contrôlées ne représentent que 0,15 % (562 000 Tonnes) du marché des engrais (1995).
Le méthylène diurée (MDU) est un composant des engrais à libération contrôlée les plus populaires . [40] Un engrais à libération contrôlée (CRF) est un engrais granulé qui libère progressivement les éléments nutritifs dans le sol (c’est-à-dire avec une période de libération contrôlée ). [41] L’engrais à libération contrôlée est également appelé engrais à disponibilité contrôlée, engrais à libération retardée, engrais à libération dosée ou engrais à action lente. Habituellement, le CRF fait référence aux engrais à base d’azote. Les libérations lentes et contrôlées ne représentent que 0,15 % (562 000 Tonnes) du marché des engrais (1995).
Application foliaire
Les engrais foliaires sont appliqués directement sur les feuilles. Cette méthode est presque toujours utilisée pour appliquer des engrais azotés simples solubles dans l’eau et utilisée en particulier pour les cultures à forte valeur telles que les fruits. L’urée est l’engrais foliaire le plus courant. [18]

 Brûlure d’engrais
Brûlure d’engrais
Produits chimiques qui affectent l’absorption d’azote

 N-Butylthiophosphoryltriamide, un engrais à efficacité renforcée.
N-Butylthiophosphoryltriamide, un engrais à efficacité renforcée.
Divers produits chimiques sont utilisés pour améliorer l’efficacité des engrais azotés. Les agriculteurs peuvent ainsi limiter les effets polluants du ruissellement d’azote. Les inhibiteurs de nitrification (également connus sous le nom de stabilisateurs d’azote) suppriment la conversion de l’ammoniac en nitrate, un anion plus sujet au lessivage. Le 1-carbamoyl-3-méthylpyrazole (CMP), le dicyandiamide , la nitrapyrine (2-chloro-6-trichlorométhylpyridine) et le phosphate de 3,4-diméthylpyrazole (DMPP) sont populaires. [42] Les inhibiteurs d’uréase sont utilisés pour ralentir la conversion hydrolytique de l’urée en ammoniac, qui est sujette à l’évaporation ainsi qu’à la nitrification. La conversion de l’urée en ammoniac catalysée par des enzymes appelées uréases . Un inhibiteur populaire des uréases est le triamide N-(n-butyl)thiophosphorique (NBPT).
Surfertilisation
Une utilisation prudente des technologies de fertilisation est importante car un excès de nutriments peut être préjudiciable. [43] Une brûlure d’engrais peut se produire lorsqu’une trop grande quantité d’engrais est appliquée, entraînant des dommages ou même la mort de la plante. Les engrais varient dans leur tendance à brûler à peu près en fonction de leur indice de sel . [44] [45]
Statistiques

 Utilisation d’engrais (2018). Extrait de l’Annuaire statistique 2020 de l’Alimentation et de l’agriculture mondiales de la FAO [46]
Utilisation d’engrais (2018). Extrait de l’Annuaire statistique 2020 de l’Alimentation et de l’agriculture mondiales de la FAO [46]
Récemment, les engrais azotés ont atteint un plateau dans la plupart des pays développés. La Chine est cependant devenue le plus grand producteur et consommateur d’engrais azotés. [47] L’ Afrique dépend peu des engrais azotés. [48] Les minéraux agricoles et chimiques sont très importants dans l’utilisation industrielle des engrais, qui est évaluée à environ 200 milliards de dollars. [49] L’azote a un impact significatif sur l’utilisation mondiale des minéraux, suivi de la potasse et du phosphate. La production d’azote a considérablement augmenté depuis les années 1960. Le prix du phosphate et de la potasse a augmenté depuis les années 1960, ce qui est supérieur à l’indice des prix à la consommation. [49] La potasse est produite au Canada, en Russie et en Biélorussie, qui représentent ensemble plus de la moitié de la production mondiale.[49] La production de potasse au Canada a augmenté en 2017 et 2018 de 18,6 %. [50] Selon des estimations prudentes, 30 à 50 % des rendements des cultures sont attribués aux engrais commerciaux naturels ou synthétiques. [36] [51] La consommation d’engrais a dépassé la quantité de terres agricoles aux États-Unis [49] . La valeur marchande mondiale devrait atteindre plus de 185 milliards de dollars américains jusqu’en 2019. [52] Le marché européen des engrais augmentera pour générer des revenus d’env. 15,3 milliards d’euros en 2018. [53]
Les données sur la consommation d’engrais par hectare de terre arable en 2012 sont publiées par la Banque mondiale . [54] Le diagramme ci-dessous montre la consommation d’engrais par les pays de l’Union européenne (UE) en kilogrammes par hectare (livres par acre). La consommation totale d’engrais dans l’UE est de 15,9 millions de Tonnes pour 105 millions d’hectares de terres arables [55] (ou 107 millions d’hectares de terres arables selon une autre estimation [56] ). Ce chiffre équivaut à 151 kg d’engrais consommés par hectare de terre arable en moyenne par les pays de l’UE.


Effets environnementaux

 Ruissellement de sol et d’engrais pendant une tempête de pluie
Ruissellement de sol et d’engrais pendant une tempête de pluie
L’utilisation d’engrais est bénéfique pour fournir des éléments nutritifs aux plantes, bien qu’elle ait des effets négatifs sur l’environnement. La forte consommation croissante d’engrais peut affecter le sol, les eaux de surface et les eaux souterraines en raison de la dispersion de l’utilisation des minéraux. [49]


Pour chaque tonne d’acide phosphorique produite par le traitement de la Roche phosphatée, cinq Tonnes de déchets sont générées. Ces déchets se présentent sous la forme d’un solide impur, inutile et radioactif appelé phosphogypse . Les estimations varient entre 100 000 000 et 280 000 000 Tonnes de déchets de phosphogypse sont produites chaque année dans le monde. [57]
Eau

 Les cercles rouges indiquent l’emplacement et la taille de nombreuses zones mortes .
Les cercles rouges indiquent l’emplacement et la taille de nombreuses zones mortes .
Les engrais phosphorés et azotés, lorsqu’ils sont couramment utilisés, ont des effets environnementaux majeurs. Cela est dû aux fortes précipitations qui entraînent le lessivage des engrais dans les cours d’eau. [58] Le Ruissellement agricole est un contributeur majeur à l’eutrophisation des masses d’eau douce. Par exemple, aux États-Unis, environ la moitié de tous les lacs sont eutrophes . Le principal contributeur à l’eutrophisation est le phosphate, qui est normalement un nutriment limitant; des concentrations élevées favorisent la croissance des cyanobactéries et des algues, dont la disparition consomme de l’oxygène. [59] Les efflorescences de cyanobactéries (« efflorescences algales ») peuvent également produire des toxines nocives qui peuvent s’accumuler dans la chaîne alimentaire et peuvent être nocives pour l’homme. [60] [61]
Les composés riches en azote présents dans le ruissellement des engrais sont la principale cause de l’épuisement grave de l’oxygène dans de nombreuses parties des océans , en particulier dans les zones côtières, les lacs et les rivières . Le manque d’oxygène dissous qui en résulte réduit considérablement la capacité de ces zones à soutenir la faune océanique . [62] Le nombre de zones mortes océaniques à proximité des côtes habitées augmente. [63] Depuis 2006, l’application d’engrais azotés est de plus en plus contrôlée dans le nord-ouest de l’Europe [64] et aux États-Unis. [65] [66] Si l’eutrophisation peut être inversée, cela peut prendre des décennies[ citation nécessaire ] avant que les nitrates accumulés dans les eaux souterraines puissent être décomposés par des processus naturels.
Pollution par les nitrates
Seule une fraction des engrais azotés est convertie en matière végétale. Le reste s’accumule dans le sol ou se perd par ruissellement. [67] Les taux d’application élevés d’engrais contenant de l’azote combinés à la forte solubilité dans l’eau du nitrate entraînent une augmentation du ruissellement dans les eaux de surface ainsi qu’un lessivage dans les eaux souterraines, provoquant ainsi une pollution des eaux souterraines . [68] [69] [70] L’utilisation excessive d’engrais contenant de l’azote (qu’ils soient synthétiques ou naturels) est particulièrement dommageable, car une grande partie de l’azote qui n’est pas absorbé par les plantes est transformée en nitrate qui est facilement lessivé. [71]
Des niveaux de nitrate supérieurs à 10 mg/L (10 ppm) dans les eaux souterraines peuvent provoquer le « syndrome du bébé bleu » ( méthémoglobinémie acquise ). [72] Les nutriments, en particulier les nitrates, contenus dans les engrais peuvent causer des problèmes aux habitats naturels et à la santé humaine s’ils sont lessivés du sol dans les cours d’eau ou lessivés à travers le sol dans les eaux souterraines. [ citation nécessaire ]
Sol
Acidification
Les engrais contenant de l’azote peuvent provoquer une acidification du sol lorsqu’ils sont ajoutés. [73] [74] Cela peut conduire à une diminution de la disponibilité des nutriments qui peut être compensée par le chaulage .
Accumulation d’éléments toxiques Cadmium
La concentration de cadmium dans les engrais contenant du phosphore varie considérablement et peut être problématique. [75] Par exemple, un engrais au phosphate de monoammonium peut avoir une teneur en cadmium aussi faible que 0,14 mg/kg ou aussi élevée que 50,9 mg/kg. [76] La Roche phosphatée utilisée dans leur fabrication peut contenir jusqu’à 188 mg/kg de cadmium [77] (des exemples sont des gisements à Nauru [78] et dans les îles Christmas [79] ). L’utilisation continue d’engrais à haute teneur en cadmium peut contaminer le sol (comme le montre la Nouvelle-Zélande) [80] et les plantes . [81]Des limites à la teneur en cadmium des engrais phosphatés ont été envisagées par la Commission européenne . [82] [83] [84] Les producteurs d’engrais contenant du phosphore sélectionnent maintenant la Roche phosphatée en fonction de la teneur en cadmium. [59]
Fluorure
Les roches phosphatées contiennent des niveaux élevés de fluorure. Par conséquent, l’utilisation généralisée d’engrais phosphatés a augmenté les concentrations de fluorure dans le sol. [81] Il a été constaté que la contamination des aliments par les engrais est peu préoccupante car les plantes accumulent peu de fluorure du sol; la possibilité de toxicité du fluorure pour le bétail qui ingère des sols contaminés est plus préoccupante. [85] [86] Les effets du fluorure sur les micro-organismes du sol sont également préoccupants. [85] [86] [87]
Éléments radioactifs
Le contenu radioactif des engrais varie considérablement et dépend à la fois de leurs concentrations dans le minéral parent et du processus de production des engrais. [81] [88] Les concentrations d’uranium-238 peuvent varier de 7 à 100 pCi/g dans la Roche phosphatée [89] et de 1 à 67 pCi/g dans les engrais phosphatés. [90] [91] [92] Là où des taux annuels élevés d’engrais phosphorés sont utilisés, cela peut entraîner des concentrations d’uranium-238 dans les sols et les eaux de drainage qui sont plusieurs fois supérieures à celles qui sont normalement présentes. [91] [93] Cependant, l’impact de ces augmentations sur le risque pour la santé humaine lié à la contamination des aliments par les radinucléides est très faible (moins de 0,05 mSv /y). [91] [94] [95]
Autres métaux
Déchets de la sidérurgie, recyclés en engrais pour leur forte teneur en zinc (essentiel à la croissance des plantes), les déchets peuvent contenir les métaux toxiques suivants : plomb [96] arsenic , cadmium , [96] chrome et nickel. Les éléments toxiques les plus courants dans ce type d’engrais sont le mercure, le plomb et l’arsenic. [97] [98] [99] Ces impuretés potentiellement nocives peuvent être éliminées ; cependant, cela augmente considérablement le coût. Les engrais très purs sont largement disponibles et peut-être mieux connus sous le nom d’engrais hautement solubles dans l’eau contenant des colorants bleus utilisés autour des ménages, tels que Miracle-Gro. Ces engrais hautement solubles dans l’eau sont utilisés dans les pépinières et sont disponibles dans des emballages plus grands à un coût nettement inférieur à celui des quantités vendues au détail. Certains engrais de jardin granulaires bon marché sont fabriqués avec des ingrédients de haute pureté.
Épuisement des oligo-éléments
L’attention s’est portée sur la diminution des concentrations d’éléments tels que le fer, le zinc, le cuivre et le magnésium dans de nombreux aliments au cours des 50 à 60 dernières années. [100] [101] Les pratiques agricoles intensives , y compris l’utilisation d’engrais synthétiques, sont fréquemment suggérées comme raisons de ces déclins et l’agriculture biologique est souvent suggérée comme solution. [101] Bien que l’on sache que l’amélioration des rendements des cultures résultant des engrais NPK dilue les concentrations d’autres nutriments dans les plantes, [100] [102] une grande partie du déclin mesuré peut être attribuée à l’utilisation de variétés de cultures à rendement progressivement plus élevé qui produisent des aliments. avec des concentrations minérales plus faibles que leurs ancêtres moins productifs. [100] [103][104] Il est donc peu probable que l’agriculture biologique ou l’utilisation réduite d’engrais résolvent le problème ; les aliments à haute densité nutritionnelle sont censés être obtenus en utilisant des variétés plus anciennes à faible rendement ou en développant de nouvelles variétés à haut rendement et riches en nutriments. [100] [105]
Les engrais sont, en fait, plus susceptibles de résoudre les problèmes de carence en oligo-éléments que de les causer : en Australie-Occidentale, des carences en zinc , cuivre, manganèse , fer et molybdène ont été identifiées comme limitant la croissance des cultures et des pâturages à grande échelle dans les années 1940 et 1950. . [106] Les sols d’Australie-Occidentale sont très anciens, très altérés et déficients en de nombreux nutriments et oligo-éléments majeurs. [106] Depuis cette époque, ces oligo-éléments sont régulièrement ajoutés aux engrais utilisés en agriculture dans cet État. [106] De nombreux autres sols dans le monde manquent de zinc, ce qui entraîne une carence à la fois chez les plantes et chez les humains, et les engrais à base de zinc sont largement utilisés pour résoudre ce problème.[107]
Modifications de la biologie du sol
Des niveaux élevés d’engrais peuvent entraîner la rupture des relations symbiotiques entre les racines des plantes et les champignons mycorhiziens . [108]
Consommation d’énergie et durabilité
Aux États-Unis en 2004, 317 milliards de pieds cubes de gaz naturel ont été consommés dans la production industrielle d’ammoniac , soit moins de 1,5 % de la consommation annuelle totale de gaz naturel aux États-Unis . [109] Un rapport de 2002 a suggéré que la production d’ammoniac consomme environ 5 % de la consommation mondiale de gaz naturel, ce qui représente un peu moins de 2 % de la production mondiale d’énergie. [110]
L’ammoniac est produit à partir de gaz naturel et d’air. [111] Le coût du gaz naturel représente environ 90 % du coût de production de l’ammoniac. [112] L’augmentation du prix du gaz naturel au cours de la dernière décennie, ainsi que d’autres facteurs comme l’augmentation de la demande, ont contribué à une augmentation du prix des engrais. [113]
Contribution au changement climatique
Les gaz à effet de serre dioxyde de carbone , méthane et protoxyde d’azote sont produits lors de la fabrication d’engrais azotés. Le CO2 est estimé à plus de 1 % des émissions mondiales de CO2. [114] L’engrais azoté peut être converti par les bactéries du sol en protoxyde d’azote , un gaz à effet de serre . [115] Les émissions de protoxyde d’azote par l’homme, dont la plupart proviennent des engrais, entre 2007 et 2016 ont été estimées à 7 millions de Tonnes par an, [116] ce qui est incompatible avec la limitation du réchauffement climatique en dessous de 2°C. [117]
Atmosphère

 Concentrations mondiales de méthane (surface et atmosphérique) pour 2005 ; notez les panaches distincts
Concentrations mondiales de méthane (surface et atmosphérique) pour 2005 ; notez les panaches distincts
Grâce à l’utilisation croissante d’engrais azotés, qui a été utilisé à raison d’environ 110 millions de Tonnes (de N) par an en 2012, [118] [119] ajoutant à la quantité déjà existante d’azote réactif, le protoxyde d’azote (N 2 O ) est devenu le troisième gaz à effet de serre après le dioxyde de carbone et le méthane. Il a un potentiel de réchauffement global 296 fois supérieur à une masse égale de dioxyde de carbone et il contribue également à l’appauvrissement de l’ozone stratosphérique. [120] En modifiant les processus et les procédures, il est possible d’atténuer certains de ces effets sur le changement climatique anthropique, mais pas tous . [121]
Les émissions de méthane des champs cultivés (notamment les rizières ) sont augmentées par l’application d’engrais à base d’ammonium. Ces émissions contribuent au changement climatique mondial car le méthane est un puissant gaz à effet de serre. [122] [123]
Politique
Régulation
En Europe, les problèmes de fortes concentrations de nitrates dans les eaux de ruissellement sont traités par la directive de l’Union européenne sur les nitrates. [124] En Grande-Bretagne, les agriculteurs sont encouragés à gérer leurs terres de manière plus durable dans le cadre d’une « agriculture sensible aux bassins versants ». [125] Aux États-Unis, les concentrations élevées de nitrate et de phosphore dans les eaux de ruissellement et de drainage sont classées comme polluants de source non ponctuelle en raison de leur origine diffuse ; cette pollution est réglementée au niveau de l’État. [126] L’Oregon et Washington, tous deux aux États-Unis, ont des programmes d’enregistrement des engrais avec des bases de données en ligne répertoriant les analyses chimiques des engrais. [127] [128]
En Chine, des réglementations ont été mises en place pour contrôler l’utilisation des engrais azotés dans l’agriculture. En 2008, les gouvernements chinois ont commencé à retirer partiellement les subventions aux engrais, y compris les subventions au transport des engrais et à l’utilisation de l’électricité et du gaz naturel dans l’industrie. En conséquence, le prix des engrais a augmenté et les grandes exploitations ont commencé à utiliser moins d’engrais. Si les grandes exploitations continuent de réduire leur utilisation des subventions aux engrais, elles n’ont d’autre choix que d’optimiser les engrais dont elles disposent, ce qui leur permettrait d’augmenter à la fois le rendement céréalier et les bénéfices. [129]
Deux types de pratiques de gestion agricole comprennent l’agriculture biologique et l’agriculture conventionnelle. Le premier encourage la fertilité des sols en utilisant les ressources locales pour maximiser l’efficacité. L’agriculture biologique évite les produits agrochimiques synthétiques. L’agriculture conventionnelle utilise tous les composants que l’agriculture biologique n’utilise pas. [130]
Voir également
- Agroécologie
- Circulus (théorie)
- Fertirrigation
- Organisation pour l’alimentation et l’agriculture
- Histoire de l’agriculture biologique
- Milorganite
- Nuancier des feuilles
- Récupération et réutilisation des nutriments
- Phosphogypse
- Défertilisation du sol
- Engrais aux algues
Références
- ^ un bc Scherer , Heinrich W.; Mengel, Konrad; Kluge, Gunter ; Séverin, Karl (2009). “Engrais, 1. Général”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a10_323.pub3 .
- ^ un b Mbow et autres. 2019 .erreur sfn : pas de cible : CITEREFMbowRosenzweigBarioniBenton2019 ( aide )
- ^ “Production totale d’engrais par nutriment” . Notre monde en données . Récupéré le 7 mars 2020 .
- ^ “La population mondiale avec et sans engrais azotés synthétiques” . Notre monde en données . Récupéré le 5 mars 2020 .
- ^ Visser, Jozef (20 novembre 2019), Larramendy, Marcelo; Soloneski, Sonia (eds.), « Histoire d’ouverture : Gagner des perspectives » , Engrais organiques – Histoire, production et applications , IntechOpen, doi : 10.5772/intechopen.86185 , ISBN 978-1-78985-147-2, récupéré le 13 avril 2021
- ^ Uekötter, Frank (2010). Die Wahrheit ist auf dem Feld : Eine Wissensgeschichte der deutschen Landwirtschaft . Vandenhoeck et Ruprecht. ISBN 978-3-5253-1705-1.
- ^ Uekötter, Frank (2014). “Pourquoi les panacées fonctionnent: refondre les intérêts de la science, des connaissances et des engrais dans l’agriculture allemande” . Histoire agricole . 88 (1): 68–86. doi : 10.3098/ah.2014.88.1.68 . ISSN 0002-1482 . JSTOR 10.3098/ah.2014.88.1.68 .
- ^
![]()
![]() Cet article incorpore le texte d’une publication maintenant dans le domaine public : Chisholm, Hugh, éd. (1911). « Lawes, Sir John Bennet ». Encyclopædia Britannica (11e éd.). La presse de l’Universite de Cambridge.
Cet article incorpore le texte d’une publication maintenant dans le domaine public : Chisholm, Hugh, éd. (1911). « Lawes, Sir John Bennet ». Encyclopædia Britannica (11e éd.). La presse de l’Universite de Cambridge. - ^ Aaron John Ihde (1984). Le développement de la chimie moderne . Courrier Douvres Publications. p. 678. ISBN 978-0-486-64235-2.
- ^ GJ Leigh (2004). La plus grande solution au monde : une histoire de l’azote et de l’agriculture . Oxford University Press États-Unis. p. 134–139 . ISBN 978-0-19-516582-1.
- ^ Trevor Illtyd Williams; Thomas Kingston Derry (1982). Une brève histoire de la technologie du XXe siècle c. 1900-c. 1950 . Presse universitaire d’Oxford. p. 134–135. ISBN 978-0-19-858159-8.
- ^ Philpot, Tom. “Une brève histoire de notre dépendance mortelle aux engrais azotés” . Mère Jones . Récupéré le 24 mars 2021 .
- ^ Verre, Anthony (septembre 2003). “Efficacité d’utilisation de l’azote des plantes cultivées: contraintes physiologiques sur l’absorption d’azote”. Revues critiques en sciences végétales . 22 (5): 453–470. doi : 10.1080/713989757 .
- ^ Erisman, Jan Willem; MA Sutton, J Galloway, Z Klimont, W Winiwarter (octobre 2008). “Comment un siècle de synthèse d’ammoniac a changé le monde” . Géosciences naturelles . 1 (10): 636–639. Bibcode : 2008NatGe…1..636E . doi : 10.1038/ngeo325 . Archivé de l’original le 23 juillet 2010 . Récupéré le 22 octobre 2010 . {{cite journal}}: Maint CS1 : noms multiples : liste des auteurs ( lien )
- ^ Vance, Carroll P; Uhde-Stone & Allan (2003). “Acquisition et utilisation du phosphore : adaptations critiques des plantes pour la sécurisation d’une ressource non renouvelable”. Nouveau Phytologue . 157 (3): 423–447. doi : 10.1046/j.1469-8137.2003.00695.x . JSTOR 1514050 . PMID 33873400 . S2CID 53490640 .
- ^ “Fusions dans l’industrie des engrais” . L’Économiste . 18 février 2010 . Récupéré le 21 février 2010 .
- ^ Alimentation et agriculture mondiales – Annuaire statistique 2021 . www.fao.org . 2021. doi : 10.4060/cb4477en . ISBN 978-92-5-134332-6. S2CID 240163091 . Récupéré le 10 décembre 2021 .{{cite book}}: Maint CS1 : url-status ( lien )
- ^ un bcde Dittmar , Heinrich ; Drach, Manfred ; Vosskamp, Ralf; Trenkel, Martin E.; Gutser, Reinhold ; Steffens, Gunter (2009). “Engrais, 2. Types”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.n10_n01 .
- ^ Marsh KL, Sims GK, Mulvaney RL (2005). “Disponibilité de l’urée pour les bactéries autotrophes oxydant l’ammoniac en relation avec le sort de l’urée marquée au 14 C et au 15 N ajoutée au sol” . Biologie et Fertilité des Sols . 42 (2): 137–145. doi : 10.1007/s00374-005-0004-2 . S2CID 6245255 .
- ^ J. Benton Jones, Jr. “Les engrais chimiques inorganiques et leurs propriétés” dans le manuel de nutrition des plantes et de fertilité du sol , deuxième édition. CRC Press, 2012. ISBN 978-1-4398-1609-7 . Livre électronique ISBN 978-1-4398-1610-3 .
- ^ un b Smil, Vaclav (2004). Enrichir la Terre . Institut de technologie du Massachusetts . p. 135. ISBN 978-0-262-69313-4.
- ^ “Résumé des lois sur les engrais de l’État” (PDF) . EPA . Récupéré le 14 mars 2013 .
- ^ “Exigences d’étiquetage des engrais spéciaux et autres engrais ensachés” . Département de l’agriculture et du développement rural du Michigan . Récupéré le 14 mars 2013 .
- ^ “Code de pratique national pour la description et l’étiquetage des engrais” (PDF) . Département de l’agriculture, des pêches et des forêts du gouvernement australien. Archivé de l’original (PDF) le 28 février 2015 . Récupéré le 14 mars 2013 .
- ^ “Manuel d’analyse des plantes AESL – Teneur en éléments nutritifs de la plante” . Aesl.ces.uga.edu . Récupéré le 11 septembre 2015 .
- ^ Moulins HA; JB Jones Jr. (1996). Manuel d’analyse des plantes II : Un guide pratique d’échantillonnage, de préparation, d’analyse et d’interprétation . ISBN 978-1-878148-05-6.
- ^ “Carence en bore” .
- ^ Chen, Huaihai; Yang, Zamin K.; Oui, Dan ; Morris, Reese H.; Lebreux, Steven J.; Cregger, Melissa A.; Klingeman, Dawn M.; Hui, Dafeng ; Hettich, Robert L.; Wilhelm, Steven W.; Wang, Gangsheng (18 juin 2019). “La fertilisation azotée ponctuelle déplace les microbiomes du sol du panic raide dans un contexte de variation spatiale et temporelle plus importante” . PLOS ONE . 14 (6) : e0211310. Bibcode : 2019PLoSO..1411310C . doi : 10.1371/journal.pone.0211310 . ISSN 1932-6203 . PMC 6581249 . PMID 31211785 .
- ^ Nations Unies (2017) Résolution adoptée par l’Assemblée générale le 6 juillet 2017, Travaux de la Commission de statistique relatifs au Programme de développement durable à l’horizon 2030 ( A/RES/71/313 )
- ^ L’ombre longue du bétail: problèmes et options environnementaux , tableau 3.3 . Consulté le 29 juin 2009. Organisation des Nations Unies pour l’alimentation et l’agriculture .
- ^ “Production et intrants | Gouvernement indien, Département des engrais, Ministère des produits chimiques et des engrais” .
- ^ “Rapport technique supplémentaire pour le nitrate de sodium (cultures)” . ams.usda.gov . Archivé de l’original le 14 juillet 2014 . Récupéré le 6 juillet 2014 .
- ^ “Caliche Ore” . mq.com . Archivé de l’original le 14 juillet 2014 . Récupéré le 6 juillet 2014 .
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ EFMA (2000). “Meilleures techniques disponibles pour la prévention et le contrôle de la pollution dans l’industrie européenne des engrais. Brochure n° 7 sur 8 : Production d’engrais NPK par la voie des nitrophosphates” (PDF) . fertilisantseurope.com . Association européenne des fabricants d’engrais. Archivé de l’original (PDF) le 29 juillet 2014 . Récupéré le 28 juin 2014 .
- ^ un bc Vasant Gowariker, VN Krishnamurthy, Sudha Gowariker, Manik Dhanorkar, Kalyani Paranjape “L’Encyclopédie des Engrais” 2009, John Wiley & Sons. ISBN 978-0-470-41034-9 . ISBN en ligne 978-0-470-43177-1 . doi : 10.1002/9780470431771
- ^ Haynes, RJ, R. Naidu (1998). “Influence des applications de chaux, d’engrais et de fumier sur la teneur en matière organique du sol et les conditions physiques du sol: une revue”. Cycle des nutriments dans les agroécosystèmes . 51 (2): 123–137. doi : 10.1023/A:1009738307837 . S2CID 20113235 – via Springer Link.
- ^ “À propos de la page d’accueil des engrais” . engrais.org . Association internationale des engrais . Récupéré le 19 décembre 2017 .
- ^ Mikkelsen, RL (2007). “Biuret dans les engrais uréiques” (PDF) . Meilleures récoltes . 91 (3) : 6–7. Archivé de l’original (PDF) le 22 décembre 2015 . Récupéré le 2 mai 2015 .
- ^ Dittmar, Heinrich; Drach, Manfred ; Vosskamp, Ralf; Trenkel, Martin E.; Gutser, Reinhold ; Steffens, Gunter (2009). “Engrais, 2. Types”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.n10_n01 .
- ^ Gregorich, Edward G.; Turchenek, LW; Carter, M. ; Angers, Denis A., éd. (2001). Dictionnaire des sciences du sol et de l’environnement . CRC Appuyez sur . p. 132. ISBN 978-0-8493-3115-2. RCAC 2001025292 . Récupéré le 9 décembre 2011 .
- ^ Yang, Ming; croc, yunting ; Soleil, Di ; Shi, Yuan Liang (2016). “Efficacité de deux inhibiteurs de nitrification (dicyandiamide et 3,4-diméthypyrazole phosphate) sur les transformations de l’azote du sol et la productivité des plantes : une méta-analyse” . Rapports scientifiques . 6 (1): 22075. Bibcode : 2016NatSR…622075Y . doi : 10.1038/srep22075 . ISSN 2045-2322 . PMC 4763264 . PMID 26902689 .
- ^ “Fertilisation azotée: informations générales” . Hubcap.clemson.edu. Archivé de l’original le 29 juin 2012 . Récupéré le 17 juin 2012 .
- ^ Garrett, Howard (2014). Entretien biologique des pelouses : faire pousser de l’herbe de façon naturelle . Presse de l’Université du Texas. p. 55–56. ISBN 978-0-292-72849-3.
- ^ “Comprendre l’indice de sel des engrais” (PDF) . Archivé de l’original (PDF) le 28 mai 2013 . Récupéré le 22 juillet 2012 .
- ^ Alimentation et agriculture mondiales – Annuaire statistique 2020 . Rome : FAO. 2020. doi : 10.4060/cb1329en . ISBN 978-92-5-133394-5. S2CID 242794287 .
- ^ Sourire, Vaclav (2015). Faire le monde moderne : matériaux et dématérialisation . Royaume-Uni : John Wiley & Sons. ISBN 978-1-119-94253-5.
- ^ Sourire, Vaclav (2012). Récolter la biosphère : ce que nous avons pris de la nature . Massachusetts Institute of Technology. ISBN 978-0-262-01856-2.
- ^ un bcde Kesler et Simon , Stephen et Simon (2015). Ressources minérales, économie et environnement . Cambridge. ISBN 978-1-107-07491-0.
- ^ “Statistiques de l’industrie – Engrais Canada” . Engrais Canada . Récupéré le 28 mars 2018 .
- ^ Stewart, WM; Dibb, DW; Johnston, AE; Smyth, TJ (2005). “La contribution des éléments nutritifs des engrais commerciaux à la production alimentaire”. Revue d’Agronomie . 97 : 1–6. doi : 10.2134/agronj2005.0001 .
- ^ Ceresana, Étude de marché sur les engrais – Monde , mai 2013,
- ^ “Engrais d’étude de marché – Europe” . Ceresana.com.
- ^ “Consommation d’engrais (Kilogrammes par hectare de terre arable) | Données” .
- ^ “Copie archivée” . Archivé de l’original le 6 octobre 2014 . Récupéré le 19 octobre 2011 . {{cite web}}: Maint CS1 : copie archivée comme titre ( lien )
- ^ Terre arable
- ^ Tayibi, Hanan; Choura, Mohamed; López, Félix A.; Alguacil, Francisco J.; Lopez-Delgado, Aurora (2009). “Impact Environnemental et Gestion du Phosphogypse”. Journal de gestion de l’environnement . 90 (8): 2377–2386. doi : 10.1016/j.jenvman.2009.03.007 . manche : 10261/45241 . PMID 19406560 .
- ^ “L’impact environnemental des engrais azotés et phosphorés dans les zones à fortes précipitations” . agric.wa.gov.au . Récupéré le 9 avril 2018 .
- ^ un b Wilfried Werner “les Engrais, 6. les Aspects Environnementaux” l’Encyclopédie d’Ullmann de Chimie Industrielle, 2002, Wiley-VCH, Weinheim. doi : 10.1002/14356007.n10_n05
- ^ “Copie archivée” . Archivé de l’original le 5 août 2014 . Récupéré le 5 août 2014 . {{cite web}}: Maint CS1 : copie archivée comme titre ( lien )
- ^ Schmidt, JR; Shaskus, M; Estenik, JF; Oesch, C; Khidekel, R; En ligneBoyer, GL (2013). “Variations de la teneur en microcystines de différentes espèces de poissons prélevées dans un lac eutrophe” . Toxines (Bâle) . 5 (5): 992-1009. doi : 10.3390/toxins5050992 . PMC 3709275 . PMID 23676698 .
- ^ “Croissance rapide trouvée dans les ‘zones mortes’ de l’océan affamé d’oxygène” , NY Times, 14 août 2008
- ^ John Heilprin, Presse associée. “Discovery Channel :: News – Animals :: UN: Ocean ‘Dead Zones’ Growing” . Dsc.discovery.com. Archivé de l’original le 18 juin 2010 . Récupéré le 25 août 2010 .
- ^ Van Grinsven, HJM; Ten Berge, HFM; Dalgaard, T.; Fraters, B.; Durand, P.; Hart, A.; … & Willems, WJ (2012). “Gestion, régulation et impacts environnementaux de la fertilisation azotée dans le nord-ouest de l’Europe dans le cadre de la Directive Nitrates ; une étude de référence” . Biogéosciences . 9 (12): 5143–5160. Bibcode : 2012BGeo….9.5143V . doi : 10.5194/bg-9-5143-2012 . {{cite journal}}: Maint CS1 : noms multiples : liste des auteurs ( lien )
- ^ “Un guide de l’agriculteur sur les problèmes d’agriculture et de qualité de l’eau: 3. Exigences environnementales et programmes d’incitation pour la gestion des éléments nutritifs” . cals.ncsu.edu . Archivé de l’original le 23 septembre 2015 . Récupéré le 3 juillet 2014 .
- ^ Groupe de travail sur les innovations nutritionnelles de l’État-EPA (2009). “Un appel urgent à l’action – Rapport du groupe de travail State-EPA Nutrient Innovations” (PDF) . epa.gov . Récupéré le 3 juillet 2014 .
- ^ Callisto, Marcos; Molozzi, Joseline; Barbosa, José Lucena Etham (2014). Eutrophisation des lacs . Eutrophisation : causes, conséquences et contrôle . p. 55–71. doi : 10.1007/978-94-007-7814-6_5 . ISBN 978-94-007-7813-9.
- ^ CJ Rosen; BP Horgan (9 janvier 2009). « Prévenir les problèmes de pollution causés par les engrais pour pelouses et jardins » . Extension.umn.edu. Archivé de l’original le 10 mars 2014 . Récupéré le 25 août 2010 .
- ^ Bijay-Singh; Yavinder-Singh ; Sekhon, GS (1995). “Efficacité d’utilisation des engrais-N et pollution par les nitrates des eaux souterraines dans les pays en développement”. Journal d’hydrologie des contaminants . 20 (3–4) : 167–184. Bibcode : 1995JCHyd..20..167S . doi : 10.1016/0169-7722(95)00067-4 .
- ^ “Conseil Interstate NOFA: L’agriculteur naturel. Gestion écologiquement saine de l’azote. Mark Schonbeck” . Nofa.org. 25 février 2004. Archivé de l’original le 24 mars 2004 . Récupéré le 25 août 2010 .
- ^ Jackson, Louise E.; Burger, Martin ; En ligneCavagnaro, Timothy R. (2008). “Racines, transformations de l’azote et services écosystémiques”. Revue annuelle de biologie végétale . 59 : 341–363. doi : 10.1146/annurev.arplant.59.032607.092932 . PMID 18444903 .
- ^ Knobeloch, L; Salna, B; Hogan, A; Postle, J; Anderson, H (2000). “Bébés bleus et eau de puits contaminée par les nitrates” . Environ. Perspective Santé . 108 (7): 675–8. doi : 10.1289/ehp.00108675 . PMC 1638204 . PMID 10903623 .
- ^ Schindler, DW; Hecky, RE (2009). “Eutrophisation: Plus de données sur l’azote nécessaires”. Sciences . 324 (5928): 721–722. Bibcode : 2009Sci…324..721S . doi : 10.1126/science.324_721b . PMID 19423798 .
- ^ Penn, CJ; Bryant, RB (2008). “Solubilité du phosphore en réponse à l’acidification des sols amendés au fumier laitier”. Soil Science Society of America Journal . 72 (1): 238. Bibcode : 2008SSASJ..72..238P . doi : 10.2136/sssaj2007.0071N .
- ^ McLaughlin, MJ; Barre franche, KG ; Naidu, R.; Stevens, DP (1996). « Bilan : le comportement et l’impact environnemental des contaminants dans les engrais ». Recherche de sol . 34 : 1–54. doi : 10.1071/sr9960001 .
- ^ Lugon-Moulin, N.; Ryan, L.; Donini, P.; En ligneRossi, L. (2006). “Teneur en cadmium des engrais phosphatés utilisés pour la production de tabac” (PDF) . Agro. Soutenir. Dév . 26 (3): 151–155. doi : 10.1051/agro:2006010 . Récupéré le 27 juin 2014 .
- ^ Zapata, F.; Roy, inf. (2004). “Utilisation des roches phosphatées pour une agriculture durable : éléments nutritifs secondaires, micronutriments, effet de chaulage et éléments dangereux associés à l’utilisation des roches phosphatées” . fao.org . FAO . Récupéré le 27 juin 2014 .
- ^ Syers JK, Mackay AD, Brown MW, Currie CD (1986). “Caractéristiques chimiques et physiques des matériaux de Roche phosphatée de réactivité variable”. J Sci Food Agric . 37 (11): 1057–1064. doi : 10.1002/jsfa.2740371102 .
- ^ Trueman NA (1965). “Les roches phosphatées, volcaniques et carbonatées de l’île Christmas (océan Indien)”. J Geol Soc Aust . 12 (2): 261–286. Bibcode : 1965AuJES..12..261T . doi : 10.1080/00167616508728596 .
- ^ Taylor MD (1997). “L’accumulation de cadmium dérivé d’engrais dans les sols néo-zélandais”. Science de l’environnement total . 208 (1–2): 123–126. Bibcode : 1997ScTEn.208..123T . doi : 10.1016/S0048-9697(97)00273-8 . PMID 9496656 .
- ^ un bcChaney , RL (2012). Problèmes de sécurité alimentaire pour les engrais minéraux et organiques . Les progrès de l’agronomie . Vol. 117. p. 51–99. doi : 10.1016/b978-0-12-394278-4.00002-7 . ISBN 9780123942784.
- ^ Oosterhuis, FH; Brouwer, FM ; Wijnants, HJ (2000). “Une éventuelle redevance à l’échelle de l’UE sur le cadmium dans les engrais phosphatés : implications économiques et environnementales” (PDF) . dare.ubvu.vu.nl . Récupéré le 27 juin 2014 .
- ^ Engrais Europe (2014). “Mettre toutes cartes sur table” (PDF) . fertilisantseurope.com . Archivé de l’original (PDF) le 8 août 2014 . Récupéré le 27 juin 2014 .
- ^ Wates, J. (2014). “Révision du règlement de l’UE sur les engrais et teneur en cadmium des engrais” . iatp.org . Récupéré le 27 juin 2014 .
- ^ un b Loganathan, P.; Hedley, MJ; Grâce, ND (2008). Sols de pâturage contaminés par du cadmium et du fluor dérivés d’engrais : effets sur le bétail . Examens de la contamination environnementale et de la toxicologie . Vol. 192. p. 29–66. doi : 10.1007/978-0-387-71724-1_2 . ISBN 978-0-387-71723-4. PMID 18020303 .
- ^ un b Cronin, SJ; Manoharan, V.; Hedley, MJ; En ligneLoganathan, P. (2000). “Fluorure: Un examen de son sort, de sa biodisponibilité et des risques de fluorose dans les systèmes de pâturages en Nouvelle-Zélande” . Journal néo-zélandais de la recherche agricole . 43 (3): 295–3214. doi : 10.1080/00288233.2000.9513430 .
- ^ Wilke, BM (1987). “Modifications induites par le fluorure dans les propriétés chimiques et l’activité microbienne des sols mull, moder et mor”. Biologie et Fertilité des Sols . 5 : 49–55. doi : 10.1007/BF00264346 . S2CID 1225884 .
- ^ Mortvedt, JJ; Beaton, JD. “Contaminants de métaux lourds et de radionucléides dans les engrais phosphatés” . Archivé de l’original le 26 juillet 2014 . Récupéré le 16 juillet 2014 .
- ^ “TENORM : Engrais et déchets de production d’engrais” . EPA des États-Unis. 2016 . Récupéré le 30 août 2017 .
- ^ Khater, AEM (2008). “L’uranium et les métaux lourds dans les engrais phosphatés” (PDF) . radioecologie.info . Archivé de l’original (PDF) le 24 juillet 2014 . Récupéré le 17 juillet 2014 .
- ^ un bc NCRP (1987). Exposition aux rayonnements de la population américaine provenant de produits de consommation et de sources diverses . Conseil national de la radioprotection et de la mesure. p. 29–32 . Récupéré le 17 juillet 2014 . [ lien mort permanent ]
- ^ Hussein EM (1994). “Radioactivité du minerai de phosphate, du superphosphate et du phosphogypse dans le phosphate d’Abu-zaabal”. Physique de la Santé . 67 (3): 280–282. doi : 10.1097/00004032-199409000-00010 . PMID 8056596 .
- ^ Barisic D, Lulic S, Miletic P (1992). « Le radium et l’uranium dans les engrais phosphatés et leur impact sur la radioactivité des eaux ». Recherche sur l’eau . 26 (5): 607–611. doi : 10.1016/0043-1354(92)90234-U .
- ^ Hanlon, EA (2012). “Radionucléides naturellement présents dans les produits agricoles” . edis.ifas.ufl.edu . Université de Floride . Récupéré le 17 juillet 2014 .
- ^ Sharpley, AN; Menzel, RG (1987). L’impact du phosphore du sol et des engrais sur l’environnement . Les progrès de l’agronomie . Vol. 41. pp. 297–324. doi : 10.1016/s0065-2113(08)60807-x . ISBN 9780120007417.
- ^ un b Wilson, Duff (3 juillet 1997). “Affaires | Peur dans les champs – Comment les déchets dangereux deviennent des engrais – L’épandage de métaux lourds sur les terres agricoles est parfaitement légal, mais peu de recherches ont été effectuées pour savoir si c’est sûr | Seattle Times Newspaper” . Communauté.seattletimes.nwsource.com . Récupéré le 25 août 2010 .
- ^ “Terres désolées : la menace des engrais toxiques” . Pirg.org. 3 juillet 1997. Archivé de l’original le 26 novembre 2010 . Récupéré le 25 août 2010 .
- ^ mindfully.org. “Terres incultes: la menace des engrais toxiques libérés par les déchets toxiques du PIRG trouvés dans les engrais Cat Lazaroff / ENS 7may01” . Mindfully.org. Archivé de l’original le 11 janvier 2002 . Récupéré le 25 août 2010 .
- ^ Zapata, F; Roy, inf. (2004). Utilisation des roches phosphatées pour une agriculture durable (PDF) . Rome : FAO. p. 82 . Récupéré le 16 juillet 2014 . [ lien mort permanent ]
- ^ un bcd Davis , DR ; Epp, MD; Riordan, HD (2004). “Changements dans les données de composition des aliments de l’USDA pour 43 cultures maraîchères, 1950 à 1999”. Journal de l’American College of Nutrition . 23 (6): 669–682. doi : 10.1080/07315724.2004.10719409 . PMID 15637215 . S2CID 13595345 .
- ^ un b Thomas, D. (2007). “L’épuisement des minéraux des aliments disponibles pour nous en tant que nation (1940–2002) – Un examen de la 6e édition de McCance et Widdowson”. Alimentation et santé . 19 (1–2): 21–55. doi : 10.1177/026010600701900205 . PMID 18309763 . S2CID 372456 .
- ^ Jarrell, WM; Beverly, RB (1981). L’effet de dilution dans les études sur la nutrition des plantes . Les progrès de l’agronomie . Vol. 34. pp. 197–224. doi : 10.1016/s0065-2113(08)60887-1 . ISBN 9780120007349.
- ^ Fan, MS; Zhao, FJ; Fairweather-Tait, SJ; Poulton, PR ; Dunham, SJ; McGrath, SP (2008). “Preuve de la diminution de la densité minérale dans le grain de blé au cours des 160 dernières années” . Journal des oligo-éléments en médecine et en biologie . 22 (4): 315–324. doi : 10.1016/j.jtemb.2008.07.002 . PMID 19013359 .
- ^ Zhao, FJ; Su, YH ; Dunham, SJ; Rakszegi, M.; Bedo, Z.; McGrath, SP; Shewry, PR (2009). “Variation des concentrations en micronutriments minéraux dans le grain de lignées de blé d’origine diverse”. Journal de la science des céréales . 49 (2): 290-295. doi : 10.1016/j.jcs.2008.11.007 .
- ^ Saltzman, A.; Birol, E.; Bouis, HE; Garçon, E. ; De Moura, FF ; Islam, Y. ; Pfeiffer, WH (2013). « Biofortification : progrès vers un avenir plus nourrissant ». Sécurité alimentaire mondiale . 2 : 9–17. doi : 10.1016/j.gfs.2012.12.003 .
- ^ un bc Moore , Geoff (2001). Soilguide – Un manuel pour comprendre et gérer les sols agricoles . Perth, Australie-Occidentale : Agriculture Australie-Occidentale. p. 161–207. ISBN 978-0-7307-0057-9.
- ^ “Le zinc dans les sols et la nutrition des cultures” . Scribd.com. 25 août 2010 . Récupéré le 17 juin 2012 .
- ^ Carroll et Salt, Steven B. et Steven D. (2004). L’écologie pour les jardiniers . Cambridge : Presse de bois. ISBN 978-0-88192-611-8.
- ^ Alexandre Abram; D. Lynn Forster (2005). “Une introduction sur l’ammoniac, les engrais azotés et les marchés du gaz naturel”. Département d’économie agricole, environnementale et du développement, Ohio State University : 38. {{cite journal}}:Citer le journal nécessite |journal=( aide )
- ^ IFA – Statistiques – Indicateurs d’engrais – Détails – Réserves de matières premières, (2002–10) Archivé le 24 avril 2008 à la Wayback Machine
- ^ Appl, Max (2000). “Ammoniac, 2. Processus de production”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim, Allemagne : Wiley-VCH. p. 139–225. doi : 10.1002/14356007.o02_o11 . ISBN 978-3-527-30673-2.
- ^ Sawyer JE (2001). “Les prix du gaz naturel affectent les coûts des engrais azotés” . IC-486 . 1 : 8.
- ^ “Tableau 8—Indices des prix des engrais, 1960–2007” . Archivé de l’original le 6 mars 2010.
- ^ “L’ammoniac vert et l’électrification du procédé Haber-Bosch réduisent les émissions de carbone” . guidehouseinsights.com . Récupéré le 6 mars 2022 .
- ^ “Comment les engrais aggravent le changement climatique” . BloombergQuint . Récupéré le 25 mars 2021 .
- ^ Tian, Hanqin; Xu, Ronting ; Canadell, Josep G.; Thompson, Rona L.; Winwarter, Wilfried ; Suntaralingam, Parvadha ; Davidson, Eric A.; Ciais, Philippe; Jackson, Robert B.; Janssens-Maenhout, Saluer; Prather, Michael J. (octobre 2020). “Une quantification complète des sources et des puits mondiaux d’oxyde nitreux” . Nature . 586 (7828): 248–256. Bibcode : 2020Natur.586..248T . doi : 10.1038/s41586-020-2780-0 . ISSN 1476-4687 . PMID 33028999 . S2CID 222217027 . Archivé de l’original le 13 octobre 2020. URL alternative
- ^ “L’utilisation d’engrais azotés pourrait” menacer les objectifs climatiques mondiaux ” ” . Carbon Brief . 7 octobre 2020 . Récupéré le 25 mars 2021 .
- ^ FAO (2012). Tendances mondiales actuelles des engrais et perspectives jusqu’en 2016 (PDF) . Rome : Organisation des Nations Unies pour l’alimentation et l’agriculture. p. 13. Archivé de l’original (PDF) le 18 mai 2017 . Récupéré le 3 juillet 2014 .
- ^ Gruber, N; Galloway, JN (2008). “Une perspective du système terrestre du cycle global de l’azote” . Nature . 451 (7176): 293–296. Bibcode : 2008Natur.451..293G . doi : 10.1038/nature06592 . PMID 18202647 .
- ^ “Altération humaine du cycle de l’azote, menaces, avantages et opportunités” Archivé le 14 janvier 2009 à la Wayback Machine UNESCO – SCOPE Policy briefs, avril 2007
- ^ Roy, RN; Misra, RV; En ligneMontanez, A. (2002). “Diminution de la dépendance à l’azote minéral – encore plus de nourriture” (PDF) . AMBIO: Un Journal de l’Environnement Humain . 31 (2): 177–183. doi : 10.1579/0044-7447-31.2.177 . PMID 12078007 . S2CID 905322 . Archivé de l’original (PDF) le 24 septembre 2015 . Récupéré le 3 juillet 2014 .
- ^ Bodelier, Paul, LE; Peter Roslev3, Thilo Henckel1 & Peter Frenzel1 (novembre 1999). “Stimulation par des engrais à base d’ammonium de l’oxydation du méthane dans le sol autour des racines de riz”. Nature . 403 (6768): 421–424. Bibcode : 2000Natur.403..421B . doi : 10.1038/35000193 . PMID 10667792 . S2CID 4351801 .
- ^ Banger, K.; Tian, H.; Lu, C. (2012). “Les engrais azotés stimulent-ils ou inhibent-ils les émissions de méthane des rizières ?”. Biologie du changement global . 18 (10): 3259–3267. Bibcode : 2012GCBio..18.3259B . doi : 10.1111/j.1365-2486.2012.02762.x . PMID 28741830 .
- ^ Union européenne. “Directive Nitrates” .
- ^ Defra. “L’agriculture sensible au bassin versant” . Archivé de l’original le 30 juin 2011.
- ^ “Le ruissellement pollué : la pollution de source non ponctuelle” . EPA . Récupéré le 23 juillet 2014 .
- ^ “Base de données sur les produits d’engrais du département de l’agriculture de l’État de Washington” . Agr.wa.gov. 23 mai 2012 . Récupéré le 17 juin 2012 .
- ^ http://www.regulatory-info-sc.com/ Liens Washington et Oregon
- ^ Ju, Xiaotang; B. Gu, Y. Wu, JNGalloway. (2016). “Réduire l’utilisation d’engrais en Chine en augmentant la taille des exploitations”. Changement environnemental global . 41 : 26–32. doi : 10.1016/j.gloenvcha.2016.08.005 . {{cite journal}}: Maint CS1 : noms multiples : liste des auteurs ( lien )
- ^ Gomiero, T.; D. Pimental & MG Paoletti (2011). « Impact environnemental des différentes pratiques de gestion agricole : agriculture conventionnelle ou biologique ». Revues critiques en sciences végétales . 30 (1–2) : 95–124. doi : 10.1080/07352689.2011.554355 . S2CID 83736589 – via Taylor & Francis Online.
Liens externes
| Wikimedia Commons a des médias liés aux engrais . |
| Wikisource contient le texte de l’ article de 1920 de l’ Encyclopedia Americana Fertilizers . |
- L’azote pour nourrir notre nourriture, son origine terrestre, processus Haber
- Association internationale de l’industrie des engrais (IFA)
- Guide agricole, Guide complet des engrais et de la fertilisation
- Valeurs d’azote-phosphore-potassium des engrais organiques Archivé le 26 février 2021 sur la Wayback Machine
