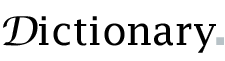Eau
L’eau (formule chimique H 2 O ) est une substance chimique inorganique , transparente, insipide, inodore et presque incolore , qui est le principal constituant de l’ hydrosphère terrestre et des fluides de tous les organismes vivants connus (dans laquelle elle agit comme un solvant [1] ). Il est vital pour toutes les formes de vie connues , même s’il ne fournit ni énergie alimentaire ni micronutriments organiques . Sa formule chimique , H 2 O, indique que chacune de ses molécules contient unoxygène et deux atomes d’hydrogène , reliés par des liaisons covalentes . Les atomes d’hydrogène sont attachés à l’atome d’oxygène sous un angle de 104,45°. [2] “Eau” est le nom de l’état liquide de H 2 O dans des Conditions standard de température et de pression .
 Un globule d’ eau liquide , et la dépression concave et le rebond dans l’eau causés par quelque chose tombant à travers la surface de l’eau
Un globule d’ eau liquide , et la dépression concave et le rebond dans l’eau causés par quelque chose tombant à travers la surface de l’eau  Un bloc d’ eau solide ( glace )
Un bloc d’ eau solide ( glace )  Les nuages dans l’atmosphère terrestre se condensent à partir de la vapeur d’eau gazeuse .
Les nuages dans l’atmosphère terrestre se condensent à partir de la vapeur d’eau gazeuse .
Il existe un certain nombre d’états naturels de l’eau. Il forme des précipitations sous forme de pluie et des aérosols sous forme de brouillard. Les nuages sont constitués de gouttelettes d’eau en suspension et de glace , son état solide. Lorsqu’elle est finement divisée, la glace cristalline peut précipiter sous forme de neige . L’état gazeux de l’eau est la vapeur ou la vapeur d’eau .
L’eau couvre environ 70,9% de la surface de la Terre, principalement dans les mers et les océans. [3] De petites portions d’eau se présentent sous forme d’ eaux souterraines (1,7 %), dans les Glaciers et les Calottes glaciaires de l’Antarctique et du Groenland (1,7 %), et dans l’air sous forme de vapeur , de nuages (constitués de glace et d’eau liquide en suspension dans l’air) , et précipitations (0,001%). [4] [5] L’eau se déplace continuellement à travers le cycle de l’eau d’ évaporation , de transpiration ( évapotranspiration ), de condensation , de précipitation et deruissellement , atteignant généralement la mer.
L’eau joue un rôle important dans l’ économie mondiale . Environ 70 % de l’eau douce utilisée par l’homme est destinée à l’agriculture. [6]La pêche dans les plans d’eau salée et douce est une source majeure de nourriture pour de nombreuses régions du monde. Une grande partie du commerce à longue distance de produits de base (tels que le pétrole, le gaz naturel et les produits manufacturés) est transportée par bateaux à travers les mers, les rivières, les lacs et les canaux. De grandes quantités d’eau, de glace et de vapeur sont utilisées pour le refroidissement et le chauffage, dans l’industrie et les maisons. L’eau est un excellent solvant pour une grande variété de substances tant minérales qu’organiques ; en tant que tel, il est largement utilisé dans les processus industriels, ainsi que dans la cuisine et le lavage. L’eau, la glace et la neige sont également au cœur de nombreux sports et autres formes de divertissement, comme la natation, la navigation de plaisance, les courses de bateaux, le surf, la pêche sportive, la plongée, le patin à glace et le ski.
Étymologie
Le mot eau vient du vieil anglais wæter , du proto-germanique * watar (source également du vieux saxon watar , du vieux frison wetir , de l’ eau hollandaise , du vieux haut allemand wazzar , de l’allemand Wasser , vatn , du gothique ( wato ), du proto-indo -Européen * wod-or , forme suffixée de la racine * wed- (“eau” ; “humide”). [7] Également apparenté , par la racine indo-européenne, avec le grec ύδωρ ( ýdor ), le russe вода́ ( vodá ), l’irlandais uisce et l’albanais ujë .
Histoire Propriétés
 Une molécule d’eau est composée de deux atomes d’hydrogène et d’un atome d’oxygène
Une molécule d’eau est composée de deux atomes d’hydrogène et d’un atome d’oxygène
Eau ( H2O ) est un composé inorganique polaire qui est à température ambiante un liquide insipide et inodore , presque incolore avec une touche de bleu . Ce chalcogénure d’hydrogène le plus simple est de loin le composé chimique le plus étudié et est décrit comme le “solvant universel” pour sa capacité à dissoudre de nombreuses substances. [8] [9] Cela lui permet d’être le « solvant de la vie » : [10] en effet, l’eau telle qu’on la trouve dans la nature comprend presque toujours diverses substances dissoutes, et des étapes spéciales sont nécessaires pour obtenir de l’eau chimiquement pure. L’eau est la seule substance commune à exister sous forme solide , liquide et gazeuse dans des conditions terrestres normales. [11]
États

 Les trois états communs de la matière
Les trois états communs de la matière
Avec l’oxidane , l’eau est l’un des deux noms officiels du composé chimique H2O ; [12] c’est aussi la phase liquide de H2O. _ [13] Les deux autres états courants de la matière de l’eau sont la phase solide , la glace , et la phase gazeuse, la vapeur d’eau ou la vapeur . L’apport ou le retrait de chaleur peut provoquer des transitions de phase : congélation (eau vers glace), fusion (glace vers eau), vaporisation (eau vers vapeur), condensation (vapeur vers eau), sublimation (glace vers vapeur) et dépôt (vapeur vers la glace). [14]
Densité
L’eau diffère de la plupart des liquides en ce sens qu’elle devient moins dense lorsqu’elle gèle. [16] À une pression de 1 atm, il atteint sa densité maximale de 1 000 kg/m 3 (62,43 lb/cu ft) à 3,98 °C (39,16 °F). [17] La densité de la glace est de 917 kg/m 3 (57,25 lb/pi3), une expansion de 9 %. [18] [19] Cette expansion peut exercer une pression énorme, faire éclater des tuyaux et fissurer des roches (voir Altération par le gel ). [20]
Dans un lac ou un océan, l’eau à 4 °C (39,2 °F) coule au fond et de la glace se forme à la surface, flottant sur l’eau liquide. Cette glace isole l’eau en dessous, l’empêchant de geler solidement. Sans cette protection, la plupart des organismes aquatiques périraient pendant l’hiver. [21]
Magnétisme
L’eau est un matériau diamagnétique . [22] Bien que l’interaction soit faible, avec des aimants supraconducteurs, elle peut atteindre une interaction notable. [22]
Transitions de phases
À une pression d’une atmosphère (atm), la glace fond ou l’eau gèle à 0 °C (32 °F) et l’eau bout ou la vapeur se condense à 100 °C (212 °F). Cependant, même en dessous du point d’ébullition, l’eau peut se transformer en vapeur à sa surface par évaporation (la vaporisation dans tout le liquide est appelée ébullition ). La sublimation et le dépôt se produisent également sur les surfaces. [14] Par exemple, le givre se dépose sur les surfaces froides tandis que les flocons de neige se forment par dépôt sur une particule d’aérosol ou un noyau de glace. [23] Dans le processus de lyophilisation , un aliment est congelé puis stocké à basse pression afin que la glace à sa surface se sublime. [24]
Les points de fusion et d’ébullition dépendent de la pression. Une bonne approximation du taux de variation de la température de fusion avec la pression est donnée par la relation de Clausius–Clapeyron :
d T d P = T ( v L − v S ) L f , {displaystyle {frac {dT}{dP}}={frac {Tleft(v_{text{L}}-v_{text{S}}right)}{L_{text{f }}}},} 
où v L {displaystyle v_{text{L}}} 
et v S {displaystyle v_{text{S}}}

sont les volumes molaires des phases liquide et solide, et L f {displaystyle L_{text{f}}}

est la chaleur molaire latente de fusion. Dans la plupart des substances, le volume augmente lors de la fusion, de sorte que la température de fusion augmente avec la pression. Cependant, comme la glace est moins dense que l’eau, la température de fusion diminue. [15] Dans les Glaciers, la fonte sous pression peut se produire sous des volumes de glace suffisamment épais, entraînant des lacs sous-glaciaires . [25] [26]
La relation Clausius-Clapeyron s’applique également au point d’ébullition, mais avec la transition liquide/gaz, la phase vapeur a une densité beaucoup plus faible que la phase liquide, de sorte que le point d’ébullition augmente avec la pression. [27] L’eau peut rester à l’état liquide à des températures élevées dans l’océan profond ou sous terre. Par exemple, les températures dépassent 205 °C (401 °F) à Old Faithful , un geyser du parc national de Yellowstone . [28] Dans les cheminées hydrothermales , la température peut dépasser 400 °C (752 °F). [29]
Au niveau de la mer , le point d’ébullition de l’eau est de 100 °C (212 °F). Comme la pression atmosphérique diminue avec l’altitude, le point d’ébullition diminue de 1 °C tous les 274 mètres. La cuisson à haute altitude prend plus de temps que la cuisson au niveau de la mer. Par exemple, à 1 524 mètres (5 000 pieds), le temps de cuisson doit être augmenté d’un quart pour obtenir le résultat souhaité. [30] (Inversement, un autocuiseur peut être utilisé pour réduire les temps de cuisson en augmentant la température d’ébullition. [31] ) Dans le vide, l’eau bouillira à température ambiante. [32]
Points triples et critiques 
 Diagramme de phase de l’eau (simplifié)
Diagramme de phase de l’eau (simplifié)
Sur un diagramme de phase pression/température (voir figure), on trouve des courbes séparant le solide de la vapeur, la vapeur du liquide et le liquide du solide. Ceux-ci se rejoignent en un seul point appelé le point triple , où les trois phases peuvent coexister. Le point triple est à une température de 273,16 K (0,01 ° C) et une pression de 611,657 pascals (0,00604 atm); [33] c’est la pression la plus basse à laquelle l’eau liquide peut exister. Jusqu’en 2019 , le point triple était utilisé pour définir l’échelle de température Kelvin. [34] [35]
La courbe de phase eau / vapeur se termine à 647,096 K (373,946 ° C; 705,103 ° F) et 22,064 mégapascals (3 200,1 psi; 217,75 atm). [36] C’est ce qu’on appelle le point critique . À des températures et des pressions plus élevées, les phases liquide et vapeur forment une phase continue appelée fluide supercritique . Elle peut être graduellement comprimée ou détendue entre des densités gazeuses et liquides, ses propriétés (qui sont assez différentes de celles de l’eau ambiante) sont sensibles à la densité. Par exemple, pour des pressions et des températures appropriées, il peut se mélanger librement avec des composés non polaires , y compris la plupart des composés organiques . Cela le rend utile dans une variété d’applications, y compris à haute températurel’ électrochimie et comme solvant ou catalyseur écologiquement bénin dans les réactions chimiques impliquant des composés organiques. Dans le manteau terrestre, il agit comme un solvant lors de la formation, de la dissolution et du dépôt des minéraux. [37] [38]
Phases de glace et d’eau
La forme normale de glace à la surface de la Terre est Ice Ih , une phase qui forme des cristaux à symétrie hexagonale . Une autre à symétrie cristalline cubique , Ice Ic , peut se produire dans la haute atmosphère. [39] À mesure que la pression augmente, la glace forme d’autres structures cristallines . En 2019, 17 ont été confirmés expérimentalement et plusieurs autres sont prédits théoriquement. [40]La 18e forme de glace, la glace XVIII, une phase de glace superionique cubique à faces centrées, a été découverte lorsqu’une gouttelette d’eau a été soumise à une onde de choc qui a élevé la pression de l’eau à des millions d’atmosphères et sa température à des milliers de degrés. résultant en une structure d’atomes d’oxygène rigides dans laquelle les atomes d’hydrogène circulaient librement. [41] [42] Lorsqu’elle est prise en sandwich entre des couches de graphène , la glace forme un réseau carré. [43]
Les détails de la nature chimique de l’eau liquide ne sont pas bien compris; certaines théories suggèrent que son comportement inhabituel est dû à l’existence de 2 états liquides. [17] [44] [45] [46]
Goût et odeur
L’Eau pure est généralement décrite comme insipide et inodore, bien que les Humains aient des capteurs spécifiques qui peuvent sentir la présence d’eau dans leur bouche, [47] et les grenouilles sont connues pour pouvoir la sentir. [48] Cependant, l’eau provenant de sources ordinaires (y compris l’eau minérale en bouteille) contient généralement de nombreuses substances dissoutes, qui peuvent lui donner des goûts et des odeurs variables. L’homme et les autres animaux ont développé des sens qui leur permettent d’évaluer la potabilité de l’eau afin d’éviter une eau trop salée ou Putride . [49]
Couleur et apparence
L’Eau pure est visiblement bleue en raison de l’ absorption de la lumière dans la région ca. 600 nm – 800 nm. [50] La couleur peut être facilement observée dans un verre d’eau du robinet placé sur un fond blanc pur, à la lumière du jour. Les principales bandes d’absorption responsables de la couleur sont les harmoniques des vibrations d’étirement O–H . L’intensité apparente de la couleur augmente avec la profondeur de la colonne d’eau, suivant la loi de Beer . Cela s’applique également, par exemple, à une piscine lorsque la source lumineuse est la lumière du soleil réfléchie par les carreaux blancs de la piscine.
Dans la nature, la couleur peut également être modifiée du bleu au vert en raison de la présence de solides en suspension ou d’algues.
Dans l’industrie, la spectroscopie proche infrarouge est utilisée avec des solutions aqueuses car la plus grande intensité des harmoniques inférieures de l’eau signifie que des cuvettes en verre à courte longueur de trajet peuvent être utilisées. Pour observer le spectre d’absorption d’étirement fondamental de l’eau ou d’une solution aqueuse dans la région autour de 3500 cm −1 (2,85 μm) [51] , une longueur de trajet d’environ 25 μm est nécessaire. Aussi, la cuvette doit être à la fois transparente vers 3500 cm -1 et insoluble dans l’eau ; le fluorure de calcium est un matériau couramment utilisé pour les fenêtres de cuvette avec des solutions aqueuses.
Les vibrations fondamentales actives Raman peuvent être observées avec, par exemple, une cellule d’échantillon de 1 cm.
Les plantes aquatiques , les algues et d’autres organismes photosynthétiques peuvent vivre dans l’eau jusqu’à des centaines de mètres de profondeur, car la lumière du soleil peut les atteindre. Pratiquement aucune lumière solaire n’atteint les parties des océans en dessous de 1 000 mètres (3 300 pieds) de profondeur.
L’ indice de réfraction de l’eau liquide (1,333 à 20 °C (68 °F)) est bien supérieur à celui de l’air (1,0), similaire à ceux des Alcanes et de l’ éthanol , mais inférieur à ceux du glycérol (1,473), du benzène (1,501 ), sulfure de carbone (1.627) et types de verre courants (1.4 à 1.6). L’indice de réfraction de la glace (1,31) est inférieur à celui de l’eau liquide.
Molécule polaire

 Structure tétraédrique de l’eau
Structure tétraédrique de l’eau
Dans une molécule d’eau, les atomes d’hydrogène forment un angle de 104,5° avec l’atome d’oxygène. Les atomes d’hydrogène sont proches des deux sommets d’un tétraèdre centré sur l’oxygène. Aux deux autres coins se trouvent des Paires isolées d’électrons de valence qui ne participent pas à la liaison. Dans un tétraèdre parfait, les atomes formeraient un angle de 109,5°, mais la répulsion entre les Paires isolées est supérieure à la répulsion entre les atomes d’hydrogène. [52] [53] La longueur de la liaison O–H est d’environ 0,096 nm. [54]
D’autres substances ont une structure moléculaire tétraédrique, par exemple le méthane ( CH4) et le sulfure d’hydrogène ( H2S ). Cependant, l’oxygène est plus électronégatif (retient plus étroitement ses électrons) que la plupart des autres éléments, de sorte que l’atome d’oxygène conserve une charge négative tandis que les atomes d’hydrogène sont chargés positivement. Avec la structure courbée, cela donne à la molécule un Moment dipolaire électrique et elle est classée comme Molécule polaire . [55]
L’eau est un bon solvant polaire , qui dissout de nombreux sels et molécules organiques hydrophiles comme les sucres et les alcools simples comme l’ éthanol . L’eau dissout également de nombreux gaz, tels que l’oxygène et le dioxyde de carbone , ce dernier donnant le pétillement des boissons gazeuses, des vins mousseux et des bières. De plus, de nombreuses substances présentes dans les organismes vivants, telles que les protéines , l’ADN et les polysaccharides , sont dissoutes dans l’eau. Les interactions entre l’eau et les sous-unités de ces biomacromolécules façonnent le repliement des protéines , l’appariement des bases de l’ADN ., et d’autres phénomènes cruciaux pour la vie ( effet hydrophobe ).
De nombreuses substances organiques (telles que les graisses et les huiles et les Alcanes ) sont hydrophobes , c’est-à-dire insolubles dans l’eau. De nombreuses substances inorganiques sont également insolubles, notamment la plupart des oxydes métalliques , des sulfures et des silicates .
Liaison hydrogène

 Modèle de liaisons hydrogène (1) entre molécules d’eau
Modèle de liaisons hydrogène (1) entre molécules d’eau
Du fait de sa polarité, une molécule d’eau à l’état liquide ou solide peut former jusqu’à quatre liaisons hydrogène avec des molécules voisines. Les liaisons hydrogène sont environ dix fois plus fortes que la force de Van der Waals qui attire les molécules les unes vers les autres dans la plupart des liquides. C’est la raison pour laquelle les points de fusion et d’ébullition de l’eau sont beaucoup plus élevés que ceux d’ autres composés analogues comme le sulfure d’hydrogène. Ils expliquent également sa capacité thermique spécifique exceptionnellement élevée (environ 4,2 J /g/K), sa chaleur de fusion (environ 333 J/g), sa chaleur de vaporisation ( 2257 J/g ) et sa conductivité thermique .(entre 0,561 et 0,679 W/m/K). Ces propriétés rendent l’eau plus efficace pour modérer le climat de la Terre , en stockant la chaleur et en la transportant entre les océans et l’atmosphère. Les liaisons hydrogène de l’eau sont d’environ 23 kJ/mol (par rapport à une liaison OH covalente à 492 kJ/mol). De cela, on estime que 90% sont attribuables à l’électrostatique, tandis que les 10% restants sont partiellement covalents. [56]
Ces liaisons sont à l’origine de la tension superficielle élevée de l’eau [57] et des forces capillaires. L’ action capillaire fait référence à la tendance de l’eau à remonter un tube étroit contre la force de gravité . Cette propriété est invoquée par toutes les plantes vasculaires , comme les arbres. [58]
Auto-ionisation
L’eau est une faible solution d’hydroxyde d’hydronium – il y a un équilibre 2H2O ⇔ H3O+
+ OH−
, en combinaison avec la solvatation des ions hydronium résultants .
Conductivité électrique et électrolyse
L’Eau pure a une faible conductivité électrique , qui augmente avec la dissolution d’une petite quantité de matière ionique comme le sel commun .
L’eau liquide peut être divisée en éléments hydrogène et oxygène en y faisant passer un courant électrique – un processus appelé électrolyse . La décomposition nécessite plus d’apport d’énergie que la chaleur dégagée par le processus inverse (285,8 kJ/ mol ou 15,9 MJ/kg). [59]
Propriétés mécaniques
L’eau liquide peut être supposée incompressible dans la plupart des cas : sa compressibilité varie de 4,4 à5,1 × 10 −10 Pa −1 dans des conditions ordinaires. [60] Même dans les océans à 4 km de profondeur, où la pression est de 400 atm, l’eau ne subit qu’une diminution de volume de 1,8 %. [61]
La viscosité de l’eau est d’environ 10 −3 Pa· s ou 0,01 poise à 20 °C (68 °F), et la vitesse du son dans l’eau liquide varie entre 1 400 et 1 540 mètres par seconde (4 600 et 5 100 pieds/s) selon sur la température. Le son parcourt de longues distances dans l’eau avec peu d’atténuation, en particulier à basses fréquences (environ 0,03 dB /km pour 1 kHz ), une propriété exploitée par les cétacés et les Humains pour la communication et la détection de l’environnement ( sonar ). [62]
Réactivité
Les éléments métalliques qui sont plus électropositifs que l’hydrogène, en particulier les métaux alcalins et les métaux alcalino-terreux tels que le lithium , le sodium , le calcium , le potassium et le césium déplacent l’hydrogène de l’eau, formant des hydroxydes et libérant de l’hydrogène. À des températures élevées, le carbone réagit avec la vapeur pour former du monoxyde de carbone et de l’hydrogène.
Sur Terre
L’hydrologie est l’étude du mouvement, de la distribution et de la qualité de l’eau sur toute la Terre. L’étude de la distribution de l’eau est l’ hydrographie . L’étude de la distribution et du mouvement des eaux souterraines est l’ hydrogéologie , celle des Glaciers est la glaciologie , celle des eaux intérieures est la limnologie et la distribution des océans est l’ océanographie . Les processus écologiques avec l’hydrologie sont au centre de l’ écohydrologie .
La masse collective d’eau trouvée sur, sous et au-dessus de la surface d’une planète s’appelle l’ hydrosphère . Le volume d’eau approximatif de la Terre (l’approvisionnement en eau total du monde) est de 1,386 × 10 9 kilomètres cubes (3,33 × 10 8 milles cubes). [4]
L’eau liquide se trouve dans les masses d’eau , comme un océan, une mer, un lac, une rivière, un ruisseau, un canal , un étang ou une flaque d’eau . La majorité de l’eau sur Terre est de l’eau de mer . L’eau est également présente dans l’atmosphère à l’état solide, liquide et vapeur. Il existe également sous forme d’eau souterraine dans les aquifères .
L’eau est importante dans de nombreux processus géologiques. L’eau souterraine est présente dans la plupart des roches , et la pression de cette eau souterraine affecte les schémas de failles . L’eau du manteau est responsable de la fonte qui produit des volcans dans les zones de subduction . À la surface de la Terre, l’eau joue un rôle important dans les processus d’ altération chimiques et physiques. L’eau, et dans une moindre mesure mais toujours significative, la glace, sont également responsables d’une grande quantité de transport de sédiments qui se produit à la surface de la terre. Le dépôt de sédiments transportés forme de nombreux types de roches sédimentaires , qui constituent leenregistrement géologique de l’histoire de la Terre .
Cycle de l’eau

 Cycle de l’eau
Cycle de l’eau
Le cycle de l’eau (connu scientifiquement sous le nom de cycle hydrologique) fait référence à l’échange continu d’eau dans l’ hydrosphère , entre l’ atmosphère , l’eau du sol , l’ eau de surface, l’eau souterraine et les plantes.
L’eau se déplace perpétuellement à travers chacune de ces régions dans le cycle de l’eau consistant en les processus de transfert suivants :
- l’ évaporation des océans et d’autres masses d’eau dans l’air et la transpiration des plantes et des animaux terrestres dans l’air.
- précipitations , de la vapeur d’eau se condensant de l’air et tombant sur la terre ou l’océan.
- le ruissellement de la terre atteignant généralement la mer.
La plupart des vapeurs d’eau trouvées principalement dans l’océan y retournent, mais les vents transportent la vapeur d’eau sur la terre au même rythme que le ruissellement dans la mer, environ 47 Tt par an, tandis que l’évaporation et la transpiration qui se produisent dans les masses terrestres contribuent également à 72 Tt supplémentaires par an. Les précipitations, au rythme de 119 Tt par an sur la terre, ont plusieurs formes : le plus souvent la pluie, la neige et la grêle , avec une certaine contribution du brouillard et de la rosée . [63] La rosée est constituée de petites gouttes d’eau qui se condensent lorsqu’une forte densité de vapeur d’eau rencontre une surface froide. La rosée se forme généralement le matin lorsque la température est la plus basse, juste avant le lever du soleil et lorsque la température de la surface de la terre commence à augmenter. [64]L’eau condensée dans l’air peut également réfracter la lumière du soleil pour produire des arcs-en -ciel .
Les eaux de ruissellement s’accumulent souvent sur les bassins versants qui se jettent dans les rivières. Un modèle mathématique utilisé pour simuler le débit d’une rivière ou d’un cours d’eau et calculer les paramètres de qualité de l’eau est un modèle de transport hydrologique . Une partie de l’eau est détournée vers l’irrigation pour l’agriculture. Les rivières et les mers offrent des possibilités de voyage et de commerce. Par l’érosion , le ruissellement façonne l’environnement en créant des vallées fluviales et des deltasqui fournissent un sol riche et un terrain plat pour l’établissement de centres de population. Une inondation se produit lorsqu’une zone de terre, généralement basse, est recouverte d’eau qui se produit lorsqu’une rivière déborde de son lit ou qu’une onde de tempête se produit. D’autre part, la sécheresse est une période prolongée de mois ou d’années lorsqu’une région constate une insuffisance de son approvisionnement en eau. Cela se produit lorsqu’une région reçoit constamment des précipitations inférieures à la moyenne, soit en raison de sa topographie, soit en raison de son emplacement en termes de latitude .
Ressources en eau
L’eau se présente à la fois sous forme de “stocks” et de “flux”. L’eau peut être stockée sous forme de lacs, de vapeur d’eau, d’eaux souterraines ou d’aquifères, de glace et de neige. Sur le volume total d’eau douce mondiale, on estime que 69 % sont stockés dans les Glaciers et la couverture de neige permanente ; 30 pour cent se trouvent dans les eaux souterraines ; et le 1 % restant dans les lacs, les rivières, l’atmosphère et le biote. [65]La durée pendant laquelle l’eau reste stockée est très variable : certains aquifères sont constitués d’eau stockée pendant des milliers d’années, mais les volumes des lacs peuvent fluctuer sur une base saisonnière, diminuant pendant les périodes sèches et augmentant pendant les périodes humides. Une fraction substantielle de l’approvisionnement en eau pour certaines régions consiste en eau extraite de l’eau stockée dans les stocks, et lorsque les prélèvements dépassent la recharge, les stocks diminuent. Selon certaines estimations, jusqu’à 30 % de l’eau totale utilisée pour l’irrigation provient de prélèvements non durables d’eau souterraine, entraînant l’épuisement des eaux souterraines . [66]
Eau de mer et marées
L’eau de mer contient environ 3,5 % de chlorure de sodium en moyenne, ainsi que de plus petites quantités d’autres substances. Les propriétés physiques de l’eau de mer diffèrent de celles de l’eau douce à certains égards importants. Il gèle à une température plus basse (environ -1,9 ° C (28,6 ° F)) et sa densité augmente avec la diminution de la température jusqu’au point de congélation, au lieu d’atteindre la densité maximale à une température au-dessus du point de congélation. La salinité de l’eau dans les principales mers varie d’environ 0,7 % dans la mer Baltique à 4,0 % dans la mer Rouge . (La mer Morte , connue pour ses niveaux de salinité ultra-élevés entre 30 et 40%, est vraiment un lac salé .)
Les marées sont la montée et la descente cycliques du niveau local de la mer causées par les forces de marée de la Lune et du Soleil agissant sur les océans. Les marées modifient la profondeur des masses d’eau marines et estuariennes et produisent des courants oscillants appelés courants de marée. La marée changeante produite à un endroit donné est le résultat des positions changeantes de la Lune et du Soleil par rapport à la Terre couplées aux effets de la rotation de la Terre et de la bathymétrie locale . La bande de rivage qui est submergée à marée haute et exposée à marée basse, la zone intertidale , est un produit écologique important des marées océaniques.
La baie de Fundy à marée haute et marée basse
-
![]()
![]()
Marée haute
-
![]()
![]()
Marée basse
Effets sur la vie

 Aperçu de la photosynthèse (vert) et de la respiration (rouge)
Aperçu de la photosynthèse (vert) et de la respiration (rouge)
D’un point de vue biologique , l’eau possède de nombreuses propriétés distinctes qui sont essentielles à la prolifération de la vie. Il remplit ce rôle en permettant aux composés organiques de réagir de manière à permettre finalement la réplication . Toutes les formes de vie connues dépendent de l’eau. L’eau est vitale à la fois en tant que solvant dans lequel de nombreux solutés du corps se dissolvent et en tant que partie essentielle de nombreux processus métaboliques dans le corps. Le métabolisme est la somme totale de l’ anabolisme et du catabolisme. Dans l’anabolisme, l’eau est retirée des molécules (par le biais d’énergie nécessitant des réactions chimiques enzymatiques) afin de faire croître des molécules plus grosses (par exemple, des amidons, des triglycérides et des protéines pour le stockage de carburants et d’informations). Dans le catabolisme, l’eau est utilisée pour rompre les liaisons afin de générer des molécules plus petites (par exemple, le glucose, les acides gras et les acides aminés à utiliser comme carburants à usage énergétique ou à d’autres fins). Sans eau, ces processus métaboliques particuliers ne pourraient pas exister.
L’eau est fondamentale pour la photosynthèse et la respiration. Les cellules photosynthétiques utilisent l’énergie du soleil pour séparer l’hydrogène de l’eau de l’oxygène. [67] L’hydrogène est combiné avec le CO 2 (absorbé de l’air ou de l’eau) pour former du glucose et libérer de l’oxygène. [ citation nécessaire ] Toutes les cellules vivantes utilisent de tels combustibles et oxydent l’hydrogène et le carbone pour capter l’énergie du soleil et reformer l’eau et le CO 2 dans le processus (respiration cellulaire).
L’eau est également essentielle à la neutralité acido-basique et à la fonction enzymatique. Un acide, un donneur d’ion hydrogène (H + , c’est-à-dire un proton), peut être neutralisé par une base, un accepteur de proton tel qu’un ion hydroxyde (OH – ) pour former de l’eau. L’eau est considérée comme neutre, avec un pH (le log négatif de la concentration en ions hydrogène) de 7. Les acides ont des valeurs de pH inférieures à 7 tandis que les bases ont des valeurs supérieures à 7.
Formes de vie aquatique
Les eaux de surface de la Terre sont remplies de vie. Les premières formes de vie sont apparues dans l’eau; presque tous les poissons vivent exclusivement dans l’eau et il existe de nombreux types de mammifères marins, tels que les dauphins et les baleines. Certains types d’animaux, comme les amphibiens , passent une partie de leur vie dans l’eau et une partie sur terre. Des plantes telles que le varech et les algues poussent dans l’eau et sont à la base de certains écosystèmes sous-marins. Le plancton est généralement à la base de la chaîne alimentaire océanique .
Les vertébrés aquatiques doivent obtenir de l’oxygène pour survivre, et ils le font de diverses manières. Les poissons ont des branchies au lieu de poumons , bien que certaines espèces de poissons, comme le poisson- poumon , aient les deux. Les mammifères marins , tels que les dauphins, les baleines, les loutres et les phoques doivent faire surface périodiquement pour respirer de l’air. Certains amphibiens sont capables d’absorber l’oxygène à travers leur peau. Les invertébrés présentent un large éventail de modifications pour survivre dans des eaux mal oxygénées, notamment des tubes respiratoires (voir siphons d’insectes et de mollusques ) et des branchies ( Carcinus). Cependant, comme la vie des invertébrés a évolué dans un habitat aquatique, la plupart ont peu ou pas de spécialisation pour la respiration dans l’eau.
-
Une partie de la biodiversité d’un récif corallien
-
![]()
![]()
Certaines diatomées marines – un groupe clé de phytoplancton
-
![]()
![]()
Le homard squat et les crevettes Alvinocarididae du champ hydrothermal de Von Damm survivent grâce à une chimie de l’eau modifiée
Effets sur la civilisation humaine
| Cette section a besoin de citations supplémentaires pour vérification . ( mai 2018 ) Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed. (Learn how and when to remove this template message) |

 Fontaine à eau
Fontaine à eau
La civilisation s’est historiquement épanouie autour des rivières et des principales voies navigables; La Mésopotamie , le soi-disant berceau de la civilisation, était située entre les grands fleuves Tigre et Euphrate ; l’ancienne société des Égyptiens dépendait entièrement du Nil . La première civilisation de la vallée de l’Indus (vers 3300 avant notre ère à 1300 avant notre ère) s’est développée le long du fleuve Indus et de ses affluents qui sortaient de l’ Himalaya . Rome a également été fondée sur les rives du Tibre italien . Grandes métropoles comme Rotterdam , Londres , Montréal, Paris , New York , Buenos Aires , Shanghai , Tokyo , Chicago et Hong Kong doivent en partie leur succès à leur facilité d’accès par l’eau et à l’expansion commerciale qui en résulte. Les îles avec des ports d’eau sûrs, comme Singapour , ont prospéré pour la même raison. Dans des endroits comme l’Afrique du Nord et le Moyen-Orient, où l’eau est plus rare, l’accès à l’eau potable était et est un facteur majeur du développement humain.
Santé et pollution

 Un programme de sciences de l’environnement – un étudiant de l’Iowa State University prélève de l’eau
Un programme de sciences de l’environnement – un étudiant de l’Iowa State University prélève de l’eau
L’eau propre à la consommation humaine est appelée eau potable ou eau potable. L’eau qui n’est pas potable peut être rendue potable par filtration ou distillation , ou par une gamme d’ autres méthodes . Plus de 660 millions de personnes n’ont pas accès à l’eau potable. [68] [69]
L’eau qui n’est pas potable mais qui n’est pas nocive pour les Humains lorsqu’elle est utilisée pour la baignade ou la baignade est appelée par divers noms autres que l’eau potable ou potable, et est parfois appelée eau salubre ou «sûre pour la baignade». Le chlore est un irritant de la peau et des muqueuses qui est utilisé pour rendre l’eau propre à la baignade ou à la consommation. Son utilisation est très technique et est généralement contrôlée par des réglementations gouvernementales (généralement 1 partie par million (ppm) pour l’eau potable et 1 à 2 ppm de chlore n’ayant pas encore réagi avec les impuretés pour l’eau de baignade). L’eau de baignade peut être maintenue dans des conditions microbiologiques satisfaisantes à l’aide de désinfectants chimiques tels que le chlore ou l’ozone ou à l’aide de rayons ultraviolets .
La récupération de l’eau est le processus de conversion des eaux usées (le plus souvent des eaux usées , également appelées eaux usées municipales) en eau qui peut être réutilisée à d’autres fins.
L’eau douce est une ressource renouvelable, recirculée par le cycle hydrologique naturel , mais les pressions sur son accès résultent de la distribution naturellement inégale dans l’espace et le temps, des demandes économiques croissantes de l’agriculture et de l’industrie et de la croissance démographique. Actuellement, près d’un milliard de personnes dans le monde n’ont pas accès à une eau salubre et abordable. En 2000, les Nations Unies ont établi les Objectifs du Millénaire pour le développement pour l’eau afin de réduire de moitié d’ici 2015 la proportion de personnes dans le monde sans accès à l’eau potable et à l’ assainissement . Les progrès vers cet objectif ont été inégaux et, en 2015, l’ONU s’est engagée à atteindre les objectifs de développement durabled’atteindre l’accès universel à une eau et à un assainissement sûrs et abordables d’ici 2030. La mauvaise qualité de l’eau et le mauvais assainissement sont mortels ; quelque cinq millions de décès par an sont dus à des maladies liées à l’eau. L’ Organisation mondiale de la santé estime que l’eau salubre pourrait prévenir 1,4 million de décès d’enfants dus à la diarrhée chaque année. [70]
Dans les pays en développement, 90 % de toutes les eaux usées municipales ne sont toujours pas traitées dans les rivières et les ruisseaux locaux. [71] Quelque 50 pays, avec environ un tiers de la population mondiale, souffrent également d’une pénurie d’eau moyenne ou élevée et 17 d’entre eux extraient annuellement plus d’eau qu’ils n’en rechargent par leurs cycles naturels. [72] La pression affecte non seulement les masses d’eau douce de surface comme les rivières et les lacs, mais elle dégrade également les ressources en eaux souterraines.
Utilisations humaines

 Prélèvements totaux d’eau à des fins agricoles, industrielles et municipales par habitant, mesurés en mètres cubes (m3) par an en 2010 [73] Agriculture
Prélèvements totaux d’eau à des fins agricoles, industrielles et municipales par habitant, mesurés en mètres cubes (m3) par an en 2010 [73] Agriculture
L’utilisation humaine la plus importante de l’eau est pour l’agriculture, y compris l’agriculture irriguée, qui représente jusqu’à 80 à 90 pour cent de la consommation humaine totale d’eau. [74] Aux États-Unis, 42 % de l’eau douce prélevée à des fins d’utilisation est destinée à l’irrigation, mais la grande majorité de l’eau « consommée » (utilisée et non restituée à l’environnement) va à l’agriculture. [75]
L’accès à l’eau douce est souvent considéré comme acquis, en particulier dans les pays développés qui ont construit des systèmes d’eau sophistiqués pour collecter, purifier et distribuer l’eau et éliminer les eaux usées. Mais les pressions économiques, démographiques et climatiques croissantes augmentent les préoccupations concernant les problèmes d’eau, conduisant à une concurrence croissante pour les ressources en eau fixes, donnant naissance au concept de pointe d’eau . [76] Alors que les populations et les économies continuent de croître, que la consommation de viande assoiffée d’eau augmente et que de nouvelles demandes augmentent pour les biocarburants ou les nouvelles industries à forte intensité d’eau, de nouveaux défis liés à l’eau sont probables. [77]
Une évaluation de la gestion de l’eau dans l’agriculture a été menée en 2007 par l’ Institut international de gestion de l’eau au Sri Lanka pour voir si le monde disposait de suffisamment d’eau pour nourrir sa population croissante. [78] Il a évalué la disponibilité actuelle de l’eau pour l’agriculture à l’échelle mondiale et a cartographié les endroits souffrant de pénurie d’eau. Il a révélé qu’un cinquième de la population mondiale, soit plus de 1,2 milliard, vit dans des zones de pénurie physique d’eau , où il n’y a pas assez d’eau pour répondre à toutes les demandes. 1,6 milliard de personnes supplémentaires vivent dans des zones connaissant une pénurie économique d’eau, où le manque d’investissements dans l’eau ou l’insuffisance des capacités humaines empêchent les autorités de satisfaire la demande en eau. Le rapport a conclu qu’il serait possible de produire la nourriture nécessaire à l’avenir, mais que la poursuite de la production alimentaire actuelle et des tendances environnementales conduirait à des crises dans de nombreuses régions du monde. Pour éviter une crise mondiale de l’eau, les agriculteurs devront s’efforcer d’augmenter leur productivité pour répondre à la demande alimentaire croissante, tandis que les industries et les villes trouveront des moyens d’utiliser l’eau plus efficacement. [79]
La rareté de l’eau est également causée par la production de produits à forte consommation d’eau. Par exemple, le coton : 1 kg de coton – l’équivalent d’une paire de jeans – nécessite 10,9 mètres cubes (380 pieds cubes) d’eau pour être produit. Alors que le coton représente 2,4 % de la consommation mondiale d’eau, l’eau est consommée dans des régions déjà menacées de pénurie d’eau. Des dommages environnementaux importants ont été causés : par exemple, le détournement de l’eau par l’ex -Union soviétique des fleuves Amu Darya et Syr Darya pour produire du coton a été en grande partie responsable de la disparition de la mer d’ Aral . [80]
-
![]()
![]()
Besoin en eau par tonne de produit alimentaire
-
![File:Subsurface drip emission on loamy soil.ogv]()
![File:Subsurface drip emission on loamy soil.ogv]() Lire des médias
Lire des médias
Distribution de l’eau dans l’irrigation goutte à goutte souterraine
-
Irrigation des grandes cultures
En tant que norme scientifique
Le 7 avril 1795, le gramme est défini en France comme étant égal au “poids absolu d’un volume d’Eau pure égal à un cube d’un centième de mètre, et à la température de fonte des glaces”. [81] Pour des raisons pratiques cependant, un étalon de référence métallique était nécessaire, mille fois plus massif, le kilogramme. Des travaux ont donc été commandés pour déterminer précisément la masse d’un litre d’eau. Malgré le fait que la définition décrétée du gramme spécifiait une eau à 0 °C (32 °F) – une température hautement reproductible – les scientifiques ont choisi de redéfinir la norme et d’effectuer leurs mesures à la température de densité d’eau la plus élevée , ce qui a été mesurée à l’époque à 4 ° C (39 ° F). [82]
L ‘ échelle de température Kelvin du système SI était basée sur le point triple de l’eau, défini comme exactement 273,16 K (0,01 ° C; 32,02 ° F), mais à partir de mai 2019, il est basé sur la constante de Boltzmann à la place. L’échelle est une échelle de température absolue avec le même incrément que l’échelle de température Celsius, qui a été définie à l’origine en fonction du point d’ébullition (réglé à 100 °C (212 °F)) et du point de fusion (réglé à 0 °C (32 ° F) F)) d’eau.
L’eau naturelle se compose principalement des isotopes hydrogène-1 et oxygène-16, mais il existe également une petite quantité d’isotopes plus lourds oxygène-18, oxygène-17 et hydrogène-2 ( deutérium ). Le pourcentage d’isotopes plus lourds est très faible, mais il affecte toujours les propriétés de l’eau. L’eau des rivières et des lacs a tendance à contenir moins d’isotopes lourds que l’eau de mer. Par conséquent, l’eau standard est définie dans la spécification Vienna Standard Mean Ocean Water .
Pour boire 
 Une jeune fille buvant de l’eau en bouteille
Une jeune fille buvant de l’eau en bouteille 
 Disponibilité de l’eau : la fraction de la population utilisant des sources d’eau améliorées par pays
Disponibilité de l’eau : la fraction de la population utilisant des sources d’eau améliorées par pays 
 Sortie d’eau douce en bordure de glacier, Nubra
Sortie d’eau douce en bordure de glacier, Nubra
Le corps humain contient de 55% à 78% d’eau, selon la taille du corps. [83] Pour fonctionner correctement, le corps nécessite entre un et sept litres (0,22 et 1,54 gal imp; 0,26 et 1,85 gal US) [ citation nécessaire ] d’eau par jour pour éviter la déshydratation ; la quantité précise dépend du niveau d’activité, de la température, de l’humidité et d’autres facteurs. La plupart de cela est ingéré par des aliments ou des boissons autres que la consommation d’Eau pure. La quantité d’eau dont ont besoin les personnes en bonne santé n’est pas claire, bien que la British Dietetic Association indique que 2,5 litres d’eau totale par jour est le minimum pour maintenir une bonne hydratation, dont 1,8 litre (6 à 7 verres) obtenu directement à partir des boissons. [84]La littérature médicale favorise une consommation plus faible, généralement 1 litre d’eau pour un homme moyen, à l’exclusion des besoins supplémentaires dus à la perte de liquide due à l’exercice ou au temps chaud. [85]
Des reins sains peuvent excréter de 0,8 à 1 litre d’eau par heure, mais le stress comme l’exercice peut réduire cette quantité. Les gens peuvent boire beaucoup plus d’eau que nécessaire pendant l’exercice, ce qui les expose à un risque d’ intoxication hydrique (hyperhydratation), qui peut être mortelle. [86] [87] L’affirmation populaire selon laquelle “une personne devrait consommer huit verres d’eau par jour” semble n’avoir aucun fondement scientifique réel. [88] Des études ont montré qu’une consommation d’eau supplémentaire, en particulier jusqu’à 500 millilitres (18 imp fl oz; 17 US fl oz) au moment des repas, était associée à une perte de poids. [89] [90] [91] [92] [93] [94] Un apport hydrique adéquat est utile pour prévenir la constipation. [95]

 Symbole de danger pour l’eau non potable
Symbole de danger pour l’eau non potable
Une recommandation originale pour la consommation d’eau en 1945 par le Food and Nutrition Board du United States National Research Council disait: “Une norme ordinaire pour diverses personnes est de 1 millilitre pour chaque calorie de nourriture. La majeure partie de cette quantité est contenue dans les aliments préparés.” [96] Le dernier rapport sur l’apport nutritionnel de référence du Conseil national de la recherche des États-Unis recommande en général, sur la base de l’apport total médian en eau des données d’enquêtes américaines (y compris les sources alimentaires): 3,7 litres (0,81 gal imp; 0,98 gal US) pour les hommes et 2,7 litres (0,59 gal imp; 0,71 gal US) d’eau totale pour les femmes, notant que l’eau contenue dans les aliments a fourni environ 19% de l’apport total en eau dans l’enquête. [97]
Plus précisément, les femmes enceintes et allaitantes ont besoin de liquides supplémentaires pour rester hydratées. L’ Institute of Medicine (États-Unis) recommande qu’en moyenne, les hommes consomment 3 litres (0,66 gal imp; 0,79 gal US) et les femmes 2,2 litres (0,48 gal imp; 0,58 gal US); les femmes enceintes devraient augmenter leur consommation à 2,4 litres (0,53 gal imp; 0,63 gal US) et les femmes qui allaitent devraient consommer 3 litres (12 tasses), car une quantité particulièrement importante de liquide est perdue pendant l’allaitement. [98] Il est également noté que normalement, environ 20% de l’apport en eau provient de la nourriture, tandis que le reste provient de l’eau potable et des boissons ( caféinées incluses). L’eau est excrétée du corps sous de multiples formes; par l’urine et les matières fécales, par la transpiration et par l’exhalation de vapeur d’eau dans l’haleine. Avec l’effort physique et l’exposition à la chaleur, la perte d’eau augmentera et les besoins quotidiens en liquide peuvent également augmenter.
Les Humains ont besoin d’eau avec peu d’impuretés. Les impuretés courantes comprennent les sels métalliques et les oxydes, notamment le cuivre, le fer, le calcium et le plomb, [99] et/ou des bactéries nocives, telles que Vibrio . Certains solutés sont acceptables et même souhaitables pour rehausser le goût et fournir les électrolytes nécessaires . [100]
La plus grande ressource d’eau douce potable (en volume) est le lac Baïkal en Sibérie. [101]
La lessive
La propension de l’eau à former des solutions et des émulsions est utile dans divers processus de lavage . La toilette est également une composante importante de plusieurs aspects de l’ hygiène corporelle personnelle . La majeure partie de l’utilisation personnelle de l’eau est due à la douche , à la lessive et à la vaisselle , atteignant des centaines de litres par jour et par personne dans les pays développés.
Le transport
L’utilisation de l’eau pour le transport de matériaux à travers les rivières et les canaux ainsi que les voies de navigation internationales est une partie importante de l’économie mondiale.
Utilisations chimiques
L’eau est largement utilisée dans les réactions chimiques comme solvant ou réactif et moins fréquemment comme soluté ou catalyseur . Dans les réactions inorganiques, l’eau est un solvant courant, dissolvant de nombreux composés ioniques, ainsi que d’autres composés polaires tels que l’ammoniac et des composés étroitement liés à l’eau . Dans les réactions organiques, il n’est généralement pas utilisé comme solvant de réaction, car il ne dissout pas bien les réactifs et est amphotère (acide et basique) et nucléophile . Néanmoins, ces propriétés sont parfois souhaitables. De plus, une accélération des réactions de Diels-Alder par l’eau a été observée.L’eau supercritique a récemment fait l’objet de recherches. L’eau supercritique saturée en oxygène brûle efficacement les polluants organiques. La vapeur d’eau est utilisée pour certains procédés de l’industrie chimique. Un exemple est la production d’acide acrylique à partir d’acroléine, de propylène et de propane. [102] [103] [104] [105] L’effet possible de l’eau dans ces réactions comprend l’interaction physique et chimique de l’eau avec le catalyseur et la réaction chimique de l’eau avec les intermédiaires de réaction.
Échange de chaleur
L’eau et la vapeur sont un fluide couramment utilisé pour l’échange de chaleur , en raison de sa disponibilité et de sa capacité calorifique élevée , tant pour le refroidissement que pour le chauffage. L’eau fraîche peut même être naturellement disponible à partir d’un lac ou de la mer. Il est particulièrement efficace pour transporter la chaleur par vaporisation et condensation de l’eau en raison de sa grande chaleur latente de vaporisation . Un inconvénient est que les métaux que l’on trouve couramment dans les industries telles que l’acier et le cuivre sont oxydés plus rapidement par l’eau et la vapeur non traitées. Dans presque toutes les centrales thermiques, l’eau est utilisée comme fluide de travail (utilisé dans une boucle fermée entre la chaudière, la turbine à vapeur et le condenseur) et le liquide de refroidissement (utilisé pour échanger la chaleur perdue vers un plan d’eau ou l’évacuer par évaporation dans une tour de refroidissement ) . Aux États-Unis, le refroidissement des centrales électriques est la plus grande utilisation d’eau. [106]
Dans l’ industrie nucléaire , l’eau peut également être utilisée comme modérateur de neutrons . Dans la plupart des réacteurs nucléaires , l’eau est à la fois un caloporteur et un modérateur. Cela fournit une sorte de mesure de sécurité passive, car l’élimination de l’eau du réacteur ralentit également la réaction nucléaire . Cependant d’autres méthodes sont privilégiées pour arrêter une réaction et on préfère maintenir le coeur nucléaire recouvert d’eau afin d’assurer un refroidissement adéquat.
Considérations relatives au feu 
 L’eau est utilisée pour lutter contre les incendies de forêt .
L’eau est utilisée pour lutter contre les incendies de forêt .
L’eau a une chaleur de vaporisation élevée et est relativement inerte, ce qui en fait un bon fluide extincteur . L’évaporation de l’eau évacue la chaleur du feu. Il est dangereux d’utiliser de l’eau sur les feux impliquant des huiles et des solvants organiques car de nombreuses matières organiques flottent sur l’eau et l’eau a tendance à répandre le liquide en combustion.
L’utilisation d’eau dans la lutte contre l’incendie doit également tenir compte des risques d’ explosion de vapeur , qui peut se produire lorsque l’eau est utilisée sur des feux très chauds dans des espaces confinés, et d’explosion d’hydrogène, lorsque des substances qui réagissent avec l’eau, comme certains métaux ou du carbone chaud tel que le charbon, le charbon de bois ou le graphite de coke , décomposent l’eau, produisant du gaz à l’eau .
La puissance de telles explosions a été constatée lors de la catastrophe de Tchernobyl , bien que l’eau impliquée dans ce cas ne provienne pas de la lutte contre l’incendie mais du système de refroidissement par eau du réacteur. Une explosion de vapeur s’est produite lorsque la surchauffe extrême du noyau a provoqué la transformation de l’eau en vapeur. Une explosion d’hydrogène peut s’être produite à la suite d’une réaction entre de la vapeur et du zirconium chaud .
Certains oxydes métalliques, notamment ceux des métaux alcalins et des métaux alcalino-terreux , produisent tellement de chaleur lors de la réaction avec l’eau qu’un risque d’incendie peut se développer. La chaux vive d’ oxyde alcalino-terreux est une substance produite en masse qui est souvent transportée dans des sacs en papier. S’ils sont trempés, ils peuvent s’enflammer lorsque leur contenu réagit avec l’eau. [107]
des loisirs 
 Île de San Andrés , Colombie
Île de San Andrés , Colombie
Les Humains utilisent l’eau à de nombreuses fins récréatives, ainsi que pour l’exercice et le sport. Certains d’entre eux comprennent la natation, le ski nautique , la navigation de plaisance , le surf et la plongée . De plus, certains sports, comme le hockey sur glace et le patinage sur glace , se pratiquent sur glace. Les bords de lac, les plages et les parcs aquatiques sont des endroits populaires pour se détendre et se divertir. Beaucoup trouvent que le son et l’apparence de l’eau qui coule sont apaisants, et les fontaines et autres éléments aquatiques sont des décorations populaires. Certains gardent des poissons et d’autres espèces de la flore et de la faune dans des aquariums ou des étangs pour le spectacle, le plaisir et la compagnie. Les Humains utilisent également l’eau pour les sports de neige, c’est-à-dire le ski, la luge , la motoneige ou la planche à neige , qui nécessitent que l’eau soit gelée.
Industrie de l’eau
L’ industrie de l’eau fournit des services d’eau potable et d’ assainissement (y compris le traitement des eaux usées ) aux ménages et à l’industrie. Les installations d’approvisionnement en eau comprennent les puits d’eau , les citernes pour la collecte des eaux de pluie , les réseaux d’approvisionnement en eau et les installations de purification de l’eau, les réservoirs d’eau , les châteaux d’ eau , les conduites d’eau , y compris les anciens aqueducs . Des générateurs d’eau atmosphérique sont en développement.
L’eau potable est souvent collectée à des sources , extraite de forages artificiels ( puits) dans le sol ou pompée dans des lacs et des rivières. Construire plus de puits à des endroits adéquats est donc un moyen possible de produire plus d’eau, en supposant que les aquifères peuvent fournir un débit adéquat. D’autres sources d’eau comprennent la collecte des eaux de pluie. L’eau peut nécessiter une purification pour la consommation humaine. Cela peut impliquer l’élimination des substances non dissoutes, des substances dissoutes et des microbes nocifs . Les méthodes populaires consistent à filtrer avec du sable qui n’élimine que les matières non dissoutes, tandis que la chloration et l’ébullition tuent les microbes nocifs. Distillationremplit les trois fonctions. Des techniques plus avancées existent, comme l’osmose inverse . Le dessalement de l’eau de mer abondante est une solution plus coûteuse utilisée dans les climats côtiers arides .
La distribution d’eau potable se fait par l’intermédiaire des réseaux d’aqueduc municipaux , par camion-citerne ou sous forme d’eau embouteillée . Les gouvernements de nombreux pays ont des programmes de distribution gratuite d’eau aux nécessiteux.
Réduire la consommation en n’utilisant de l’eau potable (potable) que pour la consommation humaine est une autre option. Dans certaines villes comme Hong Kong, l’eau de mer est largement utilisée pour la chasse d’eau des toilettes dans toute la ville afin de conserver les ressources en eau douce .
La pollution de l’eau peut être la principale mauvaise utilisation de l’eau ; dans la mesure où un polluant limite les autres utilisations de l’eau, il devient un gaspillage de la ressource, quels que soient les avantages pour le pollueur. Comme d’autres types de pollution, celle-ci n’entre pas dans la comptabilité standard des coûts de marché, étant conçue comme des externalités dont le marché ne peut rendre compte. Ainsi, d’autres personnes paient le prix de la pollution de l’eau, tandis que les bénéfices des entreprises privées ne sont pas redistribués à la population locale, victime de cette pollution. Les produits pharmaceutiques consommés par les Humains finissent souvent dans les cours d’eau et peuvent avoir des effets néfastes sur la vie aquatique s’ils se bioaccumulent et s’ils ne sont pas biodégradables .
Les eaux usées municipales et industrielles sont généralement traitées dans des stations d’épuration . L’atténuation du ruissellement de surface pollué est abordée grâce à une variété de techniques de prévention et de traitement. ( Voir Ruissellement de surface # Atténuation et traitement .)
-
![]()
![]()
Un porteur d’eau en Inde, 1882. Dans de nombreux endroits où l’eau courante n’est pas disponible, l’eau doit être transportée par des personnes.
-
Une pompe à eau manuelle en Chine
-
![]()
![]()
Installation de purification d’eau
-
Usine de dessalement par osmose inverse (OI) à Barcelone , Espagne
Applications industrielles
De nombreux processus industriels reposent sur des réactions utilisant des produits chimiques dissous dans l’eau, la suspension de solides dans des boues aqueuses ou utilisant de l’eau pour dissoudre et extraire des substances, ou pour laver des produits ou des équipements de traitement. Des processus tels que l’exploitation minière , la réduction en pâte chimique , le blanchiment de la pâte , la fabrication du papier , la production textile, la teinture, l’impression et le refroidissement des centrales électriques utilisent de grandes quantités d’eau, nécessitent une source d’eau dédiée et provoquent souvent une pollution importante de l’eau.
L’eau est utilisée dans la production d’électricité . L’hydroélectricité est l’électricité obtenue à partir de l’hydroélectricité . L’énergie hydroélectrique provient de l’eau entraînant une turbine à eau reliée à un générateur. L’hydroélectricité est une source d’énergie renouvelable peu coûteuse et non polluante. L’énergie est fournie par le mouvement de l’eau. Généralement, un barrage est construit sur une rivière, créant un lac artificiel derrière elle. L’eau sortant du lac est forcée à travers des turbines qui font tourner des générateurs.

 Le barrage des Trois Gorges est la plus grande centrale hydroélectrique .
Le barrage des Trois Gorges est la plus grande centrale hydroélectrique .
L’eau sous pression est utilisée dans le sablage à l’eau et les découpeuses au jet d’eau . De plus, des pistolets à eau à haute pression sont utilisés pour une coupe précise. Il fonctionne très bien, est relativement sûr et n’est pas nocif pour l’environnement. Il est également utilisé dans le refroidissement des machines pour éviter la surchauffe ou empêcher les lames de scie de surchauffer.
L’eau est également utilisée dans de nombreux processus et machines industriels, tels que la turbine à vapeur et l’échangeur de chaleur , en plus de son utilisation comme solvant chimique . Le rejet d’eau non traitée provenant d’utilisations industrielles est une pollution . La pollution comprend les rejets de solutés (pollution chimique) et les rejets d’eau de refroidissement ( pollution thermique ). L’industrie a besoin d’Eau pure pour de nombreuses applications et utilise une variété de techniques de purification à la fois pour l’approvisionnement et l’évacuation de l’eau.
Préparation des aliments 
 L’eau peut être utilisée pour cuire des aliments tels que des nouilles
L’eau peut être utilisée pour cuire des aliments tels que des nouilles 
 Eau stérile pour injection
Eau stérile pour injection
L’ébullition , la cuisson à la vapeur et le mijotage sont des méthodes de cuisson populaires qui nécessitent souvent d’immerger les aliments dans l’eau ou dans leur état gazeux, la vapeur. [108] L’eau est également utilisée pour la vaisselle . L’eau joue également de nombreux rôles critiques dans le domaine de la science alimentaire .
Les solutés tels que les sels et les sucres présents dans l’eau affectent les propriétés physiques de l’eau. Les points d’ébullition et de congélation de l’eau sont affectés par les solutés, ainsi que la pression atmosphérique , qui à son tour est affectée par l’altitude. L’eau bout à des températures plus basses avec la pression atmosphérique plus faible qui se produit à des altitudes plus élevées. Une mole de saccharose (sucre) par kilogramme d’eau augmente le point d’ébullition de l’eau de 0,51 ° C (0,918 ° F) et une mole de sel par kg augmente le point d’ébullition de 1,02 ° C (1,836 ° F); de même, l’augmentation du nombre de particules dissoutes abaisse le point de congélation de l’eau. [109]
Les solutés dans l’eau affectent également l’activité de l’eau qui affecte de nombreuses réactions chimiques et la croissance des microbes dans les aliments. [110] L’activité de l’eau peut être décrite comme un rapport de la pression de vapeur de l’eau dans une solution à la pression de vapeur de l’Eau pure. [109] Les solutés dans l’eau réduisent l’activité de l’eau – il est important de le savoir car la plupart des croissances bactériennes cessent à de faibles niveaux d’activité de l’eau. [110] Non seulement la croissance microbienne affecte la sécurité des aliments, mais aussi la conservation et la durée de conservation des aliments.
La dureté de l’eau est également un facteur critique dans la transformation des aliments et peut être modifiée ou traitée à l’aide d’un système chimique d’échange d’ions. Il peut affecter considérablement la qualité d’un produit, ainsi que jouer un rôle dans l’assainissement. La dureté de l’eau est classée en fonction de la concentration de carbonate de calcium contenue dans l’eau. L’eau est classée comme douce si elle contient moins de 100 mg/l (UK) [111] ou moins de 60 mg/l (US). [112]
Selon un rapport publié par l’organisation Water Footprint en 2010, un seul kilogramme de bœuf nécessite 15 000 litres (3,3 × 10 3 gal imp; 4,0 × 10 3 gal US) d’eau; cependant, les auteurs précisent également qu’il s’agit d’une moyenne mondiale et que des facteurs circonstanciels déterminent la quantité d’eau utilisée dans la production de viande bovine. [113]^^
Usage médical
L’eau pour injection figure sur la liste des médicaments essentiels de l’Organisation mondiale de la santé . [114]
Répartition dans la nature
Dans l’univers

 Le récepteur ALMA Band 5 est un instrument spécialement conçu pour détecter l’eau dans l’univers. [115]
Le récepteur ALMA Band 5 est un instrument spécialement conçu pour détecter l’eau dans l’univers. [115]
Une grande partie de l’eau de l’univers est produite en tant que sous-produit de la formation d’étoiles . La formation d’étoiles s’accompagne d’un fort vent extérieur de gaz et de poussière. Lorsque cette sortie de matière a finalement un impact sur le gaz environnant, les ondes de choc créées compriment et chauffent le gaz. L’eau observée est rapidement produite dans ce gaz chaud et dense. [116]
Le 22 juillet 2011, un rapport décrit la découverte d’un gigantesque nuage de vapeur d’eau contenant “140 000 milliards de fois plus d’eau que tous les océans de la Terre réunis” autour d’un quasar situé à 12 milliards d’années-lumière de la Terre. Selon les chercheurs, la “découverte montre que l’eau a été répandue dans l’univers pendant presque toute son existence”. [117] [118]
De l’eau a été détectée dans les nuages interstellaires de notre galaxie , la Voie lactée . [119] L’eau existe probablement aussi en abondance dans d’autres galaxies, car ses composants, l’hydrogène et l’oxygène, sont parmi les éléments les plus abondants de l’univers. Sur la base de modèles de formation et d’évolution du système solaire et d’autres systèmes stellaires, la plupart des autres systèmes planétaires sont susceptibles d’avoir des ingrédients similaires.
Vapeur d’eau
L’eau est présente sous forme de vapeur dans :
- Atmosphère du Soleil : en quantités infimes détectables [120]
- Atmosphère de Mercure : 3,4 %, et de grandes quantités d’eau dans l’ exosphère de Mercure [121]
- Atmosphère de Vénus : 0.002% [122]
- Atmosphère terrestre : ≈0,40 % au-dessus de la pleine atmosphère, généralement 1 à 4 % à la surface ; ainsi que celui de la Lune à l’état de traces [123]
- Atmosphère de Mars : 0.03% [124]
- Atmosphère de Cérès [125]
- Atmosphère de Jupiter : 0,0004% [126] – dans les glaces uniquement ; et celle de sa lune Europe [127]
- Atmosphère de Saturne – dans les glaces uniquement ; Encelade : 91% [128] et Dioné (exosphère) [ citation nécessaire ]
- Atmosphère d’Uranus – en quantités infimes en dessous de 50 bar
- Atmosphère de Neptune – trouvée dans les couches plus profondes [129]
- Atmosphères des planètes extrasolaires : dont celles de HD 189733 b [130] et HD 209458 b , [131] Tau Bootis b , [132] HAT-P-11b , [133] [134] XO-1b , WASP-12b , WASP- 17b et WASP-19b . [135]
- Atmosphères stellaires : non limitées aux étoiles plus froides et même détectées dans les étoiles chaudes géantes telles que Bételgeuse , Mu Cephei , Antares et Arcturus . [134] [136]
- Disques circumstellaires : dont ceux de plus de la moitié des étoiles T Tauri telles que AA Tauri [134] ainsi que TW Hydrae , [137] [138] IRC +10216 [139] et APM 08279+5255 , [117] [118] VY Canis Majoris et S Persei . [136]
Eau liquide
L’eau liquide est présente sur Terre, couvrant 71% de sa surface. [3] De l’eau liquide est aussi occasionnellement présente en petites quantités sur Mars . [140] Les scientifiques pensent que de l’eau liquide est présente dans les lunes saturniennes d’ Encelade , sous la forme d’un océan de 10 kilomètres d’épaisseur à environ 30 à 40 kilomètres sous la surface polaire sud d’Encelade, [141] [142] et Titan , sous la forme d’une couche souterraine, peut-être mélangé avec de l’ammoniaque . [143] La lune de Jupiter Europa a des caractéristiques de surface qui suggèrent un océan d’eau liquide souterrain. [144] De l’eau liquide peut également exister sur la lune Ganymède de Jupitercomme une couche prise en sandwich entre la glace à haute pression et la roche. [145]
Eau glacée
L’eau est présente sous forme de glace sur :

 La calotte glaciaire polaire sud de Mars pendant l’été sud martien 2000
La calotte glaciaire polaire sud de Mars pendant l’été sud martien 2000
- Mars : sous le régolithe et aux pôles. [146] [147]
- Système Terre-Lune : principalement sous forme de Calottes glaciaires sur Terre et dans les cratères lunaires et les roches volcaniques [148] La NASA a signalé la détection de molécules d’eau par le Moon Mineralogy Mapper de la NASA à bord du vaisseau spatial Chandrayaan-1 de l’Organisation indienne de recherche spatiale en septembre 2009. [149]
- Cérès [150] [151] [152]
- Les lunes de Jupiter : la surface d’ Europe et aussi celle de Ganymède [153] et Callisto [154] [155]
- Saturne : dans le système d’anneaux de la planète [156] et sur la surface et le manteau de Titan [157] et d’ Encelade [158]
- Système Pluton – Charon [156]
- Comètes [159] [160] et autres objets liés à la ceinture de Kuiper et au nuage d’Oort [161]
Et est également probablement présent sur :
- Les pôles de Mercure [162]
- Téthys [163]
Formes exotiques
L’eau et d’autres composés volatils comprennent probablement une grande partie des structures internes d’ Uranus et de Neptune et l’eau dans les couches plus profondes peut être sous la forme d’ eau ionique dans laquelle les molécules se décomposent en une soupe d’ions hydrogène et oxygène, et plus profondément encore sous forme superionique . l’eau dans laquelle l’oxygène cristallise, mais les ions hydrogène flottent librement dans le réseau d’oxygène. [164]
Eau et habitabilité planétaire
L’existence d’eau liquide, et dans une moindre mesure de ses formes gazeuses et solides, sur Terre est vitale pour l’existence de la vie sur Terre telle que nous la connaissons. La Terre est située dans la zone habitable du Système solaire ; s’il était légèrement plus proche ou plus éloigné du Soleil (environ 5%, soit environ 8 millions de kilomètres), les conditions qui permettent aux trois formes d’être présentes simultanément seraient beaucoup moins susceptibles d’exister. [165] [166]
La gravité terrestre lui permet de contenir une atmosphère . La vapeur d’eau et le dioxyde de carbone dans l’atmosphère fournissent un tampon de température ( effet de serre ) qui aide à maintenir une température de surface relativement stable. Si la Terre était plus petite, une atmosphère plus fine permettrait des températures extrêmes, empêchant ainsi l’accumulation d’eau sauf dans les calottes polaires (comme sur Mars ). [ citation nécessaire ]
La température de surface de la Terre a été relativement constante à travers le temps géologique malgré des niveaux variables de rayonnement solaire entrant ( insolation ), indiquant qu’un processus dynamique régit la température de la Terre via une combinaison de gaz à effet de serre et d’ albédo de surface ou atmosphérique . Cette proposition est connue sous le nom d’ hypothèse Gaïa . [ citation nécessaire ]
L’état de l’eau sur une planète dépend de la pression ambiante, qui est déterminée par la gravité de la planète. Si une planète est suffisamment massive, l’eau qui s’y trouve peut être solide même à des températures élevées, à cause de la haute pression causée par la gravité, comme cela a été observé sur les exoplanètes Gliese 436 b [167] et GJ 1214 b . [168]
Droit, politique et crise
| Cette rubrique doit être mise à jour . ( juin 2020 ) Please help update this article to reflect recent events or newly available information. |

 Une estimation de la proportion de personnes dans les pays en développement ayant accès à l’eau potable 1970-2000
Une estimation de la proportion de personnes dans les pays en développement ayant accès à l’eau potable 1970-2000
La politique de l’eau est une politique affectée par l’eau et les ressources en eau . Pour cette raison, l’eau est une ressource stratégique dans le monde et un élément important dans de nombreux conflits politiques. Il provoque des impacts sur la santé et des dommages à la biodiversité.
L’accès à l’eau potable s’est amélioré au cours des dernières décennies dans presque toutes les régions du monde, mais environ un milliard de personnes n’ont toujours pas accès à l’eau potable et plus de 2,5 milliards n’ont pas accès à un assainissement adéquat . [169] Cependant, certains observateurs ont estimé que d’ici 2025, plus de la moitié de la population mondiale sera confrontée à une vulnérabilité liée à l’eau. [170] Un rapport, publié en novembre 2009, suggère que d’ici 2030, dans certaines régions en développement du monde, la demande en eau dépassera l’offre de 50 %. [171]
1,6 milliard de personnes ont eu accès à une source d’eau salubre depuis 1990. [172] La proportion de personnes dans les pays en développement ayant accès à l’eau salubre est passée de 30 % en 1970 [173] à 71 % en 1990, 79 % en 2000 et 84 % en 2004. [169]
Un rapport des Nations Unies de 2006 a déclaré qu ‘«il y a assez d’eau pour tout le monde», mais que l’accès à celle-ci est entravé par la mauvaise gestion et la corruption. [174] En outre, les initiatives mondiales visant à améliorer l’efficacité de l’acheminement de l’aide, telles que la Déclaration de Paris sur l’efficacité de l’aide , n’ont pas été adoptées par les donateurs du secteur de l’eau aussi efficacement qu’elles l’ont fait dans le domaine de l’éducation et de la santé, laissant potentiellement plusieurs donateurs travailler sur des projets qui se chevauchent et des gouvernements bénéficiaires sans pouvoir d’action. [175]
Les auteurs de l’ Évaluation globale de la gestion de l’eau dans l’agriculture de 2007 citent la mauvaise gouvernance comme l’une des raisons de certaines formes de pénurie d’eau. La gouvernance de l’eau est l’ensemble des processus formels et informels par lesquels les décisions liées à la gestion de l’eau sont prises. Une bonne gouvernance de l’eau consiste principalement à savoir quels processus fonctionnent le mieux dans un contexte physique et socio-économique particulier. Des erreurs ont parfois été commises en essayant d’appliquer des « modèles » qui fonctionnent dans le monde développé à des lieux et à des contextes du monde en développement. Le fleuve Mékong en est un exemple ; un examen par l’ Institut international de gestion de l’eaudes politiques de six pays qui dépendent du fleuve Mékong pour l’eau ont révélé que des analyses coûts-avantages et des évaluations d’impact environnemental approfondies et transparentes étaient rarement entreprises. Ils ont également découvert que le projet de loi sur l’eau du Cambodge était beaucoup plus complexe que nécessaire. [176]
Le Rapport mondial des Nations Unies sur la mise en valeur des ressources en eau (WWDR, 2003) du Programme mondial d’évaluation des ressources en eau indique qu’au cours des 20 prochaines années, la quantité d’eau disponible pour tous devrait diminuer de 30 %. 40% des habitants de la planète n’ont actuellement pas assez d’eau douce pour une hygiène minimale . Plus de 2,2 millions de personnes sont mortes en 2000 de maladies hydriques (liées à la consommation d’eau contaminée) ou de sécheresse. En 2004, l’organisation caritative britannique WaterAid a rapporté qu’un enfant meurt toutes les 15 secondes de maladies facilement évitables liées à l’eau ; cela signifie souvent un manque d’ évacuation des eaux usées . [ citation nécessaire ]
Les organisations concernées par la protection de l’eau comprennent l’ Association internationale de l’eau (IWA), WaterAid , Water 1st et l’American Water Resources Association. L’ Institut international de gestion de l’eau entreprend des projets dans le but d’utiliser une gestion efficace de l’eau pour réduire la pauvreté. Les conventions relatives à l’eau sont la Convention des Nations Unies sur la lutte contre la désertification (UNCCD), la Convention internationale pour la prévention de la pollution par les navires , la Convention des Nations Unies sur le droit de la mer et la Convention de Ramsar . La Journée mondiale de l’eau a lieu le 22 mars [177] etJournée mondiale des océans le 8 juin. [178]
Dans la culture
La religion

 Les gens viennent à la source d’Inda Abba Hadera ( Inda Sillasie , Éthiopie ) pour se laver à l’eau bénite
Les gens viennent à la source d’Inda Abba Hadera ( Inda Sillasie , Éthiopie ) pour se laver à l’eau bénite
L’eau est considérée comme un purificateur dans la plupart des religions. Les religions qui intègrent le lavage rituel ( ablution ) comprennent le christianisme , [179] l’hindouisme , l’islam , le judaïsme , le mouvement Rastafari , le shintoïsme , le taoïsme et la Wicca . L’immersion (ou aspersion ou affusion ) d’une personne dans l’eau est un sacrement central du christianisme (où on l’appelle baptême ) ; c’est aussi une partie de la pratique d’autres religions, y compris l’islam ( ghusl ), le judaïsme ( mikvah ) etSikhisme ( Amrit Sanskar ). De plus, un bain rituel dans de l’Eau pure est pratiqué pour les morts dans de nombreuses religions, dont l’islam et le judaïsme. Dans l’Islam, les cinq prières quotidiennes peuvent être faites dans la plupart des cas après avoir lavé certaines parties du corps à l’eau claire ( wudu ), à moins que l’eau ne soit pas disponible (voir Tayammum ). Dans le shintoïsme, l’eau est utilisée dans presque tous les rituels pour purifier une personne ou une zone (par exemple, dans le rituel du misogi ).
Dans le christianisme, l’eau bénite est de l’eau qui a été sanctifiée par un prêtre à des fins de baptême , de bénédiction de personnes, de lieux et d’objets, ou comme moyen de repousser le mal. [180] [181]
Dans le zoroastrisme , l’eau ( āb ) est respectée comme source de vie. [182]
Philosophie

 Icosaèdre dans le cadre du monument Spinoza à Amsterdam .
Icosaèdre dans le cadre du monument Spinoza à Amsterdam .
Le philosophe grec ancien Empédocle considérait l’eau comme l’un des quatre éléments classiques (avec le feu, la terre et l’air ) et la considérait comme un ylem ou substance de base de l’univers. Thalès , qu’Aristote dépeint comme un astronome et un ingénieur, a émis l’hypothèse que la terre, qui est plus dense que l’eau, émergeait de l’eau. Thales, un moniste , croyait en outre que toutes les choses sont faites d’eau. Platon croyait que la forme de l’eau est un icosaèdre – expliquant ainsi pourquoi elle coule facilement par rapport à la terre en forme de cube. [183]
La théorie des quatre humeurs corporelles associait l’eau au flegme , comme étant froid et humide. L’ élément classique de l’eau était également l’un des cinq éléments de la philosophie traditionnelle chinoise (avec la terre , le feu , le bois et le métal ).
Certains systèmes philosophiques asiatiques traditionnels et populaires prennent l’eau comme modèle. La traduction de James Legge en 1891 du Dao De Jing déclare : « La plus haute excellence est comme (celle de) l’eau. lieu bas que tous les hommes détestent. Par conséquent (sa voie) est proche de (celle du) Tao ” et ” Il n’y a rien au monde de plus doux et plus faible que l’eau, et pourtant pour attaquer les choses qui sont fermes et fortes il n’y a rien cela peut prendre le pas sur lui – car il n’y a rien (d’aussi efficace) pour lequel il puisse être changé.” [184] Guanzidans le chapitre “Shui di” 水地 développe davantage le symbolisme de l’eau, proclamant que “l’homme est l’eau” et attribuant les qualités naturelles des habitants des différentes régions chinoises au caractère des ressources en eau locales. [185]
Folklore
“L’eau vive” figure dans les contes folkloriques germaniques et slaves comme un moyen de ramener les morts à la vie. Notez le conte de fées de Grimm ( « L’eau de la vie » ) et la dichotomie russe entre eau vivante [ ru ] et eau morte eau morte [ ru ] ). La fontaine de jouvence représente un concept connexe d’ eaux magiques censées prévenir le vieillissement.
Art et activisme
La peintre et activiste Fredericka Foster a organisé The Value of Water , à la cathédrale Saint-Jean-le-Divin à New York, [186] qui a ancré une initiative d’un an de la cathédrale sur notre dépendance à l’eau. [187] [188] La plus grande exposition jamais présentée à la cathédrale, [189] elle présentait plus de quarante artistes, dont Jenny Holzer , Robert Longo , Mark Rothko , William Kentridge , April Gornik , Kiki Smith , Pat Steir , William Kentridge ,Alice Dalton Brown , Teresita Fernandez et Bill Viola . [190] [191] Foster a créé Think About Water , un collectif écologique d’artistes qui utilisent l’eau comme sujet ou médium. Les membres comprennent Basia Irland , Aviva Rahmani , Betsy Damon , Diane Burko , Leila Daw , Stacy Levy , Charlotte Coté, [192] Meridel Rubenstein , Stacy Levy , Anna Macleod et Aviva Rahmani .
Pour marquer le 10e anniversaire de l’accès à l’eau et à l’assainissement déclaré droit de l’homme par l’ONU, l’association caritative WaterAid a mandaté dix artistes visuels pour montrer l’impact de l’eau potable sur la vie des gens. [193] [194]
Parodie de monoxyde de dihydrogène
Le nom chimique techniquement correct mais rarement utilisé de l’eau , le monoxyde de dihydrogène, a été utilisé dans une série de canulars et de farces qui se moquent de l’analphabétisme scientifique . Cela a commencé en 1983, lorsqu’un article sur le poisson d’ avril est paru dans un journal de Durand, dans le Michigan . La fausse histoire consistait en des problèmes de sécurité concernant la substance. [195]
Voir également
-
![icon]()
![icon]() Portail de l’eau
Portail de l’eau
- Contour de l’eau
- L’eau (page de données) est une collection des propriétés chimiques et physiques de l’eau.
- Aquaphobie (peur de l’eau)
- Droit humain à l’eau et à l’assainissement
- Effet Mpemba
- Thérapie de réhydratation orale
- La soif
- Analyse du pincement d’eau
Références
- ^ “Questions et réponses sur l’eau : pourquoi l’eau est-elle le” solvant universel” ?” . www.usgs.gov . ( Département américain de l’intérieur ) . Récupéré le 15 janvier 2021 .
- ^ “10.2 : Orbitales hybrides dans l’eau” . Chimie LibreTexts . 18 mars 2020 . Récupéré le 11 avril 2021 .
- ^ un b “CIA – LE MONDE FACTBOOK Géographie Aperçu géographique” . Agence centrale de renseignement . Récupéré le 20 décembre 2008 .
- ^ un b Gleick, PH, éd. (1993). L’eau en crise : un guide des ressources mondiales en eau douce . Presse universitaire d’Oxford. p. 13, Tableau 2.1 “Réserves d’eau sur la terre”. Archivé de l’original le 8 avril 2013.
- ^ Vapeur d’eau dans le système climatique Archivé le 20 mars 2007 à la Wayback Machine , Rapport spécial, [AGU], décembre 1995 (lié le 4/2007). Vital Water Archivé le 20 février 2008 sur la Wayback Machine PNUE .
- ^ Baroni, L.; Cenci, L.; Tettamanti, M.; En ligneBerati, M. (2007). “Évaluer l’impact environnemental de divers régimes alimentaires combinés à différents systèmes de production alimentaire” . Journal européen de nutrition clinique . 61 (2): 279-286. doi : 10.1038/sj.ejcn.1602522 . PMID 17035955 .
- ^ “Eau (v.)” . www.etymonline.com . Dictionnaire d’étymologie en ligne. Archivé de l’original le 2 août 2017 . Récupéré le 20 mai 2017 .
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . p. 620. ISBN 978-0-08-037941-8.
- ^ “L’eau, le solvant universel” . USGS . Archivé de l’original le 9 juillet 2017 . Récupéré le 27 juin 2017 .
- ^ Reece, Jane B. (31 octobre 2013). Campbell Biology (10 éd.). Person . p. 48. ISBN 9780321775658.
- ^ Reece, Jane B. (31 octobre 2013). Campbell Biology (10 éd.). Person . p. 44. ISBN 9780321775658.
- ^ Leigh, GJ; Favre, H.A; Metanomski, WV (1998). Principes de nomenclature chimique: un guide des recommandations de l’IUPAC (PDF) . Oxford : Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352 . Archivé de l’original (PDF) le 26 juillet 2011.
- ^ PubChem. “Eau” . Centre national d’information sur la biotechnologie . Récupéré le 25 mars 2020 .
- ^ un b Belnay, Louise. “Le cycle de l’eau” (PDF) . Activités de réflexion critique . Laboratoire de recherche sur le système terrestre . Récupéré le 25 mars 2020 .
- ^ un b Oliveira, Mário J. de (2017). Thermodynamique d’équilibre . Springer. p. 120–124. ISBN 978-3-662-53207-2. Récupéré le 26 mars 2020 .
- ^ D’autres substances possédant cette propriété comprennent le bismuth , le silicium , le germanium et le gallium . [15]
- ^ une boule b , Philip (2008). « L’eau : l’eau — un mystère persistant » . Nature . 452 (7185): 291–2. Bibcode : 2008Natur.452..291B . doi : 10.1038/452291a . PMID 18354466 . S2CID 4365814 . Archivé de l’original le 17 novembre 2016 . Récupéré le 15 novembre 2016 .
- ^ Kotz, JC, Treichel, P., & Weaver, GC (2005). Chimie & Réactivité Chimique . Thomson Brooks/Cole. ISBN 978-0-534-39597-1.{{cite book}}: CS1 maint: multiple names: authors list (link)
- ^ Ben-Naim, Ariel; Ben-Naim, Roberta; et coll. (2011). Les aventures d’Alice dans l’eau-land . Singapour. doi : 10.1142/8068 . ISBN 978-981-4338-96-7.
- ^ Matsuoka, N.; En ligneMurton, J. (2008). “Altération par le gel: avancées récentes et orientations futures”. Pergélisol Périglac. Processus . 19 (2): 195–210. doi : 10.1002/ppp.620 .
- ^ Wiltse, Brendan. “Un regard sous la glace: l’écologie des lacs d’hiver” . Association de la rivière Ausable . Récupéré le 23 avril 2020 .
- ^ un b Chen, Zijun (21 avril 2010). “Mesure du diamagnétisme dans l’eau” . {{cite journal}}: Cite journal requires |journal= (help)
- ^ Wells, Sarah (21 janvier 2017). “La beauté et la science des flocons de neige” . Centre d’éducation scientifique Smithsonian . Récupéré le 25 mars 2020 .
- ^ Fellows, P. (Peter) (2017). “Lyophilisation et lyophilisation”. Technologie de transformation des aliments : principes et pratique (4e éd.). Kent : Woodhead Publishing/Elsevier Science. pages 929–940. ISBN 978-0081005231. OCLC 960758611 .
- ^ Siegert, Martin J.; Ellis-Evans, J. Cynan; Tranter, Martyn; Mayer, Christophe; Petit, Jean-Robert; Salamatin, Andreï; Priscu, John C. (décembre 2001). “Processus physiques, chimiques et biologiques dans le lac Vostok et d’autres lacs sous-glaciaires antarctiques”. Nature . 414 (6864): 603–609. Bibcode : 2001Natur.414..603S . doi : 10.1038/414603a . PMID 11740551 . S2CID 4423510 .
- ^ Davies, Bethan. “Lacs sous-glaciaires de l’Antarctique” . Glaciers de l’Antarctique . Récupéré le 25 mars 2020 .
- ^ Masterton, William L.; Hurley, Cécile N. (2008). Chimie : principes et réactions (6e éd.). Cengage Apprentissage. p. 230. ISBN 9780495126713. Récupéré le 3 avril 2020 .
- ^ Peaco, Jim. “Plan de cours de Yellowstone : Comment les geysers de Yellowstone éclatent – Parc national de Yellowstone (US National Park Service)” . Service des parcs nationaux . Récupéré le 5 avril 2020 .
- ^ Brahić, Catherine. “Trouvé: L’eau la plus chaude sur Terre” . Nouveau scientifique . Récupéré le 5 avril 2020 .
- ^ Service de sécurité et d’inspection des aliments de l’USDA. “Cuisine à haute altitude et sécurité alimentaire” (PDF) . Récupéré le 5 avril 2020 .
- ^ “Cuisson sous pression – Science alimentaire” . Exploratoire . 26 septembre 2019.
- ^ Allain, Rhett (12 septembre 2018). “Oui, vous pouvez faire bouillir de l’eau à température ambiante. Voici comment” . Câblé . Récupéré le 5 avril 2020 .
- ^ Murphy, D.M. ; Koop, T. (1er avril 2005). “Examen des pressions de vapeur de la glace et de l’eau surfondue pour les applications atmosphériques” . Journal trimestriel de la Royal Meteorological Society . 131 (608): 1540. Bibcode : 2005QJRMS.131.1539M . doi : 10.1256/qj.04.94 .
- ^ Bureau international des poids et mesures (2006), Le système international d’unités (SI) (PDF) (8e éd.), p. 114, ISBN 92-822-2213-6, archivé (PDF) de l’original le 14 août 2017
- ^ “9ème édition de la Brochure SI” . BIPM. 2019 . Récupéré le 20 mai 2019 .
- ^ Wagner, W.; Prusse, A. (juin 2002). “La formulation IAPWS 1995 pour les propriétés thermodynamiques de la substance d’eau ordinaire à usage général et scientifique”. Journal des données de référence physiques et chimiques . 31 (2): 398. doi : 10.1063/1.1461829 .
- ^ Weingärtner, Hermann; Franck, Ernst Ulrich (29 avril 2005). “L’eau supercritique comme solvant”. Angewandte Chemie International Edition . 44 (18): 2672–2692. doi : 10.1002/anie.200462468 . PMID 15827975 .
- ^ Adschiri, Tadafumi; Lee, Youn Woo ; Goto, Motonobu ; Takami, Seichi (2011). “Synthèse de matériaux verts avec de l’eau supercritique”. Chimie verte . 13 (6): 1380. doi : 10.1039/c1gc15158d .
- ^ Murray, Benjamin J.; Knopf, Daniel A.; En ligneBertram, Allan K. (2005). “La formation de glace cubique dans des conditions pertinentes pour l’atmosphère terrestre“. Nature . 434 (7030): 202–205. Bibcode : 2005Natur.434..202M . doi : 10.1038/nature03403 . PMID 15758996 . S2CID 4427815 .
- ^ Salzmann, Christoph G. (14 février 2019). “Progrès dans l’exploration expérimentale du diagramme de phase de l’eau” . Le Journal de Physique Chimique . 150 (6) : 060901. arXiv : 1812.04333 . Bibcode : 2019JChPh.150f0901S . doi : 10.1063/1.5085163 . PMID 30770019 .
- ^ Sokol, Josué (12 mai 2019). “Une forme bizarre d’eau peut exister dans tout l’univers” . Câblé . Wired.com. Archivé de l’original le 12 mai 2019 . Récupéré le 1er septembre 2021 .
- ↑ Millot, M. ; Coppari, F.; Rygg, JR; Barrios, Antonio Correa; Hamel, Sébastien; Swift, Damian C.; Eggert, Jon H. (2019). “Diffraction nanoseconde des rayons X de la glace d’eau superionique comprimée par choc”. Nature . Springer. 569 (7755): 251–255. Bibcode : 2019Natur.569..251M . doi : 10.1038/s41586-019-1114-6 . OSTI 1568026 . PMID 31068720 . S2CID 148571419 .
- ^ Peplow, Mark (25 mars 2015). “Le sandwich au graphène crée une nouvelle forme de glace”. Nature . doi : 10.1038/nature.2015.17175 . S2CID 138877465 .
- ^ Maestro, LM; Marqués, MI ; Camarillo, E.; Jaque, D.; Solé, J. García; Gonzalo, JA ; Jaque, F.; Valle, Juan C. Del; Mallamace, F. (1er janvier 2016). “Sur l’existence de deux états dans l’eau liquide : impact sur les systèmes biologiques et nanoscopiques” . Journal international de la nanotechnologie . 13 (8–9) : 667–677. Bibcode : 2016IJNT…13..667M . doi : 10.1504/IJNT.2016.079670 . Archivé de l’original le 23 septembre 2017.
- ^ Mallamace, Francesco; Corsaro, Carmelo; Stanley, H. Eugene (18 décembre 2012). “Une température singulière thermodynamiquement constante à l’origine du comportement anormal de l’eau liquide” . Rapports scientifiques . 2 (1) : 993. Bibcode : 2012NatSR…2E.993M . doi : 10.1038/srep00993 . PMC 3524791 . PMID 23251779 .
- ^ Perakis, Fivos; Amann-Winkel, Katrin; Lehmkühler, Felix; Sprung, Michael ; Mariedahl, Daniel; Sellberg, Jonas A.; Pathak, Harshad ; Späh, Alexandre; Cavalca, Filippo; Ricci, Alessandro; Jaïn, Avni ; Massani, Bernhard; Aubrée, Flora; Benmore, Chris J.; Loerting, Thomas; Grübel, Gerhard; Pettersson, Lars GM; Nilsson, Anders (26 juin 2017). “Dynamique diffusive lors de la transition de haute à basse densité dans la glace amorphe” . Actes de l’Académie nationale des sciences des États-Unis d’Amérique . 13 (8–9) : 667–677. Bibcode : 2017PNAS..114.8193P . doi : 10.1073/pnas.1705303114 . PMC 5547632 . PMID 28652327 .
- ^ Edmund T. Rolls (2005), “L’émotion expliquée”. Oxford University Press, Médical. ISBN 0198570031 , 9780198570035.
- ^ R. Llinas, W. Precht (2012), “Frog Neurobiology: A Handbook”. Springer Science et médias d’affaires. ISBN 3642663168 , 9783642663161
- ^ Candau, Joël (2004). “L’Expérience Olfactive : constantes et variables culturelles” . Sciences et technologies de l’eau . 49 (9) : 11-17. doi : 10.2166/wst.2004.0522 . PMID 15237601 . Archivé de l’original le 2 octobre 2016 . Récupéré le 28 septembre 2016 .
- ^ Braun, Charles L.; Sergueï N. Smirnov (1993). « Pourquoi l’eau est-elle bleue ? » . J. Chem. Éduc . 70 (8): 612. Bibcode : 1993JChEd..70..612B . doi : 10.1021/ed070p612 . Archivé de l’original le 20 mars 2012 . Récupéré le 21 avril 2007 .
- ^ Nakamoto, Kazuo (1997). Spectres infrarouges et Raman des composés inorganiques et de coordination, partie A: théorie et applications en chimie inorganique (5e éd.). New York : Wiley. p. 170. ISBN 0-471-16394-5.
- ^ Bal 2001 , p. 168
- ^ Francs 2007 , p. dix
- ^ “Chimie Physique de l’Eau” . Université d’État du Michigan . Récupéré le 11 septembre 2020 .
- ^ Bal 2001 , p. 169
- ^ Isaacs, ED; Shukla, A; Platzman, PM ; Hamann, DR; Barbiellini, B; Tulk, Californie (1er mars 2000). “Preuve de diffusion Compton pour la covalence de la liaison hydrogène dans la glace”. Journal de physique et chimie des solides . 61 (3): 403–406. Bibcode : 2000JPCS…61..403I . doi : 10.1016/S0022-3697(99)00325-X .
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biologie : Explorer la vie . Boston, Massachusetts : Pearson Prentice Hall. ISBN 978-0-13-250882-7. Archivé de l’original le 2 novembre 2014 . Récupéré le 11 novembre 2008 .
- ^ Action capillaire – Liquide, eau, force et surface – Articles JRank archivés le 27 mai 2013 sur la Wayback Machine . Science.jrank.org. Consulté le 28 septembre 2015.
- ^ Boule, Philip (14 septembre 2007). “Eau brûlante et autres mythes” . Actualités@nature . doi : 10.1038/news070910-13 . S2CID 129704116 . Archivé de l’original le 28 février 2009 . Récupéré le 14 septembre 2007 .
- ^ Bien, RA & Millero, FJ (1973). “Compressibilité de l’eau en fonction de la température et de la pression”. Journal de physique chimique . 59 (10): 5529. Bibcode : 1973JChPh..59.5529F . doi : 10.1063/1.1679903 .
- ^ Nave, R. “Propriétés élastiques en vrac” . Hyperphysique . Université d’État de Géorgie . Archivé de l’original le 28 octobre 2007 . Récupéré le 26 octobre 2007 .
- ^ Laboratoire national de physique du Royaume-Uni, Calcul de l’absorption du son dans l’eau de mer Archivé le 3 octobre 2016 à la Wayback Machine . Site en ligne, consulté pour la dernière fois le 28 septembre 2016.
- ^ Gleick, PH, éd. (1993). L’eau en crise : un guide des ressources mondiales en eau douce . Presse universitaire d’Oxford. p. 15, tableau 2.3. Archivé de l’original le 8 avril 2013.
- ^ Ben-Naim, A. & Ben-Naim, R., PH (2011). Les aventures d’Alice dans l’eau-land . Éditions scientifiques mondiales. p. 31. doi : 10.1142/8068 . ISBN 978-981-4338-96-7.{{cite book}}: CS1 maint: multiple names: authors list (link)
- ^ Gleick, Peter H. (1993). L’eau en crise (1 éd.). New York : Presse universitaire d’Oxford . p. 13 . ISBN 019507627-3.
- ^ Wada, Yoshihide; Van Beek, LPH ; Bierkens, Marc FP (2012). “Irrigation de soutien des eaux souterraines non durables: une évaluation mondiale” . Recherche sur les ressources en eau . 48 (6) : W00L06. Bibcode : 2012WRR….48.0L06W . doi : 10.1029/2011WR010562 .
- ^ “Le catalyseur aide à diviser l’eau : Plantes” . DemandezNature . Récupéré le 10 septembre 2020 .
- ^ “Sur l’eau” . Banque européenne d’investissement . Récupéré le 13 octobre 2020 .
- ^ “2,4 milliards sans assainissement adéquat. 600 millions sans eau potable. Pouvons-nous y remédier d’ici 2030?” . ieg.worldbankgroup.org . Récupéré le 13 octobre 2020 .
- ^ “Organisation mondiale de la santé. Eau salubre et santé mondiale” . Qui.int. 25 juin 2008. Archivé de l’original le 24 décembre 2010 . Récupéré le 25 juillet 2010 .
- ^ Environnement international du PNUE (2002). Technologie respectueuse de l’environnement pour la gestion des eaux usées et des eaux pluviales: un livre de référence international . Édition IWA. ISBN 978-1-84339-008-4. OCLC 49204666 .
- ^ Ravindranath, Nijavalli H.; En ligneJayant A. Sathaye (2002). Changement climatique et pays en développement . Springer. ISBN 978-1-4020-0104-8. OCLC 231965991 .
- ^ “Les prélèvements d’eau par habitant” . Notre monde en données . Récupéré le 6 mars 2020 .
- ^ “Faits et tendances de l’eau WBCSD” . Archivé de l’original le 1er mars 2012 . Récupéré le 25 juillet 2010 .
- ^ Dieter, Cheryl A.; Maupin, Molly A.; Caldwell, Rodney R.; Harris, Melissa A.; Ivahnenko, Tamara I.; Lovelace, John K.; Barbier, Nancy L.; Linsey, Kristin S. (2018). “Utilisation estimée de l’eau aux États-Unis en 2015” . Circulaire . Enquête géologique des États-Unis. p. 76. doi : 10.3133/cir1441 .
- ^ Gleick, PH; En lignePalaniappan, M. (2010). “Le pic de l’eau” (PDF) . Actes de l’Académie nationale des sciences . 107 (125): 11155–11162. Bibcode : 2010PNAS..10711155G . doi : 10.1073/pnas.1004812107 . PMC 2895062 . PMID 20498082 . Archivé (PDF) de l’original le 8 novembre 2011 . Récupéré le 11 octobre 2011 .
- ^ Communiqué de presse des Nations Unies POP / 952 (13 mars 2007). La population mondiale augmentera de 2,5 milliards d’ici 2050 Archivé le 27 juillet 2014 sur la Wayback Machine
- ^ , Molden, D. (Ed). De l’eau pour l’alimentation, de l’eau pour la vie : une évaluation complète de la gestion de l’eau dans l’agriculture . Earthscan/IWMI, 2007.
- ^ Chartres, C. et Varma, S. (2010) Hors d’eau. De l’abondance à la rareté et comment résoudre les problèmes d’eau dans le monde . FT Appuyez sur (États-Unis).
- ^ Chapagain, AK; Hoekstra, AY; Savenije, HHG; Guatam, R. (septembre 2005). “L’empreinte eau de la consommation de coton” (PDF) . Institut IHE de Delft pour l’éducation relative à l’eau . Archivé (PDF) de l’original le 26 mars 2019 . Récupéré le 24 octobre 2019 .
- ↑ Décret relatif aux poids et aux mesures. 18 germinal an 3 (7 avril 1795) Archivé le 25 février 2013 à la Wayback Machine . Décret relatif aux poids et mesures (en français). quartier-rural.org
- ^ ici L’Histoire Du Mètre, La Détermination De L’Unité De Poids Archivé le 25 juillet 2013 à la Wayback Machine . histoire.du.metre.free.fr
- ^ Re : Quel pourcentage du corps humain est composé d’eau ? Archivé le 25 novembre 2007 à la Wayback Machine Jeffrey Utz, MD, The MadSci Network
- ^ “Une vie saine dans l’eau” . BBC. Archivé de l’original le 1er janvier 2007 . Récupéré le 1er février 2007 .
- ^ Rhoades RA, Tanner GA (2003). Physiologie médicale (2e éd.). Baltimore : Lippincott Williams & Wilkins. ISBN 978-0-7817-1936-0. OCLC 50554808 .
- ^ Noakes TD; Goodwin N; Rayner BL; et coll. (1985). “Intoxication hydrique : une complication possible lors d’un exercice d’endurance”. Exercice sportif Med Sci . 17 (3): 370–375. doi : 10.1249/00005768-198506000-00012 . PMID 4021781 .
- ^ Noakes TD, Goodwin N, Rayner BL, Branken T, Taylor RK (2005). « L’intoxication hydrique : une complication possible lors d’un exercice d’endurance, 1985 » . Désert Environ Med . 16 (4): 221–227. doi : 10.1580/1080-6032(2005)16[221:WIAPCD]2.0.CO;2 . PMID 16366205 .
- ^ Valtin, Heinz (2002). ” “Boire au moins huit verres d’eau par jour.” Vraiment? Existe-t-il des preuves scientifiques pour « 8 × 8 » ? » (PDF) . American Journal of Physiology. Regulatory, Integrative and Comparative Physiology . 283 (5) : R993–R1004. doi : 10.1152/ajpregu.00365.2002 . PMID 12376390 . S2CID 2256436 Archivé de l’original (PDF) le 22 février 2019.
- ^ Stookey JD, Constant F, Popkin BM, Gardner CD (novembre 2008). “L’eau potable est associée à une perte de poids chez les femmes en surpoids, indépendamment du régime alimentaire et de l’activité”. Obésité . 16 (11): 2481–2488. doi : 10.1038/oby.2008.409 . PMID 18787524 . S2CID 24899383 .
- ^ “Boire de l’eau pour freiner la prise de poids? Un essai clinique confirme l’efficacité d’une méthode simple de contrôle de l’appétit” . www.sciencedaily.com . 23 août 2010. Archivé de l’original le 7 juillet 2017 . Récupéré le 14 mai 2017 .
- ^ Dubnov-Raz G, Constantini NW, Yariv H, Nice S, Shapira N (octobre 2011). “Influence de la consommation d’eau sur la dépense énergétique au repos chez les enfants en surpoids” . Journal international de l’obésité . 35 (10) : 1295–1300. doi : 10.1038/ijo.2011.130 . PMID 21750519 .
- ^ Dennis EA; Dengo AL ; Comber DL; et coll. (février 2010). “La consommation d’eau augmente la perte de poids lors d’une intervention de régime hypocalorique chez les adultes d’âge moyen et plus âgés” . Obésité . 18 (2): 300–307. doi : 10.1038/oby.2009.235 . PMC 2859815 . PMID 19661958 .
- ^ Vij VA, Joshi AS (septembre 2013). “Effet de la” thermogenèse induite par l’eau “sur le poids corporel, l’indice de masse corporelle et la composition corporelle des sujets en surpoids” . Journal de recherche clinique et diagnostique . 7 (9) : 1894–1896. doi : 10.7860/JCDR/2013/5862.3344 . PMC 3809630 . PMID 24179891 .
- ^ Muckelbauer R, Sarganas G, Grüneis A, Müller-Nordhorn J (août 2013). “Association entre la consommation d’eau et les résultats de poids corporel : une revue systématique” . Le tourillon américain de la nutrition clinique . 98 (2): 282–299. doi : 10.3945/ajcn.112.055061 . PMID 23803882 . S2CID 12265434 .
- ^ Eau, constipation, déshydratation et autres fluides Archivé le 4 mars 2015 à la Wayback Machine . Sciencedaily.com. Consulté le 28 septembre 2015.
- ^ Conseil de l’alimentation et de la nutrition, Académie nationale des sciences. Apports nutritionnels recommandés . National Research Council, Reprint and Circular Series, No. 122. 1945. pp. 3–18.
- ^ Médecine, Institut de; Conseil, Nutrition Alimentaire ; Apports, Comité permanent sur l’évaluation scientifique des références alimentaires ; Eau, Groupe d’experts sur les apports nutritionnels de référence pour les électrolytes et (2005). 4 Eau | Apports nutritionnels de référence pour l’eau, le potassium, le sodium, le chlorure et le sulfate | La presse des académies nationales . doi : 10.17226/10925 . ISBN 978-0-309-09169-5. Archivé de l’original le 13 janvier 2017 . Récupéré le 11 janvier 2017 .
- ^ “Eau : combien devriez-vous boire chaque jour ?” . Mayoclinic.com. Archivé de l’original le 4 décembre 2010 . Récupéré le 25 juillet 2010 .
- ^ Conquérir la chimie 4e éd. Publié en 2008
- ^ Maton, Anthéa; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart ; Jill D. Wright (1993). Biologie humaine et santé . Falaises d’Englewood, New Jersey : Prentice Hall. ISBN 978-0-13-981176-0. OCLC 32308337 .
- ^ Unesco (2006). L’eau : une responsabilité partagée . Livres de Berghahn. p. 125 . ISBN 978-1-84545-177-6.
- ↑ Naumann d’ Alnoncourt , Raoul ; Csepei, Lénard-István ; Hävecker, Michael; Girgsdies, Frank ; Schuster, Manfred E; Schlogl, Robert; Trunschke, Annette (2014). “Le réseau de réaction dans l’oxydation du propane sur des catalyseurs d’oxyde MoVTeNb M1 à phase pure” (PDF) . Journal de catalyse . 311 : 369–385. doi : 10.1016/j.jcat.2013.12.008 . manche : 11858/00-001M-0000-0014-F434-5 . Archivé de l’original (PDF) le 15 février 2016 . Récupéré le 14 janvier 2018 .
- ^ Havecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d’Alnoncourt, Raoul; Kolen’Ko, Yury V; Girgsdies, Frank ; Schlogl, Robert; Trunschke, Annette (2012). “Chimie de surface de l’oxyde M1 MoVTeNb en phase pure pendant le fonctionnement de l’oxydation sélective du propane en acide acrylique” (PDF) . Journal de catalyse . 285 : 48–60. doi : 10.1016/j.jcat.2011.09.012 . hdl : 11858/00-001M-0000-0012-1BEB-F . Archivé de l’original (PDF) le 30 octobre 2016 . Récupéré le 14 janvier 2018 .
- ^ Études cinétiques de l’oxydation du propane sur des catalyseurs d’oxydes mixtes à base de Mo et V (PDF) . 2011. Archivé (PDF) de l’original le 20 décembre 2016 . Récupéré le 14 janvier 2018 .
- ^ Amakawa, Kazuhiko; Kolen’Ko, Yury V; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénard-István ; Weinberg, Gisèle; Wrabetz, Sabine; Naumann d’Alnoncourt, Raoul; Girgsdies, Frank ; Prati, Laura; Schlogl, Robert; Trunschke, Annette (2013). “Multifonctionnalité des catalyseurs d’oxyde cristallins MoV (TeNb) M1 dans l’oxydation sélective du propane et de l’alcool benzylique” . Catalyse ACS . 3 (6): 1103–1113. doi : 10.1021/cs400010q . Archivé de l’original le 22 octobre 2018 . Récupéré le 14 janvier 2018 .
- ^ Utilisation de l’eau aux États-Unis , National Atlas.gov Archivé le 14 août 2009 à la Wayback Machine
- ^ “Fiche de données de sécurité : chaux vive” (PDF) . Lhoist Amérique du Nord. 6 août 2012. Archivé (PDF) de l’original le 5 juillet 2016 . Récupéré le 24 octobre 2019 .
- ^ Duff, Sœur Loretto Basil (1916). Un cours sur les arts ménagers : première partie . Whitcomb & Barrows.
- ^ un b Vaclavik, Vickie A. & Christian, Elizabeth W (2007). L’essentiel de la science alimentaire . Springer. ISBN 978-0-387-69939-4.
- ^ un b DeMan, John M (1999). Principes de la chimie alimentaire . Springer. ISBN 978-0-8342-1234-3.
- ^ “Carte montrant le taux de dureté en mg / l sous forme de carbonate de calcium en Angleterre et au Pays de Galles” (PDF) . DEFRA/ Inspection de l’eau potable. 2009. Archivé (PDF) de l’original le 29 mai 2015 . Récupéré le 18 mai 2015 .
- ^ “Dureté de l’eau” . Service géologique américain. 8 avril 2014. Archivé de l’original le 18 mai 2015 . Récupéré le 18 mai 2015 .
- ^ MM Mekonnen; AY Hoekstra (décembre 2010). “L’empreinte eau verte, bleue et grise des animaux de ferme et des produits d’origine animale, série de rapports de recherche sur la valeur de l’eau n ° 48 – Volume 1 : rapport principal” (PDF) . UNESCO – Institut IHE pour l’éducation relative à l’eau. Archivé (PDF) de l’original le 27 mai 2014 . Récupéré le 30 janvier 2014 .
- ^ “Liste modèle OMS des médicaments essentiels” (PDF) . Organisation mondiale de la santé . Octobre 2013. Archivé (PDF) de l’original le 23 avril 2014 . Récupéré le 22 avril 2014 .
- ^ “ALMA améliore considérablement la capacité de rechercher de l’eau dans l’univers” . Archivé de l’original le 23 juillet 2015 . Récupéré le 20 juillet 2015 .
- ^ Melnick, Gary, Harvard-Smithsonian Center for Astrophysics et Neufeld, David, Johns Hopkins University cités dans: “La découverte de la vapeur d’eau près de la nébuleuse d’Orion suggère une origine possible de H20 dans le système solaire (sic)” . La Gazette de l’Université de Harvard . 23 avril 1998. Archivé de l’original le 16 janvier 2000. “Le nuage spatial contient suffisamment d’eau pour remplir les océans de la Terre 1 million de fois” . Titres@Hopkins, JHU. 9 avril 1998. Archivé de l’original le 9 novembre 2007 . Récupéré le 21 avril 2007 . “De l’eau, de l’eau partout : un radiotélescope découvre que l’eau est courante dans l’univers” . La Gazette de l’Université de Harvard . 25 février 1999. Archivé de l’original le 19 mai 2011 . Récupéré le 19 septembre 2010 .( lien archives )
- ^ un b Clavin, Whitney; Buis, Alan (22 juillet 2011). “Les astronomes trouvent le réservoir d’eau le plus grand et le plus éloigné” . NASA . Archivé de l’original le 24 juillet 2011 . Récupéré le 25 juillet 2011 .
- ^ un personnel b (22 juillet 2011). “Les astronomes trouvent la plus grande et la plus ancienne masse d’eau de l’univers” . Space.com . Archivé de l’original le 29 octobre 2011 . Récupéré le 23 juillet 2011 .
- ^ Bova, Ben (13 octobre 2009). Faint Echoes, Distant Stars: La science et la politique de la découverte de la vie au-delà de la Terre . Zondevan. ISBN 9780061854484.
- ^ Solanki, SK; Livingston, W.; Ayres, T. (1994). “Nouvelle lumière sur le cœur des ténèbres de la chromosphère solaire” (PDF) . Sciences . 263 (5143): 64–66. Bibcode : 1994Sci…263…64S . doi : 10.1126/science.263.5143.64 . PMID 17748350 . S2CID 27696504 . Archivé de l’original (PDF) le 7 mars 2019.
- ^ “Les Scientifiques MESSAGER ‘Étonnés’ de Trouver de l’Eau dans l’Atmosphère Mince de Mercure” . Société planétaire. 3 juillet 2008. Archivé de l’original le 6 avril 2010 . Récupéré le 5 juillet 2008 .
- ↑ Bertaux, Jean Loup ; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; et coll. (2007). “Une couche chaude dans la cryosphère de Vénus et des mesures à haute altitude de HF, HCl, H2O et HDO”. Nature . 450 (7170): 646–649. Bibcode : 2007Natur.450..646B . doi : 10.1038/nature05974 . PMID 18046397 . S2CID 4421875 .
- ^ Sridharan, R.; Ahmed, SM; Dasa, Tirta Pratim ; Sreelathaa, P.; Pradeepkumara, P.; Naïka, Neha ; Supriya, Gogulapati (2010). ” Preuve “directe” de l’eau (H2O) dans l’ambiance lunaire ensoleillée de CHACE sur MIP de Chandrayaan I”. Planetary and Space Science . 58 (6): 947. Bibcode : 2010P&SS…58..947S . doi : 10.1016/ j.pss.2010.02.013 .
- ^ Rapp, Donald (28 novembre 2012). Utilisation de ressources extraterrestres pour des missions spatiales habitées sur la Lune ou sur Mars . Springer. p. 78. ISBN 978-3-642-32762-9. Archivé de l’original le 15 juillet 2016 . Récupéré le 9 février 2016 .
- ^ Küppers, M.; O’Rourke, L.; Bockelée-Morvan, D.; Zakharov, V.; Lee, S.; Von Allmen, P.; Carry, B.; Teyssier, D.; Marston, A.; Muller, T.; Crovisier, J.; Barucci, MA; Moreno, R. (23 janvier 2014). “Sources localisées de vapeur d’eau sur la planète naine (1) Cérès”. Nature . 505 (7484): 525–527. Bibcode : 2014Natur.505..525K . doi : 10.1038/nature12918 . PMID 24451541 . S2CID 4448395 .
- ^ Atreya, Sushil K.; Wong, Ah-San (2005). “Nuages couplés et chimie des planètes géantes – Un cas pour les multisondes” (PDF) . Revues des sciences spatiales . 116 (1–2): 121–136. Bibcode : 2005SSRv..116..121A . doi : 10.1007/s11214-005-1951-5 . hdl : 2027.42/43766 . S2CID 31037195 . Archivé (PDF) de l’original le 22 juillet 2011 . Récupéré le 1er avril 2014 .
- ^ Cuisinier, Jia-Rui C.; Gutro, Rob ; Brown, Dwayne; Harrington, JD; Fohn, Joe (12 décembre 2013). “Hubble voit des preuves de vapeur d’eau sur Jupiter Moon” . NASA . Archivé de l’original le 15 décembre 2013 . Récupéré le 12 décembre 2013 .
- ^ Hansen; CJ; et coll. (2006). ” Panache de vapeur d’eau d’Encelade ” (PDF) . Sciences . 311 (5766): 1422–1425. Bib code : 2006Sci …311.1422H . doi : 10.1126/science.1121254 . PMID 16527971 . S2CID 2954801 . Archivé de l’original (PDF) le 18 février 2020.
- ^ Hubbard, WB (1997). “La chimie profonde de Neptune”. Sciences . 275 (5304): 1279–1280. doi : 10.1126/science.275.5304.1279 . PMID 9064785 . S2CID 36248590 .
- ^ Eau trouvée sur une planète lointaine Archivé le 16 juillet 2007 à la Wayback Machine 12 juillet 2007 Par Laura Blue, Time
- ^ Eau trouvée dans l’atmosphère de la planète extrasolaire Archivé le 30 décembre 2010 à la Wayback Machine – Space.com
- ^ Lockwood, Alexandra C; Johnson, John A; Bender, Chad F; Carr, John S; Barman, Travis ; Richert, Alexandre JW ; Blake, Geoffrey A (2014). “Détection directe proche infrarouge de la vapeur d’eau dans Tau Boo B”. Le Journal d’Astrophysique . 783 (2) : L29. arXiv : 1402.0846 . Bibcode : 2014ApJ…783L..29L . doi : 10.1088/2041-8205/783/2/L29 . S2CID 8463125 .
- ^ Clavin, Whitney; Chou, Félicia ; Tisserand, Donna ; Villard; Johnson, Michele (24 septembre 2014). “Les télescopes de la NASA trouvent un ciel clair et de la vapeur d’eau sur une exoplanète” . NASA . Archivé de l’original le 14 janvier 2017 . Récupéré le 24 septembre 2014 .
- ^ un bc Arnold Hanslmeier (le 29 septembre 2010). L’eau dans l’Univers . Springer Science et médias d’affaires. p. 159–. ISBN 978-90-481-9984-6. Archivé de l’original le 15 juillet 2016 . Récupéré le 9 février 2016 .
- ^ “Hubble trace des signaux subtils d’eau sur des mondes brumeux” . NASA . 3 décembre 2013. Archivé de l’original le 6 décembre 2013 . Récupéré le 4 décembre 2013 .
- ^ un b Andersson, Jonas (juin 2012). L’eau dans les atmosphères stellaires “Faut-il une nouvelle image pour expliquer le comportement atmosphérique de l’eau dans les étoiles géantes rouges ?” Archivé le 13 février 2015 à l’ observatoire Wayback Machine Lund, Université de Lund, Suède
- ^ Herschel trouve des océans d’eau dans le disque d’une étoile à proximité Archivé le 19 février 2015 à la Wayback Machine . NASA.gov (20 octobre 2011). Consulté le 28 septembre 2015.
- ^ “JPL” . Laboratoire de propulsion à réaction de la NASA (JPL) . Archivé de l’original le 4 juin 2012.
- ^ Lloyd, Robin. « Vapeur d’eau, comètes possibles, étoile en orbite trouvée » , 11 juillet 2001, Space.com . Récupéré le 15 décembre 2006. Archivé le 23 mai 2009 à la Wayback Machine
- ^ “La NASA confirme la preuve que l’eau liquide coule sur Mars d’aujourd’hui” . NASA . 28 septembre 2015 . Récupéré le 22 juin 2020 .
- ^ Platt, Jane; Bell, Brian (3 avril 2014). “Les actifs spatiaux de la NASA détectent l’océan à l’intérieur de la lune de Saturne” . NASA . Archivé de l’original le 3 avril 2014 . Récupéré le 3 avril 2014 .
- ^ Iess, L.; Stevenson, DJ ; Parisi, M.; Hemingway, D.; Jacobson, RA; Lune, Jonathan I.; Nimmo, F.; Armstrong, JW ; Asmar, sud-ouest ; Ducci, M.; Tortora, P. (4 avril 2014). “Le champ de gravité et la structure intérieure d’Encelade” (PDF) . Sciences . 344 (6179): 78–80. Bibcode : 2014Sci…344…78I . doi : 10.1126/science.1250551 . PMID 24700854 . S2CID 28990283 . Archivé (PDF) de l’original le 2 décembre 2017 . Récupéré le 14 juillet 2019 .
- ^ Dunaeva, AN; Kronrod, Virginie ; Kuskov, OL (2013). “Modèles numériques de l’intérieur de Titan avec l’océan souterrain” (PDF) . 44e Conférence sur les sciences lunaires et planétaires (2013) (1719): 2454. Bibcode : 2013LPI….44.2454D . Archivé (PDF) de l’original le 23 mars 2014 . Récupéré le 23 mars 2014 .
- ^ Tritt, Charles S. (2002). “Possibilité de vie sur Europa” . École d’ingénierie de Milwaukee. Archivé de l’original le 9 juin 2007 . Récupéré le 10 août 2007 .
- ^ Dunham, Will. (3 mai 2014) Ganymède, la lune de Jupiter, pourrait avoir des couches d’océan en « club sandwich » | Reuters Archivé le 3 mai 2014 sur la Wayback Machine . Sur.Reuters.com. Consulté le 28 septembre 2015.
- ^ Carr, MH (1996). L’eau sur Mars . New York : presse universitaire d’Oxford. p. 197.
- ^ Bibring, J.-P.; Langevin, Yves; Poulet, François; Gendrin, Aline; Gondet, Brigitte; Berthé, Michel; Soufflot, Alain; Drosart, Pierre; Combes, Michel; Bellucci, Giancarlo; Moroz, Vassili; Mangold, Nicolas; Schmitt, Bernard; L’équipe Oméga, la ; Erard, S.; Forni, O.; Manaud, N.; Poulleau, G.; Encrenaz, T.; Fouchet, T.; Melchiorri, R.; Altieri, F.; Formisano, V.; Bonello, G.; Fonti, S.; Capaccioni, F.; Cerroni, P.; Coradini, A.; Kottsov, V.; et coll. (2004). “Glace d’eau pérenne identifiée dans la calotte polaire sud de Mars”. Nature . 428 (6983): 627–630. Bibcode : 2004Natur.428..627B . doi : 10.1038/nature02461 . PMID 15024393 . S2CID 4373206 .
- ^ Versteckt in Glasperlen: Auf dem Mond gibt es Wasser – Wissenschaft – Archivé le 10 juillet 2008 à la Wayback Machine Der Spiegel – Nachrichten
- ^ Molécules d’eau trouvées sur la Lune Archivées le 27 septembre 2009 à la Wayback Machine , NASA, 24 septembre 2009
- ^ McCord, TB; Sotin, C. (21 mai 2005). “Cérès : évolution et état actuel” . Tourillon de recherche géophysique : Planètes . 110 (E5) : E05009. Bibcode : 2005JGRE..110.5009M . doi : 10.1029/2004JE002244 .
- ^ Thomas, PC; Parker, J.Wm. ; McFadden, LA ; et coll. (2005). “Différenciation de l’astéroïde Cérès comme révélé par sa forme”. Nature . 437 (7056): 224–226. Bibcode : 2005Natur.437..224T . doi : 10.1038/nature03938 . PMID 16148926 . S2CID 17758979 . {{cite journal}}: CS1 maint: multiple names: authors list (link)
- ^ Carey, Bjorn (7 septembre 2005). “Le plus gros astéroïde pourrait contenir plus d’eau douce que la Terre” . SPACE.com. Archivé de l’original le 18 décembre 2010 . Récupéré le 16 août 2006 .
- ^ Chang, Kenneth (12 mars 2015). “Soudain, il semble que l’eau est partout dans le système solaire” . New York Times . Archivé de l’original le 12 août 2018 . Récupéré le 12 mars 2015 .
- ^ Kuskov, OL; Kronrod, Virginie (2005). “Structure interne d’Europe et Callisto”. Icare . 177 (2): 550–369. Bibcode : 2005Icar..177..550K . doi : 10.1016/j.icarus.2005.04.014 .
- ^ Showman, AP; Malhotra, R. (1er octobre 1999). “Les satellites galiléens” (PDF) . Sciences . 286 (5437): 77–84. doi : 10.1126/science.286.5437.77 . PMID 10506564 . S2CID 9492520 . Archivé de l’original (PDF) le 12 avril 2020.
- ^ un moineau b , Giles (2006). Le système solaire . Presse de Thunder Bay. ISBN 978-1-59223-579-7.
- ^ Tobie, G.; Grasset, Olivier; Lune, Jonathan I.; Mocquet, Antoine; Sotin, Christophe (2005). “La structure interne de Titan déduite d’un modèle thermique-orbital couplé”. Icare . 175 (2): 496–502. Bibcode : 2005Icar..175..496T . doi : 10.1016/j.icarus.2004.12.007 .
- ^ Verbiscer, A.; français, R.; Showalter, M.; Helfenstein, P. (9 février 2007). “Encelade: Cosmic Graffiti Artist Pris en flagrant délit”. Sciences . 315 (5813): 815. Bibcode : 2007Sci…315..815V . doi : 10.1126/science.1134681 . PMID 17289992 . S2CID 21932253 . (matériel complémentaire en ligne, tableau S1)
- ^ Greenberg, J. Mayo (1998). “Fabriquer un noyau de comète”. Astronomie et astrophysique . 330 : 375. Bibcode : 1998A&A…330..375G .
- ^ “Boules de neige sales dans l’espace” . Ciel étoilé. Archivé de l’original le 29 janvier 2013 . Récupéré le 15 août 2013 .
- ^ EL Gibb; MJ Maman ; N. Dello Russo; MA DiSanti et K. Magee-Sauer (2003). “Méthane dans les comètes du nuage d’Oort”. Icare . 165 (2): 391–406. Bibcode : 2003Icar..165..391G . doi : 10.1016/S0019-1035(03)00201-X .
- ^ NASA, ” MESSENGER Finds New Evidence for Water Ice at Mercury’s Poles Archivé le 30 novembre 2012 à la Wayback Machine “, NASA , 29 novembre 2012.
- ^ Thomas, PC; Burns, JA; Helfenstein, P.; Squires, S.; Veverka, J.; Porco, C.; Tortue, EP ; McEwen, A.; Denk, T.; Giesef, B.; Roatschf, T.; Johnsong, TV ; Jacobsong, RA (octobre 2007). “Formes des satellites glacés saturniens et leur signification” (PDF) . Icare . 190 (2): 573–584. Bibcode : 2007Icar..190..573T . doi : 10.1016/j.icarus.2007.03.012 . Archivé (PDF) de l’original le 27 septembre 2011 . Récupéré le 15 décembre 2011 .
- ^ Une eau étrange se cache à l’intérieur des planètes géantes Archivé le 15 avril 2015 à la Wayback Machine , New Scientist , 1er septembre 2010, Magazine numéro 2776.
- ^ Ehlers, E.; Krafft, T, éd. (2001). “JCI Dooge. “Gestion intégrée des ressources en eau” “. Comprendre le système terrestre : compartiments, processus et interactions . Springer. p. 116.
- ^ “Zone Habitable” . L’Encyclopédie de l’Astrobiologie, de l’Astronomie et des Vols spatiaux . Archivé de l’original le 23 mai 2007 . Récupéré le 26 avril 2007 .
- ^ Shiga, David (6 mai 2007). “Monde extraterrestre étrange fait de “glace chaude” ” . New Scientist . Archivé de l’ original le 6 juillet 2008 . Récupéré le 28 mars 2010 .
- ^ Aguilar, David A. (16 décembre 2009). “Les astronomes trouvent la Super-Terre en utilisant une technologie amateur prête à l’emploi” . Centre d’astrophysique Harvard-Smithsonian. Archivé de l’original le 7 avril 2012 . Récupéré le 28 mars 2010 .
- ^ un b “MDG Report 2008” (PDF) . Archivé (PDF) de l’original le 27 août 2010 . Récupéré le 25 juillet 2010 .
- ^ Kulshreshtha, SN (1998). “Une perspective mondiale des ressources en eau jusqu’en 2025”. Gestion des ressources en eau . 12 (3): 167–184. doi : 10.1023/A:1007957229865 . S2CID 152322295 .
- ^ “Charting Our Water Future: Economic frameworks to inform decision-making” (PDF). Archived from the original (PDF) on 5 July 2010. Retrieved 25 July 2010.
- ^ The Millennium Development Goals Report Archived 27 August 2010 at the Wayback Machine, United Nations, 2008
- ^ Lomborg, Björn (2001). The Skeptical Environmentalist (PDF). Cambridge University Press. p. 22. ISBN 978-0-521-01068-9. Archived from the original (PDF) on 25 July 2013.
- ^ UNESCO, (2006), Water, a shared responsibility. The United Nations World Water Development Report 2 Archived 6 January 2009 at the Wayback Machine
- ^ Welle, Katharina; Evans, Barbara; Tucker, Josephine, and Nicol, Alan (2008) Is water lagging behind on Aid Effectiveness? Archived 27 July 2011 at the Wayback Machine
- ^ “Search Results”. International Water Management Institute (IWMI). Archived from the original on 5 June 2013. Retrieved 3 March 2016.
- ^ Nations, United. “World Water Day”. United Nations. Retrieved 10 September 2020.
- ^ “About | World Oceans Day Online Portal”. www.unworldoceansday.org. Retrieved 10 September 2020.
- ^ Z. Wahrman, Miryam (2016). The Hand Book: Surviving in a Germ-Filled World. University Press of New England. p. 46-48. ISBN 9781611689556. Water plays a role in other Christian rituals as well. … In the early days of Christianity, two to three centuries after Christ, the lavabo (Latin for “I wash myself”), a ritual handwashing vessel and bowl, was introduced as part of Church service.
- ^ Chambers’s encyclopædia, Lippincott & Co (1870). p. 394.
- ^ Altman, Nathaniel (2002) Sacred water: the spiritual source of life. pp. 130–133. ISBN 1-58768-013-0.
- ^ “ĀB i. The concept of water in ancient Iran – Encyclopaedia Iranica”. www.iranicaonline.org. Encyclopedia Iranica. Archived from the original on 16 May 2018. Retrieved 19 September 2018.
- ^ Lindberg, D. (2008). The beginnings of western science: The European scientific tradition in a philosophical, religious, and institutional context, prehistory to A.D. 1450. (2nd ed.). Chicago: University of Chicago Press.
- ^ “Internet Sacred Text Archive Home”. Sacred-texts.com. Archived from the original on 12 July 2010. Retrieved 25 July 2010.
- ^ Guanzi : Shui Di – Chinese Text Project Archived 6 November 2014 at archive.today. Ctext.org. Retrieved on 28 September 2015.
- ^ Vartanian, Hrag (3 October 2011). “Manhattan Cathedral Explores Water in Art”. Hyperallergic. Retrieved 14 December 2020.
- ^ Rev. Dr. A. Kowalski, James (6 October 2011). “The Cathedral of St. John the Divine and The Value of Water”. huffingtonpost.com. Huffington Post. Retrieved 14 December 2020.
- ^ Foster, Fredericka. “The Value of Water at St John the Divine”. vimeo.com. Sara Karl. Retrieved 14 December 2020.
- ^ Miller, Reverend Canon, Tom. “The Value of Water Exhibition”. UCLA Art Science Center. Retrieved 14 December 2020.
- ^ Madel, Robin (6 December 2017). “Through Art, the Value of Water Expressed”. Huffington Post. Retrieved 16 December 2020.
- ^ Cotter, Mary (4 October 2011). “Manhattan Cathedral Examines “The Value of Water” in a New Star-Studded Art Exhibition”. inhabitat.com. inhabitat. Retrieved 14 December 2020.
- ^ “Influential Figures Dr. Charlotte Cote”. tseshaht.com. Tseshaht First Nation [c̓išaaʔatḥ]. Retrieved 19 August 2021.
- ^ “10 years of the human rights to water and sanitation”. United Nations. Un – Water Family News. 27 February 2020. Retrieved 19 August 2021.
- ^ “Water is sacred’: 10 visual artists reflect on the human right to water”. The Guardian. 4 August 2020. Retrieved 19 August 2021.
- ^ “dihydrogen monoxide”. Archived from the original on 2 May 2018. Retrieved 2 May 2018.
Further reading
- Ball, Philip (2001). Life’s matrix : a biography of water (1st ed.). Farrar, Straus, and Giroux. ISBN 9780520230088.
- Debenedetti, PG., and HE Stanley, “Supercooled and Glassy Water”, Physics Today 56 (6), pp. 40–46 (2003). Downloadable PDF (1.9 MB)
- Franks, Felix (2007). Water : a matrix of life (2nd ed.). Royal Society of Chemistry. ISBN 9781847552341.
- Gleick, PH., (editor), The World’s Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. (published every two years, beginning in 1998.) The World’s Water, Island Press
- Jones, Oliver A.; Lester, John N.; Voulvoulis, Nick (2005). “Pharmaceuticals: a threat to drinking water?”. Trends in Biotechnology. 23 (4): 163–167. doi:10.1016/j.tibtech.2005.02.001. PMID 15780706.
- Journal of Contemporary Water Research & Education
- Postel, S., Last Oasis: Facing Water Scarcity. W.W. Norton and Company, New York. 1992
- Reisner, M., Cadillac Desert: The American West and Its Disappearing Water. Penguin Books, New York. 1986.
- United Nations World Water Development Report. Produced every three years.
- St. Fleur, Nicholas. The Water in Your Glass Might Be Older Than the Sun. “The water you drink is older than the planet you’re standing on.” The New York Times (15 April 2016)
External links
waterat Wikipedia’s sister projects
-
![]() Definitions from Wiktionary
Definitions from Wiktionary -
![]() Media from Commons
Media from Commons -
![]() News from Wikinews
News from Wikinews -
![]() Quotations from Wikiquote
Quotations from Wikiquote -
![]() Texts from Wikisource
Texts from Wikisource -
![]() Textbooks from Wikibooks
Textbooks from Wikibooks -
![]() Resources from Wikiversity
Resources from Wikiversity
- OECD Water statistics
- The World’s Water Data Page
- FAO Comprehensive Water Database, AQUASTAT
- The Water Conflict Chronology: Water Conflict Database
- Water science school (USGS)
- Portal to The World Bank’s strategy, work and associated publications on water resources
- America Water Resources Association Archived 24 March 2018 at the Wayback Machine
- Water on the web
- Water structure and science Archived 28 December 2014 at the Wayback Machine
- Why water is one of the weirdest things in the universe BBC Ideas, Video, 3:16 minutes, 2019
- The chemistry of water (NSF special report)
- The International Association for the Properties of Water and Steam
- H2O: La molécule qui nous a créés, un documentaire PBS 2020