Datation au radiocarbone
La datation au radiocarbone (également appelée datation au carbone ou datation au carbone 14 ) est une méthode permettant de déterminer l’âge d’un objet contenant des matières organiques en utilisant les propriétés du radiocarbone , un isotope Radioactif du carbone .
La méthode a été développée à la fin des années 1940 à l’ Université de Chicago par Willard Libby . Elle est basée sur le fait que le radiocarbone (14
C ) est constamment créé dans l’atmosphère terrestre par l’interaction des rayons cosmiques avec l’ azote atmosphérique . La résultante14
Le C se combine avec l’ oxygène atmosphérique pour former du dioxyde de carbone Radioactif , qui est incorporé dans les plantes par photosynthèse ; les animaux acquièrent alors14
C en mangeant les plantes. Lorsque l’animal ou la plante meurt, il cesse d’échanger du carbone avec son environnement, et par la suite la quantité de14
C qu’il contient commence à diminuer à mesure que le14
C subit une désintégration radioactive . Mesurer la quantité de14
C dans un échantillon d’une plante ou d’un animal mort, comme un morceau de bois ou un fragment d’os, fournit des informations qui peuvent être utilisées pour calculer quand l’animal ou la plante est mort. Plus un échantillon est ancien, moins14
C il doit être détecté, et parce que la demi-vie de14
C (la période de temps après laquelle la moitié d’un échantillon donné se sera décomposé) est d’environ 5 730 ans, les dates les plus anciennes qui peuvent être mesurées de manière fiable par ce processus remontent à environ 50 000 ans, bien que des méthodes de préparation spéciales permettent parfois une analyse précise des échantillons possibles. Libby a reçu le prix Nobel de chimie pour ses travaux en 1960.
Des recherches sont en cours depuis les années 1960 pour déterminer quelle est la proportion de14
C dans l’atmosphère a été au cours des cinquante mille dernières années. Les données résultantes, sous la forme d’une courbe d’étalonnage, sont maintenant utilisées pour convertir une mesure donnée de radiocarbone dans un échantillon en une estimation de l’âge calendaire de l’échantillon. D’autres corrections doivent être apportées pour tenir compte de la proportion de14
C dans différents types d’organismes (fractionnement), et les différents niveaux de14
C dans toute la biosphère (effets réservoirs). Des complications supplémentaires proviennent de la combustion de Combustibles fossiles tels que le charbon et le pétrole, et des essais nucléaires en surface effectués dans les années 1950 et 1960. Parce que le temps qu’il faut pour convertir les matières biologiques en Combustibles fossiles est considérablement plus long que le temps qu’il faut pour14
C pour se désintégrer en dessous des niveaux détectables, les Combustibles fossiles ne contiennent presque pas14
C. _ En conséquence, à partir de la fin du 19ème siècle, il y a eu une baisse notable de la proportion de14
C lorsque le dioxyde de carbone généré par la combustion de Combustibles fossiles a commencé à s’accumuler dans l’atmosphère. Inversement, les essais nucléaires ont augmenté la quantité de14
C dans l’atmosphère, qui a atteint un maximum vers 1965 de presque le double de la quantité présente dans l’atmosphère avant les essais nucléaires.
La mesure du radiocarbone était à l’origine effectuée par des appareils de comptage bêta, qui comptaient la quantité de Rayonnement bêta émis par la désintégration14
Atomes C dans un échantillon. Plus récemment, la spectrométrie de masse par accélérateur est devenue la méthode de choix ; ça compte tout le14
Les atomes de C dans l’échantillon et pas seulement les quelques atomes qui se désintègrent pendant les mesures ; il peut donc être utilisé avec des échantillons beaucoup plus petits (aussi petits que des graines de plantes individuelles) et donne des résultats beaucoup plus rapidement. Le développement de la datation au radiocarbone a eu un impact profond sur l’ archéologie . En plus de permettre une datation plus précise dans les sites archéologiques que les méthodes précédentes, cela permet de comparer les dates des événements sur de grandes distances. Les histoires de l’archéologie se réfèrent souvent à son impact comme la “révolution du radiocarbone”. La datation au radiocarbone a permis de dater des transitions clés de la préhistoire, comme la fin de la dernière période glaciaire , et le début du néolithique et de l’âge du bronze dans différentes régions.
Arrière-plan
Histoire
En 1939, Martin Kamen et Samuel Ruben du Radiation Laboratory de Berkeley ont commencé des expériences pour déterminer si l’un des éléments communs dans la matière organique avait des isotopes avec des demi-vies suffisamment longues pour être utiles à la recherche biomédicale. Ils ont synthétisé14
C à l’aide de l’accélérateur cyclotron du laboratoire et découvrit rapidement que la demi-vie de l’atome était beaucoup plus longue qu’on ne le pensait auparavant. [1] Cela a été suivi par une prédiction de Serge A. Korff , alors employé à l’ Institut Franklin de Philadelphie , selon laquelle l’interaction des neutrons thermiques avec14
N dans la haute atmosphère créerait14
C. _ [note 1] [3] [4] On pensait auparavant que14
C serait plus susceptible d’être créé par des deutérons interagissant avec13
C. _ [1] À un certain moment pendant la Seconde Guerre mondiale, Willard Libby , qui était alors à Berkeley, a appris les recherches de Korff et a conçu l’idée qu’il pourrait être possible d’utiliser le radiocarbone pour la datation. [3] [4]
En 1945, Libby a déménagé à l’ Université de Chicago , où il a commencé ses travaux sur la datation au radiocarbone. Il a publié un article en 1946 dans lequel il proposait que le carbone dans la matière vivante pourrait inclure14
C ainsi que du carbone non Radioactif. [5] [6] Libby et plusieurs collaborateurs ont procédé à des expériences avec du méthane collecté dans les stations d’épuration de Baltimore, et après avoir enrichi isotopiquement leurs échantillons, ils ont pu démontrer qu’ils contenaient14
C. _ En revanche, le méthane créé à partir du pétrole n’a montré aucune activité radiocarbone en raison de son âge. Les résultats ont été résumés dans un article dans Science en 1947, dans lequel les auteurs ont commenté que leurs résultats impliquaient qu’il serait possible de dater des matériaux contenant du carbone d’origine organique. [5] [7]
Libby et James Arnold ont ensuite testé la théorie de la datation au radiocarbone en analysant des échantillons d’âges connus. Par exemple, deux échantillons prélevés sur les tombes de deux rois égyptiens, Zoser et Sneferu , datés indépendamment de 2625 avant JC plus ou moins 75 ans, ont été datés par mesure au radiocarbone d’une moyenne de 2800 avant JC plus ou moins 250 ans. Ces résultats ont été publiés dans Science en décembre 1949. [8] [9] [note 2] Dans les 11 ans suivant leur annonce, plus de 20 laboratoires de datation au radiocarbone avaient été créés dans le monde. [11] En 1960, Libby a reçu le prix Nobel de chimie pour ce travail. [5]
Détails physiques et chimiques
Dans la nature, le carbone existe sous forme de trois isotopes, deux stables, non radioactifs : le carbone-12 (12
C ) et le carbone 13 (13
C ) et le carbone 14 Radioactif (14
C ), également appelé « radiocarbone ». La demi-vie de14
C (le temps qu’il faut pour la moitié d’une quantité donnée de14
C pour se désintégrer ) est d’environ 5 730 ans, on peut donc s’attendre à ce que sa concentration dans l’atmosphère diminue sur des milliers d’années, mais14
Le carbone est constamment produit dans la basse stratosphère et la haute troposphère , principalement par les rayons cosmiques galactiques et, dans une moindre mesure, par les rayons cosmiques solaires. [5] [12] Ces rayons cosmiques génèrent des neutrons lorsqu’ils traversent l’atmosphère qui peuvent frapper l’Azote-14 (14
N ) atomes et les transformer en14
C. _ [5] La réaction nucléaire suivante est la principale voie par laquelle14
C est créé :
n + 14
7N→ 14
6C+p
où n représente un neutron et p représente un proton . [13] [14] [note 3]
Une fois produit, le14
C se combine rapidement avec l’oxygène (O) dans l’atmosphère pour former d’abord du monoxyde de carbone ( CO ), [14] et finalement du dioxyde de carbone ( CO2). [15]
14
C + O2→ 14
CO + O 14
CO + OH → 14
CO2+H
Le dioxyde de carbone ainsi produit se diffuse dans l’atmosphère, se dissout dans l’océan et est capté par les plantes via la photosynthèse . Les animaux mangent les plantes et, en fin de compte, le radiocarbone est distribué dans toute la biosphère . Le rapport de14
C à12
C représente environ 1,25 partie de14
C à 10 12 parties de12
C. _ [16] De plus, environ 1 % des atomes de carbone appartiennent à l’isotope stable13
C. _ [5]
L’équation de la désintégration radioactive de14
C est : [17]
14
6C→ 14
7N+ e−
+ ve
En émettant une particule bêta (un électron , e − ) et un électron Antineutrino (ve), l’un des neutrons du14
Le noyau C se transforme en proton et le14
Le noyau C revient à l’isotope stable (non Radioactif)14
N. _ [18]
Des principes
Au cours de sa vie, une plante ou un animal est en équilibre avec son environnement en échangeant du carbone soit avec l’atmosphère, soit par son alimentation. Il aura donc la même proportion de14
C comme l’atmosphère, ou dans le cas d’animaux ou de plantes marins, avec l’océan. Une fois mort, il cesse d’acquérir14
C , mais le14
C dans son matériel biologique à ce moment-là continuera à se décomposer, et donc le rapport de14
C à12
C dans ses restes diminuera progressivement. Car14
C se désintègre à un rythme connu, la proportion de radiocarbone peut être utilisée pour déterminer combien de temps s’est écoulé depuis qu’un échantillon donné a cessé d’échanger du carbone – plus l’échantillon est ancien, moins14
C sera laissé. [16]
L’équation régissant la désintégration d’un isotope Radioactif est : [5]
N = N 0 e − λ t {displaystyle N=N_{0},e^{-lambda t},} 
où N 0 est le nombre d’atomes de l’isotope dans l’échantillon d’origine (au temps t = 0, lorsque l’organisme dont l’échantillon a été prélevé est mort), et N est le nombre d’atomes restants après le temps t . [5] λ est une constante qui dépend de l’isotope particulier ; pour un isotope donné, elle est égale à l’ inverse de la durée de vie moyenne, c’est-à -dire la durée moyenne ou prévue de survie d’un atome donné avant de subir une désintégration radioactive. [5] La durée de vie moyenne, notée τ , de14
C est 8 267 ans, [note 4] donc l’équation ci-dessus peut être réécrite comme suit : [20]
t = dans ( N 0 / N ) ⋅ 8267 years {displaystyle t=ln(N_{0}/N)cdot {text{8267 ans}}} 
L’échantillon est supposé avoir à l’origine le même14
C /12
rapport C comme le rapport dans l’atmosphère, et puisque la taille de l’échantillon est connue, le nombre total d’atomes dans l’échantillon peut être calculé, donnant N 0 , le nombre de14
atomes C dans l’échantillon d’origine. Mesure de N , le nombre de14
atomes C actuellement dans l’échantillon, permet le calcul de t , l’âge de l’échantillon, en utilisant l’équation ci-dessus. [16]
La demi-vie d’un isotope Radioactif (généralement désignée par t 1/2 ) est un concept plus familier que la durée de vie moyenne, donc bien que les équations ci-dessus soient exprimées en termes de durée de vie moyenne, il est plus courant de citer le valeur de14
demi-vie de C que sa vie moyenne. La valeur actuellement acceptée pour la demi-vie de14
C est 5 730 ± 40 ans. [5] Cela signifie qu’après 5 730 ans, seulement la moitié de la14
C restera; un quart restera après 11 460 ans ; un huitième après 17 190 ans ; etc.
Les calculs ci-dessus reposent sur plusieurs hypothèses, telles que le niveau de14
Le C dans l’atmosphère est resté constant dans le temps. [5] En fait, le niveau de14
C dans l’atmosphère a varié de manière significative et par conséquent, les valeurs fournies par l’équation ci-dessus doivent être corrigées en utilisant des données provenant d’autres sources. [21] Cela se fait par des courbes d’étalonnage (discutées ci-dessous), qui convertissent une mesure de14
C dans un échantillon en un âge calendaire estimé. Les calculs comportent plusieurs étapes et incluent une valeur intermédiaire appelée « âge radiocarbone », qui est l’âge en « années radiocarbone » de l’échantillon : un âge exprimé en années radiocarbone signifie qu’aucune courbe d’étalonnage n’a été utilisée − les calculs en années radiocarbone supposons que l’atmosphère14
C /12
Le rapport C n’a pas changé au fil du temps. [22] [23]
Le calcul des âges radiocarbone nécessite également la valeur de la demi-vie pour14
C. _ Dans l’article de Libby de 1949, il a utilisé une valeur de 5720 ± 47 ans, basée sur les recherches d’Engelkemeir et al. [24] C’était remarquablement proche de la valeur moderne, mais peu de temps après, la valeur acceptée a été révisée à 5568 ± 30 ans, [25] et cette valeur a été utilisée pendant plus d’une décennie. Il a été révisé à nouveau au début des années 1960 à 5 730 ± 40 ans, [26] [27] ce qui signifiait que de nombreuses dates calculées dans des articles publiés avant cela étaient incorrectes (l’erreur dans la demi-vie est d’environ 3 %). [note 5]Par souci de cohérence avec ces premiers articles, il a été convenu lors de la conférence sur le radiocarbone de 1962 à Cambridge (Royaume-Uni) d’utiliser la “demi-vie de Libby” de 5568 ans. Les âges radiocarbone sont toujours calculés à l’aide de cette demi-vie et sont connus sous le nom d ‘«âge radiocarbone conventionnel». Étant donné que la courbe d’étalonnage (IntCal) rend également compte des14
concentration de C en utilisant cet âge conventionnel, tout âge conventionnel calibré par rapport à la courbe IntCal produira un âge calibré correct. Lorsqu’une date est citée, le lecteur doit être conscient que s’il s’agit d’une date non calibrée (un terme utilisé pour les dates données en années radiocarbone), elle peut différer considérablement de la meilleure estimation de la date réelle du calendrier, à la fois parce qu’elle utilise la mauvaise valeur pour la demi-vie de14
C , et parce qu’aucune correction (calibrage) n’a été appliquée pour la variation historique de14
C dans l’atmosphère au fil du temps. [22] [23] [29] [note 6]
Réservoir d’échange de carbone

 Version simplifiée du réservoir d’échange de carbone, montrant les proportions de carbone et l’activité relative du 14
Version simplifiée du réservoir d’échange de carbone, montrant les proportions de carbone et l’activité relative du 14
C dans chaque réservoir [5] [note 7]
Le carbone est distribué dans l’atmosphère, la biosphère et les océans ; ceux-ci sont appelés collectivement le réservoir d’échange de carbone, [32] et chaque composant est également appelé individuellement un réservoir d’échange de carbone. Les différents éléments du réservoir d’échange de carbone varient dans la quantité de carbone qu’ils stockent et dans le temps qu’il faut pour14
C généré par les rayons cosmiques pour se mélanger complètement avec eux. Cela affecte le rapport de14
C à12
C dans les différents réservoirs, et donc les âges radiocarbone des échantillons provenant de chaque réservoir. [5] L’atmosphère, qui est là où14
C est généré, contient environ 1,9% du carbone total dans les réservoirs, et le14
C il contient des mélanges en moins de sept ans. [33] Le rapport de14
C à12
C dans l’atmosphère est pris comme référence pour les autres réservoirs : si un autre réservoir a un rapport de14
C à12
C , cela indique que le carbone est plus ancien et donc que soit une partie du14
Le carbone s’est décomposé ou le réservoir reçoit du carbone qui n’est pas à la ligne de base atmosphérique. [21] La surface de l’océan en est un exemple : elle contient 2,4 % du carbone du réservoir d’échange, mais il n’y en a qu’environ 95 %14
C comme on pourrait s’y attendre si le rapport était le même que dans l’atmosphère. [5] Le temps qu’il faut pour que le carbone de l’atmosphère se mélange à la surface de l’océan n’est que de quelques années, [34] mais les eaux de surface reçoivent également de l’eau de l’océan profond, qui contient plus de 90 % du carbone dans le réservoir. [21] L’eau de l’océan profond met environ 1 000 ans à recirculer dans les eaux de surface, et donc les eaux de surface contiennent une combinaison d’eau plus ancienne, avec des14
C , et de l’eau récemment à la surface, avec14
C en équilibre avec l’atmosphère. [21]
Les créatures vivant à la surface de l’océan ont le même14
ratios C comme l’eau dans laquelle ils vivent, et en raison de la réduction14
C /12
rapport C , l’âge au radiocarbone de la vie marine est généralement d’environ 400 ans. [35] [36] Les organismes terrestres sont en équilibre plus étroit avec l’atmosphère et ont la même14
C /12
rapport C comme l’atmosphère. [5] [note 8] Ces organismes contiennent environ 1,3 % du carbone du réservoir ; les organismes marins ont une masse inférieure à 1% de ceux terrestres et ne sont pas représentés sur le diagramme. La matière organique morte accumulée, tant végétale qu’animale, dépasse la masse de la biosphère d’un facteur de près de 3, et comme cette matière n’échange plus de carbone avec son environnement, elle a une14
C /12
Rapport C inférieur à celui de la biosphère. [5]
Considérations de rencontres
La variation dans le14
C /12
Le rapport C dans différentes parties du réservoir d’échange de carbone signifie qu’un simple calcul de l’âge d’un échantillon basé sur la quantité de14
C qu’il contient donnera souvent un résultat incorrect. Il existe plusieurs autres sources d’erreur possibles qui doivent être prises en compte. Les erreurs sont de quatre types généraux :
- variations dans la14
C /12
rapport C dans l’atmosphère, à la fois géographiquement et dans le temps ; - fractionnement isotopique;
- variations dans la14
C /12
rapport C dans différentes parties du réservoir ; - contamination.
Variation atmosphérique
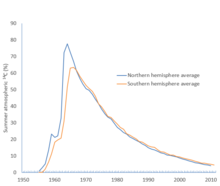
 Atmosphérique 14
Atmosphérique 14
C pour les hémisphères nord et sud, montrant un pourcentage d’excès au-dessus des niveaux d’avant la bombe. Le Traité d’interdiction partielle des essais est entré en vigueur le 10 octobre 1963. [37]
Dans les premières années d’utilisation de la technique, on comprenait qu’elle dépendait de l’atmosphère14
C /12
Le rapport C est resté le même au cours des quelques milliers d’années précédentes. Pour vérifier l’exactitude de la méthode, plusieurs artefacts datables par d’autres techniques ont été testés ; les résultats des tests étaient en accord raisonnable avec l’âge réel des objets. Au fil du temps, cependant, des écarts ont commencé à apparaître entre la chronologie connue des plus anciennes dynasties égyptiennes et les dates au radiocarbone des artefacts égyptiens. Ni la chronologie égyptienne préexistante ni la nouvelle méthode de datation au radiocarbone ne pouvaient être considérées comme exactes, mais une troisième possibilité était que le14
C /12
Le rapport C avait changé avec le temps. La question a été résolue par l’ étude des cernes d’arbres : [38] [39] [40] la comparaison de séries de cernes d’arbres superposées a permis la construction d’une séquence continue de données de cernes d’arbres couvrant 8 000 ans. [38] (Depuis lors, la série de données sur les cernes a été étendue à 13 900 ans.) [29] Dans les années 1960, Hans Suess a pu utiliser la séquence des cernes pour montrer que les dates dérivées du radiocarbone étaient cohérentes avec les dates assignées par les égyptologues. Cela a été possible parce que bien que les plantes annuelles, comme le maïs, aient une14
C /12
rapport C qui reflète le rapport atmosphérique au moment de leur croissance, les arbres n’ajoutent de la matière qu’à leur cerne d’arbre le plus externe au cours d’une année donnée, tandis que les cernes d’arbre internes ne reçoivent pas leur14
C reconstitué et à la place commencer à perdre14
C par décomposition. Par conséquent, chaque anneau conserve un enregistrement de l’atmosphère14
C /12
Rapport C de l’année où il a poussé. La datation au carbone du bois des cernes des arbres eux-mêmes fournit le contrôle nécessaire sur l’atmosphère14
C /12
Rapport C : avec un échantillon de date connue, et une mesure de la valeur de N (le nombre d’atomes de14
C restant dans l’échantillon), l’équation de datation au carbone permet le calcul de N 0 – le nombre d’atomes de14
C dans l’échantillon au moment où l’anneau de l’arbre s’est formé – et donc le14
C /12
rapport C dans l’atmosphère à ce moment-là. [38] [40] Muni des résultats de la datation au carbone des cernes des arbres, il est devenu possible de construire des courbes d’étalonnage destinées à corriger les erreurs causées par la variation dans le temps de la14
C /12
rapport C. [41] Ces courbes sont décrites plus en détail ci- dessous .
Le charbon et le pétrole ont commencé à être brûlés en grande quantité au cours du 19e siècle. Les deux sont suffisamment vieux pour contenir peu ou pas de14
C et, par conséquent, le CO2libéré considérablement dilué l’atmosphère14
C /12
rapport C. La datation d’un objet du début du XXe siècle donne donc une date apparente plus ancienne que la date réelle. Pour la même raison,14
Les concentrations de C au voisinage des grandes villes sont inférieures à la moyenne atmosphérique. Cet effet des Combustibles fossiles (également connu sous le nom d’effet Suess, d’après Hans Suess, qui l’a signalé pour la première fois en 1955) ne représenterait qu’une réduction de 0,2 % de14
C si le carbone supplémentaire provenant des Combustibles fossiles était distribué dans tout le réservoir d’échange de carbone, mais en raison du long délai de mélange avec l’océan profond, l’effet réel est une réduction de 3 %. [38] [42]
Un effet beaucoup plus important provient des essais nucléaires en surface, qui ont libéré un grand nombre de neutrons dans l’atmosphère, entraînant la création de14
C. _ De 1950 environ à 1963, date à laquelle les essais nucléaires atmosphériques ont été interdits, on estime que plusieurs tonnes de14
C ont été créés. Si tout ce supplément14
C s’était immédiatement répandu sur l’ensemble du réservoir d’échange de carbone, il aurait entraîné une augmentation du14
C /12
ratio C de quelques pour cent seulement, mais l’effet immédiat a été de presque doubler la quantité de14
C dans l’atmosphère, avec un niveau maximal en 1964 pour l’hémisphère nord et en 1966 pour l’hémisphère sud. Le niveau a depuis baissé, car cette impulsion de bombe ou “bombe de carbone” (comme on l’appelle parfois) s’infiltre dans le reste du réservoir. [38] [42] [43] [37]
Fractionnement isotopique
La photosynthèse est le principal processus par lequel le carbone se déplace de l’atmosphère vers les êtres vivants. Dans les voies photosynthétiques12
C est absorbé un peu plus facilement que13
C , qui à son tour est plus facilement absorbé que14
C. _ L’absorption différentielle des trois isotopes du carbone conduit à13
C /12
C et14
C /12
Rapports de C dans les plantes qui diffèrent des rapports dans l’atmosphère. Cet effet est connu sous le nom de fractionnement isotopique. [44] [45]
Pour déterminer le degré de fractionnement qui a lieu dans une usine donnée, les quantités des deux12
C et13
Les isotopes C sont mesurés et le résultat13
C /12
Le rapport C est ensuite comparé à un rapport standard connu sous le nom de PDB. [remarque 9] Le13
C /12
Le rapport C est utilisé à la place de14
C /12
C parce que le premier est beaucoup plus facile à mesurer, et le second peut être facilement déduit : l’épuisement de13
C par rapport à12
C est proportionnel à la différence des masses atomiques des deux isotopes, donc l’épuisement pour14
C est le double de l’épuisement de13
C. _ [21] Le fractionnement de13
C , appelé δ 13 C , se calcule comme suit : [44]
δ C 13 = ( ( C 13 C 12 ) sample ( C 13 C 12 ) standard − 1 ) × 1000 {displaystyle delta {ce {^{13}C}}=left({frac {left({frac {{ce {^{13}C}}}{{ce {^{ 12}C}}}}right)_{text{échantillon}}}{left({frac {{ce {^{13}C}}}{{ce {^{12}C} }}}right)_{text{standard}}}}-1right)times 1000} 
‰
où le signe ‰ indique les parties par millier . [44] Étant donné que la norme PDB contient une proportion inhabituellement élevée de13
C , [note 10] δ 13 C le plus mesuréles valeurs sont négatives.

 Moutons de North Ronaldsay sur la plage de North Ronaldsay . En hiver, ces moutons mangent des algues, qui ont un δ 13 C plus élevécontenu que l’herbe; les échantillons de ces moutons ont un δ 13 C valeur d’environ −13 ‰, ce qui est beaucoup plus élevé que pour les moutons qui se nourrissent d’herbes. [44]
Moutons de North Ronaldsay sur la plage de North Ronaldsay . En hiver, ces moutons mangent des algues, qui ont un δ 13 C plus élevécontenu que l’herbe; les échantillons de ces moutons ont un δ 13 C valeur d’environ −13 ‰, ce qui est beaucoup plus élevé que pour les moutons qui se nourrissent d’herbes. [44]
| Matériel | Typique δ 13 CPortée |
|---|---|
| APB | 0‰ |
| Plancton marin | −22‰ à −17‰ [45] |
| Usines C3 | −30‰ à −22‰ [45] |
| Usines C4 | −15‰ à −9‰ [45] |
| CO atmosphérique2 | −8‰ [44] |
| CO marin2 | −32‰ à −13‰ [45] |
Pour les organismes marins, les détails des réactions de photosynthèse sont moins bien compris, et le δ 13 Cles valeurs pour les organismes photosynthétiques marins dépendent de la température. À des températures plus élevées, le CO2a une faible solubilité dans l’eau, ce qui signifie qu’il y a moins de CO2disponible pour les réactions photosynthétiques. Dans ces conditions, le fractionnement est réduit, et à des températures supérieures à 14 °C, le δ 13 Cles valeurs sont proportionnellement plus élevées, tandis qu’à des températures plus basses, le CO2devient plus soluble et donc plus disponible pour les organismes marins. [45] Le δ 13 Cla valeur pour les animaux dépend de leur régime alimentaire. Un animal qui mange des aliments avec un δ 13 C élevéles valeurs auront un δ 13 C plus élevéque celui qui mange des aliments avec un δ 13 C inférieurvaleurs. [44] Les propres processus biochimiques de l’animal peuvent également avoir un impact sur les résultats : par exemple, les minéraux osseux et le collagène osseux ont généralement une concentration plus élevée de13
C que l’on trouve dans l’alimentation de l’animal, bien que pour des raisons biochimiques différentes. L’enrichissement de l’os13
C implique également que le matériel excrété est appauvri en13
C par rapport au régime alimentaire. [48]
Depuis13
C représente environ 1 % du carbone d’un échantillon, le13
C /12
Le rapport C peut être mesuré avec précision par spectrométrie de masse . [21] Valeurs typiques de δ 13 Cont été trouvés expérimentalement pour de nombreuses plantes, ainsi que pour différentes parties d’animaux comme le collagène osseux , mais lors de la datation d’un échantillon donné, il est préférable de déterminer le δ 13 Cvaleur pour cet échantillon directement que de se fier aux valeurs publiées. [44]
L’échange de carbone entre le CO atmosphérique2et le carbonate à la surface de l’océan est également soumis à un fractionnement, avec14
C dans l’atmosphère plus probablement que12
C se dissoudre dans l’océan. Le résultat est une augmentation globale de la14
C /12
ratio de C dans l’océan de 1,5 %, par rapport à la14
C /12
Rapport C dans l’atmosphère. Cette augmentation de14
La concentration en C annule presque exactement la diminution causée par la remontée d’eau (contenant de l’ancien, et donc14
C -appauvri en carbone) de l’océan profond, de sorte que des mesures directes de14
Le rayonnement C est similaire aux mesures pour le reste de la biosphère. La correction du fractionnement isotopique, comme cela est fait pour toutes les dates au radiocarbone pour permettre la comparaison entre les résultats de différentes parties de la biosphère, donne un âge apparent d’environ 400 ans pour l’eau de surface de l’océan. [21] [36]
Effets de réservoir
L’hypothèse originale du réservoir d’échange de Libby supposait que le14
C /12
Le rapport C dans le réservoir d’échange est constant partout dans le monde, [49] mais on a depuis découvert qu’il existe plusieurs causes de variation du rapport à travers le réservoir. [35]
Effet marin
Le CO2dans l’atmosphère se transfère à l’océan en se dissolvant dans l’eau de surface sous forme d’ions carbonate et bicarbonate; en même temps, les ions carbonate de l’eau retournent dans l’air sous forme de CO2. [49] Ce processus d’échange apporte14
C de l’atmosphère dans les eaux de surface de l’océan, mais le14
Le C ainsi introduit met longtemps à percoler dans tout le volume de l’océan. Les parties les plus profondes de l’océan se mélangent très lentement avec les eaux de surface, et le mélange est inégal. Le principal mécanisme qui amène l’eau profonde à la surface est l’upwelling, qui est plus fréquent dans les régions proches de l’équateur. La remontée d’eau est également influencée par des facteurs tels que la topographie du fond de l’océan local et des côtes, le climat et la configuration des vents. Globalement, le mélange des eaux profondes et de surface prend beaucoup plus de temps que le mélange du CO atmosphérique2avec les eaux de surface et, par conséquent, l’eau de certaines zones océaniques profondes a un âge au radiocarbone apparent de plusieurs milliers d’années. La remontée d’eau mélange cette « ancienne » eau avec l’eau de surface, donnant à l’eau de surface un âge apparent d’environ plusieurs centaines d’années (après correction du fractionnement). [35] Cet effet n’est pas uniforme – l’effet moyen est d’environ 400 ans, mais il existe des écarts locaux de plusieurs centaines d’années pour des zones géographiquement proches les unes des autres. [35] [36] Ces écarts peuvent être pris en compte dans l’étalonnage, et les utilisateurs de logiciels tels que CALIB peuvent fournir en entrée la correction appropriée pour l’emplacement de leurs échantillons. [15]L’effet s’applique également aux organismes marins tels que les coquillages et aux mammifères marins tels que les baleines et les phoques, qui ont des âges au radiocarbone qui semblent avoir des centaines d’années. [35]
Effet hémisphère
Les hémisphères nord et sud ont des systèmes de circulation atmosphérique suffisamment indépendants l’un de l’autre pour qu’il y ait un décalage notable dans le temps de mélange entre les deux. L’atmospherique14
C /12
Le rapport C est plus faible dans l’hémisphère sud, avec un âge supplémentaire apparent d’environ 40 ans pour les résultats radiocarbone du sud par rapport au nord. [note 11] C’est parce que la plus grande surface de l’océan dans l’hémisphère sud signifie qu’il y a plus de carbone échangé entre l’océan et l’atmosphère que dans le nord. Étant donné que l’océan de surface est appauvri en14
C à cause de l’effet marin,14
C est éliminé de l’atmosphère sud plus rapidement que dans le nord. [35] [50] L’effet est renforcé par une forte remontée d’eau autour de l’Antarctique. [12]
Autres effets
Si le carbone de l’eau douce provient en partie du carbone vieilli, comme les roches, le résultat sera une réduction de la14
C /12
Rapport C dans l’eau. Par exemple, les rivières qui passent sur du calcaire , composé principalement de carbonate de calcium , acquerront des ions carbonate. De même, les eaux souterraines peuvent contenir du carbone dérivé des roches qu’elles traversent. Ces roches sont généralement si vieilles qu’elles ne contiennent plus d’éléments mesurables.14
C , donc ce carbone abaisse la14
C /12
rapport C de l’eau dans laquelle il pénètre, ce qui peut entraîner des âges apparents de milliers d’années pour l’eau affectée et les plantes et les organismes d’eau douce qui y vivent. [21] C’est ce qu’on appelle l’effet de l’ eau dure parce qu’il est souvent associé aux ions calcium, qui sont caractéristiques de l’eau dure; d’autres sources de carbone telles que l’ humus peuvent produire des résultats similaires, et peuvent également réduire l’âge apparent si elles sont d’origine plus récente que l’échantillon. [35] L’effet varie considérablement et il n’y a pas de compensation générale qui puisse être appliquée ; des recherches supplémentaires sont généralement nécessaires pour déterminer la taille de la compensation, par exemple en comparant l’âge au radiocarbone des coquilles d’eau douce déposées avec la matière organique associée.[51]
Les Éruptions volcaniques éjectent de grandes quantités de carbone dans l’air. Le carbone est d’origine géologique et n’a pas de14
C , donc le14
C /12
Le rapport C à proximité du volcan est déprimé par rapport aux zones environnantes. Les volcans endormis peuvent également émettre du carbone vieilli. Les plantes qui photosynthétisent ce carbone ont également moins de14
C /12
Rapports C : par exemple, les plantes du voisinage de la caldeira de Furnas aux Açores se sont avérées avoir des âges apparents allant de 250 ans à 3320 ans. [52]
Contamination
Toute addition de carbone à un échantillon d’un âge différent entraînera une date de mesure inexacte. La contamination par le carbone moderne donne l’impression qu’un échantillon est plus jeune qu’il ne l’est réellement : l’effet est plus important pour les échantillons plus anciens. Si un échantillon vieux de 17 000 ans est contaminé de sorte que 1 % de l’échantillon est du carbone moderne, il semblera avoir 600 ans de moins ; pour un échantillon vieux de 34 000 ans, la même quantité de contamination entraînerait une erreur de 4 000 ans. Contamination par du vieux carbone, sans résidu14
C , provoque une erreur dans l’autre sens indépendamment de l’âge – un échantillon contaminé par 1% de vieux carbone semblera avoir environ 80 ans de plus qu’il ne l’est réellement, quelle que soit la date de l’échantillon. [53]
Échantillons
Les échantillons destinés à la datation doivent être convertis sous une forme adaptée à la mesure de la14
teneur en C ; cela peut signifier une conversion sous forme gazeuse, liquide ou solide, selon la technique de mesure à utiliser. Avant que cela puisse être fait, l’échantillon doit être traité pour éliminer toute contamination et tout constituant indésirable. [54] Cela comprend l’élimination des contaminants visibles, tels que les radicelles qui peuvent avoir pénétré l’échantillon depuis son enfouissement. [54] Des lavages alcalins et acides peuvent être utilisés pour éliminer la contamination par les acides humiques et les carbonates, mais il faut veiller à ne pas retirer la partie de l’échantillon qui contient le carbone à tester. [55]
Considérations matérielles
- Il est courant de réduire un échantillon de bois au seul composant cellulosique avant le test, mais comme cela peut réduire le volume de l’échantillon à 20% de sa taille d’origine, des tests sur le bois entier sont souvent également effectués. Le charbon de bois est souvent testé mais nécessitera probablement un traitement pour éliminer les contaminants. [54] [55]
- L’os non brûlé peut être testé; il est habituel de le dater à l’aide de collagène , la fraction protéique qui reste après avoir éliminé le matériau structurel de l’os. L’hydroxyproline , l’un des acides aminés constitutifs des os, était autrefois considérée comme un indicateur fiable car sa présence n’était connue que dans les os, mais elle a depuis été détectée dans les eaux souterraines. [54]
- Pour l’os brûlé, la testabilité dépend des conditions dans lesquelles l’os a été brûlé. Si l’os a été chauffé dans des Conditions réductrices , il (et la matière organique associée) peut avoir été carbonisé. Dans ce cas, l’échantillon est souvent utilisable. [54]
- Les coquilles des organismes marins et terrestres sont presque entièrement constituées de carbonate de calcium, sous forme d’ aragonite ou de calcite , ou d’un mélange des deux. Le carbonate de calcium est très susceptible de se dissoudre et de recristalliser; le matériau recristallisé contiendra du carbone provenant de l’environnement de l’échantillon, qui peut être d’origine géologique. Si le test de la coque recristallisée est inévitable, il est parfois possible d’identifier le matériau de la coque d’origine à partir d’une séquence de tests. [56] Il est également possible de tester la conchyoline , une protéine organique trouvée dans la coquille, mais elle ne constitue que 1 à 2 % du matériau de la coquille. [55]
- Les trois principaux composants de la tourbe sont l’Acide humique , les humines et l’Acide fulvique . Parmi celles-ci, les humines donnent la date la plus fiable car elles sont insolubles dans les alcalis et moins susceptibles de contenir des contaminants provenant de l’environnement de l’échantillon. [55] Une difficulté particulière avec la tourbe séchée est l’élimination des radicelles, qui sont probablement difficiles à distinguer de l’échantillon. [54]
- Le sol contient de la matière organique, mais en raison de la probabilité de contamination par des acides humiques d’origine plus récente, il est très difficile d’obtenir des datations radiocarbone satisfaisantes. Il est préférable de tamiser le sol pour les fragments d’origine organique et de dater les fragments avec des méthodes qui tolèrent des échantillons de petite taille. [55]
- D’autres matériaux qui ont été datés avec succès comprennent l’ivoire, le papier, les textiles, les graines et les grains individuels, la paille provenant des briques de boue et les restes de nourriture carbonisés trouvés dans la poterie. [55]
Préparation et taille
En particulier pour les échantillons plus anciens, il peut être utile d’enrichir la quantité de14
C dans l’échantillon avant le test. Cela peut être fait avec une colonne de diffusion thermique. Le processus prend environ un mois et nécessite un échantillon environ dix fois plus grand que ce qui serait nécessaire autrement, mais il permet une mesure plus précise de la14
C /12
rapport C dans le matériel ancien et prolonge l’âge maximum qui peut être rapporté de manière fiable. [57]
Une fois la contamination éliminée, les échantillons doivent être transformés en une forme adaptée à la technologie de mesure à utiliser. [58] Lorsque du gaz est nécessaire, le CO2est largement utilisé. [58] [59] Pour les échantillons à utiliser dans les compteurs à scintillation liquide , le carbone doit être sous forme liquide ; l’échantillon est généralement converti en benzène . Pour la spectrométrie de masse par accélérateur , les cibles en graphite solide sont les plus courantes, bien que le CO gazeux2peut également être utilisé. [58] [60]
La quantité de matériel nécessaire pour les tests dépend du type d’échantillon et de la technologie utilisée. Il existe deux types de technologies de test : les détecteurs qui enregistrent la radioactivité, appelés compteurs bêta, et les spectromètres de masse à accélérateur. Pour les compteurs bêta, un échantillon pesant au moins 10 grammes (0,35 once) est généralement requis. [58] La spectrométrie de masse par accélérateur est beaucoup plus sensible et des échantillons contenant aussi peu que 0,5 milligramme de carbone peuvent être utilisés. [61]
Mesure et résultats

 Mesure 14
Mesure 14
C est maintenant le plus souvent effectué avec un spectromètre de masse à accélérateur
Pendant des décennies après que Libby ait effectué les premières expériences de datation au radiocarbone, la seule façon de mesurer la14
C dans un échantillon était de détecter la désintégration radioactive d’atomes de carbone individuels. [58] Dans cette approche, ce qui est mesuré est l’activité, en nombre d’événements de désintégration par unité de masse par période de temps, de l’échantillon. [59] Cette méthode est également connue sous le nom de “comptage bêta”, car ce sont les particules bêta émises par la décomposition14
atomes C qui sont détectés. [62] À la fin des années 1970, une approche alternative est devenue disponible : compter directement le nombre de14
C et12
Atomes C dans un échantillon donné, via la spectrométrie de masse par accélérateur, généralement appelée AMS. [58] AMS compte les14
C /12
rapport C directement, au lieu de l’activité de l’échantillon, mais les mesures d’activité et14
C /12
Le rapport C peut être converti exactement l’un dans l’autre. [59] Pendant un certain temps, les méthodes de comptage bêta étaient plus précises que l’AMS, mais l’AMS est maintenant plus précis et est devenu la méthode de choix pour les mesures du radiocarbone. [63] [64] En plus d’une précision améliorée, l’AMS présente deux autres avantages significatifs par rapport au comptage bêta : il peut effectuer des tests précis sur des échantillons beaucoup trop petits pour le comptage bêta, et il est beaucoup plus rapide – une précision de 1 % peut être atteinte. en quelques minutes avec AMS, ce qui est beaucoup plus rapide que ce qui serait réalisable avec l’ancienne technologie. [65]
Comptage bêta
Le premier détecteur de Libby était un compteur Geiger de sa propre conception. Il a converti le carbone de son échantillon en noir de lampe (suie) et en a enduit la surface intérieure d’un cylindre. Ce cylindre a été inséré dans le compteur de manière à ce que le fil de comptage soit à l’intérieur du cylindre échantillon, afin qu’il n’y ait pas de matière entre l’échantillon et le fil. [58] Tout matériau d’interposition aurait interféré avec la détection de la radioactivité, puisque les particules bêta émises par la désintégration14
C sont si faibles que la moitié sont arrêtées par une épaisseur de 0,01 mm d’aluminium. [59]
La méthode de Libby fut bientôt remplacée par des compteurs proportionnels à gaz , qui étaient moins affectés par le carbone de la bombe (le supplément14
C créé par des essais d’armes nucléaires). Ces compteurs enregistrent les bouffées d’ionisation causées par les particules bêta émises par la décomposition14
atomes C ; les éclats sont proportionnels à l’énergie de la particule, de sorte que d’autres sources d’ionisation, telles que le rayonnement de fond, peuvent être identifiées et ignorées. Les compteurs sont entourés d’un blindage en plomb ou en acier, pour éliminer le rayonnement de fond et réduire l’incidence des rayons cosmiques. De plus, des détecteurs d’anticoïncidence sont utilisés ; ces événements enregistrés à l’extérieur du compteur et tout événement enregistré simultanément à l’intérieur et à l’extérieur du compteur est considéré comme un événement étranger et ignoré. [59]
L’autre technologie couramment utilisée pour mesurer14
L’activité C est le comptage par scintillation liquide, qui a été inventé en 1950, mais qui a dû attendre le début des années 1960, lorsque des méthodes efficaces de synthèse du benzène ont été développées, pour devenir compétitive avec le comptage des gaz ; après 1970, les compteurs de liquide sont devenus le choix technologique le plus courant pour les laboratoires de datation nouvellement construits. Les compteurs fonctionnent en détectant les éclairs de lumière causés par les particules bêta émises par14
C car ils interagissent avec un agent fluorescent ajouté au benzène. Comme les compteurs à gaz, les compteurs à scintillation liquide nécessitent un blindage et des compteurs anticoïncidence. [66] [67]
Pour le compteur proportionnel à gaz et le compteur à scintillation liquide, ce qui est mesuré est le nombre de particules bêta détectées dans une période de temps donnée. Étant donné que la masse de l’échantillon est connue, elle peut être convertie en une mesure standard d’activité en unités de comptage par minute par gramme de carbone (cpm/g C), ou en becquerels par kg (Bq/kg C, en Unités SI ). Chaque appareil de mesure est également utilisé pour mesurer l’activité d’un échantillon à blanc – un échantillon préparé à partir de carbone suffisamment ancien pour n’avoir aucune activité. Cela fournit une valeur pour le rayonnement de fond, qui doit être soustraite de l’activité mesurée de l’échantillon à dater pour obtenir l’activité attribuable uniquement à cet échantillon.14
C. _ De plus, un échantillon avec une activité standard est mesuré, pour fournir une base de comparaison. [68]
Spectrométrie de masse par accélérateur
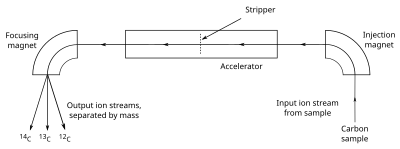
 Disposition schématique simplifiée d’un spectromètre de masse à accélérateur utilisé pour compter les isotopes du carbone pour la datation au carbone
Disposition schématique simplifiée d’un spectromètre de masse à accélérateur utilisé pour compter les isotopes du carbone pour la datation au carbone
AMS compte les atomes de14
C et12
C dans un échantillon donné, déterminer la14
C /12
rapport C directement. L’échantillon, souvent sous forme de graphite, est amené à émettre des ions C − (atomes de carbone à une seule charge négative), qui sont injectés dans un accélérateur . Les ions sont accélérés et passés à travers un décapant, qui élimine plusieurs électrons de sorte que les ions émergent avec une charge positive. Les ions, qui peuvent avoir de 1 à 4 charges positives (C + à C 4+ ), selon la conception de l’accélérateur, sont ensuite passés à travers un aimant qui courbe leur trajectoire ; les ions les plus lourds sont moins incurvés que les plus légers, de sorte que les différents isotopes émergent sous forme de flux d’ions séparés. Un détecteur de particules enregistre alors le nombre d’ions détectés dans le14
flux C , mais puisque le volume de12
C (et13
C , nécessaire pour l’étalonnage) est trop élevé pour la détection d’ions individuels, les comptages sont déterminés en mesurant le courant électrique créé dans une coupelle de Faraday . [69] La grande charge positive induite par le décapant force des molécules telles que13
CH , qui a un poids assez proche de14
C pour interférer avec les mesures, pour les dissocier, afin qu’elles ne soient pas détectées. [70] La plupart des machines AMS mesurent également le δ 13 C de l’échantillon, à utiliser pour calculer l’âge au radiocarbone de l’échantillon. [71] L’utilisation de l’AMS, par opposition à des formes plus simples de spectrométrie de masse, est nécessaire en raison de la nécessité de distinguer les isotopes du carbone d’autres atomes ou molécules de masse très proche, tels que14
N et13
CH . [58] Comme pour le comptage bêta, des échantillons blancs et des échantillons standard sont utilisés. [69] Deux types différents de blanc peuvent être mesurés : un échantillon de carbone mort qui n’a subi aucun traitement chimique, pour détecter tout bruit de fond de la machine, et un échantillon connu sous le nom de blanc de processus fabriqué à partir de carbone mort qui est transformé en matériau cible exactement de la même manière que l’échantillon qui est daté. Quelconque14
Le signal C du blanc de fond de la machine est susceptible d’être causé soit par des faisceaux d’ions qui n’ont pas suivi le chemin prévu à l’intérieur du détecteur, soit par des hydrures de carbone tels que12
CH2ou alors13
CH . UN14
Le signal C du blanc de procédé mesure la quantité de contamination introduite lors de la préparation de l’échantillon. Ces mesures sont utilisées dans le calcul ultérieur de l’âge de l’échantillon. [72]
Calculs
Les calculs à effectuer sur les mesures effectuées dépendent de la technologie utilisée, puisque les compteurs bêta mesurent la radioactivité de l’échantillon tandis que l’AMS détermine le rapport des trois isotopes différents du carbone dans l’échantillon. [72]
Pour déterminer l’âge d’un échantillon dont l’activité a été mesurée par comptage bêta, il faut trouver le rapport de son activité à l’activité de l’étalon. Pour le déterminer, un échantillon vierge (de carbone ancien ou mort) est mesuré, et un échantillon d’activité connue est mesuré. Les échantillons supplémentaires permettent de détecter et de corriger des erreurs telles que le rayonnement de fond et les erreurs systématiques dans la configuration du laboratoire. [68] Le matériau d’échantillon standard le plus courant est l’acide oxalique, tel que le standard HOxII, dont 1 000 lb ont été préparés par le National Institute of Standards and Technology (NIST) en 1977 à partir de récoltes de betteraves françaises. [73] [74]
Les résultats des tests AMS se présentent sous la forme de ratios de12
C ,13
C , et14
C , qui servent à calculer Fm, la “fraction moderne”. Celui-ci est défini comme le rapport entre le14
C /12
rapport C dans l’échantillon et le14
C /12
rapport C dans le carbone moderne, qui est à son tour défini comme le14
C /12
C ratio qui aurait été mesuré en 1950 s’il n’y avait pas eu d’effet combustible fossile. [72]
Les résultats du comptage bêta et de l’AMS doivent être corrigés du fractionnement. Cela est nécessaire car différents matériaux du même âge, qui en raison du fractionnement ont naturellement des14
C /12
les ratios C , sembleront être d’âges différents parce que le14
C /12
Le rapport C est pris comme indicateur de l’âge. Pour éviter cela, toutes les mesures de radiocarbone sont converties en la mesure qui aurait été vue si l’échantillon avait été fait de bois, qui a un δ connu13
Valeur C de −25‰. [22]
Une fois le corrigé14
C /12
Le rapport C est connu, un “âge radiocarbone” est calculé en utilisant : [75]
Age = − ln ( Fm ) ⋅ 8033 years {displaystyle {text{Âge}}=-ln({text{Fm}})cdot 8033{text{ans}}} 
Le calcul utilise 8 033 ans, la durée de vie moyenne dérivée de la demi-vie de Libby de 5 568 ans, et non 8 267 ans, la durée de vie moyenne dérivée de la valeur moderne plus précise de 5 730 ans. La valeur de Libby pour la demi-vie est utilisée pour maintenir la cohérence avec les premiers résultats des tests au radiocarbone ; les courbes d’étalonnage incluent une correction pour cela, de sorte que l’exactitude des âges calendaires rapportés finaux est assurée. [75]
Erreurs et fiabilité
La fiabilité des résultats peut être améliorée en allongeant le temps de test. Par exemple, si le comptage des désintégrations bêta pendant 250 minutes est suffisant pour donner une erreur de ± 80 ans, avec une confiance de 68 %, alors doubler le temps de comptage à 500 minutes permettra à un échantillon d’en avoir seulement la moitié.14
C à mesurer avec le même terme d’erreur de 80 ans. [76]
La datation au radiocarbone est généralement limitée à la datation d’échantillons ne dépassant pas 50 000 ans, car les échantillons plus anciens que ceux-ci n’ont pas suffisamment14
C pour être mesurable. Des dates plus anciennes ont été obtenues en utilisant des techniques spéciales de préparation d’échantillons, de grands échantillons et des temps de mesure très longs. Ces techniques peuvent permettre de mesurer des dates jusqu’à 60 000 et dans certains cas jusqu’à 75 000 ans avant le présent. [63]
Les dates au radiocarbone sont généralement présentées avec une plage d’un écart type (généralement représenté par la lettre grecque sigma comme 1σ) de chaque côté de la moyenne. Cependant, une plage de dates de 1σ ne représente qu’un niveau de confiance de 68 %, de sorte que l’âge réel de l’objet mesuré peut se situer en dehors de la plage de dates citée. Cela a été démontré en 1970 par une expérience menée par le laboratoire de radiocarbone du British Museum, dans laquelle des mesures hebdomadaires ont été prises sur le même échantillon pendant six mois. Les résultats variaient considérablement (bien que de manière cohérente avec une distribution normaled’erreurs dans les mesures), et comprenait plusieurs plages de dates (de confiance 1σ) qui ne se chevauchaient pas. Les mesures comprenaient une avec une plage d’environ 4250 à environ 4390 ans, et une autre avec une plage d’environ 4520 à environ 4690. [77]
Des erreurs de procédure peuvent également entraîner des erreurs dans les résultats. Si 1% du benzène dans un échantillon de référence moderne s’évapore accidentellement, le comptage par scintillation donnera un âge radiocarbone trop jeune d’environ 80 ans. [78]
Étalonnage

 La souche d’un très vieux pin bristlecone. Les anneaux de croissance de ces arbres (entre autres) sont utilisés pour construire des courbes d’étalonnage.
La souche d’un très vieux pin bristlecone. Les anneaux de croissance de ces arbres (entre autres) sont utilisés pour construire des courbes d’étalonnage.
Les calculs donnés ci-dessus produisent des dates en années radiocarbone : c’est-à-dire des dates qui représentent l’âge que l’échantillon aurait si14
C /12
Le rapport C avait été constant historiquement. [79] Bien que Libby ait souligné dès 1955 la possibilité que cette hypothèse soit incorrecte, ce n’est que lorsque des écarts ont commencé à s’accumuler entre les âges mesurés et les dates historiques connues pour les artefacts qu’il est devenu clair qu’une correction devrait être appliquée à âges au radiocarbone pour obtenir des dates calendaires. [80]
Pour produire une courbe qui peut être utilisée pour relier les années civiles aux années radiocarbone, une séquence d’échantillons datés de manière sûre est nécessaire qui peut être testée pour déterminer leur âge radiocarbone. L’étude des cernes des arbres a conduit à la première séquence de ce type : des morceaux de bois individuels présentent des séquences caractéristiques de cernes dont l’épaisseur varie en raison de facteurs environnementaux tels que la quantité de précipitations au cours d’une année donnée. Ces facteurs affectent tous les arbres d’une zone, c’est pourquoi l’examen des séquences de cernes provenant du vieux bois permet d’identifier les séquences qui se chevauchent. De cette manière, une séquence ininterrompue d’anneaux d’arbres peut être étendue loin dans le passé. La première séquence publiée de ce type, basée sur des cernes de pin bristlecone, a été créée par Wesley Ferguson . [40]Hans Suess a utilisé ces données pour publier la première courbe d’étalonnage pour la datation au radiocarbone en 1967. [38] [39] [80] La courbe a montré deux types de variation par rapport à la ligne droite : une fluctuation à long terme avec une période d’environ 9 000 ans, et une variation à plus court terme, souvent appelée “wiggles”, avec une période de plusieurs décennies. Suess a dit qu’il avait tracé la ligne montrant les tremblements par ” schwung cosmique “, par lequel il voulait dire que les variations étaient causées par des forces extraterrestres. On ne savait pas pendant un certain temps si les tremblements étaient réels ou non, mais ils sont maintenant bien établis. [38] [39] [81] Ces fluctuations à court terme de la courbe d’étalonnage sont maintenant connues sous le nom d’effets de Vries, d’après Hessel de Vries. [82]
Une courbe d’étalonnage est utilisée en prenant la date radiocarbone rapportée par un laboratoire et en lisant à partir de cette date sur l’axe vertical du graphique. Le point où cette ligne horizontale croise la courbe donnera l’âge civil de l’échantillon sur l’axe horizontal. C’est l’inverse de la façon dont la courbe est construite : un point sur le graphique est dérivé d’un échantillon d’âge connu, tel qu’un anneau d’arbre ; lorsqu’il est testé, l’âge au radiocarbone qui en résulte donne un point de données pour le graphique. [41]

 La courbe de l’hémisphère nord de IntCal20. À partir de 2020, il s’agit de la version la plus récente de la courbe d’étalonnage standard. La ligne diagonale montre où se situerait la courbe si les âges radiocarbone et les âges calendaires étaient les mêmes. [83]
La courbe de l’hémisphère nord de IntCal20. À partir de 2020, il s’agit de la version la plus récente de la courbe d’étalonnage standard. La ligne diagonale montre où se situerait la courbe si les âges radiocarbone et les âges calendaires étaient les mêmes. [83]
Au cours des trente années suivantes, de nombreuses courbes d’étalonnage ont été publiées en utilisant une variété de méthodes et d’approches statistiques. [41] Celles-ci ont été remplacées par la série de courbes IntCal, en commençant par IntCal98, publiée en 1998 et mise à jour en 2004, 2009, 2013 et 2020. [83] Les améliorations apportées à ces courbes sont basées sur de nouvelles données recueillies à partir des cernes des arbres , varves , coraux , macrofossiles végétaux , spéléothèmes et foraminifères. Les données IntCal20 incluent des courbes distinctes pour les hémisphères nord et sud, car elles diffèrent systématiquement en raison de l’effet d’hémisphère. La courbe sud (SHCAL20) est basée sur des données indépendantes lorsque cela est possible et dérivée de la courbe nord en ajoutant le décalage moyen pour l’hémisphère sud où aucune donnée directe n’était disponible. Il existe également une courbe d’étalonnage marine distincte, MARINE20. [29] [84] [85] [86] Pour un ensemble d’échantillons formant une séquence avec une séparation connue dans le temps, ces échantillons forment un sous-ensemble de la courbe d’étalonnage. La séquence peut être comparée à la courbe d’étalonnage et la meilleure correspondance à la séquence établie. Cette technique de « wiggle-matching » peut conduire à une datation plus précise que ce qui est possible avec des datations individuelles au radiocarbone.[87] Le Wiggle-matching peut être utilisé là où il y a un plateau sur la courbe d’étalonnage, et peut donc fournir une date beaucoup plus précise que les méthodes d’interception ou de probabilité ne sont capables de produire. [88] La technique n’est pas limitée aux cernes des arbres; par exemple, une séquence de tephra stratifiéeen Nouvelle-Zélande, censée être antérieure à la colonisation humaine des îles, a été datée de 1314 après JC ± 12 ans par wiggle-matching. [89]Les ondulations signifient également que la lecture d’une date à partir d’une courbe d’étalonnage peut donner plus d’une réponse : cela se produit lorsque la courbe monte et descend suffisamment pour que l’âge au radiocarbone intercepte la courbe à plus d’un endroit, ce qui peut conduire à un résultat au radiocarbone. signalés comme deux tranches d’âge distinctes, correspondant aux deux parties de la courbe interceptées par l’âge au radiocarbone. [41]
Les techniques statistiques bayésiennes peuvent être appliquées lorsqu’il y a plusieurs datations radiocarbone à calibrer. Par exemple, si une série de dates au radiocarbone est prise à différents niveaux dans une séquence stratigraphique, l’analyse bayésienne peut être utilisée pour évaluer les dates qui sont des valeurs aberrantes et peut calculer des distributions de probabilité améliorées, sur la base des informations préalables selon lesquelles la séquence doit être ordonnée dans le temps. . [87] Lorsque l’analyse bayésienne a été introduite, son utilisation était limitée par la nécessité d’utiliser des ordinateurs centraux pour effectuer les calculs, mais la technique a depuis été implémentée sur des programmes disponibles pour les ordinateurs personnels, tels que OxCal. [90]
Dates de déclaration
Plusieurs formats de citation des résultats radiocarbone ont été utilisés depuis la datation des premiers échantillons. Depuis 2019, le format standard requis par la revue Radiocarbon est le suivant. [91]
Les dates non calibrées doivent être signalées comme ” laboratoire : C 14 {displaystyle {ce {{}^14C}}} 
année ± plage BP”, où :
- laboratoire identifie le laboratoire qui a testé l’échantillon et l’ID de l’échantillon
- C 14 {displaystyle {ce {{}^14C}}}
année est la détermination par le laboratoire de l’âge de l’échantillon, en années radiocarbone
- la plage est l’estimation par le laboratoire de l’erreur sur l’âge, à un niveau de confiance de 1σ.
- « BP » signifie « avant le présent », se référant à une date de référence de 1950, de sorte que « 500 BP » signifie l’année 1450 après JC.
Par exemple, la date non calibrée “UTC-2020 : 3510 ± 60 BP” indique que l’échantillon a été testé par le Utrecht van der Graaff Laboratorium (“UtC”), où il a un numéro d’échantillon de “2020”, et que le non calibré l’âge est de 3510 ans avant le présent, ± 60 ans. Des formes apparentées sont parfois utilisées : par exemple, “10 ka BP” signifie 10 000 années radiocarbone avant le présent (c’est-à-dire 8 050 avant JC), et “14
C yr BP” pourrait être utilisé pour distinguer la date non calibrée d’une date dérivée d’une autre méthode de datation telle que la thermoluminescence . [91]
Calibré14
Les dates C sont fréquemment signalées comme “cal BP”, “cal BC” ou “cal AD”, encore une fois avec “BP” faisant référence à l’année 1950 comme date zéro. [92] Radiocarbon offre deux options pour rapporter les dates calibrées. Un format courant est “cal date-range confidence “, où :
- date-range est la plage de dates correspondant au niveau de confiance donné
- confiance indique le niveau de confiance pour la plage de dates donnée.
Par exemple, “cal 1220–1281 AD (1σ)” désigne une date calibrée pour laquelle la vraie date se situe entre 1220 AD et 1281 AD, avec un niveau de confiance de “1 sigma”, soit environ 68 % . Les dates calibrées peuvent également être exprimées en “BP” au lieu d’utiliser “BC” et “AD”. La courbe utilisée pour calibrer les résultats doit être la dernière courbe IntCal disponible. Les dates d’étalonnage doivent également identifier tous les programmes, tels que OxCal, utilisés pour effectuer l’étalonnage. [91] Par ailleurs, un article de Radiocarbonen 2014, à propos des conventions de déclaration de datation au radiocarbone, recommande que des informations soient fournies sur le traitement des échantillons, y compris le matériau de l’échantillon, les méthodes de prétraitement et les mesures de contrôle de la qualité ; que la citation du logiciel utilisé pour l’étalonnage doit spécifier le numéro de version et les options ou modèles utilisés ; et que la date calibrée doit être donnée avec les probabilités associées pour chaque plage. [93]
Utilisation en archéologie
Interprétation
Un concept clé dans l’interprétation des datations au radiocarbone est l’Association archéologique: quelle est la véritable relation entre deux objets ou plus sur un site archéologique ? Il arrive fréquemment qu’un échantillon pour la datation au radiocarbone puisse être prélevé directement sur l’objet d’intérêt, mais il existe également de nombreux cas où cela n’est pas possible. Les objets funéraires en métal, par exemple, ne peuvent pas être datés au radiocarbone, mais ils peuvent être trouvés dans une tombe avec un cercueil, du charbon de bois ou d’autres matériaux dont on peut supposer qu’ils ont été déposés en même temps. Dans ces cas, une date pour le cercueil ou le charbon de bois est indicative de la date de dépôt du mobilier funéraire, en raison de la relation fonctionnelle directe entre les deux. Il y a aussi des cas où il n’y a pas de relation fonctionnelle, mais l’association est assez forte : par exemple, une couche de charbon de bois dans une fosse à ordures fournit une date qui a un rapport avec la fosse à ordures.[94]
La contamination est particulièrement préoccupante lors de la datation de matériel très ancien provenant de fouilles archéologiques et un grand soin est nécessaire dans la sélection et la préparation des spécimens. En 2014, Thomas Higham et ses collègues ont suggéré que bon nombre des dates publiées pour les artefacts de Néandertal sont trop récentes en raison de la contamination par le « jeune carbone ». [95]
Au fur et à mesure qu’un arbre grandit, seul l’anneau de l’arbre le plus externe échange du carbone avec son environnement, de sorte que l’âge mesuré pour un échantillon de bois dépend de l’endroit d’où provient l’échantillon. Cela signifie que les dates au radiocarbone sur les échantillons de bois peuvent être antérieures à la date à laquelle l’arbre a été abattu. De plus, si une pièce de bois est utilisée à des fins multiples, il peut y avoir un délai important entre l’abattage de l’arbre et l’utilisation finale dans le contexte dans lequel il se trouve. [96] C’est ce qu’on appelle souvent le problème du « vieux bois ». [5] Un exemple est la piste de l’âge du bronzeà Withy Bed Copse, en Angleterre ; la voie ferrée a été construite à partir de bois qui avait manifestement été travaillé à d’autres fins avant d’être réutilisé dans la voie ferrée. Un autre exemple est le bois flotté, qui peut être utilisé comme matériau de construction. Il n’est pas toujours possible de reconnaître la réutilisation. D’autres matériaux peuvent poser le même problème : par exemple, on sait que le bitume a été utilisé par certains Néolithiquescommunautés pour imperméabiliser les paniers ; l’âge radiocarbone du bitume sera supérieur à ce qui est mesurable par le laboratoire, quel que soit l’âge réel du contexte, ainsi tester le matériau du panier donnera un âge trompeur si l’on n’y prend garde. Un problème distinct, lié à la réutilisation, est celui de l’utilisation prolongée ou du dépôt retardé. Par exemple, un objet en bois qui reste en usage pendant une longue période aura un âge apparent supérieur à l’âge réel du contexte dans lequel il est déposé. [96]
Utiliser l’archéologie extérieure
L’archéologie n’est pas le seul domaine à recourir à la datation au radiocarbone. Les datations au radiocarbone peuvent également être utilisées dans la géologie, la sédimentologie et les études lacustres, par exemple. La possibilité de dater des échantillons minuscules à l’aide de l’AMS a permis aux paléobotanistes et aux paléoclimatologues d’utiliser la datation au radiocarbone directement sur du pollen purifié à partir de séquences de sédiments, ou sur de petites quantités de matériel végétal ou de charbon de bois. Les dates sur la matière organique récupérée des strates d’intérêt peuvent être utilisées pour corréler les strates à différents endroits qui semblent être similaires sur des bases géologiques. Le matériel de datation d’un emplacement donne des informations de date sur l’autre emplacement, et les dates sont également utilisées pour placer les strates dans la chronologie géologique globale. [97]
Le radiocarbone est également utilisé pour dater le carbone libéré des écosystèmes, en particulier pour surveiller la libération du vieux carbone qui était auparavant stocké dans les sols à la suite de perturbations humaines ou du changement climatique. [98] Les progrès récents des techniques de collecte sur le terrain permettent également la datation au radiocarbone du méthane et du dioxyde de carbone , qui sont d’importants gaz à effet de serre . [99] [100]
Applications notables
Limite Pléistocène / Holocène dans la forêt fossile de Two Creeks
Le Pléistocène est une époque géologique qui a commencé il y a environ 2,6 millions d’années. L’ Holocène , l’époque géologique actuelle, commence il y a environ 11 700 ans lorsque le Pléistocène se termine. [101] Établir la date de cette frontière – qui est définie par un réchauffement climatique brutal – aussi précisément que possible a été un objectif des géologues pendant une grande partie du 20e siècle. [101] [102] À Two Creeks , dans le Wisconsin, une forêt fossile a été découverte ( Two Creeks Buried Forest State Natural Area), et des recherches ultérieures ont déterminé que la destruction de la forêt avait été causée par la réavancée des glaces de Valders, le dernier mouvement de glace vers le sud avant la fin du Pléistocène dans cette région. Avant l’avènement de la datation au radiocarbone, les arbres fossilisés avaient été datés en corrélant des séquences de couches de sédiments déposées annuellement à Two Creeks avec des séquences en Scandinavie. Cela a conduit à des estimations selon lesquelles les arbres avaient entre 24 000 et 19 000 ans [101] et, par conséquent, cela a été considéré comme la date de la dernière avancée de la glaciation du Wisconsin avant que son retrait final ne marque la fin du Pléistocène en Amérique du Nord. [103]En 1952, Libby a publié des dates au radiocarbone pour plusieurs échantillons du site de Two Creeks et de deux sites similaires à proximité; les dates ont été moyennées à 11 404 BP avec une erreur standard de 350 ans. Ce résultat n’était pas calibré, car la nécessité de calibrer les âges au radiocarbone n’était pas encore comprise. D’autres résultats au cours de la prochaine décennie ont soutenu une date moyenne de 11 350 BP, les résultats étant considérés comme les plus précis avec une moyenne de 11 600 BP. Il y eut une résistance initiale à ces résultats de la part d’ Ernst Antevs , le paléobotanistequi avait travaillé sur la série des varves scandinaves, mais ses objections ont finalement été écartées par d’autres géologues. Dans les années 1990, des échantillons ont été testés avec AMS, donnant des dates (non calibrées) allant de 11 640 BP à 11 800 BP, les deux avec une erreur standard de 160 ans. Par la suite, un échantillon de la forêt fossile a été utilisé dans un test interlaboratoire, avec des résultats fournis par plus de 70 laboratoires. Ces tests ont produit un âge médian de 11 788 ± 8 BP (confiance 2σ) qui, une fois calibré, donne une plage de dates de 13 730 à 13 550 cal BP. [101] Les datations au radiocarbone de Two Creeks sont maintenant considérées comme un résultat clé dans le développement de la compréhension moderne de la glaciation nord-américaine à la fin du Pléistocène. [103]
Manuscrits de la mer Morte 
 Une partie du grand rouleau d’Isaïe, l’un des rouleaux de la mer Morte
Une partie du grand rouleau d’Isaïe, l’un des rouleaux de la mer Morte
En 1947, des rouleaux ont été découverts dans des grottes près de la mer Morte qui se sont révélées contenir des écrits en hébreu et en araméen , dont la plupart auraient été produits par les Esséniens , une petite secte juive. Ces rouleaux sont d’une grande importance dans l’étude des textes bibliques car beaucoup d’entre eux contiennent la plus ancienne version connue des livres de la Bible hébraïque. [104] Un échantillon de l’emballage en lin de l’un de ces rouleaux, le Great Isaiah Scroll , a été inclus dans une analyse de 1955 par Libby, avec un âge estimé à 1 917 ± 200 ans. [104] [105] A partir d’une analyse du style d’écriture, paléographiquedes estimations ont été faites de l’âge de 21 ans des rouleaux, et des échantillons de la plupart d’entre eux, ainsi que d’autres rouleaux qui n’avaient pas été datés paléographiquement, ont été testés par deux laboratoires AMS dans les années 1990. Les résultats variaient en âge du début du 4ème siècle avant JC au milieu du 4ème siècle après JC. Dans tous les cas sauf deux, il a été déterminé que les rouleaux étaient à moins de 100 ans de l’âge paléographiquement déterminé. Le parchemin d’Isaïe a été inclus dans les tests et s’est avéré avoir deux plages de dates possibles à un niveau de confiance de 2σ, en raison de la forme de la courbe d’étalonnage à ce point : il y a 15 % de chances qu’il date de 355 à 295 avant JC, et 84% de chances qu’il date de 210 à 45 av. Par la suite, ces dates ont été critiquées au motif qu’avant que les rouleaux ne soient testés, ils avaient été traités avec de l’huile de ricin moderne.afin de rendre l’écriture plus lisible ; il a été avancé que le fait de ne pas retirer suffisamment l’huile de ricin aurait rendu les dattes trop jeunes. Plusieurs articles ont été publiés à la fois pour soutenir et s’opposer à la critique. [104]
Impacter
Peu de temps après la publication de l’article de Libby en 1949 dans Science , les universités du monde entier ont commencé à établir des laboratoires de datation au radiocarbone et, à la fin des années 1950, il y avait plus de 20 laboratoires actifs.14
Laboratoires de recherche C. Il est rapidement apparu que les principes de la datation au radiocarbone étaient valables, malgré certaines divergences dont les causes restaient alors inconnues. [106]
Le développement de la datation au radiocarbone a eu un impact profond sur l’archéologie – souvent décrite comme la “révolution au radiocarbone”. [107] Selon les mots de l’anthropologue R. E. Taylor, “14
Les données C ont rendu possible une préhistoire mondiale en contribuant à une échelle de temps qui transcende les frontières locales, régionales et continentales”. Elles fournissent une datation plus précise au sein des sites que les méthodes précédentes, qui dérivaient généralement soit de la stratigraphie, soit de typologies (par exemple, des outils en pierre ou de la poterie) ; il permet également la comparaison et la synchronisation des événements sur de grandes distances. L’avènement de la datation au radiocarbone a peut-être même conduit à de meilleures méthodes de terrain en archéologie, car un meilleur enregistrement des données conduit à une association plus ferme des objets avec les échantillons à tester. Ces méthodes de terrain améliorées étaient parfois motivés par des tentatives de prouver qu’un14
La date C était incorrecte. Taylor suggère également que la disponibilité d’informations sur des dates précises a libéré les archéologues de la nécessité de concentrer une grande partie de leur énergie sur la détermination des dates de leurs découvertes et a conduit à une expansion des questions que les archéologues étaient disposés à rechercher. Par exemple, à partir des années 1970, les questions sur l’évolution du comportement humain ont été beaucoup plus fréquemment rencontrées en archéologie. [108]
Le cadre de datation fourni par le radiocarbone a conduit à un changement dans la vision dominante de la façon dont les innovations se sont propagées à travers l’Europe préhistorique. Les chercheurs pensaient auparavant que de nombreuses idées se propageaient par diffusion à travers le continent, ou par des invasions de peuples apportant avec eux de nouvelles idées culturelles. Alors que les datations au radiocarbone commençaient à prouver que ces idées étaient fausses dans de nombreux cas, il est devenu évident que ces innovations devaient parfois survenir localement. Cela a été décrit comme une “deuxième révolution du radiocarbone”, et en ce qui concerne la préhistoire britannique, l’archéologue Richard Atkinsona qualifié l’impact de la datation au radiocarbone de “thérapie radicale” pour la “maladie progressive de l’invasionisme”. Plus largement, le succès de la datation au radiocarbone a stimulé l’intérêt pour les approches analytiques et statistiques des données archéologiques. [108] Taylor a également décrit l’impact de l’AMS et la capacité d’obtenir des mesures précises à partir de très petits échantillons, comme inaugurant une troisième révolution du radiocarbone. [109]
Parfois, les techniques de datation au radiocarbone permettent de dater un objet d’intérêt populaire, par exemple, le Suaire de Turin , un morceau de toile de lin dont certains pensent qu’il porte une image de Jésus-Christ après sa crucifixion. Trois laboratoires distincts ont daté des échantillons de linge du Suaire en 1988 ; les résultats ont indiqué des origines du 14ème siècle, soulevant des doutes sur l’authenticité du linceul en tant que relique présumée du 1er siècle. [17]
Les chercheurs ont étudié d’autres isotopes radioactifs créés par les rayons cosmiques pour déterminer s’ils pouvaient également être utilisés pour aider à dater des objets d’intérêt archéologique ; ces isotopes comprennent3
Il ,dix
Soyez ,21
Ne ,26
Al , et36
Cl . Avec le développement de l’AMS dans les années 1980, il est devenu possible de mesurer ces isotopes avec suffisamment de précision pour qu’ils constituent la base de techniques de datation utiles, qui ont été principalement appliquées à la datation des roches. [110] Les isotopes radioactifs naturels peuvent également constituer la base des méthodes de datation, comme la datation potassium-argon , la datation argon-argon et la datation des séries d’uranium . [111] D’autres techniques de datation intéressantes pour les archéologues incluent la thermoluminescence , la luminescence stimulée optiquement , la résonance de spin électronique et la datation par voie de fission ., ainsi que des techniques qui dépendent des bandes ou couches annuelles, telles que la dendrochronologie , la téphrochronologie et la chronologie des varves . [112]
Voir également
- Chronologie astronomique
- Âge de la Terre
- Âge de l’univers
- Datation chronologique , chronologie archéologique
- Rencontres absolues
- Rencontres relatives
- Phase (archéologie)
- Association archéologique
- Géochronologie
- Échelle de temps géologique
- Histoire géologique de la Terre
- 774–775 pointe de carbone 14
Remarques
- ↑ L’article de Korff faisait en fait référence aux neutrons lents, un terme qui depuis l’époque de Korff a acquis une signification plus spécifique, se référant à une gamme d’énergies de neutrons qui ne chevauchent pas les neutrons thermiques. [2]
- ^ Certains des échantillons originaux de Libby ont depuis été retestés, et les résultats, publiés en 2018, étaient généralement en bon accord avec les résultats originaux de Libby. [dix]
- ^ L’interaction des rayons cosmiques avec l’azote et l’oxygène sous la surface de la terre peut également créer14
C , et dans certaines circonstances (par exemple près de la surface des accumulations de neige, qui sont perméables aux gaz) cette14
C migre dans l’atmosphère. Cependant, on estime que cette filière est responsable de moins de 0,1 % de la production totale de14
C. _ [14] - ^ La demi-vie de14
On pensait que C (qui détermine la durée de vie moyenne) était de 5568 ± 30 ans en 1952. [19] La durée de vie moyenne et la demi-vie sont liées par l’équation suivante : [5] T 1 2 = 0.693 ⋅ τ {displaystyle T_{frac {1}{2}}=0.693cdot tau } - ^ Deux valeurs déterminées expérimentalement à partir du début des années 1950 n’ont pas été incluses dans la valeur utilisée par Libby : ~ 6 090 ans et 5 900 ± 250 ans. [28]
- ^ Le terme “âge radiocarbone conventionnel” est également utilisé. La définition des années radiocarbone est la suivante : l’âge est calculé en utilisant les normes suivantes : a) en utilisant la demi-vie de Libby de 5568 ans, plutôt que la demi-vie réelle actuellement acceptée de 5730 ans ; (b) l’utilisation d’une norme NIST connue sous le nom de HOxII pour définir l’activité du radiocarbone en 1950 ; (c) l’utilisation de 1950 comme date à partir de laquelle les années « avant le présent » sont comptées ; (d) une correction pour le fractionnement , basée sur un rapport isotopique standard, et (e) l’hypothèse que le14
C /12
Le rapport C n’a pas changé au fil du temps. [30] - ^ Les données sur les pourcentages de carbone dans chaque partie du réservoir sont tirées d’une estimation du carbone du réservoir pour le milieu des années 1990 ; les estimations de la distribution du carbone à l’époque préindustrielle sont très différentes. [31]
- ^ Pour la vie marine, l’âge ne semble être de 400 ans qu’une fois une correction pour le fractionnement effectuée. Cet effet est pris en compte lors de l’étalonnage en utilisant une courbe d’étalonnage marine différente ; sans cette courbe, la vie marine moderne semblerait avoir 400 ans lorsqu’elle est datée au radiocarbone. De même, l’affirmation sur les organismes terrestres n’est vraie qu’une fois le fractionnement pris en compte.
- ^ “PDB” signifie “Pee Dee Belemnite”, un fossile de la formation Pee Dee en Caroline du Sud. [46]
- ^ La valeur PDB est de 11,2372 ‰. [47]
- ^ Deux estimations récentes incluaient 8 à 80 années radiocarbone au cours des 1000 dernières années, avec une moyenne de 41 ± 14 ans; et −2 à 83 années radiocarbone au cours des 2000 dernières années, avec une moyenne de 44 ± 17 ans. Pour les ensembles de données plus anciens, un décalage d’environ 50 ans a été estimé. [50]
Références
![]()
![]() Cet article a été soumis à WikiJournal of Science pour un examen par des pairs universitaires externes en 2017 ( rapports des examinateurs ). Le contenu mis à jour a été réintégré dans la page Wikipédia sous une licence CC-BY-SA-3.0 ( 2018 ). La version du dossier telle que révisée est : “Dating au radiocarbone” (PDF) . WikiJournal of Science . 1 (1): 6. 1 juin 2018. doi : 10.15347/WJS/2018.006 . ISSN 2470-6345 . Wikidata Q55120317 .
Cet article a été soumis à WikiJournal of Science pour un examen par des pairs universitaires externes en 2017 ( rapports des examinateurs ). Le contenu mis à jour a été réintégré dans la page Wikipédia sous une licence CC-BY-SA-3.0 ( 2018 ). La version du dossier telle que révisée est : “Dating au radiocarbone” (PDF) . WikiJournal of Science . 1 (1): 6. 1 juin 2018. doi : 10.15347/WJS/2018.006 . ISSN 2470-6345 . Wikidata Q55120317 .
- ^ un b Taylor & Bar-Yosef (2014), p. 268.
- ^ Korff, SA (1940). “Sur la contribution à l’ionisation au niveau de la mer produite par les neutrons dans le rayonnement cosmique”. Journal de l’Institut Franklin . 230 (6): 777–779. Bibcode : 1940TeMAE..45..133K . doi : 10.1016/s0016-0032(40)90838-9 .
- ^ un b Taylor & Bar-Yosef (2014), p. 269.
- ^ un b “la Datation de Radiocarbone – la Société Chimique américaine” . Société américaine de chimie . Récupéré le 09/10/2016 .
- ^ un bcd e f g h i j k l m n o p q r Bowman ( 1995), pp. 9–15 .
- ^ Libby, WF (1946). “L’hélium atmosphérique trois et le radiocarbone du rayonnement cosmique”. Examen physique . 69 (11–12): 671–672. Bibcode : 1946PhRv…69..671L . doi : 10.1103/PhysRev.69.671.2 .
- ^ Anderson, CE; Libby, WF; Weinhouse, S.; Reid, AF; Kirshenbaum, AD ; Grosse, AV (1947). “Radiocarbone du rayonnement cosmique”. Sciences . 105 (2765): 576–577. Bibcode : 1947Sci…105..576A . doi : 10.1126/science.105.2735.576 . PMID 17746224 .
- ^ Arnold, JR; Libby, WF (1949). “Déterminations d’âge par teneur en radiocarbone : vérifications avec des échantillons d’âge connu” . Sciences . 110 (2869): 678–680. Bib code : 1949Sci …110..678A . doi : 10.1126/science.110.2869.678 . JSTOR 1677049 . PMID 15407879 .
- ^ Aitken1990, p. 60–61.
- ^ Jul, AJT; Pearson, CL; Taylor, RE; Southon, JR; Santos, directeur général ; Kohl, CP; Hajdas, I. ; Molnar, M.; Baisan, C.; Lange, TE ; Cruz, R.; Janovics, R.; Major, I. (2018). “La datation au radiocarbone et l’intercomparaison de certains premiers échantillons historiques de radiocarbone”. Radiocarbone . 60 (2): 535–548. doi : 10.1017/RDC.2018.18 . S2CID 134723966 .
- ^ “La méthode” . www.c14dating.com . Récupéré le 09/10/2016 .
- ^ un Russell b , Nicola (2011). Effets des réservoirs marins de radiocarbone (EMR) en archéologie : changements temporels et spatiaux à travers l’Holocène dans l’environnement côtier du Royaume-Uni (thèse de doctorat) (PDF) . Glasgow, Écosse Royaume-Uni : Université de Glasgow. p. 16 . Récupéré le 11 décembre 2017 .
- ^ Bianchi & Canuel (2011), p. 35.
- ^ un bc Lal , D.; Jull, AJT (2001). « Cosmogénique in situ 14
C : production et exemples de ses applications uniques dans les études des processus terrestres et extraterrestres” . Radiocarbon . 43 (2B) : 731–742. doi : 10.1017/S0033822200041394 . - ^ un b Queiroz-Alves, Eduardo; Macaire, Kita ; Ascough, Philippa ; Bronk Ramsey, Christopher (2018). “L’effet réservoir mondial de radiocarbone marin: définitions, mécanismes et perspectives” (PDF) . Revues de Géophysique . 56 (1): 278–305. Bibcode : 2018RvGeo..56..278A . doi : 10.1002/2017RG000588 . S2CID 59153548 .
- ^ un bc Tsipenyuk (1997), p. 343.
- ^ un b Currie, Lloyd A. (2004). “La remarquable histoire métrologique de la datation au radiocarbone II” . Journal de recherche de l’Institut national des normes et de la technologie . 109 (2): 185–217. doi : 10.6028/jres.109.013 . PMC 4853109 . PMID 27366605 .
- ^ Taylor & Bar-Yosef (2014), p. 33.
- ^ Libby (1965), p. 42.
- ^ Aitken1990, p. 59.
- ^ un bcdefgh Aitken1990 , pp . 61–66 . _
- ^ un bc Aitken1990 , pp. 92–95.
- ^ un b Bowman (1995), p. 42.
- ^ Engelkemeir, Antoinette G.; Hamill, WH; Inghram, Mark G.; Libby, WF (1949). “La demi-vie du radiocarbone (C 14 )”. Examen physique . 75 (12): 1825. Bibcode : 1949PhRv…75.1825E . doi : 10.1103/PhysRev.75.1825 .
- ^ Frederick Johnson (1951). “Introduction”. Mémoires de la Society for American Archaeology (8): 1–19. JSTOR 25146610 .
- ^ H. Godwin (1962). “Demi-vie du radiocarbone”. Nature . 195 (4845): 984. Bibcode : 1962Natur.195..984G . doi : 10.1038/195984a0 . S2CID 27534222 .
- ^ J.van der Plicht et A.Hogg (2006). “Une note sur la déclaration du radiocarbone” (PDF) . Géochronologie du Quaternaire . 1 (4): 237-240. doi : 10.1016/j.quageo.2006.07.001 . Récupéré le 9 décembre 2017 .
- ^ Taylor & Bar-Yosef (2014), p. 287.
- ^ un bc Reimer , Paula J.; Bard, Édouard; Bayliss, Alex; Beck, J. Warren; Blackwell, Paul G.; Ramsey, Christopher Bronk; Buck, Caitlin E.; Cheng, Haï ; Edwards, R. Lawrence (2013). “Courbes d’étalonnage de l’âge du radiocarbone IntCal13 et Marine13 0–50 000 ans cal BP” . Radiocarbone . 55 (4) : 1869–1887. doi : 10.2458/azu_js_rc.55.16947 . ISSN 0033-8222 .
- ^ Taylor & Bar-Yosef (2014), p. 26-27.
- ^ Post (2001) pp. 128–129.
- ^ Aitken (2003), p. 506.
- ^ Warneck (2000), p. 690.
- ^ Ferronsky & Polyakov (2012), p. 372.
- ^ un bcdefg Bowman ( 1995 ), pp . 24–27 .
- ^ un bc Cronin (2010), p. 35.
- ^ un b Hua, Quan; Barbetti, Mike; En ligneRakowski, Andrzej Z. (2013). “Radiocarbone atmosphérique pour la période 1950–2010” . Radiocarbone . 55 (4): 2059-2072. doi : 10.2458/azu_js_rc.v55i2.16177 . ISSN 0033-8222 .
- ^ un bcdefg Bowman ( 1995 ), pp . 16–20 .
- ^ un bc Suess (1970), p. 303.
- ^ un bcTaylor & Bar-Yosef (2014), pp. 50–52.
- ^ un bcd Bowman (1995), pp. 43-49 .
- ^ un b Aitken1990, pp. 71–72.
- ^ “Traité interdisant les essais d’armes nucléaires dans l’atmosphère, dans l’espace extra-atmosphérique et sous l’eau” . Département d’État américain . Récupéré le 2 février 2015 .
- ^ un bcdefg Bowman ( 1995 ), pp . 20–23 .
- ^ un bcdef Maslin & Swann (2006), p . 246.
- ^ Taylor & Bar-Yosef (2014), p. 125.
- ^ Dass (2007), p. 276.
- ^ Schoeninger (2010), p. 446.
- ^ un b Libby (1965), p. 6.
- ^ un b Hogg et autres. (2013), p. 1898.
- ^ Taylor & Bar-Yosef (2014), p. 74-75.
- ^ Pasquier-Cardina et al. (1999), p. 200–201.
- ^ Aitken1990, p. 85–86.
- ^ un bcdef Bowman ( 1995 ), pp . 27-30 .
- ^ un bcdef Aitken1990 , pp . 86–89 .
- ^ Silar (2004), p. 166.
- ^ Bowman (1995), p. 37–42.
- ^ un bcdefgh Bowman ( 1995 ) , pp . 31-37 .
- ^ un bcde Aitken1990 , pp . 76–78 .
- ^ Trumbore (1996), p. 318.
- ^ Taylor & Bar-Yosef (2014), p. 103-104.
- ^ Walker (2005), p. 20.
- ^ un b Walker (2005), p. 23.
- ^ Killick (2014), p. 166.
- ^ Malainey (2010), p. 96.
- ^ Theodorsson (1996), p. 24.
- ^ L’Annunziata & Kessler (2012), p. 424.
- ^ un b Eriksson Stenström et autres. (2011), p. 3.
- ^ un b Aitken1990, pp. 82-85.
- ^ Wiebert (1995), p. 16.
- ^ Tunis, Zoppi & Barbetti (2004), p. 395.
- ^ un bc McNichol , AP; Jul, ATS ; Burr, GS (2001). “Conversion des données AMS en valeurs radiocarbone : considérations et conventions” . Radiocarbone . 43 (2A): 313–320. doi : 10.1017/S0033822200038169 .
- ^ Terasmae (1984), p. 5.
- ^ L’ Annunziata (2007), p. 528.
- ^ un b “Calculs de Données de Radiocarbone : NOSAMS” . Institut océanographique de Woods Hole. 2007 . Récupéré le 27 août 2013 .
- ^ Bowman (1995), p. 38–39.
- ^ Taylor (1987), pp. 125–126.
- ^ Bowman (1995), p. 40–41.
- ^ Taylor & Bar-Yosef (2014), p. 155.
- ^ un b Aitken1990, p. 66–67.
- ^ Taylor & Bar-Yosef (2014), p. 59.
- ^ Taylor & Bar-Yosef (2014), p. 53–54.
- ^ un b Heaton, Timothy J.; Blaauw, Maarten; Blackwell, Paul G.; Ramsey, Christopher Bronk; Reimer, Paula J.; Scott, E. Marian (août 2020). “L’approche IntCal20 de la construction de la courbe d’étalonnage du radiocarbone : une nouvelle méthodologie utilisant des splines bayésiennes et des erreurs dans les variables” . Radiocarbone . 62 (4): 821–863. doi : 10.1017/RDC.2020.46 . ISSN 0033-8222 .
- ^ Stuiver, M.; Braziunas, TF (1993). “Modélisation atmosphérique 14
C influence et14
C ages d’ échantillons marins jusqu’à 10000 avant J. _ - ^ Hogg, Alan G.; Heaton, Timothy J.; Hua, Quan; Palmer, Jonathan G.; Turney, Chris SM; Southon, John; Bayliss, Alex; Blackwell, Paul G.; Boswijk, Gretel; Ramsey, Christopher Bronk; Pearson, Charlotte (août 2020). “Étalonnage de l’hémisphère sud SHCal20, 0–55 000 ans cal BP” . Radiocarbone . 62 (4): 759–778. doi : 10.1017/RDC.2020.59 . ISSN 0033-8222 .
- ^ Heaton, Timothy J.; Kohler, Peter; Butzin, Martin; Bard, Édouard; Reimer, Ron W.; Austin, William EN; Ramsey, Christopher Bronk; Grootes, Pieter M.; Hughen, Konrad A.; Kromer, Bernd; Reimer, Paula J. (août 2020). “Marine20—La courbe d’étalonnage de l’âge du radiocarbone marin (0–55 000 cal BP)” . Radiocarbone . 62 (4): 779–820. doi : 10.1017/RDC.2020.68 . ISSN 0033-8222 .
- ^ un b Walker (2005), pp. 35–37.
- ^ Aitken1990, pp. 103-105.
- ^ Walker (2005), pp. 207–209.
- ^ Taylor & Bar-Yosef (2014), p. 148-149.
- ^ un bc ” le Radiocarbone : l’Information pour les Auteurs” (PDF) . Radiocarbone . Université d’Arizona. 25 mai 2011. p. 5–7. Archivé de l’original (PDF) le 10 août 2013 . Récupéré le 1er janvier 2014 .
- ^ Taylor & Bar-Yosef (2014), p. 29.
- ^ Millard, Andrew R. (2014). “Conventions pour la déclaration des déterminations du radiocarbone” (PDF) . Radiocarbone . 56 (2): 555–559. doi : 10.2458/56.17455 .
- ^ Mook & Waterbolk (1985), p. 48–49.
- ^ Higham, T.; et coll. (2014). “Le moment et la structuration spatio-temporelle de la disparition de Néandertal”. Nature . 512 (7514): 306–309. Bibcode : 2014Natur.512..306H . doi : 10.1038/nature13621 . PMID 25143113 . S2CID 205239973 .
- ^ un b Bowman (1995), pp. 53–54.
- ^ Godwin, Harry (1961). “La conférence croonienne: datation au radiocarbone et histoire quaternaire en Grande-Bretagne”. Actes de la Royal Society of London B: Biological Sciences . 153 (952): 287–320. Bibcode : 1961RSPSB.153..287G . doi : 10.1098/rspb.1961.0001 . S2CID 140692260 .
- ^ Dean, Joshua F.; Garnett, Mark H.; Spyrakos, Evangelos; Billett, Michael F. (2019). “L’âge caché potentiel du carbone organique dissous exporté par les flux de tourbières” . Journal of Geophysical Research: Biogeosciences . 124 (2): 328–341. Bibcode : 2019JGRG..124..328D . doi : 10.1029/2018JG004650 . ISSN 2169-8953 .
- ^ Aîné, Clayton D.; Xu, Xiaomei ; Marcheur, Jennifer; Schnell, Jordan L.; Hinkel, Kenneth M.; Townsend-Small, Amy ; Arp, Christopher D.; Pohlman, John W.; Gaglioti, Benjamin V. (2018). “Les émissions de gaz à effet de serre provenant de divers lacs arctiques de l’Alaska sont dominées par le jeune carbone” . Nature Changement climatique . 8 (2): 166–171. Bibcode : 2018NatCC…8..166E . doi : 10.1038/s41558-017-0066-9 . ISSN 1758-678X . S2CID 90232027 .
- ^ Dean, Joshua F.; Billett, Michael F.; Murray, Callum; Garnett, Mark H. (2017). “Méthane dissous ancien dans les eaux intérieures révélé par une nouvelle méthode de collecte à faible concentration sur le terrain pour l’analyse du radiocarbone ( 14 C)” . Recherche sur l’eau . 115 : 236–244. doi : 10.1016/j.watres.2017.03.009 . PMID 28284090 .
- ^ un bcd Taylor & Bar -Yosef (2014), pp. 34–37.
- ^ Bousman & Vierra (2012), p. 4.
- ^ un b Macdougall (2008), pp. 94-95.
- ^ un bcTaylor & Bar-Yosef (2014), pp. 38–42.
- ^ Libby (1965), p. 84.
- ^ Taylor & Bar-Yosef (2014), p. 288.
- ^ Taylor (1997), p. 70.
- ^ un b Taylor (1987), pp. 143–146.
- ^ Renfrew (2014), p. 13.
- ^ Walker (2005), pp. 77–79.
- ^ Walker (2005), p. 57–77.
- ^ Walker (2005), pp. 93–162.
Sources
- Aitken, MJ (1990). Datation basée sur la science en archéologie . Londres : Longman. ISBN 978-0-582-49309-4.
- En ligneAitken, Martin J. (2003). « Datation au radiocarbone ». Dans Ellis, Linda (éd.). Méthode et théorie archéologiques . New York : Garland Publishing. pages 505–508.
- Bianchi, Thomas S. ; En ligneCanuel, Elizabeth A. (2011). Marqueurs chimiques dans les écosystèmes aquatiques . Princeton : Presse universitaire de Princeton. ISBN 978-0-691-13414-7.
- Bousman, C. Britt; En ligneVierra, Bradley J. (2012). “Chronologie, cadre environnemental et vues des transitions culturelles du Pléistocène terminal et de l’Holocène précoce en Amérique du Nord”. Dans Bousman, C. Britt; Vierra, Bradley J. (éd.). Du Pléistocène à l’Holocène : organisation humaine et transformations culturelles en Amérique du Nord préhistorique . College Station, Texas : Texas A&M University Press. p. 1–15. ISBN 978-1-60344-760-7.
- Bowman, Sheridan (1995) [1990]. Datation au radiocarbone . Londres : British Museum Press. ISBN 978-0-7141-2047-8.
- En ligneCronin, Thomas M. (2010). Paléoclimats : Comprendre le changement climatique d’hier et d’aujourd’hui . New York : presse universitaire de Columbia. ISBN 978-0-231-14494-0.
- Dass, Chhabil (2007). Principes fondamentaux de la spectrométrie de masse contemporaine . Hoboken, New Jersey : John Wiley & Sons. ISBN 978-0-471-68229-5.
- Eriksson Stenström, Kristina; Skog, Goran ; Georgiadou, Elisavet; Genberg, Johan; Johansson, Anette (2011). Un guide des unités et des calculs radiocarbone . Lund : Université de Lund.
- Ferronsky, VI; Polyakov, Virginie (2012). Isotopes de l’hydrosphère terrestre . New York : Springer. ISBN 978-94-007-2855-4.
- Killick, David (2014). “Utilisation des preuves des sciences naturelles en archéologie”. Dans Chapman, Robert; Alison, Wylie (éd.). Preuve matérielle : apprendre de la pratique archéologique . Abingdon, Royaume-Uni : Routledge. p. 159–172. ISBN 978-0-415-83745-3.
- En ligneL’Annunziata, Michael F. (2007). Radioactivité : introduction et historique . Amsterdam : Elsevier. ISBN 978-0-444-52715-8.
- L’Annunziata, Michael F.; En ligneKessler, Michael J. (2012). “Analyse par scintillation liquide: principes et pratique”. Dans L’Annunziata, Michael F. (éd.). Manuel d’analyse de la radioactivité (3e éd.). Oxford : Presse académique. p. 423–573. doi : 10.1016/b978-012436603-9/50010-7 . ISBN 978-0-12-384873-4.
- Libby, Willard F. (1965) [1952]. Datation au radiocarbone (2e éd. (1955).). Chicago : Phénix.
- Macdougall, Doug (2008). Les horloges de la nature : comment les scientifiques mesurent l’âge de presque tout . Berkeley, Californie : University of California Press. ISBN 978-0-520-24975-2.
- En ligneMalainey, Mary E. (2010). Guide du consommateur sur la science archéologique . New York : Springer. ISBN 978-1-4419-5704-7.
- Marra, John (2019). Charbon chaud : le carbone 14 et une révolution scientifique . Presse universitaire de Columbia. ISBN 9780231186704.
- Maslin, Mark A.; Swann, George EA (2006). “Isotopes dans les sédiments marins”. Dans Leng, Melanie J. (éd.). Isotopes dans la recherche paléoenvironnementale . Dordrecht : Springer. pages 227 à 290. doi : 10.1007/1-4020-2504-1_06 . ISBN 978-1-4020-2503-7.
- Mook, WG; Waterbolk, HT (1985). Manuels pour archéologues : n° 3 : Datation au radiocarbone . Strasbourg : Fondation européenne de la science. ISBN 978-2-903148-44-7.
- Poste, Wilfred M. (2001). “Cycle du carbone”. À Goudie, Andrew; Cuff, David J. (éd.). Encyclopédie du changement global : changement environnemental et société humaine, volume 1 . Oxford : presse universitaire d’Oxford. p. 127–130. ISBN 978-0-19-514518-2.
- Renfrew, Colin (2014). “Avant-propos”. À Taylor, RE ; Bar-Yosef, Ofer (éd.). Datation au radiocarbone . Walnut Creek, Californie : Left Coast Press. p. 12–14. ISBN 978-1-59874-590-0.
- En ligneSchoeninger, Margaret J. (2010). “Reconstruction de régime et écologie utilisant des rapports d’isotopes stables”. Dans Larsen, Clark Spencer (éd.). Un compagnon à l’anthropologie biologique . Oxford : Blackwell. pages 445 à 464. doi : 10.1002/9781444320039.ch25 . ISBN 978-1-4051-8900-2.
- Silar, Jan (2004). “Application des radionucléides environnementaux en radiochronologie: Radiocarbone”. À Tykva, Richard; Berg, Dieter (éd.). Radioactivité artificielle et naturelle dans la pollution de l’environnement et la radiochronologie . Dordrecht : Éditeurs académiques Kluwer. p. 150–179. ISBN 978-1-4020-1860-2.
- Suess, HE (1970). “Étalonnage Bristlecone-pin de l’échelle de temps du radiocarbone 5200 avant JC à nos jours”. Dans Olsson, Ingrid U. (éd.). Variations du radiocarbone et chronologie absolue . New York : John Wiley & Fils. pp. 303–311.
- Taylor, RE (1987). Datation au radiocarbone . Londres : Academic Press. ISBN 978-0-12-433663-6.
- Taylor, RE (1997). « Datation au radiocarbone ». À Taylor, RE ; Aitken, Martin J. (éd.). Datation chronométrique en archéologie . New York : presse plénière. p. 65–97. ISBN 978-0-306-45715-9.
- Taylor, RE; Bar-Yosef, Ofer (2014). Datation au radiocarbone (2e éd.). Walnut Creek, Californie : Left Coast Press. ISBN 978-1-59874-590-0.
- En ligneTerasmae, J. (1984). « Datation au radiocarbone : quelques problèmes et développements potentiels ». Dans Mahaney, WC (éd.). Méthodes de datation quaternaire . Amsterdam : Elsevier. pages 1 à 15. ISBN 978-0-444-42392-4.
- Theodórsson, Páll (1996). Mesure de la radioactivité faible . Singapour : édition scientifique mondiale. ISBN 978-9810223151.
- En ligneTrumbore, Susan E. (1996). “Applications de la spectrométrie de masse par accélérateur à la science du sol”. À Bouton, Thomas W. ; Yamasaki, Shin-ichi (éd.). Spectrométrie de masse des sols . New York : Marcel Dekker. p. 311–340. ISBN 978-0-8247-9699-0.
- En ligneTsipenyuk, Yuri M. (1997). Méthodes nucléaires en science et technologie . Bristol, Royaume-Uni : Institute of Physics Publishing. ISBN 978-0750304221.
- Tunis, C.; Zoppi, U.; En ligneBarbetti, M. (2004). “La datation des radionucléides en archéologie par spectrométrie de masse par accélérateur”. Dans Martini, M.; Milazzo, M.; Piacentini, M. (éd.). Méthodes physiques en archéométrie . Amsterdam : Presse IOS. p. 385–405. ISBN 978-1-58603-424-5.
- Marcheur, Mike (2005). Méthodes de datation quaternaire (PDF) . Chichester : John Wiley & Fils. ISBN 978-0-470-86927-7. Archivé de l’original (PDF) le 13 octobre 2017.
- Warneck, Peter (2000). Chimie de l’atmosphère naturelle . Londres : Academic Press. ISBN 978-0-12-735632-7.
- Wiebert, Anders (1995). Développement du système Lund AMS et évaluation d’une nouvelle technique de détection AMS . Lund : Université de Lund.
Liens externes
| Le Wikibook Historical Geology a une page sur le thème de: Datation au radiocarbone |
- RADON – base de données européenne14
dattes C

