Chimie
La chimie est l’ étude scientifique des propriétés et du comportement de la matière . [1] C’est une science naturelle qui couvre les éléments qui composent la matière jusqu’aux composés composés d’ atomes , de molécules et d’ ions : leur composition, leur structure, leurs propriétés, leur comportement et les modifications qu’ils subissent lors d’une réaction avec d’autres substances . [2] [3] [4] [5]
 Une peinture à l’huile d’un chimiste ( Ana Kansky , peinte par Henrika Šantel en 1932)
Une peinture à l’huile d’un chimiste ( Ana Kansky , peinte par Henrika Šantel en 1932)
Dans le cadre de son objet, la chimie occupe une position intermédiaire entre la physique et la biologie . [6] On l’appelle parfois la science centrale parce qu’elle fournit une base pour comprendre les disciplines scientifiques fondamentales et appliquées à un niveau fondamental. [7] Par exemple, la chimie explique les aspects de la croissance des plantes ( botanique ), la formation des roches ignées ( géologie ), la formation de l’ozone atmosphérique et la dégradation des polluants environnementaux ( écologie ), les propriétés du sol sur la lune ( cosmochimie ), comment fonctionnent les médicaments (pharmacologie ) et comment recueillir des preuves ADN sur une scène de crime ( médico -légal ).
La chimie aborde des sujets tels que la façon dont les atomes et les molécules interagissent via des liaisons chimiques pour former de nouveaux composés chimiques . Il existe deux types de liaisons chimiques : 1. les liaisons chimiques primaires — par exemple, les liaisons covalentes , dans lesquelles les atomes partagent un ou plusieurs électron(s) ; les liaisons ioniques , dans lesquelles un atome cède un ou plusieurs électrons à un autre atome pour produire des ions ( cations et anions ) ; liaisons métalliques – et 2. liaisons chimiques secondaires – par exemple, liaisons hydrogène ; Van der Waals force les liens; interaction ion-ion; interaction ion-dipôle.
Étymologie
Le mot chimie vient d’une modification du mot alchimie , qui faisait référence à un ensemble antérieur de pratiques qui englobaient des éléments de chimie, de métallurgie , de philosophie , d’ astrologie , d’astronomie , de mysticisme et de médecine . L’alchimie est souvent considérée comme liée à la quête pour transformer le plomb ou d’autres métaux de base en or, bien que les alchimistes s’intéressent également à de nombreuses questions de la chimie moderne. [8]
Le mot moderne alchimie est à son tour dérivé du mot arabe al-kīmīā ( الكیمیاء ). Cela peut avoir des origines égyptiennes puisque al-kīmīā est dérivé du grec ancien χημία , qui est à son tour dérivé du mot Kemet , qui est l’ancien nom de l’Égypte en langue égyptienne. [9] Alternativement, al-kīmīā peut dériver de χημεία ‘jeter ensemble’. [dix]
Principes modernes

 Laboratoire , Institut de Biochimie, Université de Cologne en Allemagne .
Laboratoire , Institut de Biochimie, Université de Cologne en Allemagne .
Le modèle actuel de structure atomique est le modèle mécanique quantique . [11] La chimie traditionnelle commence par l’étude des particules élémentaires , atomes , molécules , [12] substances , métaux , cristaux et autres agrégats de matière . La matière peut être étudiée à l’état solide, liquide, gazeux et plasma , isolément ou en combinaison. Les interactions , les réactionset les transformations étudiées en chimie sont généralement le résultat d’interactions entre atomes, conduisant à des réarrangements des liaisons chimiques qui maintiennent les atomes ensemble. De tels comportements sont étudiés dans un laboratoire de chimie .
Le laboratoire de chimie utilise de manière stéréotypée diverses formes de verrerie de laboratoire . Cependant, la verrerie n’est pas au cœur de la chimie, et une grande partie de la chimie expérimentale (ainsi qu’appliquée / industrielle) se fait sans elle.

 Solutions de substances dans des flacons de réactifs, y compris l’hydroxyde d’ammonium et l’acide nitrique , illuminés de différentes couleurs
Solutions de substances dans des flacons de réactifs, y compris l’hydroxyde d’ammonium et l’acide nitrique , illuminés de différentes couleurs
Une réaction chimique est une transformation de certaines substances en une ou plusieurs substances différentes. [13] La base d’une telle transformation chimique est le réarrangement des électrons dans les liaisons chimiques entre les atomes. Il peut être représenté symboliquement par une équation chimique , qui implique généralement des atomes comme sujets. Le nombre d’atomes à gauche et à droite dans l’équation d’une transformation chimique est égal. (Lorsque le nombre d’atomes de chaque côté est inégal, la transformation est appelée réaction nucléaire ou désintégration radioactive .) Le type de réactions chimiques qu’une substance peut subir et les changements d’énergie qui peuvent l’accompagner sont limités par certaines règles de base, connu commelois chimiques .
Les considérations d’ énergie et d’ entropie sont invariablement importantes dans presque toutes les études chimiques. Les substances chimiques sont classées en fonction de leur structure , de leur phase, ainsi que de leurs compositions chimiques . Ils peuvent être analysés à l’aide des outils d’ analyse chimique , par exemple la spectroscopie et la chromatographie . Les scientifiques engagés dans la recherche chimique sont connus sous le nom de chimistes . [14] La plupart des chimistes se spécialisent dans une ou plusieurs sous-disciplines. Plusieurs concepts sont essentiels pour l’étude de la chimie; certains d’entre eux sont: [15]
Question
En chimie, la matière est définie comme tout ce qui a une masse et un volume au repos (cela prend de la place) et est constitué de particules . Les particules qui composent la matière ont également une masse au repos – toutes les particules n’ont pas de masse au repos, comme le photon . La matière peut être une substance chimique pure ou un mélange de substances. [16]
Atome 
 Un diagramme d’un atome basé sur le modèle de Bohr
Un diagramme d’un atome basé sur le modèle de Bohr
L’ atome est l’unité de base de la chimie. Il se compose d’un noyau dense appelé noyau atomique entouré d’un espace occupé par un nuage d’électrons . Le noyau est constitué de Protons chargés positivement et de Neutrons non chargés (ensemble appelés nucléons ), tandis que le nuage d’ électrons est constitué d’ électrons chargés négativement qui orbitent autour du noyau. Dans un atome neutre, les électrons chargés négativement compensent la charge positive des Protons. Le noyau est dense; la masse d’un nucléon est d’environ 1 836 fois celle d’un électron, mais le rayon d’un atome est d’environ 10 000 fois celui de son noyau. [17] [18]
L’atome est également la plus petite entité qui peut être envisagée pour conserver les propriétés chimiques de l’élément, telles que l’électronégativité , le potentiel d’ionisation , le ou les états d’oxydation préférés , le nombre de coordination et les types de liaisons préférées à former (par exemple, métalliques , ioniques ). , Covalent ).
Élément 
 Forme standard du tableau périodique des éléments chimiques. Les couleurs représentent différentes catégories d’éléments
Forme standard du tableau périodique des éléments chimiques. Les couleurs représentent différentes catégories d’éléments
Un élément chimique est une substance pure composée d’un seul type d’atome, caractérisé par son nombre particulier de Protons dans le noyau de ses atomes, appelé numéro atomique et représenté par le symbole Z . Le nombre de masse est la somme du nombre de Protons et de Neutrons dans un noyau. Bien que tous les noyaux de tous les atomes appartenant à un élément aient le même numéro atomique, ils n’ont pas nécessairement le même nombre de masse ; les atomes d’un élément qui ont des nombres de masse différents sont appelés isotopes . Par exemple, tous les atomes avec 6 Protons dans leurs noyaux sont des atomes de l’élément chimique carbone , mais les atomes de carbone peuvent avoir des nombres de masse de 12 ou 13.[18]
La présentation standard des éléments chimiques se trouve dans le tableau périodique , qui ordonne les éléments par numéro atomique. Le tableau périodique est organisé en groupes , ou colonnes, et en périodes , ou lignes. Le tableau périodique est utile pour identifier les tendances périodiques . [19]
Composé 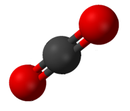
 Le dioxyde de carbone (CO 2 ), un exemple de composé chimique
Le dioxyde de carbone (CO 2 ), un exemple de composé chimique
Un composé est une substance chimique pure composée de plus d’un élément. Les propriétés d’un composé présentent peu de similitudes avec celles de ses éléments. [20] La nomenclature standard des composés est établie par l’ Union internationale de chimie pure et appliquée (IUPAC). Les composés organiques sont nommés selon le système de nomenclature organique . [21] Les noms des composés inorganiques sont créés selon le système de nomenclature inorganique . Lorsqu’un composé a plus d’un composant, ils sont divisés en deux classes, les composants électropositifs et électronégatifs. [22] En outre, leChemical Abstracts Service a mis au point une méthode pour indexer les substances chimiques. Dans ce système, chaque substance chimique est identifiable par un numéro connu sous le nom de numéro de registre CAS .
Molécule 
 Une représentation boule et bâton de la molécule de caféine (C 8 H 10 N 4 O 2 ).
Une représentation boule et bâton de la molécule de caféine (C 8 H 10 N 4 O 2 ).
Une molécule est la plus petite partie indivisible d’une substance chimique pure qui possède son ensemble unique de propriétés chimiques, c’est-à-dire son potentiel à subir un certain ensemble de réactions chimiques avec d’autres substances. Cependant, cette définition ne fonctionne bien que pour les substances composées de molécules, ce qui n’est pas le cas de nombreuses substances (voir ci-dessous). Les molécules sont généralement un ensemble d’atomes liés entre eux par des liaisons covalentes , de sorte que la structure est électriquement neutre et que tous les électrons de valence sont appariés avec d’autres électrons soit dans des liaisons, soit dans des paires isolées .
Ainsi, les molécules existent en tant qu’unités électriquement neutres, contrairement aux ions. Lorsque cette règle est enfreinte, donnant à la “molécule” une charge, le résultat est parfois appelé un ion moléculaire ou un ion polyatomique. Cependant, la nature discrète et séparée du concept moléculaire nécessite généralement que les ions moléculaires soient présents uniquement sous une forme bien séparée, comme un faisceau dirigé dans le vide dans un spectromètre de masse . Les collections polyatomiques chargées résidant dans les solides (par exemple, les ions sulfate ou nitrate courants) ne sont généralement pas considérées comme des “molécules” en chimie. Certaines molécules contiennent un ou plusieurs électrons non appariés, créant des radicaux . La plupart des radicaux sont relativement réactifs, mais certains, comme l’oxyde nitrique (NO), peuvent être stables.
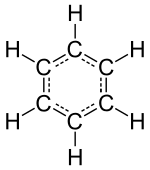
 Une formule structurelle 2-D d’une molécule de benzène (C 6 H 6 )
Une formule structurelle 2-D d’une molécule de benzène (C 6 H 6 )
Les éléments “inertes” ou gaz nobles ( hélium , néon , argon , krypton , xénon et radon ) sont composés d’atomes isolés comme leur plus petite unité discrète, mais les autres éléments chimiques isolés sont constitués soit de molécules, soit de réseaux d’atomes liés les uns aux autres. en quelque sorte. Les molécules identifiables composent des substances familières telles que l’eau, l’air et de nombreux composés organiques comme l’alcool, le sucre, l’essence et les divers produits pharmaceutiques .
Cependant, toutes les substances ou composés chimiques ne sont pas constitués de molécules discrètes, et en effet la plupart des substances solides qui composent la croûte solide, le manteau et le noyau de la Terre sont des composés chimiques sans molécules. Ces autres types de substances, tels que les composés ioniques et les solides en réseau , sont organisés de telle manière qu’il n’existe pas de molécules identifiables en soi . Au lieu de cela, ces substances sont discutées en termes d’ unités de formule ou de cellules unitaires en tant que plus petite structure répétitive au sein de la substance. Des exemples de telles substances sont les sels minéraux (tels que le sel de table ), les solides comme le carbone et le diamant, les métaux et la silice etminéraux silicatés tels que le quartz et le granit.
L’une des principales caractéristiques d’une molécule est sa géométrie souvent appelée sa structure . Alors que la structure des molécules diatomiques, triatomiques ou tétra-atomiques peut être triviale (linéaire, pyramidale angulaire, etc.), la structure des molécules polyatomiques, constituées de plus de six atomes (de plusieurs éléments) peut être cruciale pour sa nature chimique. .
Substance et mélange
    |
    |
    |
| Exemples de substances chimiques pures. De gauche à droite : les éléments étain (Sn) et soufre (S), le diamant (un allotrope du carbone ), le saccharose (sucre pur) et le chlorure de sodium (sel) et le bicarbonate de sodium (bicarbonate de soude), qui sont tous deux des composés ioniques . |
Une substance chimique est une sorte de matière avec une composition définie et un ensemble de propriétés . [23] Un ensemble de substances s’appelle un mélange. Des exemples de mélanges sont l’air et les alliages . [24]
Taupe et quantité de substance
La mole est une unité de mesure qui désigne une quantité de substance (également appelée quantité chimique). Une mole est définie comme contenant exactement6,022 140 76 × 10 23 particules ( atomes , molécules , ions ou électrons ), où le nombre de particules par mole est connu sous le nom de constante d’Avogadro . [25] La concentration molaire est la quantité d’une substance particulière par volume de solution et est généralement exprimée en mol/ dm 3 . [26]
Phase
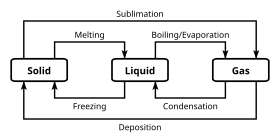
 Diagramme montrant les relations entre les phases et les termes utilisés pour décrire les changements de phase.
Diagramme montrant les relations entre les phases et les termes utilisés pour décrire les changements de phase.
En plus des propriétés chimiques spécifiques qui distinguent différentes classifications chimiques, les produits chimiques peuvent exister en plusieurs phases. Pour la plupart, les classifications chimiques sont indépendantes de ces classifications de phase en vrac; cependant, certaines phases plus exotiques sont incompatibles avec certaines propriétés chimiques. Une phase est un ensemble d’états d’un système chimique qui ont des propriétés structurelles globales similaires, sur une gamme de conditions, telles que la pression ou la température .
Les propriétés physiques, telles que la densité et l’indice de réfraction, ont tendance à se situer dans les valeurs caractéristiques de la phase. La phase de la matière est définie par la transition de phase , c’est-à-dire lorsque l’énergie introduite ou retirée du système sert à réorganiser la structure du système, au lieu de modifier les conditions de masse.
Parfois, la distinction entre les phases peut être continue au lieu d’avoir une frontière discrète. Dans ce cas, la matière est considérée comme étant dans un état supercritique . Lorsque trois états se rencontrent en fonction des conditions, cela s’appelle un point triple et, comme il est invariant, c’est un moyen pratique de définir un ensemble de conditions.
Les exemples les plus connus de phases sont les solides , les liquides et les gaz . De nombreuses substances présentent plusieurs phases solides. Par exemple, il existe trois phases de fer solide (alpha, gamma et delta) qui varient en fonction de la température et de la pression. Une différence principale entre les phases solides est la structure cristalline , ou l’arrangement, des atomes. Une autre phase couramment rencontrée dans l’étude de la chimie est la phase aqueuse , qui est l’état des substances dissoutes en solution aqueuse (c’est-à-dire dans l’eau).
Les phases moins connues comprennent les plasmas , les condensats de Bose-Einstein et les condensats fermioniques et les phases paramagnétiques et ferromagnétiques des matériaux magnétiques . Alors que la plupart des phases familières traitent des systèmes tridimensionnels, il est également possible de définir des analogues dans les systèmes bidimensionnels, ce qui a retenu l’attention pour sa pertinence pour les systèmes en biologie .
Collage
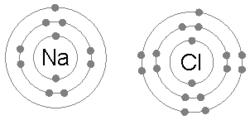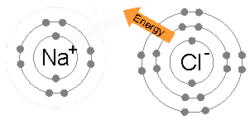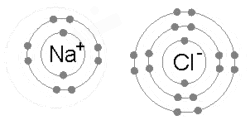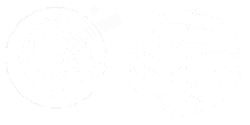
 Une animation du processus de liaison ionique entre le sodium (Na) et le chlore (Cl) pour former le chlorure de sodium , ou sel de table commun. La liaison ionique implique qu’un atome prend des électrons de valence d’un autre (par opposition au partage, qui se produit dans la liaison covalente)
Une animation du processus de liaison ionique entre le sodium (Na) et le chlore (Cl) pour former le chlorure de sodium , ou sel de table commun. La liaison ionique implique qu’un atome prend des électrons de valence d’un autre (par opposition au partage, qui se produit dans la liaison covalente)
On dit que les atomes collés ensemble dans des molécules ou des cristaux sont liés les uns aux autres. Une liaison chimique peut être visualisée comme l’ équilibre multipolaire entre les charges positives dans les noyaux et les charges négatives oscillant autour d’eux. [27] Plus qu’une simple attraction et répulsion, les énergies et les distributions caractérisent la disponibilité d’un électron à se lier à un autre atome.
La liaison chimique peut être une liaison covalente , une liaison ionique , une liaison hydrogène ou simplement à cause de la force de Van der Waals . Chacun de ces types de liens est attribué à un certain potentiel. Ces potentiels créent les interactions qui maintiennent les atomes ensemble dans les molécules ou les cristaux . Dans de nombreux composés simples, la théorie des liaisons de valence , le modèle de répulsion des paires d’électrons de la coque de Valence ( VSEPR ) et le concept de nombre d’oxydation peuvent être utilisés pour expliquer la structure et la composition moléculaires.
Une liaison ionique se forme lorsqu’un métal perd un ou plusieurs de ses électrons, devenant un Cation chargé positivement, et les électrons sont ensuite gagnés par l’atome non métallique, devenant un Anion chargé négativement. Les deux ions chargés de manière opposée s’attirent et la liaison ionique est la force électrostatique d’attraction entre eux. Par exemple, le sodium (Na), un métal, perd un électron pour devenir un Cation Na + tandis que le chlore (Cl), un non-métal, gagne cet électron pour devenir Cl − . Les ions sont maintenus ensemble en raison de l’attraction électrostatique et ce composé de chlorure de sodium (NaCl), ou sel de table commun, se forme.

 Dans la molécule de méthane (CH 4 ), l’atome de carbone partage une paire d’électrons de valence avec chacun des quatre atomes d’hydrogène. Ainsi, la règle de l’octet est satisfaite pour l’atome C (il a huit électrons dans sa couche de valence) et la règle du duo est satisfaite pour les atomes H (ils ont deux électrons dans leur couche de valence).
Dans la molécule de méthane (CH 4 ), l’atome de carbone partage une paire d’électrons de valence avec chacun des quatre atomes d’hydrogène. Ainsi, la règle de l’octet est satisfaite pour l’atome C (il a huit électrons dans sa couche de valence) et la règle du duo est satisfaite pour les atomes H (ils ont deux électrons dans leur couche de valence).
Dans une liaison covalente, une ou plusieurs paires d’ électrons de valence sont partagées par deux atomes : le groupe électriquement neutre résultant d’atomes liés est appelé une molécule . Les atomes partageront des électrons de valence de manière à créer une configuration électronique de gaz rare (huit électrons dans leur enveloppe la plus externe) pour chaque atome. On dit que les atomes qui ont tendance à se combiner de telle sorte qu’ils ont chacun huit électrons dans leur couche de valence suivent la règle de l’octet . Cependant, certains éléments comme l’hydrogène et le lithium n’ont besoin que de deux électrons dans leur couche la plus externe pour atteindre cette configuration stable ; on dit que ces atomes suivent la règle du duo, et de cette façon ils atteignent la configuration électronique du gaz rare hélium , qui a deux électrons dans sa coque externe.
De même, les théories de la physique classique peuvent être utilisées pour prédire de nombreuses structures ioniques. Avec des composés plus compliqués, tels que des complexes métalliques , la théorie des liaisons de valence est moins applicable et des approches alternatives, telles que la théorie des orbitales moléculaires , sont généralement utilisées. Voir schéma sur les orbitales électroniques.
Énergie
Dans le contexte de la chimie, l’énergie est un attribut d’une substance résultant de sa structure atomique , moléculaire ou agrégée . Puisqu’une transformation chimique s’accompagne d’un changement dans un ou plusieurs de ces types de structures, elle s’accompagne invariablement d’une augmentation ou d’ une diminution de l’énergie des substances impliquées. Une certaine énergie est transférée entre l’environnement et les réactifs de la réaction sous forme de chaleur ou de lumière ; ainsi les produits d’une réaction peuvent avoir plus ou moins d’énergie que les réactifs.
Une réaction est dite exergonique si l’état final est inférieur sur l’échelle d’énergie à l’état initial ; dans le cas des réactions endergoniques, la situation est inverse. Une réaction est dite exothermique si la réaction libère de la chaleur dans l’environnement ; dans le cas des réactions endothermiques , la réaction absorbe la chaleur de l’environnement.
Les réactions chimiques ne sont invariablement possibles que si les réactifs surmontent une barrière énergétique connue sous le nom d’ énergie d’activation . La vitesse d’une réaction chimique (à une température donnée T) est liée à l’énergie d’activation E, par le facteur de population de Boltzmann e − E / k T {displaystyle e^{-E/kT}} 
– c’est-à-dire la probabilité qu’une molécule ait une énergie supérieure ou égale à E à la température donnée T. Cette dépendance exponentielle d’une vitesse de réaction à la température est connue sous le nom d’ équation d’Arrhenius . L’énergie d’activation nécessaire pour qu’une réaction chimique se produise peut être sous forme de chaleur, de lumière, d’ électricité ou de force mécanique sous forme d’ ultrasons . [28]
Un concept connexe d’énergie libre , qui intègre également des considérations d’entropie, est un moyen très utile pour prédire la faisabilité d’une réaction et déterminer l’état d’équilibre d’une réaction chimique, en thermodynamique chimique . Une réaction n’est possible que si la variation totale de l’ énergie libre de Gibbs est négative, Δ G ≤ 0 {displaystyle Delta Gleq 0,} 
; s’il est égal à zéro, la réaction chimique est dite à l’ équilibre .
Il n’existe que des états d’énergie possibles limités pour les électrons, les atomes et les molécules. Celles-ci sont déterminées par les règles de la mécanique quantique , qui nécessitent la quantification de l’énergie d’un système lié. Les atomes/molécules dans un état d’énergie plus élevé sont dits excités. Les molécules/atomes de substance dans un état d’énergie excité sont souvent beaucoup plus réactifs ; c’est-à-dire plus propice aux réactions chimiques.
La phase d’une substance est invariablement déterminée par son énergie et l’énergie de son environnement. Lorsque les forces intermoléculaires d’une substance sont telles que l’énergie de l’environnement n’est pas suffisante pour les vaincre, elle se produit dans une phase plus ordonnée comme liquide ou solide comme c’est le cas avec l’eau (H 2 O) ; un liquide à température ambiante car ses molécules sont liées par des liaisons hydrogène . [29] Alors que le sulfure d’hydrogène (H 2 S) est un gaz à température ambiante et à pression standard, car ses molécules sont liées par des interactions dipôle-dipôle plus faibles .
Le transfert d’énergie d’une substance chimique à une autre dépend de la taille des quanta d’énergie émis par une substance. Cependant, l’énergie thermique est souvent transférée plus facilement de presque n’importe quelle substance à une autre car les phonons responsables des niveaux d’énergie vibratoire et rotationnelle dans une substance ont beaucoup moins d’énergie que les photons .invoqué pour le transfert d’énergie électronique. Ainsi, étant donné que les niveaux d’énergie vibrationnelle et rotationnelle sont plus étroitement espacés que les niveaux d’énergie électronique, la chaleur est plus facilement transférée entre les substances par rapport à la lumière ou à d’autres formes d’énergie électronique. Par exemple, le rayonnement électromagnétique ultraviolet n’est pas transféré avec autant d’efficacité d’une substance à une autre que l’énergie thermique ou électrique.
L’existence de niveaux d’énergie caractéristiques pour différentes substances chimiques est utile pour leur identification par l’analyse des raies spectrales . Différents types de spectres sont souvent utilisés en spectroscopie chimique , par exemple IR , micro -ondes , RMN , ESR , etc. La spectroscopie est également utilisée pour identifier la composition d’objets éloignés – comme les étoiles et les galaxies lointaines – en analysant leurs spectres de rayonnement.

 Spectre d’émission du fer
Spectre d’émission du fer
Le terme énergie chimique est souvent utilisé pour indiquer le potentiel d’une substance chimique à subir une transformation par une réaction chimique ou à transformer d’autres substances chimiques.
Réaction

 Au cours des réactions chimiques, les liaisons entre les atomes se rompent et se forment, donnant naissance à différentes substances aux propriétés différentes. Dans un haut fourneau, l’oxyde de fer, un composé , réagit avec le monoxyde de carbone pour former du fer, l’un des éléments chimiques , et du dioxyde de carbone.
Au cours des réactions chimiques, les liaisons entre les atomes se rompent et se forment, donnant naissance à différentes substances aux propriétés différentes. Dans un haut fourneau, l’oxyde de fer, un composé , réagit avec le monoxyde de carbone pour former du fer, l’un des éléments chimiques , et du dioxyde de carbone.
Lorsqu’une substance chimique se transforme à la suite de son interaction avec une autre substance ou avec de l’énergie, on dit qu’une réaction chimique s’est produite. Une réaction chimique est donc un concept lié à la “réaction” d’une substance lorsqu’elle entre en contact étroit avec une autre, que ce soit sous forme de mélange ou de solution ; l’exposition à une certaine forme d’énergie, ou les deux. Il en résulte un échange d’énergie entre les constituants de la réaction ainsi qu’avec l’environnement du système, qui peuvent être des récipients conçus – souvent de la verrerie de laboratoire .
Les réactions chimiques peuvent entraîner la formation ou la dissociation de molécules, c’est-à-dire la rupture de molécules pour former deux molécules ou plus ou le réarrangement d’atomes à l’intérieur ou entre les molécules. Les réactions chimiques impliquent généralement la création ou la rupture de liaisons chimiques. L’oxydation, la réduction , la dissociation , la neutralisation acido-basique et le réarrangement moléculaire sont quelques-uns des types de réactions chimiques couramment utilisés.
Une réaction chimique peut être représentée symboliquement par une équation chimique . Alors que dans une réaction chimique non nucléaire, le nombre et le type d’atomes des deux côtés de l’équation sont égaux, pour une réaction nucléaire, cela n’est vrai que pour les particules nucléaires, à savoir. Protons et Neutrons. [30]
La séquence d’étapes au cours de laquelle la réorganisation des liaisons chimiques peut avoir lieu au cours d’une réaction chimique est appelée son mécanisme . On peut envisager qu’une réaction chimique se déroule en plusieurs étapes, dont chacune peut avoir une vitesse différente. De nombreux intermédiaires réactionnels à stabilité variable peuvent ainsi être envisagés au cours d’une réaction. Des mécanismes de réaction sont proposés pour expliquer la cinétique et le mélange relatif de produits d’une réaction. De nombreux physico-chimistes se spécialisent dans l’exploration et la proposition des mécanismes de diverses réactions chimiques. Plusieurs règles empiriques, comme les règles de Woodward-Hoffmann, sont souvent utiles tout en proposant un mécanisme pour une réaction chimique.
Selon le livre d’or de l’ IUPAC , une réaction chimique est “un processus qui aboutit à l’interconversion d’espèces chimiques”. [31] Par conséquent, une réaction chimique peut être une réaction élémentaire ou une réaction par étapes . Une mise en garde supplémentaire est faite, en ce que cette définition inclut les cas où l’ interconversion des conformères est expérimentalement observable. De telles réactions chimiques détectables impliquent normalement des ensembles d’entités moléculaires comme indiqué par cette définition, mais il est souvent conceptuellement pratique d’utiliser le terme également pour des changements impliquant des entités moléculaires uniques (c’est-à-dire des « événements chimiques microscopiques »).
Ions et sels

 La structure du réseau cristallin du chlorure de potassium (KCl), un sel qui se forme en raison de l’attraction des cations K + et des anions Cl – . Notez que la charge globale du composé ionique est nulle.
La structure du réseau cristallin du chlorure de potassium (KCl), un sel qui se forme en raison de l’attraction des cations K + et des anions Cl – . Notez que la charge globale du composé ionique est nulle.
Un ion est une espèce chargée, un atome ou une molécule, qui a perdu ou gagné un ou plusieurs électrons. Lorsqu’un atome perd un électron et a donc plus de Protons que d’électrons, l’atome est un ion ou un Cation chargé positivement . Lorsqu’un atome gagne un électron et a donc plus d’électrons que de Protons, l’atome est un ion ou un Anion chargé négativement . Les cations et les anions peuvent former un réseau cristallin de sels neutres , tels que les ions Na + et Cl- formant le chlorure de sodium , ou NaCl. Des exemples d’ ions polyatomiques qui ne se séparent pas lors des réactions acide-base sont l’hydroxyde (OH –) et phosphate (PO 4 3− ).
Le plasma est composé de matière gazeuse qui a été complètement ionisée, généralement à haute température.
Acidité et basicité
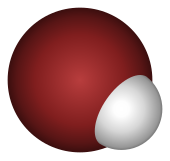
 Le bromure d’hydrogène existe en phase gazeuse sous forme de molécule diatomique
Le bromure d’hydrogène existe en phase gazeuse sous forme de molécule diatomique
Une substance peut souvent être classée comme un acide ou une base . Il existe plusieurs théories différentes qui expliquent le comportement acide-base. La plus simple est la théorie d’Arrhenius , qui stipule que l’acide est une substance qui produit des ions hydronium lorsqu’il est dissous dans l’eau, et qu’une base est celle qui produit des ions hydroxyde lorsqu’elle est dissoute dans l’eau. Selon la théorie acide-base de Brønsted–Lowry , les acides sont des substances qui donnent un ion hydrogène positif à une autre substance lors d’une réaction chimique ; par extension, une base est la substance qui reçoit cet ion hydrogène.
Une troisième théorie commune est la théorie acide-base de Lewis , qui est basée sur la formation de nouvelles liaisons chimiques. La théorie de Lewis explique qu’un acide est une substance capable d’accepter une paire d’électrons d’une autre substance au cours du processus de formation de la liaison, tandis qu’une base est une substance qui peut fournir une paire d’électrons pour former une nouvelle liaison. Selon cette théorie, les éléments cruciaux échangés sont les charges. [32] [ source non fiable ? ] Il existe plusieurs autres manières de classer une substance comme acide ou comme base, comme le montre l’histoire de ce concept. [33]
La force de l’acide est généralement mesurée par deux méthodes. Une mesure, basée sur la définition d’Arrhenius de l’acidité, est le pH , qui est une mesure de la concentration en ions hydronium dans une solution, exprimée sur une échelle logarithmique négative . Ainsi, les solutions qui ont un pH bas ont une concentration élevée en ions hydronium et peuvent être dites plus acides. L’autre mesure, basée sur la définition de Brønsted-Lowry, est la constante de dissociation acide (K a ), qui mesure la capacité relative d’une substance à agir comme un acide selon la définition de Brønsted-Lowry d’un acide. Autrement dit, les substances avec un K a plus élevé sont plus susceptibles de donner des ions hydrogène dans les réactions chimiques que celles avec un K a plus faiblevaleurs.
Rédox
Les réactions d’ oxydoréduction ( réduction – oxydation ) comprennent toutes les réactions chimiques dans lesquelles les atomes voient leur état d’ oxydation modifié en gagnant des électrons (réduction) ou en perdant des électrons (oxydation). Les substances qui ont la capacité d’oxyder d’autres substances sont dites oxydantes et sont appelées agents oxydants, oxydants ou oxydants. Un oxydant élimine les électrons d’une autre substance. De même, les substances qui ont la capacité de réduire d’autres substances sont dites réductrices et sont appelées agents réducteurs, réducteurs ou réducteurs.
Un réducteur transfère des électrons à une autre substance et s’oxyde ainsi lui-même. Et parce qu’il “donne” des électrons, on l’appelle aussi un donneur d’électrons. L’oxydation et la réduction se réfèrent correctement à un changement du nombre d’oxydation – le transfert réel d’électrons peut ne jamais se produire. Ainsi, l’oxydation est mieux définie comme une augmentation du nombre d’oxydation et la réduction comme une diminution du nombre d’oxydation.
Équilibre
Bien que le concept d’ équilibre soit largement utilisé dans toutes les sciences, dans le contexte de la chimie, il apparaît chaque fois qu’un certain nombre d’états différents de la composition chimique sont possibles, comme par exemple dans un mélange de plusieurs composés chimiques qui peuvent réagir les uns avec les autres, ou lorsqu’une substance peut être présente dans plus d’un type de phase.
Un système de substances chimiques à l’équilibre, bien qu’ayant une composition invariable, n’est le plus souvent pas statique ; les molécules des substances continuent à réagir les unes avec les autres, créant ainsi un équilibre dynamique . Ainsi, le concept décrit l’état dans lequel les paramètres tels que la composition chimique restent inchangés dans le temps.
Lois chimiques
Les réactions chimiques sont régies par certaines lois, qui sont devenues des concepts fondamentaux en chimie. Certains d’entre eux sont:
- La loi d’Avogadro
- Loi Beer-Lambert
- Loi de Boyle (1662, reliant la pression et le volume)
- Loi de Charles (1787, concernant le volume et la température)
- Les lois de diffusion de Fick
- Loi de Gay-Lussac (1809, reliant pression et température)
- Le principe de Le Chatelier
- La loi d’Henri
- Loi de Hess
- La loi de la conservation de l’énergie conduit aux concepts importants d’ équilibre , de thermodynamique et de cinétique .
- La loi de conservation de la masse continue d’être conservée dans les systèmes isolés , même dans la physique moderne. Cependant, la relativité restreinte montre qu’en raison de l’équivalence masse-énergie , chaque fois qu’une “énergie” non matérielle (chaleur, lumière, énergie cinétique) est retirée d’un système non isolé, une certaine masse sera perdue avec lui. Les pertes d’énergie élevées entraînent la perte de quantités pesables de masse, un sujet important en chimie nucléaire .
- Loi de composition définie , bien que dans de nombreux systèmes (notamment les biomacromolécules et les minéraux), les rapports aient tendance à nécessiter de grands nombres et soient fréquemment représentés sous forme de fraction.
- Loi des proportions multiples
- loi de Raoult
Histoire
L’ histoire de la chimie s’étend sur une période très ancienne jusqu’à nos jours. Depuis plusieurs millénaires avant notre ère, les civilisations utilisaient des technologies qui finiraient par former la base des différentes branches de la chimie. Les exemples incluent l’extraction de métaux à partir de minerais , la fabrication de poteries et d’émaux, la fermentation de bière et de vin, l’extraction de produits chimiques à partir de plantes pour la médecine et le parfum, la transformation de graisse en savon , la fabrication de verre et la fabrication d’ alliages comme le bronze . La chimie a été précédée par sa protoscience, l’ alchimie, qui est une approche intuitive mais non scientifique pour comprendre les constituants de la matière et leurs interactions. Il n’a pas réussi à expliquer la nature de la matière et ses transformations, mais, en réalisant des expériences et en enregistrant les résultats, les alchimistes ont ouvert la voie à la chimie moderne. La chimie en tant qu’ensemble de connaissances distinct de l’alchimie a commencé à émerger lorsqu’une différenciation claire a été faite entre elles par Robert Boyle dans son ouvrage The Skeptical Chymist (1661). Alors que l’alchimie et la chimie s’intéressent à la matière et à ses transformations, la différence cruciale a été donnée par la méthode scientifique que les chimistesemployés à leur travail. La chimie est considérée comme devenue une science établie avec les travaux d’ Antoine Lavoisier , qui a développé une loi de conservation de la masse qui exigeait une mesure minutieuse et des observations quantitatives des phénomènes chimiques. L’histoire de la chimie est intimement liée à l’ histoire de la thermodynamique , notamment à travers les travaux de Willard Gibbs . [34]
Définition
La définition de la chimie a changé au fil du temps, à mesure que de nouvelles découvertes et théories ajoutent à la fonctionnalité de la science. Le terme « chimie », de l’avis du célèbre scientifique Robert Boyle en 1661, signifiait le sujet des principes matériels des corps mixtes. [35] En 1663, le chimiste Christopher Glaser décrit la « chimie » comme un art scientifique, par lequel on apprend à dissoudre les corps, et à en tirer les différentes substances sur leur composition, et comment les unir à nouveau, et les exalter à un perfection supérieure. [36]
La définition de 1730 du mot “chimie”, telle qu’utilisée par Georg Ernst Stahl , signifiait l’art de résoudre des corps mixtes, composés ou agrégés en leurs principes; et de composer de tels corps à partir de ces principes. [37] En 1837, Jean-Baptiste Dumas considérait le mot “chimie” comme faisant référence à la science concernée par les lois et les effets des forces moléculaires. [38] Cette définition a encore évolué jusqu’à ce qu’en 1947, elle en vienne à signifier la science des substances : leur structure, leurs propriétés et les réactions qui les transforment en d’autres substances – une caractérisation acceptée par Linus Pauling . [39] Plus récemment, en 1998, le professeur Raymond Changa élargi la définition de “chimie” pour désigner l’étude de la matière et des changements qu’elle subit. [40]
Discipline

 La philosophie atomiste de Démocrite a ensuite été adoptée par Épicure (341-270 avant notre ère).
La philosophie atomiste de Démocrite a ensuite été adoptée par Épicure (341-270 avant notre ère).
Les premières civilisations, comme les Égyptiens [41] , les Babyloniens et les Indiens [42] , ont amassé des connaissances pratiques concernant les arts de la métallurgie, de la poterie et des teintures, mais n’ont pas développé de théorie systématique.
Une hypothèse chimique de base est apparue pour la première fois dans la Grèce classique avec la théorie des quatre éléments proposée définitivement par Aristote déclarant que le feu , l’air , la terre et l’eau étaient les éléments fondamentaux à partir desquels tout est formé comme une combinaison. L’ atomisme grec remonte à 440 av. J.-C., apparaissant dans les œuvres de philosophes tels que Démocrite et Épicure . En 50 avant notre ère, le philosophe romain Lucrèce a développé la théorie dans son livre De rerum natura (Sur la nature des choses). [43][44] Contrairement aux concepts modernes de la science, l’atomisme grec était de nature purement philosophique, avec peu de souci pour les observations empiriques et aucun souci pour les expériences chimiques. [45]
Une des premières formes de l’idée de conservation de la masse est la notion que « Rien ne vient de rien » dans la philosophie grecque antique , que l’on trouve chez Empédocle (env. IVe siècle avant J.-C.) : « Car il est impossible que quelque chose se produise. de ce qui n’est pas, et on ne peut ni provoquer ni entendre dire que ce qui est doit être complètement détruit.” [46] et Épicure (IIIe siècle av. J.-C.), qui, décrivant la nature de l’Univers, écrivait que “la totalité des choses a toujours été telle qu’elle est maintenant et sera toujours”. [47]

 Impression artistique du XVe siècle de Jābir ibn Hayyān (Geber), alchimiste perso-arabe et pionnier de la chimie organique .
Impression artistique du XVe siècle de Jābir ibn Hayyān (Geber), alchimiste perso-arabe et pionnier de la chimie organique .
Dans le monde hellénistique, l’art de l’alchimie a d’abord proliféré, mêlant magie et occultisme à l’étude des substances naturelles dans le but ultime de transmuter les éléments en or et de découvrir l’élixir de la vie éternelle. [48] Les travaux, en particulier le développement de la distillation , se sont poursuivis au début de la période byzantine , le praticien le plus célèbre étant le grec-égyptien Zosimos de Panopolis du 4ème siècle . [49] L’alchimie a continué à être développée et pratiquée dans tout le monde arabe après les conquêtes musulmanes , [50] et à partir de là, et des restes byzantins,[51] diffusé dans l’Europe médiévale et de la Renaissance à travers des traductions latines.
Les travaux arabes attribués à Jabir ibn Hayyan ont introduit une classification systématique des substances chimiques et fourni des instructions pour dériver un composé inorganique ( sal ammoniac ou chlorure d’ammonium ) à partir de substances organiques (telles que les plantes, le sang et les cheveux) par des moyens chimiques. [52] Certaines œuvres arabes jabiriennes (par exemple, le “Livre de la Miséricorde” et le “Livre des Soixante-dix”) ont ensuite été traduites en latin sous le nom latinisé “Geber”, [53] et dans l’Europe du XIIIe siècle, un écrivain anonyme , communément appelé pseudo-Geber , a commencé à produire des écrits alchimiques et métallurgiques sous ce nom. [54]Plus tard, des philosophes musulmans influents, tels qu’Abū al-Rayhān al-Bīrūnī [55] et Avicenne [56] ont contesté les théories de l’alchimie, en particulier la théorie de la transmutation des métaux .
Sous l’influence des nouvelles méthodes empiriques proposées par Sir Francis Bacon et d’autres, un groupe de chimistes d’ Oxford , Robert Boyle , Robert Hooke et John Mayow ont commencé à transformer les anciennes traditions alchimiques en une discipline scientifique. Boyle en particulier est considéré comme le père fondateur de la chimie en raison de son œuvre la plus importante, le texte de chimie classique The Skeptical Chymist où la différenciation est faite entre les affirmations de l’alchimie et les découvertes scientifiques empiriques de la nouvelle chimie. [57] Il a formulé la loi de Boyle, a rejeté les “quatre éléments” classiques et a proposé une alternative mécaniste d’atomes et de réactions chimiques qui pourrait être soumise à une expérience rigoureuse. [58]

 Antoine-Laurent de Lavoisier est considéré comme le “Père de la Chimie Moderne”. [59]
Antoine-Laurent de Lavoisier est considéré comme le “Père de la Chimie Moderne”. [59]
La théorie du phlogistique (une substance à l’origine de toute combustion) a été proposée par l’Allemand Georg Ernst Stahl au début du XVIIIe siècle et n’a été renversée qu’à la fin du siècle par le chimiste français Antoine Lavoisier , l’analogue chimique de Newton en la physique; qui a fait plus que tout autre pour établir la nouvelle science sur une base théorique appropriée, en élucidant le principe de la conservation de la masse et en développant un nouveau système de nomenclature chimique utilisé à ce jour. [60]
Avant son travail, cependant, de nombreuses découvertes importantes avaient été faites, concernant spécifiquement la nature de «l’air» qui était composé de nombreux gaz différents. Le chimiste écossais Joseph Black (le premier chimiste expérimental) et le flamand Jan Baptist van Helmont ont découvert le dioxyde de carbone , ou ce que Black appelait « l’air fixe » en 1754 ; Henry Cavendish a découvert l’hydrogène et élucidé ses propriétés et Joseph Priestley et, indépendamment, Carl Wilhelm Scheele ont isolé l’ oxygène pur .
Le scientifique anglais John Dalton a proposé la théorie moderne des atomes ; que toutes les substances sont composées d'”atomes” indivisibles de matière et que différents atomes ont des poids atomiques variables.
Le développement de la théorie électrochimique des combinaisons chimiques s’est produit au début du XIXe siècle à la suite des travaux de deux scientifiques en particulier, Jöns Jacob Berzelius et Humphry Davy , rendus possibles par l’invention antérieure de la pile voltaïque par Alessandro Volta . Davy a découvert neuf nouveaux éléments dont les métaux alcalins en les extrayant de leurs oxydes avec un courant électrique. [61]

 Dans son tableau périodique, Dmitri Mendeleev a prédit l’existence de 7 nouveaux éléments [62] et a placé les 60 éléments connus à l’époque à leur place correcte. [63]
Dans son tableau périodique, Dmitri Mendeleev a prédit l’existence de 7 nouveaux éléments [62] et a placé les 60 éléments connus à l’époque à leur place correcte. [63]
Le britannique William Prout a d’abord proposé de classer tous les éléments en fonction de leur poids atomique, car tous les atomes avaient un poids qui était un multiple exact du poids atomique de l’hydrogène. JAR Newlands a conçu un premier tableau des éléments, qui a ensuite été développé dans le tableau périodique des éléments moderne [64] dans les années 1860 par Dmitri Mendeleev et indépendamment par plusieurs autres scientifiques, dont Julius Lothar Meyer . [65] [66] Les gaz inertes, appelés plus tard les gaz nobles, ont été découverts par William Ramsay en collaboration avec Lord Rayleighà la fin du siècle, complétant ainsi la structure de base du tableau.

 En haut : résultats attendus : particules alpha passant à travers le modèle de plum pudding de l’atome non perturbé.
En haut : résultats attendus : particules alpha passant à travers le modèle de plum pudding de l’atome non perturbé.
En bas : résultats observés : une petite partie des particules a été déviée, indiquant une petite charge concentrée .
Au tournant du XXe siècle, les fondements théoriques de la chimie ont finalement été compris grâce à une série de découvertes remarquables qui ont réussi à sonder et à découvrir la nature même de la structure interne des atomes. En 1897, JJ Thomson de l’Université de Cambridge découvre l’ électron et peu après le scientifique français Becquerel ainsi que le couple Pierre et Marie Curie étudient le phénomène de la radioactivité . Dans une série d’expériences de diffusion pionnières Ernest Rutherford à l’ Université de Manchesterdécouvre la structure interne de l’atome et l’existence du proton, classe et explique les différents types de radioactivité et réussit à transmuter le premier élément en bombardant l’azote avec des particules alpha .
Son travail sur la structure atomique a été amélioré par ses étudiants, le physicien danois Niels Bohr et Henry Moseley . La théorie électronique des liaisons chimiques et des orbitales moléculaires a été développée par les scientifiques américains Linus Pauling et Gilbert N. Lewis .
L’année 2011 a été proclamée Année internationale de la chimie par les Nations Unies. [67] Il s’agissait d’une initiative de l’Union internationale de chimie pure et appliquée et de l’Organisation des Nations Unies pour l’éducation, la science et la culture et impliquait des sociétés chimiques, des universitaires et des institutions du monde entier et s’appuyait sur des initiatives individuelles pour organiser des activités locales et régionales. .
La chimie organique a été développée par Justus von Liebig et d’autres, suite à la synthèse de l’urée de Friedrich Wöhler . [68] D’autres avances cruciales du 19ème siècle étaient; une compréhension de la liaison de valence ( Edward Frankland en 1852) et l’application de la thermodynamique à la chimie ( JW Gibbs et Svante Arrhenius dans les années 1870).
Entraine toi
Sous-disciplines
| Cet article s’appuie en grande partie ou entièrement sur une source unique . ( septembre 2014 ) Relevant discussion may be found on the talk page. Please help improve this article by introducing citations to additional sources. Find sources: “Chemistry” – news · newspapers · books · scholar · JSTOR |
La chimie est généralement divisée en plusieurs grandes sous-disciplines. Il existe également plusieurs principaux domaines transdisciplinaires et plus spécialisés de la chimie. [69]
- La chimie analytique est l’analyse d’échantillons de matériaux pour comprendre leur composition chimique et leur structure . La chimie analytique intègre des méthodes expérimentales normalisées en chimie. Ces méthodes peuvent être utilisées dans toutes les sous-disciplines de la chimie, à l’exclusion de la chimie purement théorique.
- La biochimie est l’étude des produits chimiques , des réactions chimiques et des interactions chimiques qui ont lieu dans les organismes vivants . La biochimie et la chimie organique sont étroitement liées, comme en chimie médicinale ou en neurochimie . La biochimie est également associée à la biologie moléculaire et à la génétique .
- La chimie inorganique est l’étude des propriétés et des réactions des composés inorganiques. La distinction entre les disciplines organiques et inorganiques n’est pas absolue et il y a beaucoup de chevauchement, surtout dans la sous-discipline de la chimie organométallique .
- La chimie des matériaux est la préparation, la caractérisation et la compréhension de substances ayant une fonction utile. Le domaine est une nouvelle étendue d’études dans les programmes d’études supérieures, et il intègre des éléments de tous les domaines classiques de la chimie en mettant l’accent sur les problèmes fondamentaux qui sont propres aux matériaux. Les principaux systèmes d’étude comprennent la chimie des phases condensées (solides, liquides, polymères ) et les interfaces entre les différentes phases.
- La neurochimie est l’étude des substances neurochimiques ; y compris les transmetteurs, les peptides, les protéines, les lipides, les sucres et les acides nucléiques ; leurs interactions et les rôles qu’ils jouent dans la formation, le maintien et la modification du système nerveux.
- La chimie nucléaire est l’étude de la façon dont les particules subatomiques s’assemblent et forment des noyaux. La transmutation moderne est une composante importante de la chimie nucléaire, et le tableau des nucléides est un résultat et un outil important pour ce domaine.
- La chimie organique est l’étude de la structure, des propriétés, de la composition, des mécanismes et des réactions des composés organiques . Un composé organique est défini comme tout composé basé sur un squelette carboné.
- La chimie physique est l’étude de la base physique et fondamentale des systèmes et processus chimiques. En particulier, l’énergétique et la dynamique de tels systèmes et processus intéressent les physico-chimistes. Les domaines d’étude importants comprennent la thermodynamique chimique , la cinétique chimique , l’ électrochimie , la mécanique statistique , la spectroscopie et, plus récemment, l’ astrochimie . [70] La chimie physique a un grand chevauchement avec la physique moléculaire . La chimie physique implique l’utilisation du calcul infinitésimal pour dériver des équations. Il est généralement associé à la chimie quantiqueet la chimie théorique. La chimie physique est une discipline distincte de la physique chimique , mais encore une fois, il y a un très fort chevauchement.
- La chimie théorique est l’étude de la chimie via un raisonnement théorique fondamental (généralement dans le cadre des mathématiques ou de la physique ). En particulier, l’application de la mécanique quantique à la chimie est appelée chimie quantique . Depuis la fin de la Seconde Guerre mondiale , le développement des ordinateurs a permis un développement systématique de la chimie computationnelle , qui est l’art de développer et d’appliquer des programmes informatiques pour résoudre des problèmes chimiques. La chimie théorique a un large chevauchement avec la physique de la matière condensée (théorique et expérimentale) et la physique moléculaire .
D’autres disciplines de la chimie sont traditionnellement regroupées selon le type de matière étudiée ou le type d’étude. Il s’agit notamment de la chimie inorganique , l’étude de la matière inorganique ; la chimie organique , l’étude de la matière organique (à base de carbone) ; la biochimie , l’étude des substances présentes dans les organismes biologiques ; la chimie physique , l’ étude des processus chimiques utilisant des concepts physiques tels que la thermodynamique et la mécanique quantique ; et la chimie analytique , l’analyse d’échantillons de matériaux pour acquérir une compréhension de leurcomposition chimique et structure . De nombreuses disciplines plus spécialisées ont vu le jour ces dernières années, par exemple la neurochimie l’étude chimique du système nerveux (voir sous- disciplines ).
D’autres domaines comprennent l’ agrochimie , l’ astrochimie (et la cosmochimie ), la chimie atmosphérique , le génie chimique , la biologie chimique , la chimio-informatique , l’ électrochimie , la chimie environnementale , la femtochimie , la chimie des arômes, la chimie des flux , la géochimie , la chimie verte , l’ histochimie , l’histoire de la chimie , la chimie de l’hydrogénation . , immunochimie ,chimie marine , science des matériaux , chimie mathématique , mécanochimie , chimie médicinale , biologie moléculaire , mécanique moléculaire , nanotechnologie , chimie des produits naturels , œnologie , chimie organométallique , pétrochimie , pharmacologie , photochimie , chimie organique physique , phytochimie , chimie des polymères , radiochimie , solide- chimie d’état, sonochimie , chimie supramoléculaire , chimie de surface , chimie de synthèse , thermochimie , et bien d’autres.
Industrie
L’ industrie chimique représente une activité économique importante dans le monde. Les 50 premiers producteurs mondiaux de produits chimiques en 2013 ont réalisé des ventes de 980,5 milliards de dollars US avec une marge bénéficiaire de 10,3 %. [71]
Sociétés professionnelles
- Société américaine de chimie
- Société américaine de neurochimie
- Institut chimique du Canada
- Société chimique du Pérou
- Union internationale de chimie pure et appliquée
- Institut royal australien de chimie
- Société royale néerlandaise de chimie
- Société royale de chimie
- Société de l’industrie chimique
- Association mondiale des chimistes théoriques et informatiques
- Liste des sociétés de chimie
Voir également
-
![]()
![]() Portail de la chimie
Portail de la chimie -
![icon]()
![icon]() Portail scientifique
Portail scientifique
- Comparaison de logiciels de modélisation de la mécanique moléculaire
- Glossaire des termes de chimie
- Année internationale de la chimie
- Liste des chimistes
- Liste des composés
- Liste des publications importantes en chimie
- Liste des problèmes non résolus en chimie
- Aperçu de la chimie
- Systèmes périodiques de petites molécules
- Philosophie de la chimie
- Tourisme scientifique
Références
- ^ Brown, Théodore L.; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Murphey, Catherine J.; Woodward, Patrick M.; Stoltzfus, Matthew W.; Lufaso, Michael W. (2018). “Introduction: Matière, énergie et mesure”. Chimie: The Central Science (14e éd.). New York : Pearson. p. 46–85. ISBN 9780134414232.
- ^ “Qu’est-ce que la chimie?” . Chemweb.ucc.ie. Archivé de l’original le 3 octobre 2018 . Récupéré le 12 juin 2011 .
- ^ “Définition de la CHIMIE” . www.merriam-webster.com . Récupéré le 24 août 2020 .
- ^ “Définition de la chimie | Dictionary.com” . www.dictionary.com . Récupéré le 24 août 2020 .
- ^ “La chimie est partout” . Société américaine de chimie .
- ^ Carsten Reinhardt. Sciences chimiques au 20e siècle : franchir les frontières . Wiley-VCH, 2001. ISBN 3-527-30271-9 . p. 1–2.
- ^ Théodore L. Brown, H. Eugène Lemay, Bruce Edward Bursten, H. Lemay. Chimie : la science centrale . Prentice Hall; 8 édition (1999). ISBN 0-13-010310-1 . p. 3–4.
- ^ “Histoire de l’Alchimie” . Laboratoire d’alchimie . Récupéré le 12 juin 2011 .
- ^ “alchimie”, entrée dans The Oxford English Dictionary , JA Simpson et ESC Weiner, vol. 1, 2e éd., 1989, ISBN 0-19-861213-3 .
- ^ Weekley, Ernest (1967). Dictionnaire étymologique de l’anglais moderne. New York : Publications de Douvres. ISBN 0-486-21873-2
- ^ “liaison chimique” . Britannique . Encyclopædia Britannica . Récupéré le 1er novembre 2012 .
- ^ Matière: Atomes de Démocrite à Dalton par Anthony Carpi, Ph.D.
- ^ Définition du livre d’or IUPAC
- ^ “California Occupational Guide Number 22: Chemists” . Calmis.ca.gov. 29 octobre 1999. Archivé de l’original le 10 juin 2011 . Récupéré le 12 juin 2011 .
- ^ “Chimie générale en ligne – Notes d’accompagnement : matière” . Antoine.frostburg.edu . Récupéré le 12 juin 2011 .
- ^ Armstrong, James (2012). Général, organique et biochimie : une approche appliquée . Brooks/Cole . p. 48. ISBN 978-0-534-49349-3.
- ^ Burrows et al. 2008 , p. 13. sfn error: no target: CITEREFBurrowsHolmanParsonsPilling2008 (help)
- ^ un b Housecroft & Sharpe 2008 , p. 2.
- ^ Burrows et al. 2009 , p. 110.
- ^ Burrows et al. 2008 , p. 12. sfn error: no target: CITEREFBurrowsHolmanParsonsPilling2008 (help)
- ^ “Nomenclature IUPAC de Chimie Organique” . Acdlabs.com . Récupéré le 12 juin 2011 .
- ^ Connelly, Neil G. ; Damhus, Turé ; Hartshorn, Richard M. ; En ligneHutton, Alan T. (2005). Nomenclature des recommandations de l’ IUPAC en chimie inorganique 2005 . RSCPublishing. p. 5 –12. ISBN 978-0-85404-438-2.
- ^ Colline, JW; Petrucci, RH; McCreary, TW ; Perry, SS (2005). Chimie générale (4e éd.). Upper Saddle River, New Jersey : Pearson Prentice Hall. p. 37.
- ^ MM Avedesian; Hugues Baker. Magnésium et alliages de magnésium . ASM International. p. 59.
- ^ Burrows et al. 2008 , p. 16. sfn error: no target: CITEREFBurrowsHolmanParsonsPilling2008 (help)
- ^ Atkins & de Paula 2009 , p. 9.
- ^ Apprentissage de la vision. “Liaison chimique par Anthony Carpi, Ph” . apprentissage de la vision . Récupéré le 12 juin 2011 .
- ^ Reilly, Michael. (2007). La force mécanique induit une réaction chimique , service de presse NewScientist.com, Reilly
- ^ Changer les états de la matière – Chemforkids.com
- ^ Équation de réaction chimique – Livre d’or IUPAC
- ^ Livre d’or Réaction chimique IUPAC Goldbook
- ^ “Le Concept Acide-Base de Lewis” . Abside . 19 mai 2003. Archivé de l’original le 27 mai 2008 . Récupéré le 31 juillet 2010 .
- ^ “Histoire de l’acidité” . Bbc.co.uk. 27 mai 2004 . Récupéré le 12 juin 2011 .
- ^ Articles classiques sélectionnés de l’histoire de la chimie
- ^ Boyle, Robert (1661). Le chimiste sceptique . New York : Dover Publications, Inc. (réimpression). ISBN 978-0-486-42825-3.
- ^ Glaser, Christophe (1663). Traité de la chymie . Paris. comme trouvé dans : Kim, Mi Gyung (2003). Affinité, ce rêve insaisissable – Une généalogie de la révolution chimique . La presse du MIT. ISBN 978-0-262-11273-4.
- ^ Stahl, George, E. (1730). Principes philosophiques de la chimie universelle . Londres.
- ^ Dumas, JB (1837). ‘Affinite’ (notes de cours), vii, p 4. “Statique chimique”, Paris: Académie des Sciences
- ^ Pauling, Linus (1947). Chimie générale . Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Chang, Raymond (1998). Chimie, 6e éd . New York : McGraw Hill. ISBN 978-0-07-115221-1.
- ^ Premiers chimistes , 13 février 1999, New Scientist
- ^ Barnes, Ruth (2004). Textiles dans les sociétés de l’océan Indien . Routledge. p. 1 . ISBN 9780415297660.
- ^ Lucrèce. “de Rerum Natura (Sur la nature des choses)” . Les archives des classiques Internet . Institut de technologie du Massachusetts . Récupéré le 9 janvier 2007 .
- ^ Simpson, David (29 juin 2005). “Lucrèce (vers 99-55 avant notre ère)” . L’histoire Internet de la philosophie . Récupéré le 10 novembre 2020 .
- ^ Strodach, George K. (2012). L’art du bonheur . New York : Classiques des pingouins. p. 7–8. ISBN 978-0-14-310721-7.
- ^ Père. 12; voir pp.291-2 de Kirk, GS ; JE Corbeau; Malcom Schofield (1983). Les philosophes présocratiques (2 éd.). Cambridge : Presse universitaire de Cambridge . ISBN 978-0-521-27455-5.
- ^ Long, AA; DN Sedley (1987). « L’épicurisme : Les principes de la conservation ». Les philosophes hellénistiques. Vol 1 : Traductions des principales sources avec commentaire philosophique . Cambridge : Cambridge University Press. p. 25–26. ISBN 978-0-521-27556-9.
- ^ “Année internationale de la chimie – L’histoire de la chimie” . GIT Laboratoire Journal Europe. 25 février 2011. Archivé de l’original le 15 juin 2013 . Récupéré le 12 mars 2013 .
- ^ Bryan H. Bunch et Alexander Hellemans (2004). L’histoire des sciences et des techniques . Houghton Mifflin Harcourt. p. 88 . ISBN 978-0-618-22123-3.
- ^ Morris Kline (1985) Mathématiques pour le non-mathématicien . Courrier Douvres Publications. p. 284. ISBN 0-486-24823-2
- ↑ Marcelin Berthelot , Collection des anciens alchimistes grecs (3 vol., Paris, 1887-1888, p. 161) ; F. Sherwood Taylor, “Les origines de l’alchimie grecque”, Ambix 1 (1937), 40.
- ^ Stapleton, Henry E. et Azo, RF et Hidayat Husain, M. 1927. “Chimie en Irak et en Perse au dixième siècle après JC” dans: Mémoires de la Société asiatique du Bengale , vol. VIII, non. 6, pp. 317-418, pp. 338–340 ; Kraus, Paul 1942-1943. Jâbir ibn Hayyân : Contribution à l’histoire des idées scientifiques dans l’Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque . Le Caire : Institut français d’archéologie orientale, vol. II, p. 41–42.
- ^ Darmstaedter, Ernst. “Liber Misericordiae Geber: Eine lateinische Übersetzung des gröβeren Kitâb l-raḥma”, Archiv für Geschichte der Medizin , 17/4, 1925, pp. 181–197; Berthelot, Marcellin. « Archéologie et Histoire des sciences », Mémoires de l’Académie des sciences de l’Institut de France , 49, 1906, pp. 308-363 ; voir aussi Forster, Regula. “Jābir b. Ḥayyān” , Encyclopédie de l’Islam, Trois .
- ^ Newman, William R. “Nouvelle lumière sur l’identité de Geber”, Sudhoffs Archiv , 1985, 69, pp. 76–90; Newman, William R. The Summa perfectionis of Pseudo-Geber: Une édition critique, une traduction et une étude , Leiden: Brill, 1991, pp. 57–103. Il a été soutenu par Ahmad Y. Al-Hassan que les œuvres pseudo-Geber ont en fait été traduites en latin à partir de l’arabe (voir Al-Hassan, Ahmad Y. “The Arabic Origin of the Summa and Geber Latin Works: A Refutation of Berthelot , Ruska et Newman sur la base de sources arabes “, dans: Ahmad Y. Al-Hassan. Studies in al-Kimya ‘: Critical Issues in Latin and Arabic Alchemy and Chemistry . Hildesheim: Georg Olms Verlag, 2009, pp. 53–104 ; également disponible en ligne ).
- ^ Marmura, Michael E.; Nasr, Seyyed Hossein (1965). ” Une introduction aux doctrines cosmologiques islamiques. Conceptions de la nature et méthodes utilisées pour son étude par les Ikhwan Al-Safa’an, Al-Biruni et Ibn Sina par Seyyed Hossein Nasr” . Spéculum . 40 (4): 744–746. doi : 10.2307/2851429 . JSTOR 2851429 .
- ^ Robert Briffault (1938). La fabrication de l’humanité , pp. 196–197.
- ^ “Robert Boyle, fondateur de la chimie moderne” Harry Sootin (2011)
- ^ “Histoire – Robert Boyle (1627–1691)” . BBC . Récupéré le 12 juin 2011 .
- ^ Aigle, Cassandra T.; Jennifer Sloan (1998). “Marie Anne Paulze Lavoisier: La Mère de la Chimie Moderne”. L’éducateur chimique . 3 (5): 1–18. doi : 10.1007/s00897980249a . S2CID 97557390 .
- ^ Mi Gyung Kim (2003). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution . Presse du MIT. p. 440 . ISBN 978-0-262-11273-4.
- ^ Davy, Humphry (1808). “Sur certains nouveaux phénomènes de changements chimiques produits par l’électricité, en particulier la décomposition des alcalis fixes et l’exposition des nouvelles substances qui constituent leurs bases” . Transactions philosophiques de la Royal Society . 98 : 1–45. doi : 10.1098/rstl.1808.0001 .
- ^ Notes de cours de chimie 412. “Une brève histoire du développement du tableau périodique” . Université de l’Ouest de l’Oregon . Récupéré le 20 juillet 2015 .
- ^ Remarque : “… il est sûrement vrai que si Mendeleev n’avait jamais vécu, les chimistes modernes utiliseraient un tableau périodique” et “Dmitri Mendeleev” . Société Royale de Chimie . Récupéré le 18 juillet 2015 .
- ^ Hiver, Marc. “WebElements : le tableau périodique sur le web” . L’ Université de Sheffield . Archivé de l’original le 4 janvier 2014 . Récupéré le 27 janvier 2014 .
- ^ “Julius Lothar Meyer et Dmitri Ivanovitch Mendeleïev” . Institut d’histoire des sciences. juin 2016 . Récupéré le 20 mars 2018 .
- ↑ « Qu’est-ce qui fait que ces ressemblances familiales sont parmi les éléments ? Dans les années 1860, tout le monde se grattait la tête à ce sujet, et plusieurs scientifiques se sont dirigés vers des réponses assez similaires. L’homme qui a résolu le problème le plus triomphalement était un jeune Russe appelé Dmitri Ivanovich Mendeleev, qui a visité la mine de sel de Wieliczka en 1859.” Bronowski, Jacob (1973). L’Ascension de l’Homme . Petit, Brown et compagnie. p. 322 . ISBN 978-0-316-10930-7.
- ^ “Chimie” . Chimie2011.org. Archivé de l’original le 8 octobre 2011 . Récupéré le 10 mars 2012 .
- ^ Ihde, Aaron John (1984). Le développement de la chimie moderne . Courrier Douvres Publications. p. 164. ISBN 978-0-486-64235-2.
- ^ WG Laidlaw; DE Ryan; Gary Horlick; HC Clark; Josef Takats ; Martin Cowie; RU Lemieux (10 décembre 1986). « Sous-disciplines de la chimie » . L’Encyclopédie canadienne . Archivé de l’original le 12 mars 2012 . Récupéré le 12 juin 2011 .
- ^ Herbst, Éric (12 mai 2005). “Chimie des régions de formation d’étoiles”. Journal de chimie physique A . 109 (18): 4017–4029. Bibcode : 2005JPCA..109.4017H . doi : 10.1021/jp050461c . PMID 16833724 .
- ^ Tullo, Alexander H. (28 juillet 2014). “Les 50 meilleures entreprises chimiques mondiales de C&EN pour 2014” . Nouvelles de la chimie et de l’ingénierie . Société américaine de chimie . Récupéré le 22 août 2014 .
Bibliographie
- Atkins, Peter ; de Paula, Julio (2009) [1992]. Éléments de chimie physique (5e éd.). New York : Presse universitaire d’Oxford . ISBN 978-0-19-922672-6.
- Terriers, Andrew ; Holman, John; Parsons, Andrew ; Pilling, Gwen ; Prix, Gareth (2009). Chimie 3 . Italie : Oxford University Press . ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Chimie inorganique (3e éd.). Harlow, Essex : Éducation Pearson . ISBN 978-0-13-175553-6.
Lectures complémentaires
Lecture populaire
- Atkins, PW Galileo’s Finger ( Oxford University Press ) ISBN 0-19-860941-8
- Atkins, Molécules de PW Atkins (Cambridge University Press) ISBN 0-521-82397-8
- Kean, Sam. The Disappearing Spoon – and Other True Tales from the Periodic Table (Black Swan) Londres, 2010 ISBN 978-0-552-77750-6
- Levi, Primo The Periodic Table (Penguin Books) [1975] traduit de l’italien par Raymond Rosenthal (1984) ISBN 978-0-14-139944-7
- Stwertka, A. Un guide des éléments (Oxford University Press) ISBN 0-19-515027-9
- “Dictionnaire de l’Histoire des Idées” . Archivé de l’original le 10 mars 2008.
- “Chimie” . Encyclopædia Britannica . Vol. 6 (11e éd.). 1911. pp. 33–76.
Manuels d’introduction au premier cycle
- Atkins, PW, Overton, T., Rourke, J., Weller, M. et Armstrong, F. Shriver et Atkins Inorganic Chemistry (4e édition) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Chang, Raymond. Chimie 6e éd. Boston: James M. Smith, 1998. ISBN 0-07-115221-0 .
- Clayden, Jonathan ; Greeves, Nick ; Warren, Stuart ; Wothers, Peter (2001). Chimie organique (1ère éd.). Presse universitaire d’Oxford. ISBN 978-0-19-850346-0.
- Voet et Voet. Biochimie (Wiley) ISBN 0-471-58651-X
Manuels avancés de premier cycle ou de deuxième cycle
- Atkins, PW Chimie physique (Oxford University Press) ISBN 0-19-879285-9
- Atkins, PW et al. Mécanique quantique moléculaire (Oxford University Press)
- McWeeny, Valence de R. Coulson (Oxford Science Publications) ISBN 0-19-855144-4
- Pauling, L. La nature de la liaison chimique (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L. et Wilson, EB Introduction à la mécanique quantique avec applications à la chimie (Dover Publications) ISBN 0-486-64871-0
- Smart et Moore. Chimie du solide: une introduction (Chapman et Hall) ISBN 0-412-40040-5
- Stephenson, G. Méthodes mathématiques pour les étudiants en sciences (Longman) ISBN 0-582-44416-0
Liens externes
Chimiedans les projets frères de Wikipédia
-
![]()
![]() Définitions du Wiktionnaire
Définitions du Wiktionnaire -
![]()
![]() Médias de Commons
Médias de Commons -
![]()
![]() Nouvelles de Wikinews
Nouvelles de Wikinews -
![]()
![]() Citations de Wikiquote
Citations de Wikiquote -
![]()
![]() Textes de Wikisource
Textes de Wikisource -
![]()
![]() Manuels de Wikibooks
Manuels de Wikibooks
- Principes généraux de chimie, modèles et applications .