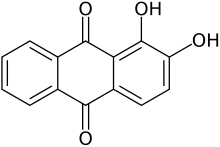
Alizarine
L’alizarine (également connue sous le nom de 1,2-dihydroxyanthraquinone , Mordant Red 11 , CI 58000 et Turkey Red [1] ) est un composé organique de formule C14H8O4qui a été utilisé tout au long de l’histoire comme colorant rouge proéminent , principalement pour teindre les tissus textiles. Historiquement, il était dérivé des racines de plantes du genre garance . [2] En 1869, il est devenu le premier colorant naturel à être produit synthétiquement. [3]
 |
|
 |
|
 |
|
| Des noms | |
|---|---|
| Nom IUPAC préféré 1,2-Dihydroxyanthracène-9,10-dione | |
| Autres noms 1,2-Dihydroxy-9,10-anthracènedione 1,2-Dihydroxyanthraquinone Rouge de dinde Rouge mordant 11 Alizarine B Rouge alizarine |
|
| Identifiants | |
| Numero CAS |
|
| Modèle 3D ( JSmol ) |
|
| 3DMet |
|
| Référence Beilstein | 1914037 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| Carte d’information de l’ECHA | 100.000.711 |
| Référence Gmelin | 34541 |
| KEGG |
|
| CID PubChem |
|
| UNII |
|
| Tableau de bord CompTox ( EPA ) |
|
InChI
|
|
SOURIRES
|
|
| Propriétés | |
| Formule chimique | C14H8O4 _ _ _ _ _ |
| Masse molaire | 240,214 g · mol -1 |
| Apparence | cristaux ou poudre rouge orangé |
| Densité | 1,540 g/cm 3 |
| Point de fusion | 279 à 283 ° C (534 à 541 ° F; 552 à 556 K) |
| Point d’ébullition | 430 ° C (806 ° F; 703 K) |
| solubilité dans l’eau | légèrement à peu soluble |
| Acidité (p K a ) | 6,94 |
| Dangers | |
| Étiquetage SGH : | |
| Pictogrammes |  |
| Mention d’avertissement | Avertissement |
| Mentions de danger | H302 , H315 , H319 |
| Conseils de prudence | P264 , P270 , P280 , P301+P312 , P302+P352 , P305+P351+P338 , P321 , P330 , P332+P313 , P337+P313 , P362 , P501 |
| Fiche de données de sécurité (FDS) | FDS externe |
| Composés apparentés | |
| Composés apparentés | anthraquinone , anthracène |
| Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
L’alizarine est l’ingrédient principal pour la fabrication des pigments de laque de garance connus des peintres sous le nom de garance rose et de pourpre d’alizarine . L’alizarine dans l’usage le plus courant du terme a une couleur rouge foncé, mais le terme fait également partie du nom de plusieurs colorants non rouges apparentés, tels que le vert cyanine alizarine et le bleu brillant alizarine. Une utilisation notable de l’alizarine dans les temps modernes est comme agent de coloration dans la recherche biologique car elle colore le calcium libre et certains composés de calcium d’une couleur rouge ou violet clair. L’alizarine continue d’être utilisée commercialement comme colorant textile rouge, mais dans une moindre mesure que par le passé.
Histoire
La garance est cultivée comme matière colorante depuis l’Antiquité en Asie centrale et en Égypte , où elle était cultivée dès 1500 av. Un tissu teint avec un pigment de racine de garance a été trouvé dans la tombe du pharaon Toutankhamon , [4] dans les ruines de Pompéi [ citation nécessaire ] , et dans l’ancienne Athènes et Corinthe . [5] Au Moyen Âge, Charlemagne a encouragé la culture de la garance. La garance était largement utilisée comme teinture en Europe occidentale à la fin du Moyen Âge. [6]Dans l’Angleterre du XVIIe siècle, l’alizarine était utilisée comme teinture rouge pour les vêtements de la New Model Army parlementaire . La couleur rouge distinctive continuerait à être portée pendant des siècles (bien qu’elle soit également produite par d’autres colorants tels que la cochenille ), donnant aux soldats anglais et plus tard britanniques le surnom de ” redcoats “.
![]()
![]() couleur alizarine
couleur alizarine
Le colorant de garance est associé à un mordant de teinture . Selon le mordant utilisé, la couleur résultante peut aller du rose au violet en passant par le brun foncé. Au 18ème siècle, la couleur la plus appréciée était un rouge vif connu sous le nom de “rouge de Turquie”. La combinaison de mordants et de technique globale utilisée pour obtenir le Turkey Red est originaire du Moyen-Orient ou de Turquie (d’où le nom). C’était une technique complexe et en plusieurs étapes dans sa formulation moyen-orientale, dont certaines parties étaient inutiles. [7] Le processus a été simplifié dans l’Europe de la fin du XVIIIe siècle. En 1804, un teinturier George Field en Grande-Bretagne avait affiné une technique pour fabriquer de la garance lacustre en la traitant avec de l’ alun et un alcali .[8] qui convertit l’extrait de garance soluble dans l’eau en un pigment solide et insoluble. Cette laque de garance résultante a une couleur plus durable et peut être utilisée plus efficacement, par exemple en la mélangeant dans une peinture . Au cours des années suivantes, il a été découvert que d’autres sels métalliques, y compris ceux contenant du fer , de l’ étain et du chrome , pouvaient être utilisés à la place de l’alun pour donner des pigments à base de garance de diverses autres couleurs. Cette méthode générale de préparation des lacs est connue depuis des siècles [9] mais a été simplifiée à la fin du XVIIIe et au début du XIXe siècle.
En 1826, le chimiste français Pierre-Jean Robiquet a découvert que la racine de garance contenait deux colorants, l’alizarine rouge et la purpurine qui s’estompait plus rapidement . [10] Le composant alizarine est devenu le premier colorant naturel à être dupliqué synthétiquement en 1868 lorsque les chimistes allemands Carl Graebe et Carl Liebermann , travaillant pour BASF , ont trouvé un moyen de le produire à partir d’ anthracène . [11] La société Bayer AG puise également ses racines dans l’alizarine. [12] À peu près à la même époque, le chimiste anglaisWilliam Henry Perkin a découvert indépendamment la même synthèse, bien que le groupe BASF ait déposé son brevet avant Perkin d’un jour. La découverte ultérieure (faite par Broenner et Gutzhow en 1871) que l’anthracène pouvait être extrait du goudron de houille a encore renforcé l’importance et l’abordabilité de la synthèse artificielle de l’alizarine. [13]
L’alizarine synthétique pouvait être produite pour une fraction du coût du produit naturel, et le marché de la garance s’est effondré pratiquement du jour au lendemain. La synthèse principale impliquait l’oxydation de l’acide anthraquinone-2-sulfonique avec du nitrate de sodium dans de l’hydroxyde de sodium concentré . L’alizarine elle-même a été à son tour largement remplacée aujourd’hui par les pigments de quinacridone plus résistants à la lumière développés chez DuPont en 1958.
Structure et propriétés

 La 1,4-dihydroxyanthraquinone, également appelée Quinizarine , est un isomère de l’alizarine. [3] [14]
La 1,4-dihydroxyanthraquinone, également appelée Quinizarine , est un isomère de l’alizarine. [3] [14]
L’alizarine est l’un des dix isomères de la dihydroxyanthraquinone . Il est soluble dans l’hexane et le chloroforme et peut être obtenu à partir de ce dernier sous forme de cristaux rouge-violet, point de fusion 277–278 °C. [2]
L’alizarine change de couleur en fonction du pH de la solution dans laquelle elle se trouve, ce qui en fait un indicateur de pH . [15]
Applications
Le Rouge d’Alizarine est utilisé dans un dosage biochimique pour déterminer, quantitativement par colorimétrie , la présence de dépôts calcifiants par les cellules d’une lignée ostéogénique . En tant que tel, il s’agit d’un marqueur de stade précoce (jours 10 à 16 de culture in vitro) de la minéralisation de la matrice, une étape cruciale vers la formation de la matrice extracellulaire calcifiée associée à l’os véritable. [ citation nécessaire ]
Les capacités de l’alizarine en tant que colorant biologique ont été notées pour la première fois en 1567, lorsqu’il a été observé que lorsqu’il était donné aux animaux, il colorait leurs dents et leurs os en rouge. Le produit chimique est maintenant couramment utilisé dans les études médicales impliquant le calcium. Le calcium libre (ionique) forme des précipités avec l’alizarine et le bloc tissulaire contenant du calcium se colore immédiatement en rouge lorsqu’il est immergé dans l’alizarine. Ainsi, le calcium pur et le calcium des os et d’autres tissus peuvent être colorés. Ces éléments colorés à l’alizarine peuvent être mieux visualisés sous des lampes fluorescentes, excitées par 440–460 nm. [16] Le processus de coloration du calcium avec de l’alizarine fonctionne mieux lorsqu’il est effectué en solution acide (dans de nombreux laboratoires, il fonctionne mieux à un pH de 4,1 à 4,3). [17]
En pratique clinique, il est utilisé pour colorer le liquide synovial afin d’évaluer la présence de cristaux de phosphate de calcium basique. [18] L’alizarine a également été utilisée dans des études portant sur la croissance osseuse, l’ostéoporose, la moelle osseuse, les dépôts de calcium dans le système vasculaire, la signalisation cellulaire, l’expression génique, l’ingénierie tissulaire et les cellules souches mésenchymateuses. [17]
En géologie , il est utilisé comme colorant pour différencier les Minéraux carbonatés de calcium , en particulier la calcite et l’ aragonite en lame mince ou en surfaces polies. [19] [20]
La laque de garance était utilisée comme pigment rouge dans les peintures depuis l’Antiquité. [21]
-
![]()
![]()
Coloration à l’alizarine rouge des os embryonnaires de rat pour l’étude de l’ostéogenèse
-
![]()
![]()
Coq juvénile coloré à l’alizarine rouge ( Nematistius pectoralis ) éclairé par une lumière fluorescente. [22]
-
![]()
![]()
Johannes Vermeer, Le Christ dans la maison de Marthe et Marie, 1654-1656. La blouse rouge de Marie est peinte en laque de garance
-
![]()
![]()
Couvertures de reconstruction teintes à la garance
Voir également
- 1,2,4-Trihydroxyanthraquinone ou purpurine, un autre colorant rouge présent dans la racine de garance
- Encre d’alizarine
- Aniline
- Dihydroxyanthraquinone
- Hydroxyanthraquinone
- Liste des couleurs (compacte)
- Liste des colorants
- Diaphonisation
Références
- ^ Catalogue SigmaAldrich: Alizarine
- ^ a b La principale espèce de garance à partir de laquelle l’alizarine a été historiquement obtenue est Rubia tinctorum . Voir aussi Vankar, PS ; Shanker, R.; Mahanta, D.; Tiwari, SC (2008). “Teinture Sonicator écologique du coton avec Rubia cordifolia Linn. Utilisation de Biomordant”. Teintures et pigments . 76 (1): 207–212. doi : 10.1016/j.dyepig.2006.08.023 .
- ^ un b Bien, H.-S.; Stawitz, J.; Wunderlich, K. “Colorants et intermédiaires d’anthraquinone”. Encyclopédie de chimie industrielle d’Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a02_355 .
- ^ Pfister, R. (décembre 1937). “Les Textiles du Tombeau de Toutankhamon” . Revue des arts asiatiques (en français). 11 (4): 209. JSTOR 43475067 . Consulté le 13 février 2021 .
- ^ Farnsworth, Marie (juillet 1951). “La garance rose du deuxième siècle avant JC de Corinthe et d’Athènes” . Journal américain d’archéologie . 55 (3): 236–239. doi : 10.2307/500972 . JSTOR 500972 . Consulté le 13 février 2021 .
- ↑ De nombreux exemples d’utilisation du mot « garance », signifiant les racines de la plante Rubia tinctorum utilisées comme colorant, sont donnés dans le Middle English Dictionary , un dictionnaire de l’anglais médiéval tardif.
- ^ Lowengard, S. (2006). “Industrie et Idées: Turquie Rouge” . La création de la couleur dans l’Europe du XVIIIe siècle . Gutenberg-E.org. ISBN 9780231503693.Histoire supplémentaire du XVIIIe siècle à “Turkey Red Dyeing in Blackley – The Delaunay Dyeworks” . ColorantsInHistory.org.
- ↑ Les notes de George Field sont conservées au Courtauld Institute of Art. Voir “CHAMP, George (?1777-1854)” . Récupéré le 04/08/2012 .
- ^ Thompson, DV (1956). Les matériaux et techniques de la peinture médiévale . Douvres. p. 115–124 . ISBN 978-0-486-20327-0.
- ^ Voir :
- Pierre-Jean Robiquet et Jean-Jacques Colin (1826) “Sur un nouveau principe immédiat des vègétaux (l’alizarine) obtenu de la garance” , Journal de pharmacie et des sciences accessoires , 2e série, 12 : 407–412.
- Jean-Jacques Colin et Pierre-Jean Robiquet (1827) « Nouvelles recherches sur la matière colorante de la garance » , Annales de chimie et de physique , 2e série, 34 : 225–253.
- ^ Remarque :
- En 1868, Graebe et Liebermann ont montré que l’alizarine peut être convertie en anthracène. Voir : C. Graebe et C. Liebermann (1868) “Ueber Alizarin, und Anthracen” (Sur l’alizarine et l’anthracène), Berichte der Deutschen chemischen Gesellschaft zu Berlin , 1 : 49-51.
- En 1869, Graebe et Liebermann annoncent avoir réussi à transformer l’anthracène en alizarine. Voir : C. Graebe et C. Liebermann (1869) “Ueber künstliche Bildung von Alizarin” (Sur la formation artificielle de l’alizarine), Berichte der Deutschen chemischen Gesellschaft zu Berlin , 2 : 14.
- Pour le procédé original de Graebe et Liebermann pour fabriquer de l’alizarine à partir d’anthracène, voir : Charles Graebe et Charles Liebermann, “Processus amélioré de préparation de l’alizarine”, brevet américain no. 95 465 (publié le 5 octobre 1869). (Voir aussi leur brevet anglais, n° 3 850, délivré le 18 décembre 1868.)
- Un procédé plus efficace pour fabriquer de l’alizarine à partir d’anthracène a été développé par Caro, Graebe et Liebermann en 1870. Voir : H. Caro, C. Graebe et C. Liebermann (1870) “Ueber Fabrikation von künstlichem Alizarin” (On the manufacture of artificial alizarine), Berichte der Deutschen chemischen Gesellschaft zu Berlin , 3 : 359-360.
- ^ “Histoire Les premières années (1863–1881)” . Bayer SA . Récupéré le 4 février 2021 .
- ^ Brönner, J.; En ligneGutzkow, H. (1871). “Verfahren zur Darstellung von Anthracen aus dem Pech von Steinkohlentheer, und zur Darstellung von Farbstoffen aus Anthracen” [Procédé de préparation d’anthracène à partir de brai de houille et de préparation de colorants à partir d’anthracène]. Dinglers Polytechnisches Journal (en allemand). 201 : 545–546.
- ^ Bigelow, LA; Reynolds, HH (1926). “Quinizarine“. Org. Synthé . 6 : 78. doi : 10.15227/orgsyn.006.0078 .
- ^ Meloan, SN; Puchtler, H.; Valentin, LS (1972). “Taches alcalines et acides d’alizarine rouge S pour les dépôts de calcium solubles dans les alcalis et insolubles dans les alcalis”. Archives de pathologie . 93 (3): 190-197. PMID 4110754 .
- ^ Smith, W. Lion; Buck, Chesney A.; Ornay, Grégory S.; Davis, Matthew P.; Martin, René P.; Gibson, Sarah Z.; Girard, Matthew G. (2018-08-20). “Amélioration des images de squelette de vertébrés : fluorescence et montage non permanent d’échantillons effacés et colorés” . Copée . 106 (3): 427–435. doi : 10.1643/cg-18-047 . ISSN 0045-8511 .
- ^ un b Puchtler, H.; Meloan, SN; Terry, MS (1969). “Sur l’histoire et le mécanisme des taches de rouge d’alizarine S pour le calcium” . Le Journal d’histochimie et de cytochimie . 17 (2): 110–124. doi : 10.1177/17.2.110 . PMID 4179464 .
- ^ Paul, H.; Reginato, AJ ; Schumacher, HR (1983). “La coloration au rouge d’alizarine S comme test de dépistage pour détecter les composés de calcium dans le liquide synovial” . Arthrite et rhumatisme . 26 (2): 191–200. doi : 10.1002/art.1780260211 . PMID 6186260 .
- ^ Vert, OR (2001). Manuel de techniques pratiques de laboratoire et de terrain en paléobiologie . Springer. p. 56. ISBN 978-0-412-58980-5.
- ^ Dickson, JAD (1966). “Identification et genèse des carbonates révélées par la coloration”. Journal de recherche sédimentaire . 36 (4): 491–505. doi : 10.1306/74D714F6-2B21-11D7-8648000102C1865D .
- ^ Schweppe, H., et Winter, J. Madder et Alizarin dans les pigments d’artistes. Un manuel de leur histoire et de leurs caractéristiques, Vol 3: EW Fitzhugh (Ed.) Oxford University Press 1997, p. 111 – 112
- ^ Smith, W. Lion; Buck, Chesney A.; Ornay, Grégory S.; Davis, Matthew P.; Martin, René P.; Gibson, Sarah Z.; Girard, Matthew G. (2018-08-20). “Amélioration des images de squelette de vertébrés: fluorescence et montage non permanent d’échantillons effacés et colorés”. Copée . 106 (3): 427–435. doi : 10.1643/cg-18-047 . ISSN 0045-8511 .
Lectures complémentaires
- Schweppe, H. et Winter, J. “Madder and Alizarin”, dans Pigments d’artistes: un manuel de leur histoire et de leurs caractéristiques, vol. 3 : EW Fitzhugh (Ed.) Oxford University Press 1997, pp. 109–142
Liens externes
| Wikimedia Commons a des médias liés à Alizarin . |
- Molécule du jour : Alizarine
- Lac de garance , Colourlex




