Composés organosoufrés
Les composés organosoufrés sont des composés organiques qui contiennent du soufre . [1] Ils sont souvent associés à des odeurs nauséabondes, mais bon nombre des composés les plus sucrés connus sont des dérivés organosoufrés, par exemple la saccharine . La nature regorge de composés organosoufrés – le soufre est essentiel à la vie. Sur les 20 Acides aminés courants , deux ( cystéine et méthionine ) sont des composés organosoufrés, et les antibiotiques pénicilline et Sulfamides contiennent tous deux du soufre. Alors que les antibiotiques contenant du soufre sauvent de nombreuses vies, la Moutarde au soufre est un Agent de guerre chimique mortel. Combustibles fossiles, charbon, le pétrole et le gaz naturel , qui sont dérivés d’organismes anciens, contiennent nécessairement des composés organosoufrés, dont l’élimination est un objectif majeur des Raffineries de pétrole .
Le soufre partage le groupe chalcogène avec l’oxygène , le sélénium et le tellure , et on s’attend à ce que les composés organosoufrés présentent des similitudes avec les composés carbone-oxygène, carbone-sélénium et carbone-tellure.
Un test chimique classique pour la détection des composés soufrés est la méthode halogène de Carius .
Des classes
Les composés organosoufrés peuvent être classés selon les groupes fonctionnels contenant du soufre , qui sont répertoriés (approximativement) par ordre décroissant de leur occurrence.
- Composés organosoufrés illustratifs
-
![]()
![]()
Allicine , le composé Aromatique actif de l’ail écrasé
-
![]()
![]()
( R )- Cystéine , un acide aminé contenant un groupe thiol
-
![]()
![]()
La méthionine , un acide aminé contenant un sulfure
-
![]()
![]()
Disulfure de diphényle , un disulfure représentatif
-
![]()
![]()
Dibenzothiophène , un composant du pétrole brut
-
![]()
![]()
L’acide perfluorooctanesulfonique , un tensioactif controversé
-
![]()
![]()
L’acide lipoïque , un cofacteur essentiel de quatre complexes enzymatiques mitochondriaux.
-
![]()
![]()
Structure centrale de la pénicilline , où “R” est le groupe variable.
-
![]()
![]()
Sulfanilamide , un Antibactérien Sulfamide , appelé Sulfamide .
-
![]()
![]()
Moutarde au soufre , un type de sulfure utilisé comme Agent de guerre chimique .
-
![]()
![]()
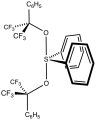
Sulfurane de Martin avec une structure en dents de scie, comme celle du SF 4 [2]
Sulfures
Les sulfures, anciennement connus sous le nom de thioéthers, sont caractérisés par des liaisons C−S−C [3] [4] Par rapport aux liaisons C−C, les liaisons C−S sont toutes deux plus longues, car les atomes de soufre sont plus gros que les atomes de carbone, et environ 10 % plus faible. Les longueurs de liaison représentatives dans les composés soufrés sont de 183 pm pour la liaison simple S-C dans le méthanethiol et de 173 pm dans le thiophène . L’ énergie de dissociation de la liaison C−S pour le thiométhane est de 89 kcal/mol (370 kJ/mol) par rapport aux 100 kcal/mol (420 kJ/mol) du méthane et lorsque l’hydrogène est remplacé par un groupe méthyle, l’énergie diminue à 73 kcal/mol (305 kJ/mole). [5] La liaison simple carbone-oxygèneest plus courte que celle de la liaison C−C. Les énergies de dissociation des liaisons pour le sulfure de diméthyle et l’éther diméthylique sont respectivement de 73 et 77 kcal/mol (305 et 322 kJ/mol).
Les sulfures sont généralement préparés par alkylation de thiols. Ils peuvent également être préparés via le réarrangement Pummerer . Dans une réaction appelée la Réaction de Ferrario, l’Éther phénylique est converti en phénoxathiine par l’action du soufre élémentaire et du chlorure d’aluminium . [6]


Les thioacétals et les thiocétals présentent une séquence de liaison C−S−C−S−C. Ils représentent une sous-classe de sulfures. Les thioacétals sont utiles dans le « umpolung » des groupes carbonyle. Les thioacétals et les thiocétals peuvent également être utilisés pour protéger un groupe carbonyle dans les synthèses organiques.
Les classes de composés soufrés ci-dessus existent également dans des structures hétérocycliques saturées et insaturées , souvent en combinaison avec d’autres Hétéroatomes , comme illustré par les thiiranes , les thiirènes , les thiétanes , les thiètes , les dithiétanes , les thiolanes , les thianes , les dithianes , les thiépanes , les thiépines , les thiazoles , les isothiazoles et les thiophènes , entre autres. Ces trois derniers composés représentent une classe particulière d’hétérocycles soufrés qui sont aromatiques. La Stabilisation de la résonance du thiophène est de 29 kcal/mol (121 kJ/mol) par rapport à 20 kcal/mol (84 kJ/mol) pour le furane analogue à l’oxygène . La raison de cette différence est l’ électronégativité plus élevée de l’oxygène attirant les électrons vers lui-même au détriment du courant du cycle Aromatique. Pourtant, en tant que substituant Aromatique , le groupe thio libère moins d’électrons que le groupe alcoxy. Les dibenzothiophènes (voir dessin), des hétérocycles tricycliques constitués de deux cycles benzéniques fusionnés à un cycle thiophène central, sont largement présents dans les fractions plus lourdes du pétrole.
Thiols, disulfures, polysulfures
Les groupes thiol contiennent la fonctionnalité R-SH. Les thiols sont structurellement similaires au groupe alcool , mais ces fonctionnalités sont très différentes dans leurs propriétés chimiques. Les thiols sont plus nucléophiles , plus acides et plus facilement oxydés. Cette acidité peut différer de 5 unités p K a . [7]
La différence d’ électronégativité entre le soufre (2,58) et l’hydrogène (2,20) est faible et, par conséquent, la Liaison hydrogène dans les thiols n’est pas importante. Les thiols aliphatiques forment des monocouches sur l’or , qui sont d’actualité en nanotechnologie .
Certains thiols aromatiques sont accessibles par une réaction de Herz .
Les disulfures R−S−S−R avec une liaison covalente soufre à soufre sont importants pour la réticulation : en biochimie pour le repliement et la stabilité de certaines protéines et en chimie des polymères pour la réticulation du caoutchouc.
Des chaînes soufrées plus longues sont également connues, comme dans le produit naturel varacine qui contient un cycle pentathiépine inhabituel (chaîne 5-soufre cyclisée sur un cycle benzénique).
Thioesters
Les thioesters ont la structure générale R-C(O)-S-R. Ils sont apparentés aux esters réguliers (R−C(O)−O−R) mais sont plus sensibles à l’hydrolyse et aux réactions associées. Les thioesters occupent une place importante en biochimie, en particulier dans la synthèse des acides gras .
Sulfoxydes, sulfones et thiosulfinates
Un sulfoxyde , R−S(O)−R, est le S -oxyde d’un sulfure (« sulfure oxyde »), une sulfone , R−S(O) 2 −R, est le S , S -dioxyde d’un sulfure , un thiosulfinate , R−S(O)−S−R, est le S -oxyde d’un disulfure, et un thiosulfonate, R−S(O) 2 −S−R, est le S , S -dioxyde d’un disulfure . Tous ces composés sont bien connus avec une chimie étendue, par exemple, le diméthylsulfoxyde , la diméthylsulfone et l’ allicine (voir dessin).
Sulfimides, sulfoximides, sulfonediimines
Les sulfimides (également appelés sulfimines) sont des composés soufre-azote de structure R 2 S=NR′, l’analogue azoté des sulfoxydes. Ils sont intéressants en partie en raison de leurs propriétés pharmacologiques. Lorsque deux groupes R différents sont attachés au soufre, les sulfures sont chiraux. Les sulfures forment des α-carbanions stables. [8]
Les sulfoximides (également appelés sulfoximines) sont des composés soufre-azote tétracoordonnés, isoélectroniques avec les sulfones, dans lesquels un atome d’oxygène de la sulfone est remplacé par un atome d’azote substitué, par exemple R 2 S(O)=NR′. Lorsque deux groupes R différents sont attachés au soufre, les sulfoximides sont chiraux. Une grande partie de l’intérêt pour cette classe de composés provient de la découverte que la méthionine sulfoximide (méthionine sulfoximine) est un inhibiteur de la glutamine synthétase . [9]
Les sulfonediimines (également appelées sulfodiimines, sulfodiimides ou sulfonediimides) sont des composés soufre-azote tétracoordonnés, isoélectroniques avec les sulfones, dans lesquels les deux atomes d’oxygène de la sulfone sont remplacés par un atome d’azote substitué, par exemple R 2 S(=NR′) 2 . Ils sont intéressants en raison de leur activité biologique et en tant que blocs de construction pour la synthèse d’hétérocycles. [dix]
S -Nitrosothiols
Les S – nitrosothiols , également connus sous le nom de thionitrites, sont des composés contenant un groupe nitroso attaché à l’atome de soufre d’un thiol, par exemple R-S-N=O. Ils ont reçu une attention considérable en biochimie parce qu’ils servent de donneurs de l’ion nitrosonium, NO + , et de l’oxyde nitrique, NO, qui peuvent servir de molécules de signalisation dans les systèmes vivants, en particulier liées à la vasodilatation. [11]
Halogénures de soufre
On connaît une large gamme de composés organosoufrés qui contiennent un ou plusieurs atomes d’ halogène (« X » dans les formules chimiques qui suivent) liés à un seul atome de soufre, par exemple : les halogénures de sulfényle , RSX ; halogénures de sulfinyle , RS(O)X; halogénures de sulfonyle , RSO 2 X; les trichlorures d’alkyle et d’arylsoufre, RSCl 3 et les trifluorures, RSF 3 ; [12] et les pentafluorures d’alkyle et d’arylsoufre, RSF 5 . [13] Moins bien connus sont les tétrahalogénures de dialkylsoufre, principalement représentés par les tétrafluorures, par exemple R 2 SF 4 . [14]
Thiocétones, thioaldéhydes et composés apparentés
Les composés avec des doubles liaisons entre le carbone et le soufre sont relativement rares, mais comprennent les composés importants disulfure de carbone , sulfure de carbonyle et thiophosgène . Les thiocétones (RC (= S) R ‘) sont rares avec des substituants alkyle, mais un exemple est la thiobenzophénone . Les thioaldéhydes sont encore plus rares, traduisant leur absence de protection stérique (« le thioformaldéhyde » existe sous forme de trimère cyclique). Les thioamides , de formule R 1 C(=S)N(R 2 )R 3 sont plus courants. Ils sont généralement préparés par la réaction d’amides avecRéactif de Lawesson . Les isothiocyanates , de formule R−N=C=S, se trouvent naturellement. Les aliments végétaux aux saveurs caractéristiques dues aux isothiocyanates comprennent le wasabi , le raifort , la moutarde , le radis , les choux de Bruxelles , le cresson , les capucines et les câpres .
S -oxydes et S , S -dioxydes de composés thiocarbonylés
Les S -oxydes de composés thiocarbonylés sont appelés thiocarbonyl S -oxydes ou sulfines, R 2 C=S=O, et thiocarbonyl S , S – dioxydes ou sulfènes , R 2 C=SO 2 . Ces composés sont bien connus avec une chimie extensive, par exemple, voir syn – propanethial – S – oxyde et sulfène .
Triples liaisons entre le carbone et le soufre
Les triples liaisons entre le soufre et le carbone dans les sulfaalcynes sont rares et peuvent être trouvées dans le monosulfure de carbone (CS) [15] et ont été suggérées pour les composés F 3 CCSF 3 [16] [17] et F 5 SCSF 3 . [18] Le composé HCSOH est également représenté comme ayant une triple liaison formelle. [19]
Acides thiocarboxyliques et thioamides
Les acides thiocarboxyliques (RC(O)SH) et les acides dithiocarboxyliques (RC(S)SH) sont bien connus. Ils sont structurellement similaires aux acides carboxyliques mais plus acides. Les thioamides sont analogues aux amides.
Acides sulfoniques, sulfiniques et sulféniques, esters, amides et composés apparentés
Les acides sulfoniques ont la fonctionnalité R-S(=O) 2 -OH. [20] Ce sont des acides forts qui sont généralement solubles dans les solvants organiques. Les acides sulfoniques comme l’acide trifluorométhanesulfonique sont un réactif fréquemment utilisé en chimie organique . Les acides sulfiniques ont une fonctionnalité R-S(O)-OH tandis que les acides sulféniques ont une fonctionnalité R-S-OH. Dans la série des acides sulfoniques-sulfiniques-sulféniques, la force et la stabilité de l’acide diminuent dans cet ordre. [21] [22] Sulfamides, sulfinamides et sulfénamides , de formules R−SO 2 NR′ 2 , R−S(O)NR′ 2, et R-SNR’ 2 , respectivement, ont chacun une chimie riche. Par exemple, les Sulfamides sont des Sulfamides dérivés de la sulfonation Aromatique . Les sulfinamides chiraux sont utilisés dans la synthèse asymétrique, tandis que les sulfénamides sont largement utilisés dans le processus de vulcanisation pour faciliter la réticulation. Les thiocyanates , R-S-CN, sont apparentés aux halogénures et esters de sulfényle en termes de réactivité.
Sulfonium, oxosulfonium et sels apparentés
Un ion sulfonium est un ion chargé positivement comportant trois substituants organiques attachés au soufre, avec la formule [R 3 S] + . Avec leur homologue chargé négativement, l’anion, les composés sont appelés sels de sulfonium. Un ion oxosulfonium est un ion chargé positivement comportant trois substituants organiques et un oxygène attaché au soufre, avec la formule [R 3 S=O] + . Avec leur homologue chargé négativement, l’anion, les composés sont appelés sels d’oxosulfonium. Les espèces apparentées comprennent les ions alcoxysulfonium et chlorosulfonium, [R2SOR ] + et [ R2SCl ] + , respectivement.
Sulfonium, oxosulfonium et ylures de thiocarbonyle
La déprotonation des sels de sulfonium et d’oxosulfonium donne des ylures , de structure R 2 S + -C – -R’ 2 et R 2 S(O) + -C – -R’ 2 . Alors que les ylures de sulfonium , par exemple dans la réaction Johnson – Corey – Chaykovsky utilisée pour synthétiser les époxydes , sont parfois dessinés avec une double liaison C = S, par exemple R 2 S = CR ‘ 2 , la liaison ylidique carbone-soufre est hautement polarisée et est mieux décrit comme étant ionique. Les ylures de sulfonium sont des intermédiaires clés dans le réarrangement de Stevens synthétiquement utile. Les ylures de thiocarbonyle (RR′C=S + −C − −RR′) peuvent se former par ouverture de cycle de thiiranes , photocyclisation de sulfures d’arylvinyle [23] ainsi que par d’autres procédés.
Sulfuranes et persulfuranes
Les sulfuranes sont des groupes fonctionnels relativement spécialisés qui sont des composés soufrés tétravalents et hypervalents , avec la formule SR 4 [24] et de même les persulfuranes sont des SR 6 hexavalents . Des complexes hexavalents tout carbone sont connus pour les représentants les plus lourds du groupe chalcogène , par exemple le composé hexaméthylpertellurane (Te(Me) 6 ) a été découvert en 1990 [25] par réaction de tétraméthyltellure avec du difluorure de xénon en TeF 2 (CH 3 ) 4 suivie d’une réaction avecdiméthylzinc . L’analogue soufré hexaméthylpersulfurane (S(CH 3 ) 6 ) a été prédit comme étant stable [26] mais n’a pas encore été synthétisé.
Le tout premier persulfurane tout carbone réellement synthétisé en laboratoire possède deux ligands méthyle et deux biphényle : [27]


Il est préparé à partir du sulfurane correspondant 1 avec du difluorure de xénon / trifluorure de bore dans de l’ acétonitrile jusqu’au sulfuranyl dication 2 suivi d’une réaction avec du méthyllithium dans du tétrahydrofurane en (un stable) persulfurane 3 comme isomère cis . La diffraction des rayons X montre des longueurs de liaison C-S comprises entre 189 et 193 pm (plus longues que la longueur de liaison standard) avec l’atome de soufre central dans une géométrie moléculaire octaédrique déformée .
La simulation informatique suggère que ces liaisons sont très polaires avec les charges négatives résidant sur le carbone.
Composés organosoufrés naturels
Tous les composés organosoufrés ne sont pas des polluants nauséabonds. La pénicilline et la céphalosporine sont des antibiotiques salvateurs , dérivés de champignons. La gliotoxine est une mycotoxine soufrée produite par plusieurs espèces de champignons à l’étude en tant qu’agent antiviral . Des composés comme l’ allicine et l’ ajoène sont responsables de l’odeur de l’ ail , et la lentionine contribue à la saveur des champignons shiitake . Les composés organosulfurés volatils contribuent également aux caractéristiques de saveur subtiles du vin , des noix et du fromage cheddar ., chocolat , café et fruits tropicaux. [28] Beaucoup de ces produits naturels ont également des propriétés médicinales importantes telles que la prévention de l’ agrégation plaquettaire ou la lutte contre le cancer.
Dans la pollution
La plupart des composés soufrés organiques présents dans l’environnement sont d’origine naturelle, car le soufre est essentiel à la vie et deux Acides aminés (cystéine et méthionine) contiennent cet élément.
Certains composés organosoufrés présents dans l’environnement sont générés en tant que sous-produits mineurs de procédés industriels tels que la fabrication de plastiques et de pneus.
Certains procédés générateurs d’odeurs sont des composés organosoufrés produits par la cokéfaction du charbon et conçus pour chasser les composés sulfureux et d’autres impuretés volatiles afin de produire du « carbone propre » ( coke ), qui est principalement utilisé pour la production d’acier.
Dans les énergies fossiles
Les odeurs se produisent également dans le traitement chimique du charbon ou du pétrole brut en produits chimiques précurseurs (matières premières) pour des utilisations industrielles en aval (par exemple , la production de plastiques ou de produits pharmaceutiques) et les besoins omniprésents de la distillation du pétrole pour la production d’ essences , de diesel et d’autres qualités de mazout .
Les composés organosoufrés peuvent être compris comme des contaminants aromatiques qui doivent être éliminés du gaz naturel avant les utilisations commerciales, des cheminées d’échappement et des évents d’échappement avant le rejet. Dans ce dernier contexte, on peut dire que les composés organosoufrés sont responsables des polluants dans les pluies acides sulfureuses ou, de manière équivalente, qu’ils sont des polluants dans la plupart des combustibles fossiles courants, en particulier le charbon .
Le composé organosoufré le plus courant présent dans toutes les fractions pétrolières est le thiophène (C 4 H 4 S), un liquide cyclique et Aromatique. De plus, les fractions lourdes du pétrole contiennent du benzothiophène (C 8 H 6 S, thianaphtène) et du dibenzothiophène . La plupart des derniers composés sont solides et sentent le naphtalène. De nombreux dérivés méthylés, diméthyl, diéthyl benzothiophène sont présents dans le diesel et les fiouls, ce qui rend les fiouls très difficiles à nettoyer.
Tous ces sulfures hétérocycliques représentent 200 à 500 ppm de carburant naturel, les dibenzothiophènes fortement substitués restent après HDS et représentent 10 à 20 ppm. Ces molécules se retrouvent aussi dans les charbons et doivent être éliminées avant consommation.
Le molybdène réduit associé au nickel est actuellement utilisé pour éliminer les thiophènes du pétrole (HDS) en raison de sa grande affinité avec le soufre. En outre, le tungstène, associé au nickel et au cobalt, est utilisé pour l’ hydrodésulfuration (HDS) dans les grandes raffineries. Il est proposé que le mécanisme d’adsorption du thiophène sur les métaux de transition se produise à travers le système π, où le composé organosoufré se trouve presque parallèle à la surface du métal. De nombreux chercheurs concentrent leurs efforts sur l’optimisation de l’état d’oxydation des métaux de transition pour HDS, comme Cu (I) et Ag (II) qui, avec Pd (0), se sont avérés plus spécifiques pour la liaison π avec des thiophènes de toutes sortes.
Base de l’odeur
Les humains et les autres animaux ont un odorat extrêmement sensible à l’ odeur des composés organosoufrés de faible valence tels que les thiols, les sulfures et les disulfures. Les thiols volatils malodorants sont des produits de dégradation des protéines présents dans les aliments putrides. L’identification sensible de ces composés est donc cruciale pour éviter l’intoxication. Des composés soufrés volatils de faible valence se trouvent également dans les zones où les niveaux d’oxygène dans l’air sont faibles, ce qui présente un risque d’étouffement. Il a été découvert que le cuivre est nécessaire pour la détection très sensible de certains thiols volatils et composés organosoufrés apparentés par les récepteurs olfactifs chez la souris. On ne sait pas encore si les humains ont également besoin de cuivre pour la détection sensible des thiols. [29]
Références
- ^ Bloc, E. (1978). Réactions des composés organosoufrés . Presse académique. ISBN 0-12-107050-6.
- ^ Martin, JC; Arhart, RJ; Franz, JA; Perozzi, EF; Kaplan, LJ “Bis[2,2,2-trifluoro-1-phényl-1-(trifluorométhyl)éthoxy]diphényl sulfurane”. Synthèses organiques . 57 : 22. doi : 10.15227/orgsyn.057.0022 .
- ^ Livre bleu IUPAC de chimie organique. Règles C-5 : Composés contenant du soufre bivalent http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ^ Livre bleu IUPAC de chimie organique. Recommandation R-5.7.1.3.4 Acides thiocarboxyliques et thiocarboniques. [1]
- ^ Manuel de chimie et de physique (81e éd.). Presse CRC. ISBN 0-8493-0481-4.
- ^ Suter, CM; Maxwell, Charles E. “Phénoxthine [Phénoxathiine]” . Synthèses organiques . 18 : 64. doi : 10.15227/orgsyn.018.0064 . ; Volume collectif , vol. 2, p. 485
- ^ Cremlyn, RJ (1996). Une introduction à la chimie des organosulfures . Chichester : John Wiley et fils. ISBN 0-471-95512-4.
- ^ García Ruano, JL; Cid, MB; Martin Castro, AM ; En ligneAlemán, J. (2008). ” S , S – Dialkylsulfimides acycliques”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. p. 352–375. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; En ligneGirek, T. (2008). ” S , S – Dialkylsulfoximides”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. p. 154–173. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; En ligneGirek, T. (2008). ” S , S – Dialkylsulfonediimines”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. pp. 173–180. ISBN 978-1-58890-530-7.
- ^ Zhang, Y.; Hogg, N. (2005). ” S -Nitrosothiols : formation et transport cellulaire”. Radic libre. Biol. Méd . 38 (7): 831–838. doi : 10.1016/j.freeradbiomed.2004.12.016 . PMID 15749378 .
- ^ Braverman, S.; Cherkinsky, M.; En ligneLevinger, S. (2008). “Trihalogénures d’alkylsoufre”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. pp. 187–188. ISBN 978-1-58890-530-7.
- ^ Sheppard, WA (1962). “Pentafluorures d’arylsoufre”. Confiture. Chim. Soc. 84 (16): 3064–3072. doi : 10.1021/ja00875a006 .
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; En ligneGirek, T. (2008). “Tétrahalogénures de dialkylsoufre”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. p. 123–124. ISBN 978-1-58890-530-7.
- ^ Moltzen, EK; Klabunde, KJ; Senning, A. (1988). “Monosulfure de carbone: un examen”. Chim. Rév . 88 (2): 391. doi : 10.1021/cr00084a003 .
- ^ Potter, B.; En ligneSepelt, K. (1984). « Trifluorure de trifluoroéthylidynesoufre, F 3 C−C≡SF 3 ». Angew. Chim. Int. Éd. angl. 23 (2): 150. doi : 10.1002/anie.198401501 .
- ^ Buschmann, J.; Damerius, R.; Gerhardt, R.; Lentz, D.; Luger, P.; Marschall, R.; Preugschat, D.; Seppelt, K.; En ligneSimon, A. (1992). “Trifluorure de soufre (trifluoroéthylidyne), F 3 CC≡SF 3 : deux structures à l’état solide et réactivité en tant que carbène”. Confiture. Chim. Soc. 114 (24) : 9465. doi : 10.1021/ja00050a027 .
- ^ Gerhardt, R.; Gerlbig, T.; Buschamann, J.; Luger, P.; En ligneSepelt, K. (1988). “L’unité SF 5 en tant que groupe protecteur stérique; synthèse et structure de F 5 S−C≡SF 3 “. Angew. Chim. Int. Éd. angl. 27 (11): 1534. doi : 10.1002/anie.198815341 .
- ^ Schreiner, P.; Reisenauer, H.; Romanski, J.; En ligneMloston, G. (2009). “Une triple liaison carbone-soufre formelle: H−C≡S−O−H”. Angew. Chim. Int. Éd. angl. 48 (43): 8133–8136. doi : 10.1002/anie.200903969 . PMID 19768827 .
- ^ Livre bleu IUPAC de chimie organique. C-6 Halogénures de soufre, sulfoxydes, sulfones et acides de soufre et leurs dérivés http://www.acdlabs.com/iupac/nomenclature/79/r79_26.htm
- ^ Braverman, S.; Cherkinsky, M.; En ligneLevinger, S. (2008). “Acides et sels alcanesulfiniques”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. pp. 196–211. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Kiełbasiński, P.; Łyżwa, P.; Zając, A.; En ligneMikołajczyk, M. (2008). “Acides alcanesulfoniques”. Dans Kambe, N. (éd.). Sciences de la Synthèse . Vol. 39. Thième. p. 550–557. ISBN 978-1-58890-530-7.
- ^ Schultz, AG; DeTar, MB (1976). “Ylures de thiocarbonyle. Réactions de photogénération, de réarrangement et de cycloaddition”. Confiture. Chim. Soc. 98 (12): 3564–3572. doi : 10.1021/ja00428a029 .
- ^ Martin, JC; Arhart, RJ; Franz, JA; Perozzi, EF; Kaplan, LJ “Bis[2,2,2-trifluoro-1-phényl-1-(trifluorométhyl)éthoxy]diphénylsulfurane” . Synthèses organiques . 57 : 22. doi : 10.15227/orgsyn.057.0022 . ; Volume collectif , vol. 6, p. 163
- ^ Ahmed, Latif; Morrison, John A. (1990). “Synthèse et caractérisation de l’hexaméthyltellure (VI)”. Confiture. Chim. Soc. 112 (20): 7411–7413. doi : 10.1021/ja00176a061 .
- ^ Fowler, JE; Schaefer, HF, III; Raymond, KN (1996). “Les Conformateurs du Groupe S 6 Points des Hexaméthylchalcogènes : Me 6 S, Me 6 Se, Me 6 Te”. Inorg. Chim . 35 (2): 279–281. doi : 10.1021/ic940240d . PMID 11666205 .
- ^ Sato, S.; Matsunaga, K.; Horn, E.; Furukawa, N.; En ligneNabeshima, T. (2006). “Isolement et structure moléculaire des organo-persulfuranes [12-S-6 (C6)]”. Confiture. Chim. Soc. 128 (21): 6778–6779. doi : 10.1021/ja060497y . PMID 16719444 .
- ^ Qian, MC; Ventilateur, X. ; Mahattanatawee, K., éd. (2011). Composés soufrés volatils dans les aliments . ACS Symposium Series 1068. Vol. 1068. Société américaine de chimie. doi : 10.1021/bk-2011-1068 . ISBN 978-0-8412-2616-6.
- ^ Duan, X.; Block, E.; Li, Z.; Connelly, T.; Zhang, J.; Huang, Z.; Su, X.; Pan, Y. ; Wu, L.; Chi, Q.; Thomas, S.; Zhang, S.; Ma, M.; Matsunami, H.; Chen, G.-Q. ; En ligneZhang, H. (2012). “Rôle crucial du cuivre dans la détection des odorants métal-coordination” . Proc. Natl. Acad. Sci. États- Unis . 109 (9): 3492–3497. Bibcode : 2012PNAS..109.3492D . doi : 10.1073/pnas.1111297109 . PMC 3295281 . PMID 22328155 .