Densité
La masse volumique (plus précisément, la masse volumique volumique , également appelée masse spécifique ), d’une substance est sa masse par unité de volume . Le symbole le plus souvent utilisé pour la densité est ρ (la lettre grecque minuscule rho ), bien que la lettre latine D puisse également être utilisée. Mathématiquement, la densité est définie comme la masse divisée par le volume : [1]
| Densité | |
|---|---|
 Une éprouvette graduée contenant divers liquides colorés non miscibles de densités différentes Une éprouvette graduée contenant divers liquides colorés non miscibles de densités différentes |
|
| Symboles communs | ρ , D |
| Unité SI | kg/ m3 |
| Vaste ? | Non |
| Intensif ? | Oui |
| Conservé ? | Non |
| Dérivations à partir d’ autres grandeurs |
ρ = m V {displaystyle rho ={frac {m}{V}}}  |
| Dimension | L − 3 M {displaystyle {mathsf {L}}^{-3}{mathsf {M}}}  |
ρ = m V {displaystyle rho ={frac {m}{V}}} 
où ρ est la masse volumique, m la masse et V le volume. Dans certains cas (par exemple, dans l’industrie pétrolière et gazière des États-Unis), la densité est vaguement définie comme son poids par unité de volume , [2] bien que cela soit scientifiquement inexact – cette quantité est plus spécifiquement appelée poids spécifique .
Pour un corps pur, la densité a la même valeur numérique que sa concentration massique . Différents matériaux ont généralement des densités différentes, et la densité peut être pertinente pour la flottabilité , la pureté et l’ Emballage . L’osmium et l’ iridium sont les éléments connus les plus denses dans des Conditions standard de température et de pression .
Pour simplifier les comparaisons de densité entre différents systèmes d’unités, elle est parfois remplacée par la quantité sans dimension ” densité relative ” ou ” Gravité spécifique “, c’est-à-dire le rapport de la densité du matériau à celle d’un matériau standard, généralement de l’eau. Ainsi, une densité relative inférieure à un par rapport à l’eau signifie que la substance flotte dans l’eau.
La densité d’un matériau varie avec la température et la pression. Cette variation est généralement faible pour les solides et les liquides, mais beaucoup plus grande pour les gaz. L’augmentation de la pression sur un objet diminue le volume de l’objet et augmente ainsi sa densité. L’augmentation de la température d’une substance (à quelques exceptions près) diminue sa densité en augmentant son volume. Dans la plupart des matériaux, le chauffage du fond d’un fluide entraîne une convection de la chaleur du bas vers le haut, en raison de la diminution de la densité du fluide chauffé, ce qui le fait monter par rapport au matériau non chauffé plus dense.
L’inverse de la densité d’une substance est parfois appelé son volume spécifique , un terme parfois utilisé en thermodynamique . La densité est une Propriété intensive en ce sens que l’augmentation de la quantité d’une substance n’augmente pas sa densité; il augmente plutôt sa masse.
Histoire
Dans un conte bien connu mais probablement apocryphe , Archimède a été chargé de déterminer SI l’ orfèvre du roi Hiéron détournait de l’or lors de la fabrication d’une couronne d’or dédiée aux dieux et de la remplacer par un autre alliage moins cher . [3] Archimède savait que la couronne de forme irrégulière pouvait être écrasée en un cube dont le volume pouvait être calculé facilement et comparé à la masse ; mais le roi n’approuva pas cela. Déconcerté, Archimède aurait pris un bain d’immersion et observé de la montée de l’eau en entrant qu’il pouvait calculer le volume de la couronne d’or à travers ledéplacement de l’eau. Lors de cette découverte, il a sauté de son bain et a couru nu dans les rues en criant: “Eureka! Eureka!” (Εύρηκα! Grec “Je l’ai trouvé”). En conséquence, le terme « eurêka » est entré dans le langage courant et est utilisé aujourd’hui pour indiquer un moment d’illumination.
L’histoire est apparue pour la première fois sous forme écrite dans les livres d’architecture de Vitruve , deux SIècles après qu’elle se soit soi-disant déroulée. [4] Certains savants ont douté de l’exactitude de ce récit, disant entre autres que la méthode aurait nécessité des mesures précises qui auraient été difficiles à faire à l’époque. [5] [6]
Mesure de densité
Un certain nombre de techniques ainsi que des normes existent pour la mesure de la densité des matériaux. Ces techniques comprennent l’utilisation d’un hydromètre (une méthode de flottabilité pour les liquides), la balance hydrostatique (une méthode de flottabilité pour les liquides et les solides), la méthode du corps immergé (une méthode de flottabilité pour les liquides), un pycnomètre (liquides et solides), un pycnomètre à comparaison d’Air ( solides), densitomètre oscillant (liquides), ainsi que verser et tapoter (solides). [7] Cependant, chaque méthode ou technique individuelle mesure différents types de densité (par exemple la densité apparente, la densité squelettique, etc.), et il est donc nécessaire de comprendre le type de densité mesuré ainsi que le type de matériau Dans la question.
Unité
D’après l’équation de la densité ( ρ = m / V ), la masse volumique a toute unité qui est la masse divisée par le volume . Comme il existe de nombreuses unités de masse et de volume couvrant de nombreuses grandeurs différentes, un grand nombre d’unités de densité de masse sont utilisées. L’ Unité SI de kilogramme par mètre cube (kg/m 3 ) et l’ unité cgs de gramme par centimètre cube (g/cm 3 ) sont probablement les unités les plus couramment utilisées pour la densité. Un g/cm 3 est égal à 1000 kg/m 3. Un centimètre cube (abréviation cc) est égal à un millilitre. Dans l’industrie, d’autres unités de masse et/ou de volume plus grandes ou plus petites sont souvent plus pratiques et les Unités usuelles américaines peuvent être utilisées. Voir ci-dessous pour une liste de certaines des unités de densité les plus courantes.
Matériaux homogènes
La densité en tous points d’un objet homogène est égale à sa masse totale divisée par son volume total. La masse est normalement mesurée avec une échelle ou une balance ; le volume peut être mesuré directement (à partir de la géométrie de l’objet) ou par le déplacement d’un fluide. Pour déterminer la masse volumique d’un liquide ou d’un gaz, on peut utiliser respectivement un hydromètre , un dasymètre ou un Débitmètre Coriolis . De même, la pesée hydrostatique utilise le déplacement de l’eau dû à un objet submergé pour déterminer la densité de l’objet.
Matériaux hétérogènes
SI le corps n’est pas homogène, sa densité varie entre les différentes régions de l’objet. Dans ce cas, la densité autour d’un emplacement donné est déterminée en calculant la densité d’un petit volume autour de cet emplacement. Dans la limite d’un volume infinitésimal la densité d’un objet inhomogène en un point devient : ρ ( r → ) = d m / d V {displaystyle rho ({vec {r}})=dm/dV} 
, où d V {displaystyle dV}

est un volume élémentaire à la position r {displaystyle r}

. La masse du corps peut alors être exprimée comme
m = ∫ V ρ ( r → ) d V . {displaystyle m=int _{V}rho ({vec {r}}),dV.} 
Matériaux non compacts
En pratique, les matériaux en vrac tels que le sucre, le sable ou la neige contiennent des vides. De nombreux matériaux existent dans la nature sous forme de flocons, de pastilles ou de granulés.
Les vides sont des régions qui contiennent autre chose que le matériau considéré. Généralement, le vide est de l’Air, mais il peut également s’agir de vide, de liquide, de solide ou d’un gaz ou d’un mélange gazeux différent.
Le volume apparent d’un matériau – y compris le taux de vide – est souvent obtenu par une simple mesure (par exemple avec une tasse à mesurer calibrée) ou géométriquement à partir de dimensions connues.
La masse divisée par le volume en vrac détermine la densité apparente . Ce n’est pas la même chose que la masse volumique volumique.
Pour déterminer la densité de masse volumétrique, il faut d’abord actualiser le volume de la fraction de vide. Parfois, cela peut être déterminé par un raisonnement géométrique. Pour le compactage de sphères égales , la fraction non vide peut être au plus d’environ 74 %. Elle peut aussi être déterminée empiriquement. Cependant, certains matériaux en vrac, tels que le sable, ont une fraction de vide variable qui dépend de la manière dont le matériau est agité ou versé. Il peut être lâche ou compact, avec plus ou moins d’espace d’Air selon la manipulation.
En pratique, le taux de vide n’est pas nécessairement de l’Air, ni même gazeux. Dans le cas du sable, il pourrait s’agir d’eau, ce qui peut être avantageux pour la mesure car la fraction de vide pour le sable saturé d’eau – une fois que toutes les bulles d’Air sont complètement chassées – est potentiellement plus cohérente que le sable sec mesuré avec un vide d’Air.
Dans le cas de matériaux non compacts, il faut également veiller à déterminer la masse de l’échantillon de matériau. SI le matériau est sous pression (généralement la pression de l’Air ambiant à la surface de la terre), la détermination de la masse à partir d’un poids d’échantillon mesuré peut devoir tenir compte des effets de flottabilité dus à la densité du constituant du vide, selon la manière dont la mesure a été effectuée. Dans le cas du sable sec, le sable est tellement plus dense que l’Air que l’effet de flottabilité est souvent négligé (moins d’un pour mille).
Le changement de masse lors du déplacement d’un matériau de vide avec un autre tout en maintenant un volume constant peut être utilisé pour estimer la fraction de vide, SI la différence de densité des deux matériaux de vide est connue de manière fiable.
Changements de densité
En général, la densité peut être modifiée en modifiant soit la pression, soit la température . L’augmentation de la pression augmente toujours la densité d’un matériau. L’augmentation de la température diminue généralement la densité, mais il existe des exceptions notables à cette généralisation. Par exemple, la densité de l’eau augmente entre son point de fusion à 0 °C et 4 °C ; un comportement similaire est observé dans le silicium à basse température.
L’effet de la pression et de la température sur les densités des liquides et des solides est faible. La compressibilité pour un liquide ou un solide typique est de 10 -6 bar -1 (1 bar = 0,1 MPa) et une Expansivité thermique typique est de 10 -5 K -1 . Cela se traduit approximativement par la nécessité d’environ dix mille fois la pression atmosphérique pour réduire le volume d’une substance d’un pour cent. (Bien que les pressions nécessaires puissent être environ mille fois plus faibles pour les sols sablonneux et certaines argiles.) Une expansion de volume d’un pour cent nécessite généralement une augmentation de température de l’ordre de milliers de degrés Celsius .
En revanche, la densité des gaz est fortement affectée par la pression. La masse volumique d’un gaz parfait est
ρ = M P R T , {displaystyle rho ={frac {MP}{RT}},} 
où M est la masse molaire , P est la pression, R est la constante universelle des gaz et T est la Température absolue . Cela signifie que la densité d’un gaz parfait peut être doublée en doublant la pression ou en divisant par deux la Température absolue.
Dans le cas d’une dilatation thermique volumique à pression constante et à petits intervalles de température, la dépendance à la température de la densité est
ρ = ρ T 0 1 + α ⋅ Δ T , {displaystyle rho ={frac {rho _{T_{0}}}{1+alpha cdot Delta T}},} 
où ρ T 0 {displaystyle rho _{T_{0}}} 
est la masse volumique à une température de référence, α {displaystylealpha}

est le coefficient de dilatation thermique du matériau à des températures proches de T 0 {displaystyle T_{0}}

.
Densité des solutions
La densité d’une solution est la somme des concentrations massiques (massiques) des composants de cette solution.
La concentration massique (massique) de chaque composant donné ρ i dans une solution correspond à la densité de la solution,
ρ = ∑ i ρ i . {displaystyle rho =sum _{i}varrho _{i}.} 
Exprimée en fonction des masses volumiques des composants purs du mélange et de leur participation volumique , elle permet de déterminer les volumes molaires en excès :
ρ = ∑ i ρ i V i V = ∑ i ρ i φ i = ∑ i ρ i V i ∑ i V i + ∑ i V E i , {displaystyle rho =sum _{i}rho _{i}{frac {V_{i}}{V}},=sum _{i}rho _{i}varphi _{ i}=sum _{i}rho _{i}{frac {V_{i}}{sum _{i}V_{i}+sum _{i}{V^{E}}_ {je}}},} 
à condition qu’il n’y ait pas d’interaction entre les composants.
Connaissant la relation entre volumes excédentaires et coefficients d’activité des composants, on peut déterminer les coefficients d’activité :
V E ̄ i = R T ∂ ln γ i ∂ P . {displaystyle {overline {V^{E}}}_{i}=RT{frac {partial ln gamma _{i}}{partial P}}.} 
Densités
Divers matériaux
Les éléments chimiques sélectionnés sont répertoriés ici. Pour les densités de tous les éléments chimiques, voir Liste des éléments chimiques
Densités de divers matériaux couvrant une gamme de valeurs| Matériel | ρ (kg/m 3 ) [remarque 1] | Remarques |
|---|---|---|
| Hydrogène | 0,0898 | |
| Hélium | 0,179 | |
| Aérographite | 0,2 | [note 2] [8] [9] |
| Micro-réseau métallique | 0,9 | [note 2] |
| Aérogel | 1.0 | [note 2] |
| Air | 1.2 | Au niveau de la mer |
| Hexafluorure de tungstène | 12.4 | L’un des gaz les plus lourds connus dans des conditions standard |
| Hydrogène liquide | 70 | À env. −255 °C |
| polystyrène | 75 | Environ. [dix] |
| Liège | 240 | Environ. [dix] |
| Pin | 373 | [11] |
| Lithium | 535 | Métal le moins dense |
| Bois | 700 | Assaisonné, typique [12] [13] |
| Chêne | 710 | [11] |
| Potassium | 860 | [14] |
| Glace | 916.7 | À température < 0 °C |
| Huile de cuisson | 910–930 | |
| Sodium | 970 | |
| Eau (douce) | 1 000 | A 4 °C, la température de sa densité maximale |
| Eau (sel) | 1 030 | 3% |
| Oxygène liquide | 1 141 | À env. −219 °C |
| Nylon | 1 150 | |
| Plastiques | 1 175 | Environ.; pour polypropylène et PETE / PVC |
| Glycérol | 1 261 | [15] |
| Tétrachloroéthène | 1 622 | |
| Sable | 1 600 | Entre 1600 et 2000 [16] |
| Magnésium | 1 740 | |
| Béryllium | 1 850 | |
| Béton | 2 400 | [17] [18] |
| Verre | 2 500 | [19] |
| Silicium | 2 330 | |
| Quartzite | 2 600 | [16] |
| Granit | 2 700 | [16] |
| Gneiss | 2 700 | [16] |
| Aluminium | 2 700 | |
| Calcaire | 2 750 | Compacte [16] |
| Basalte | 3 000 | [16] |
| Diiodométhane | 3 325 | Liquide à température ambiante |
| diamant | 3 500 | |
| Titane | 4 540 | |
| Sélénium | 4 800 | |
| Vanadium | 6 100 | |
| Antimoine | 6 690 | |
| Zinc | 7 000 | |
| Chrome | 7 200 | |
| Étain | 7 310 | |
| Manganèse | 7 325 | Environ. |
| Fer | 7 870 | |
| Niobium | 8 570 | |
| Laiton | 8 600 | [18] |
| Cadmium | 8 650 | |
| Cobalt | 8 900 | |
| Nickel | 8 900 | |
| Cuivre | 8 940 | |
| Bismuth | 9 750 | |
| Molybdène | 10 220 | |
| Argent | 10 500 | |
| Mener | 11 340 | |
| Thorium | 11 700 | |
| Rhodié | 12 410 | |
| Mercure | 13 546 | |
| Tantale | 16 600 | |
| Uranium | 18 800 | |
| Tungstène | 19 300 | |
| Or | 19 320 | |
| Plutonium | 19 840 | |
| Rhénium | 21 020 | |
| Platine | 21 450 | |
| Iridium | 22 420 | |
| Osmium | 22 570 | Élément le plus dense |
Remarques:
|
Autres
| Entité | ρ (kg/m 3 ) | Remarques |
|---|---|---|
| Milieu interstellaire | 1 × 10 −19 | En supposant 90 % H, 10 % He; T variable |
| La Terre | 5 515 | Densité moyenne. [20] |
| Le noyau interne de la Terre | 13 000 | Env., comme indiqué dans Earth . [21] |
| Le noyau du Soleil | 33 000–160 000 | Environ. [22] |
| Un trou noir supermassif | 9 × 10 5 | Densité équivalente d’un trou noir de 4,5 millions de masse solaire Le rayon de l’horizon des événements est de 13,5 millions de km. |
| Etoile naine blanche | 2,1 × 10 9 | Environ. [23] |
| Noyaux atomiques | 2,3 × 10 17 | Ne dépend pas fortement de la taille du noyau [24] |
| Étoile à neutrons | 1 × 10 18 | |
| Trou noir de masse stellaire | 1 × 10 18 | Densité équivalente d’un trou noir de 4 masses solaires Le rayon de l’horizon des événements est de 12 km. |
Eau
Densité de l’eau liquide à une pression de 1 atm| Temp. (°C) [remarque 1] | Densité (kg/m 3 ) |
|---|---|
| −30 | 983.854 |
| −20 | 993.547 |
| −10 | 998.117 |
| 0 | 999.8395 |
| 4 | 999.9720 |
| dix | 999.7026 |
| 15 | 999.1026 |
| 20 | 998.2071 |
| 22 | 997.7735 |
| 25 | 997.0479 |
| 30 | 995.6502 |
| 40 | 992.2 |
| 60 | 983.2 |
| 80 | 971.8 |
| 100 | 958.4 |
Remarques:
|
Air
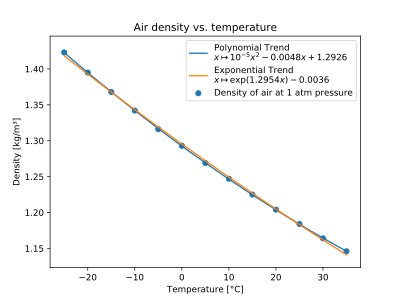
 Densité de l’Air en fonction de la température
Densité de l’Air en fonction de la température
| T (°C) | ρ (kg/m 3 ) |
|---|---|
| −25 | 1.423 |
| −20 | 1.395 |
| −15 | 1.368 |
| −10 | 1.342 |
| −5 | 1.316 |
| 0 | 1.293 |
| 5 | 1.269 |
| dix | 1.247 |
| 15 | 1.225 |
| 20 | 1.204 |
| 25 | 1.184 |
| 30 | 1.164 |
| 35 | 1.146 |
Volumes molaires des phases liquide et solide des éléments

 Volumes molaires des phases liquide et solide des éléments
Volumes molaires des phases liquide et solide des éléments
Unités communes
L’ Unité SI de la densité est :
- kilogramme par mètre cube (kg/m 3 )
Le litre et la tonne ne font pas partie du SI, mais peuvent être utilisés avec lui, ce qui donne les unités suivantes :
- kilogramme par litre (kg/L)
- gramme par millilitre (g/mL)
- tonne par mètre cube (t/m 3 )
Les densités utilisant les unités métriques suivantes ont toutes exactement la même valeur numérique, un millième de la valeur en (kg/m 3 ). L’ eau liquide a une densité d’environ 1 kg/dm 3 , ce qui rend l’utilisation de n’importe laquelle de ces unités SI numériquement pratique car la plupart des solides et des liquides ont des densités comprises entre 0,1 et 20 kg/dm 3 .
- kilogramme par décimètre cube (kg/dm 3 )
- gramme par centimètre cube (g/cm 3 )
- 1 g/cm 3 = 1000 kg/m 3
- mégagramme (tonne métrique) par mètre cube (Mg/m 3 )
Aux États-Unis, la densité des unités usuelles peut être exprimée en :
- Avoirdupois once par pouce cube (1 g/cm 3 ≈ 0,578036672 oz/cu in)
- Avoirdupois once par once liquide (1 g/cm 3 ≈ 1,04317556 oz/US fl oz = 1,04317556 lb/US fl pint)
- Avoirdupois livre par pouce cube (1 g/cm 3 ≈ 0,036127292 lb/cu in)
- livre par pied cube (1 g/cm 3 ≈ 62,427961 lb/pi3)
- livre par verge cube (1 g/cm 3 ≈ 1685,5549 lb/cu yd)
- livre par gallon liquide américain (1 g/cm 3 ≈ 8,34540445 lb/gal US)
- livre par boisseau américain (1 g/cm 3 ≈ 77,6888513 lb/bu)
- limace par pied cube
Les unités impériales différentes de celles ci-dessus (comme le gallon et le boisseau impériaux diffèrent des unités américaines) sont rarement utilisées dans la pratique, bien que trouvées dans des documents plus anciens. Le gallon impérial était basé sur le concept qu’une once liquide impériale d’eau aurait une masse d’une once Avoirdupois, et en effet 1 g/cm 3 ≈ 1,00224129 onces par once liquide impériale = 10,0224129 livres par gallon impérial. La densité des métaux précieux pourrait éventuellement être basée sur les onces et les livres Troy , une cause possible de confusion.
Connaissant le volume de la cellule unitaire d’un matériau cristallin et son poids de formule (en daltons ), la densité peut être calculée. Un dalton par ångström cube est égal à une masse volumique de 1,660 539 066 60 g/cm 3 .
Voir également
- Densités des éléments (page de données)
- Liste des éléments par densité
- Densité de l’Air
- Densité de surface
- Densité apparente
- Flottabilité
- Densité de charge
- Prédiction de la densité par la méthode de Girolami
- Dord
- Densité d’énergie
- Plus léger que l’Air
- Densité linéaire
- Densité numérique
- Densité orthobare
- Densité du papier
- Poids spécifique
- Épice (océanographie)
- Température et pression normales
Références
- ^ Le centre de recherche Glenn de la National Aeronautic and Atmospheric Administration . “Centre de recherche sur la densité de gaz Glenn” . grc.nasa.gov. Archivé de l’original le 14 avril 2013 . Consulté le 9 avril 2013 .
- ^ “Définition de la densité dans le glossaire du gaz pétrolier” . Oilgasglossary.com. Archivé de l’original le 5 août 2010 . Consulté le 14 septembre 2010 .
- ^ Archimède, un voleur d’or et une flottabilité Archivé le 27 août 2007 à la Wayback Machine – par Larry “Harris” Taylor, Ph.D.
- ↑ Vitruve sur l’architecture, livre IX [ lien mort permanent ] , paragraphes 9 à 12, traduit en anglais et en latin original .
- ^ “EXPOSITION : Le premier moment d’Eureka” . Sciences . 305 (5688): 1219e. 2004. doi : 10.1126/science.305.5688.1219e .
- ^ Réalité ou fiction ? : Archimède a inventé le terme “Eureka!” dans le bain , Scientific American , décembre 2006.
- ^ “Ligne directrice de test 109 de l’OCDE sur la mesure de la densité” .
- ^ La nouvelle aérographite à structure de nanotubes de carbone est le champion du matériau le plus léger Archivé le 17 octobre 2013 à la Wayback Machine . Phys.org (13 juillet 2012). Consulté le 14 juillet 2012.
- ^ Aerographit: Leichtestes Material der Welt entwickelt – SPIEGEL ONLINE Archivé le 17 octobre 2013 à la Wayback Machine . Spiegel.de (11 juillet 2012). Consulté le 14 juillet 2012.
- ^ un b “Re: qui est plus flottant [ sic ] styromousse ou liège” . Madsci.org. Archivé de l’original le 14 février 2011 . Consulté le 14 septembre 2010 .
- ^ un b Raymond Serway; John Jewett (2005), Principes de physique : un texte basé sur le calcul , Cengage Learning, p. 467, ISBN 0-534-49143-X, archivé de l’original le 17 mai 2016
- ^ “Densités du bois” . www.engineeringtoolbox.com . Archivé de l’original le 20 octobre 2012 . Consulté le 15 octobre 2012 .
- ^ “Densité du bois” . www.simetric.co.uk . Archivé de l’original le 26 octobre 2012 . Consulté le 15 octobre 2012 .
- ^ CRC Press Handbook of tables for Applied Engineering Science, 2e édition, 1976, tableau 1-59
- ^ composition de glycérol à Archivé le 28 février 2013 à la Wayback Machine . Physics.nist.gov. Consulté le 14 juillet 2012.
- ^ un bcdef PV Sharma (1997), Géophysique de l’environnement et de l’ingénierie , Cambridge University Press, p . 17, doi : 10.1017/CBO9781139171168 , ISBN 9781139171168
- ^ “Densité du béton – Le Factbook de physique” . hypertextbook.com .
- ^ un b Hugh D. Young; Roger A. Freedman. Physique universitaire avec la physique moderne Archivé le 30 avril 2016 à la Wayback Machine . Addison-Wesley ; 2012. ISBN 978-0-321-69686-1 . p. 374.
- ^ “Densité de verre – Le Factbook de physique” . hypertextbook.com .
- ^ Densité de la Terre , wolframalpha.com, archivé de l’original le 17 octobre 2013
- ^ Densité du noyau terrestre , wolframalpha.com, archivé de l’original le 17 octobre 2013
- ^ Densité du noyau du Soleil , wolframalpha.com, archivé de l’original le 17 octobre 2013
- ^ Extreme Stars: White Dwarfs & Neutron Stars Archivé le 25 septembre 2007 à la Wayback Machine , Jennifer Johnson, notes de cours, Astronomy 162, Ohio State University . Consulté : 3 mai 2007.
- ^ Taille et densité nucléaires Archivé le 6 juillet 2009 à la Wayback Machine , HyperPhysics, Georgia State University. Consulté : 26 juin 2009.
Liens externes
- “Densité” . Encyclopædia Britannica . Vol. 8 (11e éd.). 1911.
- “Densité” . Ouvrage de référence du nouvel étudiant . 1914.
- Vidéo : Expérience de densité avec de l’huile et de l’alcool
- Vidéo : Expérience de densité avec du whisky et de l’eau
- Calcul de la densité du verre – Calcul de la densité du verre à température ambiante et du verre fondu à 1000 – 1400 ° C
- Liste des éléments du tableau périodique – Triés par densité
- Calcul des densités de liquide saturé pour certains composants
- Test de densité de champ
- Eau – Densité et poids spécifique
- Dépendance à la température de la densité de l’eau – Conversions des unités de densité
- Une délicieuse expérience de densité
- Calculateur de densité de l’eau Archivé le 13 juillet 2011 à la Wayback Machine Densité de l’eau pour une salinité et une température données.
- Calculateur de densité de liquide Sélectionnez un liquide dans la liste et calculez la densité en fonction de la température.
- Calculateur de densité de gaz Calculer la densité d’un gaz en fonction de la température et de la pression.
- Densités de divers matériaux.
- Détermination de la densité du solide , instructions pour effectuer une expérience en classe.
- prévision de la densité
- prévision de la densité
